0
Пептидные связи появляются благодаря реакции аминокислоты с аминокислотой. В составе аминокислот есть две группы – аминогруппа и группа карбоксильная. Пептидная связь появляется при условии, что реакция дегидрации имеет место между аминогруппой в одной аминокислоте и карбоксильной группой в иной. Карбоксильная группа теряет атом кислорода, а аминогруппа – пару атомов водорода, при этом образуется вода и пептид.
Пептидная связь
Появление пептидного соединения происходит в момент, когда азот из аминогруппы связывается с углеродом карбоксильной. Эта связь является ковалентной и некоторыми учеными называется также амидной. Образование связи осуществляется благодаря гидролизу, а не синтезу, поэтому не требует дополнительного источника энергии. Биосинтез пептидов происходит буквально за несколько секунд, но воссоздание такой же реакции в лаборатории может быть делом длительным. Однако образованные связи являются стабильными, и в отсутствии катализаторов в водном растворе пептиды могут существовать тысячи лет.
Если две аминокислоты связываются друг с другом, то появляется дипептид, если три – то трипептид. Количество аминокислот, что могут создавать сложные полимерные структуры, почти не ограничено. Конец аминокислоты, у которой связана карбоксильная группа, называется N-концом. С другой же стороны находится С-конец, то есть свободная карбоксильная группа второй участвующей в образовании соединения аминокислоты. Пептидная связь крайне распространена в организме, часто она становится основой для формирования белков. К пептидным соединениям относят и гормоны, в частности, окситоцин. Синтез пептидов в организме человека осуществляется во всех клетках, включая нейроны мозга.

Резонанс и биосинтез
Пептиды имеют особое значение в функционировании и биосинтезе белков, потому что именно они в конечном итоге определяют структуру белка. Их состав позволяет осуществить дополнительный переход пары электронов между кислородом и углеродом с образованием двойной связи и резонанса. Это процесс крайне динамичный, потому что электроны находятся в вечном движении, поэтому пептидные соединения и обладают повышенной биологической активностью. В пептидной связи присутствует дипольный момент, образованный благодаря наличию разных зарядов на двух концах соединения. Возможность использовать несколько электронов, а также дополнительно присоединять к связи аминокислоты, делает пептиды идеальными переносчиками информации, а их резонанс обеспечивает высокую биологическую активность. Полипептиды способны обеспечивать регулировку большинства биологических процессов, включая аппетит, восстановление и регенерацию, пищеварение, настроение, высшую нервную деятельность, артериальное давление и обладать гормональной активностью.
Необычное соединение
Из-за характера связи у нее ограничивается свобода вращения, и пептиды становятся стабильными соединениями. Также в полипептидах замечена локализация аминокислот в некоторых определенных областях. Предполагается, что эти области могут быть характерны для разных структур организма и определять предназначение пептида. Но при этом пептиды с трудом поддаются исследованию и так многообразны, что мы представления не имеем, как именно расположение аминокислот в связи определяет воздействие пептида. Исследования в области пептидных связей еще продолжаются.
Образование пептидной связи в общем сводится к отщеплению элементов воды.
Образование пептидных связей, катализируемое гидролитическими ферментами, наблюдали в таких системах, где продукт реакции нерастворим и, тем самым, удаляется из сферы реакции.
Образование пептидной связи, на которое оказывают ката литическое действие ионы металла (серебра, свинца, Меди или ртути), требует контроля рН для достижения оптимальных выходов.
Образование пептидной связи, как уже указывалось (разд.
Образование пептидной связи активированием аминогруппы также проходит через приобретение положительного заряда атомом углерода карбоксильной группы, так как первой стадией процесса является присоединение карбоксильной группы к активируемой части молекулы. В этом случае течению реакции способствуют также стерические факторы.
Образование пептидной связи требует участия макроэргичг-ских молекул ГТФ.
Основной принцип пептидного синтеза. Образование пептидной связи в случае дипептида является простым химическим процессом. Последовательное повторение этого процесса, казалось бы, должно привести к длинным пептидам и даже к белкам. Однако реализация этого прит нципа возможна только в жестких условиях неконтролируемой реакции.
Образование пептидной связи, как уже указывалось (разд. Повышение электрофильных потенциалов достигается введением электроаффинных - I или - М (индуктивных или мезомерных) заместителей (XR), которые снижают электронную плотность как на карбонильном углероде, так и на карбонильном кислороде.
Образование пептидной связи может протекать как одно - или двухста-дийный процесс (разд.
Образование пептидной связи представляет собой нуклеофильную атаку аминогруппой одной аминокислоты карбонильного атома углерода другой аминокислоты.
После образования пептидной связи бензилоксикарбонильную группу отщепляют посредством бромоводорода в ледяной уксусной кислоте. Для защиты а-карбоксильной группы ее превращают в метиловый или бутиловый эфир. Затем по мере надобности соответствующий эфир омыляют щелочью.
Шаро-стержневая скелетная модель (без водородов остатка аланилпролиладенозина как донорного субстрата в пептидилтрансферазном центре рибосомы (предоставлено В. И. Лимом, Институт белка АН СССР, Пущино. До образования пептидной связи атом азота имеет три валентные связи, направленные к вершинам тетраэдра, в то время как к четвертой вершине направлена орбиталь неподеленной пары электронов.
Процеоо образования пептидной связи термодинамически невыгоден и может идти лишь в жестких условиях.
Методы образования пептидной связи, рассматриваемые ниже, отличаются оригинальными подходами. До сих пор они не получили широкого практического применения, но все же представляют потенциальные возможности для развития пептидной химии.
В образовании пептидных связей участвует гл. В синтезе пептидов из Ь - изомера наряду с а Н2 - группой защищают у-карбок-сильную группу, для чего ее этерифицируют бензиловым спиртом или получают трет-бутиловый эфир действием изобутилена в присут.
В образовании пептидной связи у м оноамино динар-боковых и диаминомонокарбоковых кислот принимают участие только аминогруппы и карбоксильные группы, связанные с и-утл сродным атомом.
Например, образование пептидной связи в белке соответствует увеличению функции Гпб-бса примерло на 17 кДж / моль, однако биосинтез не идет напрямую, и используемая в нем последовательность реакций эквивалента потреблению трех молекул АТФ на каждую связь. В случае белка относительно небольшой величины, например миоглобнна, содержащего примерно 150 пептидных связей, для биосинтеза требуется 450 молекул АТФ или 12 молей глюкозы на каждый моль образующегося белка.
Азидный метод образования пептидной связи, хотя и сопровождается нек-рыми побочными процессами (в основном подавляемыми при темп - pax от-10 до 5 С), выгодно отличается от всех остальных методов активации карбоксильных групп практически полным отсутствием рацемизации. Прочие методы могут, однако, применяться для активации аминокислот и пептидов с N-защитой уретанового типа, а также пептидов с С-концевыми группами глицина и пролина, устойчивого к рацемизации.
Интересный метод образования пептидных связей описал в 1955 г. Бреннер ; несколько позднее появился обзор об этих работах (см. также [ 149а ], стр.
Общий метод образований пептидной связи иллюстрирует следующий пример.
Общий метод образования пептидной связи иллюстрирует следующий пример.
Карбодиимидный метод образования пептидной связи предусматривает использование в качестве конденсирующих реагентов разл.
В процессе образования пептидной связи необходимо защищать реакци-онноояоообныв боковые группы некоторых аминокислот. К ним относятся: / - аминогруппа лизина, ув-амяногруппа орнитина, гуанидиновая группа аргинина, карбоксильные группы аспарагиновой и глутаминовой кислот, гидрокоилыше и тиольные группы серина, треонина, тирозина и цистеи-на, имидазольное кольцо гистидина. В некоторых случаях осуществляют блокирование боковых групп метиояина, аспарагина и глутвми-на. Недавно предложены защитные группы для индольного кольца триптофана.
Очень удобный способ образования пептидной связи заключается во взаимодействии карбоновой кислоты и амина с дици-клогексилкарбодиимидом (DCCI; ДЦКИ) в качестве водоотщепляю-щего средства.
Очень удобный способ образования пептидной связи заключается во взаимодействии карбоновой кислоты и амина с днцн-клогексилкарбодиимидом (DCCI; ДЦК.
Синтоны, использованные для синтеза протеазы ВИЧ-1. Реакции, используемые для образования пептидной связи и удаления защитных групп, могут повреждать ряд боковых функциональных групп. Поэтому использование защитных групп важно не только для fr - амино - и а-карбоксиль-ных групп, но и для многих боковых радикалов. Эти группы должны оставаться защищенными во время всего процесса образования полипептидной цепи и должны удаляться только по завершении процесса. В практике полипептидного синтеза используются различные комбинации этих групп. Они вводятся в мономеры в дополнение к группам, защищающим o - NH2 - и а - С00 - - группы. Мономеры, содержащие набор защитных групп и в ряде случаев активированные остатки, делающие возможным их непосредственное использование в процессе синтеза, обычно называют синтонами. В качестве примера, в табл. 7.6 приведены синтоны, использованные для синтеза 99-членного пептида, который представляет собой протеазу, кодированную вирусом ВЙЧ-1, вызывающим СПИД. Огромный интерес к этой протеазе обусловлен надеждой найти специфические ингибиторы протеазы, которые позволят предотвратить созревание вирусных белков и, следовательно, размножение этого вируса.
Под действием макролида прекращается образование пептидных связей при синтезе белка, нарушается процесс транслокации на этапе, когда пептидил-т РНК возвращается из акцепторного (А) места в (Р) место.
Существует большое число методов образования пептидной связи между замещенными аминокислотами или пептидами. Обычно их разделяют на методы, при которых активируется карбоксильная группа, и методы, связанные с активированием аминогруппы.
Поскольку это первый пример образования ыс пептидной связи у остатка, отличающегося от пролина, к нему следует отнестись с некоторой осторожностью. С другой стороны, возможно, что такой способ образования связи имеет значение для активности фермента.
Фосфорилирование нуклеозида хлорфосфатом аналогично образованию пептидной связи, происходящему при взаимодействии амина с ацилхлоридом. Вероятно, один из простейших таких примеров - реакция рибонуклеозида с хлороксидом фосфора.
Напомним, что энергия на образование пептидной связи выделяется при аминолизе тиоэфира.
Дициклогексилкарбодиимид применяют не только для образования пептидных связей, но часто используют и для эте-рификации, например, при синтезе активированных тиоалкило-вых и тиоариловых эфиров. С помощью N, N - дициклогексилкарбодиимида синтезирован также пропио-тиолактон (см. гл.
Наиболее распространенные антибиотики. У большинства грамположительных бактерий ингибируют образование пептидных связей между молекулами клеточной стенки, что приводит к ее лизису. Эффективны только в отношении делящихся бактерий.
Другим направлением в разрешении проблемы образования пептидных связей являются поиски биологических систем, которые обладают выраженной потребностью в некоторых пептидах, более выраженной, чем их потребность в отдельных аминокислотах, составляющих эти пептиды. Если, например, бактериальная клетка использует пептид для своего роста более эффективно, чем аминокислоты, то можно предположить, что скорость синтеза пептида определяет собой скорость использования аминокислот для образования белка. Этот метод был использован в исследованиях по обмену пептидов у бактерий, проводившихся Софьей Симмондс и автором данной статьи в Иэльском университете.
Наиболее широко применяются следующие методы образования пептидной связи: 1) карбодиимидный; 2) азидный; 3) смешанных ангидридов; 4) активированных эфиров; 5) карбокоиаигидридный.
Липмана о том, что образованию пептидных связей предшествует синтез фосфорнокислых производных аминокислот.
Мегги определил теплоту и энтропию образования пептидной связи в твердом полиглицине, которые равны соответственно 3 3 ккал / моль и 17 энтр.
Конечно, как и в случае образования пептидной связи, вается определенная энергия, и поэтому необходима Синтез фосфодиэфирной связи был бы невозможен при простом смешивании фосфорной кислоты с соответствующими защищенными нуклеозидами. Наконец (см. ниже), может потребоваться даже блокирование фосфатной группы. Хотя это не строго необходимо (и не применялось в первых нуклеотидных синтезах), такой метод имеет свои преимущества и в настоящее время наиболее распространен.
Разработанные еще Фишером и Курциусом методы образования пептидной связи не нашли широкого применения из-за отсутствия селективно-отщепляемых защитных групп.
Этим реакциям явно благоприятствует невысокая скорость образования нужной пептидной связи, что происходит из-за пространственных препятствий, и по этой причине объемистые аминокислотные остатки, например валин и изолейцин, не следует располагать в местах сшивки. Во всех случаях, когда пептидные фрагменты содержат С-концевые остатки, не являющиеся глицином или пролином, должна использоваться также методика, делающая риск рацемизации минимальным.
Для всех аминокислот характерна способнесть к образованию пептидных связей. При этом группа NH2 одной молекулы аминокислоты реагирует с группой СООН другой молекулы. В результате отщепляется вода и получаются продукты сложного состава, называемые пептидами.
Для всех аминокислот характерна способность к образованию пептидных связей. При этом группа NH3 одной молекулы аминокислоты реагирует с группой СООН другой молекулы. В результате отщепляется вода и получаются продукты сложного состава, называемые пептидами.
II ] и подобно тетраэтилпирофосфиту применяют для образования пептидных связей.
Примером такого процесса является приведенная выше реакция образования пептидной связи, идущая с увеличением свободной г нергии системы. Эта реакция становится осуществимой в присутствии дициклогексилкарбодиимида, поскольку при гидратации последнего освобождается свободная энергия, перекрывающая затраты свободной энергии на синтез пептидной связи.
Примером такого процесса является приведенная выше реакция образования пептидной связи, идущая с увеличением свободной энергии системы. Эта реакция становится осуществимой в присутствии дициклогексилкарбодиимида, поскольку при гид - ратации последнего освобождается свободная энергия, перекрывающая затраты свободной энергии на синтез пептидной связи.
Принимая, что те же значения соответствуют образованию пептидных связей из других аминокислот, Мегги приходит к выводу, что синтез протеинов в биологических условиях термодинамически возможен, если сопровождается гидролизом аде-нозинтрифосфата, пирофосфата или полифосфата.
Ацилирование другой аминокислоты смешанным ангидридом приводит к образованию пептидной связи. Карбоксильная группа полученного таким образом пептида вновь может быть активирована и соединена со следующей аминокислотой.
Пептидная связь – это связь между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой аминокислоты.
Рис 5. Образование пептидной связи
К свойствам пептидной связи относятся:
1. Трансположение заместителей (радикалов) аминокислот по отношению к C-N связи. Рис 6.
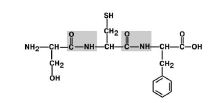
Рис 6. Радикалы аминокислот находятся в транс-положении.
2. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Рис 7, а.
3. Наличие кето
формы и енол
ьной формы. Рис 7, б 
Рис 7. а) б)
4. Способность к образованию двух водородных связей с другими пептидными группами. Рис 8.
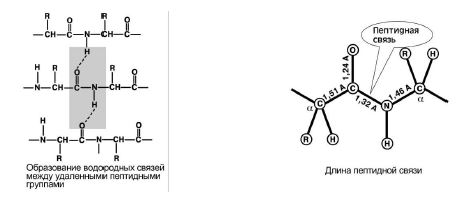
5. Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию(пространственное расположение атомов).
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру
белка. Она уникальна для любого белка и определяет его форму, а также различные свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между-CO-
и -NH-
группами разных аминокислотных остатков полипептидной цепи. Водородные связи непрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль - вторичная структура
белка.
Третичная структура - трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация -глобула . Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура
характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка, в данном случае основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия.
Такая сложность структуры белковых молекул связана с разнообразием функций, которые свойственны этим биополимерам, например, защитная, структурная и т.д.
Нарушение природной структуры белка называют денатурацией
. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном - третичная, а затем - вторичная, и белок остается в виде полипептидной цепи, то есть в виде первичной структуры.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.

Рис 9. Белковые структуры
©2015-2017 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Пептиды, последовательность которых короче примерно 10-20 аминокислотных остатков могут также называться олигопептидами, при большей длине последовательности они называются полипептидами. Белками обычно называют полипептиды, содержащие примерно от 50 аминокислотных остатков.
На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
Панкреатические молекулы полипептидного характера
- APP Avian pancreatic polypeptide
- en:HPP Human pancreatic polypeptide
Свойства пептидов
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры - последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки
Молекула пептида - это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид. Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды - молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
- полипептиды - молекулы, в состав которых входит более десяти аминокислот.
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
- гомомерные пептиды - соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды - вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные - пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды - те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (-NH-CH-OC-). Участок (-CH-) с аминокислотным радикалом образует соединение (-NH-C(R1)H-OC-), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (-NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC-). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про Несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства.
Пептидная связь
Пептидная (амидная) связь - это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный ph) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение
Пептидные биорегуляторы
На основе разработанной петербургскими учеными технологии из органов и тканей животных были выделены пептиды, обладающие тканеспецифическим действием, способные восстанавливать на оптимальном уровне метаболизм в клетках тех тканей, из которых они выделены. Важным отличием этих пептидов является их регулирующее действие: при подавлении функции клетки они её стимулируют, а при повышенной функции – снижают до нормального уровня. Это позволило создать новый класс лекарственных препаратов – пептидные биорегуляторы.
Первый из них – иммуномодулятор тималин – уже более 28 лет находится на фармацевтическом рынке и применяется для восстановления функции иммунной системы при заболеваниях различного генеза, включая онкологические заболевания. За ним последовали эпиталамин (биорегулятор нейроэндокринной системы), сампрост (препарат для лечения заболеваний предстательной железы), кортексин (препарат для лечения широкого спектра неврологических заболеваний), ретиналамин (препарат для лечения дегенеративно-дистрофических заболеваний сетчатки). За 25 лет широкого применения пептидных биорегуляторов их получили более 15 млн человек. При этом не было выявлено противопоказаний к их применению и побочного действия.
В настоящее время обнаружено, что тималин и ему подобные противопоказаны при аутоиммунных заболеваниях, т.к. тималин стимулирует область перевозбужденного иммунитета в том числе. По всей видимости в тималине полностью отсутствует супрессорная функция, которая чрезвычайно важна при борьбе с аутоиммунными заболеваниями.
