0
Пептидните връзки се образуват от реакцията на аминокиселина с аминокиселина. Аминокиселините имат две групи – аминогрупа и карбоксилна група. Пептидната връзка възниква, когато протича реакция на дехидратация между аминогрупа в една аминокиселина и карбоксилна група в друга. Карбоксилната група губи кислороден атом, а аминогрупата губи двойка водородни атоми, което води до образуването на вода и пептид.
Пептидна връзка
Появата на пептидно съединение става в момента, когато азотът от аминогрупата се свързва с карбоксилния въглерод. Тази връзка е ковалентна и се нарича също амидна от някои учени. Образуването на връзка става чрез хидролиза, а не чрез синтез и следователно не изисква допълнителен източник на енергия. Пептидната биосинтеза се извършва само за няколко секунди, но пресъздаването на същата реакция в лабораторията може да бъде дълъг процес. Въпреки това образовани връзкиса стабилни, а при липса на катализатори в воден разтворпептидите могат да продължат хиляди години.
Ако две аминокиселини се свържат една с друга, тогава се появява дипептид, ако три, тогава трипептид. Броят на аминокиселините, които могат да създадат сложни полимерни структури, е почти неограничен. Краят на аминокиселината, който има прикрепена карбоксилна група, се нарича N-край. От другата страна е С-краят, тоест свободната карбоксилна група на втората аминокиселина, участваща в образуването на съединението. Пептидните връзки са изключително често срещани в тялото и често стават основа за образуването на протеини. Пептидните съединения също включват хормони, по-специално окситоцин. Пептидният синтез в човешкото тяло се извършва във всички клетки, включително мозъчните неврони.

Резонанс и биосинтеза
Пептидите са от особено значение за функцията и биосинтезата на протеините, тъй като те в крайна сметка определят структурата на протеина. Техният състав позволява допълнителен преход на двойка електрони между кислород и въглерод с образуване на двойна връзка и резонанс. Този процес е изключително динамичен, тъй като електроните са във вечно движение, поради което пептидните съединения имат повишена биологична активност. В пептидната връзка има диполен момент, образуван поради наличието на различни заряди в двата края на съединението. Способността да използват няколко електрона, както и допълнително да прикрепят аминокиселини към връзката, прави пептидите идеални носители на информация, а техният резонанс осигурява висока биологична активност. Полипептидите са способни да регулират повечето биологични процеси, включително апетит, възстановяване и регенерация, храносмилане, настроение, по-високо нервна дейност, кръвно налягане и имат хормонална активност.
Необичайна връзка
Поради естеството на връзката, нейната свобода на въртене е ограничена и пептидите стават стабилни съединения. Също така в полипептидите се наблюдава локализиране на аминокиселини в някои специфични области. Предполага се, че тези области може да са характерни за различни структуриорганизъм и определете предназначението на пептида. Но пептидите са трудни за изследване и са толкова разнообразни, че нямаме представа как точно подреждането на аминокиселините в една връзка определя ефекта на пептида. Изследванията на пептидните връзки все още продължават.
Образуването на пептидна връзка обикновено се свежда до елиминирането на водните елементи.
Образуването на пептидни връзки, катализирано от хидролитични ензими, е наблюдавано в системи, където реакционният продукт е неразтворим и по този начин отстранен от реакционната сфера.
Образуването на пептидна връзка, катализирано от метални йони (сребро, олово, мед или живак), изисква контрол на pH за постигане на оптимални добиви.
Образуването на пептидна връзка, както вече беше посочено (Разд.
Образуването на пептидна връзка чрез активиране на аминогрупата също става чрез придобиване на положителен заряд от въглеродния атом на карбоксилната група, тъй като първият етап на процеса е добавянето на карбоксилната група към активираната част на молекула. В този случай пространствените фактори също допринасят за реакцията.
Образуването на пептидна връзка изисква участието на високоенергийни GTP молекули.
Основен принцип на пептидния синтез. Образуването на пептидна връзка в случая на дипептид е прост химичен процес. Последователното повторение на този процес изглежда ще доведе до дълги пептиди и дори протеини. Прилагането на този принцип обаче е възможно само при тежки условия на неконтролирана реакция.
Образуването на пептидна връзка, както вече беше посочено (раздел. Увеличаването на електрофилните потенциали се постига чрез въвеждане на електроафинитетни - I или - M (индуктивни или мезомерни) заместители (XR), които намаляват електронната плътност както на карбонилния въглерод, така и на карбонилния кислород .
Образуването на пептидна връзка може да се осъществи като едно- или двуетапен процес (Разд.
Образуването на пептидна връзка е нуклеофилна атака от аминогрупата на една аминокиселина върху карбонилния въглерод на друга аминокиселина.
След образуването на пептидната връзка, бензилоксикарбонилната група се елиминира с помощта на бромоводород в леденостудена вода. оцетна киселина. За да се защити а-карбоксилната група, тя се превръща в метилов или бутилов етер. След това, ако е необходимо, съответният етер се осапунява с алкали.
Скелетен модел с топка и пръчка (без водороди на аланилпролиладенозиновия остатък като донорен субстрат в пептидил трансферазния център на рибозомата (предоставен от V.I. Lim, Институт за протеини, Академия на науките на СССР, Пущино. Преди образуването на пептидна връзка , азотният атом има три валентни връзки, насочена към върховете на тетраедъра, докато орбиталата на несподелената двойка електрони е насочена към четвъртия връх.
Процесът на образуване на пептидна връзка е термодинамично неблагоприятен и може да се случи само при тежки условия.
Методите за образуване на пептидна връзка, обсъдени по-долу, се различават по своите оригинални подходи. Досега те не са получили широко разпространение практическо приложение, но все още представляват потенциални възможности за развитието на пептидната химия.
Ch. участва в образуването на пептидни връзки. При синтеза на пептиди от b изомера, заедно с a H2 групата, у-карбоксилната група е защитена, за която се естерифицира с бензилов алкохол или се получава tert-бутилов етер чрез действието на изобутилен в присъствието.
При образуването на пептидната връзка в моноаминодинар-бокс и диаминомонокарбоксилни киселини участват само аминогрупи и карбоксилни групи, свързани с атом, свързан с u-tele.
Например, образуването на пептидна връзка в протеин съответства на повишаване на функцията на Hpb-bs с приблизително 17 kJ/mol, но биосинтезата не се осъществява директно и последователността от реакции, използвани в нея, е еквивалентна на потреблението от три АТФ молекулиза всяка връзка. В случай на сравнително малък протеин, като миоглобин, съдържащ приблизително 150 пептидни връзки, биосинтезата изисква 450 ATP молекули или 12 мола глюкоза за всеки мол образуван протеин.
Азидният метод за образуване на пептидна връзка, въпреки че е придружен от определени странични процеси (главно потиснати при температура от -10 до 5 °C), се сравнява благоприятно с всички други методи за активиране на карбоксилни групи на практика пълно отсъствиерацемизация. Други методи, обаче, могат да се използват за активиране на аминокиселини и N-защитени пептиди от уретанов тип, както и пептиди с С-краен глицин и устойчиви на рацемизация пролинови групи.
Интересен метод за образуване на пептидни връзки е описан през 1955 г. от Brenner; Малко по-късно се появи преглед на тези произведения (виж също [149a], p.
Общ методОбразуването на пептидна връзка се илюстрира със следния пример.
Общият метод за образуване на пептидна връзка е илюстриран със следния пример.
Карбодимидният метод за образуване на пептидна връзка включва използването на разлож.
По време на образуването на пептидна връзка е необходимо да се защитят реакционните странични групи на някои аминокиселини. Те включват: / - амино група на лизин, хидроамино група на орнитин, гуанидинова група на аргинин, карбоксилни групи на аспарагинова и глутаминова киселини, хидрокоиленови и тиолови групи на серин, треонин, тирозин и цистеин, имидазолов пръстен на хистидин. В някои случаи се блокират страничните групи на метиоанин, аспарагин и глутамин. Наскоро бяха предложени защитни групи за индоловия пръстен на триптофана.
Много удобен начин за образуване на пептидна връзка е да реагирате на карбоксилна киселина и амин с дициклохексилкарбодиимид (DCCI) като разцепващ водата агент.
Много удобен начин за образуване на пептидна връзка е да реагирате на карбоксилна киселина и амин с dcn-клохексилкарбодиимид (DCCI).
Синтони, използвани за синтеза на HIV-1 протеаза. Реакциите, използвани за образуване на пептидната връзка и отстраняване на защитните групи, могат да повредят редица висящи функционални групи. Следователно, използването на защитни групи е важно не само за fr-амино- и а-карбоксилни групи, но и за много странични радикали. Тези групи трябва да останат защитени през целия процес на образуване на полипептидна верига и трябва да бъдат отстранени едва след завършване на процеса. В практиката на синтеза на полипептиди се използват различни комбинации от тези групи. Те се въвеждат в мономерите в допълнение към групите, защитаващи o - NH2 - и a - C00 - - групите. Мономери, съдържащи набор от защитни групи и в някои случаи активирани остатъци, което прави възможно директното им използване в процеса на синтез, обикновено се наричат синтони. Като пример, в табл. Фигура 7.6 показва синтоните, използвани за синтезиране на 99-мерния пептид, който е протеаза, кодирана от вируса HIV-1, който причинява СПИН. Огромният интерес към тази протеаза е воден от надеждата за намиране на специфични протеазни инхибитори, които ще предотвратят узряването на вирусните протеини и, следователно, репликацията на този вирус.
Под въздействието на макролида, образуването на пептидни връзки по време на протеиновия синтез се спира, процесът на транслокация се нарушава на етапа, когато пептидиловата РНК се връща от акцепторното (А) място към (Р) мястото.
Съществува голям бройметоди за образуване на пептидни връзки между заместени аминокиселини или пептиди. Те обикновено се разделят на методи, които активират карбоксилната група и методи, които включват активирането на аминогрупата.
Тъй като това е първият пример за образуване на полипептидна връзка при остатък, различен от пролин, трябва да се третира с известна предпазливост. От друга страна, възможно е този метод на образуване на връзка да има отражение върху активността на ензима.
Фосфорилирането на нуклеозид от хлорофосфат е подобно на образуването на пептидна връзка, което възниква, когато амин реагира с ацил хлорид. Вероятно един от най-простите такива примери е реакцията на рибонуклеозид с фосфорен хлороксид.
Нека припомним, че енергията за образуване на пептидна връзка се освобождава при аминолизата на тиоетера.
Дициклохексилкарбодиимидът се използва не само за образуване на пептидни връзки, но често се използва за естерификация, например при синтеза на активирани тиоалкилови и тиоарилови етери. Пропио-тиолактон също беше синтезиран с помощта на N,N-дициклохексилкарбодиимид (виж гл.
Най-често срещаните антибиотици. В повечето грам-положителни бактерии те инхибират образуването на пептидни връзки между молекулите клетъчна стена, което води до неговия лизис. Ефективен само срещу делящи се бактерии.
Друга посока в решаването на проблема с образуването на пептидни връзки е търсенето на биологични системи, които имат изразена нужда от определени пептиди, по-силно изразена от нуждата им от отделните аминокиселини, които изграждат тези пептиди. ако напр. бактериална клеткаизползва пептида за своя растеж по-ефективно от аминокиселините, тогава може да се приеме, че скоростта на пептидния синтез определя скоростта на използване на аминокиселините за образуване на протеин. Този метод е използван в изследване на пептидния метаболизъм в бактериите, проведено от София Симъндс и автора на тази статия в Йейлския университет.
Най-широко използваните методи за образуване на пептидни връзки са: 1) карбодиимид; 2) азид; 3) смесени анхидриди; 4) активирани естери; 5) въглехидрати.
Липман, че образуването на пептидни връзки се предшества от синтеза на фосфатни производни на аминокиселини.
Меги определи топлината и ентропията на образуването на пептидна връзка в твърд полиглицин съответно на 3,3 kcal/mol и 17 entr.
Разбира се, както в случая на образуване на пептидна връзка, е включено определено количество енергия и следователно е необходимо синтезът на фосфодиестерната връзка да не е възможен чрез просто смесване на фосфорна киселина със съответните защитени нуклеозиди. И накрая (вижте по-долу), може дори да е необходимо да блокирате фосфатната група. Въпреки че това не е строго необходимо (и не е използвано в първите нуклеотидни синтези), този метод има своите предимства и в момента е най-разпространеният метод.
Методите за образуване на пептидни връзки, разработени от Фишер и Курциус, не са намерили широко приложение поради липсата на селективно разцепващи се защитни групи.
Тези реакции са ясно благоприятствани от бавната скорост на образуване на желаната пептидна връзка, която възниква поради пространствени пречки, и поради тази причина обемисти аминокиселинни остатъци, като валин и изолевцин, не трябва да се намират в местата на омрежване. Във всички случаи, когато пептидните фрагменти съдържат С-терминални остатъци, различни от глицин или пролин, трябва също да се използва техника, която минимизира риска от рацемизация.
Всички аминокиселини се характеризират със способността да образуват пептидни връзки. В този случай NH2 групата на една молекула аминокиселина реагира с COOH групата на друга молекула. В резултат на това водата се отделя и се получават сложни продукти, наречени пептиди.
Всички аминокиселини се характеризират със способността да образуват пептидни връзки. В този случай NH3 групата на една молекула аминокиселина реагира с COOH групата на друга молекула. В резултат на това водата се отделя и се получават сложни продукти, наречени пептиди.
II] и подобно на тетраетилпирофосфита се използва за образуване на пептидни връзки.
Пример за такъв процес е горната реакция на образуване на пептидна връзка, която протича с увеличаване на свободната енергия на системата. Тази реакция става осъществима в присъствието на дициклохексилкарбодиимид, тъй като при хидратирането на последния се освобождава свободна енергия, която покрива разходите за свободна енергия за синтеза на пептидната връзка.
Пример за такъв процес е горната реакция на образуване на пептидна връзка, която протича с увеличаване на свободната енергия на системата. Тази реакция става осъществима в присъствието на дициклохексилкарбодиимид, тъй като при хидратирането на последния се освобождава свободна енергия, която покрива разходите за свободна енергия за синтеза на пептидната връзка.
Приемайки, че същите стойности съответстват на образуването на пептидни връзки от други аминокиселини, Меги стига до извода, че синтезът на протеини при биологични условия е термодинамично възможен, ако е придружен от хидролиза на аденозин трифосфат, пирофосфат или полифосфат.
Ацилирането на друга аминокиселина със смесен анхидрид води до образуването на пептидна връзка. Карбоксилната група на така получения пептид може да бъде реактивирана и комбинирана със следващата аминокиселина.
Пептидна връзкае връзка между алфа карбоксилната група на една аминокиселина и алфа амино групата на друга аминокиселина.
Фигура 5. Образуване на пептидна връзка
Свойствата на пептидната връзка включват:
1. Транспониране на аминокиселинни заместители (радикали) по отношение на C-N връзки. Фиг. 6.
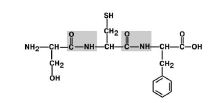
Фигура 6. Аминокиселинните радикали са в транс позиция.
2. Копланарност
Всички атоми, включени в пептидната група, са в една и съща равнина, като атомите "H" и "O" са разположени от противоположните страни на пептидната връзка. Фиг. 7, а.
3. Наличност кетоформи и енол ny форма. Фиг. 7, б 
Фигура 7. а) б)
4. Образователна способност две водородни връзкис други пептидни групи. Фигура 8.
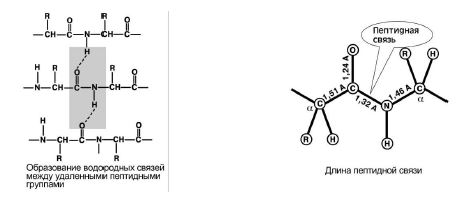
5. Пептидната връзка е частично двойнокомуникации. Дължината му е по-къса от тази на единичната връзка, структурата е твърда и въртенето около нея е трудно.
Но тъй като освен пептидната връзка в протеина има и други връзки, веригата от аминокиселини е способна да се върти около главната ос, което придава на протеините различна конформация (пространствено разположение на атомите).
Последователността на аминокиселините в полипептидната верига е първична структуракатерица. Той е уникален за всеки протеин и определя неговата форма, както и различни свойства и функции.
Повечето протеини имат спираловидна форма в резултат на образуването на водородни връзки между -CO-И -NH-групи от различни аминокиселинни остатъци на полипептидната верига. Водородните връзки са слаби, но взети заедно, те осигуряват доста силна структура. Тази спирала е вторична структура
катерица.
Третична структура- триизмерно пространствено "опаковане" на полипептидната верига. Резултатът е странна, но специфична конфигурация за всеки протеин - глобула. Силата на третичната структура се осигурява от различните връзки, които възникват между аминокиселинните радикали.
Кватернерна структуране е характерно за всички протеини. Възниква в резултат на комбинирането на няколко макромолекули с третична структура в сложен комплекс. Например човешкият кръвен хемоглобин е комплекс от четири протеинови макромолекули; в този случай хидрофобните взаимодействия имат основен принос за взаимодействието на субединиците.
Тази сложност на структурата на протеиновите молекули е свързана с разнообразието от функции, които са характерни за тези биополимери, например защитни, структурни и др.
Нарушаването на естествената структура на протеина се нарича денатурация. Може да възникне под въздействието на температурата, химикали, лъчиста енергия и други фактори. При слабо въздействие се разпада само кватернерната структура, при по-силна - третичната, а след това и вторичната, а протеинът остава под формата на полипептидна верига, т.е. под формата на първична структура.
Този процес е частично обратим: ако не се нарушава първична структура, тогава денатурираният протеин е в състояние да възстанови своята структура. От това следва, че всички структурни характеристики на протеиновата макромолекула се определят от нейната първична структура.

Фигура 9. Протеинови структури
©2015-2017 сайт
Всички права принадлежат на техните автори. Този сайт не претендира за авторство, но предоставя безплатно използване.
Пептидите, чиято последователност е по-къса от около 10-20 аминокиселинни остатъка, също могат да бъдат наречени олигопептиди; тези с по-голяма дължина на последователността се наричат полипептиди. Протеините обикновено се наричат полипептиди, съдържащи приблизително 50 аминокиселинни остатъка.
Към днешна дата са известни повече от 1500 вида пептиди, техните свойства са определени и са разработени методи за синтез.
Панкреатични полипептидни молекули
- ПРИЛОЖЕНИЕ Птичи панкреатичен полипептид
- en:HPP Човешки панкреатичен полипептид
Свойства на пептидите
Пептидите непрекъснато се синтезират във всички живи организми, за да регулират физиологичните процеси. Свойствата на пептидите зависят основно от тяхната първична структура – последователността на аминокиселините, както и от структурата на молекулата и нейната конфигурация в пространството (вторична структура).
Класификация на пептидите и структура на пептидната верига
Пептидната молекула е последователност от аминокиселини: два или повече аминокиселинни остатъка, свързани с амидна връзка, образуват пептид. Броят на аминокиселините в един пептид може да варира значително. А според количеството си се разграничават:
- олигопептиди - молекули, съдържащи до десет аминокиселинни остатъка; понякога името им споменава броя на аминокиселините, които съдържат, например дипептид, трипептид, пентапептид и т.н.;
- полипептидите са молекули, съдържащи повече от десет аминокиселини.
Съединения, съдържащи повече от сто аминокиселинни остатъка, обикновено се наричат протеини. Това разделение обаче е условно, някои молекули, например хормонът глюкагон, съдържащ само двадесет и девет аминокиселини, се наричат протеинови хормони. Въз основа на техния качествен състав се разграничават:
- хомомерни пептиди - съединения, състоящи се само от аминокиселинни остатъци;
- хетеромерните пептиди са вещества, които също съдържат непротеинови компоненти.
Пептидите също се разделят според начина, по който аминокиселините са свързани една с друга:
- хомодетия - пептиди, чиито аминокиселинни остатъци са свързани само с пептидни връзки;
- хетерогенни пептиди са тези съединения, в които освен пептидни връзки има и дисулфидни, етерни и тиоетерни връзки.
Веригата от повтарящи се атоми се нарича пептиден скелет: (-NH-CH-OC-). Мястото (-CH-) с аминокиселинен радикал образува съединение (-NH-C(R1)H-OC-), наречено аминокиселинен остатък. N-терминалният аминокиселинен остатък има свободна α-аминогрупа (-NH), докато С-терминалният аминокиселинен остатък има свободна α-карбоксилна група (OC-). Пептидите се различават не само по аминокиселинен състав, но и по количество, както и по разположение и свързване на аминокиселинните остатъци в полипептидна верига. Пример: Pro-Ser-Pro-Ala-Gis и Gis-Ala-Pro-Ser-Pro Въпреки еднакъв количествен и качествен състав, тези пептиди имат напълно различни свойства.
Пептидна връзка
Пептидна (амидна) връзка е вид химическа връзка, което възниква поради взаимодействието на α-аминогрупата на една аминокиселина и α-карбокси групата на друга аминокиселина. Амидната връзка е много силна и не се разкъсва спонтанно при нормални клетъчни условия (37 °C, неутрално pH). Пептидната връзка се разрушава от действието върху нея на специални протеолитични ензими (протеази, пептидни хидролази).
Смисъл
Пептидни биорегулатори
Въз основа на технологията, разработена от учени от Санкт Петербург, от животински органи и тъкани са изолирани пептиди, които имат тъканно-специфичен ефект и са способни да възстановят метаболизма в клетките на тъканите, от които са изолирани, до оптимално ниво. Важна разликана тези пептиди е техният регулаторен ефект: когато функцията на клетката е потисната, те я стимулират, а когато функцията се увеличи, те я намаляват до нормално ниво. Това направи възможно създаването нов класлекарства – пептидни биорегулатори.
Първият от тях, имуномодулаторът Thymalin, е на фармацевтичния пазар повече от 28 години и се използва за възстановяване на функцията на имунната система при заболявания от различен произход, включително рак. Следват епиталамин (биорегулатор на невроендокринната система), сампрост (лекарство за лечение на заболявания на простатата), Кортексин (лекарство за лечение на широк спектър от неврологични заболявания) и ретиналамин (лекарство за лечение на дегенеративни заболявания на ретината). За 25 години широко използване на пептидни биорегулатори повече от 15 милиона души са ги получили. В същото време не са установени противопоказания за тяхното използване или странични ефекти.
Сега е открито, че тималинът и други подобни са противопоказани при автоимунни заболявания, т.к Тималинът също така стимулира зоната на превъзбуден имунитет. Очевидно на тималина напълно липсва супресорна функция, която е изключително важна в борбата с автоимунните заболявания.
