Тема 2. ФАЗНИ ПРЕХОДИ.
Фазовият преход (фазова трансформация) е преходът на вещество от една фаза в друга, когато се променят външни канали (например температура, налягане, магнитни и електрически полета и др.), Придружен от промяна във физическите свойства и параметри на веществото.
Стойността на температура, налягане или някакво друго физическо количество, при което се случва фазовият преход, се нарича преходна точка. Разграничете фазовия преход на два рода.
ПЪРВИ ПРОМЕНИ НА ПРОМЕНА
При фазов преход от първи ред, такъв термодинамичен
характеристики на вещество, като плътност, концентрация на компоненти, специфичен обем, количество натрупана вътрешна енергия, т.е. определено количество топлина, наречена топлина на прехода, се отделя или абсорбира. И имам предвид рязката промяна на тези количества не във времето, а в случай на промяна на температурата, налягането и т.н. Най-честите примери за фазови преходи от първия вид:
- топене и кристализация
- изпаряване и кондензация
- сублимация и десублимация
ВТОРИ ФАЗНИ ПРЕХОДИ
При фазовия преход от втори ред плътността и вътрешната енергия не се променят, така че такъв фазов преход може да бъде невидим с просто око. Скокът се преживява от техните производни по отношение на температура и налягане: топлинен капацитет, коефициент на топлинно разширение, различни податливости и др. Фазовите преходи от втори ред са придружени от промяна в симетрията на структурата на веществото, а не от освобождаването или абсорбирането на енергия (топлина). Най-често срещаните примери за фазови преходи от втори вид:
- система, преминаваща през критична точка
- парамагнет-феромагнетичен преход
- преход на метали и сплави в състояние на свръхпроводимост
- свръхтечен преход на течен хелий
- преходът на аморфни материали в стъклено състояние
Съвременната физика също изследва системи с фазови преходи от трети или по-висш вид. Напоследък идеята за квантов фазов преход, т.е. фазов преход, контролиран не от класическите топлинни колебания, а от квантови, които съществуват дори при абсолютна нулева температура, където класическият фазов преход не може да бъде реализиран поради теоремата на Нернст.
Нека разгледаме по-подробно феномените, които ни интересуват, свързани с фазови преходи от първи вид.
ОЦЕНЯВАНЕ, КОНДЕНСАЦИЯ, ВАРЯНЕ.
САТУРИРАНИ И НЕЗАСУТИРАНИ ВАПОРИ.
При определени условия всяко вещество може да бъде в различни агрегационни състояния - твърди, течни и газообразни. Преходите от едно състояние на агрегация във второ са фазови преходи от първия вид.
изпаряване и кондензация са фазови преходи между течната и газообразната фаза на веществото.
всички истински газове (кислород, азот, водород и др.) при определени условия са в състояние да се превърнат в течност. Такава трансформация обаче може да се случи само при температури под определена, т.нар критична температура T Кр. Например критичната температура за водата е 647,3 К, за азот 126 К, за кислород 154,3 К. При стайна температура (≈ 300 К) водата може да бъде в течно и газообразно състояние, а азот и кислород съществуват само под формата на газове.
изпаряване наречен фазов преход от течно в газообразно състояние. От гледна точка на молекулярно-кинетичната теория, изпаряването е процес, при който най-бързите молекули излитат от повърхността на течност, чиято кинетична енергия надвишава енергията на свързването им с други течни молекули. Това води до намаляване на средната кинетична енергия на останалите молекули, т.е. до охлаждане на течността (ако няма снабдяване с енергия от околните тела).
кондензация Дали е обратното на процеса на изпаряване. При кондензация молекулите на парите се връщат в течността.
В затворен съд течността и неговите пари могат да бъдат в състояние динамично равновесиекогато броят на молекулите, напускащи течността, е равен на броя на молекулите, които се връщат в течността от парата, т.е. когато скоростите на изпаряване и кондензация са еднакви. Тази система се нарича двуфазен , Нарича се пара в равновесие с нейната течност наситен.
Броят на молекулите, които излитат от единичната повърхност на течността за една секунда, зависи от температурата на течността. Броят на молекулите, връщащи се от пари в течност, зависи от концентрацията на молекулите на парите и от средната им скорост топлинно движение, която се определя от температурата на парата. От това следва, че за дадено вещество концентрацията на молекулите на парата при равновесие на течността и нейните пари се определят от тяхната равновесна температура. Установяването на динамично равновесие между процесите на изпаряване и кондензация с повишаване на температурата става при по-високи концентрации на молекулите на парите. Тъй като налягането на газа (парата) се определя от неговата концентрация и температура, можем да заключим: налягането наситена пара p 0 на дадено вещество зависи само от неговата температура и не зависи от обема, Следователно изотермите на реални газове в равнината ( р, V) съдържат хоризонтални секции, съответстващи на двуфазна система (фиг. 3.4.1).
С повишаване на температурата налягането на наситената пара и нейната плътност нарастват, а плътността на течността намалява поради термично разширение. При температура, равна на критичната T cr за дадено вещество, плътността на парите и течността стават еднакви. при T > T cr физически разлики между течността и нейните наситени пари изчезват.
Ако изотермично компресирате ненаситена пара при T < T cr, тогава налягането му ще се увеличава, докато стане равно на налягането на наситени пари. С по-нататъшно намаляване на обема се образува течност на дъното на съда и се установява динамично равновесие между течността и нейната наситена пара. С намаляване на обема, все по-голяма част от парата се кондензира и налягането й остава непроменено (хоризонтално сечение върху изотермата). Когато цялата пара се превърне в течност, налягането рязко се увеличава с по-нататъшно намаляване на обема поради ниската свиваемост на течността.
От газообразно състояние в течно състояние човек може да премине, заобикаляйки двуфазния участък. За да направите това, трябва да завършите процеса, заобикаляйки критичната точка. K, Един от възможните процеси от този вид е показан на фиг. 1 чрез прекъсната линия. ABC.
В атмосферния въздух водната пара винаги присъства при някакво частично налягане. р, което обикновено е по-малко от налягането на наситените пари р 0. отношение р / р 0, изразено като процент, се нарича относителна влажност въздух.
| |
Теоретично ненаситената пара може теоретично да се опише, като се използва уравнението на състоянието на идеален газ при обичайните ограничения за реални газове: налягането на парата не трябва да бъде твърде високо (практически р ≤ (10 6–10 7) Ра), а температурата му е над определена стойност, определена за всяко вещество. Законите на идеалния газ също могат да бъдат приблизително приложени към наситени пари, при условие че за всяка температура T налягането р 0 наситена пара се определя от равновесна кривар 0 (T) за дадено вещество.
налягането р 0 наситената пара се увеличава много бързо с температурата T, зависимост р 0 (T) не може да се получи от законите на идеалния газ. Налягането на газ при постоянна концентрация на молекули нараства в пряка пропорция на температурата. При наситена двойка с повишаване на температурата се увеличава не само средната кинетична енергия на молекулното движение, но и тяхната концентрация. Следователно налягането на наситените пари се увеличава по-бързо с повишаване на температурата, отколкото налягането на идеален газ при постоянна концентрация на молекули.
Изпаряването може да се случи не само от повърхността, но и в обема на течността. Винаги има мънички газови мехурчета в течност. Ако налягането на наситените пари на течността е равно или по-голямо от външното налягане (т.е. налягането на газа в мехурчетата), течността ще се изпари вътре в мехурчетата. Мехурчетата, напълнени с пара, се разширяват и изплуват на повърхността. Този процес се нарича кипене , По този начин кипенето на течност започва при температура, при която налягането на наситените му пари става равно на външното налягане.
По-специално при нормално атмосферно налягане водата кипи при температура 100 ° C. Това означава, че при тази температура налягането на наситена водна пара е 1 атм. При изкачване на планини атмосферното налягане намалява и следователно точката на кипене на водата намалява (приблизително 1 ° C за всеки 300 метра надморска височина). На надморска височина от 7 км налягането е около 0,4 атм, а температурата на кипене пада до 70 ° С.
В херметически затворен съд течността не може да заври, тъй като при всяка температура на температурата се установява равновесие между течността и нейната наситена пара. По дължината на кривата на равновесие р 0 (T) възможно е да се определи температурата на кипене на течност при различни налягания.
Картината на изотермите на реален газ, изобразена на фиг. 1, описва процесите на изпаряване и кондензация, т.е. фазовия преход между газообразната и течната фаза на веществото. Всъщност тази картина е непълна, тъй като всяко вещество може да премине в твърдо състояние от газообразни и течни. При дадена температура T термодинамично равновесие между две фази на едно и също вещество е възможно само с определено налягане в системата. Нарича се зависимостта на равновесното налягане от температурата крива на фазово равновесие , Пример е кривата на равновесие. р 0 (T) наситена пара и течност. Ако кривите на равновесие между различните фази на дадено вещество са изградени на равнината ( р, T), след това разбиват тази равнина на отделни области, в които веществото съществува в униформа състояние на агрегация - твърди, течни или газообразни (фиг. 2). Изобразен в координатната система ( р, T) равновесни криви се наричат фазова диаграма .
Крива 0 Tсъответстващо на равновесието между твърдата и газообразната фаза се нарича сублимационна крива, Кривата TK се нарича равновесие между течност и пара крива на изпарениетя се откъсва в критична точка K, Кривата TM равновесието между твърдо и течно се нарича крива на топене.
Равновесните криви се сближават в точка Tв която и трите фази могат да съществуват в равновесие. Тази точка се нарича тройна точка.
За много вещества, налягане р tr в тройната точка е по-малко от 1 атм ≈ 10 5 Па. Такива вещества се стопят при нагряване при атмосферно налягане. Например, тройната точка на водата (фиг. 3) има координати T т.т. \u003d 273,16 К, р mp \u003d 6.02 · 10 2 Pa и се използва като еталон за калибриране на абсолютната скала на температурата на Келвин.
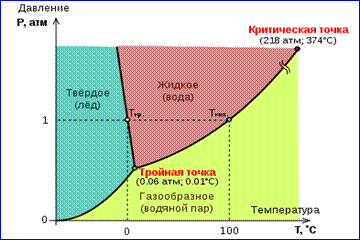 Има обаче и такива фиг. 3 фазова диаграма на водата
Има обаче и такива фиг. 3 фазова диаграма на водата
вещества, за които р т.т.
надвишава 1 атм. Така че за
налягане на въглероден диоксид (CO 2)
р т.т. \u003d 5,11 атм и температура
T т.т. \u003d 216,5 K. Следователно при атмосферно
твърд въглероден диоксид може
съществуват само при ниски температури и в течно състояние при р \u003d 1 атм, изобщо не съществува. В твърдо състояние въглеродният диоксид е в равновесие със своите пари при атмосферно налягане при температура 173 К или -80 ° С. Това е широко използван „сух лед“, който никога не се топи, а само се изпарява (сублимира).
При естествени условия парата се счита за газ. Той може да бъде наситен и нена-насищане, което зависи от неговата плътност, температура и налягане.
Парата в динамично равновесие със собствената си течност е наситен.
Динамично равновесие между течност и пара възниква, когато броят на молекулите, излъчени от свободната повърхност на течността, е равен на броя на молекулите, които се връщат към нея.
В отворен съд динамичното равновесие се нарушава и парата става нена-насищане, тъй като определен брой молекули се изпаряват в атмосферата и не се връщат в течността.
Наситена пара образувани в затворен съд над свободната повърхност на течността.
наситен и ненаситени пара имат различни свойства. Разгледайте ги.
| Фиг. 3.2. Изотермално компресиране на пара |
Молекулна концентрация наситена пара независимо от нейния обем.
нека ненаситена парапри температура T разположен в цилиндъра с бутало (фиг. 3.2). Започваме да го компресираме бавно, за да осигурим изотермичен процес (раздел AB). Първо, ако парата е значително разредена, зависимостта от налягането от обема ще съответства на закона на Бойл-Мариот за идеален газ: pV \u003d const. Независимо от това, с намаляване на обема на ненаситената пара (увеличаване на плътността й) започва да се наблюдава отклонение от нея. По-нататъшното изотермично компресиране на парите води до факта, че тя започва да се кондензира (точка В), в цилиндъра се образуват течни капки и парата става наситена. Неговата плътност и следователно концентрацията на молекулите придобиват максималната стойност за дадена температура. Те са независими от обема, зает от наситена пара и се определят от неговото налягане и температура.
Под компресия наситена пара (BC секция) налягането му няма да се промени ( p \u003d Конст). Това се обяснява с факта, че с намаляване на обема, наситената пара кондензира, образувайки течност. Делът му в обема на цилиндъра се увеличава непрекъснато, а обемът, който заема наситената пара, намалява. Това се случва, докато цялата наситена пара преминава в течно състояние (точка С).
По-нататъшното намаляване на обема причинява бързо повишаване на налягането (DC секция), тъй като течностите почти не се компресират. Материал от сайта
И така, с изотермична компресия ненаситена пара първо (при ниска плътност) проявява свойствата на идеален газ. Кога става пара наситен, неговите свойства се подчиняват на други закони. По-специално при ниски температури състоянието му е приблизително описано от уравнението р = нКТ,когато концентрацията на молекулите е независима от обема, зает от газа. Графика на налягането р по обем V, изобразена на фиг. 3.2 се нарича изотерма на реални газове.
Изотерми на реален газ характеризират нейното равновесно състояние с течността. Тяхната съвместимост дава възможност да се определи зависимостта от натиска. наситена пара от температура.
На тази страница материал по темите:
Какво е характерно за наситената пара от молекулярна гледна точка
Какво е характерно за молекулярната гледна точка за залог
Какво е характерно за наситен газ от молекулярна гледна точка
Научни знания
Кратък синопсис на наситена пара
Въпроси относно този материал:
Процесите на изпаряване и кондензация са непрекъснати и успоредни един на друг.
В открит съд количеството на течността намалява с времето, защото изпарението надделява над конденза.
Парата, която е над повърхността на течността, когато изпарението надделява над конденза или парата при липса на течност се нарича ненаситени.
В херметически затворен съд нивото на течността не се променя с течение на времето, защото изпаряването и кондензацията се отменят взаимно: колко молекули излитат от течността, колко от тях се връщат към нея за едно и също време, между парата и нейната течност възниква динамично (подвижно) равновесие.
Нарича се пара, която е в динамично равновесие с течността си наситен.
При дадена температура наситените пари на течността имат най-висока плътност ( ) и създава максимално налягане ( ), които могат да имат пари от тази течност при тази температура.
Налягането и плътността на наситената пара при същата температура зависи от естеството на веществото: по-високото налягане създава наситени пари от течността, които се изпаряват по-бързо.Например и
Свойства на ненаситените пари:Ненаситените двойки се подчиняват на газовите закони на Бойл - Marriott, Gay-Lussac, Charles, а уравнението на състоянието на идеален газ може да се приложи към тях.
Свойства на наситените пари:1. При постоянен обем с повишаване на температурата налягането на наситените пари се увеличава, но не в пряка пропорция (законът на Чарлз не е изпълнен), налягането нараства по-бързо от това на идеалния газ. , с повишаване на температурата ( ) , масата на парите се увеличава и следователно концентрацията на молекулите на парите () се увеличава и налягането на наситените пари се стопява по две причини (
3 1 - ненаситена пара (идеален газ);
2 2 - наситена пара; 3 Ненаситена пара
1 получени от наситена пара в същата
Обем при нагряване.
2. Налягането на наситените пари при постоянна температура не зависи от обема, който заема.
С увеличаването на обема масата на парите нараства и масата на течността намалява (част от течността се превръща в пара), с намаляване на обема на пара тя става по-малка и по-течна (част от парата се превръща в течност), плътността и концентрацията на наситените молекули на пара остават постоянни, следователно налягането остава постоянно ().
течност
(сб пара + течност)
Ненаситените. пара
Наситените пари не се подчиняват на газовите закони на Бойл - Marriott, Gay-Lussac, Charles, защото масата на пара в процесите не остава постоянна, а всички газови закони се получават за постоянна маса. Може да се приложи уравнението на наситения газ на състояние на идеален газ.
По този начин, наситената пара може да се превърне в ненаситена пара, или чрез нагряване с постоянен обем, или чрез увеличаване на обема си при постоянна температура. Ненаситената пара може да се превърне в наситена пара, или чрез охлаждане с постоянен обем, или чрез компресиране при постоянна температура.
Критично състояние
Наличието на свободна повърхност в течност позволява да се посочи къде се намира течната фаза на веществото и къде е газообразната. Рязката разлика между течността и нейните пари се обяснява с факта, че плътността на течността е многократно по-голяма от тази на парата. Ако течността се нагрява в херметически затворен съд, тогава поради разширяване плътността й ще намалее, а плътността на парите над нея ще се увеличи. Това означава, че разликата между течността и нейните наситени пари се изглажда и изчезва напълно при достатъчно висока температура. Температурата, при която разликите в физически свойства между течността и нейните наситени пари и плътностите им стават еднакви, нареченикритична температура.
Критична точка
За образуването на течност от газ, средното потенциална енергия привличането на молекулите трябва да надвишава средната им кинетична енергия.
Критична температура – максималната температура, при която парата се превръща в течност. Критичната температура зависи от потенциалната енергия на взаимодействие на молекулите и следователно е различна за различните газове. Поради силното взаимодействие на водни молекули, водната пара може да се превърне във вода дори при температура. В същото време втечняването на азот става само при температура, по-ниска от \u003d -147˚, тъй като азотните молекули взаимодействат слабо помежду си.
Друг макроскопичен параметър, засягащ прехода пара-течност, е налягането. С увеличаване на външното налягане по време на компресиране на газ средното разстояние между частиците намалява, атрактивната сила между тях се увеличава и съответно средната потенциална енергия на тяхното взаимодействие.
налягането наситена пара при критичната си температура се нарича критичен, Това е възможно най-високото налягане на наситени пари на дадено вещество.
Състояние на веществото с критични параметри се нарича критичен(критична точка) . Всяко вещество има собствена критична температура и налягане.
В критично състояние специфичната топлина на изпаряване и коефициентът на повърхностно напрежение на течността изчезват. При температури над критични, дори при много високо налягане, не е възможно да се преобразува газ в течност, т.е. над критичната температура, течността не може да съществува. При свръхкритични температури е възможно само състоянието на парата на веществото.
Втечняване на газ е възможно само при температури под критичната температура. За втечняване газовете се охлаждат до критична температура, например, чрез адиабатно разширение и след това се пресоват изотермично.
кипене
Външно явлението изглежда така: От целия обем на течността, бързо растящите мехурчета се издигат на повърхността, те се спукват на повърхността и парата се отделя в околната среда.
MKT обяснява кипенето така: винаги има въздушни мехурчета в течност; изпаряването става от тях в течност. Затвореният обем на мехурчетата се изпълва не само с въздух, но и с наситена пара. Налягането на наситените пари в тях се увеличава при нагряване на течността, отколкото налягането на въздуха. Когато налягането на наситените пари в мехурчетата в достатъчно загрята течност стане по-голямо от външното налягане, те се увеличават по обем и силата на плаваемост, надвишаваща тежестта им, издига мехурчетата на повърхността. Повърхностните мехурчета започват да се спукват, когато при определена температура налягането на наситените пари в тях надвишава налягането над течността. Температурата на течността, при която налягането на наситената й пара в мехурчетата е равно или по-голямо от външното налягане върху течността, се нарича точка на кипене.
Точката на кипене на различни течности е различназащото налягането на наситените пари в техните мехурчета се сравнява със същото външно налягане при различни температури. Например налягането на наситените пари в мехурчетата е равно на нормалното атмосферно налягане за вода при 100 ° С, за живак при 357 ° С, за алкохол при 78 ° С, за етер при 35 ° С.
Точката на кипене в процеса на кипене остава постоянна, защото цялата топлина, която се подава към загрятата течност, се изразходва за изпаряване.
Точката на кипене зависи от външното налягане върху течността: с увеличаване на налягането температурата се повишава; с намаляващо налягане температурата намалява. Например на надморска височина от 5 km, където налягането е 2 пъти по-ниско от атмосферното, точката на кипене на водата е 83 ° C, в котли на парни машини, където налягането на парата е 15 atm. (), температурата на водата е около 200 ° C.
Влажност на въздуха
Във въздуха винаги има водна пара, така че можем да говорим за влажност на въздуха, която се характеризира със следните стойности:
1.Абсолютна влажност Дали плътността на водната пара във въздуха (или налягането, което създава тази пара (.
Абсолютната влажност не дава представа за степента на насищане на въздуха с водна пара. Едно и също количество водна пара при различни температури създава различно усещане за влага.
2.Относителна влажност е съотношението на плътността (налягането) на водната пара, съдържаща се във въздуха при дадена температура, към плътността (налягането) на наситената пара при същата температура : или
- абсолютна влажност при дадена температура; - плътност, налягане на наситени пари при същата температура. Плътността и налягането на наситената водна пара при всяка температура могат да бъдат намерени в таблицата. От таблицата се вижда, че колкото по-висока е температурата на въздуха, толкова по-голяма трябва да е плътността и налягането на водната пара във въздуха, така че той да е наситен.
Познавайки относителната влажност, можем да разберем колко процента водна пара във въздуха при дадена температура е далеч от насищане. Ако парите във въздуха са наситени, тогава. ако , тогава до състоянието на насищане във въздуха няма достатъчно пара.
Фактът, че парата във въздуха става наситен, се съди по появата на влага под формата на мъгла, роса. Нарича се температурата, при която водната пара във въздуха става наситен точка на оросяване.
Парата във въздуха може да бъде наситена, ако добавите пара поради допълнително изпаряване на течността, без да променяте температурата на въздуха, или ако количеството пара във въздуха е достъпно, намалете температурата му.
Нормалната относителна влажност, най-благоприятна за хората, е 40-60%. От голямо значение е познаването на влажността в метеорологията за прогнозиране на времето. В тъкачната и сладкарската промишленост е необходима определена влажност за нормалния ход на процеса. Съхранението на произведения на изкуството и книги изисква поддържане на влажността на въздуха на необходимото ниво.
Устройства за определяне на влажност:
1. Кондензационен хигрометър (ви позволява да определите точката на оросяване).
2. Хигрометър за коса (принципът на действие се основава на зависимостта на дължината на обезкостената коса от влагата) измерва относителната влажност в проценти.
3. Психометърът се състои от два сухи и мокри термометра. Резервоарът на овлажнения термометър е увит в кърпа, потопена във вода. Поради изпаряването от тъканта температурата на навлажнения е по-ниска от тази на сухата. Разликата в показанията на термометрите зависи от влажността на околния въздух: колкото по-сух е въздухът, толкова по-интензивно е изпаряването от тъканта, толкова по-голяма е разликата в показанията на термометрите и обратно. Ако влажността е 100%, то показанията на термометрите са същите, т.е. разликата в показанията е 0. За определяне на влажността с помощта на психрометър се използва психрометрична таблица.
Топене и кристализация
При топене на твърдо тяло, разстоянието между частиците, образуващи кристалната решетка, се увеличава и самата решетка се разрушава. Необходимо е да се изразходва енергия за процеса на топене. При загряване на твърдо вещество кинетичната енергия на вибриращите молекули се увеличава и съответно амплитудата на техните вибрации. При определена температура, наречена точка на топене редът в подреждането на частиците в кристалите се нарушава, кристалите губят формата си. Веществото се топи, преминавайки от твърдо състояние в течно състояние.
По време на кристализациятаима сближаване на молекулите, които образуват кристалната решетка. Кристализацията може да възникне само когато течността отделя енергия. Когато разтопеното вещество се охлади, средната кинетична енергия и скоростта на молекулите намаляват. Гравитационните сили могат да задържат частиците близо до равновесно положение. При определена температура, наречена температура на втвърдяване (кристализация),всички молекули са в стабилно равновесно положение, подреждането им става подредено - образува се кристал.
Твърдото топене се извършва при същата температура, при която това вещество се втвърдява
Всяко вещество има своя собствена точка на топене. Например точката на топене на хелия е -269.6 ° С, за живак -38.9 ° С и за мед 1083 ° С.
По време на процеса на топене температурата остава постоянна. Количеството топлина, подавана отвън, се използва за унищожаване на кристалната решетка.
По време на процеса на втвърдяване, въпреки факта, че топлината се отстранява, температурата не се променя. Енергията, отделена по време на кристализацията, се използва за поддържане на постоянна температура.
Докато цялото вещество не се е разтопило или цялото вещество не се е втвърдило, т.е. докато твърдата и течната фаза на веществото съществуват заедно, температурата не се променя.
ТВ. + Евреин. Евреин + телевизор.
, където е количеството топлина, е количеството топлина, необходимо за разтопяване на веществото, отделено при кристализация на вещество с маса маса
- специфична топлина на синтез– количеството топлина, необходимо за разтопяване на вещество с тегло 1 kg в точка на топене.
Колко топлина се изразходва по време на топенето на определена маса на веществото, същото количество топлина се отделя по време на кристализацията на тази маса.
Също така се нарича специфична топлина на кристализация.
При температура на топене вътрешната енергия на веществото в течно състояние е по-голяма от вътрешната енергия на една и съща маса на вещество в твърдо състояние.
За голям брой вещества обемът по време на топенето се увеличава, а плътността намалява. При втвърдяване, напротив, обемът намалява и плътността се увеличава. Например, твърди нафталинови кристали се удавят в течен нафталин.
Някои вещества, например, бисмут, лед, галий, чугун и др., Се пресоват по време на топене и се разширяват при втвърдяване. Тези отклонения от общото правило се обясняват със структурните особености на кристалните решетки. Следователно водата е по-гъста от леда, ледът плава във вода. Разширяването на водата по време на замръзване води до разрушаване на скалите.
Промяната в обема на металите по време на топенето и втвърдяването е от съществено значение за леярския бизнес.
Опитът показва това промяна на външното налягане твърда материя влияе върху точката на топене на това вещество, За тези вещества, които се разширяват при топене, увеличаването на външното налягане води до повишаване на температурата на топене, защото усложнява процеса на топене. Ако по време на топенето веществата се компресират, тогава за тях увеличаването на външното налягане води до намаляване на температурата на топене, защото подпомага процеса на топене. Само много голямо увеличение на налягането осезаемо променя температурата на топене. Например, за да се понижи температурата на топене на лед с 1 ° С, налягането трябва да се увеличи с 130 атм. Точката на топене на вещество при нормално атмосферно налягане се нарича точка на топене на веществото.
След кипене температурата на водата спира да расте и остава непроменена до пълно изпаряване. Изпаряването е процесът на преминаване от течно състояние в пара, който има същия температурен индикатор като вряща течност. Това изпарение се нарича наситена пара. Когато цялата вода се изпари, всяко последващо добавяне на топлина повишава температурата. Загрятата пара след наситено ниво се нарича прегрята. Наситената пара обикновено се използва в промишлеността за отопление, готвене, сушене или други процедури. Прегрятото се използва изключително за турбини. Различните видове пара имат различни енергии на обменния потенциал и това оправдава използването им за напълно различни цели.
Парата като едно от трите физически състояния
Разбирането на свойствата на парата може да помогне за разбирането на общата молекулна и атомна структура на веществото, както и прилагането на тези знания относно лед, вода и пара. Молекулата е най-малката единица от всеки елемент или съединение. Той от своя страна се състои от още по-малки частици, наречени атоми, които определят основни елементи като водород и кислород. Конкретните комбинации от тези атомни елементи осигуряват комбинация от вещества. Едно от тези съединения е представено с химичната формула Н20, молекулите на която се състоят от 2 водородни атома и 1 кислороден атом. Въглеродът също е в изобилие, той е ключов компонент на всички органични вещества. Повечето минерали могат да съществуват в три физически състояния ( твърдо тялотечност и пара), които се наричат \u200b\u200bфази.
Процес на образуване на пара
Когато температурата на водата се приближи до точката на кипене, някои молекули получават достатъчно кинетична енергия, за да достигнат скорости, които им позволяват за момент да се отделят от течността в пространството над повърхността, преди да се върнат. По-нататъшното нагряване предизвиква повече вълнение и броят на молекулите, желаещи да напуснат течността, се увеличава. При атмосферно налягане температурата на насищане е 100 ° C. Парата с точка на кипене при това налягане се нарича суха наситена пара. Подобно на фазовия преход от лед към вода, процесът на изпаряване също е обратим (кондензация). Критичната точка е най-високата температура, при която водата може да бъде в течно състояние. Над тази точка парата може да се счита за газ. Газовото състояние е подобно на дифузното, при което молекулите имат почти неограничена възможност за движение.
Променлива връзка
При дадена температура има определено налягане на парата, което съществува в равновесие с течна вода. Ако този индикатор се увеличи, парата се прегрява и се нарича суха. Съществува връзка между налягане и температура: знаейки една стойност, можете да определите друга. Състоянието на пара се определя от три променливи: налягане, температура и обем. Сухата наситена пара е състояние, при което пара и вода могат да присъстват едновременно. С други думи, това се случва, когато скоростта на изпаряване е равна на скоростта на кондензация.
Наситена пара и нейните свойства
Когато обсъждаме свойствата на наситената пара, тя често се сравнява с идеалния газ. Имат ли нещо общо или това е проста заблуда? Първо, при постоянно ниво на температура, плътността, плътността не зависи от обема. Визуално това може да се представи по следния начин: необходимо е визуално да намалите обема на резервоара с пара, без да променяте температурните индикатори. Броят кондензирани молекули ще надвиши броя на изпаряващите се и парите ще се върнат в състояние на равновесие. В резултат на това плътността ще бъде постоянен параметър. Второ, такива характеристики като налягане и обем не зависят една от друга. Трето, като се вземе предвид инвариантността на обемните характеристики, плътността на молекулите се увеличава при повишаване на температурата и става по-малка, когато тя намалява. Всъщност при нагряване водата започва да се изпарява по-бързо. В този случай балансът ще бъде разстроен и няма да бъде възстановен, докато плътността на парите се върне в предишното си положение. По време на кондензацията, напротив, плътността на наситената пара ще намалее. За разлика от идеалния газ, наситената пара не може да се нарече затворена система, тъй като е постоянно в контакт с вода.

Ползи за отопление
Наситените се наричат \u200b\u200bчиста пара при директен контакт с течна вода. Той има много характеристики, които го правят отличен източник на топлинна енергия, особено за високи температури (над 100 ° C). Някои от тях:

Различни видове пара
Парата е газообразната фаза на водата. Той използва топлина по време на образуването си и освобождава голямо количество топлина след това. Затова той
може да се използва като работно вещество за топлинни двигатели. Известни са следните условия: наситен наситен, сух наситен и прегрят. Наситената пара е за предпочитане пред прегрятата пара като топлоносител в топлообменниците. Когато се изпуска в атмосферата от тръби, част от нея се кондензира, се образуват облаци от бяло влажно изпарение, съдържащи малки капчици вода. Прегрятата пара няма да се кондензира, дори ако влиза в пряк контакт с атмосферата. В прегрято състояние той ще има по-голям топлопренос поради ускоряването на движението на молекулите и по-ниската плътност. Наличието на влага причинява валежи, корозия и намаляване на експлоатационния живот на котлите или друго оборудване за топлообмен. Затова сухата пара е за предпочитане, тъй като произвежда повече енергия и не предизвиква корозия.

Сух и наситен: какво е противоречието
Мнозина са объркани с термините "сухо" и "наситено". Как нещо може да бъде едновременно едновременно? Отговорът се крие в терминологията, която използваме. Терминът „сух“ се свързва с липса на влага, тоест „не е мокър“. „Наситен“ означава „напоен“, „мокър“, „наводнен“, „засмъртен“ и така нататък. Всичко това, изглежда, потвърждава противоречието. В пароенергетиката обаче терминът "наситен" има различно значение и в този контекст означава състоянието, в което се извършва кипене. По този начин температурата, при която настъпва кипене, технически е известна като температура на насищане. Сухата пара в този контекст няма влага в нея. Ако наблюдавате кипящ чайник, можете да видите бялото изпарение, излизащо от чучура на чайника. Всъщност това е смес от суха, безцветна пара и мокра пара, съдържаща капчици вода, които отразяват светлината и побеляват. Следователно терминът "суха наситена пара" означава, че парата е дехидратирана и не е прегрята. Не съдържа течни частици, това е вещество в газообразно състояние, което не следва общите газови закони.
Със сигурност мнозина трябваше да гледат снимка как отворен контейнер с вода след известно време се оказва празен. Ако го покриете с капак, тогава водата не изчезва. Всеки знае причината - водата се изпарява. Обяснението на това явление е просто: някои от водните молекули имат достатъчно висока скорост на движение, за да оставят течността. Този процес на преход на течност в газообразно състояние се нарича изпаряване.
Друг процес, а именно превръщането на парата в течност, се нарича кондензация. Тези два процеса, изпаряване и кондензация, продължават: част от водата се изпарява, част - кондензира. Ако обемът над водната повърхност е неограничен, тогава процесът на изпаряване преобладава. Изпарената вода се отстранява, както например се случва над повърхността на откритата вода, а течността постепенно преминава в газообразно състояние - пара.
Но ако количеството свободно пространство над течността е ограничено, възниква малко по-различна ситуация. Изпарената вода не може да остави този обем и над повърхността на водата се образува наситена пара. Това е името на пара в равновесие, когато количеството изпарена вода и кондензираната пара са равни. Водата не намалява и не постъпва; състояние на равновесие е между изпарението и кондензацията.
Сега знаем какво е наситена пара и нейните свойства могат да се окажат доста интересни за нас. От самото начало установихме, че количеството свободно пространство над повърхността на течността е ограничено. Над него се образува наситена пара. И ако сега да намалите този безплатен обем? Какво ще стане? В този случай се нарушава установеното равновесие между кондензацията и изпарението. Процесът на кондензация ще започне да преобладава, обемът на влагата ще се увеличи и парата ще намалее.
Налягането на парата, при което е в равновесие с течността, се нарича Ако намалим количеството свободно пространство над водата, тогава налягането на парата се увеличава. Последицата от това ще бъде преходът на пара във вода. При уголемяване заема по-малко място от наситената пара. От това следва още един извод: ако температурата е постоянна, налягането на наситените пари е същото за всеки обем.
Има и друг вариант за поведението на парата - обемът над повърхността на водата е намален, а преходът на пара в течност не се случва. Това означава, че над повърхността има ненаситени пари. Впоследствие, с намаляване на обема при постоянна температура, парата започва да се превръща във вода - което означава, че се е образувала наситена пара. Но не напразно беше условието, че всичко се случва при постоянна температура. Има определена стойност, при която парата може да се превърне в течност.
Тази стойност се нарича критична температура. Веществото остава газ при температура над критичната, ако е под критичната, тогава газът се превръща в течност. Всяко вещество има своя собствена стойност. Заслужава да се отбележат още две характеристики на парата: тя може да бъде или мокра, или суха наситена пара. Капки вода присъстват във влажността, а сухата пара не съдържа влага.
Има и така наречената прегрята пара - това е суха пара с температура над критичната. В този случай се смята, че в затворения обем вече няма течност, а присъства само пара. Прегрятата пара се използва главно в инженерството и енергетиката. прегрятата пара ви позволява да я транспортирате с парни тръбопроводи и да използвате. Поради липсата на вода в прегрятата пара, експлоатационният живот на турбината се увеличава.
Статията разглежда какво представлява наситената пара, нейните видове и свойства, както и процесът на нейното образуване и превръщане в течност.



