Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Реакции превращения аминокислот в клетке условно разделяют на три части, в зависимости от реагирующей группы:
1. по боковой цепи (радикалу):
Аминокислоты могут давать энергию
Поскольку в организме присутствует 20 протеиногенных и еще больше непротеиногенных аминокислот, которые отличаются друг от друга строением бокового радикала, то существует аналогичное количество специфических путей для их катаболизма их боковой группы. Но, тем не менее, все эти пути сливаются и сходятся к шести продуктам, которые вступают в ЦТК и здесь полностью окисляются до углекислого газа и воды с выделением энергии. Из общего количества энергии, образующейся в организме, на долю аминокислот приходится около 10%.

При определенных условиях углеродный скелет аминокислот не распадается, а участвует в синтезе углеводов (глюкогенные аминокислоты) и липидов (кетогенные аминокислоты).
К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат.
Строго кетогенными являются лизин и лейцин, при их окислении образуется исключительно ацетил-S-КоА. Он принимает участие в синтезе кетоновых тел, жирных кислот и холестерола.
Также выделяют небольшую группу смешанных аминокислот, из них образуется пируват, метаболиты ЦТК и ацетил-S-КоА (фенилаланин, тирозин, изолейцин, триптофан).
2. по карбоксильной группе:
Нейромедиаторы образуются из аминокислот
Синтез нейромедиаторов из аминокислот в первую очередь связан с вовлечением в метаболизм α-карбоксильной группы аминокислот или, проще говоря, ее удалением.
Гистамин
Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах.

Реакция синтеза гистамина
В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями – при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция.
Физиологические эффекты
расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления;
повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство (отечность), снижение артериального давления;
если предыдущие пункты имеют место в головном мозге – повышение внутричерепного давления;
увеличивает тонус гладких мышц бронхов, как следствие – спазм и удушье;
слабо повышает тонус мышц желудочно-кишечного тракта;
стимулирует секрецию слюны и желудочного сока.
Серотонин
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС.
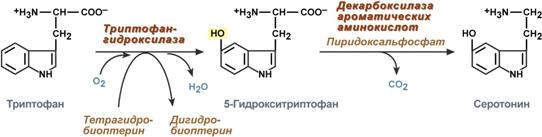
Реакции синтеза серотонина
Физиологические эффекты
стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ;
выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления;
слабо увеличивает тонус гладких мышц бронхов;
в центральной нервной системе является тормозным медиатором;
в периферических нервных окончаниях обуславливает возникновение боли и зуда (например, при укусе насекомых).
Гамма-аминомасляная кислота
Синтез γ-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе – в подкорковых образованиях головного мозга.

Реакция синтеза ГАМК
Физиологические эффекты
В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка.
Синтез дофамина происходит в основном в нейронах промежуточного и среднего мозга.

Реакции синтеза дофамина
Физиологические эффекты
Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез.
Обезвреживание биогенных аминов
Существуют два типа реакций инактивация биогенных аминов – дезаминирование и метилирование.
Дезаминирование протекает с образованием свободного аммиака и с участием ФАД. Катализирует реакцию моноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани.
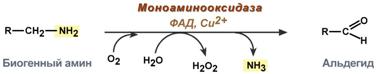
Реакция с участием моноаминоксидазы
Метилирование биогенного амина происходит при наличии у него гидроксильной группы (дофамин, серотонин). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ).
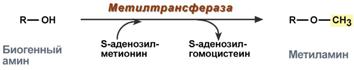
Реакция метилирования
3. с участием аминогруппы:
Существуют 4 типа дезаминирования
Превращение аминокислот с участием NH2-группы сводится к ее отщеплению от углеродного скелета – реакции дезаминирования.
Типы дезаминирования
внутримолекулярное – с образованием ненасыщенной жирной кислоты:

восстановительное – с образованием насыщенной жирной кислоты:
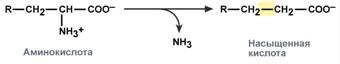
гидролитическое – с образованием карбоновой гидроксикислоты:
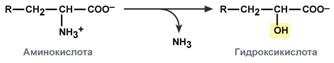
окислительное – с образованием кетокислот:

У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других типов дезаминирования, а треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида.
Аминокислоты надо переносить через мембраны
Перенос аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система.
Транспорт аминокислот через мембраны
Вторичный активный транспорт
Вторичный активный транспорт – это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны.
Вторичный активный транспорт основан на использовании низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком-переносчиком.
Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме.
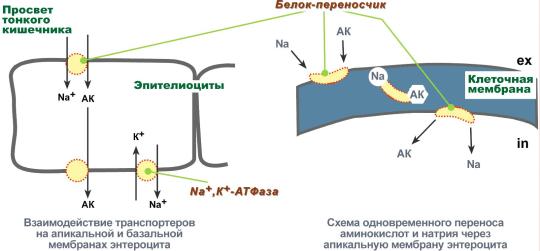
Вторичный активный транспорт аминокислот через мембраны
В настоящее время выделяют 5 транспортных систем:
для крупных нейтральных, в том числе алифатических и ароматических аминокислот,
для малых нейтральных – аланина, серина, треонина,
для основных аминокислот – аргинина и лизина,
для кислых аминокислот – аспартата и глутамата,
для малых аминокислот – глицина, пролина и оксипролина.
Глутатионовая система транспорта
Второй способ переноса аминокислот внутрь клетки происходит в комплексе с глутатионом при помощи фермента γ-глутамилтрансферазы.
Транспорт аминокислот при участии глутатиона

Переносчиком некоторых аминокислот (обычно нейтральных) по этой схеме является трипептид глутатион (γ-глутамилцистеилглицин). При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы. γ-Глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона.
В клетках постоянно образуется аммиак
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основные источники аммиака
Основными источниками аммиака являются следующие реакции:
неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
жизнедеятельность бактерий толстого кишечника,
распад пуриновых и пиримидиновых оснований – во всех тканях.
Связывание аммиака
Так как аммиак является чрезвычайно токсичным соединением, то в тканях существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата:
синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
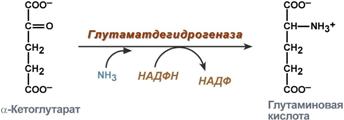
Реакция синтеза глутаминовой кислоты
синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
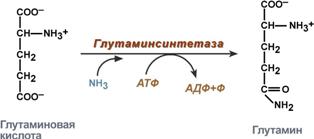
Реакция синтеза глутамина
Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового и пиримидинового колец, гуанозинмонофосфата (ГМФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
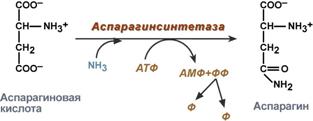
Реакция синтеза аспарагина
синтез карбамоилфосфата в митохондриях печени – реакция является первой в процессе синтеза мочевины, средства для удаления аммиака из организма.
Транспорт аммиака
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аммиак от мышц и стенки кишечника.
Глюкозо-аланиновый цикл
В мышцах основным акцептором лишнего аминного азота является пируват. При катаболизме белков в мышцах происходят реакции трансаминирования аминокислот, образуется глутамат, который далее передает аминоазот на пируват и образуется аланин. Из мышц с кровью аланин переносится в печень, где в обратной реакции передает свою аминогруппу на глутамат. Образующийся пируват используется как субстрат в реакциях синтеза глюкозы (глюконеогенез), а глутаминовая кислота дезаминируется и аммиак используется в синтезе мочевины.
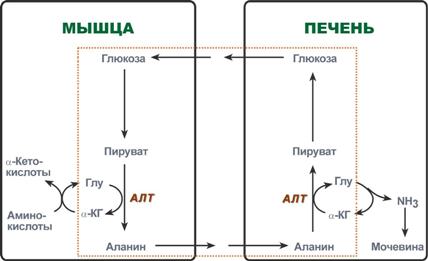
Реакции глюкозо-аланинового цикла (выделен рамкой).
Реакции, связанные с транспортными формами аммиака
Целевыми органами для транспорта аммиака являются печень, почки и кишечник.
В печени:
аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины,
аланин вступает в реакции трансаминирования с α-кетоглутаратом,
глутаминовая кислота подвергается окислительному дезаминированию.
В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень,
В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина.
Накопление аммиака представляет проблему
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость.
Гипотезы токсичности аммиака
Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий
Приобретенные формы
Приобретенная (вторичные) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений.
Наследственные формы
Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния.
Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения).
Лабораторным критерием заболевания является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче.
Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности.
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма.
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.

Креатинфосфат - срочный резерв энергии
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.

Использование креатинфосфата для ресинтеза АТФ
Особенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает ресинтез АТФ в первые секунды работы (5‑10 сек), когда ни анаэробный гликолиз, ни аэробное окисление глюкозы и жирных кислот еще не активировано, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода.
При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь - активацию фермента продуктом реакции креатином. Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается в креатинин. Количество креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы.

Образование креатинина из креатинфосфата
Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг.


Реакции синтеза креатина в почках и печени
Здесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
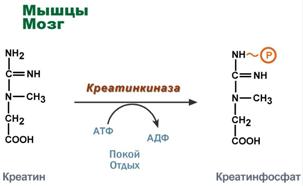
Синтез креатинфосфата
Если синтез креатина опережает возможности его фиксации в мышечной ткани, то развивается креатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина – патологическая креатинурия.
Литература
Пути биосинтеза формирующих белок аминокислот (протеиноген-ных ) довольно сложны, многоплановы (одна и та же аминокислота может синтезироваться разными способами) и могут существенно отличаться у разных организмов. Тем не менее существует довольно большое количество закономерностей в этих процессах, и для удобства все 20 протеиногенных аминокислот можно разделить на 5 биосинтетических семейств. Для принадлежащих к одному семейству аминокислот характерно наличие общих предшественников, которые образуются в ЦТК, в процессе гликолиза, в ходе пентозофосфатных путей.
Заменимые аминокислоты синтезируются с помощью довольно простых реакций, в то время как пути биосинтеза незаменимых аминокислот очень сложны. К незаменимым для белых крыс аминокислотам относятся: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, гистидин и аргинин. Восемь из десяти перечисленных аминокислот не синтезируются также организмом человека, являются ли гистидин и аргинин незаменимыми для человека, остается спорным.
Биосинтез аминокислот семейства глутамата . К этому семейству относятся: глутамат, глутамин, пролин, и аргинин. Первые две аминoкислоты образуются из a-кетоглутарата, а аминогруппы берут свое начало из молекул аммиака (рис. 16.3). Пролин синтезируется из глутамата в ходе четырех реакций: g-карбоксильная группа глутамата реагирует с АТР, образуя ацилфосфат. Последний восстанавливается с участием NADРH до альдегида, а затем в ходе самопроизвольной дегидратации преобразуется в циклическое соединение - пирролин-карбоксилат. Этот продукт восстанавливается при участии NADPH в пролин (рис. 16.4).
Синтез аргинина (рис. 16.5) также осуществляется из глутамата, который вначале ацетилируется по аминогруппе, а затем подвергается уже описанным выше реакциям фосфорилирования и формирования полуальдегида. Однако g-полуальдегид N-ацетилглутамата не циклизуется, как в пути биосинтеза пролина, а трансаминируется с участием глутамата (Glu). В результате этой реакции образуется a-кетоглутарат (КГ) и N-ацетилорнитин. Последний подвергается деацетилированию с образованием орнитина. Орнитин превращается в аргинин в ходе нескольких реакций, представленных в цикле мочевины.
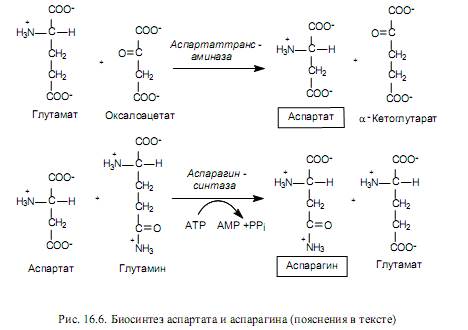
Биосинтез аминокислот семейства аспартата. К семейству аспартата относятся: аспартат, аспарагин, лизин, треонин, изолейцин и метионин. Пять последних аминокислот из этого состава синтезируются из аспартата, который, в свою очередь, образуется из оксалоацетата-промежуточного продукта ЦТК - в ходе реакции трансаминирования. Донором аминогруппы при этом выступает глутамат (рис. 16.6).
Аспартат служит предшественником для синтеза аспарагина, причем у многих бактерий может осуществляться прямое аминирование аспартата в АТР-зависимой реакции с участием аспарагинсинтетазы (16.2).
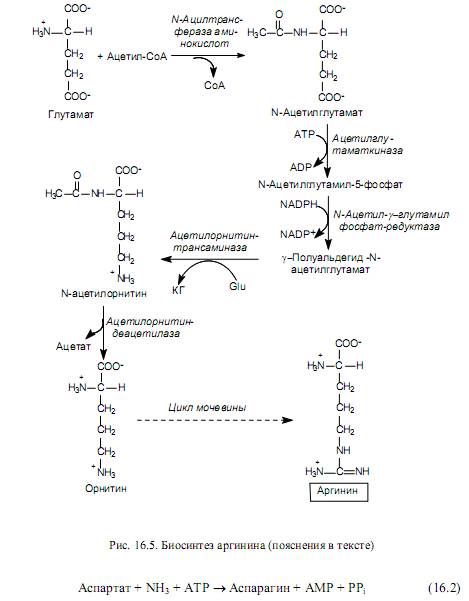
В клетках млекопитающих осуществляется другая реакция (рис. 16.6), в которой донором аминогруппы при образовании аспарагина выступает глутамин.
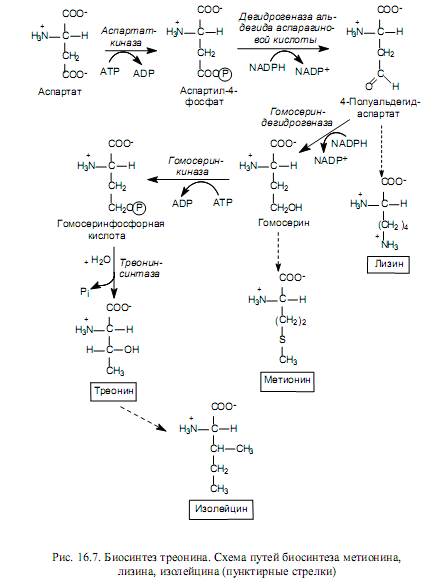
Лизин, метионин и треонин синтезируются из производных аспартата (рис. 16.7), а изолейцин - из треонина.
Лизин в клетках бактерий и растений синтезируется в ходе альдольной конденсации полуальдегида аспарагиновой кислоты и пирувата с последующим восстановлением, присоединением остатка сукцината, трансаминированием с участием глутамата, внутримолекулярной перестройкой и декарбоксилированием. В клетках грибов используется другой путь биосинтеза лизина - из a-кетоглутарата и ацетил-СоА.
Углеродный скелет метионина формируется из гомосерина, атом серы происходит от цистеина, а донором метильной группы служит N-метилтетрагидрофолиевая кислота.
Треонин служит источником четырех из шести углеродных атомов в молекуле изолейцина. На первой стадии синтеза треонин дезаминируется, превращаясь в 2-кетобутират, затем взаимодействует с пируватом, подвергается структурным перестройкам и реакции трансаминирования, в которой донором аминогруппы выступает глутамат.
Биосинтез аминокислот семейства пирувата . Из пирувата синтезируются: аланин, валин и лейцин.
Аланин образуется в реакции трансаминирования, где донором аминогруппы служит глутамат (рис. 16.8). Синтез валина и лейцина имеет несколько общих стадий и начинается с образования ацетолактата. Этот метаболит формируется из двух молекул пирувата: одна из них декарбоксилируется, и образованный активный ацетат переносится на вторую молекулу (рис. 16.8). Эту реакцию катализирует ацетолактат-синтаза при участии тиаминпирофосфата. 2-Ацетолактат восстанавливается в диоксиизовалериановую кислоту, что сопровождается миграцией метильной группы. Диоксиизовалерат дегидратируется в 2-кетоизовалерат. Этот продукт может превращаться в валин в реакции трансаминирования с участием глутамата, а также конденсироваться с ацетил-СоА и в ходе нескольких реакций (изомеризация, восстановление, декарбоксилирование, трансаминирование) преобразовываться в лейцин. Донором аминогруппы в образовании лейцина также является глутамат (рис. 16.8).
Биосинтез аминокислот семейства серина . В семейство входят серин, цистеин и глицин. Предшественником этих аминокислот является 3- фосфоглицерат - промежуточный продукт гликолиза.
3-Фосфоглицерат окисляется в 3-фосфогидроксипируват, а затем аминируется с участием глутамата в 3-фосфосерин и дефосфорилируется в серин (рис. 16.9). Существует и альтернативный путь, когда отщепление фосфатной группы происходит до реакции окисления:
3-Фосфоглицерат→Глицерат→Гидроксипируват→Серин
Серин служит субстратом для синтеза глицина и цистеина. При образовании глицина b-углеродный атом боковой цепи серина акцептируется переносчиком одноуглеродных фрагментов - кофактором тетрагидрофолиевой кислотой при участии фермента серин-гидроксиметил-трансферазы (рис. 16.9). Существует и другой путь синтеза глицина: из СО 2 , NH + 4 и метилентетрагидрофолиевой кислоты, который катализируется глицин-синтазой.

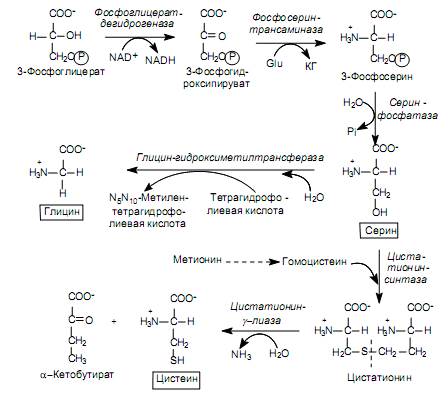
Превращение серина в цистеин связано с замещением атома кислорода боковой цепи на атом серы, донором которого является метионин. Вначале метионин в серии АТР-зависимых реакций, где образуется его активированная форма (S-аденозилметионин), теряет метильную группу при атоме серы и превращается в гомоцистеин:
Затем гомоцистеин взаимодействует с серином, образуя цистатионин, который расщепляется цистатионин-g-лиазой на цистеин и a-кетобутират (рис. 16.9).
У некоторых микроорганизмов существует альтернативный путь синтеза цистеина, где донором атома серы служит сероводород. В этом случае серин вначале ацетилируется за счет ацетил-СоА (катализирует реакцию серинтрансацетилаза), а затем ацетилсерин взаимодействует с сероводородом при участии О-ацетилсерин-сульфгидролазы:
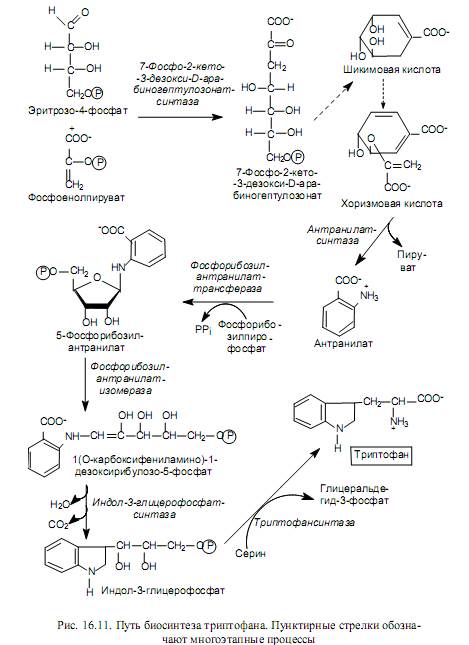
Биосинтез аминокислот семейства пентоз. Принадлежащие к этому семейству аминокислоты (гистидин, триптофан, фенилаланин и тирозин) синтезируются при участии пятиуглеродного промежуточного соединения пентозофосфатных путей - рибозо-5-фосфата, на основании чего их и объединяют в семейство пентоз. На рис. 16.10 показаны пути преобразования рибозо-5-фосфата, приводящие к формированию соединений, из которых синтезируются названные аминокислоты.
Процесс биосинтеза гистидина довольно сложен и осуществляется с участием 5-фосфорибозил-1-пирофосфата, АТР и глутамина. На рис. 16.10 в составе молекулы гистидина показано происхождение атомов углерода и азота: один атом азота имидазольного кольца происходит из амидной группы глутамина, другой атом азота и один из углеродных атомов кольца берут начало от АТР, а остальные углеродные атомы ведут происхождение от 5-фосфорибозил-1-пирофосфата.
Биосинтез ароматических аминокислот начинается со стадии конденсации эритрозо-4-фосфата с фосфоенолпируватом. Образующееся семиуглеродное соединение (7-фосфо-2-кето-3-дезокси-D-арабиногептулозо-нат) дефосфорилируется, циклизуется, дегидратируется и восстанавливается при участии NADPH в шикимовую кислоту. Шикимовая кислота претерпевает еще одну конденсацию с фосфоенолпируватом и после элиминирования остатка фосфорной кислоты превращается в хоризмовую кислоту (рис. 16.11). Хоризмат служит основным предшественником пути биосинтеза триптофана, который изображен на рис. 16.11.
Хоризмовая кислота используется также для синтеза фенилаланина, т. е. на этапе ее формирования пути биосинтеза двух незаменимых ароматических аминокислот - триптофана и фенилаланина - расходят-ся (отсюда и название хоризмата, которое происходит от греческого слова, означающего «вилка»).
Фенилаланин образуется в ходе трех последовательных реакций: изомеризации хоризмата в префенат, дегидратирования и декарбоксилирования префената в фенилпируват и трансаминирования фенилпирувата с участием глутамата.
Заменимая кислота тирозин может синтезироваться из фенилаланина путем его гидроксилирования с участием фенилаланин-4-моноокси-геназы, а также из префеновой кислоты после ее декарбоксилирования и аминирования.

Закономерности биосинтеза аминокислот . Обзор путей биосинтеза протеиногенных аминокислот позволяет выявить следующие основные закономерности этих процессов: 1) углеродные скелеты аминокислот берут свое начало от промежуточных продуктов гликолиза (3-фосфоглицерат, фосфоенолпируват, пируват), пентозофосфатных путей (рибозо-5-фосфат и эритрозо-4-фосфат), ЦТК (оксалоацетат и a-кетоглутарат); 2) донором аминогрупп для большинства протеиногенных аминокислот служит глутамат, реже-глутамин; реакции, в которых аминогруппа аминокислоты переносится на кетокислоту, называются «реакции трансаминирования»; 3) биосинтез многих аминокислот осуществляется «семействами», для которых используются общие предшественники; многие аминокислоты сами служат субстратами для синтеза других аминокислот; 4) многие стадии биосинтеза аминокислот требуют притока энергии и сопровождаются гидролизом АТР (стадии синтеза гистидина, пролина, метионина, аспарагина, глутамина, аргинина); кроме этого, используется энергия активированных молекул, участвующих в синтезе; наконец, из катаболических и амфиболических процессов изымаются промежуточные продукты, которые могли бы обеспечить клетке запасание энергии; 5) многие этапы биосинтеза аминокислот требуют участия восстановительных эквивалентов (NADH и NADPH), которые могли бы быть окислены в дыхательной цепи и обусловить энергетический выигрыш.
Таким образом, биосинтез аминокислот обходится клетке достаточно дорого. Неудивительно поэтому, что данный процесс в каждом организме (клетке) подвержен очень сложной регуляции (глава 19), которая, с одной стороны, определяется сложностью и разветвленностью самого биосинтеза протеиногенных аминокислот, а с другой стороны, должна обеспечить строгую экономию клеточных ресурсов (энергии, восстановительных эквивалентов, строительных блоков). Закономерным представляется и тот факт, что при наличии экзогенных аминокислот, клетки микроорганизмов, в частности, не осуществляют их синтез самостоятельно, а используют готовые формы.
1. Углеродный скелет восьми заменимых аминокислот (Ала, Асп, Асн, Сер, Гли, Про, Глу, Глн) и цистеина может синтезироваться из глюкозы (рис. 9.15).
α-Аминогруппа вводится в соответствующие α-кетокислоты с помощью реакции трансаминирования. Универсальным донором α-аминогруппы является глутамат.
Непосредственно путем трансаминирования метаболитов ОПК с глутаматом синтезируются:
 Рис. 9.15. Пути биосинтеза заменимых аминокислот
Рис. 9.15. Пути биосинтеза заменимых аминокислот
2. Частично заменимые аминокислоты Арг и Гис синтезируются в небольших количествах, которые не отвечают потребностям организма, что особенно ощутимо в детском возрасте. Синтез аргинина происходит в реакциях орнитинового цикла. Гистидин синтезируется из АТФ и рибозы.
Условно заменимые аминокислоты Тир и Цис образуются с использованием незаменимых аминокислот:
Фенилаланин превращается в тирозин под действием фенилаланингидроксилазы;
Для образования цистеина необходима сера, донором которой является метионин. В синтезе используются углеродный скелет и α-аминогруппа серина.
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ОБМЕНА АМИНОКИСЛОТ, ИЗУЧАЕМЫЕ В ДАННОЙ МОДУЛЬНОЙ ЕДИНИЦЕ
Концентрация аммиака в сыворотке крови: 0,04-0,07 мг/дл (25-40 мкмоль/л)
Концентрация мочевины в сыворотке крови: 15-50 мг/дл (2,5-8,4 ммоль/л)
Суточное выведение мочевины: -25 г/сут
Суточное выведение аммонийных солей: -0,5 г/сут
Модульная единица 3 ОСОБЕННОСТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ: СЕРИНА, ГЛИЦИНА, МЕТИОНИНА, ФЕНИЛАЛАНИНА, ТИРОЗИНА И ГИСТИДИНА. РОЛЬ ВИТАМИНОВ В 12 , В 6 И ФОЛИЕВОЙ КИСЛОТЫ. ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА.
СИНТЕЗ, БИОЛОГИЧЕСКАЯ РОЛЬ И ИНАКТИВАЦИЯ
БИОГЕННЫХ АМИНОВ
ТЕМА 9.9. ОБМЕН СЕРИНА И ГЛИЦИНА.
РОЛЬ ФОЛИЕВОЙ КИСЛОТЫ
Кроме путей обмена, характерных для большинства аминокислот, входящих в состав белков, почти для всех аминокислот существуют и специфические пути превращения. Рассмотрим обмен некоторых аминокислот, специфические пути превращения которых приводят к синтезу биологически важных продуктов и во многом определяют физиологическое состояние человека.
1. Серин - заменимая аминокислота, синтезируется из промежуточного
продукта гликолиза - 3-фосфоглицерата в последовательности реакций дегидрирования, трансаминирования и гидролиза под действием фосфатазы
В организме серин используется для синтеза:
Фосфолипидов (фосфатидилсерины, сфингомиелины);
Аминокислот (глицина, цистеина).
Основной путь катаболизма серина - его дезаминирование с образованием пирувата (см. тему 9.3).
2. Глицин образуется из серина под действием сериноксиметилтрансферазы. Коферментом этого фермента является тетрагидрофолиевая кислота (Н4-фолат),
которая присоединяет β-углеродный атом серина, образуя метилен - Н4-фолат
Глицин является предшественником:
Порфиринов (гема),
Пуриновых оснований,
Коферментов,
Глутатиона и др. Катаболизм глицина происходит
также с участием Н 4 -фолата, который связывает а-СН 2 -группу глицина (см. рис. 9.18).
3. Н 4 -фолат образуется в печени из фолиевой кислоты (фолата) с участием ферментов фолатредуктазы и дигидрофолатредуктазы (рис. 9.19). Коферментом этих редуктаз является NADPH.
Метиленовая группа -СН 2 - в молекуле метилен-Н 4 -фолата может превращаться в другие одноуглеродные группы:
Н 4 -фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп.
Одноуглеродные фрагменты используются для синтеза нуклеотидов и ряда соединений (см. рис. 9.18).
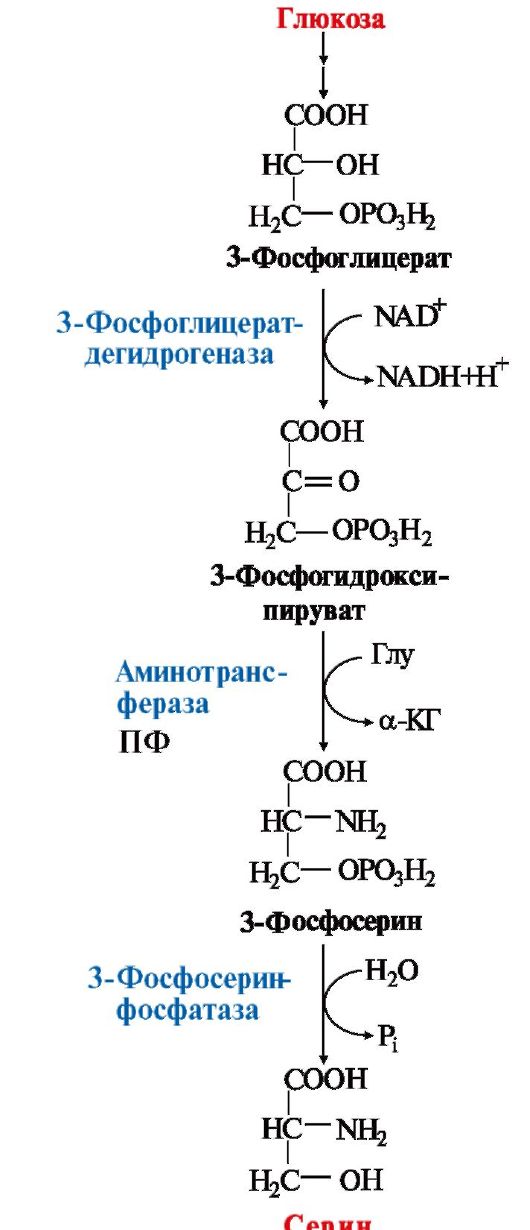 Рис. 9.17. Синтез серина из глюкозы
Рис. 9.17. Синтез серина из глюкозы
 Рис. 9.18. Биологическая роль одноуглеродных групп
Рис. 9.18. Биологическая роль одноуглеродных групп
Рис. 9.19. Схема синтеза Н 4 -фолата в печени
4. Фолиевая кислота является витамином для человека и большинства млекопитающих (витамин В С или В 9). Она широко распространена в пищевых продуктах и синтезируется бактериями кишечника. Гиповитаминоз у человека возникает достаточно редко. Причинами его могут послужить:
Неправильное питание - недостаточное потребление овощей, фруктов и мясных продуктов;
Нарушение всасывания фолиевой кислоты в кишечнике;
Гепатит, цирроз и другие поражения печени, вызывающие снижение активности фолатредуктазы.
Гиповитаминоз фолиевой кислоты приводит к нарушению синтеза нуклеиновых кислот в организме, что сказывается прежде всего на быстро делящихся клетках крови, и развитию мегалобластной анемии.
5. Многие патогенные микроорганизмы способны синтезировать фолиевую кислоту из парааминобензойной кислоты, которая является составной частью фолата. На этом основано бактериостатическое действие сульфаниламидных лекарственных препаратов, которые являются структурными аналогами n-аминобензойной кислоты:
Препараты являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у бактерий или могут использоваться как псевдосубстраты, в результате чего образуется соединение, не выполняющее функции фолиевой кислоты, Это делает невозможным деление клеток, бактерии перестают размножаться и погибают. Сульфаниламиды называют антивитаминами.
Введение
2. ПРОДУЦЕНТЫ АМИНОКИСЛОТ.
3. БИОСИНТЕЗ АМИНОКИСЛОТ.
3.1 Одноступенчатый метод получения аминокислот.
3.2 Двухступенчатый метод получения аминокислот.
3.3 Получение лизина.
3.4 Получение аминокислот с помощью иммобилизованных ферментов и клеток.
3.5 Технология получения глутамата.
4. ПРОМЫШЛЕННЫЙ СИНТЕЗ АМИНОКИСЛОТ.
4.1 Микробиологический синтез.
4.2 Химический синтез.
5. ПРИМЕНЕНИЕ АМИНОКИСЛОТ. Заключение.
Список использованных источников.
Введение
Современный уровень развития биотехнологии обусловлен общим прогрессом науки и техники, особенно - в течении последних 50 лет. Достаточно отметить лишь такие события, как установление структуры и функций нуклеиновых кислот, обнаружение ферментов рестрикции ДНК и выявление их значения в жизни клеток с последующим использованием в генно - инженерных работах, создание гибридом и получение моноклональных антител, внедрение ЭВМ и компьютерной техники в биотехнологические процессы.
Промышленный биосинтез аминокислот относится к микробиотехнологии. По сути своей микробиотехнология тождественна промышленной (технической) микробиологии. Ее объектами являются микробы - вирусы (включая вироиды и фаги), бактерии, грибы, лишайники, протозоа. В ряде случаев биообъектами являются первичные метаболиты микробного происхождения - ферменты, каталитическая активность которых лежит в основе инженерной энзимологии.
В сравнении с растительным и животным клеткам микробы размножаются, как правило, быстрее и, следовательно, у них быстрее протекают все метаболические (обменные) процессы. Относительные преимущества большинства микробов как биообъектов следующие:
1) большая « простота» организации генома,
2) достаточно легкая приспособляемость (лабильность) к среде обитания в естественных и искусственных условиях,
3) выраженные скорости протекания ферментативных реакций и нарастания клеточной массы в единицу времени.
Первое преимущество обеспечивает микробным клеткам лучшие возможности для измерения и перестроек наследственного материала, например, включение в него чужеродной генетической информации, привнесение в клетки или, напротив, элиминации из них плазмид.
Второе преимущество, связанное с лабильностью микробов, можно показать на примере бактерий и грибов. Так, применительно к температуре микробы подразделяются на психофилы у мезофиллы и термофилы.
1. ХАРАКТЕРИСТИКА АМИНОКИСЛОТ.
Аминокислоты играют большую роль в здравоохранении, животноводстве и легкой промышленности. По значению для макроорганизма аминокислоты подразделяют на заменимые и незаменимые. К незаменимым относятся те аминокислоты, которые не синтезируются в животном или человеческом организме, они должны быть привнесены с пищей или кормом для животным (табл. 1).
Таблица 1
Заменимые и незаменимые аминокислоты.
Заменимые синтезируются invivo из аммиака и различных источников углерода. Микроорганизмы сами синтезируют все необходимые им аминокислоты из аммиака и нитратов, а углеродные « скелеты » - из соответствующих интермедиаторов.
Исходя из оценки аминокислот, ученые давно стремятся использовать способности микроорганизмов продуцировать заменимые и незаменимые аминокислоты в ощутимых количествах.
Потребность людей в аминокислотах достаточно велика и этим определяется уровень их производства в мире (порядка 500 тыс. тонн в год).
Большинство микроорганизмов и зеленые растения способны синтезировать denovo все двадцать аминокислот. Углеродные скелеты аминокислот образуются из промежуточных продуктов обмена.
Исходным материалом для синтеза аминокислот служат простые промежуточные продукты катаболизма (пируват, 2 - оксиглутарат, оксалоацетат и фумарат, эригрозо - 4 - фосфат, рибозо - 5 - фосфат и АТР). При синтезе большинства аминокислот аминогруппа вводится только на последнем этапе путем трансаминирования. Некоторые аминокислоты образуются в результате ряда превращений других аминокислот, и в этих случаях трансаминирование не требуется.
Белки синтезируются на рибосомах из аминокислот по информации м - РНК, которая переписана (путем транскрипции) с генов ДНК.
2. ПРОДУЦЕНТЫ АМИНОКИСЛОТ
Специфические ферменты, регулирующие биосинтез аминокислот, широко распространены у бактерий; они с определенной глубиной изучены у Escherichiacoli. Salmonellatyphimurium, Bacillussubtilis и прочие. У грибов, на аминокислотное лимитирование, отмечается некоординированное, параллельное возрастания уровня ферментов, катализирующих реакции биосинтеза различных аминокислот. Этот « общий контроль биосинтеза аминокислот » был также назван « метаболическим интерблоком », или « перекрестнопутевой регуляцией », впервые выявленной у Neurosporacrassa в 1965 году М. Карсиотисом и сотрудниками, а позднее - у Saccharomycescerevisiae, Aspergillusnidulas и других грибов.
В гиперпродукции отдельных аминокислот культурами Escherichiacoli, Serratiamarcescens и другие важную роль играют Feedak - репрессия, например, при биосинтезе ароматических аминокислот на последних стадиях.
В любом живом организме аминокислоты расходуются прежде всего на биосинтез первичных метаолитов - ферментных и неферментных белков. Следовательно, кроме биосинтеза аминокислот denovo, возможен другой путь их получения, а именно - из гидролизатов соответствующих белков (триптофан разрушается при кислотном гидролизе), в том числе из нативной биомассы микробных клеток.
Природные аминокислоты являются, как правило, оптически активными L - и D - формами, которые трудно разделить. Вот почему микробный синтез с помощью коринебактерий и некоторых других микробов является ныне основным и экономически выгодным. Первое место здесь по праву занимает Япония, где лишь глутаминовой кислоты изготавливается свыше 100 тысяч тонн в год; большинство природных незаменимых аминокислот производит фирма «Такеда». С. Киношита, впервые в 50-е годы открывший и доказавший перспективность микробного синтеза, уже 1963 году признавал: «Мало сомнения в том, что недалеко то время, когда с помощью микроорганизмов будет возможно производить все известные аминокислоты». Это время наступило уже к 70 -м годам. Получены микробы - суперпродуценты из родов Brevibacterium, Corynebacterium, Micrococcus и другие, с помощью которых освоено крупнотоннажное производство не только глутамата, но и L - лизина, L - валина, L - гистидина и других. При суперпродукции уровень экспрессии клонированного гена выражается в синтезе специфического белка в количестве 2 % от всех растворимых белков клетки - хозяина. В настоящее время имеются продуценты, у которых количество синтезируемого специфического белка достигает 10-15% (здесь важнейшую роль играют многокопийные плазмиды, несущее встроенный гены). Генно - инженерными методами во ВНИИ генетики и селекции промышленных микроорганизмов (Москва) был получен штамм Escherichiacoli, обладающий сверхпродукцией L - треонина (30 г / л за 40 часов ферментации).
С любым штаммом - продуцентом какой - либо аминокислоты необходимо внимательное и бережное обращение в целях поддерживания ее в активном состоянии в течении длительного времени.
Получен штамм Escherichiacoli, продуцирующий за 48 часов 27 г / л L - пролина, и штамм, продуцирующий до 22,4 г / л L - фениланина.
С помощью Corynebacteriumsp. можно получигь алкапосодержащих средах L - тирозин (до 19 г/л); с помощью Corynebacteriumglutamicum на глюкозной среде - L - валин (до 11 г / л; L - аргинин, L - гистидин, L - изолейцин - 15 - 20,8 г / л.
3. БИОСИНТЕЗ АМИНОКИСЛОТ
Технология получения аминокислот базируется на принципах ферментации продуцентов и выделении вторичных метаболитов, то есть размножают маточную культуру вначале на агаризованной среде в пробирках, затем - на жидкой среде в колбах, инокуляторах и посевных аппаратах, а затем в головных (основных) ферментаторах. Обработку культуральных жидкостей и выделение аминокислот проводят по схеме, аналогичной схеме получения антибиотиков. Изолированные чистые кристаллы целевого продукта обычно высушивают под вакуумом и упаковывают.
3.1 Одноступенчатый метод получения аминокислот
Известны два способа получения аминокислот: одноступенчатый и двухступенчатый. Согласно первому способу, например, мутантный полиауксотрофный штамм - продуцент аминокислоты культивируют на оптимальной для биосинтеза среде. Целевой продукт накапливается в культуральной жидкости, из которой его выделяют согласно схеме на рисунке d
1 - ферментатор,
2 - охладитель, 3,9 - рефрижераторы,
4 - емкость для предварительной обработки,
5 - центрифуга,
6 - вакуум - упариватель,
7 - аппарат прямой
8 - барабанный фильтр, А,Б - пути (при необходимости смыкающиеся),
10 - аппарат для ультрофилырации,
11 - емкость для консервации раствора фермента,
12 - мембранный фильтр,
13 - накопитель жидкого консерванта, 14-емкость для осаждения фермента,
15 - фильтр - пресс,
16 - распылительная сушилка,
17 - накопитель сухого концентрата.
Рисунок №1 Примерная технологическая схема получения аминокислот.
3.2 Двухступенчатый метод получения аминокислот
В двухступенчатом способе микроб - продуцент культивируют в среде, где он получается и синтезирует все необходимые ингредиенты для последующего синтеза (в идиофазу) целевого продукта.
Если ферменты биосинтеза аминокислоты накапливаются внутриклеточно, но после 1 - ой ступени клетки сепарируют, дезинтегрируют и применяют клеточный сок. В других случаях для целей биосинтеза целевых продуктов применяют непосредственно клетки.
3.3 Получение лизина
Если аминокислота предусмотрена в качестве добавки к кормам, то биотехнологический процесс кормового продукта включает следующие стадии: ферментацию, стабилизацию аминокислоты в культуральной жидкости перед упариванием, вакуум - упаривание, стандартизацию упаренного раствора при добавлении наполнителя, высушивание и упаковку готового продукта, в котором должно содержатся не более 10 % основного вещества. Например, в промышленности изготавливают сухой кормовой и жидкий кормовой концентраты лизина наряду с кристаллическим лизином.(рис. 2)
Рисунок №2
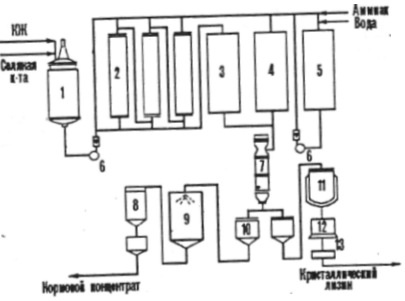
1 - емкость для культуральной жидкости (КЖ),
2 - ионообменные колонны,
3 - сборник злюата,
4 - сборник фильтрата,
5 - емкость для элюата,
7 - вакуум - выпарной аппарат,
8 - циклон,
9 - сушилка кормового концентрата,
10 - сборник,
11 - реактор - кристаллизатор,
12 - центрифуга,
13 - сушилка.
Если концентрат содержит 70 - 80 % сухих веществ, то достаточно устойчив против микробной порчи за счет повышенной осмотической концентрации ингредиентов.
3.4 Получение аминокислот с помощью иммобилизованных ферментов и клеток
Экономически целесообразным являются способы получения аминокислот с помощью иммобилизованных ферментов и клеток. Сравнительно давно реализован процесс получения L - аспаргиновой кислоты из фумаровой и аммиака в одну стадию с помощью иммобилизованных клеток Е. coli или Pseudomonasaeruginosa, обладающая аспартазной активностью (см схему)
Аспартаза катализирует реакцию присоединения аммиака к фумаровой кислоте. Фермент в иммобилизованном состоянии сохраняет активность на исходном уровне 2 -2,5 недель и более.
L - Аспаргиновую кислоту можно получить и с помощью иммобилизованных клеток, что существенно повышает длительность функционирования системы, производительность которой по целевому продукту составляет около 2000 кг с 1м реактора. Периодические ферментации используют при получений других L - аминокислот (глутаминовой, фенилаланина, лизина, триптофана и др.). При этом культивируют обычно специальные мутантные штаммы, метаболизм которых по целевому продукту изучен достаточно полно. Так, например, установлено, что лимитирующем агентом коринебак герий, образующих глутаминовую кислоту, является биотип в дозе 1 - 5 мкг/ л. Биотин индуцирует структурно - функциональные изменения в клеточной мембране, благодаря чему увеличивается ее проницаемость для глутаминовой кислоты, выходящей из клетки в культуральную жидкость. Отдельные штаммы продуцентов способны накапливать ее более 50 г/л на мелассных средах.
Роль биотина аналогична в случае получения пролина, являющимся производным глутаминовой кислоты.
Несложность этой технологии и ее преимущества по сравнению с глубинной ферментацией наглядно иллюстрируют опыт японской фирмы «Танабе Сейяку ». В 1973 году эта фирма разработала способ получения аспарагиновой кислоты при помощи иммобилизованных бактериальных клеток, обладающих аспартазной активностью. Аспартаза катализирует присоединение аммиака по двойной связи фумаровой кислоты, т.е. аспарагиновая кислота образуется в одной стадии и данный биотехнологический процесс можно отнести к категории биотрансформации органических соединений. Иммобилизованный в геле фермент функционировал хорошо, длительность его полуинактивации составила 1 месяц. Затем в геле иммобилизовали клетки продуцента, дополнительно стабилизируя их путем химического связывания между собой и с гелем. Длительность полуинактивации клеток в этом случае увеличивалась до 4 месяцев. Технологию биотрансформации фумаровой кислоты, таким образом, можно представить в такой последовательности:
выращивание клеток методом глубинной ферментации и их выделение центрифугированием;
иммобилизация клеток биокатализатора в геле в виде гранул размером 2 -3 мм;
биотрансформация фумарата аммония в колонке с катализатором в проточном режиме и получение раствора аспарагиновой кислоты;
кристаллизация, центрифугирование и промывка кристаллов.
Производительность системы биотранеформации аспарагиновой кислоты 1 м биореактора 1700 кг.
3.5. Технология получения глутамата.
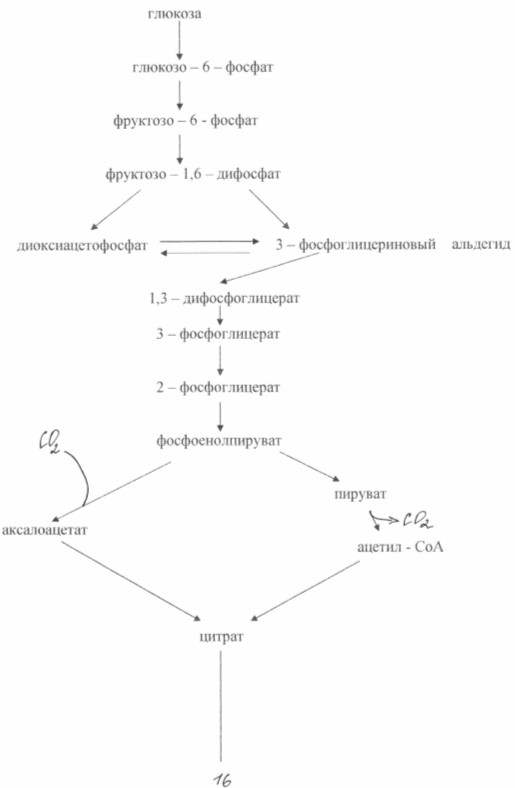
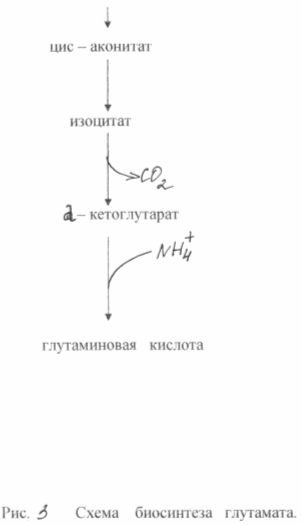
В основе сверхсинтеза глутаминовой кислоты из глюкозы у этих бактерий лежат два биохимических принципа: недостаток фермента а - кетоглутаратдегидрогеназы и блокировка биосинтеза биотина. Неспособность клеток синтезировать биотин приводит к увеличению проницаемости цитоплазмотической мембраны, что повышает экскрецию глутамата. Он образуется в результате аминирования а - кетоглутарата, неспособного к дальнейшим превращениям в цикле трикарбоновых кислот. Схема биосинтеза глутамата из глюкозы у данного типа мутантов показана на рис. 3
При биосинтезе глутаминовой кислоты очень большое значение имеет концентрация биотина в среде. Необходимо обеспечить его концентрацию 1 - 5 мкг /л. В этом случае нарушается нормальный синтез фосфолипидов мембраны и последняя становится проницаемой для глутамата. При концентрации биотина 15 мкг/л наблюдается интенсивный рост биомассы. Проницаемость цитоплазмотической мембраны для глутамата можно снизить также при помощи пенициллина, добавляя его к среде во время логарифмической фазы роста. В этом случае фосфолипиды экстрагируются из мембраны и транспорт глутамата может осуществляться в течение 40 - 50 часов. Бактериальный синтез глутамата позволяет получать примерно 50 % - ный выход продукта из сахара и накапливать в среде ферментации до 200 г/л глутамата. Известны методы получения глутамата на этанольных средах (до 60 г/л) или на ацетате (до 98 г/ л).
4. ПРОМЫШЛЕННЫЙ СИНТЕЗ АМИНОКИСЛОТ
Промышленное производство аминокислот осуществляется двумя способами: микробиологическим и химическим.
4.1 Микробиологический синтез
Микробиологический синтез основан на выращивании определенных видов микроорганизмов на питательных средах, имеющих подходящий источник углерода. Чаще всего это сахара, содержащиеся, например, в патоке. Мутированные микроорганизмы с нарушенным азотным обменом выделяют в раствор большое количество какой-либо одной аминокислоты. После окончания процесса ферментации аминокислоту выделяют из раствора химическими методами
Путем микробиологической ферментации получают основное количество глутаминовой кислоты и весь лизин. У этого процесса свои преимущества и свои недостатки. С одной стороны, в нем мало стадий и требуется относительно простая и универсальная аппаратура. С другой стороны, живые микроорганизмы, с которыми приходится работать, очень чувствительны к малейшему изменению условий, а концентрация целевого продукта получается низкой, что ведет к увеличению размеров аппаратуры.
Существует способ микробиологического получения фенилаланина при помощи тирозин - и метиониндефицитного мутанта Brevibacteriumlactofermentum. В периодическом процессе ферментации достигнута концентрация продукта 24,8 г/л. Однако для данного процесса требуются сложные и дорогие среды. Определенный интерес представляют биосинтез фенилаланина ауксотрофным мутантом Е. coli, который можно культивировать в глюкозной среде с фосфатами. Процесс ферментации осуществляют доливным методом с рециркуляцией биомассы. Биомасса в реакторе 60 - му часу достигает 45 - 50 г/л, а концентрация фенилаланина - 22,4 - 22,8 г/л. Продуктивность системы 0,72-0,86 г/(лч); выход продукта 0,11г.
4.2 Химический синтез
Химический синтез более универсален, чем микробиологический, и позволяет получать соединения любой возможной структуры. Здесь используется непищевое минеральное сырье, достигается любая концентрация продукта, однако, как правило, процесс многостадиен и требует более сложной аппаратуры.
Оба способа обеспечивают получение природных аминокислот необходимой степени химической и оптической чистоты. Так что в конечном счете, когда речь идет о промышленном производстве, последнее слово остается за экономикой: по данным зарубежных специалистов, при больших масштабах химические методы становятся более рентабельными.
Наиболее широко разработан промышленный синтез метионина- аминокислоты, главным потребителем которой является птицеводство. Исходным веществом служит пропилен - продукт крекинга нефти. Пропилен окисляется до акролеина, который в результате серии реакций, превращается в рацемический метионин.

В результате химического синтеза обычно получается смесь равных количеств L и D - изомеров аминокислот, в то время как в состав белков входят исключительно L-изомеры. Эти же изомеры питательны. D-изомеры организмом, как правило, не усваиваются и являются балластом. Следовательно, необходимо разделение, что неминуемо отрицательно сказывается на экономике. В последнее время в области расщепления рацемических смесей аминокислот достигнуты серьезные успехи. В работах СВ. Рогожина и В.А. Даванкова показано, что оптически неактивные аминокислоты, будучи ковалентно присоединены к нерастворимому полимерному носителю, легко образуют комплексы с медью, никелем и т.п. другая рацемическая аминокислота, находящаяся в растворе, занимает два вакантных координационных места у атома металла, причем прочность комплексов L - и D - изомеров различна. Сколь ни мало это различие, будучи повторенным многократно в процессе хромотографии, оно обеспечивает полное или частичное разделение оптических антиподов. Наилучшие результаты получены с DL - пролином, который может быть препаративно разделен на оптические изомеры.
Усилие многих исследователей направлены также на разработку такого химического синтеза, который давал бы только один желаемый природный оптически активный изомер - изомер, синтезируемый живой природой, - ассиметрического синтеза. В этом направлении за последние годы достигнуты серьезные успехи. В работах А. Кагана (Франция) и Е, Корна (США) достигнуты практически количественные оптические выходы. Чрезвычайно заманчивым представляется воспроизведение путей синтеза аминокислот природными ферментными системами. Большое количество таких синтезов осуществляется пироксальзависимыми ферментами, причем сразу получается нужный оптический изомер аминокислоты. Большой вклад в изучение этих процессов сделан академиком А.Е. Браунштейном (Россия) и профессором Ю. Снеллом (США).
Российские ученые поставили своей целью найти химические системы, которые могли бы не только моделировать биохимические реакции, но и осуществлять процессы, не проходящие в живом организме. В качестве такой системы были выбраны комплексы шиффовых оснований аминокислот с ионами переходных металлов. Предпологалось, что салициловый альдегид в этих комплексах будет играть роль лиридоксаля, увеличивая реакционную способность С - Н - связи аминокислоты, ион металла будет делать тоже самое, но еще удерживать систему в жестком плоском состоянии, что в природе обеспечивает белок фермента. Общая диссимметрия комплекса позволяла надеяться, что в природе обеспечивает белок фермента. Общая диссиметрия комплекса позволяла надеяться, что реакция может быть проведена стереоспепифически, т.е. в результате дать оптически активную кислоту.
Такие реакции в природе не идут, а практическая ценность их заключается в том, что при этом сразу получается глутаминовая кислота. Таким образом, открывается путь нового общего синтеза аминокислот, проходящего в чрезвычайных условиях.
Несравненно сложнее оказатось воспроизвести другую сторону действия природных ферментов - ассиметричеекий синтез. Для этого комплексы были разделены на оптически активные антиподы.
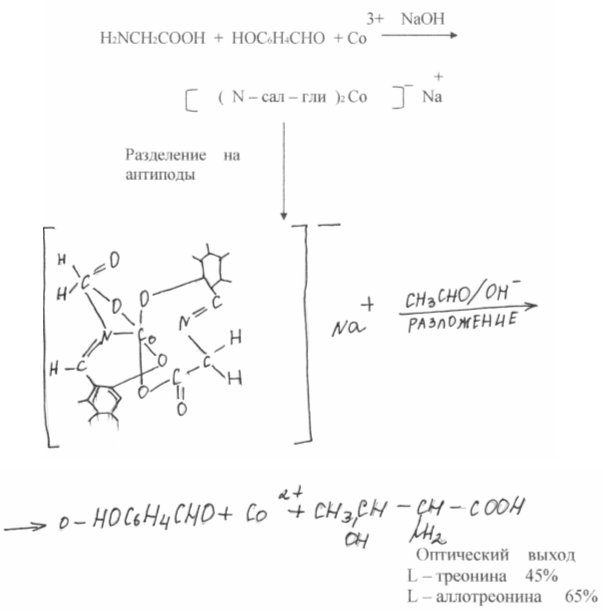

5. ПРИМЕНЕНИЕ АМИНОКИСЛОТ
Белки всех организмов от вируса до человека состоят из 21 аминокислоты, которые по своей биологической ценности делятся на заменимые (их для построения белков организм может синтезировать сам с достаточной скоростью) и незаменимые (их он синтезировать не может и должен получать из вне из пищи). Каждый белок содержит определенное количество каждой аминокислоты. Если в потребляемом белке какой - либо незаменимой аминокислоты нет или мало, белок организма не будет построен. Отсюда необходимость балансирования рациона, что приводит к увеличению их питательной ценности.
На рисунке (4) в качестве этанола взят казеин- питательный животный белок. Заштрихованная в линейку часть каждой колонки соответствует питательной ценности природного белка в единицах КЭБ (коэффициент эффективности белка). Добавление в продукт некоторого количества лизина, первой лимитирующей аминокислоты, приводит к резкому увеличению питательности, добавление второй лимитирующей аминокислоты повышает питательность до уровня животных белков.
Рис. 4 Увеличение питательной ценности белка добавлением лимитирующих аминокислот в единицах КЭБ
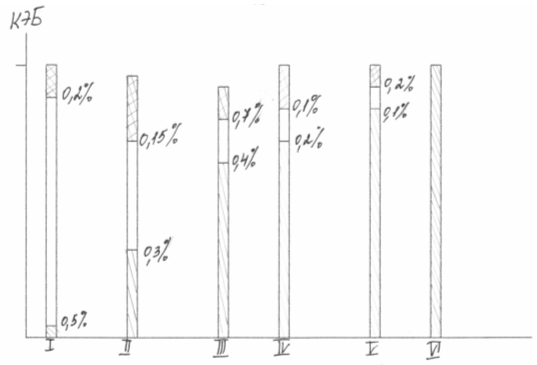
Балансирование рациона широко используется в сельском хозяйстве. По данным М.Ф. Томмэ, И.Ф. Ткачева, включение 0,2 - 0,5 % лизина в рацион поросят и цыплят позволяет снизить расход кормового белка на 25 % и повысить продуктивность животных на 10-13 %. Обобщая результаты исследований, как российских, так и зарубежных авторов получаем, что при организации производства 20 тысяч тонн лизина в год можно получить дополнительно 1,2 миллиона тонн мяса и сэкономить 3,6 миллионов тонн белкового корма. По мнению голландского экономиста Н. Маргудера, 0,125% лизина в корме свиней, состоящем из кукурузной муки и земляного ореха, дают чистую прибыль 100%.
Балансирование зерновых продуктов чистыми аминокислотами пока не нашло себе широкого применения в пищевой промышленности, хотя оно улучшает питательные свойства растительного белка, и, следовательно, увеличивает количество белка, пригодного для использования в пищу. Последнее особенно важно, так как появляется реальная возможность обеспечить быстро растущие потребности в пищевом белке без одновременных изменений характера рационов и органолептических свойств продуктов Не менее успешно применяются аминокислоты в медицине. После тяжелых операции, ожогов и т.п. организм человека очень часто не может усваивать белок в количестве, необходимый для процессов регенерации, и это приводит к ухудшению состояния больного. Тогда прибегают к аминокислотному питанию. Прекрасный терапевтический эффект, достигаемый в этих случаях, вызывает большую потребность в смесях аминокислот. Смесью, не содержащей фенилаланина, кормят детей, страдающих фенилпировиноградной олигофренией.
Аминокислоты служат исходными веществами для синтеза полипептидов, многие из которых являются сильнейшими физиологически активными соединениями, а также для создания других лекарственных препаратов.
Наконец, в процессе поликонденсации аминокислоты образуют полимеры, которые, не обладая биологической активностью белков, похожи на них своим строением и лимитируют некоторые их важные физические свойства. Искусственные шерсть, шелк и кожа, полученные с участием аминокислот по эксплуатационным показателям не уступают естественным материалам.
Несмотря на широкое использование аминокислот в медицине, промышленности и сельском хозяйстве, главным их потребителем остается пищевая промышленность. Так, глутамат натрия (натриевая соль глутаминовой кислоты) - мощный усилитель вкуса. Во многих странах его добавляют во все продукты при консервировании, замораживании, при длительном хранении; он находит применение и в общественном питании и в домашнем хозяйстве в виде смеси со столовой поваренной солью. Из смеси из аминокислот составляют также композиции, имитирующие вкус и запах пищевых продуктов.
Потребление аминокислот в мире возрастает ежегодно на 10 %. Их производство характеризуется следующими цифрами
Заключение
Данная курсовая работа посвящена промышленному биосинтезу аминокислот. Благодаря этой работе я выяснила, что существуют следующие способы получения аминокислот:
1. Биосинтез аминокислот, который включает в себя одноступенчатый и двухступенчатый методы;
2. Промышленный синтез аминокислот - микробиологический и химический синтез.
Рассмотрели получение аминокислот с помощью иммобилизованных ферментов и клеток, а также технологию получения лизина и глутамата.
Установила применение аминокислот не только в медицине, но и в сельском хозяйстве для того чтобы снизить расход кормового белка; и в пищевой промышленности в качестве консервантов и усилителей вкуса
Список использованных источников
1. Е.А. Строев. Биологическая химия. М., Высшая школа, 1986.
2. М.Е. Беккер, Г.К. Лиепинын, Е.П. Райпулис. Биотехнология. М., ВО Агропромиздат, 1990.
3. У.Э. Виестур, И.А. Шмите, А.В. Жилевич. Биотехнология. Био технологические агенты, технология, аппаратура. Рига, Зинатне, 1987.
4. Г.К. Лиепинын, М.Э. Дунцэ. Сырье и питательные субстраты для промышленной биотехнологии. Рига, Зинатне, 1986.
5. Н.П. Блинов. Основы биотехнологии. СПБ., Наука, 1995.
6. Л.И. Воробьев. Промышленная микробиология. М., МГУ, 1989.
7. С.Д. Варфоломеев, С.В. Калюжный. Биотехнология. Кинетические основы микробиологических процессов. М., Высшая школа, 1990.
8. В.М. Беликов. Аминокислоты, их химический синтез и применение. Вестн. АН СССР, 1973.
9. Дж. Бейли, Д. Оллис. Основы биохимической инженерии, т. 1. М„ Мир, 1989.
10. Г.С. Муровцев, Р.Г. Бутенко, Т.Н. Тихоненко, М.И. Прокофьев. Основы сельскохозяйственной биотехнологии. М., ВО Агропромиздат, 1990.
11. Биотехнология: принципы и применение. Под ред. И. Хиггинса, Д.Беста, Дж. Джонса. М., Мир, 1988.
Практическая значимость темы. Аминокислоты, поступающие в организм с пищей, могут быть источниками атомов углерода и азота для различных небелковых соединений. В частности, аминокислоты могут вступать в реакции взаимопревращения, что обеспечивает потребности организма в заменимых аминокислотах независимо от их поступления извне. К числу физиологически важных продуктов, образующихся из аминокислот, относятся гем, креатин, холин, пуриновые и пиримидиновые нуклеотиды, некоторые гормоны, нейромедиаторы. Знание этих метаболических путей важно для понимания патогенеза некоторых гиповитаминозов и врождённых ферментопатий, разработки методов их биохимической диагностики и коррекции.
Цель занятия. После изучения данной темы студент должен знать основные реакции синтеза заменимых аминокислот в организме человека, пути использования аминокислот для синтеза небелковых азотистых соединений и возможные нарушения этих процессов, уметь применять полученные знания для решения теоретических и практических задач.
Исходный уровень знаний.
Строение аминокислот (глицин, серин, метионин, цистеин, фенилаланин, тирозин).
Реакции переноса функциональных групп в биологических системах.
Восстановительное аминирование α-кетокислот: ферменты, роль в организме.
Трансаминирование аминокислот: реакции, роль в организме.
Коферментные функции витаминов (фолиевой кислоты, цианкобаламина).
Принципы диагностики врождённых дефектов ферментов.
3.1. Биосинтез аминокислот в тканях.
3.1.1. В организме человека возможен синтез заменимых аминокислот, к которым относятся: аланин, аргинин, аспартат, гистидин, глицин, глутамат, глутамин, пролин, серин, тирозин, цистеин. Недостаток в пище любой из этих аминокислот не будет сопровождаться её дефицитом в организме. Основными путями образования заменимых аминокислот являются: 1) трансаминирование α-кетокислот , 2) восстановительное аминирование α-кетокислот , 3) синтез с участием незаменимых аминокислот .
3.1.2. Трансаминирование (см. тему 2). Источниками атомов углерода в этих реакциях служат метаболиты гликолиза и цикла Кребса, источниками атомов азота – другие аминокислоты, чаще всего – глутамат (см. рисунок 7).
3.1.3. Восстановительное аминирование (см. тему 2). Источником атома азота аминогруппы является молекула аммиака, источником углерода - α-кетокислоты, чаще всего - α-кетоглутарат (см. рисунок 3.1).
Рисунок 3.1. Биосинтез заменимых аминокислот в тканях с использованием углеродного скелета глюкозы (одной звёздочкой показаны реакции трансаминирования, двумя – восстановительного аминирования).
3.1.4. Синтез с участием незаменимых аминокислот. Заменимая аминокислота тирозин может образоваться из незаменимой аминокислоты фенилаланина:
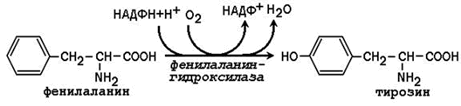
Фенилаланингидроксилаза - типичная цитохром P 450 -зависимая гидроксилаза со смешанной функцией: один атом кислорода включается в воду и другой в гидроксильную группу тирозина. Восстановителем служит кофактор тетрагидробиоптерин , который поддерживается в восстановленном состоянии НАДФН-зависимым ферментом дигидробиоптерин-редуктазой.
Заменимая аминокислота цистеин синтезируется при участии незаменимой аминокислоты метионина, которая используется как источник атома серы. После отдачи метильной группы в реакциях трансметилирования метионин превращается в гомоцистеин. При его взаимодействии с заменимой аминокислотой серин образуется цистатионин:
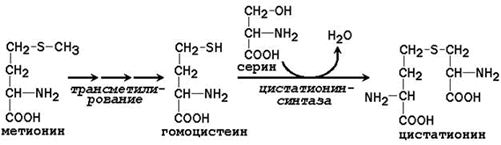
Цистатионин подвергается расщеплению с образованием цистеина и гомосерина, который подвергается дезаминированию в α-кетобутират:
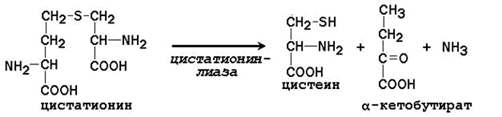
Таким образом, фенилаланин и метионин, поступающие с пищей, частично используются для синтеза заменимых аминокислот. Поэтому суточная потребность в фенилаланине и метионине может быть существенно снижена при поступлении в организм дополнительных количеств тирозина и цистеина соответственно.
