8.doc
87Stati aggregati della materia e transizioni tra di essi. Proprietà di gas, liquidi e solidi.
8.1. Stati aggregati della materia e transizioni tra di loro a seconda
temperatura e pressione
Una sostanza è l'aggregato di un gran numero di particelle (atomi, molecole, ioni). Una sostanza può esistere e avere una certa struttura solo a causa di determinate interazioni tra le sue particelle costituenti. Inoltre, la struttura di una sostanza, le sue proprietà fisiche dipendono molto dall'energia di queste interazioni e dalla sua relazione con l'energia termica del movimento delle particelle.
Per la maggior parte delle sostanze, ci sono quattro stati chiaramente distinti, la transizione tra i quali si verifica quando la temperatura cambia. Questi stati sono chiamati aggregati: solido, liquido, gassoso, plasma.
Per ogni sostanza esiste una temperatura alla quale l'energia di legame tra le sue particelle supera l'energia delle loro vibrazioni termiche. In questo caso, il movimento oscillatorio, ovviamente, non si ferma, ma non è sufficiente a rompere i legami tra le particelle. In questo caso, le particelle di solito formano la struttura geometrica corretta. Questo stato della materia è chiamato solida.
Con l'aumentare della temperatura, arriva un momento in cui l'energia delle vibrazioni termiche supera l'energia dei legami tra le particelle e iniziano a tradursi. La struttura geometrica sta crollando. Tuttavia, mentre l'energia del movimento traslazionale non è così grande che le particelle possono finalmente staccarsi l'una dall'altra: si muovono, mantenendo una distanza costante tra loro. Questo stato della materia è chiamato liquido.
Con un ulteriore aumento della temperatura, l'energia del movimento termico traslazionale supera l'energia delle interazioni tra le particelle e possono staccarsi l'una dall'altra.
Poiché la forza di interazione diminuisce con l'aumentare della distanza, le particelle si trovano a tale distanza l'una dall'altra il più possibile con la loro concentrazione. Questa condizione è chiamata gas.
A temperature altissime o in un campo elettrico di altissima tensione, sorge un quarto stato: plasma.A rigor di termini, questa è un'altra sostanza, perché è caratterizzata dalla presenza di un gran numero di molecole ionizzate ed elettroni liberi.
Diagrammi di stato
La transizione di una sostanza da uno stato di aggregazione a un altro è determinata non solo dalla temperatura, ma anche dalla pressione. L'ultima dipendenza per la transizione liquido-gas è particolarmente forte. A basse temperature e alte pressioni, la sostanza è allo stato solido, con una diminuzione della temperatura e della pressione diventa liquida e gassosa. Inoltre, per ogni singola sostanza, queste transizioni hanno caratteristiche quantitative rigorose, che sono visualizzate visivamente dal cosiddetto diagramma di fase dello stato. Questo è un diagramma bidimensionale, sugli assi di cui sono tracciati i valori di temperatura e pressione, e il diagramma stesso nel caso più semplice è costituito da tre linee che convergono in un punto. Queste linee separano quelle regioni di temperatura e pressione che corrispondono agli stati liquido, solido e gassoso (Fig. 16).
Il diagramma di stato e le sue proprietà sono descritte in dettaglio nel corso di fisica.
^ 8.2. Proprietà caratteristiche di gas, liquidi e solidi.
1. Gas. Allo stato gassoso si trovano di solito sostanze covalenti a basso peso molecolare e gas nobili. La distanza tra le particelle di materia nei gas è molto più grande della dimensione delle particelle stesse e l'interazione tra loro è trascurabile
Poco rispetto all'energia termica. Di conseguenza, i gas si espandono e si contraggono facilmente. I gas non hanno la loro forma e volume e prendono la forma e il volume della nave che li contiene, esercitando la stessa pressione sulle pareti della nave in tutte le direzioni. Tutti i gas si mescolano tra loro in qualsiasi rapporto.
2. Liquidi. Allo stato liquido in condizioni normali, di solito ci sono sostanze covalenti (che non hanno un reticolo cristallino atomico) e alcuni metalli (mercurio). La distanza tra le particelle nel liquido non è molto diversa da quella allo stato solido, ma le particelle sono mobili l'una rispetto all'altra. Di conseguenza, i liquidi non hanno la loro forma e assumono la forma di una nave, tuttavia hanno il loro volume e, di norma, sono praticamente incomprimibili.
3. Solidi. Lo stato solido è caratteristico di sostanze con tutti i tipi di legami (metallo, ionico, covalente). In questo caso, le sostanze con tipi ionici e atomici di legami in condizioni normali sono sempre solide. La distanza tra le particelle è piccola, le interazioni sono forti, le particelle sono immobili l'una rispetto all'altra (se non vengono presi in considerazione piccoli movimenti vibratori). Inoltre, formano una struttura permanente. Pertanto, i solidi hanno la loro forma e volume, che sono praticamente indipendenti dalla pressione e dalla temperatura (ovviamente, nella regione del diagramma di fase corrispondente allo stato solido).
Quindi, la quantità di sostanza solida o liquida in un dato volume è praticamente indipendente dalla temperatura e dalla pressione ed è determinata dalla densità, che è individuale per ciascuna sostanza e praticamente non può essere calcolata senza una conoscenza accurata della struttura. Tuttavia, non è così per i gas in cui queste dipendenze obbediscono alle leggi generali. La conoscenza di queste leggi è necessaria per risolvere molti problemi chimici e ora li considereremo.
^ 8.3. Gaza. Leggi del gas.
Lo stato della sostanza gassosa è completamente caratterizzato dai seguenti parametri:
M- peso molecolare della sostanza m - massa di gas P - la pressione
V- volume fornito al gas
T- temperatura del gas (nelle leggi del gas viene utilizzata la temperatura nella scala Kelvin)
Le leggi che collegano questi parametri e che considereremo ora sono molto vicine per tutti i gas e possono essere considerate uguali. A rigor di termini, sono assolutamente precisi per gas perfettoin cui non vi è alcuna interazione tra le particelle e le cui particelle sono punti materiali. Di conseguenza, l'applicazione di queste leggi ai gas reali è chiamata approssimazione del gas ideale. Quali sono queste leggi?
1. La legge di Avogadro. Lo stesso volume di qualsiasi gas alla stessa temperatura e pressione contiene lo stesso numero di molecole, ad es.
m / m= const a P, V, T \u003dconst per qualsiasi gas.
2. La legge Boyle-Marriott. Con una massa costante di gas e una temperatura costante, la pressione del gas è inversamente proporzionale al volume da esso occupato, ad es.
PV \u003d const a Tm= const
3. La legge Gay-Lussac. Con massa e pressione del gas costanti, il volume occupato dal gas è direttamente proporzionale alla sua temperatura, ovvero
Cost P, m= const
4. La legge di Carlo. Con massa e volume del gas costanti, la pressione del gas è direttamente proporzionale alla temperatura, ad es.
P / T= const a V, m \u003d const
^ 8.4. Equazione di Mendeleev-Clapeyron
Combinare le ultime tre leggi rende facile ottenere la legge combinata del gas:
P 1 V 1 / T1 \u003d P 2 V 2 / T 2 o PV / T \u003d const at m \u003d const Questa legge non è ancora generale - la costante sarà diversa per le stesse masse di gas diversi. Tuttavia, se prendiamo in considerazione la legge di Avogadro, che collega tutti i gas con una proprietà comune, la otteniamo per qualsiasi gas
PV / T \u003d (m / M) const,
E ora la costante è comune a tutti i gas. A cosa equivale? Fu sperimentalmente stabilito che a condizioni normali (P= ioatm \u003d 1.013 10 5 Pa, T \u003d273 K) una mole di qualsiasi gas occupa lo stesso volume, ovvero 22,4 litri. Sostituendo questi valori nell'equazione che abbiamo ottenuto e considerato
M che - è il numero di moli, otteniamo che il valore della costante
8.3144 J / (mol K). Si chiama costante di gas universale ed è indicata dal simbolo R.
Pertanto, abbiamo ottenuto un'equazione universale relativa a tutti i parametri che caratterizzano lo stato di una sostanza gassosa. Si chiama equazione di Mendeleev-Clapeyron.
PV=(m / M) RTUsando questa equazione, è possibile trovare qualsiasi parametro sconosciuto per qualsiasi gas, se gli altri sono noti. Consideriamo due conseguenze praticamente importanti di questa equazione.
1. È facile vedere che a pressione e temperatura costanti la densità del gas
p \u003dm / v= const M
Cioè, la densità di qualsiasi gas nelle stesse condizioni dipende solo dalla sua peso molecolare. Ciò consente di trovare la massa molecolare di un gas sconosciuto, se la sua densità relativa è nota.
D \u003d 1 / 2 .
Per gas con un peso molecolare noto, perché
Quindi, se la densità relativa del gas nell'idrogeno è 22, il suo peso molecolare è 44 (anidride carbonica). La densità relativa dell'aria viene spesso utilizzata. In questo caso, la massa molecolare dell'aria è presa pari a 29.
2. È anche facile dedurre dall'equazione di Mendeleev-Clapeyron che ritengo che se una reazione che coinvolge gas si verifica in un recipiente chiuso a temperatura costante, la pressione nel recipiente
Direttamente proporzionale al numero totale di moli di gas.
3. L'universalità delle proprietà dei gas ci consente di introdurre il concetto di peso molecolare medio per una miscela di gas (viene spesso utilizzato nei problemi). Se introduciamo la notazione
V \u003d m / M - (numero di moli), quindi il peso molecolare medio:
Poiché i gas nella miscela sono sempre nelle stesse condizioni, ad essi si applica la legge Avogadro e la definizione della massa molare media può essere riscritta sostituendo il numero di moli in volume:

^ 8.5. Legge di Avogadro, volume molare
Poiché i gas sono l'oggetto di studio più semplice, le loro proprietà e reazioni tra le sostanze gassose sono state studiate nel modo più completo.
Viene fondata la scienziata francese F, L. Gay-Lussac legge sul volume:

Ad esempio, 1 litro di cloro si combina con 1 litro di idrogeno per formare 2 litri di acido cloridrico; 2 l di anidride solforosa (IV) sono combinati con 1 l di ossigeno, formando 2 l di ossido di zolfo (VI).
Questa legge consentiva allo scienziato italiano A. Avogadro di supporre che le molecole di gas semplici (idrogeno, ossigeno, azoto, cloro, ecc.) Fossero costituite da due atomi identici. Quando l'idrogeno e il cloro si combinano, le loro molecole si scompongono in atomi; e quest'ultimo forma molecole di acido cloridrico. Ma dal momento che due molecole di acido cloridrico sono formate da una molecola, il volume di quest'ultima dovrebbe essere uguale alla somma dei volumi dei gas di origine, ad es.
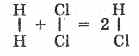
Pertanto, le relazioni volumetriche sono facilmente spiegabili se partiamo dall'idea della diatomicità delle molecole di gas semplici (H 2, Cl 2, O 2, N 2, ecc.). Questo, a sua volta, serve come prova della diatomicità delle molecole di queste sostanze.
Lo studio delle proprietà dei gas ha permesso ad A. Avogadro di avanzare un'ipotesi, che è stata successivamente confermata da dati sperimentali, e quindi è diventata nota come legge di Avogadro:
Una conseguenza importante deriva dalla legge di Avogadro: in condizioni identiche, 1 mole di qualsiasi gas occupa lo stesso volume. Questo volume può essere calcolato se si conosce la massa di 1 litro di gas. In condizioni normali, ad es. una temperatura di 273 K (0 ° C) e una pressione di 101325 Pa, la massa di 1 litro di idrogeno è 0,09 g, la sua massa molare è 1,008 2 \u003d 2,016 g / mol. Quindi il volume occupato da 1 mole di idrogeno è
2.016 g / mol
(2,016 g / mol) / 0,09 g / l \u003d 22,4 l / mol.
Nelle stesse condizioni, la massa di 1 litro di ossigeno è 1,429 g; massa molare 32 g / mol. Quindi il volume è
32 g / mol / 1.429 g / l \u003d 22,4 l / mol.
di conseguenza,

^ 1 Valore esatto 22.4135 ± 0.0006 L / mol
dove V m - volume molare di gas (dimensione m 3 / mol o l / mol); V- il volume della sostanza del sistema; n - la quantità di sostanza nel sistema. Esempio di registrazione: V m gas (n.o.) 22,4 l / mol.
Ricordiamo che nel 1860, al congresso internazionale dei chimici di Karlsruhe, gli insegnamenti di A. Avogadro ricevettero un riconoscimento universale.
Il congresso ha dato un forte impulso allo sviluppo della teoria atomico-molecolare. Ma ha ottenuto uno sviluppo particolarmente rapido dopo la scoperta da parte di D. I. Mendeleev della legge periodica degli elementi chimici.
Sulla base della legge di Avogadro, vengono determinate le masse molari di sostanze gassose. Maggiore è la massa delle molecole di gas, maggiore è la massa dello stesso volume di gas. A parità di volumi di vari gas nelle stesse condizioni, è contenuto lo stesso numero di molecole, e quindi moli di gas. Il rapporto tra le masse di uguali volumi di gas è uguale al rapporto delle loro masse molari:
m 1:m 2 = M 1:M 2 ,
dove m 1 - la massa di un certo volume del primo gas; m 2 - massa dello stesso volume del secondo gas; M 1 e M 2 - masse molari del primo e del secondo gas.

M 1 / M 2 \u003d D, quindi M 1 \u003d DM 2 .
Tipicamente, la densità del gas è determinata in relazione al gas più leggero - idrogeno (denota D H2). Massa molare l'idrogeno è 2,016 g / mol o circa 2 g / mol. Pertanto, otteniamo:
M \u003d 2D H2 .
Spesso la densità del gas viene determinata rispetto all'aria (D in). Sebbene l'aria sia una miscela di gas, parlano ancora della sua massa molare media. È di 29 g / mol. La massa molare media dell'aria è facile da calcolare, dato che l'aria è costituita da circa 4 volumi di azoto (massa molare 28 g / mol) e 1 volume di ossigeno (massa molare 32 g / mol), cioè 4N 2 O 2. poi:
(4 28 1 32). (4 1) \u003d 28,8 g / mol (arrotondato 29 g / mol).
In questo caso, la massa molare è determinata dall'espressione:
M \u003d29D c.
La determinazione delle masse molari ha mostrato che le molecole di gas semplici sono costituite da due atomi (H 2, F 2, Cl 2, O 2, N 2) e le molecole di gas nobili sono costituite da un atomo (He, Ne, Ar, Kr, Xe, Rn ). Per i gas nobili, i concetti di "molecola" e "atomo" sono equivalenti. Tuttavia, le molecole di alcune altre sostanze semplici sono costituite da tre o più atomi, ad esempio molecole di ozono O 3, fosforo P 4, vapore di zolfo ad alte temperature S 8.
Sulla base della legge di Avogadro, vengono eseguiti vari calcoli: il calcolo del volume, della massa, della densità dei gas in condizioni normali, della massa molare delle sostanze gassose e della densità relativa dei gas.
8.6. liquidi
Lo stato liquido è intermedio tra gassoso e cristallino (vedere §8.2). In alcune proprietà, i liquidi sono vicini ai gas e in altri sono vicini ai solidi. Innanzitutto, la loro isotropia e fluidità riuniscono gas liquidi; quest'ultimo determina la capacità di un liquido di cambiare facilmente la sua forma esterna. Tuttavia, l'alta densità e la bassa compressibilità dei liquidi li avvicinano ai solidi.
La capacità dei liquidi di cambiare facilmente forma indica l'assenza di forze rigide di interazione intermolecolare in essi. Allo stesso tempo, la bassa compressibilità dei liquidi, che determina la capacità di mantenere un volume costante a una determinata temperatura, indica la presenza di forze di interazione tra particelle, sebbene non rigide, ma comunque significative.
Ogni stato aggregato è caratterizzato dalla propria relazione tra le energie potenziali e cinetiche delle particelle di materia. Per i solidi, l'energia potenziale media delle particelle è maggiore della loro energia cinetica media. Pertanto, nei solidi, le particelle occupano una certa posizione l'una rispetto all'altra e oscillano solo attorno a queste posizioni. Per i gas, il rapporto energetico è l'opposto, per cui le molecole di gas sono sempre in uno stato di movimento caotico e le forze di adesione tra le molecole sono praticamente assenti, in modo che il gas occupi sempre l'intero volume fornito. Nel caso di liquidi, l'energia cinetica e potenziale delle particelle sono approssimativamente le stesse, ad es. le particelle sono collegate tra loro, ma non rigidamente. Pertanto, i liquidi sono fluidi, ma hanno un volume costante a una data temperatura.
Come risultato dell'applicazione di metodi di analisi strutturale ai liquidi, si è riscontrato che la struttura del liquido è simile ai corpi amorfi. Nella maggior parte dei liquidi, si osserva un ordine a corto raggio: il numero dei vicini più vicini per ciascuna molecola e le loro posizioni relative sono approssimativamente le stesse nell'intero volume di questo liquido.
Il grado di ordinamento delle particelle in diversi liquidi è diverso. Inoltre, cambia con la temperatura. A basse temperature, leggermente superiore al punto di fusione di una determinata sostanza, il grado di disposizione ordinata delle particelle di un dato liquido è grande. All'aumentare della temperatura, diminuisce e quando le proprietà del liquido diventano sempre più vicine alle proprietà del gas. Quando viene raggiunta la temperatura critica, la differenza tra il liquido e il gas scompare.
A causa della somiglianza nella struttura interna dei liquidi e dei corpi amorfi, questi ultimi sono spesso considerati liquidi con una viscosità molto elevata e solo le sostanze allo stato cristallino sono riferite a solidi. Confrontando i corpi amorfi con i liquidi, tuttavia, va ricordato che nei corpi amorfi, a differenza dei liquidi ordinari, le particelle hanno poca mobilità, lo stesso dei cristalli.
^ 8.7. Solidi. I principali tipi di reticoli cristallini: cubici ed esagonali
Allo stato solido, la maggior parte delle sostanze ha una struttura cristallina. Ciò può essere facilmente verificato suddividendo un pezzo di sostanza ed esaminando la frattura risultante. Di solito, alla frattura (ad esempio, nello zucchero, nello zolfo, nei metalli), sono chiaramente visibili sottili facce di cristallo posizionate ad angoli diversi, che brillano a causa della diversa riflessione della luce da parte loro. Nei casi in cui i cristalli sono molto piccoli, la struttura cristallina della sostanza può essere determinata usando un microscopio.
Ogni sostanza di solito forma cristalli di una certa forma. Ad esempio, il cloruro di sodio si cristallizza nelle probabilità di cubi, allume sotto forma di ottaedri, nitrato di sodio sotto forma di prismi, ecc. La forma cristallina è una delle proprietà caratteristiche dei solidi.
La classificazione delle forme cristalline si basa sulla simmetria dei cristalli. Vari casi di simmetria di poliedri cristallini sono studiati in dettaglio nei corsi di cristallografia.
Molte sostanze, in particolare ferro, rame, diamante, cloruro di sodio, si cristallizzano in un sistema cubico. Le forme più semplici di questo sistema sono il cubo, l'ottaedro, il tetraedro. Magnesio, zinco, ghiaccio, quarzo si cristallizzano nel sistema esagonale. La forma principale di questo sistema è un prisma esagonale e un bipiramide.
Oggetto: Proprietà di solidi, liquidi e gas.
Scopo: consolidare la conoscenza dello stato dei corpi.
Considera le proprietà di solidi, liquidi e gas.
Formare idee su deformazione, elasticità, plasticità.
Il corso della lezione
Organizzazione degli studenti per una lezione. Quale scienza studia corpi, sostanze, fenomeni in natura e tecnologia? (Fisica).
Cos'è un corpo? Esempi.
Cos'è una sostanza? Esempi.
In quali condizioni possono trovarsi le sostanze?
Quali proprietà hanno le sostanze allo stato solido, liquido, gassoso?
Imparare nuovo materiale.
Sappiamo che siamo circondati da molti corpi composti da sostanze. Sono molto diversi. Prova a descrivere le proprietà di acqua, zucchero, paraffina. Perché queste sostanze sono così diverse? La scienza della fisica ci aiuterà a rispondere a questa domanda. Da dove iniziamo
Proprietà dei solidi.
Prendi un libro, prova a cambiarne forma e volume.
Trarre una conclusione: quali proprietà hanno i solidi?
(I corpi rigidi sono in grado di mantenere invariati forma e volume.)
Proprietà dei liquidi.
Fissare la quantità di acqua nel misurino, versare l'acqua nel pallone, quindi di nuovo nel bicchiere.
Il volume dell'acqua è cambiato?
La forma del fluido è cambiata?
Trarre una conclusione: quali proprietà hanno i liquidi?
Scrivi i risultati della tua ricerca in una tabella. (I liquidi sono in grado di mantenere il volume, ma non sono in grado di mantenere la forma.)
Le proprietà dei gas
Gonfia un palloncino. Che forma prende la palla?
Rilasciare l'aria dal palloncino. Dove è andata l'aria?
Il volume dell'aria è cambiato?
La forma dell'aria è cambiata?
Trarre una conclusione: quali proprietà hanno i gas?
Scrivi i risultati della tua ricerca in una tabella. (I gas non mantengono la loro forma e occupano l'intero volume che viene loro fornito.)
riflessione:
Cosa è comune nelle proprietà di solidi e liquidi? Qual è la loro differenza?
Cosa è comune nelle proprietà di gas e liquidi? Qual è la loro differenza?
È noto sull'argomento che conserva bene il suo volume e la sua forma. In quali condizioni è la sostanza di cui è costituito questo oggetto? (allo stato solido.)
Deformazione.
Prendi la striscia di metallo e ruota le estremità in diverse direzioni. Cosa è successo La forma della striscia è cambiata? (La forma della striscia è cambiata sotto l'influenza della forza.)
Dare una definizione:
Deformazione - cambia forma, dimensioni e volume del corpo.
Elasticità.
Allunga l'elastico e poi rilascia. Cosa è successo (Sotto l'influenza della forza, la forma e il volume del nastro sono cambiati e, dopo la fine della forza, il nastro ha assunto la sua forma originale.)
Dare una definizione:
Elasticità - la proprietà di un corpo di cambiare forma e volume sotto l'influenza di altri corpi e ripristinarli dopo la fine dell'azione.
Dove viene applicata la proprietà di elasticità? (Una primavera nella tecnologia.)
Plasticità.
Dai pezzi di plastilina, forma una palla, quindi da una palla: un cubo. La forma di plastilina è cambiata?
Metti la figurina sul tavolo. È tornata la forma originale di plastilina?
Dare una definizione:
Plasticità - la proprietà dei corpi di cambiare forma sotto l'influenza di altri corpi e di preservarla dopo la fine dell'azione.
Dove si applica la proprietà di plasticità dei materiali? (Ceramica - prodotti in argilla, modellistica in argilla, fabbricazione di candele con cera o paraffina.)
Inizio del modulo
Fine del modulo
Riflessione: esaminare le proprietà dell'acqua e compilare la tabella.
|
Condizioni dell'acqua |
Stato di sostanza |
||
|
Salva |
|||
|
Vapore acqueo |
Non salva |
Compiti a casa. Ripetere le proprietà di base di solidi, liquidi e gas; Trova esempi di applicazione di queste proprietà nella vita di tutti i giorni.
Tutti i corpi sono composti da atomi o molecole (particelle di materia) che si muovono casualmente e interagiscono anche con le forze di attrazione e repulsione. Sono le differenze in moto termico di queste particelle, così come la loro interazione in condizioni diverse, determina l'esistenza di diversi stati aggregati in una sostanza: gassoso, liquido, solido. Le caratteristiche di questi stati sono l'argomento di questa lezione.
Un atomo è costituito da un nucleo carico positivamente e da elettroni caricati negativamente che ruotano attorno al nucleo. Un atomo, come una molecola, è elettricamente neutro.
Considera la forza di interazione tra particelle usando l'esempio di due molecole stazionarie.
Tra i corpi in natura ci sono forze gravitazionali ed elettromagnetiche. Poiché le masse di molecole sono estremamente piccole, le forze di interazione gravitazionale tra loro non possono essere considerate. A grandi distanze, non c'è neanche interazione elettromagnetica tra le molecole.
Quando la distanza tra le particelle diminuisce (vedi Fig. 1), iniziano a orientarsi in modo che i loro lati uno di fronte all'altro abbiano delle cariche diverse in segno (in generale, le molecole rimangono neutre in questo caso) e, di conseguenza, sorgono forze attrattive tra le molecole (massima forza di attrazione a una distanza di 2-3 diametri della molecola). Quando la distanza tra le molecole diminuisce, sorgono forze repulsive a seguito dell'interazione di gusci di elettroni carichi negativamente degli atomi delle molecole. Pertanto, la somma delle forze agisce sulla molecola: attrazione e repulsione (a grandi distanze, prevale la forza di attrazione, a piccole distanze - la forza repulsiva).
Fig. 1. Interazione tra molecole
La Figura 2 mostra un grafico della dipendenza della forza di interazione tra le molecole sulla distanza tra loro. La linea rossa mostra la forza di attrazione, la linea blu mostra la forza repulsiva, la linea verde mostra il grafico finale delle forze. Un valore è una distanza tra le molecole a cui le forze attrattive diventano uguali alle forze repulsive (posizione di equilibrio stabile).
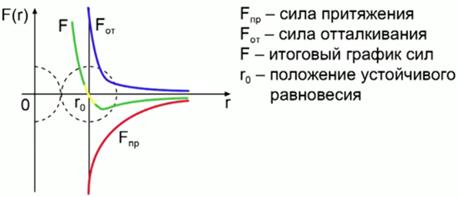
Fig. 2. Il grafico della dipendenza della forza di interazione tra le molecole a seconda della distanza tra loro
Molecole situate a distanza l'una dall'altra e collegate da forze elettromagnetiche energia potenziale. In una posizione di equilibrio stabile, l'energia potenziale delle molecole è minima. Nella materia, ogni molecola interagisce contemporaneamente con molte molecole vicine, il che influenza anche il valore della loro minima energia potenziale. Inoltre, tutte le molecole della sostanza sono in movimento continuo, cioè hanno energia cinetica. Pertanto, la struttura di una sostanza e le sue proprietà (corpi solidi, liquidi, gassosi) è determinata dal rapporto tra l'energia potenziale minima di interazione delle molecole e il loro deposito di energia cinetica del movimento termico.
La distanza media tra le particelle di gas è molto più grande della dimensione delle particelle stesse, quindi, negli intervalli tra le collisioni, le particelle di gas percorrono distanze di diversi ordini di grandezza più grandi delle loro stesse dimensioni. Ad esempio, nell'aria (in condizioni normali) il percorso libero medio di una molecola è mille volte la dimensione media della molecola.
A distanze così grandi tra le molecole, le forze di interazione intermolecolare tra loro sono molto piccole. Da un punto di vista energetico, ciò significa che l'energia potenziale di interazione delle molecole (rispetto all'energia cinetica del loro movimento) può essere trascurata.
Se consideriamo l'energia cinetica, cioè il movimento delle molecole di gas, vale la pena notare che ognuna di esse partecipa non solo al movimento traslazionale, ma anche al movimento rotazionale (se non è un gas monatomico), e se prendiamo in considerazione l'interazione molto piccola delle molecole di gas, allora queste molecole prenderà parte al movimento oscillatorio (vedi Fig. 3).
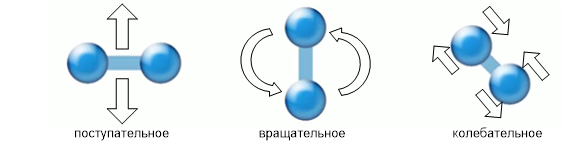
Fig. 3. Tipi di movimenti molecolari
Pertanto, qualsiasi molecola di gas, senza sperimentare una forte interazione con i suoi vicini, può trovarsi in qualsiasi luogo della nave in qualsiasi momento, quindi dicono che i gas non conservano né la forma né il volume. Questa proprietà dei gas è ampiamente utilizzata nella tecnologia moderna (apparecchiature pneumatiche, motori termici, ecc.).
I solidi sono l'esatto opposto dei gas. In essi non c'è libero movimento di particelle. Le molecole si trovano nei nodi del reticolo cristallino (vedi Fig. 4). Cioè, esiste un rigido ordine periodico nella disposizione delle particelle che compongono un solido.
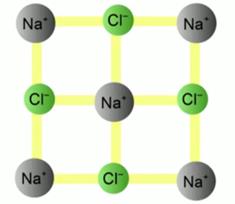
Fig. 4. Il reticolo cristallino di NaCl (cloruro di sodio)
Nei solidi, l'energia potenziale dell'interazione è molto significativa, l'energia cinetica, rispetto al potenziale, non è grande. Gli atomi, le molecole o gli ioni fanno solo movimenti oscillatori vicino alla posizione di equilibrio. Le distanze tra le particelle vicine sono approssimativamente uguali alla dimensione delle particelle stesse.
I tipi di reticoli cristallini differiscono a seconda della sostanza (la cosa principale è la frequenza e l'ordine). I punti dello spazio in cui si trovano le particelle di un solido sono chiamati nodi del reticolo cristallino.
A causa della stabilità e dell'ordine nella disposizione delle particelle ai nodi del reticolo cristallino, i fisici affermano che i solidi hanno ordini a lungo e corto raggio nella disposizione delle particelle di materia (vedi sotto).
I solidi mantengono la loro forma e volume (ad esempio, se si espone la molla alla deformazione, tornerà alla sua forma precedente senza modificare il volume).
Ogni molecola liquida, sebbene non sia posizionata in modo così rigoroso e ordinato come in un corpo solido, è circondata dallo stesso numero di molecole "vicine" (vedi Fig. 5). Ma se guardi da lontano le molecole liquide, allora non possiamo parlare di alcun ordine nel liquido, osserveremo il caos. Pertanto, si dice che nei solidi esiste un ordine a corto raggio e un ordine a lungo raggio, mentre in un liquido c'è solo un ordine a corto raggio. Nei corpi gassosi, sono assenti sia l'ordine a corto che a lungo raggio.

Fig. 5. Ordine a lungo e corto raggio nella disposizione delle particelle di materia
I liquidi, a differenza dei solidi, hanno un ordine a corto raggio nella disposizione delle particelle di materia.
Le particelle nei corpi liquidi sono "impacchettate" strettamente e, come nei solidi, oscillano attorno alla posizione di equilibrio. Un tentativo di comprimere rapidamente il liquido porta alla deformazione delle molecole e incontra una forte resistenza da parte del liquido. Cioè, i liquidi non sono praticamente comprimibili.
Sebbene le molecole del fluido si trovino quasi nello stesso modo di un solido, il fluido è fluido. Ciò è dovuto al fatto che, a differenza di un corpo solido, le vibrazioni delle molecole vicino alla posizione di equilibrio in un liquido non sono eterne, ad un certo punto nel tempo la molecola fa un "salto", spostandosi in un'altra posizione. Pertanto, il liquido mantiene bene il suo volume, ma non mantiene la sua forma.
Da un punto di vista energetico, un liquido occupa una posizione intermedia tra un solido e un gas: le particelle di un liquido possiedono un'energia cinetica di movimento significativa a livello microscopico, nonché una potenziale energia di interazione.
Lo stato amorfo del corpo è chiamato intermedio tra solido e liquido. Un esempio di tale sostanza è la plastilina, la resina, il vetro.
Le molecole nelle sostanze amorfe si trovano come molecole in un liquido, cioè hanno un ordine a corto raggio, ma non hanno un ordine a lungo raggio.
Con un certo grado di condizionalità, i corpi amorfi possono essere chiamati liquidi molto viscosi. Puoi verificarlo se guardi il profilo dei vetri delle finestre nei castelli antichi. Nella parte superiore, questi vetri sono molto più stretti che nella parte inferiore - il vetro per molti anni “scorre” verso il basso (vedi Fig. 6), senza cambiare la sua struttura interna. In effetti, ad esempio, anche i ghiacciai possono scorrere verso il basso. Ciò è dovuto allo scioglimento del ghiacciaio e all'ulteriore cristallizzazione dell'acqua.

Fig. 6. Profilo del vetro della finestra in un antico castello
Nei solidi, le particelle hanno un'energia potenziale significativa e un'energia cinetica relativamente piccola, poiché fanno movimenti oscillatori vicino alla posizione di equilibrio.
La posizione intermedia è occupata dai liquidi, poiché le particelle liquide possiedono sia una significativa energia cinetica del movimento che una potenziale energia di interazione, e nei gas le molecole hanno una grande energia cinetica del movimento e un'energia di interazione potenziale relativamente piccola (trascurabile).
riferimenti
- GY Myakishev, B.B. Bukhovtsev, N.N. Constables. Fisica 10. - M.: Istruzione, 2008.
- Gendenshtein L.E., Dick Yu.I. Fisica 10 ° grado. - M.: Ileksa, 2005.
- Kasyanov V.A. Fisica 10 ° grado. - M .: Bustard, 2010.
- Class-fizika.spb.ru ().
- Kaf-fiz-1586.narod.ru ().
- Presentazione ().
compito
- Domande (1-4) alla fine del paragrafo 47 (p. 229); Kasyanov V.A. Grado di fisica 10 (vedi elenco della letteratura consigliata) ().
- Qual è la differenza tra le traiettorie delle molecole di gas, liquido e solido?
- Con un forte raffreddamento dell'aria, può essere reso liquido. Allo stesso tempo, il volume che occupa l'aria viene ridotto di quasi 700 volte. Trarre una conclusione da questo fatto: quale frazione del volume di gas è il volume delle molecole stesse?
- Il gas è in grado di espandersi senza limiti. Perché esiste l'atmosfera della terra?
Proprietà fisiche di liquidi, gas e solidi.
Per comprendere meglio il concetto di mezzi continui solidi, liquidi e gassosi, consideriamo le proprietà di pulito (costante composizione chimica) materiali. Prendi l'acqua come esempio. Dalla fisica è noto che le sostanze pure possono trovarsi in quattro stati aggregati: cristallino, liquido, gassoso e plasma. Di seguito è riportata un'illustrazione di un diagramma di fase per l'acqua.
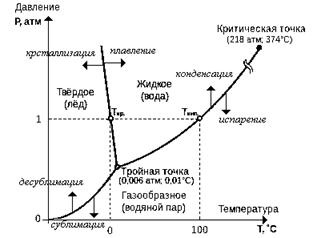 Figura 1.1. Diagramma di fase dell'acqua. Figura 1.1. Diagramma di fase dell'acqua. |
Le proprietà fisiche dei materiali sono determinate dalla loro interazione intermolecolare (interatomica). A basse temperature (basse energie), la struttura cristallina della molecola ha luogo o gli atomi sono rigidamente interconnessi e oscillano attorno ai centri del reticolo cristallino, e il mezzo viene solitamente chiamato cristallo. In fisica è consuetudine affermare che ha luogo ordine a lungo raggio. In questo caso, il suo reticolo può essere presente nel reticolo stesso - dislocazioni, posti vacanti (assenza di un atomo nel sito del reticolo), ecc. Saremo principalmente interessati alla questione di cambiare le caratteristiche di un mezzo continuo sotto l'azione delle forze.
tensione (dal lat. defogmatio - "distorsione") - un cambiamento nella posizione relativa delle particelle del corpo associate al loro movimento l'una rispetto all'altra. La deformazione è il risultato di cambiamenti nelle distanze interatomiche e riarrangiamento dei blocchi atomici.
Per deformare un cristallo, sono necessari grandi sforzi per renderlo, quindi i corpi cristallini (solidi) sono considerati incomprimibili. Considerare un'asta di materiale solido di sezione trasversale costante, alle cui estremità viene applicata la tensione (Fig. 1.2.). La deformazione lineare può essere descritta da una quantità senza dimensioni
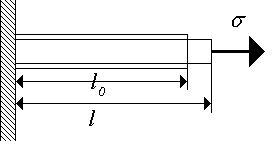 Fig. 1.2. Deformazione a trazione dell'asta. Fig. 1.2. Deformazione a trazione dell'asta. |
Di seguito (Fig. 1.3.) Sono riportati i diagrammi della dipendenza della sollecitazione dalla deformazione lineare.

Fig. 1.3. Diagrammi di allungamento per materiale generalizzato.
Per la maggior parte dei materiali solidi, ha luogo una sezione lineare, mentre la tensione non supera il valore - limite di proporzionalità. La legge di Hooke è valida in questo settore. Per questa sezione, la deformazione è reversibile: dopo la rimozione del carico, la deformazione scompare, tale deformazione viene chiamata elastico -. Questa è seguita da una sezione con una dipendenza non lineare, con una deformazione permanente ( plastica), che si forma dopo lo scarico. Allo stesso tempo, un certo numero di materiali ha un punto di snervamento chiaramente definito (il campione continua a deformarsi anche con un carico costante di Fig. 1.3.a), mentre un certo numero di materiali no (Fig. 1.3.b). Per i primi materiali, viene introdotto un valore - la resistenza allo snervamento, per il secondo viene introdotta la resistenza allo snervamento condizionale - lo stress a cui la deformazione plastica, dopo lo scarico, è dello 0,2% o 0,002. Nel primo caso, il sito è il sito di deformazione plastica, il sito è il punto di snervamento. Si noti che il flusso di materiale avviene uniformemente lungo l'intera asta più lunga.
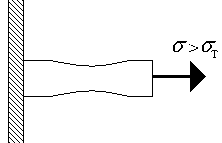 Fig. 1.4. Formazione del collo. Fig. 1.4. Formazione del collo. |
Un ulteriore aumento del carico porta a una distribuzione irregolare della deformazione lungo l'asta lunga (Fig. 1.4) - in qualche punto è possibile notare la formazione del collo (Fig. 1.4.). La deformazione del materiale nel punto A (Fig. 1.3.a) è anch'essa di plastica ed elastica. Un ulteriore aumento del carico porta alla distruzione del materiale quando raggiunge la massima resistenza.
Lo stress, ĸᴏᴛᴏᴩᴏᴇ questo materiale può resistere in pratica, senza collassare e senza subire una pericolosa deformazione, chiamato accettabile e denotare. Di solito, tutti i calcoli si basano sulle leggi di Hooke. Per garantire la resistenza in ogni circostanza, la sollecitazione ammissibile è selezionata come parte della resistenza alla trazione, in particolare per i metalli [s] \u003d 0,2 s m, e per il legno [s] \u003d 0,1 s m. Va notato che le maggiori deformazioni che possono resistere il materiale non è determinato dall'estensione dell'area di resa. Se l'area di resa è grande, il materiale viene solitamente chiamato plastica. Un materiale come l'acciaio può sopportare carichi pesanti senza rompersi. Al contrario, se l'area di resa è piccola, questo materiale è fragile. I materiali fragili, come la ghisa, vengono distrutti dalla deformazione. In alcuni casi, i materiali plastici possono anche rompersi in piccole deformazioni (ad esempio acciaio a basse temperature). Le caratteristiche di resistenza dei materiali solidi dipendono sostanzialmente dalla temperatura del materiale.
Con un aumento di energia, il numero di violazioni del reticolo cristallino aumenta e questo processo procede in dinamica (da qualche parte scompaiono e da qualche parte si formano di nuovo). Al raggiungimento di una certa soglia di energia, l'elasticità scompare. In questo caso, si svolge ordine a corto raggioe tale materiale viene solitamente chiamato liquido. La distanza caratteristica media tra le molecole (atomi) di un liquido e un cristallo corporeo è approssimativamente la stessa ed è uguale a ʼʼ (3¸4) 10 -6 M. Anche le densità delle fasi liquida e cristallina sono approssimativamente uguali. Quindi la densità dell'acqua, la densità delle benzine, il cherosene, i carburanti diesel, gli oli. In questo caso, il liquido dovuto alla rottura delle obbligazioni acquisisce una nuova proprietà fluidità - la capacità di deformarsi sotto l'influenza di influenze esterne arbitrariamente piccole, fino a quando le sollecitazioni tangenziali interne diventano uguali a zero. Con l'aumentare della temperatura, aumenta la fluidità del corpo.. In questo caso, il liquido, come un corpo solido, è incomprimibile (la densità rimane quasi invariata). Un ulteriore aumento della temperatura porta a una completa rottura dei legami (mancanza di ordine a corto raggio). Il materiale in questo stato viene solitamente chiamato gas. Per i corpi gassosi, una caratteristica è il movimento caotico e la collisione delle molecole nello spazio. Per questo motivo, i gas hanno non solo fluidità, ma anche comprimibilità.
Considera una nave piena di liquido, con un'area di base e pareti verticali. Applichiamo la forza e aumentiamo la pressione nel volume di dp (Fig. 1.5). Allo stesso tempo, il mezzo continuo viene compresso, diminuendo il suo volume di un importo. Si ottiene empiricamente che la relazione tra la variazione di volume e la pressione della linea - на, ᴛ.ᴇ. per ogni fluido, è possibile inserire una costante, che si chiama coefficiente di espansione del volume (a temperatura costante):
 .
(1.3.2)
.
(1.3.2)
Il coefficiente di compressione volumetrica ha dimensione (Pa) -1. Un segno meno indica che il volume è ridotto dalla compressione.
Il modulo inverso è di solito chiamato il modulo di elasticità di massa:
Entrambi questi valori dipendono dalla temperatura e dal tipo di liquido, il modulo elastico sfuso per l'acqua a T \u003d 293 ° K è uguale a \u003d 2 × 10 9 Pa ʼʼ 20000 kgf / cm 2.
Se l'acqua oltre alla pressione atmosferica ( p a \u003d 101325 Pa o 1.033 kgf / cm 2), agirà inoltre la stessa pressione, quindi il volume dell'acqua diminuirà di circa 1/20000, ᴛ.ᴇ. quasi impossibile da notare. Pertanto, l'acqua e altri liquidi possono essere considerati incomprimibili e mantenere costante la loro densità ( r \u003d const), indipendente dalla pressione. Per la maggior parte dei liquidi, la densità diminuisce con l'aumentare della temperatura, ad eccezione dell'acqua, la cui densità ha un massimo a 4 ° C. Per analogia con (1.3.2), possiamo introdurre il coefficiente di espansione termica volumetrica
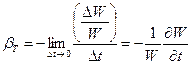 ,
,
quindi la densità del liquido dovrebbe essere calcolata con la formula:
qui la densità in condizioni standard (), è la temperatura in gradi Celsius.
Come già accennato in precedenza, la principale differenza tra un gas e un liquido consiste nel fatto che il gas è facilmente compresso. In esso, la velocità di propagazione del suono (e quindi tutti i disturbi meccanici) è molto più bassa che in un liquido. Questa caratteristica del gas dovrebbe essere presa in considerazione quando la velocità di movimento (o la velocità di movimento di un solido in esso) diventa comparabile con la velocità del suono o la supera.
Contrariamente al gas, un liquido ha una superficie di confine chiaramente definita tra esso e il gas che lo circonda, che è comunemente chiamato superficie libera. Nel campo di gravità, la superficie libera del liquido ha un profilo orizzontale. Sotto gravità zero, a causa della tensione superficiale, la superficie libera è sferica. Questa proprietà del liquido, così come la sua bassa compressibilità, è dovuta alla costante interazione delle molecole vicine. In un gas, le molecole interagiscono tra loro solo al momento della collisione, la maggior parte di nel tempo, si muovono liberamente nello spazio, in relazione a ciò, a causa della casualità del movimento, il gas tende a distribuirsi uniformemente in tutta la parte chiusa dello spazio. Se lo spazio non è chiuso, il volume del gas può aumentare in modo illimitato.
In un gas, è possibile ridurre all'infinito la pressione e aumentare la temperatura, e così facendo, le proprietà del gas cambieranno continuamente. In un liquido, la pressione può diminuire fino a un certo valore, al di sotto del quale inizia la formazione di bolle di gas al suo interno, e iniziano le transizioni di fase, che modificano qualitativamente le proprietà del fluido. La stessa cosa può succedere quando la temperatura del liquido aumenta. Equazione di stato. Il Centro clienti viene spesso utilizzato a due parametri o semplice Mercoledì. Cioè, un mezzo, i cui parametri termodinamici sono calcolati in due, mediante relazioni chiamate equazioni di stato .
Esistono due tipi di equazioni di stato.
termico equazione di stato
calorifico equazione di stato
Ecco l'energia interna specifica (per unità di massa).
Per il gas, si può usare abbastanza efficacemente il modello di gas descritto dall'equazione termica dello stato di Klaiperon - Mendeleev -
dove D - costante di gas, tale gas viene chiamato perfetto o (termicamente perfetto.
, G o\u003d 8.3144 J / (mol × K) è la costante di gas universale.
Massa molare del gas, \u003d kg / mol.
L'equazione di stato di van der Waals viene spesso utilizzata, ĸᴏᴛᴏᴩᴏᴇ è valida in una gamma più ampia di temperature e pressioni:
Coefficienti nell'equazione di Van Der Waltz
Notiamo anche che l'equazione di Van Der Waltz è anche usata per descrivere i liquidi, ma in condizioni normali fornisce solo una descrizione qualitativa.
Per i liquidi a goccia, per i quali la compressibilità è estremamente ridotta, in una vasta gamma di variazioni di pressione, la relazione tra densità e pressione di linea è:
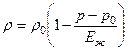 ,
,
Dov'è la densità corrispondente alla pressione è il modulo di compressione di massa, il cui ordine è 10 4 MPa.
Per alte pressioni e temperature, è preferibile un'equazione binomiale di stato:
![]()
Quindi, per l'acqua, vengono utilizzati i seguenti valori delle costanti: ![]()
Per il processo adiabatico (in assenza di trasferimento di calore e massa tra il volume di gas allocato e l'ambiente), è caratteristica la seguente dipendenza:
dove - costante di gas adiabatica (indice adiabatico); con v - capacità termica del gas a volume costante; con p - lo stesso a pressione costante. Tale gas è chiamato termicamente e caloricamente perfetto o politropico.
Viscosità di liquidi e gas. Proprietà reologiche dei liquidi. viscosità è consuetudine chiamare la proprietà di un fluido, ĸᴏᴛᴏᴩᴏᴇ consiste nel verificarsi di forze interne in esso che ne impediscono la deformazione, ᴛ.ᴇ. un cambiamento nella posizione relativa delle sue parti. Considera un caso speciale della teoria cinetica molecolare di un gas ideale: un semplice flusso di taglio (Fig. 1.6).
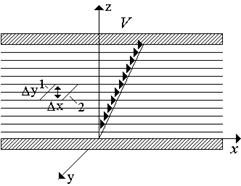 Figura 1.6 Sollecitazioni viscose in liquidi e gas Figura 1.6 Sollecitazioni viscose in liquidi e gas |
L'area elementare della superficie che separa gli strati 1 e 2 si muove con il liquido. In questo caso, lo strato liquido 1 scorre lungo lo strato 2 con una velocità relativa. Le molecole di gas partecipano a due tipi di movimenti:
1. ordinato (longitudinale) con velocità;
2. moto termico caotico e disordinato, la cui velocità è generalmente di due ordini di grandezza superiore alla velocità del moto ordinato.
La viscosità del gas è dovuta al trasferimento di molecole durante il loro movimento termico (diffusione) attraverso una piattaforma elementare che giace in un piano che separa due strati con diverse velocità longitudinali e la quantità di movimento dovuta alla differenza di velocità di questi strati. Le molecole si muovono casualmente in modo casuale, mentre si spostano da uno strato all'altro, attraversando il sito. Le molecole che hanno una velocità ordinata passano strato 2 e rallenta il suo movimento e lo stesso numero di molecole intrappolate nello strato 1 dallo strato 2 accelera lo strato 1. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, la viscosità del mezzo si manifesta solo quando il mezzo si muove.
È importante notare che per un mezzo continuo si ritiene che lo sforzo di taglio agisca sul sito per compensare il trasferimento del momento dovuto al movimento termico delle molecole. Secondo la teoria cinetica molecolare, questo stress da taglio
![]() (1.3.6)
(1.3.6)
dove h - coefficiente di viscosità dinamica (viscosità dinamica) gas. Il suo valore è determinato dalle proprietà fisiche del mezzo. Il segno di stress è come se stesse "cercando" di ridurre la differenza di velocità tra gli strati.
La dipendenza (1.3.6) è valida per la maggior parte di gas e liquidi e viene generalmente chiamata la legge di Newton per gli stress viscosi.Contrariamente alla legge sull'attrito secco, lo stress da taglio è indipendente dallo stress normale.
Secondo la definizione (1.3.6), coefficiente di viscosità dinamica h nel sistema SI ha la seguente unità:

In pratica, a volte come unità h usa P \u003d g / cm × s, che si chiama Poise (in onore del medico francese A. Poiseuille, che ha svolto ricerche fondamentali sul movimento di un fluido viscoso): Pa × s \u003d 10 × P.
Vale la pena dire che per i media incomprimibili () è consigliabile utilizzare il valore
![]() . (1.3.7)
. (1.3.7)
detto coefficiente di viscosità cinematica(viscosità cinematica). In pratica, viene spesso utilizzato il valore St \u003d cm 2 / s, che di solito viene chiamato Stokes (in onore dell'idromeccanica inglese J. Stokes, che ha formulato le equazioni differenziali di movimento di un fluido viscoso): 1St \u003d 10 -4 m 2 / s.
Per misurare la viscosità, strumenti chiamati viscosimetro.
Per i liquidi trasparenti, viene utilizzato un viscosimetro Stokes - un bicchiere alto con divisioni in cui vengono introdotte dall'alto piccole sfere da una sostanza con una densità vicina alla densità del liquido e viene misurata la velocità della palla. Poiché il peso, la forza di Archimede e la forza di resistenza sono noti per le piccole velocità e la palla si muove uniformemente, il coefficiente di viscosità viene facilmente calcolato.
Vale la pena dire che per i liquidi opachi viene utilizzato Engler, con cui viene determinata la viscosità condizionale, che viene misurata in circa E - gradi di Engler. Il numero di gradi Engler è determinato dal rapporto tra il tempo di scadenza del liquido di prova a una data temperatura dal viscosimetro e il tempo di deflusso dell'acqua distillata dallo stesso dispositivo a temperatura normale (20 ° C). La conversione dei gradi di Engler in unità di viscosità cinematica (Stokes) viene effettuata secondo la formula empirica di Ubellode:
![]() . (1.3.8)
. (1.3.8)
Nella tabella. La Figura 1.1 mostra i valori di h, r, n per alcuni liquidi e gas, e la Figura 1.7 mostra la temperatura e la dipendenza dall'acqua per l'acqua e l'aria.
Tabella 1.1
Valori H, r, n per alcuni liquidi e gas

Fig. 1.7. Dipendenza del coefficiente di viscosità cinematica dalla temperatura.
Da questi dati risulta che la viscosità dell'acqua diminuisce all'aumentare della temperatura da 0 a 100 ° Quasi sette volte e la viscosità dell'aria aumenta all'aumentare della temperatura da 20 a 50 ° C del 25% . Si noti che nei gas, la viscosità e la diffusione sono dovute allo stesso meccanismo fisico: il movimento termico caotico delle molecole. Per questo motivo, il coefficiente di viscosità cinematica n ha un ordine di grandezza con il coefficiente di diffusione molecolare. Nei liquidi, la viscosità e la diffusione hanno una diversa natura fisica. Di conseguenza, il coefficiente di diffusione in un liquido è centinaia di volte inferiore al coefficiente di viscosità.
All'aumentare della temperatura nel gas, aumenta la velocità del movimento caotico delle molecole, il che porta ad un aumento del numero di molecole che attraversano il sito per unità di tempo e, quindi, aumenta anche lo stress tangenziale da uno strato all'altro. Secondo (1.3.6), ciò significa che con all'aumentare della temperatura, aumenta il coefficiente dinamico della viscosità del gas .
il liquidila ragione principale del trasferimento di quantità di moto è l'interazione di molecole situate su lati opposti del confine tra gli strati e non il trasferimento di molecole attraverso questo confine. Per questo motivo, con all'aumentare della temperatura, diminuisce il coefficiente dinamico di viscosità del liquido(a differenza dei gas).
Per i calcoli nella pratica ingegneristica, utilizzare il valore approssimativo del coefficiente cinematico di viscosità dell'acqua n \u003d 0,01 cm 2 / s \u003d 0,01 St.
Tuttavia, ci sono molti liquidi per i quali la legge di Newton non è soddisfatta. Tali liquidi sono chiamati non-newtonianoe la scienza della natura della dipendenza ![]() comunemente chiamato reologia (greco. reo - flow, logos - insegnamento). Le loro proprietà saranno discusse più dettagliatamente più avanti nel quarto capitolo.
comunemente chiamato reologia (greco. reo - flow, logos - insegnamento). Le loro proprietà saranno discusse più dettagliatamente più avanti nel quarto capitolo.
Le molecole situate all'interfaccia tra i media sono attratte o respinte dal mezzo vicino. Di conseguenza, le forze di trazione dovrebbero apparire sull'interfaccia curva del supporto, cercando di raddrizzare l'interfaccia.
Lo sforzo di trazione (forza per unità di lunghezza) è chiamato coefficiente di tensione superficiale. Per il confine tra acqua e aria (superficie libera) a T \u003d 293 K ° \u003d 72,8 ∙ 10-3 N / m. Il coefficiente di tensione superficiale diminuisce con l'aumentare della temperatura ed è praticamente indipendente dalla pressione. La tensione superficiale dovrebbe essere ridotta con l'aiuto di sostanze tensioattive (tensioattivi), che includono detergenti. Questa proprietà dei liquidi si manifesta più chiaramente all'interfaccia tra tre fluidi (gas, liquido, solido). Vi sono liquidi bagnanti e non bagnanti fig.16. Angolo: comunemente chiamato angolo di bagnatura.
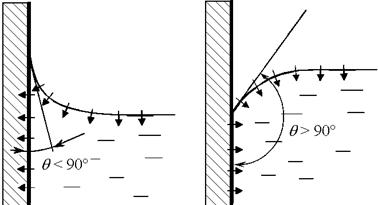
Fig. 1.8. Liquidi bagnanti e non bagnanti.
La caduta di pressione creata dalle forze di superficie su una superficie curva deve essere calcolata usando la formula di Laplace
 , (1.3.9)
, (1.3.9)
dove sono le principali curvature della superficie. È importante notare che per le formazioni sferiche (goccia, bolla, palla) la formula assume la forma:
Ecco il raggio della formazione sferica.
Per l'acqua, è vera la seguente relazione:
![]() ,
,
Ecco la temperatura in gradi Celsius.
Riassumendo, ricordiamo che MSS opera con modelli di un mezzo continuo. La tabella 1. riassume le principali caratteristiche dei tre modelli di base.
Tabella 1. Le principali caratteristiche del modello di supporto continuo.
L'uso di un modello per descrivere le caratteristiche di un ambiente reale è determinato dalle condizioni in cui si trova l'ambiente. Quindi, ad esempio, se la velocità del gas è piccola (numero di Mach, uguale al rapporto tra velocità e velocità del suono, inferiore a 0,2), il gas può essere considerato un fluido incomprimibile.
Il vetro viene generalmente descritto come un corpo solido deformabile, ma dal punto di vista fisico è un fluido a viscosità insolitamente alta. I liquidi, ad alte pressioni e temperature, ad esempio esplosioni o grandi profondità, diventano comprimibili.
Prestare di nuovo attenzione alla Fig. 1.1. Ne consegue che la stessa sostanza, procedendo da condizioni (pressione e temperatura), può trovarsi in diversi stati di aggregazione. Un cambiamento nello stato di aggregazione è sempre accompagnato da un cambiamento nell'energia del sistema (transizioni di fase del primo tipo). Questo diagramma e simili corrispondono al caso dei processi di equilibrio per sostanze chimicamente omogenee. In pratica, non è sempre così. Pertanto, un liquido sottoposto a riscaldamento può trasformarsi in vapore al momento dell'ebollizione, in questo caso si forma una nuova fase sotto forma di bolle sulla superficie riscaldata della nave o nel liquido stesso. Allo stesso modo, con un forte calo di pressione nel liquido, si formano bolle di vapore, questo fenomeno viene chiamato cavitazione (dal lat. cavita - vuoto). Successivamente, le bolle si spostano nell'area con una maggiore pressione e collasso, con la formazione di un'onda d'urto, che porta alla distruzione di superfici solide che sono snellite dal liquido.
Nei media costituiti da più sostanze, le transizioni di fase hanno i loro specifici. Quindi nelle miscele di gas (aria, gas naturale), si forma condensa per vari componenti a diverse pressioni e temperature. Questa proprietà viene utilizzata per separare qualsiasi frazione di gas.
Per vari liquidi, la solubilità dei gas è diversa e varia con l'aumentare della pressione.
Il volume relativo di gas disciolto in un liquido fino a quando non è completamente saturo può essere considerato direttamente proporzionale alla pressione:
dove è il volume di gas disciolto, è il volume di liquido, è la pressione finale e iniziale del gas, è il coefficiente di solubilità. Coefficiente di solubilità nell'aria k ha i seguenti significati quando t\u003d 20 ° C:
- per l'acqua k= 0,016;
- per cherosene k= 0,127;
- per olio per trasformatore k= 0,083;
- per olio industriale k= 0,076.
Quando la pressione nel liquido diminuisce, il gas disciolto in esso viene rilasciato e il gas viene rilasciato dal liquido più intensamente di quanto non si dissolva in esso.
1.4. Metodi per descrivere il moto di un mezzo continuo. Derivato locale e sostanziale.
mozione - una proprietà essenziale della materia, a questo proposito, nel mondo che ci circonda, incontriamo costantemente vari tipi di movimento, incluso e il movimento di vari media. Quindi, nel settore petrolifero e del gas, si deve affrontare il movimento di liquidi e gas attraverso i tubi e all'interno di varie macchine e meccanismi; con filtrazione che filtra liquidi e gas attraverso un mezzo poroso; con deformazione di vari tipi di strutture (serbatoi, serbatoi, serrande, ecc.), spostamenti geologici. Per questo motivo, è importante conoscere le leggi dell'interazione di liquido e gas con i limiti di flusso (in particolare le leggi sulla resistenza di tubi, velocità, restrizioni, ugelli), la distribuzione irregolare di flussi ad alta velocità, le leggi di filtraggio di liquidi e gas attraverso un mezzo poroso, l'equilibrio di liquidi e corpi che galleggiano su superficie liquida, propagazione di onde e vibrazioni in solidi e liquidi.
Il compito della cinematica - una descrizione del movimento del mezzo, indipendentemente dalle condizioni esterne che avviano e supportano il movimento. Le caratteristiche cinematiche includono coordinate delle particelle, velocità, accelerazione. Esistono due approcci per descrivere il moto di un mezzo continuo. Per metodo Lagrange Viene considerato il movimento di ciascuna particella di fluido.
Consideriamo il moto di una particella in un determinato sistema definito di coordinate rettangolari e rettilinee Oxyz, che accettiamo di chiamare stazionario (sistema di osservazione). Lascia che la particella occupi una posizione con coordinate nell'istante iniziale del tempo. In questo caso, per descrivere il moto completo di un punto, è estremamente importante conoscere l'equazione del suo moto ᴛ.ᴇ. ![]() dov'è il raggio vettore del punto.
dov'è il raggio vettore del punto.
Viene chiamata una curva descritta da posizioni successive di un punto mobile sentiero.
Il movimento di un punto viene determinato se vengono specificate le sue coordinate x, y, z, come funzioni continue del tempo t:
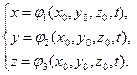 (1.4.1)
(1.4.1)
Queste equazioni determinano la posizione di una particella in movimento in un dato momento. t e rappresentano l'equazione della traiettoria in forma parametrica. Le variabili vengono chiamate variabili di Lagrange. Coordinate lagrangiane - questi sono i parametri che caratterizzano ogni punto del mezzo e non cambiano durante il movimento della particella. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, il punto di vista di Lagrange si basa su una descrizione della storia del moto di ciascun punto del mezzo continuo separatamente.
La velocità di un punto mobile è uguale alla derivata temporale del vettore di raggio di una particella mobile ed è un vettore con proiezioni:
Un punto geometrico basato sul tempo. Per questo motivo, il campo di velocità è definito in funzione delle coordinate geometriche e del tempo:
![]() (1.4.4)
(1.4.4)
Linea corrente è consuetudine chiamare una linea tangente alla quale in ogni momento coincide con la direzione del vettore di velocità. Pertanto, l'equazione delle linee di flusso ha la forma:
Le caratteristiche di un mezzo continuo (campo di velocità, campo di pressione, campo di sollecitazione, ecc.), Indicate come elementi fissi immobili dello spazio geometrico (punti, linee, superfici, volumi), e questi stessi elementi sono chiamati variabili euleriane.
Per il metodo di Eulero, la velocità è una funzione di entrambe le coordinate e il tempo. Per questo motivo, l'accelerazione, così come altre quantità idromeccaniche che variano con il movimento del volume del fluido, sono espresse attraverso una forma speciale del derivato, che è in qualche modo collegato al campo di velocità. Tuttavia, questo derivato deve essere associato al movimento di particelle di un liquido o gas (sostanza). Questo derivato è chiamato pieno o sostanziale
Lezione №41 7 celle
ARGOMENTO: Proprietà dei gas. liquidi e solidi
Obiettivo della lezione: Formare idee sulla struttura della materia in vari stati di aggregazione. Spiega in termini teoria molecolare caratteristiche salienti struttura interna delle sostanze allo stato gassoso, liquido e solido.
Obiettivi della lezione:
Materiale didattico: sviluppo di conoscenze sulle proprietà meccaniche di solidi, liquidi e gas basate su idee sulla struttura molecolare della materia.
Sviluppare: continuare la formazione di abilità per stabilire relazioni causali tra fatti, fenomeni e cause che le hanno causate, avanzare ipotesi, sostenerle e verificarne l'affidabilità.
Parenting: continuare la formazione di interesse cognitivo nella materia "Fisica"
Tipo di lezione: imparare nuovo materiale
CORSO DI LEZIONE
I. Parte organizzativa (saluto, verifica della prontezza per la lezione, umore emotivo)
Ciao ragazzi Oggi continueremo ad aprire pagine nella conoscenza del mondo che ci circonda. Scoperte interessanti ci aspettano. Sei pronto? Sì! Quindi iniziamo ...
II. Definizione degli obiettivi e motivazione
Sin dai tempi antichi, l'uomo ha cercato di spiegare i fenomeni che si verificano in natura, per conoscere non solo udibile, ma anche impercettibile, non solo visibile, ma anche non visibile.
Quali tre gruppi possono essere suddivisi nelle seguenti sostanze: acqua, pietra, aria, stagno, alcool, zucchero, gas naturale, ghiaccio, ossigeno, olio vegetale, alluminio, latte, azoto (queste sostanze sono date a temperatura ambiente).
Hai diviso le sostanze in tre gruppi: solido, liquido e gassoso. Siamo abituati a vederne molti in ogni stato. Ad esempio, ferro - in solido, olio vegetale - in liquido, idrogeno - in gassoso. Tuttavia, ci sono quelli che nella nostra vita si trovano in tre stati contemporaneamente, QUALE? per esempio, acqua: stato solido di acqua - ghiaccio, liquido - acqua, gassoso - vapore acqueo. Proviamo a capire come queste sostanze differiscono l'una dall'altra.
Come pensi che possa sembrare il tema della nostra lezione?
L'argomento della nostra lezione oggi
« Le proprietà dei gas liquidi e solidi» .- scrivere su un quaderno
Quale pensi sarà il nostro obiettivo in questa lezione?
L'obiettivo che ci prefiggiamo oggi è scoprire quali proprietà hanno solidi, liquidi e gas, spiegare queste proprietà in base alla conoscenza delle differenze nella posizione, nel movimento e nell'attrazione delle molecole.
Scrivere su una lavagna (obiettivo per gli studenti)
Proprietà di solidi, liquidi e corpi gassosi
La disposizione di molecole in solidi, liquidi e corpi gassosi
Il movimento di molecole in corpi solidi, liquidi e gassosi
L'interazione di molecole di corpi solidi, liquidi e gassosi
III. Assimilazione primaria di nuove conoscenze
Per sistematizzare le nostre conoscenze sulla struttura della materia, le proprietà dei corpi nei diversi stati di aggregazione, compila la tabella: (modulo per bambini sul tavolo)
Compiti di ricerca
Compito 1: "Studio delle proprietà dei gas." Attrezzatura: palloncino, siringa medica, conduci un esperimento e rispondi alle domande:
1. Gonfiare la palla. Quale parte della palla riempie l'aria? Qual è la forma del gas?
2. Stringere la palla a mano (cambiarne la forma). Il volume dell'aria è preservato? La sua forma è stata preservata?
3. Riempire la siringa con aria estraendo il pistone. Chiudi il foro con un dito e prova a strizzarlo. Il gas è facile da comprimere?
Compito 2: "Studio delle proprietà dei liquidi." Attrezzatura: una nave con acqua, un becher, 2-3 navi di varie forme, una siringa medica. Conduci un esperimento e rispondi alle domande:
1. Misurare il volume del liquido con un becher?
2. Versare acqua in recipienti di varie forme? Quale parte della nave riempie il fluido? Il fluido mantiene la sua forma?
3. Misurare nuovamente il volume del fluido. Il suo volume è cambiato?
4. Riempi la siringa con acqua. Chiudi il foro con un dito e prova a strizzarlo. È facile comprimere il fluido?
Compito 3: "Studio delle proprietà dei solidi." Attrezzatura: una serie di solidi di diverse sostanze (metallo, legno, plastica, ecc.) Conduci un esperimento e rispondi alle domande: I solidi hanno la loro forma? 2. Mantengono il loro volume?
3. Prova a stringere il corpo con la mano. È facile spremerlo?
Sulla base dei risultati della ricerca, compila la tabella
Non ha formaNon risparmia volume
comprimere
Non ha forma
Salva il volume
Non comprimibile
fluido
Salva modulo
Salva il volume
Non comprimibile
Disposizione molecolare
A grande distanza l'uno dall'altro, caoticamente
Strettamente imballato, ad es. a breve distanza l'uno dall'altro
Ordinato, formando un reticolo cristallino
Movimento della molecola
Muoversi liberamente in tutto il volume
Esitando sul posto, saltando da un posto all'altro
Esitare sul posto, vicino a una posizione di equilibrio
Interazione molecolare
povero
forte
Molto forte
Quali proprietà dei solidi conosci? Mantieni forma e volume
Quali proprietà dei liquidi conosci? Mantieni il volume, ma cambia facilmente forma
Quali proprietà dei gas conosci? Non conservare forma e volumeProprietà dei solidi.
Qual è la condizione dei corpi che ci circondano: scrivanie, libri, quaderni? (Solid)
Considera alcuni solidi.
Che forma hanno? (corretto, parallelepipedo, cilindro)
Proviamo a cambiare la loro forma: spremere o allungare. È facile farlo? (N)
Possiamo determinare il volume di solidi? Definire il volume della scatola.
conclusione: I solidi mantengono la loro forma e volume. (Scrivere l'output sulla lavagna e nella tabella).
Proprietà dei liquidi.
Ora definiamo le proprietà dei liquidi. Possiamo trasferirlo in varie navi. (L'insegnante versa acqua in vasi di varie forme, la prima e l'ultima volta in bicchieri, per determinare il volume)
Cosa succede alla forma liquida? (sta cambiando)
In che forma prende il liquido ogni volta? (forma della nave)
Il volume del fluido è cambiato? (No)
conclusione: il fluido cambia facilmente forma ma mantiene il volume. (Scrivere l'output sulla lavagna e nella tabella). Queste proprietà liquide sono utilizzate nella fabbricazione di prodotti in vetro.
Le proprietà dei gas
Scopri quali proprietà hanno i gas. Esperienza con una palla di gomma: bendare la palla al centro con un filo, gonfiare una metà con aria, quindi tagliare il filo. L'aria occupa l'intero pallone.
Pertanto, i gas occupano l'intero volume fornito. Ora prova a spremere la palla. Ci siamo riusciti facilmente.
Cosa possiamo dire delle proprietà dei gas?
conclusione: Il gas occupa l'intero volume fornito ed è facilmente comprimibile. (Registra l'output nella tabella)
Come possono essere spiegate queste proprietà? Dopotutto, acqua, ghiaccio, vapore acqueo sono stati della stessa sostanza, il che significa che le molecole non differiscono l'una dall'altra. Pertanto, dobbiamo scoprire come si trovano queste molecole e come si muovono.
Gaza. Poiché i gas riempiono l'intero volume fornito, non hanno forma e sono facilmente compressi, si dovrebbe presumere che la distanza tra le molecole sia molte volte maggiore delle molecole stesse, non sono quasi attratte e si muovono liberamente. Ciò è dimostrato anche dalla diffusione, che si verifica più rapidamente nei gas che nei liquidi e nei solidi. Ma se i gas sono fortemente compressi o raffreddati, diventano liquidi. (Scrivere l'output sulla lavagna e nella tabella).
Liquido. I liquidi non mantengono la loro forma, possono fluire, sono facili da traboccare. Ma spremerli è difficile. Ciò può essere spiegato solo dal fatto che per qualsiasi approccio delle molecole tra loro, si verifica repulsione, perché le molecole si trovano una vicino all'altra, la distanza tra loro è paragonabile alla dimensione delle molecole. Cambiano il loro posto in modo irregolare - "salta". (Scrivere l'output sulla lavagna e nella tabella).
Solidi. I solidi mantengono forma e volume. Ciò significa che le molecole si trovano a distanze paragonabili alle dimensioni delle molecole. Le molecole sono disposte in ordine, formando un reticolo cristallino, mentre oscillano attorno ad un certo punto. (Scrivere l'output sulla lavagna e nella tabella).
Lavora con il libro di testo sul disegno (28,6 p. 125).
4. La fase di generalizzazione e consolidamento di nuovo materiale
È possibile riempire una nave di gas a metà del suo volume? Perché?
Possono essere allo stato liquido a temperatura ambiente: ossigeno?
Possono essere allo stato gassoso a temperatura ambiente: ferro?
In una gelida giornata invernale, la nebbia si formò sopra un assenzio nel fiume. Qual è lo stato della sostanza?
Nella stanza in cui si trova la candeggina, si sente sempre il suo odore. Spiegare in quali condizioni si trova la candeggina?
5. La fase finale
Cosa abbiamo appreso sulle proprietà dei corpi nei vari stati di aggregazione?
Come possono essere spiegate queste proprietà, data la struttura molecolare della sostanza?
6. Riflessione
Nella lezione ho lavoratoattivo / passivo
Con il mio lavoro durante la lezione, io
soddisfatto / non soddisfatto
La lezione mi è sembrata
corto / lungo
Per la lezione i
non stanco / stanco
Il mio umore
migliorò / peggiorò
Il materiale della lezione è stato
capito / non capito
utile / inutile
interessante / noioso
Penso ai compiti
facile / difficile
interessante / non interessante
Le risposte sottolineano
D / s p 28.29, exp posteriore p. 127
RISERVA Domande:
Perché i gas non trattengono il volume e sono facilmente compressi? (La distanza tra le molecole è grande, le forze attrattive sono deboli, quindi le molecole vengono facilmente rimosse l'una dall'altra e altrettanto facilmente si uniscono.
Perché i gas non hanno forma e riempiono l'intero volume fornito? (Il motivo è la libera circolazione delle molecole e la loro debole attrazione)
Perché i liquidi trattengono il volume? (L'interazione tra le molecole è ottima, quindi non sono in grado di "staccarsi" l'una dall'altra)
Perché i liquidi non sono modellati e scorre? (Le molecole liquide sono mobili, sono in grado di saltare da un posto all'altro. Nel caso in cui una forza esterna agisca sul liquido, ad esempio l'attrazione verso la Terra, i salti di particelle si verificheranno principalmente nella direzione della sua azione (cioè verso il basso).
Cosa spiega l'incomprimibilità dei liquidi? (La distanza tra le molecole è piuttosto piccola. All'avvicinarsi, le forze repulsive aumentano bruscamente, non permettendo alle molecole di unirsi)
Perché i solidi mantengono la loro forma? (La ragione sta nella natura del movimento delle molecole. Oscillano attorno alle posizioni di equilibrio e non possono muoversi liberamente)
Perché i solidi mantengono il loro volume? (L'interazione tra le molecole del solido è enorme, quindi non possono staccarsi)
Cosa spiega la non compressibilità dei solidi? (La distanza tra le molecole è piccola (commisurata alla dimensione delle molecole). Quando si avvicinano, le forze repulsive aumentano bruscamente, impedendo alle molecole di avvicinarsi).
