În lecția 5" Formula chimică"de la curs" Chimie pentru manechine» vom defini formulele chimice și indicii acestora și, de asemenea, vom afla diferențele dintre formulele chimice ale moleculare și structură nemoleculară. Permiteți-mi să vă reamintesc că în ultima lecție „” am definit compușii chimici, am analizat diferențele dintre compușii organici și anorganici și am aflat, de asemenea, ce înseamnă compoziția calitativă și cantitativă.
Compoziția oricărei substanțe este exprimată ca formula chimica.
Formula chimică este o notație convențională a compoziției unei substanțe folosind simboluri și indici chimici.
Compoziția calitativă este prezentată folosind semnele (simbolurile) elementelor chimice, iar compoziția cantitativă - folosind indici care sunt înscriși în dreapta și chiar sub semnele elementelor chimice.
Index- numărul de atomi ai unui dat element chimicîn formula unei substanţe.
De exemplu, formula chimică a substanței simple hidrogen este scrisă după cum urmează:
și citește „cenușă-doi”.
Formule chimice ale substanțelor cu structură moleculară
Formule ale moleculelor diatomice: oxigen - O 2 ("o-doi"), clor - Cl 2 ("clor-doi"), azot - N 2 ("en-doi"). Molecula triatomică de ozon și molecula de sulf cu opt atomi sunt desemnate prin formulele O 3 („o-trei”) și S 8 („es-opt”).
Formulele moleculelor de substanțe complexe reflectă, de asemenea, compoziția lor calitativă și cantitativă. De exemplu, formula apei, după cum probabil știți deja bine, este H 2 O ("cenusa-două-o"), metanul este CH 4 ("tse-cenusa-patru"), iar amoniacul este NH 3 (" en- cenuşă-trei"). Formulele oricăror substanțe complexe sunt citite în același mod. De exemplu, formula acidului sulfuric este H 2 SO 4 ("cenusa-doua-es-o-patru"), iar cea a glucozei este C 6 H 12 O 6 ("tse-six-ash-doisprezece-o- şase").
Formule chimice substanțe cu structură moleculară (se numesc formule moleculare) arată compoziția părților elementare, adică „cărămizile” convenționale din care sunt compuse aceste substanțe. Astfel de componente elementare ( unități structurale elementare, sau doar unități structurale) în acest caz sunt molecule.
Ce se întâmplă dacă substanța are o structură nemoleculară? Formule chimice substanțe simple de acest tip (de exemplu, metalele) se scriu pur și simplu cu semnele elementelor corespunzătoare fără indice (sau, mai corect, cu indice, egal cu unu, care nu este înregistrat). Astfel, formula substanței simple a fierului este Fe, cuprul este Cu, aluminiul este Al.
Compoziția substanțelor complexe cu structură nemoleculară este exprimată folosind formule care arată cel mai simplu raport al numerelor atomice diferite elemente chimice din aceste substanţe. Astfel de formule sunt numite cel mai simplu. De exemplu, cea mai simplă formulă pentru cuarț - componenta principală a nisipului de râu - este SiO2. Acesta arată că într-un cristal de cuarț există doi atomi de oxigen pe atom de siliciu, adică cel mai simplu raport al numărului de atomi de siliciu și de oxigen din această substanță este 1:2. Cea mai simplă formulă Al 2 O 3 arată că în acest compus cel mai simplu raport dintre numărul de atomi de aluminiu și oxigen este 2:3.
Un grup de atomi a cărui compoziție corespunde celei mai simple formule a unei substanțe cu structură nemoleculară se numește ei unitate de formulă.
Unitatea de formulă, sare de masă NaCl („clorul de sodiu”) este un grup format din un atom de sodiu și un atom de clor. Unitatea de formulă de cretă CaCO 3 („calciu-ce-o-trei”) este un grup de un atom de calciu, un atom de carbon și trei atomi de oxigen.
Formulele compușilor mai complecși cu structură nemoleculară sunt citite în mod similar. În plus, este indicat doar numărul de grupe de atomi cuprinse între paranteze: Al 2 (SO 4 ) 3 („aluminiu-de două-es-o-patru-trei ori”), Mg(NO 3) 2 („magneziu-en -o-trei -de două ori"), etc.
Astfel, unități structurale ale substanțelor structura moleculara sunt molecule. Unitățile structurale ale substanțelor structură nemoleculară sunt ale lor unități de formulă .
Tabelul de mai jos prezintă notarea formulei și reprezentarea schematică a compoziției substanțelor de diferite tipuri.
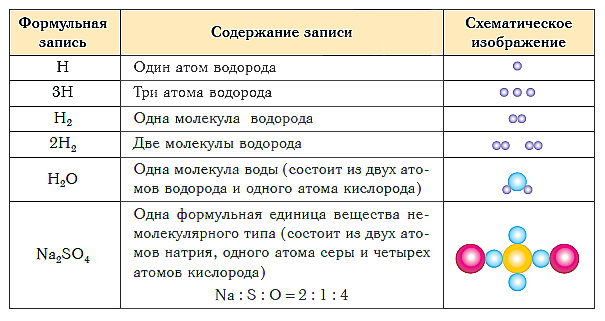
Scurte concluzii ale lecției:
- Compoziția calitativă și cantitativă a unei substanțe este exprimată folosind formule chimice.
- Formula chimică a unei substanțe cu structură moleculară arată compoziția moleculei sale, care este unitatea structurală elementară a acestei substanțe.
- Formula chimică a unei substanțe cu structură nemoleculară arată cel mai simplu raport de atomi din unitatea sa de formulă.
Lecția de speranță 5" Formula chimică„A fost clar și informativ. Dacă aveți întrebări, scrieți-le în comentarii.
Clasificare substante anorganice iar nomenclatura lor se bazează pe cea mai simplă și mai constantă caracteristică în timp - compozitia chimica , care arată atomii elementelor care formează o substanță dată în raportul lor numeric. Dacă o substanță este formată dintr-un atom, adică este forma de existenta a acestui element in forma libera, atunci se numeste simplu substanţă; dacă substanţa este formată din doi atomi sau Mai mult elemente, atunci se numește substanță complexă. Toate substanțele simple (cu excepția celor monoatomice) și toate substanțele complexe sunt de obicei numite compuși chimici , deoarece în ele atomii aceluiași sau ai elementelor diferite sunt legați unul de celălalt legături chimice.
Nomenclatura substanțelor anorganice este formată din formule și denumiri. Formula chimică - reprezentarea compoziției unei substanțe folosind simboluri ale elementelor chimice, indici numerici și alte semne. Denumirea chimică - imaginea compoziției unei substanțe folosind un cuvânt sau un grup de cuvinte. Construcția formulelor și numelor chimice este determinată de sistem reguli de nomenclatură.
Simbolurile și denumirile elementelor chimice sunt date în Tabelul periodic al elementelor de D.I. Mendeleev. Elementele sunt împărțite în mod convențional în metale Şi nemetale . Nemetalele includ toate elementele din grupa VIIIA (gaze nobile) și din grupa VIIA (halogeni), elementele din grupa VIA (cu excepția poloniului), elementele azot, fosfor, arsen (grupa VA); carbon, siliciu (grupa IVA); bor (grup IIIA), precum și hidrogen. Elementele rămase sunt clasificate ca metale.
La compilarea denumirilor de substanțe, se folosesc de obicei denumiri rusești de elemente, de exemplu, dioxigen, difluorura de xenon, selenat de potasiu. În mod tradițional, pentru unele elemente, rădăcinile numelor lor latine sunt introduse în termeni derivați:
De exemplu: carbonat, manganat, oxid, sulfură, silicat.
Titluri substanțe simple consta dintr-un cuvânt - numele unui element chimic cu un prefix numeric, de exemplu:
 Sunt folosite următoarele prefixe numerice:
Sunt folosite următoarele prefixe numerice:
 Un număr nedefinit este indicat printr-un prefix numeric n- poli.
Un număr nedefinit este indicat printr-un prefix numeric n- poli.
Pentru unele substanțe simple se folosesc și ei special denumiri precum O 3 - ozon, P 4 - fosfor alb.
Formule chimice substanțe complexe alcătuit din desemnare electropozitiv(cationi condiționali și reali) și electronegativ(anioni condiționali și reali), de exemplu, CuSO 4 (aici Cu 2+ este un cation real, SO 4 2- este un anion real) și PCl 3 (aici P +III este un cation condiționat, Cl -I este un anion condiționat).
Titluri substanțe complexe compuse după formule chimice de la dreapta la stânga. Ele sunt formate din două cuvinte - numele componentelor electronegative (în cazul nominativ) și ale componentelor electropozitive (în cazul genitiv), de exemplu:
CuSO 4 - sulfat de cupru(II).
PCl 3 - triclorura de fosfor
LaCl3 - clorură de lantan(III).
CO - monoxid de carbon
Numărul de componente electropozitive și electronegative din nume este indicat de prefixele numerice date mai sus ( metoda universala), sau stări de oxidare (dacă pot fi determinate prin formulă) folosind numere romane între paranteze (semnul plus este omis). În unele cazuri, încărcarea ionilor este dată (pentru cationi și anioni de compoziție complexă), folosind cifre arabe cu semnul corespunzător.
Următoarele denumiri speciale sunt utilizate pentru cationii și anionii multielement comuni:
Pentru un număr mic de substanțe cunoscute se mai folosește special titluri:
![]() 1. Hidroxizi acizi și bazici. Săruri
1. Hidroxizi acizi și bazici. Săruri
Hidroxizii sunt un tip de substanțe complexe care conțin atomi ai unui element E (cu excepția fluorului și oxigenului) și grupări hidroxil OH; formula generală a hidroxizilor E(OH) n, Unde n= 1÷6. Forma hidroxizilor E(OH) n numit orto-formă; la n> 2 hidroxid poate fi găsit și în meta-formă, care include, pe lângă atomii E și grupările OH, atomii de oxigen O, de exemplu E(OH) 3 și EO(OH), E(OH) 4 și E(OH) 6 și EO 2 (OH) 2 .
Hidroxizii sunt împărțiți în două grupe cu proprietăți chimice opuse: hidroxizi acizi și bazici.
^ Hidroxizi acizi conțin atomi de hidrogen, care pot fi înlocuiți cu atomi de metal supuși regulii valenței stoechiometrice. Majoritatea hidroxizilor acizi se găsesc în meta-formă, iar atomii de hidrogen din formulele hidroxizilor acizi sunt dați pe primul loc, de exemplu, H 2 SO 4 , HNO 3 și H 2 CO 3, și nu SO 2 (OH) 2, NO 2 (OH) și CO ( OH) 2. Formula generală a hidroxizilor acizi este H X EO la, unde componenta electronegativă EO la X- numit reziduu acid. Dacă nu toți atomii de hidrogen sunt înlocuiți cu un metal, atunci ei rămân ca parte a reziduului acid.
Denumirile hidroxizilor acizi obișnuiți constau din două cuvinte: numele propriu cu terminația „aya” și cuvântul de grup „acid”. Iată formulele și numele proprii ale hidroxizilor acizi obișnuiți și ale reziduurilor lor acide (o liniuță înseamnă că hidroxidul nu este cunoscut sub formă liberă sau într-o soluție apoasă acidă):
Hidroxizii acizi mai puțin obișnuiți sunt denumiți conform regulilor de nomenclatură pentru compuși complecși, de exemplu:
 Numele reziduurilor acide sunt folosite pentru a construi numele sărurilor.
Numele reziduurilor acide sunt folosite pentru a construi numele sărurilor.
^ Hidroxizi bazici conțin ioni de hidroxid, care pot fi înlocuiți cu reziduuri acide supuse regulii valenței stoechiometrice. Toți hidroxizii bazici se găsesc în orto-formă; formula lor generală este M(OH) n, Unde n= 1,2 (mai rar 3,4) și M n+ - cation metalic. Exemple de formule și denumiri de hidroxizi bazici:
 Cea mai importantă proprietate chimică a hidroxizilor bazici și acizi este interacțiunea lor între ei pentru a forma săruri ( reacție de formare a sării), De exemplu:
Cea mai importantă proprietate chimică a hidroxizilor bazici și acizi este interacțiunea lor între ei pentru a forma săruri ( reacție de formare a sării), De exemplu:
Ca(OH)2 + H2SO4 = CaS04 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2S04(OH)2 + 2H2O
Sărurile sunt un tip de substanțe complexe care conțin cationi M n+ și reziduuri acide*.
Săruri cu formula generală M X(EO la) n numit medie săruri și săruri cu atomi de hidrogen nesubstituiți - acru săruri. Uneori, sărurile conțin și ioni de hidroxid și/sau oxid; astfel de săruri se numesc principal săruri. Iată exemple și denumiri de săruri:
 Sărurile acide și bazice pot fi transformate în săruri medii prin reacția cu hidroxidul bazic și acid adecvat, de exemplu:
Sărurile acide și bazice pot fi transformate în săruri medii prin reacția cu hidroxidul bazic și acid adecvat, de exemplu:
Ca(HS04)2 + Ca(OH) = CaS04 + 2H2O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Există, de asemenea, săruri care conțin doi cationi diferiți: sunt adesea numite săruri duble, De exemplu:
 2. Oxizi acizi și bazici
2. Oxizi acizi și bazici
Oxizii E X DESPRE la- produse de deshidratare completa a hidroxizilor:
 Hidroxizi acizi (H2SO4, H2CO3) raspund oxizii acizi(SO 3, CO 2) și hidroxizi bazici (NaOH, Ca(OH) 2) - oxizi bazici(Na 2 O, CaO), iar starea de oxidare a elementului E nu se schimbă la trecerea de la hidroxid la oxid. Exemple de formule și denumiri de oxizi:
Hidroxizi acizi (H2SO4, H2CO3) raspund oxizii acizi(SO 3, CO 2) și hidroxizi bazici (NaOH, Ca(OH) 2) - oxizi bazici(Na 2 O, CaO), iar starea de oxidare a elementului E nu se schimbă la trecerea de la hidroxid la oxid. Exemple de formule și denumiri de oxizi:
 Oxizii acizi și bazici păstrează proprietățile de formare de sare ale hidroxizilor corespunzători atunci când interacționează cu hidroxizi cu proprietăți opuse sau între ei:
Oxizii acizi și bazici păstrează proprietățile de formare de sare ale hidroxizilor corespunzători atunci când interacționează cu hidroxizi cu proprietăți opuse sau între ei:
N2O5 + 2NaOH = 2NaNO3 + H2O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
^ 3. Oxizi și hidroxizi amfoteri
Amfoteritate hidroxizi și oxizi - o proprietate chimică constând în formarea a două rânduri de săruri de către aceștia, de exemplu, pentru hidroxid de aluminiu și oxid de aluminiu:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Astfel, hidroxidul și oxidul de aluminiu în reacțiile (a) prezintă proprietățile principal hidroxizi și oxizi, adică reacționează cu hidroxizi și oxid acizi, formând sarea corespunzătoare - sulfat de aluminiu Al 2 (SO 4) 3, în timp ce în reacțiile (b) prezintă și proprietățile acid hidroxizi și oxizi, adică reacţionează cu hidroxidul şi oxidul bazic, formând o sare - dioxoaluminat de sodiu (III) NaAlO 2. În primul caz, elementul aluminiu prezintă proprietatea unui metal și face parte din componenta electropozitivă (Al 3+), în al doilea - proprietatea unui nemetal și face parte din componenta electronegativă a formulei sării ( AlO 2 -).
Dacă aceste reacții apar într-o soluție apoasă, atunci compoziția sărurilor rezultate se schimbă, dar prezența aluminiului în cation și anion rămâne:
2Al(OH)3 + 3H2S04 = 2 (SO4)3
Al(OH)3 + NaOH = Na
Aici, ionii complecși 3+ - cationul hexaacualuminiu(III), - - ionul tetrahidroxoaluminat(III) sunt evidențiați între paranteze drepte.
Elementele care prezintă proprietăți metalice și nemetalice în compuși sunt numite amfotere, acestea includ elemente din grupele A din Tabelul Periodic - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po etc., ca precum și majoritatea elementelor grupelor B - Cr, Mn, Fe, Zn, Cd, Au etc. Oxizii amfoteri sunt numiți la fel ca și cei de bază, de exemplu:
 Hidroxizii amfoteri (dacă starea de oxidare a elementului depășește + II) pot fi găsiți în orto- sau (și) meta- forma. Iată exemple de hidroxizi amfoteri:
Hidroxizii amfoteri (dacă starea de oxidare a elementului depășește + II) pot fi găsiți în orto- sau (și) meta- forma. Iată exemple de hidroxizi amfoteri:
 Oxizii amfoteri nu corespund întotdeauna hidroxizilor amfoteri, deoarece atunci când se încearcă obținerea acestora din urmă, se formează oxizi hidratați, de exemplu:
Oxizii amfoteri nu corespund întotdeauna hidroxizilor amfoteri, deoarece atunci când se încearcă obținerea acestora din urmă, se formează oxizi hidratați, de exemplu:
 Dacă un element amfoter dintr-un compus are mai multe stări de oxidare, atunci amfoteritatea oxizilor și hidroxizilor corespunzători (și, în consecință, amfoteritatea elementului însuși) va fi exprimată diferit. Pentru stările de oxidare scăzută, hidroxizii și oxizii prezintă o predominanță a proprietăților de bază, iar elementul în sine are proprietăți metalice, deci este aproape întotdeauna inclus în cationi. Pentru grade înalte oxidarea, dimpotrivă, hidroxizii și oxizii au o predominanță a proprietăților acide, iar elementul în sine are proprietăți nemetalice, deci este aproape întotdeauna inclus în compoziția anionilor. Astfel, oxidul și hidroxidul de mangan(II) au proprietăți de bază dominante, iar manganul însuși face parte din cationii de tip 2+, în timp ce oxidul și hidroxidul de mangan(VII) au proprietăți acide dominante, iar manganul însuși face parte din MnO 4 - tip anion. Hidroxizilor amfoteri cu o mare predominanță a proprietăților acide li se atribuie formule și denumiri modelate după hidroxizi acizi, de exemplu HMn VII O 4 - acid mangan.
Dacă un element amfoter dintr-un compus are mai multe stări de oxidare, atunci amfoteritatea oxizilor și hidroxizilor corespunzători (și, în consecință, amfoteritatea elementului însuși) va fi exprimată diferit. Pentru stările de oxidare scăzută, hidroxizii și oxizii prezintă o predominanță a proprietăților de bază, iar elementul în sine are proprietăți metalice, deci este aproape întotdeauna inclus în cationi. Pentru grade înalte oxidarea, dimpotrivă, hidroxizii și oxizii au o predominanță a proprietăților acide, iar elementul în sine are proprietăți nemetalice, deci este aproape întotdeauna inclus în compoziția anionilor. Astfel, oxidul și hidroxidul de mangan(II) au proprietăți de bază dominante, iar manganul însuși face parte din cationii de tip 2+, în timp ce oxidul și hidroxidul de mangan(VII) au proprietăți acide dominante, iar manganul însuși face parte din MnO 4 - tip anion. Hidroxizilor amfoteri cu o mare predominanță a proprietăților acide li se atribuie formule și denumiri modelate după hidroxizi acizi, de exemplu HMn VII O 4 - acid mangan.
Astfel, împărțirea elementelor în metale și nemetale este condiționată; Între elementele (Na, K, Ca, Ba etc.) cu proprietăți pur metalice și elementele (F, O, N, Cl, S, C etc.) cu proprietăți pur nemetalice, există un grup mare de elemente cu proprietăți amfotere.
4. Compuși binari
Un tip larg de substanțe complexe anorganice sunt compuși binari. Aceștia includ, în primul rând, toți compușii cu două elemente (cu excepția oxizilor bazici, acizi și amfoteri), de exemplu H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC2, SiH4. Componentele electropozitive și electronegative ale formulelor acestor compuși includ atomi individuali sau grupuri legate de atomi ale aceluiași element.
Substanțele cu mai multe elemente, în formulele cărora unul dintre componente conține atomi neînrudiți ai mai multor elemente, precum și grupuri de atomi cu un singur element sau cu mai multe elemente (cu excepția hidroxizilor și sărurilor), sunt considerate compuși binari, de exemplu CSO, IO 2F3, SBr02F, Cr0(02)2, PSI3, (CaTi)03, (FeCu)S2, Hg(CN)2, (PF3)20, VC12 (NH2). Astfel, CSO poate fi considerat un compus CS 2 în care un atom de sulf este înlocuit cu un atom de oxigen.
Numele compușilor binari sunt construite conform regulilor obișnuite de nomenclatură, de exemplu:
 Pentru unii compuși binari, sunt folosite nume speciale, a căror listă a fost dată mai devreme.
Pentru unii compuși binari, sunt folosite nume speciale, a căror listă a fost dată mai devreme.
Proprietăți chimice compușii binari sunt destul de diverși, așa că sunt adesea împărțiți în grupuri sub numele de anioni, adică Halogenurile, calcogenurile, nitrururile, carburile, hidrurile etc. sunt considerate separat Dintre compușii binari se numără și cei care au unele caracteristici ale altor tipuri de substanțe anorganice. Astfel, compușii CO, NO, NO 2 și (Fe II Fe 2 III) O 4, ale căror denumiri sunt construite folosind cuvântul oxid, nu pot fi clasificați ca oxizi (acizi, bazici, amfoteri). Monoxidul de carbon CO, monoxidul de azot NO și dioxidul de azot NO 2 nu au hidroxizi acizi corespunzători (deși acești oxizi sunt formați din nemetale C și N) și nici nu formează săruri ai căror anioni ar include atomii C II, N II și N IV. Oxid dublu (Fe II Fe 2 III) O 4 - difier(III)-oxid de fier(II), deși conține atomi ai elementului amfoter - fier în componenta electropozitivă, dar în două grade diferite oxidare, în urma căreia, atunci când interacționează cu hidroxizi acizi, formează nu una, ci două săruri diferite.
Compușii binari precum AgF, KBr, Na2S, Ba(HS)2, NaCN, NH4Cl și Pb(N3)2 sunt formați, ca sărurile, din cationi și anioni reali, motiv pentru care sunt numiți. asemănătoare cu sare compuși binari(sau doar săruri). Ele pot fi considerate produse ale substituției atomilor de hidrogen în compușii HF, HCl, HBr, H2S, HCN și HN3. Acestea din urmă într-o soluție apoasă au o funcție acidă și, prin urmare, soluțiile lor se numesc acizi, de exemplu HF (aqua) - acid fluorhidric, H 2 S (aqua) - acid hidrosulfurat. Cu toate acestea, ei nu aparțin tipului de hidroxizi acizi, iar derivații lor nu aparțin sărurilor din clasificarea substanțelor anorganice.
TEST DE CHIMIE
14. Ce cantitate de Cr(OH)3 conține același număr de echivalenți ca 174,96 g de Mg(OH)2?
Masa molară a hidroxidului de magneziu este de 58,32 g/mol, iar masa echivalentă este de 29,16 g/mol. Prin urmare, o masă de hidroxid de magneziu de 174,96 g conține 174,96 g: 29,16 g/mol = 6 echiv mol.
Masa molară a echivalentului de hidroxid de crom (III) este 1/3 M Cr(OH)3 sau 34,34 g/mol, iar 6 mol-echiv din această substanță va fi 34,33 g/mol x 6 mol = 205,98 g.
Astfel, 205,98 g de Cr(OH)3 conțin același număr de echivalenți ca 174,96 g de Mg(OH)2.
34. Câte și ce valori poate lua numărul cuantic magnetic m l cu numărul cuantic orbital l=0,1,2,3? În ce elemente se află tabel periodic se numesc elemente s-, p-, d-, f-? Dați exemple
Numărul de valori ale numărului cuantic magnetic depinde de numărul cuantic orbital și este egal cu
(21 + 1), unde 1 este numărul cuantic orbital. Prin urmare, când l=0m l =0,
la l=1m l ia valori -1,0, +1;
la 1=2m l ia valorile -2,-1, 0,+1,+2;
la =3m l poate lua valori -3,-2,-1, 0, +1,+2,+3.
Elementele chimice din atomii cărora orbitalii s-, p-, d-, f- sunt umpluți cu electroni, respectiv, se numesc elemente s-, p-, d-, f-.
De exemplu, elementele s includ H, He, precum și metale alcaline și alcalino-pământoase (metale din grupele 1A și 11A - Na, K, Rb, Be. Ca, Mg, Sg etc.)
Elementele P includ, de exemplu, elemente care completează perioade în sistemul periodic de elemente (cu excepția primei perioade) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te etc.
Elementele D includ elemente situate în perioade mari între elementele s și elementele p, de exemplu, Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh etc.
Elementele f includ lantanide, de exemplu, Ce, Nd, Pm, Sm, Eu, Gd și actinide, de exemplu, Th, U, Np, Pu, Am etc.
54. Care este cea mai scăzută stare de oxidare a hidrogenului, fluorului, sulfului și azotului? De ce? Alcătuiți formule pentru compușii de calciu cu aceste elemente în această stare de oxidare. Care sunt denumirile compușilor corespunzători?
Atomul de hidrogen are un singur electron de valență. Prin urmare, cea mai scăzută stare de oxidare a hidrogenului va fi -1 (un atom de hidrogen acceptă 1 electron de la alt element). Hidrogenul prezintă cea mai scăzută stare de oxidare +2 -1 în compusul CaH2. Acest compus se numește hidrură de calciu.
Atomul de fluor are șapte electroni de valență, până la finalizare nivelul energetic Un electron lipsește. Prin urmare, cea mai scăzută (și singura) stare de oxidare a fluorului este -1. Compușii cu fluor în această stare de oxidare +2 -1 se numesc fluoruri. De exemplu, CaF2 este fluorură de calciu.
Atomul de sulf are șase electroni de valență, lipsesc doi electroni pentru a completa nivelul de energie. Prin urmare, cea mai scăzută stare de oxidare a sulfului este -2. Compușii sulfului în această stare de oxidare +2 -2 se numesc sulfuri. De exemplu, CaS este sulfură de calciu.
Atomul de azot are cinci electroni de valență lipsesc trei electroni înainte de finalizarea pierderii de energie. Prin urmare, cea mai scăzută stare de oxidare a azotului este -3. Compușii de azot în această stare de oxidare +2 -3 se numesc nitruri. Ca3N2 este nitrură de calciu.
74. Ce ar trebui să se înțeleagă prin starea de oxidare a unui atom? Determinaţi starea de oxidare a atomului de carbon şi valenţa acestuia în compuşii: CH 4 ; CH30H; UNDC; CO2
Starea de oxidare se referă la sarcina condiționată a unui atom dintr-un compus, calculată din ipoteza că acesta este format numai din ioni. Numărul de oxidare poate fi negativ, pozitiv sau zero, reprezintă un număr întreg sau număr fracționar. Suma algebrică a stărilor de oxidare ale atomilor dintr-un compus este întotdeauna egală cu zero, iar într-un ion complex este egală cu sarcina ionului.
În compușii de carbon dați, atomul de carbon este tetravalent. Dar gradul de oxidare al atomului de carbon din acești compuși este diferit.
În metan - CH 4 - starea de oxidare a carbonului este 4.
În metanol - CH3OH - stare de oxidare a carbonului - 2 în acid formic HCOOH - stare de oxidare a carbonului +2, în dioxid de carbon - CO 2 - stare de oxidare a carbonului +4.
94. La arderea a 11,5 g de lichid alcool etilic S-a eliberat 308,71 kJ de căldură. Scrieți ecuația termochimică pentru reacția care are ca rezultat formarea vaporilor de apă și a dioxidului de carbon. Calculați căldura de formare a C 2 H 5 OH (l). Raspuns: -277,67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 mol de alcool etilic lichid are o masă de 46 g.
Pentru a compila o ecuație termochimică, să creăm proporția:
11,5 g etanol ----------- 308,71 kJ
46 g etanol ------------ x kJ
Atunci ecuația termochimică a metanului va lua forma:
C2H5OH (l) + 302 (g) = 2C02 (g) + 3H20 (p); ∆Н° = -1234,84
Scriem efectul termic al reacției cu semnul minus, deoarece căldura este eliberată în timpul reacției.
Conform legii lui Hess, efectul termic al unei reacții nu depinde de calea de tranziție, ci depinde doar de starea finală și inițială a sistemului.
∆Н° reacție = ∑∆Н° final. - ∑∆Н° retur pornire
Entalpii standard de formare materii primeși produse de reacție pe care le luăm din cartea de referință:
∆Н° eșantion CO 2 (g) = -393,51 kJ/mol,
∆Н° arr H 2 O (abur) = -241,83 kJ/mol
∆H° proba O 2 (g) = 0 kJ/mol.
∆H° arr (C 2 H 5 OH (l)) = [∆H° arr (H 2 O) *3 + ∆H° arr (CO 2) *2] - reacția ∆H° = [(-241, 83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 kJ/mol
114. Care dintre carbonaţi: BeCO3, CaCO3 sau BaCO3 - pot fi obţinute prin acţiunea oxizilor corespunzători cu CO 2? Care reacție are loc cel mai energetic? Trageți o concluzie calculând ∆G° 298 reacții
Să luăm din cartea de referință valorile standard ale energiei Gibbs ∆G° 298 pentru substanțele inițiale și produșii finali ai reacțiilor: ∆G° 298 BeO = -569,54 kJ/mol, ∆G° 298 BeCO3 = -944,75, ∆G° 298 BaO = -525,84 kJ/mol, ∆G° 298 ВаСО 3 = -1132,77 kJ/mol; ∆G° 298 CaO = -603,46 kJ/mol,
∆G° 298 CaC03 = -1128,35 kJ/mol; ∆G° 298 CO2 = -394,37 kJ/mol;
Atunci pentru reacția BeO(k) + CO 2 (g) = BeCO3(k) valoarea standard a energiei Gibbs va fi:
944,75-[(-569,54)+(-394,37)]=+19,16 kJ/mol.
Valoarea pozitivă a energiei Gibbs pentru această reacție indică faptul că, în condiții standard, această reacție se desfășoară predominant de la dreapta la stânga și cabonatul de beriliu nu poate fi obținut din BeO și CO2.
Pentru reacția BaO(k) + CO 2 (g) = BaCO3(k) valoarea standard a energiei Gibbs va fi:
1132,77-[(-525,84)+(-394,37)]=-212,56 kJ/mol/
Pentru reacția CaO(k) + CO 2 (g) = CaCO3(k) valoarea standard a energiei Gibbs va fi:
1128,35-[(-603,46)+(-394,37)]=-130,52 kJ/mol.
Valoarea energiei Gibbs pentru aceste reacții este negativă și aceste procese merg în direcția înainte, adică carbonați de calciu și bariu pot fi obținuți în acest fel. Cea mai energică reacție va avea loc între oxidul de bariu și dioxid de carbon, deoarece valoarea energiei Gibbs pentru această reacție va avea cea mai negativă valoare.
134. Echilibrul sistemului omogen 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) a fost stabilit la următoarele concentrații de reactanți mol/l: [H 2 O] p = 0,14; [CI2]p = 0,14; [HCI]P = 0,20; [02] p = 0,32. Calculați concentrațiile inițiale de acid clorhidric și oxigen
[H20] p = 0,14 mol/l
[CI2]p = 0,14 mol/l
[HCI]P = 0,20 mol/l
[02]p = 0,32 mol/l
Ref =?
ref=?
Pe baza ecuației de reacție, tot clorul (2 moli) este format din acid clorhidric (4 moli), iar toată apa se formează din acidul clorhidric și oxigen inițial.
Prin urmare, pentru a forma 0,14 moli de clor trebuie să reacționeze 0,28 moli de acid clorhidric, iar pentru a obține 0,14 moli de apă trebuie să reacționeze 0,07 moli de oxigen.
Astfel, concentrația inițială de HCI a fost de 0,20 + 0,28 = 0,48 mol/l, iar concentrația inițială de O 2 a fost egală cu 0,32 + 0,07 = 0,39 mol/l.
Răspuns: Concentrațiile inițiale de acid clorhidric și oxigen sunt 0,48 mol/L și, respectiv, 0,39 mol/L.
154. Pentru a neutraliza 1 litru de soluție care conține 1,4 g KOH, sunt necesari 50 cm 3 de soluție acidă. Calculați concentrația molară a echivalentului soluție acidă
Să găsim titrul soluției KOH:
Acum să calculăm concentrația molară a echivalentului soluției de KOH:
0,5 mol/dm 3.
174. Câte grame de uree CO(NH 2) 2 trebuie dizolvate în 75 g de apă, astfel încât temperatura de cristalizare a soluției să scadă cu 0,465°? Constanta crioscopică a apei este 1,86
Masa molară a ureei este de 60 g/mol. Scăderea temperaturii de îngheț a soluției ∆T K = 0,465 °C.
Conform legii lui Raoult, scăderea temperaturii de cristalizare a unei soluții în comparație cu temperatura de cristalizare a unui solvent pur depinde de constanta crioscopică a solventului și de concentrația molală a solutului. De aici puteți calcula masa substanței dizolvate - uree în soluție.
194. Scrieți ecuații moleculare și ion-moleculare pentru reacțiile care sunt exprimate prin ecuații ion-moleculare
Fe(OH)3 + 3 H + = Fe3+ + 3 H2O
Cd2+ + 2OH - = Cd(OH)2
H + + NO2 - =HNO2
Fe(OH) 3 (t)+ 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH)3(t) + 3H + = Fe3+ + 3H2O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
Cd 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = НNO2 + NaС1
H + +N02 - =HNO2
214. La amestecarea A12(SO4)3 şi Na2CO3, fiecare dintre sărurile luate este hidrolizată ireversibil pentru a forma baza şi acidul corespunzător. Exprimați această hidroliză comună folosind ecuații ionice și moleculare
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. Plăcile de fier și argint sunt legate printr-un conductor extern și scufundate într-o soluție de acid sulfuric. Desenați o diagramă a acestei celule galvanice și scrieți ecuații electronice pentru procesele de la anod și catod.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
Procesul Fe-2 e = Fe 2+ are loc la anod (fier), electronii trec prin conductor către placa de argint și procesul are loc pe suprafața catodului de argint
2 N + + 2 e = N 2 T.
Placa de fier se va dizolva, iar placa de argint va prezenta hidrogen.
274. Alcătuiți ecuații electronice pentru procesele care au loc pe electrozii de grafit în timpul electrolizei unei soluții de KBr. Ce masă de substanță este eliberată la catod și anod dacă electroliza se efectuează timp de 1 oră și 35 de minute la un curent de 15 A? Răspuns: 0,886 g; 70,79 g
Cu electroliza soluție apoasă bromură de potasiu cu electrozi inerți (grafit) la catod, are loc procesul de reducere a moleculelor de apă și se eliberează hidrogen:
2Н 2 О+2е =Н 2 +2О1H -
La anod are loc procesul de oxidare a ionilor de bromură și se eliberează brom: 2Br - - 2е = Br 2 Masa molară a echivalentului de hidrogen este de 1 g/mol și masa molara echivalentul de brom este 79,904 g/mol.
Apoi, conform legilor lui Faraday, se poate găsi masa de hidrogen și brom, care sunt eliberate la catod și, respectiv, anod.
294. Ce metal este mai potrivit de ales pentru protecția benzii de rulare împotriva coroziunii mantalei cablului de plumb: zinc, magneziu sau crom? De ce? Alcătuiți ecuații electronice pentru procesele anodice și catodice ale coroziunii atmosferice. Care este compoziția produselor de coroziune?
În protecția sacrificială, protectorul, un metal mai activ decât metalul structurii protejate, servește ca anod și este distrus, protejând astfel structura de distrugere. Prin urmare, cu cât potențialul metalului protector este mai negativ, cu atât protecția protectorului va fi mai eficientă. Cel mai scăzut potențial va fi pentru magneziu -2,37 V, (pentru zinc - 0,763 V; pentru crom - 0,74 V)
Deoarece mantaua cablului este realizată din plumb, perechea galvanică magneziu-plumb va avea cea mai mare diferență de potențial. Iar magneziul va servi drept cea mai bună protecție de protecție.
În timpul coroziunii atmosferice pe suprafața unui protector cu magneziu, are loc următorul proces:
2Mg – 4е = 2Mg 2+
Electronii trec prin conductor către cablul de plumb și depolarizarea oxigenului are loc pe suprafața conductorului:
O 2 + 2 H 2 O + 4е = 4 OH -
Produsul coroziunii atmosferice va fi hidroxidul de magneziu
2 Mg2+ + 4 OH- = 2 Mg(OH)2
314. Scrieţi expresii pentru constantele de instabilitate ale următorilor ioni complecşi: [Аg(СN) 2 ] - ; [Аg(NН3)2] +; [Аg(SСМ) 2 ] - . Știind că sunt, respectiv, egali cu 1,0*10 -21, 6,8*10 -8, 2,1*10 -11, indicați în ce soluție care conține acești ioni, cu o concentrație molară egală de ioni Ag +, există mai mult?
Să notăm expresiile constantei de instabilitate pentru acești ioni complecși:
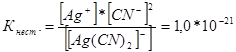
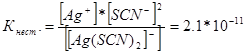
La o anumită temperatură, valoarea constantei de instabilitate este o valoare constantă. Cu cât constanta de instabilitate este mai mică, cu atât complexul este mai stabil, prin urmare cea mai mare concentrație de ioni de argint va fi într-o soluție care conține ionul complex [Аg(NНз) 2 ] +.
Literatură
1. Akhmetov N.S. Chimie generală și anorganică. M, 2002.
2. Karapetyants M.Kh., Drakin S.I. Chimie generală și anorganică. M. 1994.
3. Glinka L. I. Chimie generală. M. 1984.
