În cursul studierii temei „Fundamentele teoriei cinetice moleculare”, am examinat așa-numitele izoprocese, adică procese care au loc la unul constant dintre parametrii macroscopici (presiune, volum sau temperatură). La înlocuirea acestor date în ecuația Clapeyron, aceste condiții au modificat-o ușor. Acum vom face o analiză similară, dar cu prima lege a termodinamicii:
Să luăm în considerare cazul procesului care are loc la o temperatură constantă:
Prin urmare:
![]()
Aceasta înseamnă că prima lege a termodinamicii ia forma:
Având în vedere cazul muncii pozitive efectuate asupra unui gaz de către forțe externe:
Adică, în timpul compresiei sau expansiunii izoterme, gazul eliberează căldură în mediu.
Să luăm în considerare cazul în care procesul are loc la presiune constantă:
Deoarece niciun factor nu este inclus în nicio mărime termodinamică, niciun termen din prima lege a termodinamicii nu este resetat și își păstrează forma anterioară:
Acum să luăm în considerare ce schimbări vor avea loc în înregistrarea primei legi a termodinamicii dacă procesul are loc într-un volum fix.
Prin urmare:
![]()
Aceasta înseamnă că prima lege a termodinamicii ia forma:
Adică, sensul utilizării proceselor izocorice în motoarele termice se pierde, deoarece toată energia combustibilului ars va fi folosită pentru a schimba energie internă, iar gazul nu va face nicio lucrare utilă.
Există, de asemenea, un altul foarte proces important- adiabatic.
Definiţie.Proces adiabatic - un proces care are loc într-un sistem izolat termic. Adică fără a furniza gaz sau a elibera căldură din gaz.
Prima lege a termodinamicii ia forma:
Adică, ca urmare a muncii efectuate asupra unui gaz de către forțe externe, energia sa internă și, prin urmare, temperatura, crește, iar atunci când munca este efectuată de gaz, aceasta scade.
Următoarele experimente sunt exemple clare ale ultimelor două afirmații.
1. Un cilindru închis de un piston în mișcare conține o cantitate mică de combustibil. După apăsarea rapidă a pistonului, combustibilul se aprinde.
2. Într-un recipient închis cu dop și filetat cu un furtun de pompă, există o cantitate mică de apă. După ce o anumită cantitate de aer este pompată în vas, dopul zboară rapid și se observă ceață în vas (Fig. 1).


Orez. 1. Exemple ilustrative procese adiabatice ()
În două cazuri, gazul efectuează lucrări de semn diferit și, prin urmare, modificarea energiei interne și a temperaturii are semne diferite. În ambele cazuri, se pune accent pe o schimbare rapidă a volumului deoarece este imposibil să se creeze un sistem perfect izolat, dar dacă luăm în considerare un proces foarte tranzitoriu, atunci căldura nu va avea timp să fie transferată, iar procesul poate fi luat în considerare. adiabatic.
Graficul proceselor adiabatice în Coordonatele P-V arată astfel (Fig. 2).
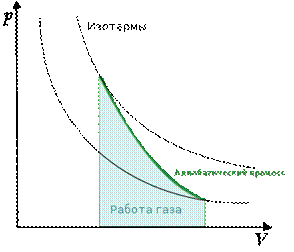
Orez. 2. Graficul procesului adiabatic ()
Începând de la următoarea lecție, trecem la studiul unei noi secțiuni de fizică - electrostatica.
Referințe
- Myakishev G.Ya., Sinyakov A.Z. Fizica moleculară. Termodinamica. - M.: Dropia, 2010.
- Gendenshtein L.E., Dick Yu.I. Fizica clasa a X-a. - M.: Ilexa, 2005.
- Kasyanov V.A. Fizica clasa a X-a. - M.: Dropia, 2010.
- Flash-fizika.narod.ru ().
- Youtube.com().
- Nashaucheba.ru ().
Teme pentru acasă
- Pagină 82: nr. 635-639. Fizică. Cartea cu probleme. 10-11 clase. Rymkevici A.P. - M.: Butard, 2013. ()
- Odată cu expansiunea adiabatică a 64 g de oxigen în condiții normale, temperatura a crescut de 2 ori. Câtă muncă a fost făcută de gaz?
- Determinați cantitatea de căldură transmisă la 2 kg de heliu la un volum constant dacă temperatura acestuia a crescut cu 100 K. Cât de mult s-a schimbat energia internă a gazului și câtă muncă a fost efectuată de acesta?
- * De ce, dacă dărâmați robinetul unui cilindru cu aer comprimat, apare îngheț pe gâtul cilindrului?
Conform primei legi a termodinamiciiΔ U =Q+O.
Izoprocesele izoterme, izocorice și izobarice sunt utilizate pe scară largă în tehnologie. Aşa, legea lui Gay-Lussac formează baza pentru structura termometrelor cu gaz; legea lui Charles„funcționează” în dispozitive numite autoclave etc. Termodinamica studiază un alt proces care este utilizat pe scară largă în practică, în special în motoarele termice. Acesta este așa-numitul proces adiabatic.
Proces adiabatic este un proces termodinamic care are loc într-un sistem izolat termic, adică în absența schimbului de căldură cu corpurile înconjurătoare.
Pentru că în acest caz Q = 0 , apoi, în conformitate cu prima lege a termodinamicii, toată munca efectuată are drept scop modificarea energiei interne a sistemului: A=Δ U.
Desigur, în condiții reale este aproape imposibil să se obțină un astfel de rezultat, deoarece nu există izolatori termici ideali. Dar există mai multe moduri de a aborda această afecțiune. De exemplu, pentru a crea cochilii cu conductivitate termică scăzută (după principiul unui termos) sau pentru a efectua procesul atât de repede încât schimbul de căldură între sistem și corpurile înconjurătoare ar fi de scurtă durată și ar putea fi neglijat.
La compresie adiabatică Ga-pentru toată munca efectuată duce la creșterea energiei interne a corpului:O = Δ U.La expansiunea adiabatică gazO'= — Δ U,adică gazul funcționează reducându-și propria energie internă.
De exemplu, compresia rapidă a unui gaz determină o creștere a energiei interne, care este egală cu cantitatea de muncă efectuată O, iar gazul se încălzește. În special, arderea spontană a amestecului de combustibil din motoarele diesel se bazează pe acest fenomen. Și invers, dacă gazul însuși efectuează lucru datorită expansiunii rapide, atunci energia sa internă scade și temperatura gazului scade. Această proprietate a procesului adiabatic este baza pentru lichefierea gazului. Un exemplu de proces adiabatic este, de asemenea, o explozie, topirea unei siguranțe în timpul unui scurtcircuit etc.
Adiabații, ca și izotermele, nu se intersectează.Material de pe site
Grafic pe planul de coordonate pV procesul adiabatic este descris printr-o curbă numită adiabatic(Fig. 2.5). Cade mai abrupt decât izoterma, deoarece într-un proces adiabatic schimbarea presiunii are loc datorită creșterii simultane a volumului și scăderii temperaturii. Această concluzie este confirmată și de formula (24): p =nkT, la urma urmei, o creștere a volumului de gaz duce la o scădere a concentrației de molecule de gaz și, prin urmare, o scădere a presiunii este determinată de doi parametri - temperatura gazului Tși concentrația moleculelor n.
Datorită expansiunea adiabatică gaz are o schimbare a stării sale, care se caracterizează printr-o scădere a energiei interne; la compresie adiabatică gaz, energia sa internă crește.
Pe această pagină există material pe următoarele subiecte:
Isoprocese formule cheat sheet
Chimie fizică proces adiabatic
Fizica proces adiabatic
Cheat sheet pentru fizica procesului adiabatic
Raport proces adiabatic
Întrebări despre acest material:
Un proces adiabatic este un proces fără schimb de căldură cu mediul extern. Într-un proces adiabatic, schimbul de energie între fluidul de lucru și mediul înconjurător are loc numai sub formă de lucru, nu există schimb de energie sub formă de căldură. Aceste condiţii sunt exprimate prin relaţia: . Atunci ecuația primei legi a termodinamicii pentru un proces adiabatic are forma:
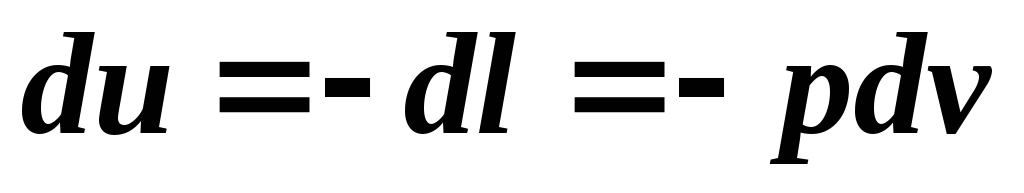 .
(5.4)
.
(5.4)
Din această ecuație este clar că activitatea procesului de expansiune adiabatică are loc datorită scăderii energiei interne a gazului și, în consecință, temperatura gazului scade. Lucrarea compresiei adiabatice se referă în totalitate la creșterea energiei interne a gazului, adică la creșterea temperaturii acestuia. Astfel, schimbarea energiei interne și a muncii într-un proces adiabatic sunt echivalente ca mărime și opus ca semn.
Să derivăm ecuația adiabatică pentru un gaz ideal. Să folosim ecuația primei legi a termodinamicii:
Împărțind variabilele, obținem:
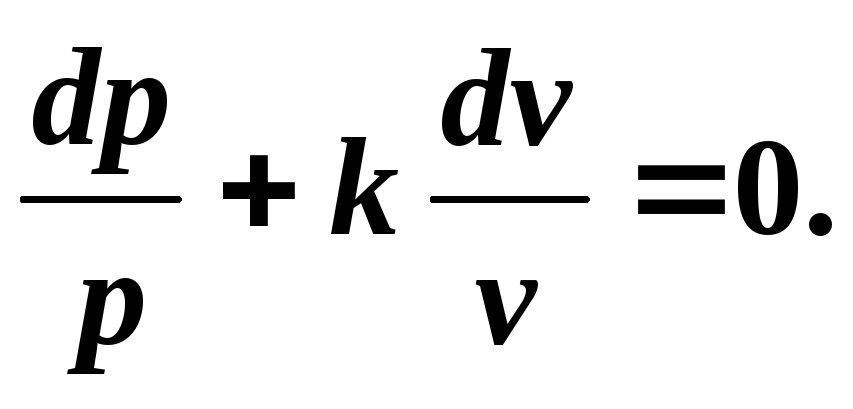 (5.6)
(5.6)
Integrarea (5.6) la k = const , ajungem unde
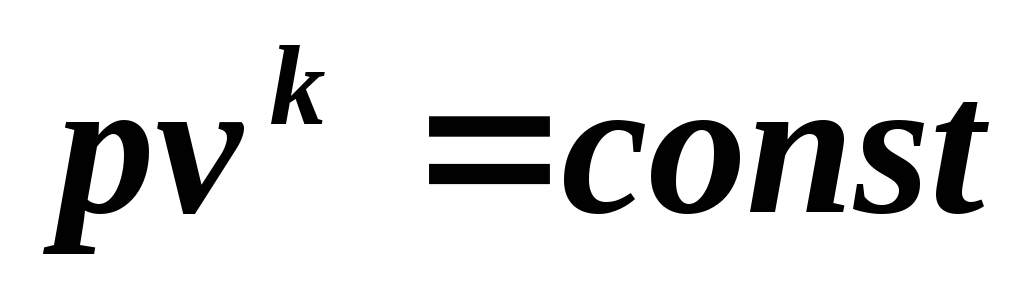 (5.7)
(5.7)
Ecuația (5.7) este o ecuație adiabatică.
În fig. Figura 5.10 prezintă procesul adiabatic de expansiune a gazului în  -diagramă.
-diagramă.
Din ecuația (5.7) rezultă:
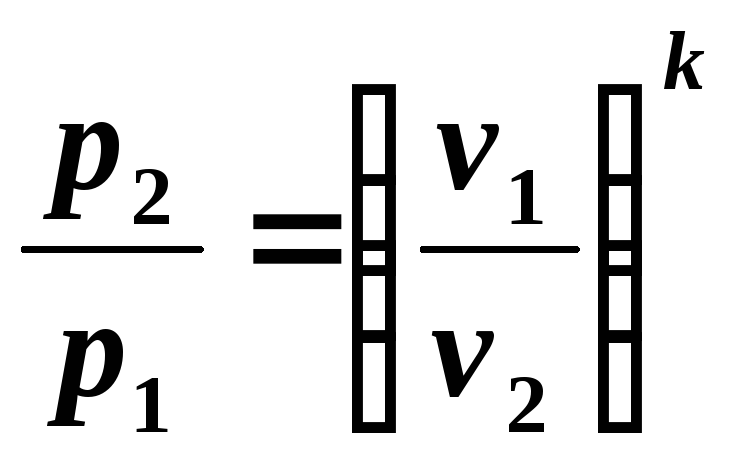 , (5.8)
, (5.8)
adică în timpul expansiunii adiabatice presiunea scade, iar în timpul compresiei crește.
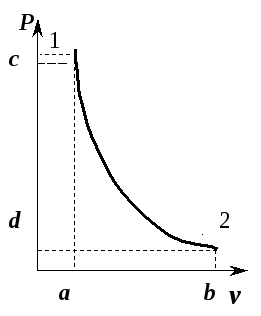
Orez. 5.10. Adiabatul unui gaz ideal
Având în vedere că într-un proces adiabatic toți cei trei parametri de stare se modifică, este necesar să se identifice relațiile dintre v Şi T , p Şi T .
Relația dintre temperatură T și volum v poate fi obținut din ecuația (5.8) și ecuațiile de stare scrise pentru punctele de proces 1 Şi 2 : R 1 v 1 = RT 1 Şi R 2 v 2 = RT 2 , unde
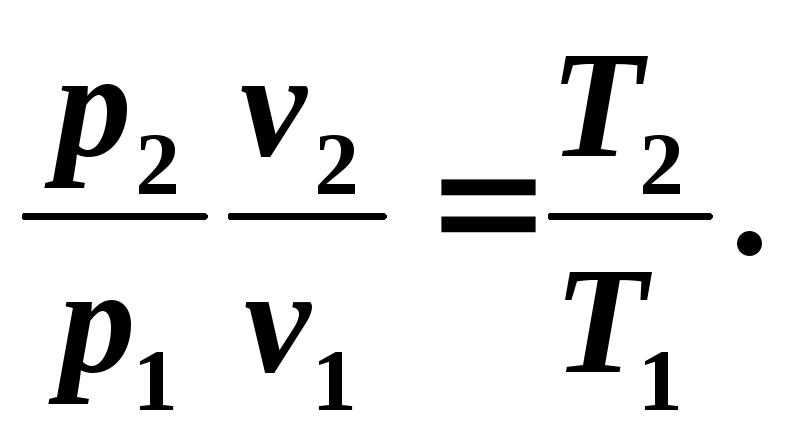 (5.9)
(5.9)
Din ecuațiile (5.8) și (5.9) rezultă: 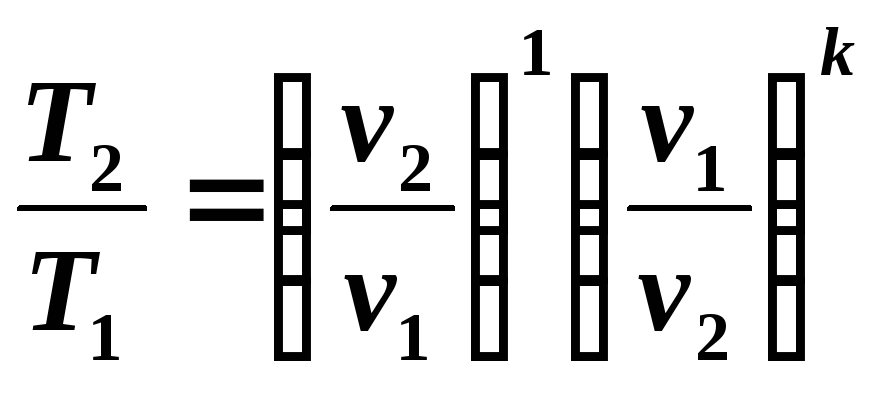
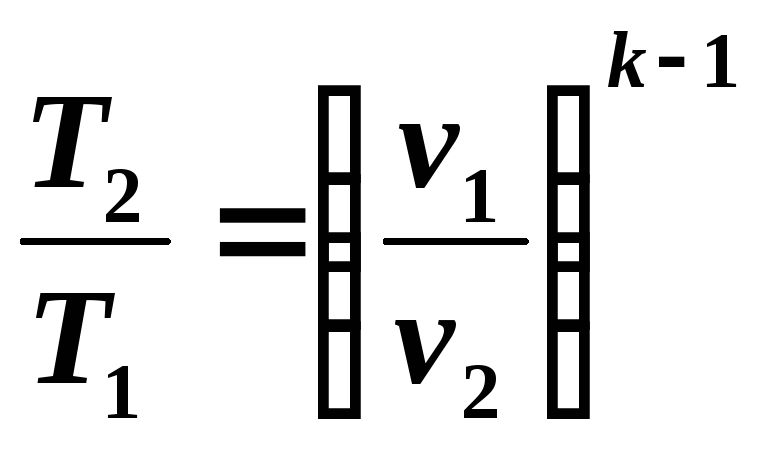 (5.10)
(5.10)
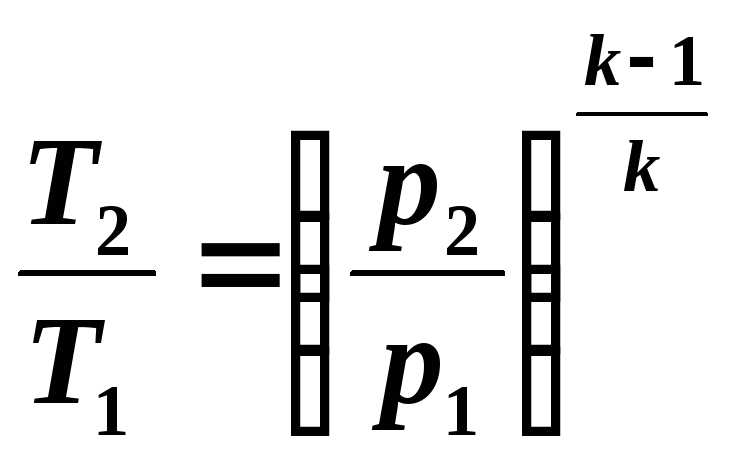 (5.11)
(5.11)
La k
=
const
Pentru a calcula munca unui proces adiabatic, puteți scrie mai multe formule. Din Eq. 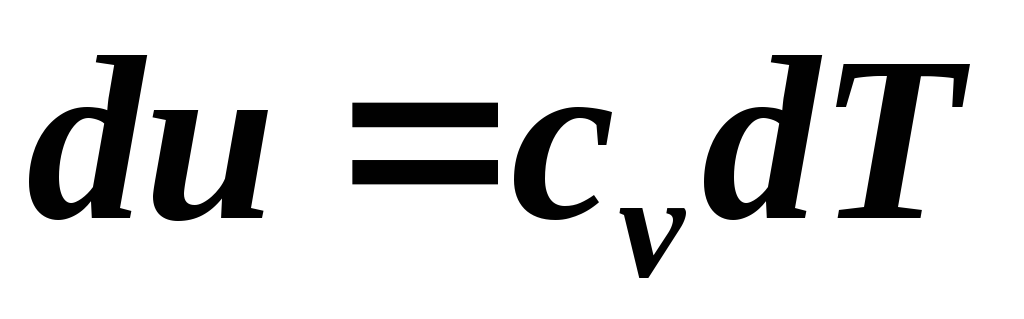 la c
v
=
const
avem:
la c
v
=
const
avem:
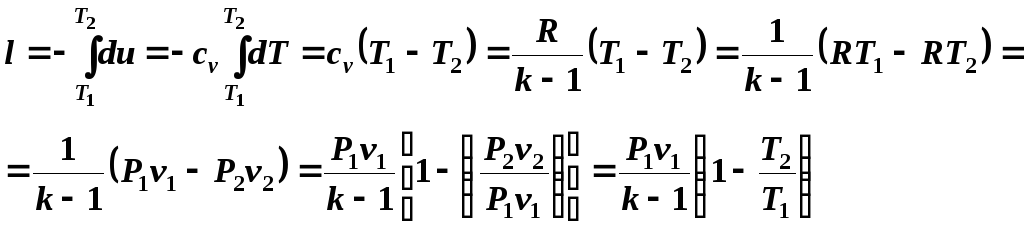 (5.12)
(5.12)
Ținând cont de relațiile (5.10) și (5.11), scriem ecuația (5.12) sub forma:
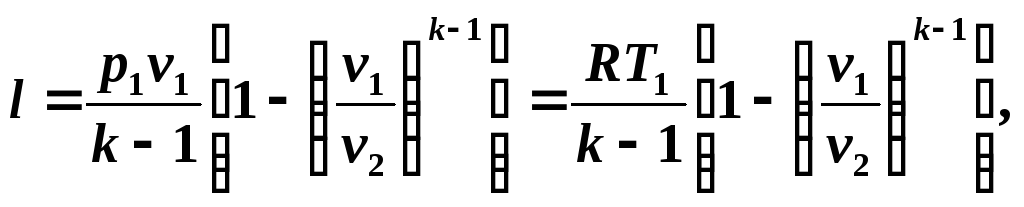
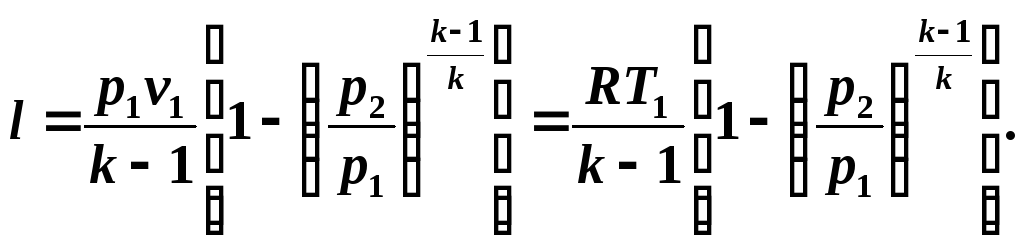
Determinăm munca disponibilă într-un proces adiabatic din relație
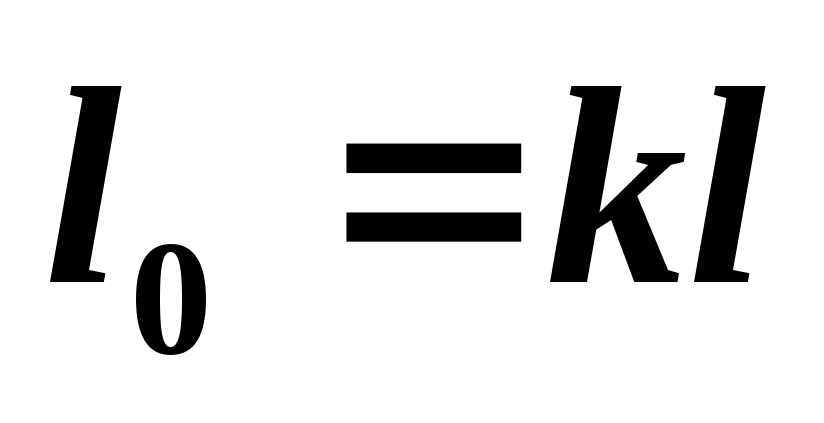 (5.14)
(5.14)
Pentru un proces adiabatic reversibil 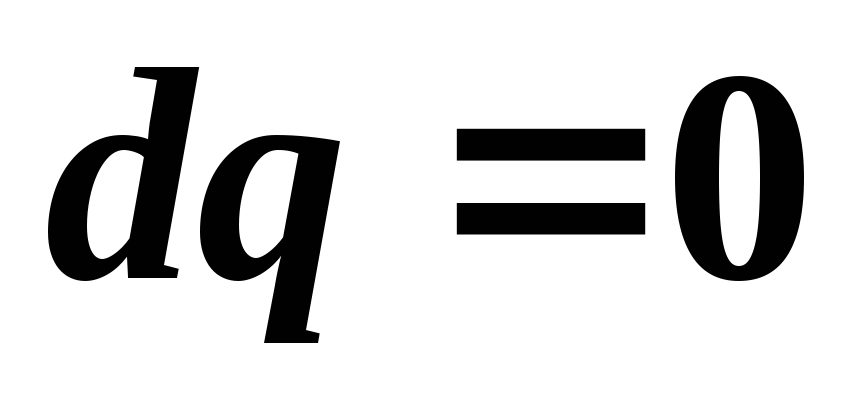 , De aceea
, De aceea
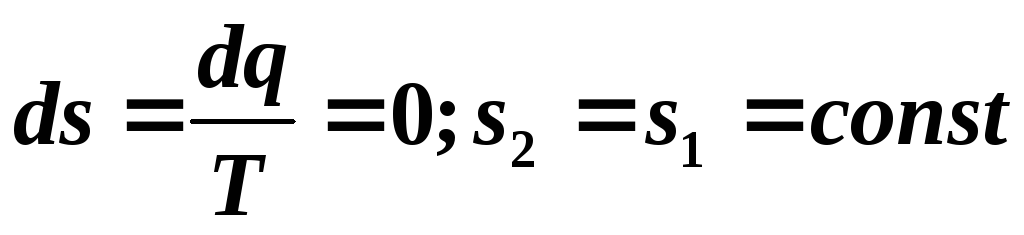 , adică un proces adiabatic reversibil va fi izoentropic și în
, adică un proces adiabatic reversibil va fi izoentropic și în  -diagrama este reprezentată ca o linie dreaptă paralelă cu axa
-diagrama este reprezentată ca o linie dreaptă paralelă cu axa  (Fig. 5.11). Procesul de expansiune adiabatică este descris printr-o linie verticală 2-1 care coboară, iar procesul de comprimare adiabatică 1-2 printr-o linie verticală în sus.
(Fig. 5.11). Procesul de expansiune adiabatică este descris printr-o linie verticală 2-1 care coboară, iar procesul de comprimare adiabatică 1-2 printr-o linie verticală în sus.
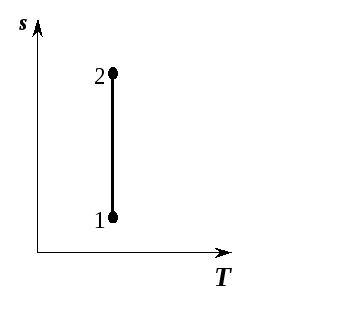
Orez. 5.11. Procesul adiabatic în  -diagramă
-diagramă
Capacitatea termică într-un proces adiabatic este zero: 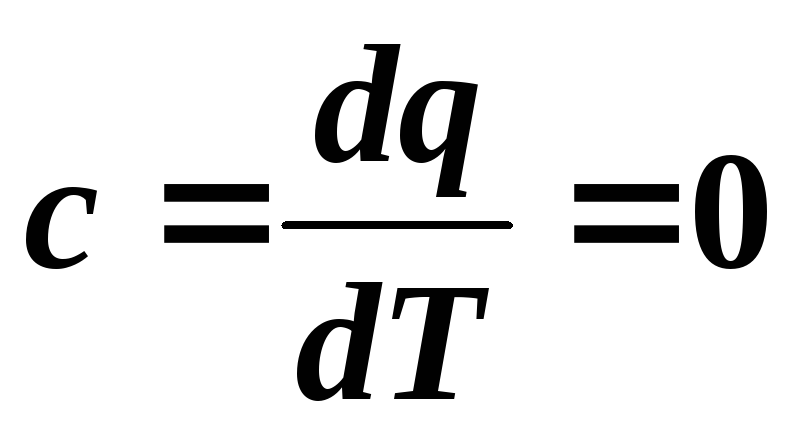 .
.
|
|
|
Orez. 5.12. Schema de distribuție a energiei într-un proces adiabatic:
a- în timpul expansiunii gazului; b – în timpul compresiei gazului
Proces politropic
Procesul politropic este orice proces arbitrar de modificare a stării fluidului de lucru, care are loc la o capacitate termică constantă Cu x , adică c = c x = const. Linia de proces se numește politrop.
Din definirea unui proces politropic rezultă că principalele procese termodinamice (izocoric, izobare, izoterme, adiabatice, dacă au loc la o capacitate termică specifică constantă, sunt cazuri speciale de proces politrop.
Cu alte cuvinte, un proces politropic este caracterizat de aceeași fracțiune din cantitatea de căldură de intrare cheltuită pentru modificarea energiei interne a sistemului.
Ecuația unui proces politropic poate fi obținută din ecuațiile primei legi a termodinamicii pentru un gaz ideal:
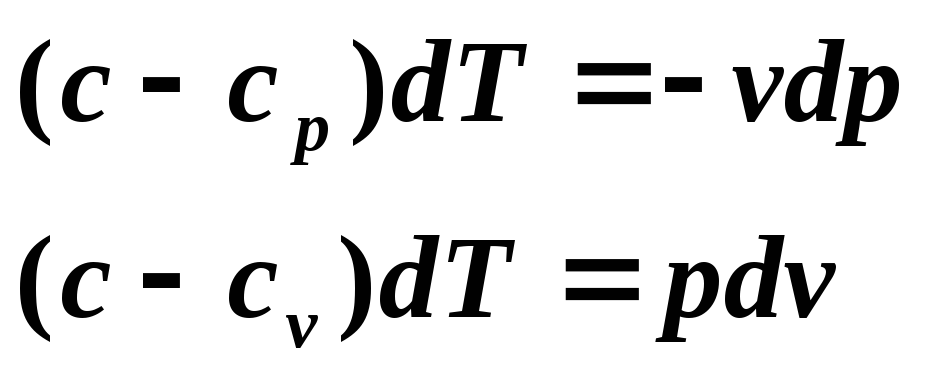
Împărțiți prima ecuație la a doua
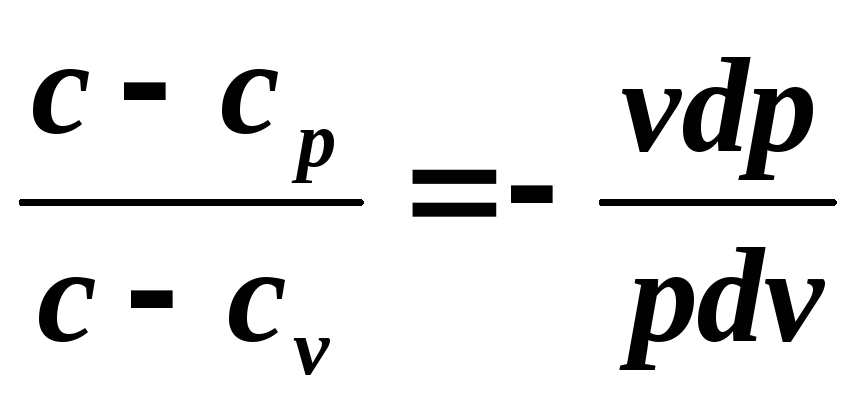
si denota
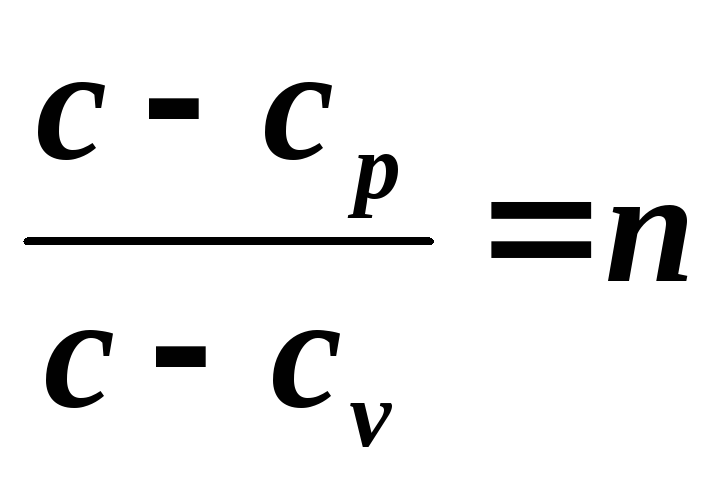 ,
,
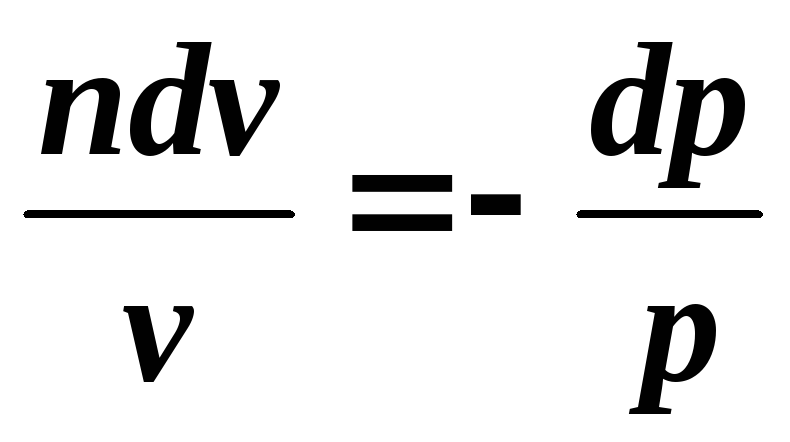
Integrând relația rezultată de la începutul până la sfârșitul procesului, găsim:
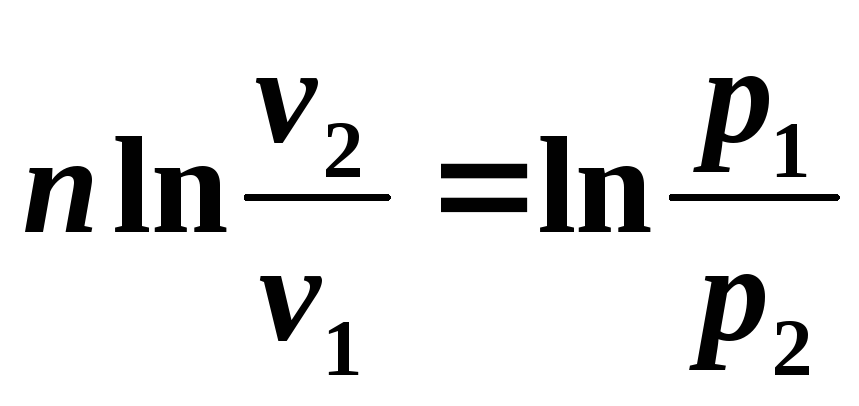 ,
,
sau după potențare
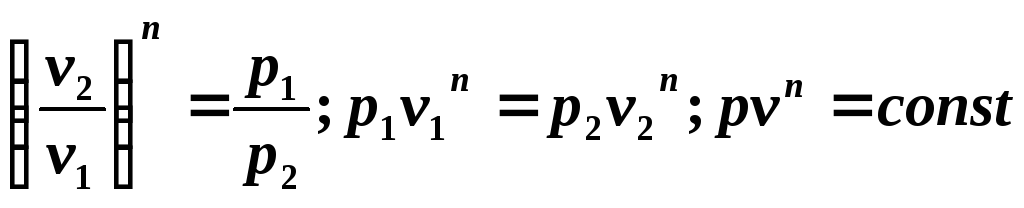
obţinem ecuaţia procesului politropic 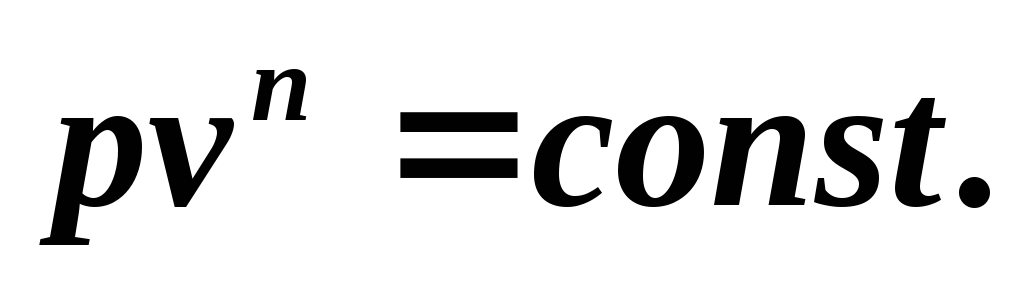
Deoarece ecuația politropică diferă de ecuația adiabatică doar prin valoarea exponentului n , atunci toate relațiile dintre parametrii principali pot fi reprezentate prin formule similare cu formulele pentru procesul adiabatic:
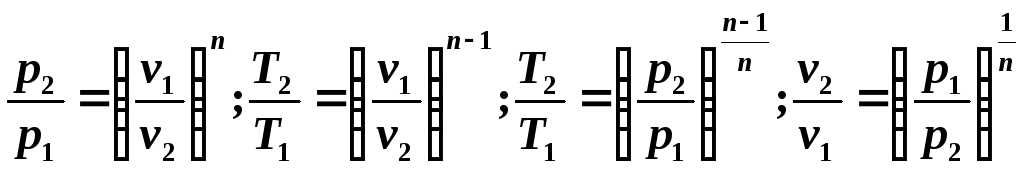
Capacitatea termică specifică a unui proces politropic poate fi determinată din expresia indicelui politropic
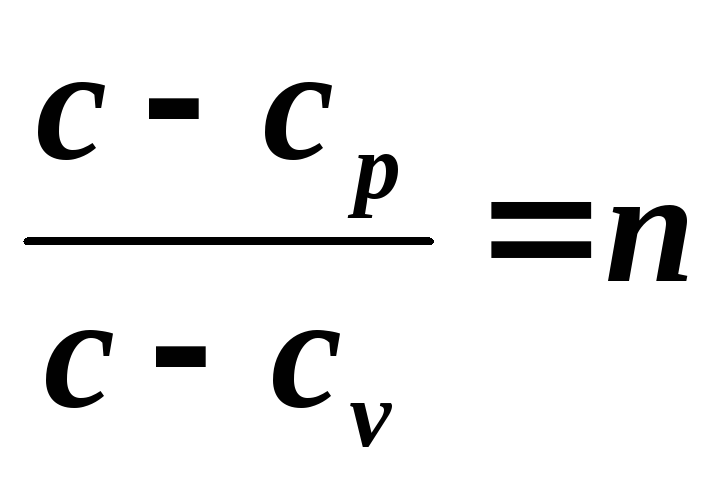 , unde
, unde 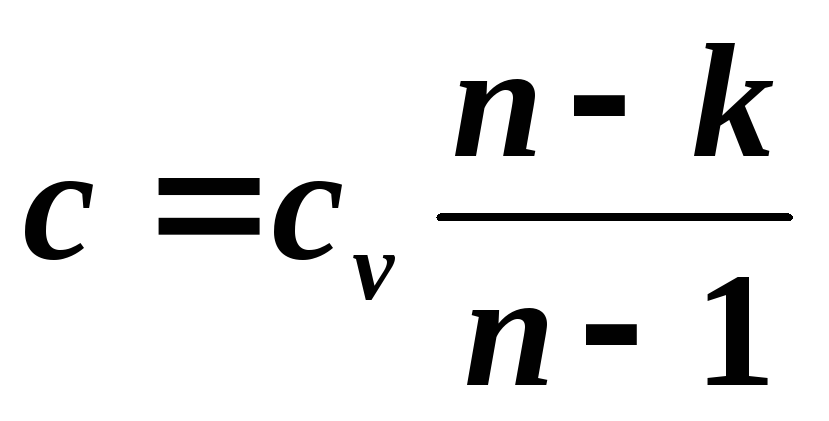 ,
,
Unde k – indicele adiabatic.
Ultima ecuație ne permite să determinăm capacitatea termică specifică a unui proces politropic pentru orice valoare n . Dacă înlocuim valori pentru cazuri speciale în această ecuație, putem obține:
|
Procesul izocor: |
n = ; |
c = c v ; |
v = const. |
|
|
Procesul izobaric: |
n = 0 ; |
c = kc v =c p ; |
p = const . |
|
|
Proces izotermic: |
n= 1 ; |
c = ; |
T = const. |
|
|
Proces adiabatic: |
n = k ; | |||
Proces adiabatic
Adiabatic este un proces în care nu există schimb de căldură ( = 0) între sistemul fizic și mediu. Toate procesele rapide sunt aproape de adiabatice. De exemplu, procesul de propagare a sunetului într-un mediu poate fi considerat un proces adiabatic, deoarece viteza de propagare undă sonoră atât de mare încât schimbul de energie între undă și mediu nu are timp să se producă. Procesele adiabatice sunt utilizate în motoarele cu ardere internă (expandarea și comprimarea amestecului combustibil în cilindri), în unitățile frigorifice etc.
Din prima lege a termodinamicii () pentru un proces adiabatic rezultă că
adică munca externă se realizează datorită modificărilor energiei interne a sistemului. Astfel, proces adiabatic este opusul izotermei, deoarece în acesta din urmă munca se realizează datorită afluxului unei cantități echivalente de căldură din exterior.
Folosind expresiile (52.1) și (53.4), pentru o masă de gaz arbitrară rescriem ecuația (55.1):
![]() . (55.2)
. (55.2)
Diferențierea ecuației de stare pentru un gaz ideal
![]() . (55.3)
. (55.3)
Să excludem din (55.2) și (55.3) temperatura T:
![]() .
.
Separând variabilele și ținând cont de faptul că (vezi (53.8)), obținem
![]()
Integrarea acestei ecuații în interval p 1 la p 2 si in consecinta din V 1 la V 2, iar apoi potențarea, obținem
![]() , sau .
, sau .
Din moment ce statele 1 Şi 2 ales arbitrar, putem scrie
Const. (55,4)
Expresia rezultată este ecuaţie stare gazoasăîntr-un proces adiabatic, numit și ecuația lui Poisson.
Pentru a merge la variabile T, V sau r, T eliminați din (55.4) folosind ecuația Clapeyron-Mendeleev
presiune sau volum, respectiv:
Const, (55,5)
Const. (55,6)
Expresiile (55.4) - (55.6) reprezintă ecuațiile procesului adiabatic. În aceste ecuații, mărimea adimensională (vezi (53.8) și (53.2))
este Raportul lui Poisson. Pentru gazele monoatomice (Ne, He etc.), care satisfac destul de bine condiția de idealitate, = 3, = 1,67. Pentru gaze biatomice (H 2, N 2, O 2 etc.) = 5, = 1,4. Valorile calculate folosind formula (55.7) sunt bine confirmate prin experiment.
Diagrama unui proces adiabatic ( adiabatic) în coordonate p, V este reprezentat ca o hiperbolă (Fig. 83). Figura arată că adiabat ( = const) este mai abrupt decât izoterma ( pV= const). Acest lucru se explică prin faptul că în timpul compresiei adiabatice 1-3 O creștere a presiunii gazului este cauzată nu numai de o scădere a volumului acestuia, ca și în cazul compresiei izoterme, ci și de o creștere a temperaturii.
Să calculăm munca efectuată de gaz într-un proces adiabatic. Să scriem ecuația (55.2) sub forma
![]()
Dacă un gaz se extinde adiabatic din volumul său V 1 la V 2, apoi temperatura îi scade de la T 1 la T 2și munca de dilatare a unui gaz ideal
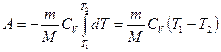 . (55.8)
. (55.8)
Folosind aceleași tehnici ca la derivarea formulei (55.5), expresia (55.8) pentru lucru în timpul unui proces adiabatic poate fi transformată în forma 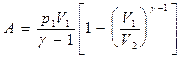
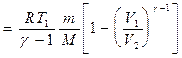
Lucrul efectuat de un gaz în timpul expansiunii adiabatice 1-2 (determinată de zona umbrită din Fig. 83), mai mică decât cu izotermă. Acest lucru se explică prin faptul că în timpul expansiunii adiabatice gazul este răcit, în timp ce în timpul expansiunii izoterme temperatura este menținută constantă datorită afluxului unei cantități echivalente de căldură din exterior.
Procesele considerate izocorice, izobare, izoterme și adiabatice au caracteristică comună– apar la capacitate termică constantă. În primele două procese, capacitățile termice sunt, respectiv, egale C V și C pîntr-un proces izoterm (dT=0) capacitatea termică este egală cu ±∞, într-un proces adiabatic (δQ=0) capacitatea termică este zero. Procesul prin care capacitatea termică rămâne constantă se numește politropică.
Pe baza primei legi a termodinamicii, în condiția capacității termice constante (C=const), putem deriva ecuația politropică:
unde este indicele politropic. Evident, pentru C=0, n=γ, din (55.9) se obține ecuația adiabatică; la С=∞, n=1 – ecuație izotermă; la C=C p, n=0 – ecuația izobară, la C=C V, n=±∞ – ecuația izocoră. Astfel, toate procesele luate în considerare sunt cazuri speciale de proces politropic.
3.8. Aplicarea primei legi a termodinamicii
Pentru proces adiabatic
Un proces termodinamic în care un sistem, la trecerea de la starea 1 la starea 2, nu face schimb de căldură cu mediul înconjurător se numește adiabatic.
În practică, un proces adiabatic poate fi efectuat cu expansiune (compresie) rapidă a unui gaz, când d Q º0. De exemplu, expansiunea rapidă a gazelor în cilindrul unui motor cu ardere internă. Într-un motor diesel, aerul este rapid comprimat adiabatic de 15 ori sau mai mult decât într-un motor cu ardere internă. În acest caz, temperatura aerului se ridică la 3000 o C, deci atunci când amestecul combustibil este injectat, acesta se aprinde spontan.
Oricând undă de șoc gazul este comprimat adiabatic și devine foarte fierbinte, deoarece nu are timp să renunțe la căldura degajată.
Când meteoriții intră în atmosferă, se topesc și se evaporă în principal din acest motiv, și nu datorită prezenței frecării și rezistenței atunci când se deplasează în aerul atmosferic.
Expansiunea adiabatică duce la răcirea sistemului, care este utilizat în lichefierea gazelor (demagnetizarea adiabatică a sărurilor paramagnetice permite obţinerea unor temperaturi apropiate de zero absolut). Procesele adiabatice includ şi expansiunea liberă a gazelor (Fig. 3.6), deoarece Q=0, A=0, D U=0, DT=0.
Orez. 3.6
Să reprezentăm prima lege a termodinamicii pentru un proces adiabatic sub formă
În consecință, în timpul unui proces adiabatic, gazul funcționează din cauza scăderii energiei sale interne.
Capacitatea termică a unei substanțe în timpul unui proces adiabatic este C = 0 (d Q=0, dT1 0).
Să găsim forma ecuației de stare a unui gaz ideal pentru un proces adiabatic.
Să rescriem ecuația (3.21) ca:
Aplicând ecuația lui Mayer (3.16), transformăm (3.24) în forma
|
CU r РdV + C v VdP = 0. |
(3.25) |
Ecuația (3.25) poate fi reprezentată ca
|
|
(3.26) |
Unde
|
(3.27) |
numit coeficient Poisson
(exponent adiabatic).După integrarea (3.26) ținând cont de (3.27), obținem
sau
|
(3.28) |
Se numește expresia (3.28). ecuația adiabatică (ecuaţie Poisson).
Folosind ecuația Mendeleev-Clapeyron (1.9) rescriem (3.28) ca:
![]() .
.
Diagrama P-V a procesului adiabatic este prezentată în Fig. 3.7.
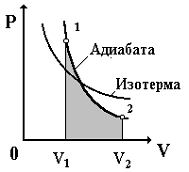
Orez. 3.7
Din fig. 3.7 este clar că curba adiabatică este mai abruptă decât izoterma. Acest lucru se explică prin faptul că, în timpul expansiunii adiabatice a unui gaz ideal, nu are loc doar o scădere a presiunii, ci și o scădere a temperaturii, deoarece energia internă a gazului scade.
În timpul comprimării adiabatice a unui gaz, presiunea și temperatura cresc, nu numai datorită scăderii volumului, ci și datorită creșterii energiei interne. Acest lucru poate fi observat în modelul computerizat „Procesul adiabatic”.
Model de computer „Proces adiabatic”