8.doc
87Stări agregate substanțe și tranziții între ele. Proprietățile gazelor, lichidelor și solide.
8.1. Stări agregate ale materiei și tranziții între ele în funcție de
temperatura si presiunea
O substanță este o colecție cantitate mare particule (atomi, molecule, ioni). O substanță poate exista și poate avea o anumită structură numai datorită anumitor interacțiuni între particulele sale constitutive. Mai mult, structura unei substanțe și proprietățile sale fizice depind foarte mult de energia acestor interacțiuni și de relația acesteia cu energia termică a mișcării particulelor.
Pentru majoritatea substanțelor, există patru stări clar distincte, tranziția între care are loc cu o schimbare a temperaturii. Aceste stări se numesc stări agregate: solid, lichid, gazos, plasmă.
Pentru fiecare substanță există o temperatură la care energia de legare dintre particulele sale depășește energia vibrațiilor lor termice. În acest caz, mișcarea oscilativă, desigur, nu se oprește, dar nu este suficient să rupeți legăturile dintre particule. În acest caz, particulele formează de obicei o structură geometrică regulată. Această stare a materiei se numește greu.
Pe măsură ce temperatura crește, vine un moment în care energia vibrațiilor termice depășește energia legăturilor dintre particule și acestea încep să avanseze. Structura geometrică este distrus. Cu toate acestea, până acum energia mișcării de translație nu este atât de mare încât particulele să se poată rupe în cele din urmă unele de altele: se mișcă, menținând o distanță constantă între ele. Această stare a materiei se numește lichid.
Odată cu o creștere suplimentară a temperaturii, energia mișcării termice de translație depășește energia interacțiunilor dintre particule și se pot desprinde unele de altele.
Deoarece forța de interacțiune scade odată cu creșterea distanței, particulele sunt situate la o astfel de distanță unele de altele, cât este posibil cu concentrația lor. Această condiție se numește gazos.
La temperaturi ultra-înalte sau într-un câmp electric de foarte înaltă tensiune, apare o a patra stare - plasmă. Strict vorbind, aceasta este o substanță diferită, deoarece se caracterizează prin prezența unui număr mare de molecule ionizate și electroni liberi.
Diagrame de stări
Trecerea unei substanțe de la o stare de agregare la alta este determinată nu numai de temperatură, ci și de presiune. Ultima dependență este deosebit de puternică pentru tranziția lichid-gaz. La temperaturi scăzute și presiuni mari, substanța este în stare solidă; atunci când temperatura și presiunea scad, devine lichidă și gazoasă. Mai mult, pentru fiecare substanță individuală, aceste tranziții au caracteristici cantitative stricte, care sunt afișate în mod clar de așa-numita diagramă de fază. Aceasta este o diagramă bidimensională, pe axele căreia sunt trasate valorile temperaturii și presiunii, iar diagrama în sine, în cel mai simplu caz, reprezintă trei linii convergente într-un punct. Aceste linii separă acele zone de temperatură și presiune care corespund stărilor lichide, solide și gazoase (Fig. 16).
Diagrama de stare și proprietățile sale sunt descrise în detaliu în cursul de fizică.
^ 8.2. Proprietățile caracteristice ale gazelor, lichidelor și solidelor.
1. Gaze. În stare gazoasă, se găsesc de obicei substanțe covalente cu molecul scăzut și gaze nobile. Distanța dintre particulele unei substanțe din gaze este mult mai mare decât dimensiunea particulelor în sine și interacțiunea dintre ele este neglijabilă
Puțin în comparație cu energia termică. În consecință, gazele se extind și se comprimă ușor. Gazele nu au propria formă și volum și iau forma și volumul recipientului care le conține, exercitând în același timp o presiune egală asupra pereților recipientului în toate direcțiile. Toate gazele se amestecă între ele în orice raport.
2. Lichide. În stare lichidă în condiții normale există de obicei substanțe covalente (neavând rețea cristalină atomică) și unele metale (mercur). Distanța dintre particule dintr-un lichid nu este mult diferită de cea din starea solidă, dar particulele sunt mobile unele față de altele. În consecință, lichidele nu au propria lor formă și iau forma unui vas, dar au propriul volum și, de regulă, sunt practic incompresibile.
3. Solide. Starea solidă este caracteristică substanțelor cu toate tipurile de legături (metalice, ionice, covalente). Mai mult, substanțele cu tipuri de legături ionice și atomice sunt întotdeauna solide în condiții normale. Distanța dintre particule este mică, interacțiunile sunt puternice, particulele sunt nemișcate unele față de altele (dacă nu sunt luate în considerare mișcările oscilatorii mici). În același timp, ele formează o structură permanentă. Prin urmare, solidele au propria lor formă și volum, care sunt practic independente de presiune și temperatură (desigur, în regiunea diagramei de fază corespunzătoare stării solide).
Deci, cantitatea de solid sau substanță lichidăîntr-un anumit volum este practic independent de temperatură și presiune și este determinat de densitate, care este individuală pentru fiecare substanță și practic nu poate fi calculată fără cunoașterea exactă a structurii. Cu toate acestea, acest lucru nu este valabil pentru gaze, pentru care aceste dependențe se supun legilor generale. Cunoașterea acestor legi este necesară pentru rezolvarea multor probleme chimice și acum le vom lua în considerare.
^ 8.3. Gaze. Legile gazelor.
Starea unei substanțe gazoase este complet caracterizată de următorii parametri:
M- greutatea moleculară a substanței m - masa de gaz P - presiune
V- volumul furnizat gazului
T- temperatura gazului (in legile gazelor Se folosește temperatura Kelvin)
Legile care leagă acești parametri și pe care le vom lua în considerare acum sunt foarte asemănătoare pentru toate gazele și pot fi considerate la fel. Strict vorbind, sunt absolut exacte pentru gaz ideal,în care nu există complet interacțiune între particule și ale căror particule reprezintă puncte materiale. În consecință, aplicarea acestor legi la gazele reale se numește aproximarea gazului ideal. Care sunt aceste legi?
1. Legea lui Avogadro. Același volum al oricărui gaz la aceeași temperatură și presiune conține același număr de molecule, adică.
m/M= const când P,V,T= const pentru orice gaz.
2. Legea Boyle-Mariotte. La o masă a gazului constantă și o temperatură constantă, presiunea gazului este invers proporțională cu volumul pe care îl ocupă, adică.
RV= const când T,m= const
3. Legea lui Gay-Lussac. La masa constanta gaz și presiune, volumul ocupat de un gaz este direct proporțional cu temperatura acestuia, adică
Const la P, m= const
4. Legea lui Charles. La masa și volumul gazului constant, presiunea gazului este direct proporțională cu temperatura, adică
P/T= const la V, m=const
^ 8.4. Ecuația Mendeleev-Clapeyron
Combinând ultimele trei legi, este ușor obțineți legea combinată a gazelor:
P 1 V 1 /T1=P 2 V 2 /T 2 sau PV/T=const cu m=const Această lege nu este încă generală - constanta va fi diferită pentru aceleași mase de gaze diferite. Cu toate acestea, dacă luăm în considerare legea lui Avogadro, conectarea proprietate comună toate gazele, obținem asta pentru orice gaz
PV/T=(m/M) const,
Mai mult, acum constanta este comună tuturor gazelor. Cu ce este egal? S-a stabilit experimental că la conditii normale (P= eu atm=1,013 10 5 Pa, T= 273 K) un mol de orice gaz ocupă același volum și anume 22,4 litri. Înlocuind aceste valori în ecuația pe care am obținut-o și ținând cont,
M care - este numărul de moli, aflăm că valoarea constantei
8,3144 J/(mol K). Se numește constanta universală a gazelor și este desemnată prin simbol R.
Astfel, am obținut o ecuație universală care conectează toți parametrii care caracterizează starea unei substanțe gazoase. Se numește ecuația Mendeleev-Clapeyron.
PV=(m/M)RT Folosind această ecuație, puteți găsi orice parametru necunoscut pentru orice gaz dacă ceilalți sunt cunoscuți. Să luăm în considerare două consecințe practic importante din această ecuație.
1. Este ușor de observat că la presiune și temperatură constantă densitatea gazului
p=m/V= const M,
Adică, densitatea oricărui gaz în aceleași condiții depinde doar de el greutate moleculară. Acest lucru vă permite să găsiți masa moleculară a unui gaz necunoscut dacă densitatea lui relativă este cunoscută
D= 1 / 2 .
Pentru un gaz cu o masă moleculară cunoscută, deoarece
Deci, dacă densitatea relativă a unui gaz în raport cu hidrogenul este 22, atunci greutatea sa moleculară este 44 ( dioxid de carbon). Densitatea relativă a aerului este adesea folosită. În acest caz, se presupune că greutatea moleculară a aerului este de 29.
2. Din ecuația Mendeleev-Clapeyron se deduce ușor și faptul că, dacă o reacție care implică gaze are loc într-un vas închis la o temperatură constantă, atunci presiunea din vas.
Direct proporțional cu numărul total de moli de gaze.
3. Universalitatea proprietăților gazelor ne permite să introducem conceptul de greutate moleculară medie pentru un amestec de gaze (este adesea folosit în probleme). Dacă introduceți denumirea
V=m/M - (număr de moli), apoi greutatea moleculară medie:
Deoarece gazele dintr-un amestec sunt întotdeauna în aceleași condiții, li se aplică legea lui Avogadro, iar definiția masei molare medii poate fi rescrisă prin înlocuirea numărului de moli cu volum:

^ 8.5. Legea lui Avogadro, volumul molar
Deoarece gazele sunt cel mai simplu obiect de studiu, proprietățile și reacțiile lor între substanțele gazoase au fost studiate cel mai pe deplin.
Omul de știință francez J. L. Gay-Lussac a stabilit legea relatiilor volumetrice:

De exemplu, 1 litru de clor se combină cu 1 litru de hidrogen pentru a forma 2 litri de acid clorhidric; 2 litri de oxid de sulf (IV) se combină cu 1 litru de oxigen, formând 2 litri de oxid de sulf (VI).
Această lege i-a permis omului de știință italian A. Avogadro să sugereze că moleculele gazelor simple (hidrogen, oxigen, azot, clor etc.) sunt formate din doi atomi identici. Când hidrogenul se combină cu clorul, moleculele acestora se descompun în atomi; iar acestea din urmă formează molecule de acid clorhidric. Dar, deoarece dintr-o moleculă se formează două molecule de acid clorhidric, volumul acesteia din urmă trebuie să fie egal cu suma volumelor gazelor originale, adică.
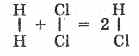
Astfel, relațiile volumetrice sunt ușor de explicat dacă pornim de la ideea naturii diatomice a moleculelor de gaze simple (H 2, Cl 2, O 2, N 2 etc.). Aceasta, la rândul său, servește drept dovadă a naturii diatomice a moleculelor acestor substanțe.
Studiul proprietăților gazelor i-a permis lui A. Avogadro să prezinte o ipoteză, care a fost ulterior confirmată de date experimentale și, prin urmare, a devenit cunoscută ca Legea lui Avogadro:
Rezultă din legea lui Avogadro consecință importantă: în aceleași condiții, 1 mol de orice gaz ocupă același volum. Acest volum poate fi calculat dacă se cunoaște masa a 1 litru de gaz. În condiții normale, de ex. temperatura 273 K (0 ° C) și presiunea 101325 Pa, masa a 1 litru de hidrogen este de 0,09 g, masa sa molară este de 1,008 2 = 2,016 g/mol. Atunci volumul ocupat de 1 mol de hidrogen este egal cu
2,016 g/mol
(2,016 g/mol)/0,09 g/l=22,4 l/mol.
În aceleași condiții, masa a 1 litru de oxigen este de 1,429 g; masa molara 32 g/mol. Atunci volumul este egal
32 g/mol/1,429 g/l = 22,4 l/mol.
Prin urmare,

^ 1 Valoarea exactă 22,4135±0,0006 l/mol
Unde V m - volumul molar de gaz (dimensiunea m 3 /mol sau l/mol); V- volumul de substanță al sistemului; n - cantitatea de substanță din sistem. Exemplu de intrare: V m gaz (n.s.) 22,4 l/mol.
Să ne amintim că în 1860, la congresul internațional al chimiștilor de la Karlsruhe, învățăturile lui A. Avogadro au primit recunoaștere universală.
Congresul a dat un impuls puternic dezvoltării științei atomo-moleculare. Dar a primit o dezvoltare deosebit de rapidă după descoperirea legii periodice a elementelor chimice de către D.I. Mendeleev.
Pe baza legii lui Avogadro se determină masele molare ale substanțelor gazoase. Cu cât masa moleculelor de gaz este mai mare, cu atât este mai mare masa aceluiași volum de gaz. Conțin volume egale de gaze diferite în aceleași condiții acelasi numar molecule și, prin urmare, moli de gaze. Raportul dintre masele de volume egale de gaze este egal cu raportul dintre masele lor molare:
m 1:m 2 = M 1:M 2 ,
Unde m 1 - masa unui anumit volum a primului gaz; m 2 - masa de același volum a celui de-al doilea gaz; M 1 Și M 2 - mase molare ale primului și celui de-al doilea gaz.

M 1 /M 2 =D, de aici M 1 =DM 2 .
De obicei, densitatea gazului este determinată în raport cu cel mai ușor gaz - hidrogen (notat D H2). Masă molară hidrogenul este 2,016 g/mol sau aproximativ 2 g/mol. Prin urmare obținem:
M=2D H2 .
Adesea, densitatea unui gaz este determinată în raport cu aerul (D in). Deși aerul este un amestec de gaze, ei încă vorbesc despre masa sa molară medie. Este egal cu 29 g/mol. Masa molară medie a aerului este ușor de calculat dacă avem în vedere că aerul este format din aproximativ 4 volume de azot (masă molară 28 g/mol) și 1 volum de oxigen (masă molară 32 g/mol), adică. 4N2O2. Apoi:
(4 28 1 32).(4 1)=28,8 g/mol (rotunjit la 29 g/mol).
În acest caz, masa molară este determinată de expresia:
M= 29D c.
Determinarea maselor molare a arătat că moleculele de gaze simple constau din doi atomi (H 2, F 2, Cl 2, O 2, N 2), iar moleculele de gaze nobile constau dintr-un atom (He, Ne, Ar, Kr, Xe). , Rn). Pentru gazele nobile, conceptele „moleculă” și „atom” sunt echivalente. Cu toate acestea, moleculele altora substanțe simple constau din trei sau mai mulți atomi, de exemplu, molecule de ozon O 3, fosfor P 4, vapori de sulf la temperaturi ridicate S 8.
Pe baza legii lui Avogadro, se efectuează diverse calcule - calculând volumul, masa, densitatea gazelor în condiții normale, masa molară a substanțelor gazoase, precum și densitatea relativă a gazelor.
8.6. Lichide
Starea lichidă este intermediară între gazos și cristalin (vezi §8.2). În unele proprietăți, lichidele sunt aproape de gaze, iar în altele - de solide. Lichidele sunt asemănătoare gazelor în primul rând datorită izotropiei și fluidității lor; acesta din urmă determină capacitatea lichidului de a-și schimba cu ușurință forma exterioară. in orice caz densitate mare iar compresibilitatea scăzută a lichidelor le apropie de solide.
Capacitatea lichidelor de a-și schimba cu ușurință forma indică absența unor forțe puternice de interacțiune intermoleculară în ele. În același timp, compresibilitatea scăzută a lichidelor, care determină capacitatea de a menține un volum constant la o anumită temperatură, indică prezența unor forțe de interacțiune între particule, deși nu rigide, dar totuși semnificative.
Fiecare stare de agregare este caracterizată de propria sa relație între energiile potențiale și cinetice ale particulelor substanței. În solide, energia potențială medie a particulelor este mai mare decât energia lor cinetică medie. Prin urmare, în solide, particulele ocupă o anumită poziție unele față de altele și doar oscilează în jurul acestor poziții. Pentru gaze, raportul de energie este opus, drept urmare moleculele de gaz sunt întotdeauna într-o stare de mișcare haotică și practic nu există forțe de coeziune între molecule, astfel încât gazul ocupă întotdeauna întregul volum care îi este furnizat. În cazul lichidelor, energiile cinetice și potențiale ale particulelor sunt aproximativ aceleași, adică. particulele sunt conectate între ele, dar nu rigid. Prin urmare, lichidele sunt fluide, dar au un volum constant la o anumită temperatură.
Ca urmare a aplicării metodelor de analiză structurală la lichide, s-a stabilit că structura lichidelor este similară cu corpurile amorfe. În majoritatea lichidelor, se observă ordinea pe distanță scurtă - numărul de vecini cei mai apropiați ai fiecărei molecule și pozițiile lor relative sunt aproximativ aceleași pe întregul volum al unui lichid dat.
Gradul de ordonare a particulelor în diferite lichide este diferit. În plus, se modifică odată cu schimbările de temperatură. La temperaturi scăzute puțin peste punctul de topire a acestei substante, grad: ordinea aranjamentului particulelor dintr-un lichid dat este mare. Pe măsură ce temperatura crește, scade și, pe măsură ce se încălzește, proprietățile lichidului devin din ce în ce mai asemănătoare cu proprietățile unui gaz. Când se atinge temperatura critică, diferența dintre lichid și gaz dispare.
Datorită asemănării structurii interne a lichidelor și a corpurilor amorfe, acestea din urmă sunt adesea considerate lichide cu vâscozitate foarte mare, în timp ce solidele includ doar substanțe în stare cristalină. Când asemănăm corpurile amorfe cu lichide, trebuie totuși să ne amintim că în corpurile amorfe, spre deosebire de lichidele obișnuite, particulele au o mobilitate nesemnificativă - la fel ca și în cristale.
^ 8.7. Solide. Principalele tipuri de rețele cristaline: cubice și hexagonale
În stare solidă, majoritatea substanțelor au o structură cristalină. Acest lucru poate fi verificat cu ușurință prin despicarea unei bucăți din substanță și examinarea fracturii rezultate. De obicei, pe o fractură (de exemplu, în zahăr, sulf, metale), mici margini de cristal situate în unghiuri diferite sunt clar vizibile, strălucind datorită reflectării diferite a luminii de către acestea. În cazurile în care cristalele sunt foarte mici, structură cristalină substanțele pot fi identificate cu ajutorul unui microscop.
Fiecare substanță formează de obicei cristale de o anumită formă. De exemplu, clorura de sodiu cristalizează sub formă de cuburi, alaunul sub formă de octaedre, nitratul de sodiu sub formă de prisme etc. Forma cristalină este una dintre proprietățile caracteristice ale solidelor.
Clasificarea formelor de cristal se bazează pe simetria cristalelor. Diverse cazuri de simetrie a poliedrelor cristaline sunt discutate în detaliu în cursurile de cristalografie.
Multe substanțe, în special fier, cupru, diamant, clorură de sodiu, cristalizează în sistemul cubic. Cele mai simple forme ale acestui sistem sunt cubul, octaedrul, tetraedrul. Magneziul, zincul, gheața, cuarțul se cristalizează într-un sistem hexagonal. Forma de bază a acestui sistem este prisma hexagonală și bipiramida.
Subiect: Proprietățile solide, lichide și gaze.
Scop: Consolidarea cunoștințelor despre stările corpului.
Luați în considerare proprietățile solidelor, lichidelor și gazelor.
Formează idei despre deformare, elasticitate, plasticitate.
În timpul orelor.
Organizarea elevilor pentru cursuri. Ce știință studiază corpurile, substanțele, fenomenele din natură și tehnologie? (Fizică).
Ce este un corp? Exemple.
Ce este o substanță? Exemple.
În ce stări pot exista substanțele?
Ce proprietăți au substanțele în stare solidă, lichidă și gazoasă?
Învățarea de materiale noi.
Știm că suntem înconjurați de multe corpuri care constau din substanțe. Ele sunt foarte diferite. Încercați să descrieți proprietățile apei, zahărului, parafinei. De ce sunt aceste substanțe atât de diferite? Știința fizicii ne va ajuta să răspundem la această întrebare. De unde începem?
Proprietățile solidelor.
Luați o carte, încercați să-i schimbați forma și volumul.
Trageți o concluzie: ce proprietăți au solidele?
(Corpurile solide sunt capabile să mențină forma și volumul neschimbate.)
Proprietățile lichidelor.
Înregistrați cantitatea de apă din paharul de măsurare, turnați apa în balon, apoi înapoi în pahar.
S-a schimbat volumul de apă?
S-a schimbat forma lichidului?
Trageți o concluzie: ce proprietăți au lichidele?
Înregistrați rezultatele cercetării dvs. într-un tabel. (Lichidele pot păstra volumul, dar nu pot păstra forma.)
Proprietățile gazelor.
Aruncă un balon. Ce formă ia mingea?
Eliberați aerul din balon. Unde s-a dus aerul?
S-a modificat volumul de aer?
S-a schimbat forma aerului?
Trageți o concluzie: ce proprietăți au gazele?
Înregistrați rezultatele cercetării dvs. într-un tabel. (Gazele nu își păstrează forma și ocupă întregul volum care le este dat.)
Reflecţie:
Ce au în comun proprietățile solidelor și lichidelor? Care este diferența lor?
Ce au în comun proprietățile gazelor și lichidelor? Care este diferența lor?
Despre obiect se știe că își păstrează bine volumul și forma. În ce stare este substanța din care este compus acest obiect? (în stare solidă.)
Deformare.
Luați o bandă de metal și întoarceți-i capetele în direcții diferite. Ce s-a întâmplat? S-a schimbat forma benzii? (Sub influența forței, forma benzii s-a schimbat.)
Defini:
Deformare - modificarea formei, dimensiunii și volumului corpului.
Elasticitate.
Întinde banda de cauciuc și apoi eliberează. Ce s-a întâmplat? (Sub influența forței, forma și volumul benzii s-au schimbat, iar după ce forța a încetat, banda și-a luat forma inițială.)
Defini:
Elasticitate - proprietatea unui corp de a schimba forma și volumul sub influența altor corpuri și de a le reface după încetarea acțiunii.
Unde se aplică proprietatea elasticității? (Primăvara tehnologiei.)
Plastic.
Faceți o minge din bucăți de plastilină, apoi formați un cub din minge. S-a schimbat forma plastilinei?
Așezați figurina pe masă. A revenit forma inițială a plastilinei?
Defini:
Plasticitate - proprietatea corpurilor de a-și schimba forma sub influența altor corpuri și de a o păstra după încetarea acțiunii.
Unde se aplică proprietatea plasticității materialelor? (Ceramica - produse din argilă, modelare din plastilină, confecţionarea lumânărilor cu ceară sau parafină.)
Începutul formei
Sfârșitul formularului
Reflecție: Explorați proprietățile apei și completați tabelul.
|
Starea apei |
Stare a materiei |
||
|
Salvează |
|||
|
vapor de apă |
Nu salvează |
Teme pentru acasă. Trecerea în revistă a proprietăților de bază ale solidelor, lichidelor și gazelor; găsiți exemple despre cum aceste proprietăți pot fi utilizate în viața de zi cu zi.
Toate corpurile sunt formate din atomi sau molecule (particule de materie) care se mișcă aleatoriu și, de asemenea, interacționează cu forțele de atracție și repulsie. Sunt diferențele în mișcarea termică Aceste particule, precum și interacțiunea lor în diferite condiții, determină faptul că materia are mai multe stări de agregare: gazoasă, lichidă, solidă. Această lecție este dedicată trăsăturilor acestor stări.
Un atom este format dintr-un nucleu încărcat pozitiv și electroni încărcați negativ care orbitează în jurul nucleului. Un atom, ca o moleculă, este neutru din punct de vedere electric.
Să luăm în considerare forța de interacțiune dintre particule folosind exemplul a două molecule staționare.
Există forțe gravitaționale și electromagnetice între corpuri din natură. Deoarece masele de molecule sunt extrem de mici, forțele de interacțiune gravitațională dintre ele pot fi ignorate. La distanțe mari nu există nicio interacțiune electromagnetică între molecule.
Pe măsură ce distanța dintre particule scade (vezi fig. 1), ele încep să se orienteze astfel încât părțile lor față în față vor avea sarcini de semne diferite (în general, moleculele rămân neutre) și, ca urmare, apar forțe atractive. între molecule (forță de atracție maximă la distanță de 2-3 diametre moleculare). Pe măsură ce distanța dintre molecule scade, forțele de respingere apar ca urmare a interacțiunii învelișurilor de electroni încărcate negativ ale atomilor moleculelor. În consecință, asupra moleculei se acționează suma forțelor: atracție și repulsie (la distanțe mari predomină forța de atracție, la distanțe mici predomină forța de respingere).
Orez. 1. Interacțiunea dintre molecule
Figura 2 prezintă un grafic al dependenței forței de interacțiune dintre molecule de distanța dintre ele. Linia roșie arată forța de atracție, linia albastră arată forța de respingere, iar linia verde arată graficul forței finale. Mărimea este distanța dintre molecule la care forțele de atracție devin egale cu forțele de respingere (poziția de echilibru stabilă).
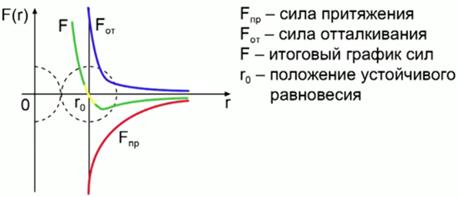
Orez. 2. Graficul forței de interacțiune dintre molecule în funcție de distanța dintre ele
Moleculele situate la distanță unele de altele și conectate prin forțe electromagnetice au energie potențială. Într-o poziție stabilă de echilibru, energia potențială a moleculelor este minimă. Într-o substanță, fiecare moleculă interacționează simultan cu multe molecule învecinate, ceea ce afectează și valoarea energiei potențiale minime a acestora. În plus, toate moleculele unei substanțe sunt în mișcare continuă, adică au energie cinetică. Astfel, structura unei substanțe și proprietățile acesteia (corpi solid, lichid, gazos) este determinată de relația dintre energia potențială minimă de interacțiune a moleculelor și rezerva lor de energie cinetică a mișcării termice.
Distanța medie dintre particulele de gaz este mult mai mare decât dimensiunea particulelor în sine; astfel, în intervalele dintre coliziuni, particulele de gaz parcurg distanțe care sunt cu câteva ordine de mărime mai mari decât propriile dimensiuni. De exemplu, în aer (în condiții normale) calea liberă medie a unei molecule este , care este de o mie de ori mai mare decât dimensiunea medie a moleculei.
Cu distanțe atât de mari între molecule, forțele de interacțiune intermoleculară dintre ele sunt foarte mici. Din punct de vedere energetic, aceasta înseamnă că energia potențială de interacțiune a moleculelor (comparativ cu energia cinetică a mișcării lor) poate fi neglijată.
Dacă luăm în considerare energia cinetică, adică mișcarea moleculelor de gaz, atunci este de remarcat faptul că fiecare dintre ele participă nu numai la translație, ci și la mișcare de rotație(dacă nu este un gaz monoatomic) și dacă luăm în considerare interacțiunea foarte mică a moleculelor de gaz, atunci și aceste molecule vor lua parte la mișcarea vibrațională (vezi Fig. 3).
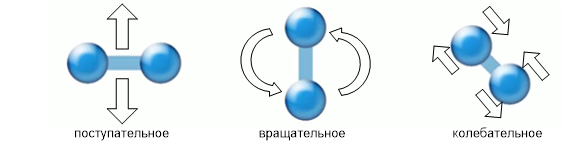
Orez. 3. Tipuri de mișcări moleculare
Astfel, orice moleculă de gaz, fără a experimenta o interacțiune puternică cu vecinii săi, poate ajunge oricând într-un loc arbitrar din vas, motiv pentru care se spune că gazele nu își păstrează nici forma, nici volumul. Această proprietate a gazelor este utilizată pe scară largă în tehnologie moderna(echipament pneumatic, motoare termice etc.).
Solidele sunt exact opusul gazelor. Nu există mișcare liberă a particulelor în ele. Moleculele sunt situate la nodurile rețelei cristaline (vezi Fig. 4). Adică, există o ordine periodică strictă în aranjarea particulelor care alcătuiesc un corp solid.
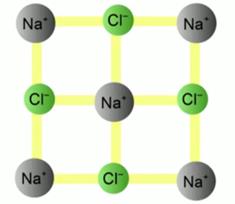
Orez. 4. Rețea cristalină NaCl (sare de masă)
La solide, energia potențială de interacțiune este foarte semnificativă; energia cinetică, în comparație cu energia potențială, nu este mare. Atomii, moleculele sau ionii efectuează numai mișcări vibraționale în apropierea poziției de echilibru. Distanțele dintre particulele învecinate sunt aproximativ egale cu dimensiunile particulelor în sine.
Tipurile de rețele cristaline diferă în funcție de substanță (principalul este periodicitatea și ordinea). Punctele din spațiu în care se află particulele unui corp solid se numesc noduri ale rețelei cristaline.
Datorită stabilității și ordinii în aranjarea particulelor la nodurile rețelei cristaline, fizicienii spun că solidele au ordine pe distanță lungă și scurtă în aranjarea particulelor de materie (vezi mai jos).
Solidele își păstrează forma și volumul (de exemplu, dacă supuneți un arc la deformare, acesta va reveni la forma anterioară fără a-și schimba volumul).
Fiecare moleculă de lichid, deși nu sunt aranjate la fel de strict și ordonat ca în corp solid, înconjoară același număr de molecule „învecinate” (vezi Fig. 5). Dar dacă te uiți la moleculele unui lichid de departe, atunci nu putem vorbi despre nicio ordine în lichid; vom observa haos. Prin urmare, ei spun că în solide există ordine pe rază scurtă și ordine pe rază lungă, dar în lichide există doar ordine pe rază scurtă. În corpurile gazoase nu există atât ordine pe distanță scurtă, cât și pe distanță lungă.

Orez. 5. Ordinea pe distanță lungă și scurtă în aranjarea particulelor de materie
Lichidele, spre deosebire de solide, au o ordine scurtă în aranjarea particulelor de materie.
Particulele din corpurile lichide sunt „împachetate” strâns și, ca și în corpurile solide, oscilează în jurul poziției de echilibru. O încercare de a comprima rapid un lichid duce la deformarea moleculelor și întâmpină o rezistență puternică din partea lichidului. Adică lichidele sunt practic incompresibile.
Deși moleculele unui lichid sunt dispuse aproape în același mod ca într-un solid, lichidul are fluiditate. Acest lucru se explică prin faptul că, spre deosebire de solid, vibrațiile moleculelor în jurul poziției de echilibru într-un lichid nu sunt eterne; la un moment dat în timp, molecula face un „salt”, deplasându-se într-o altă poziție. În consecință, lichidul își păstrează bine volumul, dar nu își păstrează forma.
Din punct de vedere energetic, un lichid ocupă o poziţie intermediară între un solid şi un gaz - particulele lichide au semnificative, la nivel microscopic, atât energie cinetică de mişcare, cât şi energie potenţială de interacţiune.
Starea amorfă a unui corp se numește intermediară între solid și lichid. Un exemplu de astfel de substanță este plastilina, rășina, sticla.
Moleculele din substanțele amorfe sunt aranjate asemănător cu moleculele dintr-un lichid, adică au ordine de rază scurtă, dar nu au ordine de rază lungă.
Este posibil, cu un anumit grad de convenție, să numim corpuri amorfe foarte lichide vâscoase. Puteți verifica acest lucru uitându-vă la profilul sticlei din castele antice. În partea de sus, acești pahare sunt mult mai înguste decât în partea de jos - sticla „curge” în jos de-a lungul multor ani (vezi Fig. 6), fără a-și schimba structura interna. La urma urmei, de exemplu, ghețarii pot curge și în jos. Dar acest lucru se datorează topirii ghețarului și cristalizării în continuare a apei.

Orez. 6. Profil de geam pentru fereastră într-un castel antic
În solide, particulele au energie potențială semnificativă și energie cinetică relativ mică, deoarece efectuează mișcări oscilatorii în apropierea poziției de echilibru.
Lichidele ocupă o poziție intermediară, deoarece particulele lichide au atât energie cinetică de mișcare, cât și energie potențială de interacțiune, iar în gaze moleculele au energie cinetică mare de mișcare și energie potențială de interacțiune relativ mică (neglijabilă).
Bibliografie
- G.Ya. Myakishev, B.B. Buhovtsev, N.N. Sotsky. Fizica 10. - M.: Educație, 2008.
- Gendenshtein L.E., Dick Yu.I. Fizica clasa a X-a. - M.: Ilexa, 2005.
- Kasyanov V.A. Fizica clasa a X-a. - M.: Dropia, 2010.
- Class-fizika.spb.ru ().
- Kaf-fiz-1586.narod.ru ().
- Prezentare ().
- Întrebările (1-4) de la sfârșitul paragrafului 47 (pag. 229); Kasyanov V.A. Fizica nota 10 (vezi lista literaturii recomandate) ().
- Cum diferă traiectoriile moleculelor de gaz, lichid și solid?
- Prin răcirea puternică a aerului, acesta poate deveni lichid. În același timp, volumul ocupat de aer este redus de aproape 700 de ori. Trageți o concluzie din acest fapt: ce fracțiune din volumul gazului este volumul moleculelor în sine?
- Gazul este capabil de expansiune nelimitată. De ce există atmosfera Pământului?
Proprietățile fizice ale lichidelor, gazelor și solidelor.
Pentru a înțelege mai bine conceptul de mediu continuu solid, lichid și gazos, luați în considerare proprietățile pur (constante compoziție chimică) materiale. Să luăm ca exemplu apa. Din fizică se știe că substanțele pure pot exista în patru stări de agregare: cristalină, lichidă, gazoasă și plasmă. Mai jos este o diagramă de fază pentru apă pentru ilustrare.
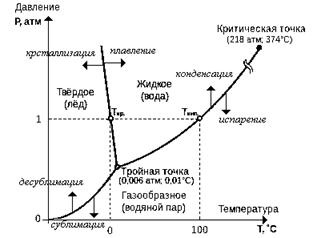 Fig.1.1. Diagrama de fază a apei. Fig.1.1. Diagrama de fază a apei. |
Proprietățile fizice ale materialelor sunt determinate de interacțiunile lor intermoleculare (interatomice). La temperaturi scăzute (energii scăzute), are loc structura cristalină a moleculei sau atomii sunt interconectați rigid și vibrează în jurul centrelor rețelei cristaline, iar mediul este de obicei numit cristalin. În fizică se obisnuieste sa se spuna ca are loc comanda pe termen lung. În acest caz, rețeaua în sine poate conține încălcările sale - dislocații, locuri libere (absența unui atom într-un site rețelei), etc. Ne va interesa în primul rând problema schimbărilor în caracteristicile unui mediu continuu sub influența forțelor.
Deformare(din latină defogmatio - ʼʼdistortionʼʼ) - o schimbare a poziției relative a particulelor corpului asociată cu mișcarea lor una față de alta. Deformarea este rezultatul modificărilor distanțelor interatomice și al rearanjarii blocurilor de atomi.
Pentru a deforma un cristal, trebuie să i se aplice forțe mari; prin urmare, corpurile cristaline (solide) sunt considerate incompresibile. Să considerăm o tijă dintr-un material solid de secțiune transversală constantă, la capetele căreia se aplică o tensiune (Fig. 1.2.). Deformarea liniară poate fi descrisă prin mărimea adimensională
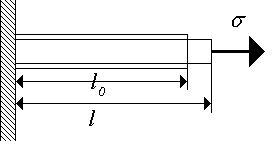 Orez. 1.2. Deformarea la tracțiune a tijei. Orez. 1.2. Deformarea la tracțiune a tijei. |
Mai jos (Fig. 1.3.) sunt diagrame ale dependenței efortului de deformația liniară.

Orez. 1.3. Diagrame de tensiune pentru material generalizat.
Pentru majoritatea materialelor solide există o secțiune liniară până când solicitarea depășește - limita de proporționalitate. Legea lui Hooke este valabilă în acest domeniu. Pentru această zonă, deformarea este reversibilă - după îndepărtarea sarcinii, deformația dispare; o astfel de deformare este de obicei numită elastic- . Este urmată de o secțiune cu o dependență neliniară și are loc o deformare reziduală ( plastic) care se formează după îndepărtarea sarcinii. În acest caz, un număr de materiale au un platou de curgere clar definit (proba continuă să se deformeze chiar și sub sarcină constantă, Fig. 1.3.a), dar un număr de materiale nu o fac (Fig. 1.3.b). Pentru primele materiale se introduce o valoare - limita de curgere, pentru a doua se introduce o limită de curgere condiționată - efortul la care deformarea plastică, după îndepărtarea sarcinii, este de 0,2% sau 0,002. În primul caz, secțiunea este o secțiune de deformare plastică, secțiunea este o secțiune de curgere. Rețineți că materialul curge uniform pe toată lungimea tijei.
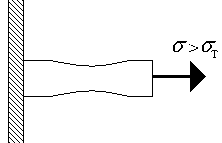 Fig.1.4. Formația cervicală. Fig.1.4. Formația cervicală. |
O creștere suplimentară a sarcinii duce la o distribuție neuniformă a deformării de-a lungul lungimii tijei (Fig. 1.4) - într-un loc puteți observa formarea unui gât (Fig. 1.4.). Deformarea materialului în punctul A (Fig. 1.3.a) constă tot din plastic și elastic. O creștere suplimentară a sarcinii duce la distrugerea materialului atunci când acesta își atinge rezistența maximă.
Stresul pe care un anumit material îl poate rezista în practică fără a se prăbuși sau a primi deformații periculoase se numește acceptabil si noteaza . De obicei, toate calculele sunt efectuate pe baza legilor lui Hooke. Pentru a asigura rezistența în toate circumstanțele, efortul admisibil este selectat ca parte a rezistenței la tracțiune, în special pentru metale [s] = 0,2 s m, iar pentru lemn [s] = 0,1 s m. Trebuie remarcat că cele mai mari deformații care pot rezista materialului nu sunt determinate de întinderea regiunii de curgere. Dacă suprafața de producție este mare, atunci materialul este de obicei numit plastic. Un material precum oțelul poate rezista la sarcini grele fără a se rupe. Dimpotrivă, dacă suprafața de producție este mică, atunci materialul este fragil. Materialele fragile, cum ar fi fonta, sunt distruse prin deformare. În unele cazuri, materialele plastice pot ceda chiar și la deformații mici (de exemplu, oțelul la temperaturi scăzute). Caracteristicile de rezistență ale materialelor solide depind în mod semnificativ de temperatura materialului.
Odată cu creșterea energiei, numărul de încălcări ale rețelei cristaline crește și acest proces merge în dinamică (undeva dispar, iar undeva se formează din nou). La atingerea unui anumit prag de energie, elasticitatea dispare. În acest caz există ordine de închidere, și un astfel de material este de obicei numit lichid. Distanța medie caracteristică dintre moleculele (atomii) lichidului și cristalul corpului este aproximativ aceeași și egală cu ʼʼ (3¸4)10 -6 m. Densitățile fazelor lichide și cristaline sunt, de asemenea, aproximativ aceleași . Deci densitatea apei, densitatea benzinei, kerosenului, motorinei, uleiului. În același timp, lichidul, din cauza rupturii de obligațiuni, capătă o nouă proprietate fluiditate - capacitatea de a se deforma sub influența unor influențe externe arbitrar mici până când solicitările de forfecare interne devin egal cu zero. Pe măsură ce temperatura crește, fluiditatea corpului crește. În acest caz, lichidul, ca un solid, este incompresibil (densitatea rămâne aproape neschimbată). O creștere suplimentară a temperaturii duce la ruperea completă a legăturilor (lipsa ordinii pe distanță scurtă). Materialul în această stare este de obicei numit gaz. O trăsătură caracteristică a corpurilor gazoase este mișcarea haotică și ciocnirea moleculelor în spațiu. Din acest motiv, gazele au nu numai fluiditate, ci și compresibilitatea.
Luați în considerare un vas plin cu lichid cu o zonă de bază și pereți verticali. Să aplicăm forță și să creștem presiunea în volum cu o cantitate Dp(Fig. 1.5). Mediul continuu se va comprima, reducându-și volumul cu . S-a constatat empiric că relația dintre modificarea volumului și presiune este liniară, ᴛ.ᴇ. pentru fiecare lichid, puteți introduce o constantă, care se numește coeficient de dilatare volumetrică (la temperatură constantă):
 .
(1.3.2)
.
(1.3.2)
Raportul de compresie volumetric are o dimensiune (Pa) -1. Semnul minus indică faptul că volumul scade sub compresie.
Modulul de elasticitate în vrac este de obicei numit reciprocă a:
Ambele cantitati depind de temperatura si tipul lichidului.Modulul de elasticitate vrac pentru apa la T= 293°K este egal cu = 2×10 9 Pa ʼʼʼ20000 kgf/cm 2 .
Dacă pentru apă pe lângă presiune atmosferică (r a=101325 Pa sau 1,033 kgf/cm 2), va acţiona suplimentar aceeaşi presiune, apoi volumul de apă va scădea cu aproximativ 1/20000, ᴛ.ᴇ. practic este imposibil de observat. În consecință, apa și alte lichide pot fi considerate incompresibile și densitatea lor considerată constantă ( r= const), independent de presiune. Pentru majoritatea lichidelor, densitatea scade cu creșterea temperaturii, cu excepția apei, a cărei densitate are maxim la 4 o C. Prin analogie cu (1.3.2), se poate introduce coeficientul de dilatare termică volumetrică.
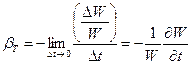 ,
,
atunci densitatea lichidului trebuie calculată folosind formula:
aici densitatea în condiții standard (), este temperatura în grade Celsius.
După cum sa menționat mai sus, principala diferență dintre gaz și lichid este, în esență, că gazul este ușor comprimat. În ea, viteza de propagare a sunetului (și, prin urmare, a tuturor perturbațiilor mecanice) este semnificativ mai mică decât în lichid. Această caracteristică a unui gaz trebuie luată în considerare atunci când viteza de mișcare (sau viteza de mișcare a unui corp solid în el) devine proporțională cu viteza sunetului sau o depășește.
Spre deosebire de un gaz, un lichid are o suprafață de limită clar definită între el și gazul care îl înconjoară, care se numește în mod obișnuit suprafața liberă. În câmpul gravitațional, suprafața liberă a lichidului are un profil orizontal. În condiții de imponderabilitate, din cauza tensiunii superficiale, suprafața liberă este sferică. Această proprietate a unui lichid, precum și compresibilitatea sa scăzută, se datorează interacțiunii constante a moleculelor învecinate. Într-un gaz, moleculele interacționează între ele numai în momentul ciocnirii, cel mai De-a lungul timpului, se mișcă liber în spațiu și, prin urmare, datorită caracterului aleatoriu al mișcării, gazul tinde să fie distribuit uniform în întreaga zonă închisă a spațiului. Dacă spațiul nu este închis, atunci volumul de gaz poate crește fără limită.
Într-un gaz, puteți reduce nelimitat presiunea și crește temperatura și, în același timp, proprietățile gazului se vor schimba continuu. Într-un lichid, presiunea poate scădea până la o anumită valoare, sub care încep să se formeze bule de gaz în interiorul acestuia și încep tranzițiile de fază, care modifică calitativ proprietățile mediului fluid. Același lucru se poate întâmpla atunci când temperatura lichidului crește. Ecuația de stare. Folosit adesea în MSS cu doi parametri sau simplu Miercuri. Adică un mediu, a cărui toți parametrii termodinamici pot fi calculați în două moduri, prin relații numite ecuatii de stare .
Există două tipuri de ecuații de stare.
Termic ecuația de stare
Caloric ecuația de stare
Iată energia internă specifică (pe unitate de masă).
Pentru gaz, se poate folosi destul de eficient un model de gaz descris de ecuația de stare termică Clayperon-Mendeleev:
Unde G– constanta de gaz, un astfel de gaz se numește de obicei perfect sau (perfect termic.
, G o=8,3144 J/(mol×K) – constantă universală de gaz.
Masa molară a gazului, = kg/mol.
Ecuația de stare Van Der Waals este adesea folosită, dar este valabilă pentru o gamă mai largă de temperaturi și presiuni:
Coeficienți în ecuația Van Der Wals
De asemenea, observăm că ecuația Van Der Wals este folosită și pentru a descrie lichide, dar în condiții normale oferă doar o descriere calitativă.
Pentru lichidele cu picături, pentru care compresibilitatea este extrem de scăzută, pe o gamă largă de modificări de presiune, relația dintre densitate și presiune este liniară:
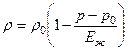 ,
,
Unde este densitatea corespunzătoare presiunii - modulul de compresie volumetrică, ordinul căruia este de 10 4 MPa.
Pentru presiuni și temperaturi ridicate, este de preferat ecuația de stare cu doi termeni:
![]()
Deci, pentru apă sunt utilizate următoarele valori ale constantelor definitorii: ![]()
Pentru un proces adiabatic (când nu există transfer de căldură și masă între volumul de gaz eliberat și mediu inconjurator) este caracteristică următoarea dependență:
Unde - constanta de gaz adiabatic (indice adiabatic); cu v - capacitatea termică a gazului la volum constant; cu p - la fel la presiune constantă. Un astfel de gaz este de obicei numit perfect termic și caloric sau politropică.
Vâscozitatea lichidelor și gazelor. Proprietățile reologice ale lichidelor. Viscozitate se obișnuiește să se numească proprietatea unui mediu fluid, ĸᴏᴛᴏᴩᴏᴇ, constă în apariția în el a unor forțe interne care împiedică deformarea acestuia, ᴛ.ᴇ. schimbând poziţia relativă a părţilor sale. Sa luam in considerare caz special teoria molecular-cinetică a unui gaz ideal - flux de forfecare simplu (Fig. 1.6).
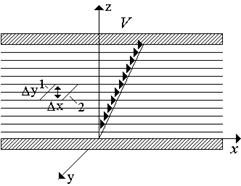 Fig.1.6. Tensiuni vâscoase în lichide și gaze Fig.1.6. Tensiuni vâscoase în lichide și gaze |
Zona elementară a suprafeței care separă straturile 1 și 2 se mișcă împreună cu lichidul. În acest caz, stratul lichid 1 alunecă peste stratul 2 cu o viteză relativă. Moleculele de gaz participă la două tipuri de mișcări:
1. ordonat (longitudinal) cu viteza;
2. mișcare termică haotică, dezordonată, a cărei viteză este de obicei cu două ordine de mărime mai mare decât viteza mișcării ordonate.
Vâscozitatea unui gaz se datorează transferului de molecule în timpul mișcării lor termice (difuzie) printr-o zonă elementară situată într-un plan care separă două straturi care au viteze longitudinale și impuls diferite datorită diferenței de viteze ale acestor straturi. Moleculele se deplasează haotic într-o manieră aleatorie, în timp ce se deplasează de la un strat la altul, traversând zona. Moleculele cu viteză ordonată intră în stratul 2 șiîncetinește mișcarea acestuia, iar același număr de molecule care intră în stratul 1 din stratul 2 accelerează stratul 1. Cu toate acestea, vâscozitatea mediului se manifestă numai atunci când mediul se mișcă.
Este important de menționat că, pentru un mediu continuu, se crede că un stres tangențial acționează asupra locului, compensând transferul de impuls cauzat de mișcarea termică a moleculelor. Conform teoriei cinetice moleculare, acest stres de forfecare
![]() (1.3.6)
(1.3.6)
Unde h - coeficient de vâscozitate dinamică (vâscozitate dinamică) gaz Valoarea sa este determinată de proprietățile fizice ale mediului. Semnul tensiunii este ca și cum ar „încerca” să reducă diferența de viteză dintre straturi.
Dependența (1.3.6) este valabilă pentru majoritatea gazelor și lichidelor și este de obicei numită Legea lui Newton pentru tensiunile vâscoase. Spre deosebire de legea frecării uscate, efortul de forfecare nu depinde de efortul normal.
Conform definiției (1.3.6), coeficientul de vâscozitate dinamică hîn sistemul SI are următoarea unitate de măsură:

În practică, uneori ca unitate h folosiți P = g/cm×s, care se numește poise (în cinstea medicului francez A. Poiseuille, care a efectuat cercetări fundamentale asupra mișcării unui fluid vâscos): Pa×s = 10×P.
Merită spus că pentru mediile incompresibile () se recomandă utilizarea cantității
![]() . (1.3.7)
. (1.3.7)
numit coeficientul de vâscozitate cinematică(vâscozitatea cinematică). În practică, se folosește adesea valoarea St = cm 2 /s, care se numește de obicei Stokes (în onoarea hidromecanicului englez J. Stokes, care a formulat ecuatii diferentiale mişcarea unui fluid vâscos): 1St = 10 -4 m 2 /s.
Pentru a măsura vâscozitatea, instrumentele numite viscozimetre.
Pentru lichidele transparente se folosește un viscoziometru Stokes - un pahar înalt cu diviziuni în care se introduc de sus bile mici dintr-o substanță cu o densitate apropiată de densitatea lichidului și se măsoară viteza de cădere a bilei. Deoarece greutatea, forța lui Arhimede și forța de rezistență sunt cunoscute pentru viteze mici de mișcare, iar bila se mișcă uniform, coeficientul de vâscozitate este ușor de calculat.
Merită spus că pentru lichidele opace se folosește Engler, cu ajutorul căruia se determină vâscozitatea condiționată, care se măsoară în aproximativ E - grade Engler. Numărul Engler este determinat de raportul dintre timpul de curgere a lichidului de testat la o temperatură dată de la un viscozimetru și timpul de curgere a apei distilate de la același dispozitiv la temperatură normală (20 °C). Conversia gradelor Engler în unități de vâscozitate cinematică (Stokes) se realizează folosind formula empirică Ubellode:
![]() . (1.3.8)
. (1.3.8)
În tabel Figura 1.1 prezintă valorile lui h, r, n pentru unele lichide și gaze, iar Figura 1.7 arată dependența apei și aerului de temperatură.
Tabelul 1.1
Valorile lui h, r, n pentru unele lichide și gaze

Fig.1.7. Dependența coeficientului de vâscozitate cinematică de temperatură.
Din datele de mai sus rezultă că vâscozitatea apei scade odată cu creșterea temperaturii de la 0 la 100 ° C de aproape șapte ori, iar vâscozitatea aerului crește cu creșterea temperaturii de la 20 la 50 ° C cu 25% . Rețineți că în gaze, vâscozitatea și difuzia sunt determinate de același lucru mecanism fizic- mișcarea haotică termică a moleculelor. Din acest motiv, coeficientul de vâscozitate cinematică n este de același ordin de mărime ca și coeficientul de difuzie moleculară. În lichide, vâscozitatea și difuzia sunt diferite natura fizica. Ca o consecință a acestui fapt, coeficientul de difuzie într-un lichid este de sute de ori mai mic decât coeficientul de vâscozitate.
Odată cu creșterea temperaturii în gaz, viteza de mișcare haotică a moleculelor crește, ceea ce duce la o creștere a numărului de molecule care traversează zona pe unitatea de timp și, în consecință, la transferul de impuls de la un strat la altul și, în consecință, la stresul tangențial crește. Conform (1.3.6) aceasta înseamnă că Cu Pe măsură ce temperatura crește, coeficientul dinamic al vâscozității gazului crește .
ÎN lichide Motivul principal pentru transferul de impuls este interacțiunea moleculelor situate pe părți opuse ale graniței dintre straturi și nu transferul moleculelor peste această limită. Din acest motiv, Cu Pe măsură ce temperatura crește, coeficientul dinamic de vâscozitate al lichidului scade(spre deosebire de gaze).
Pentru calcule în practica inginerească se folosesc valoare aproximativă coeficientul cinematic al vâscozității apei n= 0,01 cm 2 /s = 0,01 Art.
Mai mult, există multe lichide pentru care legea lui Newton nu este valabilă. Astfel de lichide se numesc non-newtonian, și știința naturii dependenței ![]() numită de obicei reologie (greacă reo - flux, logos - predare). Proprietățile lor vor fi discutate mai detaliat mai târziu în capitolul 4.
numită de obicei reologie (greacă reo - flux, logos - predare). Proprietățile lor vor fi discutate mai detaliat mai târziu în capitolul 4.
Moleculele situate la interfața dintre medii sunt fie atrase, fie respinse de mediul vecin. Ca urmare, ar trebui să apară forțe de tracțiune pe interfața curbată dintre medii, având tendința de a îndrepta interfața.
Tensiunea de tracțiune (forța pe unitate de lungime) este de obicei numită coeficient de tensiune superficială. Pentru limita de apă și aer (suprafață liberă) la T = 293 K° = 72,8∙10-3 N/m. Coeficientul de tensiune superficială scade odată cu creșterea temperaturii și este practic independent de presiune. Tensiunea de suprafață trebuie redusă folosind agenți tensioactivi, care includ detergenți. Această proprietate a lichidelor se manifestă cel mai clar la interfața dintre trei medii (gaz, lichid, solid). Există lichide umede și neumezive (Fig. 16). Unghi - numit de obicei unghi de umezire.
Orez. 1.8. Lichide umede și neumezitoare.
Diferența de presiune creată de forțele de suprafață pe o suprafață curbă trebuie calculată folosind formula lui Laplace
 , (1.3.9)
, (1.3.9)
unde sunt principalele curburi ale suprafeței. Este important de reținut că pentru formațiunile sferice (picătură, bule, minge) formula ia forma:
Aici este raza formațiunii sferice.
Pentru apă este adevărată următoarea relație:
![]() ,
,
Iată temperatura în grade Celsius.
Pentru a rezuma, să ne amintim că MSS operează cu modele continuum. Tabelul 1 prezintă principalele caracteristici ale celor trei modele de bază.
Tabelul 1. Principalele caracteristici ale modelelor de medii continue.
Utilizarea oricărui model pentru a descrie caracteristicile unui mediu real este determinată de condițiile în care se află acest mediu. Deci, de exemplu, dacă viteza gazului este mică (numărul Mach, egal cu raportul dintre viteză și viteza sunetului, este mai mic de 0,2), gazul poate fi considerat un lichid incompresibil.
Sticla este de obicei descrisă ca un solid deformabil, dar din punct de vedere fizic este un lichid cu o vâscozitate anormal de mare. Lichidele, la presiuni și temperaturi ridicate, de exemplu într-o explozie sau la adâncimi mari, devin compresibile.
Să fim atenți încă o dată la Fig. 1.1. Din aceasta rezultă că aceeași substanță, în funcție de condiții (presiune și temperatură), poate fi în diferite stări de agregare. O modificare a stării de agregare este întotdeauna însoțită de o schimbare a energiei sistemului (tranziții de fază de ordinul întâi). Această diagramă și altele similare corespund cazului proceselor de echilibru pentru substanțe omogene din punct de vedere chimic. În practică, acest lucru nu este întotdeauna adevărat. Astfel, un lichid supus încălzirii se poate transforma în vapori la fierbere; în acest caz, se formează o nouă fază sub formă de bule fie pe suprafața încălzită a vasului, fie în lichidul însuși. În mod similar, atunci când presiunea dintr-un lichid scade brusc, în el se formează bule de vapori; acest fenomen se numește cavitație (din latină cavita - gol). Ulterior, bulele se deplasează într-o zonă cu presiune crescută și se prăbușesc, formându-se undă de șoc, ceea ce duce la distrugerea suprafețelor solide care curg în jurul lichidului.
În mediile formate din mai multe substanțe, tranzițiile de fază au propriile lor specificități. Deci, în amestecurile de gaze (aer, gaz natural), condensul are loc pentru diferite componente la diferite presiuni și temperaturi. Această proprietate este utilizată pentru a separa orice fracție de gaz.
Pentru diferite lichide, solubilitatea gazelor este diferită și se modifică odată cu creșterea presiunii.
Volumul relativ de gaz dizolvat într-un lichid până când este complet saturat poate fi considerat direct proporțional cu presiunea:
unde este volumul gazului dizolvat, este volumul lichidului, este presiunea finală și inițială a gazului, este coeficientul de solubilitate. Coeficientul de solubilitate în aer k are următoarele valori la t= 20 °C:
– pentru apă k= 0,016;
– pentru kerosen k= 0,127;
– pentru ulei de transformator k= 0,083;
– pentru ulei industrial k= 0,076.
Când presiunea într-un lichid scade, gazul dizolvat în acesta este eliberat, iar gazul este eliberat din lichid mai intens decât se dizolvă în el.
1.4. Metode de descriere a mișcării unui mediu continuu. Derivat local și substanțial.
Circulaţie - o proprietate integrală a materiei, în legătură cu aceasta, în lumea din jurul nostru cu care ne confruntăm constant tipuri variate mișcări, incl. și mișcarea diferitelor mijloace de informare în masă. Deci, în afacerile cu petrol și gaze trebuie să se ocupe de mișcarea lichidelor și gazelor prin conducte și în interiorul diferitelor mașini și mecanisme; cu filtrare, filtrare a lichidelor și gazelor printr-un mediu poros; cu deformarea diferitelor tipuri de structuri (rezervoare, rezervoare, supape etc.), deplasări geologice. Din acest motiv, este important să cunoaștem legile interacțiunii lichidului și gazului cu limitele curgerii (în special legile rezistenței țevilor, dispozitivelor de trecere, constricțiilor, duzelor), distribuția neuniformă a debitelor de mare viteză, legile filtrării a lichidelor și gazelor printr-un mediu poros, echilibrul lichidelor și corpurilor care plutesc pe suprafața unui lichid, propagarea undelor și vibrațiilor în corpuri solide și lichide.
Problemă de cinematică- descrierea mișcării mediului, indiferent de condițiile externe care inițiază și susțin mișcarea. Caracteristicile cinematice includ coordonatele particulelor, viteza și accelerația. Există două abordări pentru a descrie mișcarea unui mediu continuu. Prin metoda Lagrange se ia în considerare mișcarea fiecărei particule de fluid.
Să luăm în considerare mișcarea unei particule în unele anumit sistem coordonate dreptunghiulare și rectilinie Oxyz, pe care suntem de acord să-l numim nemișcat (sistemul observatorului). Fie că în momentul inițial de timp particula ocupă o poziție cu coordonate. În acest caz, pentru a descrie mișcarea completă a unui punct, este extrem de important să cunoaștem ecuația mișcării sale ᴛ.ᴇ. ![]() , unde este vectorul raza punctului.
, unde este vectorul raza punctului.
Se numește o curbă descrisă de pozițiile succesive ale unui punct în mișcare traiectorie.
Mișcarea unui punct este determinată dacă sunt date coordonatele acestuia x, y, z, ca funcții continue ale timpului t:
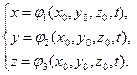 (1.4.1)
(1.4.1)
Aceste ecuații determină poziția unei particule în mișcare în fiecare moment de timp tși reprezintă ecuația traiectoriei în formă parametrică. Variabilele sunt numite Variabilele Lagrange. Coordonatele lagrangiene- sunt parametri care caracterizează fiecare punct al mediului și nu se modifică în timpul mișcării particulei. Cu toate acestea, punctul de vedere al lui Lagrange se bazează pe o descriere a istoriei mișcării fiecărui punct al mediului continuu separat.
Viteza unui punct în mișcare este egală cu derivata în timp a vectorului rază al particulei în mișcare și este un vector cu proiecții:
Punct geometric bazat pe timp. Din acest motiv, câmpul de viteză este specificat în funcție de coordonatele geometrice și de timp:
![]() (1.4.4)
(1.4.4)
Linia curentă Se obișnuiește să se numească o dreaptă a cărei tangentă coincide în fiecare moment de timp cu direcția vectorului viteză. Prin urmare, ecuația liniilor de curgere are forma:
Caracteristicile unui mediu continuu (câmp de viteză, câmp de presiune, câmp de stres etc.) legate de elementele staționare fixe ale spațiului geometric (puncte, linii, suprafețe, volume), iar aceste elemente în sine sunt numite variabile Euler.
Pentru metoda lui Euler, viteza este o funcție atât de coordonate, cât și de timp. Din acest motiv, accelerația, precum și alte mărimi hidromecanice care se modifică odată cu mișcarea volumului fluidului, sunt exprimate prin tip special derivată, care este legată într-un anumit fel de câmpul de viteză. În același timp, acest derivat trebuie să fie asociat cu mișcarea particulelor de lichid sau gaz (substanță). Acest derivat se numește completă sau substanțială
Lecția nr. 41 Clasa a VII-a
TEMA: Proprietățile gazelor. lichide și solide
Scopul lecției: Să-și formeze idei despre structura materiei în diferite stări de agregare. Explicați în termeni de teoria moleculară caracteristici structura internă a substanțelor în stare gazoasă, lichidă și solidă.
Obiectivele lecției:
Educațional: Dezvoltarea cunoștințelor despre proprietățile mecanice ale solidelor, lichidelor și gazelor pe baza ideilor despre structura moleculară a materiei.
Dezvoltare: Continuarea dezvoltării abilităților de stabilire a relațiilor cauză-efect între fapte, fenomene și motivele care le-au determinat, formularea de ipoteze, justificarea lor și verificarea autenticității acestora.
Educarea: Continuați să dezvoltați interesul cognitiv pentru disciplina „Fizică”
Tip de lecție: învăţarea de materiale noi
ÎN CURILE CURĂRILOR
I. Partea organizatorică (salut, verificarea pregătirii pentru lecție, starea emoțională)
Buna baieti! Astăzi vom continua să deschidem pagini pentru a înțelege lumea din jurul nostru. Descoperiri interesante ne așteaptă înainte. Gata? Da! Atunci hai să începem...
II. Stabilirea obiectivelor și motivația
Omul a încercat de mult să explice fenomenele care au loc în natură, să cunoască nu numai audibilul, ci și inaudibilul, nu numai vizibilul, ci și invizibilul.
În ce trei grupe pot fi împărțite următoarele substanțe: apă, piatră, aer, tablă, alcool, zahăr, gaz natural, gheață, oxigen, ulei vegetal, aluminiu, lapte, azot(aceste substanțe sunt date la temperatura camerei).
Ați împărțit substanțele în trei grupe: solide, lichide și gazoase. Suntem obișnuiți să vedem multe dintre ele într-o anumită stare. De exemplu, fierul este un solid, uleiul vegetal este un lichid, hidrogenul este un gaz. Cu toate acestea, există și cei care apar în viața noastră în trei stări deodată, CE? de exemplu, apa: starea solidă a apei este gheața, starea lichidă este apă, starea gazoasă este vapori de apă. Să încercăm să ne dăm seama cum diferă aceste substanțe unele de altele.
Cum crezi că ar putea suna subiectul lecției noastre?
Tema lecției noastre de astăzi
« Proprietățile gazelor. lichide și solide» .- scriind într-un caiet
Care credeți că va fi scopul nostru în această lecție?
Scopul pe care ni ne-am propus astăzi este să aflăm ce proprietăți au solidele, lichidele și gazele, să explicăm aceste proprietăți pe baza cunoștințelor despre diferențele de aranjare, mișcare și atracție a moleculelor.
Scrierea pe tablă (scop pentru elevi)
Proprietățile solide, lichide și gaze
Aranjarea moleculelor în solide, lichide și gaze
Mișcarea moleculelor în solide, lichide și gaze
Interacțiunea moleculelor în corpurile solide, lichide și gazoase
III. Absorbție primară cunoștințe noi
Pentru a sistematiza cunoștințele noastre dobândite despre structura materiei, proprietățile corpurilor în diferite stări de agregare, să completăm tabelul: (formular pentru copii pe masă)
Sarcini pentru muncă de cercetare
Exercitiul 1: „Investigarea proprietăților gazelor”. Echipament: balon, seringa medicala Efectuați un experiment și răspundeți la întrebările:
1. Umflați balonul. Ce parte a balonului este plină cu aer? Care este forma gazului?
2. Strângeți mingea cu mâna (schimbați-i forma). Este menținut volumul de aer? Se păstrează forma sa?
3. Umpleți seringa cu aer trăgând pistonul. Închideți gaura cu degetul și încercați să o strângeți. Este ușor să comprimați gazul?
Sarcina 2: „Investigarea proprietăților lichidelor”. Echipament: vas cu apa, pahar, 2-3 vase forme diferite, seringă medicală. Efectuați un experiment și răspundeți la întrebările:
1. Măsurați volumul de lichid folosind un pahar?
2. Turnați apă în recipiente de diferite forme? Ce parte a vasului umple lichidul? Lichidul își păstrează forma?
3. Măsurați din nou volumul de lichid. Volumul i s-a schimbat?
4. Umpleți seringa cu apă. Închideți gaura cu degetul și încercați să o strângeți. Este ușor să comprimați lichidul?
Sarcina 3: „Investigarea proprietăților solidelor”. Echipament: un set de solide din diferite substanțe (metal, lemn, plastic etc.) Efectuați un experiment și răspundeți la întrebările: Solidele au propria lor formă? 2. Își păstrează volumul?
3. Încercați să strângeți corpul cu mâna. Este ușor de strâns?
Pe baza rezultatelor cercetării, completați tabelul
Nu are formăNu păstrează volumul
Comprima
Nu are formă
Mentine volumul
Nu este compresibil
Fluid
Mentine forma
Mentine volumul
Nu este compresibil
Aranjament molecular
La mare distanță unul de celălalt, haotic
Ambalate strâns, adică la mică distanţă unul de celălalt
Ordonat, formând rețea cristalină
Natura mișcării moleculelor
Mișcă-te liber pe tot volumul
Ezită pe loc, sărind din loc în loc
Oscilează pe loc, în jurul unei poziții de echilibru
Interacțiunea moleculelor
Slab
Puternic
Foarte puternic
Ce proprietăți ale solidelor cunoașteți? Mentine forma si volumul
Ce proprietăți ale lichidelor cunoașteți? Menține volumul, dar schimbă ușor forma
Ce proprietăți ale gazelor cunoașteți? Nu păstrează forma și volumulProprietățile solidelor.
Care este starea corpurilor din jurul nostru - birouri, cărți, caiete? (solid)
Să luăm în considerare mai multe corpuri solide.
Ce formă au? (regulat, paralelipiped, cilindru)
Să încercăm să le schimbăm forma: comprimați sau întindeți. Este ușor de făcut? (Nu.)
Putem determina volumul de solide? Să determinăm volumul paralelipipedului.
Concluzie: Solidele își păstrează forma și au volum. (Scrieți rezultatul pe tablă și în tabel).
Proprietățile lichidelor.
Acum să determinăm proprietățile lichidelor. Îl putem turna în diferite vase. (Profesorul toarnă apă în vase diverse forme, prima și ultima dată în pahare, pentru a determina volumul)
Ce se întâmplă cu forma lichidului? (ea se schimba)
Ce formă ia lichidul de fiecare dată? (forma vasului)
S-a modificat volumul lichidului? (Nu)
Concluzie: lichidul își schimbă ușor forma, dar își păstrează volumul. (Scrieți rezultatul pe tablă și în tabel). Aceste proprietăți ale lichidului sunt utilizate la fabricarea produselor din sticlă.
Proprietățile gazelor.
Să aflăm ce proprietăți au gazele. Experimentați cu o minge de cauciuc: legați mingea în mijloc cu un fir, umflați o jumătate cu aer, apoi tăiați firul. Aerul ocupă întreaga minge.
Deci, gazele ocupă întregul volum disponibil. Acum încercăm să strângem mingea. Ne-am descurcat cu ușurință.
Ce putem spune despre proprietățile gazelor?
Concluzie: Gazul ocupă întregul volum furnizat acestuia și este ușor de comprimat. (Înregistrați ieșirea în tabel)
Cum pot fi explicate aceste proprietăți? La urma urmei, apa, gheața, vaporii de apă sunt stări ale aceleiași substanțe, ceea ce înseamnă că moleculele nu diferă unele de altele. Prin urmare, trebuie să ne dăm seama cum sunt aranjate aceste molecule și cum se mișcă.
Gaze. Deoarece gazele umplu întregul volum furnizat, nu au formă și sunt ușor de comprimat, ar trebui să presupunem că distanța dintre molecule este de multe ori mai mare decât moleculele în sine, ele aproape că nu se atrag și nu se mișcă liber. Acest lucru este dovedit și prin difuzie, care are loc mai rapid în gaze decât în lichide și solide. Dar dacă gazele sunt puternic comprimate sau răcite, ele se transformă în stare lichidă. (Scrieți rezultatul pe tablă și în tabel).
Lichide. Lichidele nu își păstrează forma, pot curge și sunt ușor de umplut în exces. Dar este dificil să le comprimați. Acest lucru poate fi explicat doar prin faptul că ori de câte ori moleculele se apropie unele de altele, între ele apare repulsie, deoarece moleculele sunt situate aproape una de alta, distanța dintre ele este comparabilă cu dimensiunea moleculelor. Își schimbă brusc locul - „sări”. (Scrieți rezultatul pe tablă și în tabel).
Solide. Solidele își păstrează forma și volumul. Aceasta înseamnă că moleculele sunt situate la distanțe comparabile cu dimensiunea moleculelor. Moleculele sunt aranjate ordonat, formând o rețea cristalină și vibrează în jurul unui anumit punct. (Scrieți rezultatul pe tablă și în tabel).
Lucrul cu un manual de desen (28.6 p. 125).
4. Etapa de generalizare și consolidare a materialului nou
Este posibil să umpleți un recipient cu gaz la jumătate din volum? De ce?
Oxigenul poate fi în stare lichidă la temperatura camerei?
Fierul poate fi în stare gazoasă la temperatura camerei?
Într-o zi geroasă de iarnă, peste gaura de gheață din râu s-a format ceață. Ce stare a materiei este aceasta?
Într-o cameră în care se află înălbitor, îl poți mirosi întotdeauna. Explicați în ce stare se află înălbitorul?
5. Etapa finală
Ce am învățat despre proprietățile corpurilor în diferite stări de agregare?
Cum pot fi explicate aceste proprietăți, date structura moleculara substante?
6. Reflecție
Am lucrat la clasăactiv pasiv
Prin munca mea din clasa I
mulțumit/nemulțumit
Lecția mi s-a părut
scurt lung
Pentru lecția I
nu obosit / obosit
Starea mea
a devenit mai bine/a devenit mai rău
Am avut materialul de lecție
clar / nu clar
util/inutil
interesant plictisitor
Tema pentru acasă mi se pare
usor / dificil
interesant / nu este interesant
Subliniați răspunsurile
D/z p 28,29, exp spate p. 127
REZERVA Intrebari:
De ce gazele nu rețin volum și sunt ușor comprimate? (Distanța dintre molecule este mare, forțele atractive sunt slabe, astfel încât moleculele se îndepărtează cu ușurință unele de altele și se apropie la fel de ușor.
De ce gazele nu au formă și umplu întreg volumul dat? (Motivul este mișcarea liberă a moleculelor și atracția lor slabă)
De ce lichidele păstrează volum? (Interacțiunea dintre molecule este puternică, prin urmare nu se pot „desprinde” una de cealaltă)
De ce lichidele nu au formă și curge? (Moleculele unui lichid sunt mobile, sunt capabile să sară dintr-un loc în altul. Dacă o forță externă acționează asupra lichidului, de exemplu, atracția către Pământ, salturile de particule vor avea loc în principal în direcția acțiunii sale (adică , jos).
Ce explică necompresibilitatea lichidelor? (Distanța dintre molecule este destul de mică. La apropiere, forțele de respingere cresc brusc, împiedicând apropierea moleculelor)
De ce solidele își păstrează forma? (Motivul constă în natura mișcării moleculelor. Ele oscilează în jurul pozițiilor de echilibru și nu se pot mișca liber)
De ce solidele își păstrează volumul? (Interacțiunea dintre moleculele unui solid este enormă, astfel încât acestea nu se pot desprinde unele de altele)
Ce explică necompresibilitatea solidelor? (Distanța dintre molecule este mică (comparabilă cu dimensiunea moleculelor). La apropiere, forțele de respingere cresc brusc, împiedicând moleculele să se apropie unele de altele.)
