Masa moleculara- unul dintre cele mai importante caracteristici substante Acest concept este strâns legat de definiția unei molecule.
Pentru particule structurale convenționale (unități de formulă) substanțe nemoleculare Este folosit conceptul de „masă de formulă”.
Masele unităților structurale ale materiei sunt foarte mici. Prin urmare, se folosesc mase relative pentru ele.
Greutatea moleculară relativă se notează cu Domnul .
Se notează și masa relativă de formulă a substanțelor nemoleculare Domnul .
Valorile maselor moleculare relative sunt utilizate pe scară largă în diferite calcule chimice, fizice și chimico-tehnice. Prin urmare, este important să le poți calcula.
Calculul masei moleculare relative a unei substanțe din ea formula chimica. Folosind formula chimică a unei substanțe, puteți nu numai să caracterizați compoziția acesteia, ci și să calculați masa moleculară relativă sau (pentru compușii nemoleculari) masa relativă a formulei.
Relativ masa moleculara constă din masele relative ale atomilor care intră în moleculă, ținând cont de numărul acestora.
Exemplu. Să calculăm greutatea moleculară relativă a acidului sulfuric H2SO4 (Fig. 9.1). Masa relativă a unei molecule de acid sulfuric constă din suma maselor relative a doi atomi de hidrogen, un atom de sulf și patru atomi de oxigen:
Mr (H2S04) = 2Ar (H) + Ar (S) + 4Ar (0);
Mr (H2S04) = 2. 1 + 32 + 4 . 16 = 98.
Masele relative de formulă ale substanțelor nemoleculare se calculează în același mod.
Exemplu. Să calculăm formula relativă a masei de fluorură de calciu CaF 2 (Fig. 9.2). Masa relativă a unității de formulă a fluorurii de calciu constă din suma maselor relative ale cationului de calciu Ca 2+ și doi anioni de fluorură F -:
Mr (CaF2) = Ar (Ca) + 2Ar (F); Mr (CaF2) = 40 + 2. 19 = 78.
 |
| Orez. 9.3. Compoziția și structura uvarovitei |
Adesea, formulele chimice ale substanțelor conțin paranteze. De exemplu, compoziția mineralului uvarovit este descrisă prin formula chimică Ca 3 Cr 2 (SiO 4) 3. Uvarovitul este un cristal ionic (Fig. 9.3). Masa relativă unitatea sa de formulă poate fi calculată după cum urmează: Material de pe site
Mr (Ca3Cr2(Si04)3) = 3Ar (Ca) + 2Ar (Cr) + 3;
Mr (Ca3Cr2(Si04)3) = 3. 40 + 2. 52 + 3(28 + 4,16) = 500.
Vă rugăm să rețineți: indicii care apar în formula chimică în afara parantezei sunt pronunțați astfel - de două ori, de trei ori etc.
Compoziția băuturii Coca-Cola include apă H2O, dioxid de carbon CO2, cărbune H2CO3 și fosfor H3RO 4 acizi, zaharoză (zahăr) C 12 H 22O 11, cofeinăC 8H 10N 4O2.
Pe această pagină există material pe următoarele subiecte:
Chimiștii din întreaga lume reflectă foarte frumos și concis compoziția substanțelor simple și complexe, sub formă de formule chimice. Formulele chimice sunt analogi ale cuvintelor care sunt scrise folosind litere - simboluri ale elementelor chimice.
Să exprimăm, folosind simboluri chimice, compoziția celei mai comune substanțe de pe Pământ - apa. O moleculă de apă conține doi atomi de hidrogen și un atom de oxigen. Acum să traducem această propoziție într-o formulă chimică folosind simboluri chimice (hidrogen - H și oxigen - O). Scriem numărul de atomi în formulă folosind indici - numere situate în partea dreaptă jos a simbolului chimic (indicele 1 nu este scris pentru oxigen): H 2 0 (a se citi „cenusa-două-o”).
Formule substanțe simple hidrogenul și oxigenul, ale căror molecule sunt formate din doi atomi identici, sunt scrise astfel: H 2 (se citește „cenusa-doi”) și 0 2 (se citește „o-doi”) (Fig. 26).
Orez. 26.
Modele de molecule și formule de oxigen, hidrogen și apă
Pentru a reflecta numărul de molecule, se folosesc coeficienți care sunt înscriși înaintea formulelor chimice: de exemplu, intrarea 2CO 2 (a se citi „două-tse-o-două”) înseamnă două molecule dioxid de carbon, dintre care fiecare constă dintr-un atom de carbon și doi atomi de oxigen.
Coeficienții se scriu în mod similar atunci când indică numărul de atomi liberi element chimic. De exemplu, trebuie să notăm expresia: cinci atomi de fier și șapte atomi de oxigen. Acest lucru se face după cum urmează: 5Fe și 7O.
Dimensiunile moleculelor, și cu atât mai mult ale atomilor, sunt atât de mici încât nu pot fi văzute nici în cele mai bune microscoape optice, care oferă o mărire de 5-6 mii de ori. Ele nu pot fi văzute nici măcar la microscoapele electronice, care oferă o mărire de 40 de mii de ori. Desigur, dimensiunea neglijabilă a moleculelor și atomilor corespunde maselor lor neglijabile. Oamenii de știință au calculat, de exemplu, că masa unui atom de hidrogen este de 0,000 000 000 000 000 000 000 001 674 g, care poate fi reprezentată ca 1,674 10 -24 g, masa unui atom de oxigen este 0,000 000 000 000 000 000 026 667 g, sau 2,6667 10 -23 g, masa unui atom de carbon este de 1,993 10 -23 g, iar masa unei molecule de apă este de 3,002 10 -23 g.
Să calculăm de câte ori masa unui atom de oxigen este mai mare decât masa unui atom de hidrogen, cel mai ușor element:
În mod similar, masa unui atom de carbon este de 12 ori mai mare decât masa unui atom de hidrogen:


Orez. 27. Masa unui atom de carbon este egală cu masa a 12 atomi de hidrogen
Masa unei molecule de apă este de 18 ori mai mare decât masa unui atom de hidrogen (Fig. 28). Aceste valori arată de câte ori masa unui atom al unui anumit element chimic este mai mare decât masa unui atom de hidrogen, adică sunt relative.

Orez. 27. Masa unui atom de apă este egală cu masa a 18 atomi de hidrogen
În prezent, fizicienii și chimiștii sunt de părere că masa atomică relativă a unui element este o valoare care arată de câte ori masa atomului său este mai mare decât 1/12 din masa unui atom de carbon. Masa atomică relativă se notează cu Ar, unde r este litera inițială cuvânt englezesc relativă, care înseamnă „rudă”. De exemplu, A r (0) = 16, A r (C) = 12, A r (H) = 1.
Fiecare element chimic are propria sa valoare relativă a masei atomice (Fig. 29). Valori relative mase atomice elementele chimice sunt indicate în celulele corespunzătoare din tabelul lui D.I.

Orez. 29.
Fiecare element are propria sa valoare relativă a masei atomice
În mod similar, greutatea moleculară relativă a unei substanțe se notează cu M r, de exemplu M r (H 2 0) = 18.
Masa atomică relativă a unui element A r și masa moleculară relativă a unei substanțe M r sunt mărimi care nu au unități de măsură.
Pentru a afla masa moleculară relativă a unei substanțe, nu este necesar să se împartă masa moleculei acesteia la masa atomului de hidrogen. Trebuie doar să adunați masele atomice relative ale elementelor care formează substanța, ținând cont de numărul de atomi, de exemplu:
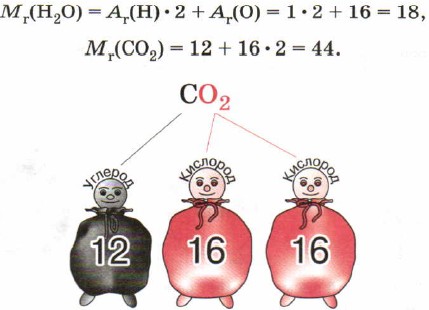
O formulă chimică conține informații importante despre o substanță. De exemplu, formula C0 2 arată următoarele informații:
Să calculăm fracții de masă elemente de carbon și oxigen în dioxid de carbon CO 2 .
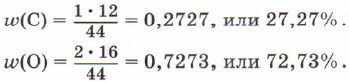
Cuvinte și expresii cheie
- Formula chimica.
- Indici și coeficienți.
- Masa atomică relativă (A r).
- Greutatea moleculară relativă (Mr).
- Fracția de masă a unui element dintr-o substanță.
Lucrați cu computerul
- Consultați aplicația electronică. Studiați materialul lecției și finalizați sarcinile atribuite.
- Găsiți adrese de e-mail pe Internet care pot servi drept surse suplimentare care dezvăluie conținutul cuvintelor cheie și al expresiilor din paragraf. Oferiți-vă ajutorul profesorului în pregătirea unei noi lecții - trimiteți un mesaj prin Cuvinte cheieși fraze din paragraful următor.
Întrebări și sarcini
- Ce înseamnă intrările: 3H; 2H20; 5O2?
- Scrieți formula zaharozei dacă știți că molecula sa conține doisprezece atomi de carbon, douăzeci și doi de atomi de hidrogen și unsprezece atomi de oxigen.
- Folosind figura 2, notați formulele substanțelor și calculați greutățile moleculare relative ale acestora.
- Carei forme de existenta a elementului chimic oxigen corespunde fiecaruia dintre urmatoarele intrari: 3O; 5O2; 4CO2?
- De ce masa atomică relativă a unui element și masa moleculară relativă a unei substanțe nu au unități de măsură?
- Care dintre substanțele ale căror formule sunt SO 2 și SO 3 are o fracție de masă mai mare de sulf? Confirmați răspunsul cu calcule.
- Calculați fracțiile de masă ale elementelor din acidul azotic HNO3.
- Dați o descriere completă a glucozei C 6 H 12 0 6, folosind exemplul de descriere a dioxidului de carbon C0 2.
Acesta este raportul dintre masa moleculară ma component chimic la 1/12 masa atomului de carbon C+12: Mr = ma/(1/12mc) = (12ma)/mc. Greutatea moleculară relativă este o mărime adimensională D. I. Tabelul lui Mendeleev va ajuta la determinarea greutății moleculare relative prin rotunjirea valorilor masei atomice la două sau trei. cifre semnificative. Masa atomică relativă este notată cu Ar, valoarea sa este indicată în tabelul periodic al elementelor de mai jos semn chimic element Masa moleculară relativă a unei substanțe este egală cu suma maselor atomice relative ale tuturor elementelor (inclusiv indicii). Deci, cum se calculează masa moleculară relativă, de exemplu, a unei molecule de apă (H2O): Mr (apă) = 2Ar (H) + Ar (O) ≈ 2 1 + 16 = 18 Masa moleculară relativă a apei este 18 și asta înseamnă că masa moleculei de apă este de 18 ori mai mare decât 1/12 din masa unui atom de C+12.
Un amestec este două sau mai multe substanțe care alternează între ele în spațiu. În acest caz, proprietățile componentelor de deplasare rămân neschimbate. Cum se află masa unui amestec? Masa amestecului este egală cu suma maselor componentelor care alcătuiesc amestecul. mcm = m1 + m2+….. mi. Densitatea amestecului ρ(cm) al unui amestec format din i componente și care ocupă un volum V este determinată de formula: ρ (cm)= m/V =(m1+m2+…+mi)/V = m1/V + m2/V +… + mi/V = ρ1 + ρ2 +…+ ρunde m1, m2,………..mi; și ρ1,ρ2,…..ρi - masele și densitățile fiecăruia dintre componentele amestecului Densitățile componentelor amestecului sunt determinate din cărțile de referință Masa amestecului m este egală cu ρcmV = (ρ1 + ρ2 +…+ ρi)V
Substanțele sunt formate din molecule, o moleculă este cea mai mică particulă. a acestei substante. Cum se determină masa unei molecule? Masa unei molecule dintr-o substanță poate fi determinată prin împărțirea masei molare a substanței la numărul de molecule dintr-un mol, adică la numărul Avogardo. Prin urmare m0 = M/NA. Masa molară este numeric aceeași cu masa moleculară, dar diferă ca dimensiune. Dimensiunea sa este g/mol. Masă molară de apă este de 18 g/mol Pentru a afla masa unei molecule de apă, împărțiți 18 la numărul lui Avogadro = 6,022×10^23:18/(6,022×10^23) = 2,99·10^-23 într-un mod similar, este ușor de găsit masa unei molecule a unei substanțe cu o formulă chimică cunoscută.
Substanțele pot exista în mai multe stări - solidă, lichidă și gazoasă. Gazele își schimbă constant forma și volumul. Cum se calculează masa gazului? Ecuația de stare a unui gaz raportează parametrii termodinamici care caracterizează gazul - presiunea p, volumul V și temperatura T: рV = (m/M)RT, unde m este masa gazului, M este masa molară, R este constanta universală a gazelor. Masa unui gaz poate fi determinată dacă sunt cunoscuți parametrii de stare: m = pVM/RT Constanta universală a gazului, denumită R, este egală cu 8,314 J/(K.mol) sau 1,987 cal/(K.mol). Aceasta este o constantă universală - o constantă fizică fundamentală.
Soluțiile sunt un sistem omogen multicomponent format dintr-un solvent, substanțe dizolvate și produse ale interacțiunii lor. Cum se determină masa unei soluții? Puteți găsi masa unei soluții folosind formula pentru aflarea masei unei soluții: m (soluție) = m (substanță) + m (solvent). Soluțiile se găsesc peste tot. De exemplu, o soluție de dioxid de carbon (CO2) în apă este cunoscuta apă carbogazoasă. Unul dintre cele mai importante proprietăți apa - capacitatea sa de a se dizolva diverse substanțe. Soluțiile pot fi gazoase, dar amestecurile lichide din chimie se numesc pur și simplu soluții. Apa este solventul anorganic cel mai frecvent utilizat.
MASA MOLECULARA,
suma maselor atomilor care alcătuiesc o moleculă dată; exprimată în unități de masă atomică (amu). De la 1 a. e.m (numit uneori dalton, D) este egal cu 1/12 din masa unui atom al nuclidului de 12 C și în unități de masă este 1,66057. 10 -27 kg, apoi înmulțiți M. m cu 1,66057. 10 -27 dă abdomene. masa moleculei în kilograme. Mai des folosesc mărimea adimensională M rel - relativă M. m.: M rel
Unde M x -> masa unei molecule x, exprimată în aceleași unități de masă (kg, g sau altele) ca D. M. m caracterizează masa medie a unei molecule, ținând cont de compoziția izotopică a tuturor elementelor care formează o anumită substanță chimică. compus. Uneori se determină M. m. pentru un amestec de descompunere. bine cunoscute compoziție, de exemplu pentru aer, „eficientul” M. m poate fi considerat egal cu 29.
Abs. Este convenabil să se opereze cu masele de molecule din domeniul fizicii proceselor subatomice și radiochimiei, unde prin măsurarea energiei particulelor, conform teoriei relativității, abs lor. mase. În chimie și chimie. tehnologia trebuie aplicată macroscopic. unități de măsură ale cantității. Numărul oricăror particule (molecule, atomi, electroni sau particule separate mental în grupuri, de exemplu, perechi de ioni Na + și Cl - din rețeaua cristalină NaCl), egal cu Avogadro de constanta N A = 6,022. 10 23, este macroscopic. unitate de cantitate in-va-mol. Atunci putem scrie: M rel = X. N A /(D . N A), adică relativă M. m este egală cu raportul dintre masa unui mol de substanță și N A D. Dacă substanța este formată din molecule cu legaturi covalenteîntre atomii lor constitutivi, apoi valoarea X. N A reprezintă masa molară a acestei substanțe, unitățile de măsură sunt kg-mol (kilomol, km). Pentru substanțele care nu conțin molecule, dar constau din atomi, ioni sau radicali, se determină masa molară formulă, adică masa N A particulelor corespunzătoare formulei acceptate a substanței (cu toate acestea, în URSS se vorbește adesea despre M. m. în acest caz, ceea ce este incorect).
Anterior în chimie se foloseau conceptele de gram-moleculă, gram-atom, gram-ion, acum mol de molecule, mol de atomi, mol de ioni, adică prin aceasta molecule de N A, atomi, ioni etc. masele lor molare, exprimate în grame sau kilograme. În mod tradițional, termenul „greutate moleculară (molară)” este folosit ca sinonim, deoarece masa este determinată folosind cântare. Dar, spre deosebire de greutate, care depinde de geografie. coordonate, masa este un parametru constant al numărului de substanțe (la viteze obișnuite de mișcare a particulelor în condiții chimice), de aceea este mai corect să spunem „masă moleculară”.
Un număr mare de termeni și concepte învechite referitoare la nave spațiale sunt explicate prin faptul că înainte de era cosmică. zborurile în chimie nu au acordat importanță diferenței dintre masă și greutate, care se datorează diferenței de valori ale accelerației libere. cade la poli (9,83 m. s -2) si la ecuator (9,78 m. s -2); atunci când se calculează gravitația (greutatea), se utilizează de obicei o valoare medie de 9,81 m s -2. În plus, dezvoltarea conceptului de moleculă (precum și atom) a fost asociată cu studiul macroscopic. cantitatea de substanţe în procesele lor chimice. (reacții) sau fizice. () transformări, când teoria structurii substanței nu a fost dezvoltată (secolul al XIX-lea) și s-a presupus că totul era chimic. conn. construit numai din atomi și molecule.
Metode de determinare. Din punct de vedere istoric, prima metodă (fundamentată de cercetările lui S. Cannizzaro și A. Avogadro) a fost propusă de J. Dumas în 1827 și a constat în măsurarea densității substanțelor gazoase în raport cu hidrogenul gazos, a cărui masă molară a fost inițial dusă la fie 2, iar după trecerea la unitatea de măsură a oxigenului masele moleculare și atomice - 2,016 g. stadiul de dezvoltare experimental. posibilităţi de determinare a M. m. au constat în studiul lichidelor şi soluţiilor nevolatile şi nedisociante în-în mod măsurători ale proprietăților coligative (adică, în funcție doar de numărul de particule dizolvate) - osmotice. presiune (vezi osmometrie), scăderea presiunii vaporilor, scăderea punctului de îngheț ( crioscopie) și creșterea punctului de fierbere ( ebulioscopie) soluție în comparație cu soluția pură. În același timp, a fost descoperit comportamentul „anormal” al electroliților.
Scăderea presiunii vaporilor deasupra soluției depinde de fracția molară a substanței dizolvate (legea lui Raoult): [( p - p 0)/R] = N, Unde p 0 -> presiunea vaporilor soluției pure, R- presiunea aburului deasupra soluției, N- fracție molară substanța dizolvată investigată, N=(t x/M x)/[(t x/M x) +
(m0/M0)], Xşi M x -resp. greutatea (g) și M. m ale substanței studiate, m 0 și M 0 sunt aceleași pentru soluție. În cursul determinărilor, extrapolarea se realizează la o dispersie infinită. soluție, adică sunt stabilite pentru soluțiile substanței studiate și pentru soluțiile unei substanțe chimice (standard) cunoscute. conexiuni. În cazul crioscopiei și ebulioscopiei se folosesc, respectiv, dependențele. Dt 3 = KSși Dt k = Ec, unde Dt 3 este o scădere a temperaturii de îngheț a soluției, Dt to este o creștere a temperaturii de fierbere a soluției, LAȘi E- resp. crioscopic și ebulioscopic. Constantele pH, determinate dintr-o substanță dizolvată standard cu o valoare M.m. c-molală precis cunoscută a substanței studiate în soluție ( c = M x t x. 1000/m 0). M. m se calculează după următoarele formule: M x = t x K. 1000/m 0 Dt 3 sau M x = t x E. 1000/m 0 Dt k Metodele se caracterizează printr-o precizie destul de mare, deoarece există speciale. (așa-numitele termometre Beckmann), care fac posibilă măsurarea schimbărilor foarte mici de temperatură.
Pentru determinarea M. m. se folosește și izotermă. distilarea soluției. În acest caz, o probă din soluția substanței studiate este introdusă în cameră cu saturație. soluție de abur (la o temperatură dată); vaporii soluției se condensează, temperatura soluției crește și, după stabilirea echilibrului, scade din nou; Prin modificarea temperaturii, ei judecă cantitatea de căldură de evaporare eliberată, care este legată de M. m a substanței dizolvate. În așa-numitul izopietic metodele sunt efectuate izoterme. distilarea unei soluții într-un volum închis, de exemplu. într-un vas în formă de H. Într-un cot al vasului se află așa-numitul. solutie de comparatie, care conține o masă cunoscută a unei substanțe de M. m cunoscută (concentrație molară C 1), într-o altă soluție care conține o masă cunoscută a substanței studiate (concentrație molară C 2 necunoscut). Dacă, de exemplu, C1 > C2, > Solutul este distilat de la al doilea genunchi la primul până când concentrațiile molare în ambii genunchi sunt egale. Comparând volumele izopiesticului obținut. şanţuri, calculaţi M. m. unei insule necunoscute. Pentru a determina M. m., puteți măsura masa isopiesticului. soluții folosind cântare McBen, care constau din două cupe suspendate pe arcuri într-un vas de sticlă închis; Soluția de testare se pune într-o cană, iar soluția de comparație în cealaltă; prin schimbarea poziţiei cupelor se determină masele izopietice. raioane şi, deci, M. m. ale insulei studiate.
De bază metoda de determinare a atomilor si mol. mase materie volatilă este spectrometrie de masa. Pentru a studia amestecul conn. utilizare eficientă cromatografie-spectrometrie de masă. La intensitatea maximă scăzută, mol. ionii se folosesc efuziometric. atașamente pentru spectrometre de masă. Efuziune-metrică Metoda se bazează pe faptul că viteza gazului care curge din cameră printr-o gaură al cărei diametru este semnificativ mai mic decât calea liberă medie. cale moleculară, invers proporțională rădăcină pătrată din satul M. m. Debitul este controlat de modificările presiunii din cameră. M. m. compuşi volatili. determinata si prin metode de cromatografie gazoasa cu balante de gaze Martin. Acestea din urmă măsoară viteza de mișcare a gazului în canalul care leagă tuburile prin care circulă gazul purtător și gazul din fluxul cromatografic. coloane, ceea ce face posibilă determinarea diferenței de densități ale acestor gaze, în funcție de masa moleculară a substanței studiate.
M. m. sunt măsurate pentru a identifica substanțele chimice. conexiune, pentru a stabili conținutul de nuclizi individuali din conexiune, de exemplu. în apa folosită în energia nucleară. instalații, precum și în cercetarea și sinteza cu greutate moleculară mare. conexiune, ale căror proprietăți depind în mod semnificativ de M. m. greutatea moleculară a polimerului). Valorile medii ale masei moleculare a polimerilor sunt determinate prin metodele enumerate mai sus, pe baza proprietăților coligative ale soluțiilor diluate, în funcție de numărul de legături duble (ozonoliză „moale”) sau funcționale. grupuri (prin metode de analiză funcțională), precum și prin proprietățile soluțiilor lor precum difuzarea luminii. Valorile medii mol. mase polimerice grad înalt polimerizarea este determinată de reologia lor. caracteristici.
Lit.: Rafikov S. R., Pavlova S. A., Tverdokhlebova I. I., Metode pentru determinarea greutăților moleculare și a polidispersității compușilor cu molecule înalte, M., 1963; Pauling L., Pauling P., Chimie, trad. din engleză, M., 1978; Vilkov L.V., Pentin Yu.A., Metode fizice Cercetare în chimie, M., 1987. Yu. A. Klyachko.
Enciclopedie chimică. - M.: Enciclopedia Sovietică. Ed. I. L. Knunyants. 1988 .
Vezi ce este „MASA MOLECULARĂ” în alte dicționare:
Valoarea masei unei molecule, exprimată în unități de masă atomică. Practic, masa moleculară este egală cu suma maselor atomilor incluși în ea (vezi MASA ATOMICĂ). Dicționar enciclopedic fizic. M.: Enciclopedia Sovietică. Editor sef A. M. Prohorov. 1983... Enciclopedie fizică
- (greutatea moleculară) masa unei molecule exprimată în unități de masă atomică. Aproape egală cu suma maselor tuturor atomilor care alcătuiesc molecula. Valorile masei moleculare sunt utilizate în calculele de inginerie chimică, fizică și chimică... Mare Dicţionar enciclopedic
- (masa molar), termenul a fost folosit anterior pentru a desemna MASA MOLECULARA RELATIVA... Dicționar enciclopedic științific și tehnic
Greutatea moleculară M m- Masa moleculară, M. m * masa moleculară, M. m. masa unei molecule care nu are propriile unități de măsură, deci termenul de „greutate moleculară” (vezi) este de obicei folosit în acest sens... Genetica. Dicţionar enciclopedic
masa moleculara- - Subiecte de biotehnologie EN masa moleculară ... Ghidul tehnic al traducătorului
Masa moleculara - – valoare relativă, raportul dintre masa unei molecule a unei substanțe date și 1/12 din masa unui atom al izotopului de carbon C12. [Usherov Marshak A.V. Știință concretă: lexic. M.: RIF Materiale de constructii. 2009. – 112 p.] Titlu termen: Condiții generale... ... Enciclopedie de termeni, definiții și explicații ale materialelor de construcție
masa moleculara- santykinė molekulinė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Molekulės vidutinės masės arba tiksliai apibrėžto medžiagos darinio masės ir nuklido ¹²C atomo masės dali 1/12. atitikmenys: engl. masa moleculara;… …
masa moleculara- santykinė molekulinė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Molekulę sudarančių atomų santykinių atominių masių suma, skaitine verte lygi medžiagos molio masei. atitikmenys: engl. masa moleculara; greutate moleculară;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
masa moleculara- santykinė molekulinė masė statusas T sritis chemija apibrėžtis Molekulę sudarančių atomų santykinių atominių masių suma, skaitine verte lygi vieno medžiagos molio masei. atitikmenys: engl. masa moleculara; greutate moleculară; masa moleculara relativa... Chemijos terminų aiškinamasis žodynas
- (greutatea moleculară), masa unei molecule exprimată în unități de masă atomică. Aproape egală cu suma maselor tuturor atomilor care alcătuiesc molecula. Valorile masei moleculare sunt utilizate în calculele de inginerie chimică, fizică și chimică. *... Dicţionar enciclopedic
