Lichidele tind să se evapore. Dacă am scăpat o picătură de apă, eter și mercur pe masă (doar nu o faceți acasă!), Am putea observa cum picăturile dispar treptat - se evaporă. Unele lichide se evaporă mai repede, altele mai încet. Procesul de evaporare a unui lichid se mai numește și vaporizare. Și procesul invers de transformare a vaporilor în lichid este condensarea.
Aceste două procese ilustrează faza de tranzitie- procesul de tranziție a substanțelor de la o stare de agregare la alta:
- evaporare (trecerea de la starea lichidă la starea gazoasă);
- condensare (trecerea de la starea gazoasă la starea lichidă);
- desublimare (trecerea de la starea gazoasă la starea solidă, ocolind faza lichidă);
- sublimare, este și sublimare (trecerea de la starea solidă la starea gazoasă, ocolirea lichidului).
Acum, apropo, este sezonul potrivit pentru a observa procesul de desublimare în natură: îngheț și îngheț pe copaci și obiecte, modele înghețate pe ferestre - rezultatul său.
Cum se formează aburul saturat și nesaturat
Dar să revenim la vaporizare. Vom continua să experimentăm și să turnăm un lichid - apă, de exemplu, într-un vas deschis și vom conecta un manometru la acesta. Invizibil pentru ochi, evaporarea are loc în vas. Toate moleculele lichide sunt în mișcare continuă. Unii se mișcă atât de repede încât energia lor cinetică este mai puternică decât cea care leagă moleculele lichide.
După ce au părăsit lichidul, aceste molecule continuă să se miște haotic în spațiu, majoritatea covârșitoare dintre ele se împrăștie în el - așa abur nesaturat... Doar o mică parte dintre ele revine înapoi în lichid.
Dacă închidem vasul, moleculele de vapori vor deveni treptat din ce în ce mai multe. Și tot mai mulți dintre ei se vor întoarce la lichid. Acest lucru va crește presiunea vaporilor. Acest lucru va fixa manometrul conectat la vas.
După ceva timp, numărul de molecule care scapă din lichid și se întorc la acesta va fi egal. Presiunea aburului va înceta să se mai schimbe. Ca urmare saturație cu abur se va stabili echilibrul termodinamic al sistemului lichid-vapori. Adică, evaporarea și condensarea vor fi egale.
Proprietățile aburului saturat
Pentru a le ilustra clar, vom folosi încă un experiment. Invocați toată puterea imaginației voastre pentru a o prezenta. Deci, să luăm un manometru cu mercur, format din două coate - tuburi comunicante. Mercurul este turnat în ambele, un capăt este deschis, celălalt este sigilat, iar peste mercur există încă o anumită cantitate de eter și vaporii săi saturati în el. Dacă coborâți și ridicați genunchiul nesigilat, nivelul de mercur din cel sigilat va crește și va scădea și el.
În acest caz, se va modifica și cantitatea (volumul) de vapori saturati ai eterului. Diferența dintre nivelurile coloanelor de mercur din ambele picioare ale manometrului arată presiunea de vapori saturati a eterului. Va rămâne neschimbat tot timpul.
Aceasta implică proprietatea aburului saturat - presiunea acestuia nu depinde de volumul pe care îl ocupă. Presiune vapori saturati diferite lichide (apa și eter, de exemplu) sunt diferite la aceeași temperatură.
Cu toate acestea, temperatura aburului saturat contează. Cu cât temperatura este mai mare, cu atât presiunea este mai mare. Presiunea aburului saturat crește mai repede odată cu creșterea temperaturii decât în cazul aburului nesaturat. Temperatura și presiunea aburului nesaturat sunt legate liniar.
Un alt experiment interesant poate fi efectuat. Luați un balon gol fără vapori de lichid, închideți-l și conectați un manometru. Treptat, picătură cu picătură, adăugați lichid în interiorul balonului. Pe măsură ce lichidul intră și se evaporă, se stabilește presiunea vaporilor saturați, care este cea mai mare pentru un anumit lichid la o anumită temperatură.
Mai multe despre temperatură și abur saturat
Temperatura aburului afectează și viteza de condensare. La fel cum temperatura unui lichid determină viteza de evaporare - cu alte cuvinte, numărul de molecule care zboară de pe suprafața unui lichid pe unitatea de timp.
Pentru aburul saturat, temperatura acestuia este egală cu temperatura lichidului. Cu cât temperatura vaporilor saturati este mai mare, cu atât presiunea și densitatea acestuia sunt mai mari, cu atât densitatea lichidului este mai mică. Când se atinge temperatura critică pentru o substanță, densitatea lichidului și a vaporilor este aceeași. Dacă temperatura vaporilor este mai mare decât temperatura critică pentru substanță, diferențele fizice dintre vaporii lichidi și saturați dispar.
Determinarea presiunii aburului saturat amestecat cu alte gaze
Am spus că presiunea vaporilor saturați rămâne neschimbată la o temperatură constantă. Am determinat presiunea în condiții „ideale”: când există lichid și vapori dintr-o singură substanță într-un vas sau balon. Să luăm în considerare și un experiment în care moleculele unei substanțe sunt împrăștiate în spațiu într-un amestec cu alte gaze.
Pentru a face acest lucru, luați doi cilindri de sticlă deschisi și puneți-i în ambele vase închise cu eter. Ca de obicei, vom conecta manometrele. Deschidem un vas cu eter, după care manometrul înregistrează creșterea presiunii. Diferența dintre această presiune și presiunea din cilindrul cu un vas de eter închis vă permite să aflați presiunea vaporilor saturati ai eterului.
Despre presiune și fierbere
Evaporarea este posibilă nu numai de la suprafața lichidului, ci și în volumul acestuia - atunci se numește fierbere. Pe măsură ce temperatura lichidului crește, se formează bule de vapori. Când presiunea vaporilor saturați este mai mare sau egală cu presiunea gazului din bule, lichidul se evaporă în interiorul bulelor. Și acestea se extind și se ridică la suprafață.
Lichidele fierb la diferite temperaturi. În condiții normale, apa fierbe la 100 0 C. Dar odată cu modificarea presiunii atmosferice, se modifică și punctul de fierbere. Așadar, la munte, unde aerul este foarte rarefiat și presiunea atmosferică este mai mică, scade și punctul de fierbere al apei pe măsură ce urci munții.
Apropo, fierberea este deloc imposibilă într-un vas închis ermetic.
![]()
Un alt exemplu de relație dintre presiunea vaporilor și evaporare este demonstrat de o asemenea caracteristică a conținutului de vapori de apă din aer precum umiditatea relativă a aerului. Este raportul dintre presiunea parțială a vaporilor de apă și presiunea vaporilor saturați și este determinat de formula: φ = p / p aproximativ * 100%.
Odată cu scăderea temperaturii aerului, concentrația de vapori de apă în acesta crește, adică. devin mai bogate. Această temperatură se numește punct de rouă.
Să rezumam
Folosind exemple simple, am analizat esența procesului de evaporare și aburul nesaturat și saturat rezultat. Toate aceste fenomene le poți observa în fiecare zi în jurul tău: de exemplu, vezi bălți care se usucă după ploaie pe străzi sau o oglindă în baie aburită de abur. În baie, puteți chiar observa cum se produce mai întâi vaporizarea, iar apoi umiditatea acumulată pe oglindă se condensează înapoi în apă.
De asemenea, puteți folosi aceste cunoștințe pentru a vă face viața mai confortabilă. De exemplu, iarna în multe apartamente aerul este foarte uscat, iar acest lucru are un efect negativ asupra bunăstării. Puteți folosi un umidificator modern pentru a-l face mai umed. Sau, la modă veche, puneți un recipient cu apă în cameră: evaporând treptat, apa va satura aerul cu vaporii săi.
www.site, cu copierea integrală sau parțială a materialului, este necesară un link către sursă.
Procesele de evaporare și condensare sunt continue și paralele între ele.
Într-un vas deschis, cantitatea de lichid scade în timp, deoarece evaporarea prevalează asupra condensului.
Vaporii care se află deasupra suprafeței lichidului, atunci când evaporarea prevalează asupra condensului, sau vapori în absența lichidului, se numesc nesaturat.
Într-un recipient închis ermetic, nivelul lichidului nu se modifică în timp, deoarece evaporarea și condensarea se compensează reciproc: câte molecule zboară din lichid, același număr revin la el în același timp, între vapori și lichidul său are loc un echilibru dinamic (mobil).
Se numește aburul care se află în echilibru dinamic cu lichidul său saturate.
La o anumită temperatură, vaporii saturati ai oricărui lichid au cea mai mare densitate ( ) și creează presiune maximă ( ), pe care vaporii acestui lichid îl pot avea la această temperatură.
Presiunea și densitatea vaporilor saturați la aceeași temperatură depind de tipul de substanță: mai multă presiune creează vapori saturati din acel lichid, care se evaporă mai repede. De exemplu, și
Proprietățile vaporilor nesaturați: Vaporii nesaturați respectă legile gazelor lui Boyle - Mariotte, Gay-Lussac, Charles; li se poate aplica ecuația de stare a unui gaz ideal.
Proprietățile vaporilor saturati:1. Cu un volum constant odată cu creșterea temperaturii, presiunea vaporilor saturați crește, dar nu direct proporțional (legea lui Charles nu este îndeplinită), presiunea crește mai repede decât cea a unui gaz ideal. , cu creșterea temperaturii ( ) , masa vaporilor crește și, prin urmare, concentrația moleculelor de vapori () crește și presiunea vaporilor saturați crește din două motive (
3 1 - abur nesaturat (gaz ideal);
2 2 - abur saturat; 3 - abur nesaturat,
1 obtinut din abur saturat in acelasi
Volumul la încălzire.
2. Presiunea aburului saturat la o temperatură constantă nu depinde de volumul pe care îl ocupă.
Odată cu creșterea volumului vaporilor, masa vaporilor crește, iar masa lichidului scade (o parte din lichid se transformă în vapori), cu o scădere a volumului vaporilor, acesta devine mai mic, iar lichidul devine mai mare (o parte din vapori se transformă în lichid), densitatea și concentrația moleculelor de vapori saturati rămân constante, prin urmare, iar presiunea rămâne constantă ().
lichid
(satura abur + lichid)
Nesaturat. aburi
Vaporii saturați nu respectă legile gazelor lui Boyle - Mariotte, Gay-Lussac, Charles, deoarece masa aburului din procese nu rămâne constantă, iar toate legile gazelor sunt obținute pentru o masă constantă. Ecuația de stare a gazului ideal poate fi aplicată aburului saturat.
Asa de, aburul saturat poate fi transformat în abur nesaturat, fie prin încălzirea acestuia la un volum constant, fie prin creșterea volumului acestuia la o temperatură constantă. Aburul nesaturat poate fi transformat în abur saturat fie prin răcirea lui la un volum constant, fie prin comprimarea acestuia la o temperatură constantă.
Situatie critica
Prezența unei suprafețe libere într-un lichid face posibilă indicarea unde se află faza lichidă a unei substanțe și unde este cea gazoasă. Diferența accentuată dintre un lichid și vaporii acestuia se explică prin faptul că densitatea lichidului este de multe ori mai mare decât cea a vaporilor. Dacă un lichid este încălzit într-un vas închis ermetic, atunci, din cauza expansiunii, densitatea acestuia va scădea, iar densitatea vaporilor de deasupra acestuia va crește. Aceasta înseamnă că diferența dintre un lichid și vaporii săi saturati este netezită și, la o temperatură suficient de ridicată, dispare cu totul. Temperatura la care diferențele în proprietăți fizice ah între un lichid și vaporii săi saturati, iar densitățile lor devin aceleași, se numeștetemperatura critica.
Punct critic
Pentru formarea lichidului din gaz, media energie potențială atracția moleculelor trebuie să depășească energia lor cinetică medie.
Temperatura critica – temperatura maximă la care aburul se transformă în lichid. Temperatura critică depinde de energia potențială de interacțiune a moleculelor și, prin urmare, este diferită pentru diferite gaze. Datorită interacțiunii puternice a moleculelor de apă, vaporii de apă pot fi transformați în apă chiar și la temperaturi. În același timp, lichefierea azotului are loc doar la o temperatură mai mică de = -147˚, deoarece moleculele de azot interacționează slab unele cu altele.
Un alt parametru macroscopic care afectează tranziția vapori-lichid este presiunea. Odată cu creșterea presiunii externe în timpul comprimării gazului, distanța medie dintre particule scade, forța de atracție dintre ele crește și, în consecință, energia potențială medie a interacțiunii lor.
Presiunese numește abur saturat la temperatura sa critică critic... Aceasta este cea mai mare presiune a vaporilor saturați posibil a unei substanțe date.
Stare a materiei cu parametri critici se numește critic(punct critic) . Fiecare substanță are propria sa temperatură critică și presiune.
În stare critică, căldura specifică de vaporizare și coeficientul de tensiune superficială a lichidului dispar. La temperaturi peste critice, chiar și la presiuni foarte mari, transformarea unui gaz într-un lichid este imposibilă, adică. peste temperatura critică, lichidul nu poate exista. La temperaturi supercritice, este posibilă doar o stare de vapori a materiei.
Lichefierea gazelor este posibilă numai la temperaturi sub temperatura critică. Pentru lichefiere, gazele sunt răcite la o temperatură critică, de exemplu, în timpul expansiunii adiabatice, și apoi comprimate izotermic.
Fierbere
În exterior, fenomenul arată astfel: bule cu creștere rapidă se ridică din întregul volum de lichid la suprafață, izbucnesc la suprafață, iar vaporii sunt eliberați în mediu.
MKT explică fierberea după cum urmează: există întotdeauna bule de aer într-un lichid, în care se produce evaporarea din lichid. Volumul închis al bulelor este umplut nu numai cu aer, ci și cu abur saturat. Presiunea vaporilor saturați din ele, atunci când lichidul este încălzit, crește mai repede decât presiunea aerului. Când într-un lichid suficient de încălzit presiunea vaporilor saturați din bule devine mai mare decât presiunea exterioară, acestea cresc în volum, iar forța de flotabilitate, care depășește gravitația lor, ridică bulele la suprafață. Bulele plutitoare încep să spargă atunci când, la o anumită temperatură, presiunea vaporilor saturați din ele depășește presiunea deasupra lichidului. Temperatura lichidului la care presiunea vaporilor saturați din bule este egală sau depășește presiunea exterioară asupra lichidului se numește Punct de fierbere.
Punctul de fierbere al diferitelor lichide este diferit de cand presiunea vaporilor saturați din bulele lor este comparată cu aceeași presiune externă la diferite temperaturi. De exemplu, presiunea vaporilor saturați din bule este egală cu presiunea atmosferică normală pentru apă la 100˚C, pentru mercur la 357˚C, pentru alcool la 78˚C, pentru eter la 35˚C.
Punctul de fierbere în timpul fierberii rămâne constant, de cand toată căldura care este furnizată lichidului încălzit este cheltuită pentru vaporizare.
Punctul de fierbere depinde de presiunea exterioară asupra lichidului: odată cu creșterea presiunii, temperatura crește; odata cu scaderea presiunii, temperatura scade. De exemplu, la o altitudine de 5 km deasupra nivelului mării, unde presiunea este de 2 ori mai mică decât presiunea atmosferică, punctul de fierbere al apei este de 83˚C, în cazanele motoarelor cu abur, unde presiunea aburului este de 15 atm. (), temperatura apei este de aproximativ 200˚С.
Umiditatea aerului
În aer există întotdeauna vapori de apă, așa că putem vorbi despre umiditatea aerului, care se caracterizează prin următoarele valori:
1.Umiditate absolută Este densitatea vaporilor de apă din aer (sau presiunea pe care o creează acești vapori (.
Umiditatea absolută nu oferă o idee despre gradul de saturație a aerului cu vapori de apă. Aceeași cantitate de vapori de apă la temperaturi diferite creează o senzație diferită de umiditate.
2.Umiditate relativă este raportul dintre densitatea (presiunea) vaporilor de apă conținuti în aer la o temperatură dată și densitatea (presiunea) vaporilor saturați la aceeași temperatură : sau
- umiditate absolută la o temperatură dată; - densitatea, presiunea aburului saturat la aceeasi temperatura. Densitatea și presiunea vaporilor de apă saturați la orice temperatură pot fi găsite în tabel. Tabelul arată că cu cât temperatura aerului este mai mare, cu atât densitatea și presiunea vaporilor de apă din aer trebuie să fie mai mari pentru ca acesta să fie saturat.
Cunoscând umiditatea relativă, se poate înțelege câte procente din vaporii de apă din aer la o anumită temperatură sunt departe de saturație. Dacă vaporii din aer sunt saturati, atunci. Dacă , atunci nu este suficient abur în aer până când acesta este saturat.
Faptul că aburul din aer devine saturat este judecat după apariția umidității sub formă de ceață, rouă. Se numește temperatura la care vaporii de apă din aer devin saturați punct de condensare.
Vaporii din aer pot fi saturați prin adăugarea de vapori datorită evaporării suplimentare a lichidului fără modificarea temperaturii aerului sau prin scăderea temperaturii acestuia cu cantitatea disponibilă de vapori din aer.
Umiditatea relativă normală, cea mai favorabilă pentru om, este de 40 - 60%. Mare importanță are cunoștințe de umiditate în meteorologie pentru prognoza meteo. În țesut, producția de cofetărie, este necesară o anumită umiditate pentru desfășurarea normală a procesului. Depozitarea de artă și cărți necesită menținerea umidității aerului la nivelul necesar.
Dispozitive pentru determinarea umidității:
1. Higrometru de condensare (vă permite să determinați punctul de rouă).
2. Un higrometru de păr (pe baza dependenței lungimii părului degresat de conținutul de umiditate) măsoară umiditatea relativă în procente.
3. Psihrometrul este format din două termometre uscate și umede. Rezervorul termometrului umidificat este învelit într-o cârpă înmuiată în apă. Datorită evaporării din țesătură, temperatura umed este mai mică decât cea a uscatului. Diferența dintre citirile termometrului depinde de umiditatea aerului ambiental: cu cât aerul este mai uscat, cu atât evaporarea din țesătură este mai intensă, cu atât diferența dintre citirile termometrului este mai mare și invers. Dacă umiditatea aerului este de 100%, atunci citirile termometrului sunt aceleași, adică diferența de citiri 0. Pentru a determina umiditatea cu un psicrometru, se folosește un tabel psicrometric.
Topire și cristalizare
La topire a unui solid, distanța dintre particulele care formează rețeaua cristalină crește și are loc distrugerea rețelei în sine. Procesul de topire necesită consum de energie. Când un solid este încălzit, energia cinetică a moleculelor care vibrează crește și, în consecință, amplitudinea vibrațiilor acestora. La o anumită temperatură, numit punct de topire, ordinea în aranjarea particulelor în cristale este perturbată, cristalele își pierd forma. Substanța se topește, trecând de la starea solidă la starea lichidă.
În timpul cristalizării există o convergență a moleculelor care formează o rețea cristalină. Cristalizarea poate avea loc numai atunci când lichidul renunță la energie. Pe măsură ce substanța topită se răcește, energia cinetică medie și viteza moleculelor scad. Forțele gravitației pot menține particulele în jurul poziției lor de echilibru. La o anumită temperatură, numit temperatura de solidificare (cristalizare), toate moleculele se găsesc într-o poziție de echilibru stabil, aranjamentul lor devine ordonat - se formează un cristal.
Topirea unui solid are loc la aceeași temperatură la care această substanță se solidifică
Fiecare substanță are propriul punct de topire. De exemplu, punctul de topire pentru heliu este -269,6˚С, pentru mercur -38,9˚С, pentru cupru 1083˚С.
În timpul procesului de topire, temperatura rămâne constantă. Cantitatea de căldură furnizată din exterior se duce la distrugerea rețelei cristaline.
În timpul procesului de întărire, deși căldura este îndepărtată, temperatura nu se schimbă. Energia eliberată în timpul cristalizării este cheltuită pentru menținerea unei temperaturi constante.
Până când întreaga substanță se topește sau întreaga substanță se întărește, adică. atâta timp cât fazele solidă și lichidă ale unei substanțe coexistă, temperatura nu se modifică.
TV + lichid lichid + tv
, unde este cantitatea de căldură, este cantitatea de căldură necesară pentru a topi o substanță eliberată în timpul cristalizării unei substanțe cu o masă de
- căldură specifică de fuziune– cantitatea de căldură necesară pentru a topi o substanță care cântărește 1 kg la temperatura de topire.
Ce cantitate de căldură este consumată atunci când o anumită masă a unei substanțe se topește, aceeași cantitate de căldură este eliberată în timpul cristalizării acestei mase.
Numit si căldură specifică de cristalizare.
La punctul de topire energie interna o substanță în stare lichidă este mai mare decât energia internă a aceleiași mase a unei substanțe în stare solidă.
Pentru un număr mare de substanțe, volumul crește în timpul topirii, iar densitatea scade. Dimpotrivă, la solidificare, volumul scade și densitatea crește. De exemplu, cristalele de naftalină solidă se scufundă în naftalină lichidă.
Unele substanțe, de exemplu, bismut, gheață, galiu, fontă etc., se micșorează atunci când se topesc și se extind atunci când se solidifică. Aceste abateri de la regula generala sunt explicate prin particularitățile structurii rețelelor cristaline. Prin urmare, apa se dovedește a fi mai densă decât gheața, gheața plutește în apă. Expansiunea apei în timpul înghețului duce la distrugerea rocilor.
Modificarea volumului metalelor în timpul topirii și solidificării este esențială în turnătorie.
Experiența arată că modificarea presiunii externe prin solid se reflectă în punctul de topire al acestei substanţe... Pentru acele substanțe care se extind în timpul topirii, o creștere a presiunii externe duce la o creștere a temperaturii de topire, deoarece complică procesul de topire. Dacă substanțele sunt comprimate în timpul topirii, atunci pentru ele o creștere a presiunii externe duce la o scădere a temperaturii de topire, deoarece ajută la procesul de topire. Doar o creștere foarte mare a presiunii modifică semnificativ punctul de topire. De exemplu, pentru a scădea punctul de topire al gheții cu 1˚C, presiunea trebuie crescută cu 130 atm. Punctul de topire al unei substanțe la normal presiune atmosferică sunt numite punctul de topire al substanței.
Dacă lăsați un pahar deschis cu apă perioadă lungă de timp, apoi în cele din urmă apa se va evapora complet. Mai exact, se va evapora. Ce este evaporarea și de ce se întâmplă?
2.7.1 Evaporare și condensare
La o anumită temperatură, moleculele lichide au viteze diferite. Vitezele majorității moleculelor sunt apropiate de o anumită valoare medie (caracteristică acestei temperaturi). Dar există molecule ale căror viteze diferă semnificativ de medie, atât în direcția inferioară, cât și în cea superioară.
În fig. 2.16 prezintă un grafic aproximativ al distribuției vitezei moleculelor lichide. Fondul albastru arată majoritatea moleculelor, ale căror viteze sunt grupate în jurul valorii medii. „Coada” roșie a graficului este un număr mic de molecule „rapide”, ale căror viteze depășesc semnificativ viteza medie a majorității moleculelor lichide.
Numărul de molecule
Molecule rapide
Viteza moleculară
Orez. 2.16. Distribuția vitezei moleculelor
Când o astfel de moleculă foarte rapidă se află pe suprafața liberă a lichidului (adică, la interfața dintre lichid și aer), energia cinetică a acestei molecule poate fi suficientă pentru a depăși forțele de atracție ale moleculelor rămase și a zbura din lichid. Acest procesși are loc evaporare, iar moleculele care au părăsit lichidul formează vapori.
Deci, evaporarea este procesul de transformare a unui lichid în vapori care are loc pe suprafața liberă a unui lichid7.
Se poate întâmpla ca după un timp molecula de vapori să revină înapoi la lichid.
Procesul de tranziție a moleculelor de vapori într-un lichid se numește condensare. Condensarea vaporilor este procesul invers al evaporării lichidului.
2.7.2 Echilibru dinamic
Și ce se va întâmpla dacă vasul cu lichid este închis ermetic? Densitatea vaporilor deasupra suprafeței lichidului va începe să crească; Particulele de vapori vor împiedica din ce în ce mai mult alte molecule lichide să zboare, iar viteza de evaporare va scădea. Va începe în același timp
7 În condiții speciale, transformarea lichidului în vapori poate avea loc pe întregul volum al lichidului. Acest proces de fierbere vă este bine cunoscut.
p n = n RT:
viteza de condensare va crește, deoarece odată cu creșterea concentrației de vapori, numărul de molecule care se întorc în lichid va deveni din ce în ce mai mare.
În cele din urmă, la un moment dat, viteza de condensare va fi egală cu viteza de evaporare. Va exista un echilibru dinamic între lichid și vapori: pe unitatea de timp, același număr de molecule vor zbura din lichid pe măsură ce se întorc la el din vapori. Din acest moment, cantitatea de lichid va înceta să scadă, iar cantitatea de vapori va crește; aburul ajunge la „saturație”.
Abur saturat este un vapor care se află într-o stare de echilibru dinamic cu lichidul său. Aburul care nu a atins o stare de echilibru dinamic cu lichidul se numește nesaturat.
Presiunea și densitatea aburului saturat sunt indicate prin pn in. Evident, pn in este presiunea și densitatea maximă pe care le poate avea aburul la o anumită temperatură. Cu alte cuvinte, presiunea și densitatea aburului saturat depășesc întotdeauna presiunea și densitatea aburului nesaturat.
2.7.3 Proprietățile aburului saturat
Se dovedește că starea vaporilor saturați (și cu atât mai puțin nesaturați) poate fi descrisă aproximativ prin ecuația de stare a unui gaz ideal (ecuația Mendeleev-Clapeyron). În special, avem o relație aproximativă între presiunea vaporilor saturați și densitatea acesteia:
Acesta este un fapt foarte surprinzător, confirmat prin experiment. Într-adevăr, în ceea ce privește proprietățile sale, aburul saturat diferă semnificativ de un gaz ideal. Să enumerăm cele mai importante dintre aceste diferențe.
1. La o temperatură constantă, densitatea vaporilor saturați nu depinde de volumul acestuia.
Dacă, de exemplu, vaporii saturati sunt comprimați izotermic, atunci densitatea sa în primul moment va crește, viteza de condensare va depăși rata de evaporare și o parte din vapori se va condensa în lichid până când echilibrul dinamic apare din nou, în care densitatea vaporilor va reveni la valoarea anterioară.
În mod similar, odată cu expansiunea izotermă a vaporilor saturați, densitatea acestuia în primul moment va scădea (vaporii vor deveni nesaturați), viteza de evaporare va depăși viteza de condensare, iar lichidul se va evapora suplimentar până la restabilirea echilibrului dinamic, adică, până când vaporii devin din nou saturati cu aceeași valoare a densității.
2. Presiunea vaporilor saturați nu depinde de volumul acesteia.
Aceasta rezultă din faptul că densitatea vaporilor saturați nu depinde de volum, iar presiunea este legată în mod unic de densitate prin ecuația (2.6).
După cum puteți vedea, legea lui Boyle, care este valabilă pentru gazele ideale, nu este satisfăcută pentru aburul saturat. Acest lucru nu este surprinzător deoarece a fost obținut din ecuația Mendeleev-Clapeyron presupunând că masa gazului rămâne constantă.
3. Cu un volum constant, densitatea vaporilor saturați crește odată cu creșterea temperaturii și scade odată cu scăderea temperaturii.
Într-adevăr, odată cu creșterea temperaturii, viteza de evaporare a lichidului crește. Echilibrul dinamic în primul moment este încălcat și un suplimentar
evaporarea unei părți din lichid. Perechea va continua să crească până când echilibrul dinamic este restabilit.
În același mod, cu scăderea temperaturii, viteza de evaporare a lichidului devine mai lentă, iar o parte din vapori se condensează până la restabilirea echilibrului dinamic, dar cu o cantitate mai mică de vapori.
Astfel, în timpul încălzirii sau răcirii izocorice a aburului saturat, masa acestuia se modifică, astfel încât legea lui Charles nu funcționează în acest caz. Dependența presiunii aburului saturat de temperatură nu va mai fi o funcție liniară.
4. Presiunea aburului saturat crește cu temperatura mai repede decât liniar.
Într-adevăr, odată cu creșterea temperaturii, densitatea vaporilor saturați crește, iar conform ecuației (2.6), presiunea este proporțională cu produsul dintre densitate și temperatură.
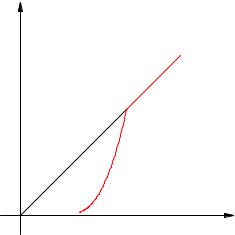
Dependenţa presiunii vaporilor saturaţi de temperatură este exponenţială (Fig. 2.17). Este reprezentat de secțiunea 1-2 a graficului. Această dependență nu poate fi dedusă din legile unui gaz ideal.
abur izocor
Orez. 2.17. Dependența presiunii aburului de temperatură
La punctul 2, tot lichidul se evaporă; cu o creștere suplimentară a temperaturii, aburul devine nesaturat, iar presiunea acestuia crește liniar conform legii lui Charles (secțiunea 2–3).
Reamintim că o creștere liniară a presiunii unui gaz ideal este cauzată de o creștere a intensității impactului moleculelor împotriva pereților vasului. În cazul încălzirii aburului saturat, moleculele încep să bată nu numai mai tare, ci mai des pentru că aburul devine mai mare. Acțiunea simultană a acestor doi factori este responsabilă pentru creșterea exponențială a presiunii vaporilor saturați.
2.7.4 Umiditatea aerului
Umiditatea absolută este presiunea parțială a vaporilor de apă din aer (adică presiunea pe care vaporii de apă ar exercita-o singuri, în absența altor gaze). Uneori, umiditatea absolută este numită și densitatea vaporilor de apă din aer.
Umiditatea relativă a aerului „este raportul dintre presiunea parțială a vaporilor de apă din acesta și presiunea vaporilor de apă saturati la aceeași temperatură. De regulă, este
raportul este exprimat ca procent:
"= p 100%: pн
Din ecuația Mendeleev-Clapeyron (2.6) rezultă că raportul presiunilor de vapori este egal cu raportul densităților. Deoarece ecuația (2.6) însăși, reamintim, descrie vaporii saturati doar aproximativ, avem o relație aproximativă:
„= 100%: n
Unul dintre dispozitivele care măsoară umiditatea aerului este un psicrometru. Include două termometre, dintre care rezervorul unuia este învelit într-o cârpă umedă. Cu cât umiditatea este mai mică, cu atât evaporarea apei din țesătură este mai intensă, cu atât rezervorul termometrului „umed” se răcește și cu atât diferența dintre citirile acestuia și cele ale termometrului uscat este mai mare. Pe baza acestei diferențe, umiditatea aerului este determinată folosind un tabel psicrometric special.
Tema 2. TRANZIȚII DE FAZA.
O tranziție de fază (transformare de fază) este o tranziție a unei substanțe de la o fază la alta atunci când condițiile externe se modifică (de exemplu, temperatura, presiunea, câmpurile magnetice și electrice etc.), însoțită de o modificare a proprietăților fizice și a parametrilor substanta.
Valoarea temperaturii, presiunii sau a unei alte mărimi fizice la care are loc o tranziție de fază se numește punct de tranziție. Există două tipuri de tranziție de fază.
TRANZIȚII DE FAZĂ DE PRIMUL FEL
Într-o tranziție de fază de ordinul întâi, o astfel de termodinamică
caracteristicile unei substanțe, cum ar fi densitatea, concentrația componentelor, volumul specific, cantitatea de energie internă stocată, de ex. este eliberată sau absorbită o anumită cantitate de căldură, care se numește căldură de tranziție. Mai mult, aceasta se referă la schimbarea bruscă a acestor cantități nu în timp, ci cu o schimbare a temperaturii, presiunii etc. Cele mai comune exemple de tranziții de fază de ordinul întâi:
- topirea si cristalizarea
- evaporare și condensare
- sublimare și desublimare
TRANZIȚII DE FAZĂ AL DOILEA TIP
În timpul unei tranziții de fază de ordinul doi, densitatea și energia internă nu se schimbă, astfel încât o astfel de tranziție de fază poate fi invizibilă cu ochiul liber. Un salt este experimentat de derivații lor în raport cu temperatură și presiune: capacitatea termică, coeficientul de dilatare termică, diverse susceptibilități etc. tranzițiile de fază de al doilea fel sunt însoțite de o modificare a simetriei structurii substanței și nu de eliberarea sau absorbția de energie (căldură). Cele mai comune exemple de tranziții de fază de ordinul doi sunt:
- trecerea sistemului printr-un punct critic
- tranziție paramagnetic-feromagnet
- trecerea metalelor și aliajelor la starea de supraconductivitate
- tranziția superfludă a heliului lichid
- trecerea materialelor amorfe la starea sticloasă
Fizica modernă studiază și sistemele cu tranziții de fază de ordinul trei sau superior. Recent, conceptul de tranziție de fază cuantică a devenit larg răspândit, adică. tranziție de fază controlată nu de fluctuațiile termice clasice, ci de cele cuantice, care există chiar și la zero absolut temperaturi la care tranziția clasică de fază nu poate fi realizată datorită teoremei Nernst.
Să luăm în considerare mai detaliat fenomenele care ne interesează, asociate cu tranzițiile de fază de ordinul întâi.
EVAPORARE, CONDENSARE, FICERERE.
PERECHI SATURATE SI NESATURI.
Orice substanță în anumite condiții poate fi în diferite stări de agregare - solidă, lichidă și gazoasă. Tranzițiile de la o stare de agregare la a doua sunt tranziții de fază de primul fel.
Evaporareși condensare sunt tranziții de fază între faza lichidă și cea gazoasă a unei substanțe.
Tot gaze reale(oxigen, azot, hidrogen etc.) în anumite condiții sunt capabile să se transforme într-un lichid. Cu toate acestea, o astfel de transformare poate avea loc numai la temperaturi sub o anumită, așa-numita temperatura critica T cr. De exemplu, pentru apă temperatura critică este de 647,3 K, pentru azot 126 K, pentru oxigen 154,3 K. La temperatura camerei (≈ 300 K), apa poate fi atât în stare lichidă, cât și în stare gazoasă, iar azotul și oxigenul există doar sub formă de gaze.
Evaporare se numește tranziție de fază de la starea lichidă la starea gazoasă. Din punctul de vedere al teoriei cinetice moleculare, evaporarea este un proces în care cele mai rapide molecule zboară de pe suprafața unui lichid, a cărui energie cinetică depășește energia legării lor cu restul moleculelor lichide. Acest lucru duce la o scădere a energiei cinetice medii a moleculelor rămase, adică la răcirea lichidului (dacă nu există o sursă de energie din corpurile înconjurătoare).
Condensare Este procesul invers de evaporare. Când are loc condensarea, moleculele de vapori revin în lichid.
Într-un vas închis, lichidul și vaporii săi pot fi în stare echilibru dinamic, când numărul de molecule care ies din lichid este egal cu numărul de molecule care se întorc în lichid din vapori, adică atunci când vitezele proceselor de evaporare și condensare sunt aceleași. Acest sistem este numit bifazic ... Aburul aflat în echilibru cu lichidul său se numește saturate.
Numărul de molecule emise dintr-o unitate de suprafață a unui lichid într-o secundă depinde de temperatura lichidului. Numărul de molecule care se întorc din vapori în lichid depinde de concentrația moleculelor de vapori și de viteza medie a acestora. mișcarea termică, care este determinată de temperatura aburului. Rezultă că pentru o substanță dată concentrația moleculelor de vapori aflate la echilibru între un lichid și vaporii acestuia este determinată de temperatura lor de echilibru. Stabilirea echilibrului dinamic între procesele de evaporare și condensare odată cu creșterea temperaturii are loc la concentrații mai mari de molecule de vapori. Deoarece presiunea unui gaz (vapor) este determinată de concentrația și temperatura acestuia, putem concluziona: presiune abur saturat p 0 dintr-o substanță dată depinde numai de temperatura acesteia și nu depinde de volum... Prin urmare, izotermele gazelor reale de pe plan ( p, V) conţin secţiuni orizontale corespunzătoare unui sistem bifazat (Fig. 3.4.1).
Pe măsură ce temperatura crește, presiunea și densitatea vaporilor saturați cresc, iar densitatea lichidului scade din cauza expansiunii termice. La o temperatură egală cu temperatura critică T cr pentru o substanță dată, densitățile vaporilor și lichidului devin aceleași. La T > T cr diferenţele fizice dintre lichid şi vaporii saturaţi dispar.
Dacă aburul nesaturat este comprimat izotermic la T < T cr, atunci presiunea sa va crește până când devine egală cu presiunea aburului saturat. Odată cu o scădere suplimentară a volumului, în fundul vasului se formează un lichid și se stabilește un echilibru dinamic între lichid și vaporii săi saturati. Cu o scădere a volumului, totul majoritatea vaporii se condensează, dar presiunea acestuia rămâne neschimbată (secțiune orizontală pe izotermă). Când toți vaporii se transformă în lichid, presiunea crește brusc cu o scădere suplimentară a volumului datorită compresibilității scăzute a lichidului.
Este posibil să treceți de la o stare gazoasă la una lichidă ocolind regiunea bifazată. Pentru a face acest lucru, trebuie să finalizați procesul ocolind punctul critic K... Unul dintre posibilele procese de acest fel este prezentat în Fig. 1 printr-o linie întreruptă ABC.
Aerul atmosferic conține întotdeauna vapori de apă la o anumită presiune parțială p, care, de regulă, este mai mică decât presiunea aburului saturat p 0. Atitudine p / p 0, exprimat ca procent, se numește umiditate relativă aer.
| |
Aburul nesaturat poate fi descris teoretic folosind ecuația de stare a unui gaz ideal sub restricțiile obișnuite pentru gazele reale: presiunea vaporilor nu trebuie să fie prea mare (în practică p≤ (10 6 –10 7) Pa), iar temperatura acestuia este mai mare decât o anumită valoare pentru fiecare substanță. Legile unui gaz ideal pot fi aplicate aproximativ și aburului saturat, cu condiția ca pentru fiecare temperatură T presiune p 0 abur saturat este determinat de curba de echilibrup 0 (T) pentru o substanță dată.
Presiune p 0 aburul saturat crește foarte repede odată cu creșterea temperaturii T... Dependenta p 0 (T) nu poate fi obținută din legile unui gaz ideal. Presiunea gazului la o concentrație constantă de molecule crește direct proporțional cu temperatura. Într-un vapor saturat, cu creșterea temperaturii, crește nu numai energia cinetică medie a mișcării moleculare, ci și concentrația acestora. Prin urmare, presiunea vaporilor saturați cu creșterea temperaturii crește mai repede decât presiunea unui gaz ideal la o concentrație constantă de molecule.
Evaporarea poate apărea nu numai de la suprafață, ci și în volumul lichidului. Există întotdeauna bule de gaz minuscule într-un lichid. Dacă presiunea de vapori saturați a lichidului este egală sau mai mare decât presiunea externă (adică presiunea gazului din bule), lichidul se va evapora în bule. Bulele pline cu abur se extind și plutesc la suprafață. Acest proces se numește fierbere ... Astfel, fierberea lichidului începe la o temperatură la care presiunea vaporilor saturați devine egală cu presiunea exterioară.
În special, la presiunea atmosferică normală, apa fierbe la o temperatură de 100 ° C. Aceasta înseamnă că la această temperatură, presiunea vaporilor de apă saturați este de 1 atm. La escaladarea munților, presiunea atmosferică scade și, prin urmare, punctul de fierbere al apei scade (cu aproximativ 1 ° C la fiecare 300 de metri de altitudine). La o altitudine de 7 km, presiunea este de aproximativ 0,4 atm, iar punctul de fierbere scade la 70 ° C.
Într-un vas închis ermetic, un lichid nu poate fierbe, deoarece la fiecare valoare a temperaturii se stabilește un echilibru între lichid și vaporii săi saturati. Curba de echilibru p 0 (T) se poate determina punctul de fierbere al unui lichid la diferite presiuni.
Imaginea izotermelor reale ale gazului descrisă în Fig. 1 descrie procesele de evaporare și condensare, adică tranziția de fază între gaz și faze lichide substante. De fapt, această imagine este incompletă, deoarece orice substanță poate trece de la starea gazoasă sau lichidă la starea solidă. La o temperatură dată T echilibrul termodinamic între două faze ale aceleiași substanțe este posibil doar la o anumită presiune în sistem. Dependența presiunii de echilibru de temperatură se numește curba de echilibru de fază ... Un exemplu este curba de echilibru p 0 (T) vapori saturati si lichid. Dacă curbele de echilibru între diferitele faze ale unei substanțe date sunt trasate pe plan ( p, T), apoi rup acest plan în regiuni separate în care substanța există într-o stare omogenă de agregare - solidă, lichidă sau gazoasă (Fig. 2). Înfățișat în sistemul de coordonate ( p, T) curbele de echilibru se numesc diagramă de fază .
Curba 0 T, corespunzător echilibrului dintre fazele solidă și gazoasă, se numește curba de sublimare... Curba TK echilibrul dintre lichid și vapori se numește curba de evaporare, se termină într-un punct critic K... Curba TM echilibru între corp solid si se numeste lichid curba de topire.
Curbele de echilibru converg într-un punct T, în care toate cele trei faze pot coexista în echilibru. Acest punct se numește punct triplu.
Pentru multe substanțe, presiunea p tr în punctul triplu este mai mic de 1 atm ≈ 10 5 Pa. Astfel de substanțe se topesc atunci când sunt încălzite la presiunea atmosferică. De exemplu, un punct triplu al apei (Fig. 3) are coordonate T tr = 273,16 K, p tr = 6,02 · 10 2 Pa și este folosit ca referință pentru calibrarea scalei de temperatură absolută Kelvin.
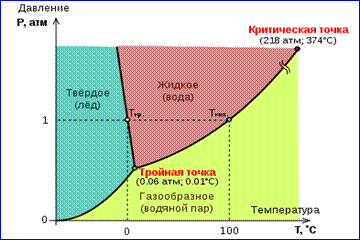 Cu toate acestea, există și astfel de Fig. Diagrama în 3 faze a apei
Cu toate acestea, există și astfel de Fig. Diagrama în 3 faze a apei
substanţe în care p tr
depășește 1 atm. Atât de mult pentru
presiunea dioxidului de carbon (CO 2).
p tr = 5,11 atm și temperatura
T tr = 216,5 K. Prin urmare, la atmosferă
presiune, bioxid de carbon solid
există numai la temperaturi scăzute, și în stare lichidă la p= 1 atm, nu există deloc. În stare solidă, în echilibru cu vaporii săi la presiunea atmosferică, dioxidul de carbon se află la o temperatură de 173 K sau –80 ° C. Este o „gheață carbonică” folosită pe scară largă care nu se topește niciodată, ci doar se evaporă (se sublimează).
