Să luăm în considerare dependența unor proprietăți ale atomilor de structura învelișurilor lor electronice. Să ne oprim, în primul rând, asupra modelelor de modificări ale razelor atomice și ionice.
Norii de electroni nu au granițe bine definite. Prin urmare, conceptul de dimensiune a unui atom nu este strict. Dar dacă vă imaginați atomi în cristale substanță simplă sub formă de bile care se ating unele de altele, atunci distanța dintre centrele bilelor vecine (adică între nucleele atomilor vecini) poate fi luată egală cu dublul razei atomului. Astfel, cea mai mică distanță internucleară în cristalele de cupru este egală cu; aceasta ne permite să presupunem că raza atomului de cupru este egală cu jumătate din această valoare, adică.
Dependența razelor atomice de sarcina nucleului unui atom Z este periodică. Într-o perioadă, pe măsură ce Z crește, apare o tendință de scădere a dimensiunii atomice, care se observă în mod deosebit în mod clar în perioade scurte (razele atomice sunt date în nm):
Acest lucru se explică prin creșterea atracției electronilor din stratul exterior către miez pe măsură ce sarcina acestuia crește.
Odată cu începerea construcției unui nou strat electronic, mai îndepărtat de nucleu, adică în timpul tranziției la următoarea perioadă, razele atomice cresc (comparați, de exemplu, razele atomilor de fluor și sodiu). Ca urmare, în cadrul unui subgrup, odată cu creșterea sarcinii nucleare, dimensiunile atomilor cresc. Să dăm ca exemplu valorile razelor atomice (în nm) ale elementelor unor subgrupe principale:

Electronii stratului exterior, care sunt cel mai puțin strâns legați de nucleu, pot fi desprinși de atom și atașați de alți atomi, devenind parte a stratului exterior al acestuia din urmă.
Atomii care au pierdut unul sau mai mulți electroni devin încărcați pozitiv deoarece sarcina nucleului atomic depășește suma sarcinilor electronilor rămași. Dimpotrivă, atomii care au adăugat electroni suplimentari devin încărcați negativ. Particulele încărcate produse se numesc ioni.
Ionii sunt desemnați prin aceleași simboluri ca și atomii, indicând încărcătura lor în dreapta sus: de exemplu, un ion de aluminiu încărcat triplu pozitiv este notat cu , un ion de clor încărcat unic negativ este notat cu .
Pierderea atomilor de electroni duce la o scădere a dimensiunii sale efective, iar adăugarea de electroni în exces duce la o creștere. Prin urmare, raza unui ion încărcat pozitiv (cation) este întotdeauna mai mică, iar raza unui non (anion) încărcat negativ este întotdeauna mai mare decât raza atomului neutru electric corespunzător. Astfel, raza atomului de potasiu este , iar raza ionului, razele atomului de clor și, respectiv, ionului sunt 0,099 și . În acest caz, raza ionului diferă mai mult de raza atomului, cu atât sarcina ionului este mai mare. De exemplu, razele atomului de crom și ale ionilor sunt 0,127, 0,083 și, respectiv.
În cadrul unui subgrup, razele ionilor cu aceeași sarcină cresc odată cu creșterea sarcinii nucleare. Acest lucru este ilustrat de următoarele exemple (razele ionilor sunt date în nm):

Acest model se explică prin creșterea numărului de straturi electronice și distanța în creștere a electronilor exteriori față de nucleu.
Un atom este un sistem neutru din punct de vedere electric format dintr-un nucleu încărcat pozitiv și electroni încărcați negativ.
Nucleele atomilor constau din două tipuri de particule (nucleoni) - protoni (p) și neutroni (n). Sarcina unui proton este egală ca mărime și opusă ca semn sarcinii unui electron; masa sa este de aproximativ un amu. Un neutron este o particulă neîncărcată cu o masă de aproximativ masa egala proton.
Dimensiunile liniare ale unui atom sunt ~10 -8 cm, cele ale unui nucleu sunt ~10-12 -10 -13 cm.
Cea mai mare parte a atomului este concentrată în nucleu și se caracterizează printr-un număr de masă A egal cu suma numerelor de protoni (sarcină nucleară) Z și neutroni N: A=Z+N.
Caracteristica principală a unui atom este sarcina nucleului (Z). Determină numărul de electroni din jurul nucleului, adică. apartenența unui atom la un anumit tip de element chimic și corespunde numărului atomic (in tabel periodic elemente – număr de serie) al elementului.
Denumirea atomului unui element reflectă numărul de masă și numărul de protoni - de exemplu.
Relativ masa atomica a unui element este valoarea medie a numerelor de masă ale izotopilor săi naturali, ținând cont de gradul de distribuție a acestora. De exemplu, clorul în natură se găsește în principal sub formă de doi izotopi - (75,43%) și (24,57%). Masa atomică relativă a clorului este  .
.
bază teoria modernă Structura atomului este legile și prevederile mecanicii cuantice (unde) - o ramură a fizicii care studiază mișcarea micro-obiectelor.
Microobiectele au atât corpusculare cât și proprietățile valurilor. Pentru a descrie mișcarea microparticulelor, se utilizează o abordare probabilistică, adică nu se determină poziția lor exactă, ci probabilitatea de a se afla într-o anumită regiune a spațiului perinuclear.
Starea unui electron într-un atom este descrisă folosind un model mecanic cuantic - un nor de electroni, a cărui densitate a secțiunilor corespunzătoare este proporțională cu probabilitatea de a găsi un electron. De obicei, norul de electroni este înțeles ca regiunea spațiului perinuclear, care acoperă aproximativ 90% din norul de electroni. Această regiune a spațiului este numită și orbital.
Există un sistem de numere cuantice care determină starea unui electron într-un atom.
Numărul cuantic principal n determină energia electronului și dimensiunea norului de electroni. Poate lua valori întregi de la 1 la .
Un set de stări electronice care au același număr cuantic principal n, se numește stratul electronic sau nivelul energetic.
Cea mai mică valoare energia E corespunde n=1. Stările cuantice rămase corespund unor valori energetice mai mari. Electronii găsiți la aceste niveluri de energie sunt legați mai puțin strâns de nucleu.
Pentru atomul de hidrogen, starea cuantică cu n=1 corespunde energiei sale celei mai mici și se numește fundamentală. state n= 2, 3, 4... se numesc excitat.
Orbitală Numărul cuantic (lateral) determină momentul unghiular orbital al electronului și caracterizează forma norului de electroni. Acceptă toate valorile întregi de la 0 la ( n-1). Tuturor n corespunde unui anumit număr de valori, adică nivelul energetic este un set de subniveluri energetice, ușor diferite ca energie. Numărul de subniveluri în care este împărțit nivelul de energie este egal cu numărul nivelului(adică valoarea numerică n). Aceste subnivele au următoarele denumiri de litere:
Numărul cuantic orbital: 0 1 2 3 4
Subnivel: s p d f g
Formele orbitalilor corespunzătoare diferitelor valori ale sunt prezentate în figura următoare.
plasma).
Proprietățile atomului, inclusiv cea mai importantă capacitate a atomului de a se forma compuși chimici, sunt determinate de caracteristicile structurii sale.
Caracteristicile generale ale structurii atomului. Un atom este format dintr-un nucleu încărcat pozitiv, înconjurat de un nor de electroni încărcați negativ. Dimensiunile unui atom în ansamblu sunt determinate de dimensiunile norului său de electroni și sunt mari în comparație cu dimensiunile nucleului (dimensiunile liniare ale unui atom sunt ~ 10~8 cm, nucleul său ~ 10" -10" 13 cm). Norul de electroni al unui atom nu are granițe strict definite, prin urmare dimensiunile unui atom sunt în mare măsură arbitrare și depind de metodele de determinare a acestora. Nucleul unui atom este format din protoni Z și N neutroni detinuti de forte nucleare. Pozitiv sarcina de protoni si negativ. sarcina electronului este identică în valoare absolută și egală cu e = 1,60*10 -19 C; Un neutron nu are sarcină electrică. Sarcina nucleară +Ze este principala caracteristică a unui atom, care determină apartenența acestuia la un anumit element chimic. Numărul ordinal al elementului din tabelul periodic al lui Mendeleev (numărul atomic) egală cu numărulîn miez.
Într-un atom neutru din punct de vedere electric, numărul din nor este egal cu numărul de protoni din nucleu. Cu toate acestea, în anumite condiții poate pierde sau câștiga electroni, devenind pozitiv sau, respectiv, negativ. de exemplu Li+, Li2+ sau O-, O2-. Când vorbim despre atomi ai unui anumit element, ne referim atât la atomi neutri, cât și la acel element.
Masa unui atom este determinată de masa nucleului său; Masa unui electron (9,109 * 10 -28 g) este de aproximativ 1840 de ori mai mică decât masa unui proton sau neutron (1,67 * 10 -24 g), deci contribuția la masa atomului este nesemnificativă. Număr totalŞi A = Z + N numit . Numărul de masă și sarcina nucleară sunt indicate, respectiv, prin superscripte și subscripte în stânga simbolului elementului, de exemplu 23 11 Na. Vedere a atomilor unui element cu o anumită valoare N numit . Atomi ai aceluiași element cu același Z și diferiți N numit a acestui element Diferența de masele izotopilor are un efect redus asupra chimică a acestora și proprietăți fizice Oh. Cele mai semnificative diferențe se observă la izotopii de hidrogen datorită diferenței relative mari în masele ordinare (protium), D și T. Valorile exacte ale maselor atomice sunt determinate prin metode de spectrometrie de masă.
Atom. Datorită dimensiunii sale mici și a masei mari, nucleul unui atom poate fi considerat aproximativ punctual și în repaus în centrul de masă al atomului, iar atomul poate fi considerat ca un sistem de electroni care se mișcă în jurul unui centru staționar - nucleul. Energia totală a unui astfel de sistem E egală cu suma energiilor cinetice T toată lumea și energie potenţială U, care constă din energia de atracție de către nucleu și energia de respingere reciprocă a electronilor unul de celălalt. Atomul respectă legile mecanicii cuantice; principala sa caracteristică ca sistem cuantic este energia totală E - poate lua doar una dintre valorile unei serii discrete E 1 ...; intermitent Un atom nu poate avea valori energetice. Fiecare dintre valorile „permise”. E corespunde uneia sau mai multor stări staţionare (cu energie care nu se modifică în timp) ale atomului Energie E se poate schimba doar brusc - printr-o tranziție cuantică a unui atom de la o stare staționară la alta. Metodele mecanicii cuantice pot fi folosite pentru a calcula cu precizie E pentru atomii cu un electron - hidrogen și asemănător hidrogenului: E= -hcRZ2/n2, Unde h- constanta lui Planck Cu- viteza luminii, întreg n= 1, 2, 3, ... definește valori discrete de energie și se numește. numărul cuantic principal; constanta Rydberg ( hcR = 13,6 eV). Când se utilizează SI, formula pentru exprimarea nivelurilor de energie discrete ale atomilor cu un electron este scrisă astfel:

Unde t e - masa electronului, este o constantă electrică Valorile posibile de energie „permise” într-un atom sunt reprezentate sub forma unei diagrame a nivelurilor de energie - linii drepte orizontale, distanțe între care corespund diferențelor dintre aceste valori de energie (. Figura 1). nivelul cel mai de jos al lui E 1, corespunzător energiei minime posibile, se numește sol, toate celelalte sunt numite excitate. Stările (sol și excitat) cărora le corespund nivelurile de energie indicate sunt numite în mod similar. Odată cu creșterea n nivelurile se apropie și când energia electronului se apropie de valoarea corespunzătoare unui electron liber (în repaus) scos din atom. Starea cuantică a unui atom cu energie E descris pe deplin funcția de undă, unde r este vectorul rază a electronului nucleului Produsul este egal cu probabilitatea de a găsi un electron în volum dV, adică densitatea de probabilitate. Funcția de undă este determinată de ecuația Schrödinger = , unde operatorul R energie totală(Hamiltonian).
Împreună cu energia, mișcarea unui electron în jurul nucleului (mișcarea orbitală) este caracterizată de momentul unghiular orbital (momentul mecanic orbital) M 1; pătratul mărimii sale poate lua valori determinate de numărul cuantic orbital l = 0, 1, 2, ...; ![]() , Unde . Pentru un număr dat și cuantic l poate lua valori de la 0 la (și - 1). Proiecția momentului orbital pe o anumită axă z ia și o serie discretă de valori M lz = , unde m l este un număr cuantic magnetic având valori discrete de la -l la +l(-l,... - 1, 0, 1, ... + l), total 2l+ 1 valori. Axa z pentru un atom în absența forțelor externe este aleasă în mod arbitrar, iar într-un câmp magnetic coincide cu direcția vectorului intensității câmpului. Electronul are și propriul său moment unghiular -învârtireși momentul magnetic de spin asociat. Moment mecanic de spin pătrat M S2 = S(S+ + 1) este determinată de numărul cuantic de spin S= 1/2, iar proiecția acestui moment pe axa z M sz = =-numărul cuantic Domnișoară, luând valori pe jumătate întregi m s = 1 / 2Şi Domnișoară= - 1 / 2 .
, Unde . Pentru un număr dat și cuantic l poate lua valori de la 0 la (și - 1). Proiecția momentului orbital pe o anumită axă z ia și o serie discretă de valori M lz = , unde m l este un număr cuantic magnetic având valori discrete de la -l la +l(-l,... - 1, 0, 1, ... + l), total 2l+ 1 valori. Axa z pentru un atom în absența forțelor externe este aleasă în mod arbitrar, iar într-un câmp magnetic coincide cu direcția vectorului intensității câmpului. Electronul are și propriul său moment unghiular -învârtireși momentul magnetic de spin asociat. Moment mecanic de spin pătrat M S2 = S(S+ + 1) este determinată de numărul cuantic de spin S= 1/2, iar proiecția acestui moment pe axa z M sz = =-numărul cuantic Domnișoară, luând valori pe jumătate întregi m s = 1 / 2Şi Domnișoară= - 1 / 2 .

Orez. 1. Diagrama nivelurilor de energie hidrogen (linii orizontale) și tranziții optice (linii verticale). Mai jos este o parte a spectrului atomic de emisie de hidrogen - două serii de linii spectrale; Linia punctată arată corespondența liniilor și tranzițiile electronului
Starea staționară a unui atom cu un electron este caracterizată în mod unic de patru numere cuantice: n, l, m l și m s. Energia unui atom de hidrogen depinde numai de n, și la nivel cu un dat n corespunde unui număr de stări care diferă în valorile lui l, m l, Domnișoară. Statele cu specificate nși l este de obicei notat ca 1s, 2s, 2p, 3s etc., unde numerele indică valorile lui k și literele s, p, d, f și mai departe în alfabetul latin corespund valorilor l = 0, 1, 2, 3, ... Numărul de stări diferite cu date nși l este egal cu 2(2l+ 1) numărul de combinații de valori m l și m s . Numărul total de scafandri. state cu un dat n egală 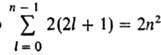 , adică niveluri cu valori n= 1, 2, 3, ... corespunde cu 2, 8, 18, ..., 2n 2 decomp. stări cuantice. Un nivel căruia îi corespunde o singură stare cuantică (o funcție de undă) se numește nedegenerat. Dacă un nivel corespunde la două sau mai multe stări cuantice, se numește degenerat. În atomul de hidrogen, nivelurile de energie sunt degenerate în valorile l și m l; degenerarea în m s are loc doar aproximativ, dacă nu ținem cont de interacțiunea spinului moment magnetic electron cu câmp magnetic, cauzată de mișcarea orbitală a electronului în câmpul electric al nucleului. Acesta este un efect relativist, mic în comparație cu interacțiunea Coulomb, dar este fundamental semnificativ, deoarece duce la divizarea suplimentară a nivelurilor de energie, care se manifestă în spectre atomice sub forma așa-numitei structuri fine.
, adică niveluri cu valori n= 1, 2, 3, ... corespunde cu 2, 8, 18, ..., 2n 2 decomp. stări cuantice. Un nivel căruia îi corespunde o singură stare cuantică (o funcție de undă) se numește nedegenerat. Dacă un nivel corespunde la două sau mai multe stări cuantice, se numește degenerat. În atomul de hidrogen, nivelurile de energie sunt degenerate în valorile l și m l; degenerarea în m s are loc doar aproximativ, dacă nu ținem cont de interacțiunea spinului moment magnetic electron cu câmp magnetic, cauzată de mișcarea orbitală a electronului în câmpul electric al nucleului. Acesta este un efect relativist, mic în comparație cu interacțiunea Coulomb, dar este fundamental semnificativ, deoarece duce la divizarea suplimentară a nivelurilor de energie, care se manifestă în spectre atomice sub forma așa-numitei structuri fine.
Pentru n, l și m l dat, pătratul modulului funcției de undă determină distribuția medie a densității electronilor pentru norul de electroni din atom. Diferitele stări cuantice ale atomului de hidrogen diferă semnificativ unele de altele în distribuția densității electronilor (Fig. 2). Astfel, la l = 0 (s-starea), densitatea electronică este diferită de zero în centrul atomului și nu depinde de direcție (adică este simetrică sferic pentru alte stări este egală cu zero la); centrul atomului și depinde de direcție.

Orez. 2. Forma norilor de electroni pentru diferite stări ale hidrogenului
În atomii multielectroni, datorită respingerii electrostatice reciproce a electronilor, puterea legăturii lor cu nucleul scade semnificativ. De exemplu, energia de îndepărtare a electronilor din . He + este egal cu 54,4 eV, într-un atom He neutru este mult mai mic - 24,6 eV. Pentru atomii mai grei, legătura dintre electronii exteriori și nucleu este și mai slabă. Un rol important în atomii multielectroni îl joacă specificul interacțiune de schimb, asociat cu indistingubilitatea electronilor și faptul că electronii se supun principiului Pauli, conform căruia fiecare stare cuantică caracterizată prin patru numere cuantice nu poate conține mai mult de un electron Pentru un atom cu mulți electroni, este logic să vorbim doar despre stările cuantice ale întregului atom ca întreg. Cu toate acestea, aproximativ, în așa-numita aproximare cu un electron, este posibil să se ia în considerare stări cuantice individuale și să se caracterizeze fiecare stare cu un electron (o anumită orbital, descris de funcţia corespunzătoare) printr-o mulţime de patru numere cuantice n, l, m l şi Domnișoară. Colecția 2(2l+ 1) în stare cu date nși l formează un shell electronic (numit sdftve. de asemenea un subnivel, subshell); dacă toate aceste stări sunt ocupate de electroni, învelișul se numește umplut (închis). Totalitate 2n 2 stări cu același n, dar l diferit formează un strat electronic (numit și nivel, înveliș). Pentru n= 1, 2, 3, 4, ... straturi sunt indicate prin simboluri LA, L, M, N,... Numărul de electroni din învelișuri și straturi atunci când sunt complet umplute este dat în tabel:
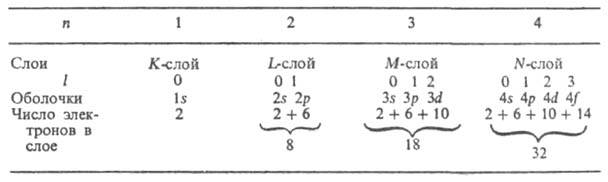
Forța legăturii unui electron într-un atom, adică energia care trebuie să fie conferită unui electron pentru a-l îndepărta din atom, scade odată cu creșterea n și pentru un anumit n - s crescând l. Ordinea în care electronii umplu învelișurile și straturile dintr-un atom complex determină configurația sa electronică, adică distribuția electronilor între învelișuri în starea fundamentală (neexcitată) a acestui atom și a acestuia. Cu această umplere, electronii cu valori crescătoare ale u și / sunt asociați secvenţial. De exemplu, pentru atomul de azot (Z = 7) și configurațiile electronice ale acestuia N + , N 2+ , N 3+ , N 4+ , N 5+ și N 6+ sunt, respectiv: Is 2 2s 2 2p 3 ; Este 2 2s 2 2p 2 ; Este 2 2s 2 2p; Este 2 2s 2 ; este 2 2s; este 2; Is (numărul de electroni din fiecare înveliș este indicat de indicele din dreapta sus). Atomii neutri ai elementelor cu același număr de electroni au aceleași configurații electronice ca și cea a azotului: C, B, Be, Li, He, H (Z = 6, 5, 4, 3, 2, 1). Pornind de la n = 4, ordinea de umplere a învelișurilor se modifică: electroni cu o mai mare n, dar cu l mai mic se dovedesc a fi legați mai strâns decât electronii cu mai mici nși l mare (regula lui Klechkovsky), de exemplu, electronii 4s sunt legați mai strâns decât electronii 3d, iar învelișul 4s este umplut mai întâi, apoi 3d. La umplerea cojilor 3d, 4d, 5d se obțin grupuri de elemente de tranziție corespunzătoare; la umplere 4f-și 5 f-cochilii - resp. lantanide și actinide. Ordinea de completare corespunde de obicei unei sume crescătoare de numere cuantice ( n+ l ); dacă aceste sume sunt egale pentru două sau mai multe coji, cochiliile cu cele mai mici și sunt umplute mai întâi. Următoarele au loc. secvența de umplere a învelișurilor de electroni:

Pentru fiecare perioadă sunt indicate configuratie electronica gaz nobil, max. numărul de electroni, iar ultima linie arată valorile n+ l. Există, totuși, abateri de la această procedură de umplere.
Între stări staţionare Tranzițiile cuantice sunt posibile într-un atom. La mutarea de la mai mult nivel înalt energia E i la un E k inferior atomul renunță la energie (E i - E k), iar în timpul tranziției inverse o primește. În timpul tranzițiilor radiative, un atom emite sau absoarbe o cantitate de radiație electromagnetică (foton). Tranzițiile non-radiative sunt de asemenea posibile, atunci când un atom dă sau primește energie atunci când interacționează cu alte particule cu care se ciocnește (de exemplu, în gaze) sau este asociată pentru o perioadă lungă de timp (în molecule, lichide și solide ). În gazele atomice, ca urmare a unei coliziuni a unui atom liber cu o altă particulă, se poate trece la un alt nivel de energie - experimentează o coliziune inelastică; în timpul unei coliziuni elastice, se modifică doar energia cinetică a mișcării de translație a atomului și totalul acestuia. E rămâne neschimbată. O coliziune neelastică a unui atom liber cu un electron în mișcare rapidă, care își transferă energia cinetică acestui atom - excitarea atomului prin impactul electronilor - este una dintre metodele de determinare a nivelurilor de energie ale unui atom.
Structura și proprietățile substanțelor. Proprietățile chimice sunt determinate de structura învelișurilor de electroni exterioare ale atomului, în care electronii sunt legați relativ slab (energii de legare de la câțiva eV la câteva zeci de eV). Structura învelișurilor exterioare ale atomilor elementelor chimice dintr-un grup (sau subgrup) este periodică. sistemele sunt similare, ceea ce determină asemănarea proprietăți chimice aceste elemente. Pe măsură ce numărul de electroni dintr-un înveliș de umplere crește, energia lor de legare, de regulă, crește; Electronii dintr-un înveliș închis au cea mai mare energie de legare. Prin urmare, atomii cu unul sau mai mulți electroni într-un înveliș exterior parțial umplut îi donează reactii chimice. Atomii cărora le lipsește unul sau mai mulți pentru a forma un înveliș exterior închis, de obicei, îi acceptă. Atomii de gaz nobil, care au învelișuri exterioare închise, nu intră în reacții chimice în condiții normale.
Structura cochilii interioare atomi ai căror electroni sunt legați mult mai strâns (energie de legare 10 2 -10 4 eV), se manifestă numai atunci când atomii interacționează cu particule rapide și fotoni de înaltă energie. Astfel de interacțiuni determină natura spectrelor de raze X și împrăștierea particulelor (electroni, neutroni) pe atomi. Masa unui atom determină proprietățile sale fizice, cum ar fi impulsul și energia cinetică. Unele efecte fizice subtile (RMN, NQR, structura hiperfină a liniilor spectrale) depind de momentele mecanice și magnetice și electrice asociate ale nucleului atomic.
Mai slabă în comparație cu legăturile chimice interacțiuni electrostatice doi atomi se manifestă în polarizabilitatea lor reciprocă – deplasare față de nuclee și apariția unor forțe de polarizare de atracție între atomi. Atomul este, de asemenea, polarizat în exterior câmpuri electrice; Ca urmare, nivelurile de energie sunt deplasate și, cel mai important, nivelurile degenerate sunt împărțite. Un atom poate fi polarizat și sub influența unui câmp electric, o undă de radiație electromagnetică; polarizarea depinde de frecvența radiației, care determină dependența de ea a indicelui de refracție al substanței asociat cu polarizabilitatea atomului proprietăți optice atom cu electricitatea sa proprietățile sunt deosebit de pronunțate în spectrele optice.
Electronii exteriori ai unui atom determina si proprietăți magnetice substante. Într-un atom cu învelișuri exterioare pline, momentul său magnetic, ca și momentul unghiular total (momentul mecanic), egal cu zero. Atomii cu învelișuri exterioare parțial umplute au, de regulă, momente magnetice permanente care sunt diferite de zero; astfel de substanțe sunt paramagnetice. Într-un câmp magnetic extern, toate nivelurile de energie atomică pentru care momentul magnetic nu este zero sunt împărțite. Toți atomii au diamagnetism, care este cauzat de apariția unui moment magnetic indus sub influența unui câmp magnetic extern.
Proprietățile unui atom într-o stare legată (de exemplu, o parte a unei molecule) diferă de proprietățile atomilor liberi determinate de electronii exteriori, participând la legătură chimică; proprietăţile determinate de electronii învelişurilor interioare pot rămâne practic neschimbate. Unele proprietăți ale unui atom pot suferi modificări în funcție de simetria mediului unui atom dat. Un exemplu este împărțirea nivelurilor de energie atomică în cristale și compuși complecși, care are loc sub influența câmpurilor electrice create de înconjurător sau de liganzi.
Literatură: Karapetyants M. X., Drakin S. I., Structura materiei, ed. a III-a, M., 1978; Shlolevsky E.V., Fizica atomică, ed. a 7-a, vol. 1-2, M., 1984. M.A. Eliaşevici.
Selectați prima literă din titlul articolului:
Atom(din greaca veche ἄτομος - indivizibil) - o particulă a unei substanțe de dimensiune și masă microscopică, cea mai mică parte a unui element chimic, care este purtătorul proprietăților sale.Un atom este format din nucleul atomicși electroni. Dacă numărul de protoni din nucleu coincide cu numărul de electroni, atunci atomul în ansamblu se dovedește a fi neutru din punct de vedere electric. În caz contrar, are o sarcină pozitivă sau negativă și se numește ion. În unele cazuri, atomii sunt înțeleși doar ca sisteme neutre din punct de vedere electric, în care sarcina nucleului este egală cu sarcina totală a electronilor, contrastându-i astfel cu încărcarea electrică. ionii.
Miez, care poartă aproape întreaga masă (mai mult de 99,9%) a unui atom, constă din protoni încărcați pozitiv și neutroni neîncărcați, legați împreună printr-o interacțiune puternică. Atomii sunt clasificați în funcție de numărul de protoni și neutroni din nucleu: numărul de protoni Z corespunde numărului de serie al atomului din tabelul periodic și determină apartenența acestuia la un anumit element chimic, iar numărul de neutroni N - a izotop specific al acestui element. Numărul Z determină, de asemenea, totalul pozitiv sarcina electrica(Ze) a nucleului atomic și numărul de electroni dintr-un atom neutru, care determină dimensiunea acestuia.
Atomi diverse tipuriîn cantități diferite, legate prin legături interatomice, formează molecule.
Proprietățile atomului
Prin definiție, oricare doi atomi cu același număr de protoni în nucleele lor aparțin aceluiași element chimic. Atomii cu același număr de protoni dar cu numere diferite de neutroni sunt numiți izotopi ai unui element dat. De exemplu, atomii de hidrogen conțin întotdeauna un proton, dar există izotopi fără neutroni (hidrogen-1, numit uneori și protium - cea mai comună formă), cu un neutron (deuteriu) și doi neutroni (tritiu). Elementele cunoscute formează o serie naturală continuă în funcție de numărul de protoni din nucleu, începând cu atomul de hidrogen cu un proton și terminând cu atomul de ununoctium, care are 118 protoni în nucleu. Toți izotopii elementelor tabelului periodic, începând cu numărul 83 (bismutul), sunt radioactivi.
Greutate
Deoarece protonii și neutronii au cea mai mare contribuție la masa unui atom, numărul total al acestor particule se numește număr de masă. Masa în repaus a unui atom este adesea exprimată în unități de masă atomică (amu), care se mai numește și dalton (Da). Această unitate este definită ca 1⁄12 din masa în repaus a unui atom de carbon-12 neutru, care este aproximativ egală cu 1,66 × 10−24 g Hidrogenul-1 este cel mai ușor izotop de hidrogen și atomul cu cea mai mică masă o greutate atomică de aproximativ 1,007825 a. e.m. Masa unui atom este aproximativ egală cu produsul dintre numărul de masă și unitatea de masă atomică Cel mai greu izotop stabil este plumbul-208 cu o masă de 207,9766521 a. e.m.
Deoarece masele chiar și ale celor mai grei atomi în unități obișnuite (de exemplu, grame) sunt foarte mici, alunițele sunt folosite în chimie pentru a măsura aceste mase. Un mol din orice substanță, prin definiție, conține același număr de atomi (aproximativ 6,022·1023). Acest număr (numărul lui Avogadro) este ales în așa fel încât dacă masa unui element este 1 a. e.m., atunci un mol de atomi ai acestui element va avea o masă de 1 g De exemplu, carbonul are o masă de 12 a. e.m., deci 1 mol de carbon cântărește 12 g.
Dimensiune
Atomii nu au o graniță externă clar definită, așa că dimensiunile lor sunt determinate de distanța dintre nucleele atomilor vecini care au format o legătură chimică (raza covalentă) sau de distanța până la cea mai îndepărtată orbită stabilă a electronilor din învelișul de electroni a acesteia. atom (Raza atomică). Raza depinde de poziția atomului în tabelul periodic, de tipul de legătură chimică, de numărul de atomi din apropiere (numărul de coordonare) și de o proprietate mecanică cuantică cunoscută sub numele de spin. În tabelul periodic al elementelor, dimensiunea unui atom crește pe măsură ce vă deplasați în jos pe o coloană și scade pe măsură ce vă deplasați pe un rând de la stânga la dreapta. În consecință, cel mai mic atom este un atom de heliu cu o rază de 32 pm, iar cel mai mare este un atom de cesiu (225 pm). Aceste dimensiuni sunt de mii de ori mai mici decât lungimea de undă a luminii vizibile (400-700 nm), astfel încât atomii nu pot fi văzuți cu un microscop optic. Cu toate acestea, atomii individuali pot fi observați folosind un microscop de scanare tunel.
Micimea atomilor este demonstrata de urmatoarele exemple. Un păr uman este de un milion de ori mai gros decât un atom de carbon. O picătură de apă conține 2 sextilioane (2 1021) atomi de oxigen și de două ori mai mulți atomi de hidrogen. Un carat de diamant cu o greutate de 0,2 g este format din 10 sextilioane de atomi de carbon. Dacă un măr ar putea fi mărit la dimensiunea Pământului, atunci atomii ar atinge dimensiunea inițială a mărului.
Oamenii de știință de la Institutul de Fizică și Tehnologie din Harkov au prezentat primele fotografii ale unui atom din istoria științei. Pentru a obține imagini, oamenii de știință au folosit un microscop electronic care înregistrează radiațiile și câmpurile (microscop electronic cu emisie de câmp, FEEM). Fizicienii au plasat secvenţial zeci de atomi de carbon într-o cameră vid şi au trecut prin ei o descărcare electrică de 425 de volţi. Radiația ultimului atom din lanț pe un ecran de fosfor a făcut posibilă obținerea unei imagini a unui nor de electroni în jurul nucleului.
Moleculă(novolat. moleculă, prescurtat din latină. mole-mass), o microparticulă formată din doi sau mai mulți atomi și capabilă de existență independentă. Are o compoziție constantă (calitativă și cantitativă) a nucleelor atomice incluse în ea și un număr fix de electroni și are un set de proprietăți care fac posibilă distingerea unei molecule de altele, inclusiv de molecule de aceeași compoziție. O moleculă, ca sistem format din electroni și nuclei care interacționează, poate fi în diferite stări și se poate trece de la o stare la alta forțat (sub influența influențelor externe) sau spontan. Toate moleculele de un anumit tip sunt caracterizate de un anumit set de stări, care pot servi la identificarea moleculelor. Ca formațiune independentă, o moleculă are în fiecare stare un anumit set de proprietăți fizice, aceste proprietăți se păstrează într-un grad sau altul în timpul trecerii de la molecule la substanța formată din ele și determină proprietățile acestei substanțe. În timpul transformărilor chimice, moleculele unei substanțe schimbă atomi cu molecule ale altei substanțe, se descompun în molecule cu mai puțini atomi și, de asemenea, intră în alte tipuri de reacții chimice. Prin urmare, chimia studiază substanțele și transformările lor în legătură inextricabilă cu structura și starea moleculelor.
De obicei, o moleculă este o particulă neutră din punct de vedere electric; dacă o moleculă poartă o sarcină electrică (pozitivă sau negativă), atunci vorbim de ioni moleculari (cationi sau, respectiv, anioni). Într-o substanță, ionii pozitivi coexistă întotdeauna cu cei negativi. Moleculele care se află în stări cu o multiplicitate diferită de unitate (de obicei în stări dublete) se numesc radicali. Radicalii liberi în condiții normale, de regulă, nu pot exista mult timp. Cu toate acestea, sunt cunoscuți radicali liberi cu o structură relativ complexă, care sunt destul de stabili și pot exista în condiții normale.
Pe baza numărului de nuclee atomice incluse în moleculă, moleculele se disting ca diatomice, triatomice etc. Dacă numărul de atomi dintr-o moleculă depășește sute și mii, molecula se numește macromoleculă. Suma maselor tuturor atomilor care alcătuiesc molecula este considerată ca masă moleculară (vezi și Masa moleculară a unui polimer. Distribuția masei moleculare). După mărime greutate moleculară Toate substanțele sunt împărțite în mod convențional în moleculare joase și cu moleculare înaltă.
Atom(din greaca veche ἄτομος - indivizibil) - o particulă a unei substanțe de dimensiune și masă microscopică, cea mai mică parte a unui element chimic, care este purtătorul proprietăților sale.
Ideea atomilor ca cele mai mici particule indivizibile de materie a apărut în antichitate, dar abia în secolul al XVIII-lea, prin lucrările lui A. Lavoisier, M.V. Lomonosov și alți oameni de știință, a fost dovedită realitatea existenței atomilor.
Caracteristicile generale ale structurii atomului. Un atom este format dintr-un nucleu încărcat pozitiv, înconjurat de un nor de electroni încărcați negativ. Dimensiunile unui atom în ansamblu sunt determinate de dimensiunile norului său de electroni și sunt mari în comparație cu dimensiunile nucleului atomic (dimensiunile liniare ale unui atom sunt ~ 10~8 cm, nucleul său ~ 10" -10" 13 cm). Norul de electroni al unui atom nu are limite strict definite, deci dimensiunea unui atom înseamnă. gradele sunt arbitrare și depind de metodele de determinare a acestora (vezi razele atomice). Nucleul unui atom este format din Z protoni și N neutroni ținuți împreună de forțele nucleare (vezi Nucleul atomic). Pozitiv sarcina de protoni si negativ. sarcina electronului este aceeași în termeni absoluti. magnitudinea si sunt egale cu e = 1,60*10 -19 C; neutronul nu are electricitate. încărca. Sarcina nucleară +Ze - de bază. caracteristică a unui atom care determină apartenența acestuia la o anumită substanță chimică. element. Numărul de serie al elementului în perioada periodică. sistemul periodic (numărul atomic) este egal cu numărul de protoni din nucleu.
Într-un atom neutru din punct de vedere electric, numărul de electroni din nor este egal cu numărul de protoni din nucleu. Cu toate acestea, în anumite condiții, poate pierde sau câștiga electroni, întorcându-se, respectiv. în pozitiv sau nega. ion, de ex. Li+, Li2+ sau O-, O2-. Când vorbim despre atomii unui anumit element, ne referim atât la atomii neutri, cât și la ionii acestui element.
Structura și proprietățile atomicesubstante. Chim. Sfinții sunt determinați de structura exteriorului. învelișurile de electroni ale atomilor, în care electronii sunt legați relativ slab (energii de legare de la câțiva eV la câteva zeci de eV). Structura externă învelișuri de atomi chimici. elemente ale unui grup (sau subgrup) periodic. sistemele sunt similare, ceea ce determină asemănarea substanțelor chimice. Sf. în aceste elemente (1) Odată cu creșterea numărului de electroni din învelișul de umplere, energia lor de legare, de regulă, crește; max. electronii dintr-un înveliș închis au energie de legare. Prin urmare, atomi cu unul sau mai mulți. electroni într-un ext parțial umplut. învelișul este dat substanței chimice. r-ţii. Atomi, Crimeea îi lipsesc unul sau mai mulți. electroni pentru formarea unui exterior închis. scoicile le acceptă de obicei. Atomi de gaze nobile cu exterior închis coji, în condiții normale nu intră în reacții chimice. raioane.
Structura internă învelișuri de atomi, ai căror electroni sunt legați mult mai strâns (energie de legare 10 2 -10 4 eV), apare numai în timpul interacțiunii. atomi cu particule rapide și fotoni de înaltă energie. Asemenea interacțiuni determinați natura spectrelor de raze X și împrăștierea particulelor (electroni, neutroni) pe atomi (vezi Metode de difracție). Masa unui atom determină proprietățile sale fizice. sfânt, ca un impuls, cinetic. energie. Din magneți mecanici și înrudiți. si electrice momentele nucleului atomic depind de anumiți factori fizici subtili. efecte (RMN, NQR, structura hiperfină a liniilor spectrale, vezi Spectroscopie).
1 notă de subsol: Electron-volt(rareori electronvolt; Denumirea rusă: eV, international: eV) - o unitate extrasistem de energie utilizată în fizica atomică și nucleară, în fizica particulelor elementare și în domenii apropiate și conexe ale științei (biofizică, chimie fizică, astrofizică etc.). În Federația Rusă, electronvoltul este aprobat pentru utilizare ca unitate în afara sistemului, fără nicio limitare a perioadei de aplicare.
Modelul nuclear al atomului
La începutul secolului al XX-lea, în urma studiului razelor catodice, au fost descoperite particule negative - electroni cu o sarcină de 1,6. 10‾ 19 C, masa 9,11. 10‾ 31 kg, radiație electromagnetică cu raze X deschise. După ce a rezumat aceste descoperiri, J. Thomson a propus în 1897 modelul său al atomului - este o sferă încărcată pozitiv în care sunt intercalate electroni negativi (ca stafidele într-o budincă). Dacă acest model este corect, atunci folia metalică este o peliculă de electricitate pozitivă care conține electroni și fluxul de particule α ar trebui să pătrundă ușor prin ea fără a schimba direcția.
În 1909, angajați ai englezilor. savantul E. Rutherford a verificat acest lucru. 1 din 100.000 de particule α, când au trecut prin folie de aur, au fost împrăștiate în unghiuri mari și chiar întoarse înapoi. Analizând rezultatele experimentului, Rutherford a concluzionat că masa și sarcina atomului sunt concentrate într-o mică parte din volum numită nucleu. Acele particule α care se ciocnesc cu nucleele sunt respinse. Majoritatea particulelor α trec prin spațiul dintre nuclei. Modelul structurii atomice propus de E. Rutherford semăna cu sistemul solar. Se numește model planetar. Potrivit acestuia, în centrul atomului există un nucleu pozitiv în care este concentrată întreaga masă a atomului. Electronii se deplasează în jurul nucleului pe orbite circulare. Sarcina nucleului și numărul de electroni sunt aceleași, adică. atomul este o particulă neutră.
În 1913 Fizicianul englez Moseley a măsurat lungimile de undă ale razelor X emise de diferite metale într-un tub catodic și a trasat dependența rădăcinii pătrate inverse a lungimii de undă a razelor X de numărul atomic al elementului. Acest grafic (Fig. 1) arată că numărul de serie reflectă unele caracteristici importante ale elementului. Moseley a propus că această caracteristică este încărcătura nucleului unui atom și că aceasta crește cu unul atunci când se trece de la un element la altul în ordine. El a numit numărul atomic numărul atomic - Z.
Legea lui Moseley:
Rădăcina pătrată a inversei lungimii de undă a razelor X emise de atomii diferitelor elemente se găsește în dependență liniară din numărul de serie al elementului.
Aceasta este o lege care leagă frecvența liniilor spectrale ale radiației caracteristice de raze X a unui atom al unui element chimic cu numărul său atomic.
unde este lungimea de undă, O– valoare constantă, Z– numărul de serie al elementului (sarcină nucleară).
Mai târziu s-a cunoscut că numărul atomic este egal cu numărul de protoni din nucleu. Astfel, numărul atomic este egal cu sarcina nucleului și determină, de asemenea, prezența protonilor (particule pozitive) în acesta. Și deoarece atomii sunt neutri, numărul de electroni dintr-un atom trebuie să fie egal cu numărul de protoni. Dar masele atomilor s-au dovedit a fi mai mari decât masa totală a protonilor. Pentru a explica excesul de masă, a fost sugerată existența neutronilor. Aceste particule ar trebui să aibă aceeași masă ca un proton, dar încărcătură zero (1,675 - 10 - 27 kg). Neutronul a fost descoperit de colaboratorul lui Rutherford, Chadwig, în 1932. În cele din urmă s-a stabilit că atomul este format dintr-un nucleu și electroni, iar nucleul din protoni și neutroni. Se numește suma lor nucleon număr sau masiv - O.
O= Z+ N,
Z- numărul de protoni, N- numărul de neutroni.
Atomi cu numere diferite de protoni ( Z) și neutroni ( N), dar cu același număr de nucleoni O, numit izobare . De exemplu,
Izotopi – atomi cu același număr de protoni ( Z), nas numere diferite nucleonii
Izotone – atomi cu același număr de neutroni ( N)
Astfel, valorile fracționale ale maselor atomice din tabelul periodic sunt explicate prin prezența izotopilor pentru același element.
Nucleul atomic- partea centrală a atomului, în care se concentrează cea mai mare parte a masei sale (mai mult de 99,9%). Nucleul este încărcat pozitiv; sarcina nucleului este determinată de elementul chimic căruia îi este atribuit atomul. Dimensiunile nucleelor diferiților atomi sunt de câteva femtometre, care este de peste 10 mii de ori mai mică decât dimensiunea atomului însuși.
Linia spectrală- o caracteristică a unei părți a spectrului, exprimată într-o creștere locală (lumină, linii de emisie, maxime spectrale) sau scădere (linii întunecate, linii de absorbție, minime spectrale) a nivelului semnalului.
Intensitate reziduala numită îmbunătățirea/atenuarea radiației într-o linie spectrală în comparație cu un spectru continuu.
Funcția care caracterizează dependența intensității reziduale de frecvență se numește profil de linie.
radiații cu raze X- undele electromagnetice, a căror energie fotonilor se află la scara undelor electromagnetice dintre radiațiile ultraviolete și radiațiile gamma, care corespund lungimilor de undă de la 10 −2 la 10 2 Å (de la 10 −12 la 10 −8 m).
Foton(din greaca veche φῶς, pad nativ. φωτός, „lumină”) - o particulă elementară, un cuantum de radiație electromagnetică (în sensul restrâns al luminii). Este o particulă fără masă, capabilă să existe în vid doar deplasându-se cu viteza luminii.
