В клетката има три източника на аминокиселини – прием от кръвта, разграждане на собствените вътреклетъчни протеини и синтез на неесенциални аминокиселини.
Пътят на по-нататъшна трансформация на аминокиселините зависи от вида и функцията на клетката, условията на нейното съществуване и хормоналните влияния. Обхватът на веществата, получени от клетката от аминокиселини, е изключително широк.
Реакциите на трансформация на аминокиселини в клетката са условно разделени на три части, в зависимост от реагиращата група:
1. на страничната верига (радикал):
Аминокиселините могат да осигурят енергия
Тъй като в тялото има 20 протеиногенни и още повече непротеиногенни аминокиселини, които се различават една от друга по структурата на страничния радикал, има подобен брой специфични пътища за техния катаболизъм на тяхната странична група. Но въпреки това всички тези пътища се сливат и се сливат в шест продукта, които влизат в CTC и тук се окисляват напълно до въглероден диоксид и вода с освобождаване на енергия. От общото количество енергия, произведена в тялото, аминокиселините представляват около 10%.

При определени условия въглеродният скелет на аминокиселините не се разпада, а участва в синтеза на въглехидрати (глюкогенни аминокиселини) и липиди (кетогенни аминокиселини).
Глюкогенните аминокиселини включват (повечето от тях), чието разграждане произвежда пируват и метаболити на TCA, например оксалоацетат или α-кетоглутарат.
Лизинът и левцинът са строго кетогенни; когато се окисляват, се образува само ацетил-S-CoA. Участва в синтеза на кетонни тела, мастни киселини и холестерол.
Изолирана е и малка група смесени аминокиселини, от които се образуват пируват, метаболити на TCA и ацетил-S-CoA (фенилаланин, тирозин, изолевцин, триптофан).
2. по карбоксилна група:
Невротрансмитерите се образуват от аминокиселини
Синтезът на невротрансмитери от аминокиселини се свързва преди всичко с участието на α-карбоксилната група на аминокиселините в метаболизма или, по-просто, нейното отстраняване.
хистамин
Реакцията на образуване на хистамин е най-активна в мастоцитите на белите дробове, кожата, черния дроб, базофилите и еозинофилите. При тях хистаминът се синтезира и се натрупва в секреторни гранули.

реакция на синтез на хистамин
Хистаминът се освобождава в кръвта, когато тъканта е повредена, при удар или при електрическа стимулация. В клиничната практика секрецията на хистамин обикновено се свързва с алергии – когато антигенът отново попадне в преди това сенсибилизиран организъм, се развива алергична реакция.
Физиологични ефекти
разширяване на артериолите и капилярите и в резултат на това зачервяване на кожата, понижаване на кръвното налягане;
повишена пропускливост на капилярната стена и в резултат на това отделяне на течност в междуклетъчното пространство (подуване), понижаване на кръвното налягане;
ако предишните точки се извършват в мозъка - повишаване на вътречерепното налягане;
повишава тонуса на гладката мускулатура на бронхите, в резултат на това - спазъм и задушаване;
леко повишава тонуса на мускулите на стомашно-чревния тракт;
стимулира секрецията на слюнка и стомашен сок.
Серотонин
Серотонинът се синтезира активно в мастоцитите на кожата, белите дробове, черния дроб, далака и централната нервна система.
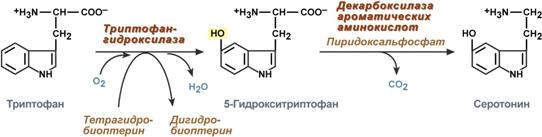
Реакции на синтез на серотонин
Физиологични ефекти
стимулира свиването на гладката мускулатура на стомашно-чревния тракт и в резултат на това увеличаване на стомашно-чревната подвижност;
силно стимулира свиването на съдовата гладка мускулатура, с изключение на съдовете на миокарда и скелетните мускули и в резултат на това повишаване на кръвното налягане;
леко повишава тонуса на гладката мускулатура на бронхите;
в централно нервна системае инхибиторен медиатор;
в периферните нервни окончания причинява болка и сърбеж (например при ухапване от насекоми).
Гама аминомаслена киселина
Синтезът на γ-аминомаслена киселина (GABA) се извършва изключително в централната нервна система - в подкоровите образувания на мозъка.

Реакция на синтез на GABA
Физиологични ефекти
В централната нервна система GABA (заедно с глутаминова киселина) е инхибиторен невротрансмитер. Най-високата му роля е в темпоралната и фронталната кора, хипокампуса, амигдалата и хипоталамичните ядра, черната субстанция и мозъчните ядра.
Синтезът на допамин се извършва главно в невроните на диенцефалона и средния мозък.

Реакции на допамин синтез
Физиологични ефекти
Той е медиатор на допаминовите рецептори в подкоровите образувания на централната нервна система, в големи дози разширява съдовете на сърцето, стимулира честотата и силата на сърдечните контракции, разширява съдовете на бъбреците, увеличава диурезата.
Неутрализация биогенни амини
Има два вида реакции на инактивиране на биогенни амини, дезаминиране и метилиране.
Деаминирането протича с образуването на свободен амоняк и с участието на FAD. Моноамин оксидазата катализира реакцията; тя се намира в много тъкани, но е най-активна в черния дроб, стомаха, бъбреците, червата и нервната тъкан.
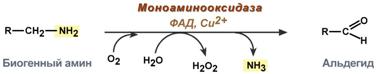
Реакция, включваща моноаминоксидаза
Метилирането на биогенен амин се случва, когато той има хидроксилна група (допамин, серотонин). Активната форма на метионин, S-аденозилметионин (SAM), участва в реакцията, образуват се метилираната форма на амина и S-аденозилхомоцистеин (SAG).
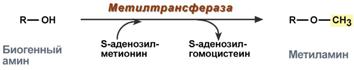
реакция на метилиране
3. с участието на аминогрупата:
Има 4 вида дезаминиране
Трансформацията на аминокиселините с участието на NH2 групата се свежда до нейното отделяне от въглеродния скелет - реакцията на дезаминиране.
Видове дезаминиране
интрамолекулно - с образуването на ненаситена мастна киселина:

намаляване - с образуването на наситена мастна киселина:
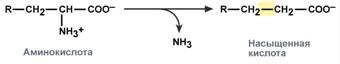
хидролитичен - с образуването на карбоксилна хидрокси киселина:
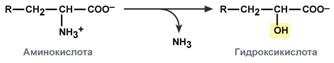
окислителен - с образуването на кето киселини:

При хората окислителното дезаминиране е основният път за катаболизъм на аминокиселините. Въпреки това, аминокиселини като серин и хистидин могат да загубят своята аминогрупа чрез други видове дезаминиране и треонинът незабавно се разцепва директно до глицин и ацеталдехид.
Аминокиселините трябва да се транспортират през мембраните
Прехвърлянето на аминокиселини през клетъчните мембрани, както по време на абсорбцията от чревната кухина в ентероцитите, така и по време на прехода от кръвта към клетките на различни тъкани, се осъществява с помощта на два механизма: вторичен активен транспорт и глутатионова транспортна система.
Транспортиране на аминокиселини през мембраните
вторичен активен транспорт
Вторичният активен транспорт е транспортирането на вещества, в този случай аминокиселини, като се използва градиент на концентрация на натрий между вътрешната и външната страна на клетъчната мембрана.
Вторичният активен транспорт се основава на използването на ниска концентрация на натриеви йони вътре в клетките, създадена от мембранния ензим Na+,K+-АТФаза. Специфичен транспортен протеин свързва аминокиселина и натриев йон върху апикалната повърхност на ентероцитите. Важното е, че при липса на натрий аминокиселината не е в състояние да се свърже с белтъка носител.
След това, променяйки позицията си в мембраната, протеинът дарява натриевия йон на цитозола по градиента на концентрация. Веднага след това аминокиселината губи връзката си с протеина и остава в цитоплазмата.
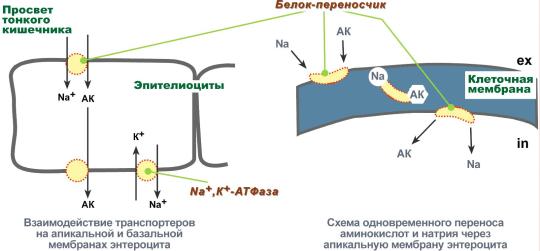
Вторичен активен транспорт на аминокиселини през мембраните
В момента има 5 транспортни системи:
за големи неутрални, включително алифатни и ароматни аминокиселини,
за малки неутрални - аланин, серин, треонин,
за основните аминокиселини - аргинин и лизин,
за киселинни аминокиселини - аспартат и глутамат,
за малки аминокиселини - глицин, пролин и хидроксипролин.
Транспортна система на глутатион
Вторият начин за прехвърляне на аминокиселини в клетката се осъществява в комбинация с глутатион с помощта на ензима γ-глутамилтрансфераза.
Транспорт на аминокиселини с участието на глутатион

Носителят на някои аминокиселини (обикновено неутрални) според тази схема е трипептидът глутатион (γ-глутамилцистеилглицин). Когато глутатионът взаимодейства с аминокиселина от външната страна на клетъчната мембрана с участието на глутамил трансфераза. Остатъкът от γ-глутамил свързва аминокиселината и тя се движи вътре в клетката. Глутатионът се разпада на своите съставки. След отделяне на аминокиселината, глутатионът се ресинтезира.
В клетките постоянно се произвежда амоняк
Амонякът се образува непрекъснато във всички органи и тъкани на тялото. Най-активните му продуценти в кръвта са органи с висок обмен на аминокиселини и биогенни амини – нервна тъкан, черен дроб, черва, мускули.
Основни източници на амоняк
Основните източници на амоняк са следните реакции:
неокислително деаминиране на някои аминокиселини (серин, треонин, хистидин) - в черния дроб,
окислително деаминиране на глутаминова киселина във всички тъкани (с изключение на мускулите), особено в черния дроб и бъбреците,
дезаминиране на амиди на глутаминова и аспарагинова киселини - в черния дроб и бъбреците,
катаболизъм на биогенни амини - във всички тъкани, в най-голяма степен в нервната тъкан,
бактериална активност в дебелото черво
разграждането на пуринови и пиримидинови основи - във всички тъкани.
Свързване на амоняк
Тъй като амонякът е изключително токсично съединение, има няколко реакции на свързване (неутрализация) на амоняка в тъканите - синтеза на глутаминова киселина и глутамин, синтеза на аспарагин, синтеза на карбамоил фосфат:
синтез на глутаминова киселина (редукционно аминиране) - взаимодействието на α-кетоглутарат с амоняк. Реакцията е по същество обратната на реакцията на окислително дезаминиране, но NADPH се използва като коензим. Среща се в почти всички тъкани с изключение на мускулите, но е от малко значение, т.к. за глутамат дехидрогеназа, предпочитаният субстрат е глутаминова киселинаи равновесието на реакцията се измества към α-кетоглутарат,
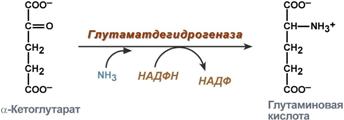
Реакция на синтез на глутаминова киселина
синтез на глутамин - взаимодействието на глутамат с амоняк. Това е основният начин за отстраняване на амоняка, най-активно се среща в нервната и мускулната тъкан, в бъбреците, ретината и черния дроб. Реакцията протича в митохондриите.
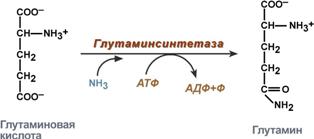
Реакция на синтез на глутамин
Образуването на голямо количество глутамин осигурява високи концентрации в кръвта (0,5-0,7 mmol / l).
Тъй като глутаминът прониква през клетъчните мембрани чрез улеснена дифузия, той лесно влиза не само в хепатоцитите, но и в други клетки, където има нужда от аминогрупи. Азотът, пренасян от глутамин, се използва от клетките за синтеза на пуринови и пиримидинови пръстени, гуанозин монофосфат (GMP), аспарагин, глюкозамино-6-фосфат (прекурсорът на всички други аминозахари).
синтез на аспарагин - взаимодействието на аспартат с амоняк. Това е вторичен начин за отстраняване на амоняка, той е енергийно неблагоприятен, т.к. в същото време се изразходват 2 макроергични връзки,
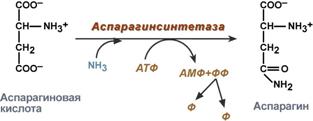
Реакция на синтез на аспарагин
синтез на карбамоил фосфат в митохондриите на черния дроб - реакцията е първата в синтеза на урея, средство за отстраняване на амоняка от тялото.
Транспорт на амоняк
Транспортни форми на амоняк от тъканите към черния дроб са глутамин и аланин, в по-малка степен аспарагин и глутамат, известно количество амоняк е в кръвта в свободна форма. Най-застъпени са глутаминът и аланинът, техният дял сред всички аминокиселини в кръвта е до 50%. Повечето отглутаминът идва от мускулите и нервната тъкан, аланинът носи амоняк от мускулите и чревната стена.
Глюкозо-аланинов цикъл
В мускулите основният акцептор на излишния аминоазот е пируватът. По време на протеиновия катаболизъм в мускулите възникват реакции на трансаминиране на аминокиселини, образува се глутамат, който след това прехвърля аминоазот към пируват и се образува аланин. От мускулите с кръв аланинът се пренася в черния дроб, където при обратната реакция прехвърля своята аминогрупа на глутамат. Полученият пируват се използва като субстрат в реакциите на синтеза на глюкоза (глюконеогенеза), докато глутаминовата киселина се дезаминира и амонякът се използва в синтеза на урея.
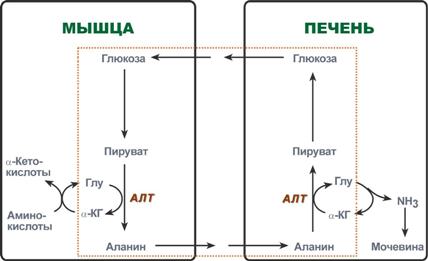
Реакции на цикъла глюкоза-аланин (маркирани с рамка).
Реакции, свързани с транспортни форми на амоняк
Целевите органи за транспортиране на амоняк са черният дроб, бъбреците и червата.
В черния дроб:
аспарагинът и глутаминът се деаминират съответно от аспарагиназа и глутаминаза, полученият амоняк се използва за синтеза на урея,
аланинът влиза в реакции на трансаминиране с α-кетоглутарат,
глутаминовата киселина се подлага на окислително дезаминиране.
В червата част от глутамина се дезаминира от глутаминаза. След това образуваният амоняк се освобождава в чревния лумен (не повече от 5%) или отива в черния дроб през кръвта на порталната вена, а глутаматът преминава в трансаминиране с пируват, в резултат на което аминоазотът преминава в аланин и също така влиза в черния дроб с него,
В бъбреците се образуват амониеви соли с помощта на глутамат, глутамин и аспарагин.
Натрупването на амоняк е проблем
Амонякът е токсично съединение, което се намира в кръвта в относително ниски концентрации (11,0-32,0 µmol/l). Симптомите на отравяне с амоняк се появяват, когато тези граници са превишени само 2-3 пъти. Максимално допустимото ниво на амоняк в кръвта е 60 µmol/l. При повишаване на концентрацията на амоняк (хиперамонемия) до екстремни стойности може да настъпи кома и смърт. При хронична хиперамонемия се развива умствена изостаналост.
Хипотези за токсичност на амоняка
Токсичността на амоняка се дължи на следните обстоятелства:
1. Свързването на амоняка по време на синтеза на глутамат предизвиква изтичане на α-кетоглутарат от цикъла на трикарбоксилната киселина, докато образуването на АТФ енергия намалява и клетъчната активност се влошава.
2. Амониеви йони NH4+ предизвикват алкализиране на кръвната плазма. Това увеличава афинитета на хемоглобина към кислорода (ефект на Бор), хемоглобинът не отделя кислород в капилярите, което води до клетъчна хипоксия.
3. Натрупването на свободен йон NH4+ в цитозола влияе върху мембранния потенциал и работата на вътреклетъчните ензими – съревновава се с йонни помпи за Na+ и K+.
4. Продуктът от свързването на амоняка с глутаминова киселина – глутаминът – е осмотично активно вещество. Това води до задържане на вода в клетките и тяхното подуване, което причинява подуване на тъканите. В случай на нервна тъкан, това може да причини мозъчен оток, кома и смърт.
5. Използването на α-кетоглутарат и глутамат за неутрализиране на амоняка причинява намаляване на синтеза на γ-аминомаслена киселина (GABA), инхибиторен медиатор на нервната система.
Наследствени и придобити форми на хиперамонемия
Придобити форми
Придобитата (вторична) хиперамонемия се развива в резултат на чернодробни заболявания и вирусни инфекции. В изключително тежки случаи се проявява като гадене, повръщане, гърчове, неясен говор, замъглено зрение, тремор и нарушена координация на движенията.
наследствени форми
Наследствените форми на хиперамонемия са причинени от генетичен дефект в някой от петте ензима за синтез на урея. Според ензима заболяването се разделя на пет вида. Основните признаци на хиперамонемия са сънливост, отказ от хранене, повръщане, тревожност, конвулсии, нарушена координация на движенията, тахипнея, респираторна алкалоза. Може да се развие чернодробна недостатъчност, белодробни и вътречерепни кръвоизливи.
Най-честата е хиперамонемия тип II, свързана с липса на орнитин карбамоилтрансфераза. Заболяването е рецесивно, свързано с Х хромозомата. Майката също има хиперамонемия и отвращение към протеиновите храни. При пълен ензимен дефект, наследствените хиперамонемии имат ранно начало (до 48 часа след раждането).
Лабораторният критерий за заболяването е натрупването на глутамин (20 или повече пъти) и амоняк в кръвта, цереброспиналната течност и урината.
Основата на лечението на хиперамонемия се свежда до ограничаването на протеина в диетата, което вече ви позволява да предотвратите много нарушения на мозъчната дейност.
Синтез на урея
В черния дроб целият отстранен амоняк се използва за синтеза на урея. Увеличаване на синтеза на урея се наблюдава при разграждане на тъканни протеини и азотни съединения (гладуване, възпалителни процеси, захарен диабет) или при прекомерно протеиново хранене. При кърмачета и деца синтезът на урея може да бъде намален по две причини: незрялост на черния дроб и активният синтез на протеини и нуклеинови киселини по време на растежа.
Реакциите на синтез на урея са цикличен процес и се наричат орнитин цикъл. Синтезът на урея започва в митохондриите (първата и втората реакция), останалите три реакции протичат в цитозола. За преноса на цитрулин и орнитин през митохондриалната мембрана има специални носители.
Като страничен продукт от орнитиновия цикъл се образува фумарова киселина, която се прехвърля обратно в митохондриите. Тук в реакциите на TCA от него се образува оксалоацетат, който се трансаминира с глутамат до аспартат, навлиза в цитозола и отново реагира с цитрулин.
В образуването на една молекула урея, 1 молекула NH4 +, 1 молекула CO2, участва аминогрупата на 1 молекула аспарагинова киселина, изразходват се 4 макроергични връзки на три молекули АТФ.

Креатин фосфат - спешен енергиен резерв
Креатинът е вещество от скелетните мускули, миокарда и нервната тъкан. Под формата на креатин фосфат, креатинът е "депо" от макроергични връзки, използва се за бързия ресинтез на АТФ по време на работа на клетката.

Използване на креатин фосфат за ресинтеза на АТФ
Ролята на креатина в мускулна тъкан. Креатин фосфатът осигурява ресинтеза на АТФ в първите секунди на работа (5-10 секунди), когато все още не е активирана нито анаеробната гликолиза, нито аеробното окисление на глюкозата и мастните киселини и кръвоснабдяването на мускула не се увеличава. В клетките на нервната тъкан креатин фосфатът поддържа клетъчната жизнеспособност при липса на кислород.
По време на мускулна работа йони Са2+, освободени от саркоплазмения ретикулум, са активатори на креатин киназата. Реакцията е интересна и с това, че може да се използва като пример за наблюдение на положителна обратна връзка – активиране на ензима от продукта на реакцията креатин. По този начин се избягва намаляване на скоростта на реакцията по време на работа, което е трябвало да се случи според закона за масовото действие поради намаляване на концентрацията на креатин фосфат в работещите мускули.
Около 3% от креатин фосфата постоянно се превръща в креатинин в реакцията на неензимно дефосфорилиране. Количеството креатинин, отделяно от здравия човек на ден, винаги е почти едно и също и зависи само от количеството мускулна маса.

Образуване на креатинин от креатин фосфат
Синтезът на креатин протича последователно в бъбреците и черния дроб в две трансферазни реакции. В края на синтеза креатинът се доставя до мускулите или мозъка с кръвния поток.


Реакции на синтеза на креатин в бъбреците и черния дроб
Тук, в присъствието на АТФ енергия (по време на почивка или почивка), тя се фосфорилира, за да образува креатин фосфат.
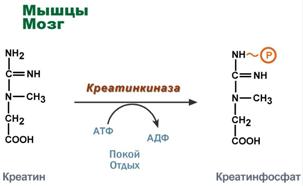
Синтез на креатин фосфат
Ако синтезът на креатин изпреварва възможността за неговото фиксиране в мускулната тъкан, тогава се развива креатинурия - появата на креатин в урината. Физиологичната креатинурия се наблюдава през първите години от живота на детето. Понякога креатинурия при възрастни хора също се нарича физиологична, която възниква в резултат на мускулна атрофия и непълно използване на креатин, образуван в черния дроб. При заболявания на мускулната система (с миопатия или прогресираща мускулна дистрофия) най-високи концентрации на креатин се наблюдават в урината - патологична креатинурия.
литература
Биосинтетични пътища за протеин-образуващи аминокиселини ( протеиногенен) са доста сложни, многостранни (една и съща аминокиселина може да се синтезира по различни начини) и могат да се различават значително при различните организми. Въпреки това има доста голям брой модели в тези процеси и за удобство всичките 20 протеиногенни аминокиселини могат да бъдат разделени на 5 биосинтетични семейства. Аминокиселините, принадлежащи към едно и също семейство, се характеризират с наличието на общи предшественици, които се образуват в TCA цикъла, в процеса на гликолиза, в хода на пентозофосфатните пътища.
Неесенциалните аминокиселини се синтезират от прости реакции, докато биосинтетичните пътища за есенциалните аминокиселини са много сложни. Необходими за белите плъхове аминокиселини включват: валин, изолевцин, левцин, треонин, метионин, лизин, фенилаланин, триптофан, хистидин и аргинин. Осем от десетте изброени аминокиселини също не се синтезират от човешкото тяло, остава спорно дали хистидинът и аргининът са от съществено значение за хората.
Биосинтеза на аминокиселини от семейството на глутамата . Това семейство включва: глутамат, глутамин, пролин и аргинин. Първите две аминокиселини се образуват от а-кетоглутарат, а аминогрупите произлизат от амонячни молекули (фиг. 16.3). Пролинът се синтезира от глутамат в четири реакции: g-карбоксилната група на глутамата реагира с АТФ, за да образува ацил фосфат. Последният се редуцира с участието на NADPH до алдехид, а след това, по време на спонтанна дехидратация, се превръща в циклично съединение - пиролин карбоксилат. Този продукт се редуцира с участието на NADPH до пролин (фиг. 16.4).
Синтезът на аргинин (фиг. 16.5) също се извършва от глутамат, който първо се ацетилира при аминогрупата, а след това преминава през описаните по-горе реакции на фосфорилиране и образуване на полуалдехид. Въпреки това, g-полуалдехидът на N-ацетилглутамат не се циклизира, както в пътя на биосинтеза на пролин, а се трансаминира с участието на глутамат (Glu). В резултат на тази реакция се образуват a-кетоглутарат (KG) и N-ацетилорнитин. Последният се подлага на деацетилиране, за да образува орнитин. Орнитинът се превръща в аргинин чрез няколко реакции, присъстващи в цикъла на уреята.
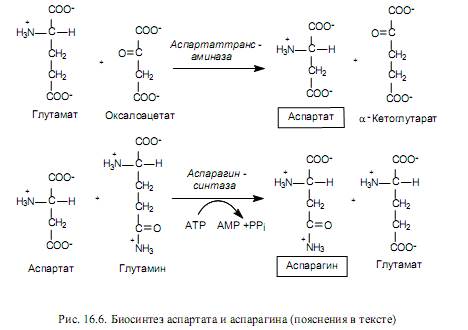
Биосинтеза на аминокиселини от семейство аспартат.Семейството аспартат включва: аспартат, аспарагин, лизин, треонин, изолевцин и метионин. Последните пет аминокиселини от този състав се синтезират от аспартат, който от своя страна се образува от оксалоацетат, междинен продукт на TCA, по време на реакцията на трансаминиране. В този случай глутаматът действа като донор на аминогрупата (фиг. 16.6).
Аспартатът служи като прекурсор за синтеза на аспарагин и при много бактерии може да се случи директно аминиране на аспартат в АТФ-зависима реакция, включваща аспарагин синтетаза (16.2).
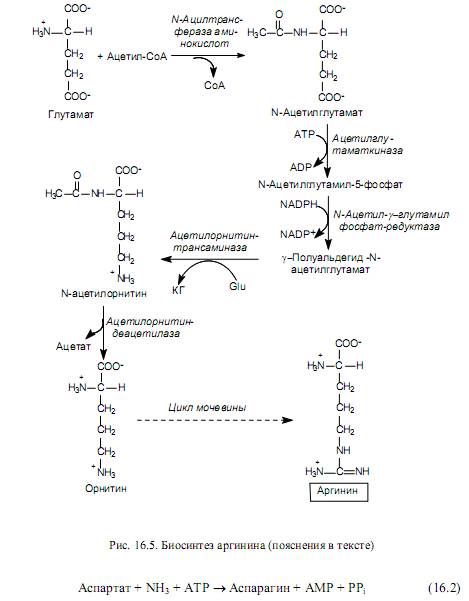
В клетките на бозайници се осъществява друга реакция (фиг. 16.6), при която глутаминът действа като донор на аминогрупата по време на образуването на аспарагин.
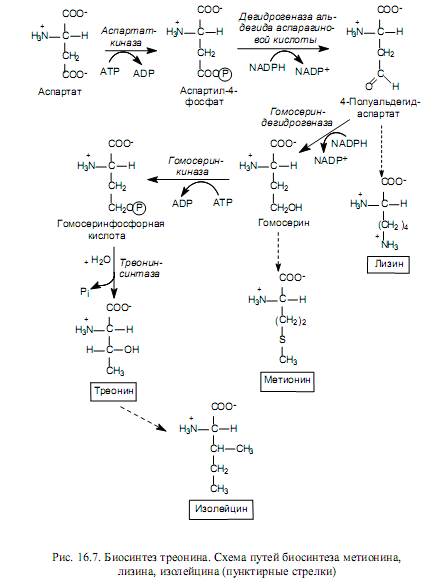
Лизин, метионин и треонин се синтезират от аспартатни производни (фиг. 16.7), а изолевцинът се синтезира от треонин.
Лизинът в бактериални и растителни клетки се синтезира при алдолна кондензация на аспарагинова киселина, полуалдехид и пируват, последвана от редукция, добавяне на сукцинатен остатък, трансаминиране с участието на глутамат, вътрешномолекулно пренареждане и декарбоксилиране. При гъбичните клетки се използва друг път за биосинтеза на лизин – от а-кетоглутарат и ацетил-КоА.
Въглеродният скелет на метионина се образува от хомозерин, серният атом идва от цистеин, а N-метилтетрахидрофолиевата киселина служи като донор на метилова група.
Треонинът е източник на четири от шестте въглеродни атома в молекулата на изолевцин. На първия етап на синтеза треонинът се дезаминира, превръщайки се в 2-кетобутират, след това взаимодейства с пируват, претърпява структурни пренареждания и реакция на трансаминиране, при която глутаматът действа като донор на аминогрупата.
Биосинтеза на аминокиселини от семейството на пируват. От пируват се синтезират: аланин, валин и левцин.
Аланинът се образува в реакцията на трансаминиране, където глутаматът служи като донор на аминогрупа (фиг. 16.8). Синтезът на валин и левцин има няколко общи стъпки и започва с образуването на ацетолактат. Този метаболит се образува от две молекули пируват: едната от тях се декарбоксилира, а образуваният активен ацетат се прехвърля към втората молекула (фиг. 16.8). Тази реакция се катализира от ацетолактат синтаза с участието на тиамин пирофосфат. 2-ацетолактатът се редуцира до дихидроксиизовалеринова киселина, което е придружено от миграция на метиловата група. Дихидроксиизовалератът се дехидратира до 2-кетоизовалерат. Този продукт може да се превърне във валин в реакция на трансаминиране, включваща глутамат, както и да кондензира с ацетил-КоА и в хода на няколко реакции (изомеризация, редукция, декарбоксилиране, трансаминиране) да се превърне в левцин. Донор на аминогрупата при образуването на левцин също е глутаматът (фиг. 16.8).
Биосинтеза на аминокиселини от семейството на серините. Семейството включва серин, цистеин и глицин. Предшественикът на тези аминокиселини е 3-фосфоглицератът, междинен продукт на гликолизата.
3-Фосфоглицератът се окислява до 3-фосфохидроксипируват, след което се аминира с участието на глутамат до 3-фосфосерин и се дефосфорилира до серин (фиг. 16.9). Има и алтернативен начинкогато елиминирането на фосфатната група настъпи преди реакцията на окисление:
3-Фосфоглицерат→Глицерат→Хидроксипируват→Серин
Серинът служи като субстрат за синтеза на глицин и цистеин. При образуването на глицин b-въглеродният атом на страничната верига на серина се приема от носителя на едновъглеродни фрагменти – кофактора тетрахидрофолиева киселина с участието на ензима серин-хидроксиметил-трансфераза (фиг. 16.9). Има и друг начин за синтез на глицин: от CO 2 , NH + 4 и метилентетрахидрофолиева киселина, която се катализира от глицин синтаза.

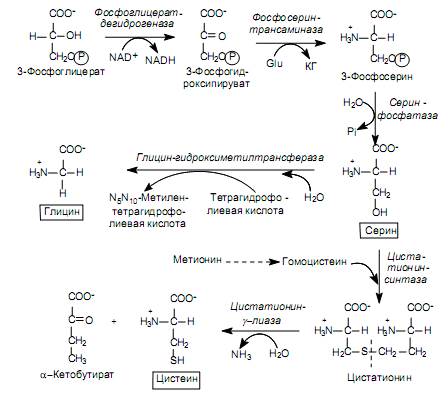
Превръщането на серин в цистеин е свързано със замяната на кислородния атом на страничната верига със серен атом, чийто донор е метионин. Първо, метионинът в поредица от АТФ-зависими реакции, при които се образува неговата активирана форма (S-аденозилметионин), губи метиловата група при серния атом и се превръща в хомоцистеин:
След това хомоцистеинът взаимодейства със серин, образувайки цистатионин, който се разцепва от цистатионин-g-лиаза в цистеин и а-кетобутират (фиг. 16.9).
Някои микроорганизми имат алтернативен път за синтеза на цистеин, където сероводородът служи като донор на серен атом. В този случай серинът първо се ацетилира от ацетил-КоА (катализира реакцията на серин трансацетилаза), а след това ацетилсеринът взаимодейства със сероводород с участието на О-ацетилсерин сулфхидролаза:
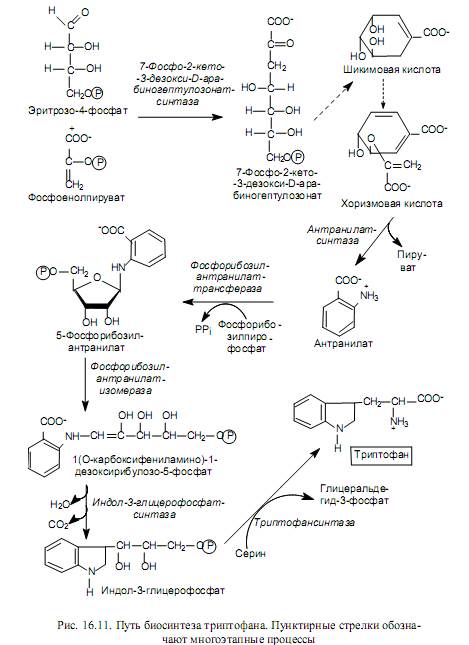
Биосинтеза на аминокиселини от семейството на пентозите. Аминокиселините, принадлежащи към това семейство (хистидин, триптофан, фенилаланин и тирозин), се синтезират с участието на петвъглеродно междинно съединение на пентозофосфатните пътища - рибоза-5-фосфат, на базата на което се комбинират в пентоза семейство. На фиг. 16.10 показва пътищата на трансформация на рибоза-5-фосфат, водещи до образуването на съединения, от които се синтезират тези аминокиселини.
Процесът на биосинтеза на хистидин е доста сложен и се осъществява с участието на 5-фосфорибозил-1-пирофосфат, АТФ и глутамин. На фиг. 16.10 в състава на молекулата на хистидин е показан произходът на въглеродните и азотните атоми: един азотен атом на имидазоловия пръстен идва от амидната група на глутамин, другият азотен атом и един от въглеродните атоми на пръстена произлизат от АТФ , а останалите въглеродни атоми произхождат от 5-фосфорибозил-1-пирофосфат.
Биосинтезата на ароматни аминокиселини започва с етапа на кондензация на еритроза-4-фосфат с фосфоенолпируват. Полученото седем въглеродно съединение (7-фосфо-2-кето-3-деокси-D-арабинохептулоза-нат) се дефосфорилира, циклизира, дехидратира и редуцира с участието на NADPH до шикимова киселина. Шикимовата киселина претърпява друга кондензация с фосфоенолпируват и след елиминиране на остатъка от фосфорна киселина се превръща в хоризманова киселина (фиг. 16.11). Chorismate служи като основен предшественик на биосинтетичния път на триптофана, който е изобразен на фиг. 16.11.
Хоризманова киселина се използва и за синтеза на фенилаланин, тоест на етапа на неговото образуване пътищата на биосинтеза на две незаменими ароматни аминокиселини - триптофан и фенилаланин - се разминават (оттук и името chorismate, което идва от гръцката дума, която означава " вилица").
Фенилаланинът се образува в три последователни реакции: изомеризация на хоризмата до префенат, дехидратация и декарбоксилиране на префенат до фенилпируват и трансаминиране на фенилпируват с участието на глутамат.
Заменимата киселина тирозин може да се синтезира от фенилаланин чрез неговото хидроксилиране с участието на фенилаланин-4-монооксигеназа, както и от префенова киселина след нейното декарбоксилиране и аминиране.

Модели на биосинтеза на аминокиселини . Преглед на пътищата на биосинтеза на протеиногенни аминокиселини разкрива следните основни модели на тези процеси: 1) въглеродните скелети на аминокиселините произхождат от междинни продукти на гликолиза (3-фосфоглицерат, фосфоенолпируват, пируват), пентозофосфатни пътища (рибоза-4-трозефат и 5-фосфат) -фосфат), TCA (оксалоацетат и а-кетоглутарат); 2) донорът на аминогрупи за повечето протеиногенни аминокиселини е глутаматът, по-рядко глутаминът; реакции, при които аминогрупата на аминокиселина се прехвърля в кето киселина се наричат "реакции на трансаминиране"; 3) биосинтезата на много аминокиселини се осъществява от "семейства", за които се използват общи предшественици; много аминокиселини сами по себе си служат като субстрати за синтеза на други аминокиселини; 4) много етапи на биосинтеза на аминокиселини изискват приток на енергия и са придружени от хидролиза на АТФ (етапи на синтез на хистидин, пролин, метионин, аспарагин, глутамин, аргинин); освен това се използва енергията на активираните молекули, участващи в синтеза; накрая, междинните продукти се отстраняват от катаболните и амфиболните процеси, които биха могли да осигурят на клетката съхранение на енергия; 5) много етапи на биосинтеза на аминокиселини изискват участието на редуциращи еквиваленти (NADH и NADPH), които могат да се окислят в дихателната верига и да причинят енергийно натрупване.
По този начин биосинтезата на аминокиселини е доста скъпа за клетката. Следователно не е изненадващо, че този процес във всеки организъм (клетка) е обект на много сложна регулация (глава 19), която, от една страна, се определя от сложността и разклонението на самия биосинтез на протеиногенни аминокиселини, и, от друга страна, трябва да осигури строга икономия на клетъчни ресурси (енергия, еквиваленти за възстановяване, градивни елементи). Също така изглежда логично, че в присъствието на екзогенни аминокиселини, по-специално клетките на микроорганизмите не ги синтезират сами, а използват готови форми.
1. Въглероден скелет от осем незаменими аминокиселини (Ala, Asp, Asn, Ser, Gli, Pro, Glu, Gln)и цистеинможе да се синтезира от глюкоза (фиг. 9.15).
α-Аминогрупата се въвежда в съответните α-кето киселини чрез реакция на трансаминиране. Универсалният донор на α-аминогрупата е глутаматът.
Директно чрез трансаминиране на OPC метаболити с глутамат се синтезират следните:
 Ориз. 9.15. Пътища за биосинтеза на неесенциални аминокиселини
Ориз. 9.15. Пътища за биосинтеза на неесенциални аминокиселини
2. Частично заменими аминокиселини Arg и Hisсе синтезират в малки количества, които не отговарят на нуждите на организма, което е особено забележимо в детството. Синтез на аргининвъзниква в реакциите на орнитиновия цикъл. хистидинсинтезиран от АТФ и рибоза.
Условно незаменими аминокиселини Tyr и Cysобразуван с помощта на незаменими аминокиселини:
Фенилаланинът се превръща в тирозинпод действието на фенилаланин хидроксилаза;
За образованието цистеиннеобходима е сяра, чийто донор е метионин. Синтезът използва въглеродния скелет и α-амино групата на серина.
КОЛИЧЕСТВЕНИТЕ ХАРАКТЕРИСТИКИ НА МЕТАБОЛИЗМА НА АМИНОКИСЕЛИНИ, ИЗУЧЕН В ТОЗИ МОДУЛЕН ЗДЕС
Серумна концентрация на амоняк: 0,04-0,07 mg/dL (25-40 µmol/L)
Серумна концентрация на урея: 15-50 mg/dL (2,5-8,4 mmol/L)
Ежедневна екскреция на урея: -25 г/ден
Ежедневно отделяне на амониеви соли: -0,5 g/ден
Модулна единица 3 ОСОБЕНОСТИ НА МЕТАБОЛИЗМА НА ОТДЕЛНИ АМИНОКИСЕЛИНИ: СЕРИН, ГЛИЦИН, МЕТИОНИН, ФЕНИЛАЛАНИН, ТИРОЗИН И ХИСТИДИН. РОЛЯТА НА ВИТАМИНИ В 12, В 6 И ФОЛИЕВА КИСЕЛИНА. ЗАБОЛЯВАНИЯ, СВЪРЗАНИ С НАРУШЕНИЕ НА МЕТАБОЛИЗМА НА ФЕНИЛАЛАНИН И ТИРОЗИН.
СИНТЕЗ, БИОЛОГИЧНА РОЛЯ И ИНАКТИВАЦИЯ
БИОГЕННИ АМИНИ
ТЕМА 9.9. МЕТАБОЛИЗЪМ НА СЕРИНА И ГЛИЦИНА.
РОЛЯТА НА ФОЛИЕВАТА КИСЕЛИНА
В допълнение към метаболитните пътища, характерни за повечето аминокиселини, които изграждат протеините, има специфични пътища на трансформация за почти всички аминокиселини. Нека разгледаме обмена на някои аминокиселини, специфичните пътища на трансформация на които водят до синтеза на биологично важни продукти и до голяма степен определят физиологичното състояние на човек.
1. Спокоен- неесенциална аминокиселина, синтезирана от междинен продукт
гликолизен продукт - 3-фосфоглицерат в последователността на реакциите на дехидрогениране, трансаминиране и хидролиза под действието на фосфатаза
В тялото серинът се използва за синтезиране на:
Фосфолипиди (фосфатидилсерини, сфингомиелини);
Аминокиселини (глицин, цистеин).
Основен път на серинов катаболизъм- дезаминирането му с образуване на пируват (виж тема 9.3).
2. Глицинът се образува от серин под действието на серин оксиметилтрансфераза. Коензимна този ензим е тетрахидрофолиева киселина (H4-фолат),
който свързва β-въглеродния атом на серина, образувайки метилен - Н4-фолат
Глицинът е предшественик на:
порфирини (хем),
пуринови основи,
коензими,
Глутатион и др. Глицинов катаболизъмпродължава
също с участието на Н4-фолат,който свързва а-СН2 групата на глицина (виж фиг. 9.18).
3. Н4-фолатсе образува в черния дроб от фолиева киселина (фолат) с участието на ензимите фолат редуктаза и дихидрофолат редуктаза (фиг. 9.19). Коензимът на тези редуктази е NADPH.
Метиленова група - CH 2 -в молекула метилен-Н4-фолатможе да се трансформира в други едновъглеродни групи:
Н4-фолате в състояние да прехвърли тези групи към други връзки и играе роля междинен носител на едновъглеродни групи.
Едновъглеродните фрагменти се използват за синтеза на нуклеотиди и редица съединения (виж фиг. 9.18).
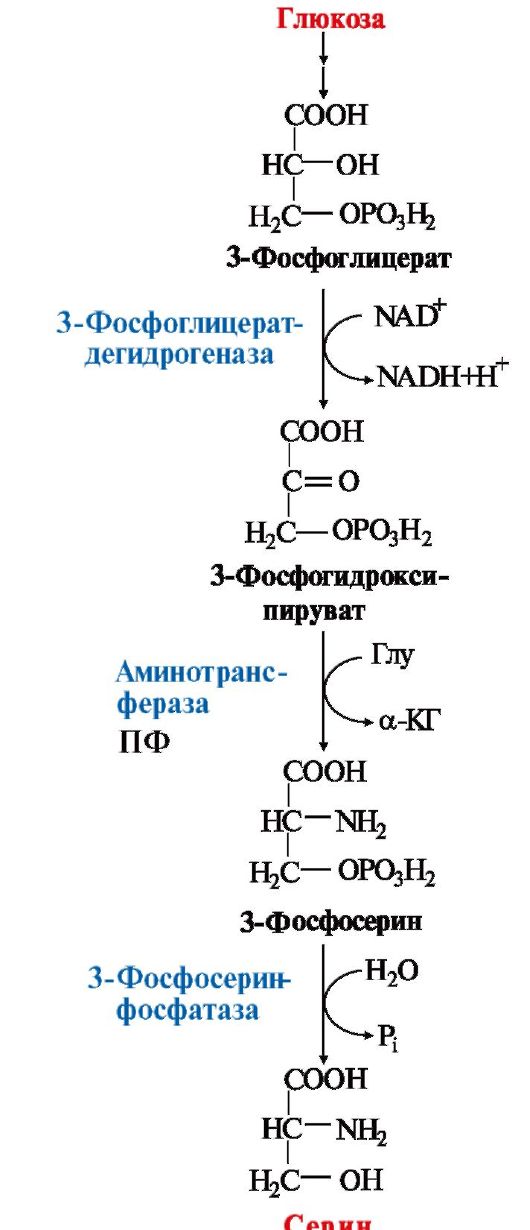 Ориз. 9.17. Синтез на серин от глюкоза
Ориз. 9.17. Синтез на серин от глюкоза
 Ориз. 9.18. Биологична роляедновъглеродни групи
Ориз. 9.18. Биологична роляедновъглеродни групи
Ориз. 9.19. Схема на синтеза на Н4-фолат в черния дроб
4. Фолиева киселинае витамин за хората и повечето бозайници (витамин В Сили В 9).Той е широко разпространен в храните и се синтезира от чревни бактерии. Хиповитаминозасе среща рядко при хора. Причините за това могат да бъдат:
Неправилно хранене - недостатъчна консумация на зеленчуци, плодове и месни продукти;
Нарушаване на абсорбцията на фолиева киселина в червата;
Хепатит, цироза и други увреждания на черния дроб, което води до намаляване на активността на фолиевата редуктаза.
Хиповитаминозата на фолиева киселина води до нарушен синтез нуклеинова киселинав тялото, което засяга предимно бързо делящите се кръвни клетки и развитието мегалобластна анемия.
5. Много патогенни микроорганизми са в състояние да синтезират фолиева киселина от парааминобензоена киселина, която е съставна част на фолиевата киселина. Въз основа на това бактериостатично действие на сулфаниламидни лекарства,които са структурни аналози на n-аминобензоена киселина:
Лекарствата са конкурентни инхибитори на ензимите за синтез на фолиева киселина в бактериите или могат да се използват като псевдосубстрати, в резултат на което се образува съединение, което не изпълнява функцията на фолиева киселина.Това прави невъзможно деленето на клетките, бактериите спират да се размножават и умират. Сулфонамидите се наричат антивитамини.
Въведение
2. ПРОИЗВОДИТЕЛИ НА аминокиселини.
3. БИОСИНТЕЗА НА АМИНОКИСЕЛИНИ.
3.1 Едноетапен метод за получаване на аминокиселини.
3.2 Двуетапен метод за получаване на аминокиселини.
3.3 Получаване на лизин.
3.4 Получаване на аминокиселини с помощта на имобилизирани ензими и клетки.
3.5 Технология за получаване на глутамат.
4. ИНДУСТРИАЛЕН СИНТЕЗ НА АМИНОКИСЕЛИНИ.
4.1 Микробиологичен синтез.
4.2 Химичен синтез.
5. ПРИЛОЖЕНИЕ НА АМИНОКИСЕЛИНИ. Заключение.
Списък на използваните източници.
Въведение
Настоящото ниво на развитие на биотехнологиите се дължи на общия напредък на науката и технологиите, особено през последните 50 години. Достатъчно е да се отбележат само такива събития като установяването на структурата и функциите на нуклеиновите киселини, откриването на ДНК рестрикционни ензими и идентифицирането на тяхното значение в клетъчния живот с последващото им използване в генното инженерство, създаването на хибридоми и производството на моноклонални антитела, въвеждането на компютри и компютърни технологии в биотехнологичните процеси.
Индустриалният биосинтез на аминокиселини принадлежи към микробиотехнологията. По същество микробиотехнологията е идентична с индустриалната (техническа) микробиология. Негов обект са микроби - вируси (включително вироиди и фаги), бактерии, гъбички, лишеи, протозои. В някои случаи биологичните обекти са първични метаболити от микробен произход - ензими, чиято каталитична активност е в основата на инженерната ензимология.
В сравнение с растителните и животинските клетки, микробите обикновено се размножават по-бързо и следователно всички метаболитни (обменни) процеси протичат по-бързо в тях. Относителните предимства на повечето микроби като биологични обекти са както следва:
1) голяма "простота" на организацията на генома,
2) сравнително лесна адаптивност (лабилност) към околната среда в естествени и изкуствени условия,
3) изразени скорости на ензимни реакции и растеж на клетъчна маса за единица време.
Първото предимство предоставя на микробните клетки по-добри възможности за измерване и пренареждане. наследствен материал, например, включването на извънземна генетична информация в нея, въвеждането в клетките или, напротив, елиминирането на плазмиди от тях.
Второто предимство, свързано с лабилността на микробите, може да се илюстрира с примера на бактерии и гъбички. И така, по отношение на температурата, микробите са разделени на психофили в мезофили и термофили.
1. ХАРАКТЕРИСТИКА НА АМИНОКИСЕЛИНИТЕ.
Аминокиселините играят голяма роля в здравеопазването, животновъдството и леката промишленост. Според значението им за макроорганизма аминокиселините се делят на взаимозаменяеми и незаменими. Незаменими аминокиселини са тези, които не могат да бъдат синтезирани от животни или човешкото тяло, те трябва да се въвеждат с храна или храна за животни (Таблица 1).
маса 1
Сменяеми и незаменими аминокиселини.
Несъществените вещества се синтезират in vivo от амоняк и различни източници на въглерод. Самите микроорганизми синтезират всички необходими им аминокиселини от амоняк и нитрати, а въглеродните „скелети“ от съответните междинни продукти.
Въз основа на оценката на аминокиселините учените отдавна се стремят да използват способността на микроорганизмите да произвеждат есенциални и несъществени аминокиселини в осезаеми количества.
Нуждата на хората от аминокиселини е доста голяма и това определя нивото на тяхното производство в света (около 500 хиляди тона годишно).
Повечето микроорганизми и зелени растения са в състояние да синтезират всичките двадесет аминокиселини denovo. Въглеродните скелети на аминокиселините се образуват от междинни метаболитни продукти.
Изходният материал за синтеза на аминокиселини са прости междинни продукти на катаболизма (пируват, 2-хидроксиглутарат, оксалоацетат и фумарат, еригрозо-4-фосфат, рибоза-5-фосфат и АТФ). В синтеза на повечето аминокиселини аминогрупата се въвежда едва в последния етап чрез трансаминиране. Някои аминокиселини се образуват в резултат на поредица от трансформации на други аминокиселини и в тези случаи не се изисква трансаминиране.
Протеините се синтезират върху рибозоми от аминокиселини според m-RNA информация, която се пренаписва (чрез транскрипция) от ДНК гени.
2. ПРОИЗВОДИТЕЛИ НА аминокиселини
В бактериите са широко разпространени специфични ензими, които регулират биосинтезата на аминокиселини; те са изследвани до известна степен в Escherichia coli. Salmonellatyphimurium, Bacillus subtilis и др. При гъбичките, при ограничаване на аминокиселините, има некоординирано, паралелно повишаване на нивото на ензимите, които катализират реакциите на биосинтеза на различни аминокиселини. Този "общ контрол на биосинтеза на аминокиселини" се нарича още "метаболитен интерблок" или "регулация на кръстосани пътища", идентифициран за първи път в Neurosporacrassa през 1965 г. от M. Karsiotis и сътрудници, а по-късно в Saccharomyces cerevisiae, Aspergillusnidulas и други гъби.
Feedak играе важна роля в хиперпродукцията на определени аминокиселини от култури на Escherichiacoli, Serratiamarcescens и други - репресия, например, в биосинтеза на ароматни аминокиселини в последните етапи.
Във всеки жив организъм аминокиселините се консумират предимно за биосинтеза на първични металити - ензимни и неензимни протеини. Следователно, в допълнение към биосинтеза на аминокиселини denovo, е възможен и друг начин за получаването им, а именно от хидролизати на съответните протеини (триптофанът се разрушава по време на киселинната хидролиза), включително от нативната биомаса на микробните клетки.
Естествените аминокиселини по правило са оптически активни L - и D - форми, които трудно се отделят. Ето защо микробният синтез с помощта на коринебактерии и някои други микроби сега е основен и икономически изгоден. Първото място тук с право се заема от Япония, където се произвеждат само над 100 хиляди тона глутаминова киселина годишно; Повечето от естествените незаменими аминокиселини се произвеждат от Takeda. С. Киношита, който за първи път през 50-те години открива и доказва обещанието за микробен синтез, още през 1963 г. признава: „Няма съмнение, че не е далеч времето, когато ще бъде възможно да се произвеждат всички известни аминокиселини с с помощта на микроорганизми." Това време вече дойде към 70-те години. Получени са микроби – суперпродуценти от родовете Brevibacterium, Corynebacterium, Micrococcus и други, с помощта на които се овладя мащабно производство не само на глутамат, но и на L – лизин, L – валин, L – хистидин и др. При суперпродукция нивото на експресия на клонирания ген се изразява в синтеза на специфичен протеин в количество от 2% от всички разтворими протеини на клетката гостоприемник. В момента има производители, при които количеството на синтезирания специфичен протеин достига 10-15% (тук най-важна роля играят плазмидите с множество копия, носещи вградени гени). Методите на генното инженерство във Всеруския изследователски институт по генетика и развъждане на индустриални микроорганизми (Москва) произвеждат щам Escherichiacoli със свръхпроизводство на L-треонин (30 g/l за 40 часа ферментация).
С всеки щам - производител на всяка аминокиселина, е необходимо внимателно и внимателно боравене, за да се поддържа в активно състояние за дълго време.
Получават се щам Escherichiacoli, произвеждащ 27 g/l L-пролин за 48 часа и щам, произвеждащ до 22,4 g/l L-фениланин.
С Corynebacterium sp. можете да получите алкално-съдържаща среда L - тирозин (до 19 g / l); използване на Corynebacteriumglutamicum върху глюкозна среда - L - валин (до 11 g / l; L - аргинин, L - хистидин, L - изолевцин - 15 - 20,8 g / l.
3. БИОСИНТЕЗА НА АМИНОКИСЕЛИНИ
Технологията за получаване на аминокиселини се основава на принципите на ферментация на продуцентите и изолирането на вторични метаболити, тоест майчината култура се размножава първо върху агарова среда в епруветки, след това върху течна средав колби, инокулатори и устройства за сеитба, а след това в главните (основните) ферментатори. Обработката на културални течности и изолирането на аминокиселини се извършва по схема, подобна на схемата за получаване на антибиотици. Изолираните чисти кристали от желания продукт обикновено се сушат под вакуум и се пакетират.
3.1 Едноетапен метод за получаване на аминокиселини
Има два начина за получаване на аминокиселини: едноетапен и двуетапен. Съгласно първия метод, например, мутантен полиауксотрофен щам - производител на аминокиселини се култивира върху оптимална среда за биосинтеза. Целевият продукт се натрупва в културалната течност, от която се изолира съгласно схемата на фигура d
1 - ферментатор,
2 - охладител, 3.9 - хладилници,
4 - контейнер за предварителна обработка,
5 - центрофуга,
6 - вакуум - изпарител,
7 - прав апарат
8 - барабанен филтър, A, B - пътища (ако е необходимо, блокиране),
10 - апарат за ултрафилация,
11 - контейнер за съхранение на ензимния разтвор,
12 - мембранен филтър,
13 - акумулатор на течен консервант, 14 - контейнер за ензимно утаяване,
15 - филтър - преса,
16 - спрей сушилня,
17 - акумулатор на сух концентрат.
Фигура No 1 Приблизителна технологична схема за получаване на аминокиселини.
3.2 Двуетапен метод за получаване на аминокиселини
При двуетапния метод микробът-продуцент се култивира в среда, където се получава и синтезира всички необходими съставки за последващия синтез (в идиофаза) на целевия продукт.
Ако ензимите на биосинтеза на аминокиселини се натрупват вътреклетъчно, но след 1-ва стъпка клетките се отделят, разпадат и се използват клетъчен сок. В други случаи клетките се използват директно за целите на биосинтеза на целеви продукти.
3.3 Получаване на лизин
Ако аминокиселината е предоставена като добавка към фуража, тогава биотехнологичният процес на фуражния продукт включва следните етапи: ферментация, стабилизиране на аминокиселината в културалната течност преди изпаряване, вакуумно изпаряване, стандартизиране на отстранения разтвор, когато добавя се пълнител, сушене и опаковане на готовия продукт, който трябва да съдържа повече от 10% от основното вещество. Например, в промишлеността, сухи фуражни и течни фуражни концентрати на лизин се произвеждат заедно с кристален лизин (фиг. 2).
Фигура №2
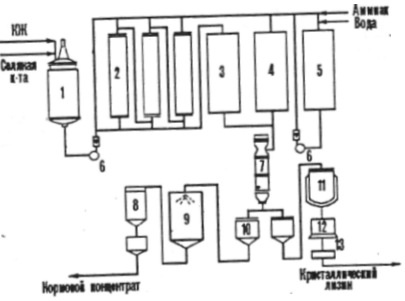
1 - контейнер за културална течност (QL),
2 - йонообменни колони,
3 - колекция от злуат,
4 - събиране на филтрат,
5 - контейнер за елуата,
7 - вакуум - изпарител,
8 - циклон,
9 - сушилня за фуражни концентрати,
10 - колекция,
11 - реактор - кристализатор,
12 - центрофуга,
13 - сушилня.
Ако концентратът съдържа 70 - 80% сухо вещество, то той е достатъчно устойчив на микробно разваляне поради повишената осмотична концентрация на съставките.
3.4 Получаване на аминокиселини с помощта на имобилизирани ензими и клетки
Икономически изпълними са методите за получаване на аминокиселини с помощта на имобилизирани ензими и клетки. Преди сравнително дълго време процесът на получаване на L - аспарагинова киселина от фумарова и амоняк в един етап се осъществява с помощта на имобилизирани клетки на E. coli или Pseudomonasaeruginosa, която има аспартазна активност (виж диаграмата)
Аспартазата катализира добавянето на амоняк към фумарова киселина. Ензимът в имобилизирано състояние остава активен на първоначалното ниво за 2-2,5 седмици или повече.
L - аспарагинова киселина може да се получи и с помощта на имобилизирани клетки, което значително увеличава продължителността на системата, чиято производителност за целевия продукт е около 2000 kg на 1 m от реактора. Периодичната ферментация се използва за получаване на други L - аминокиселини (глутаминова, фенилаланин, лизин, триптофан и др.). В този случай обикновено се култивират специални мутантни щамове, чийто метаболизъм за целевия продукт е проучен доста пълно. Така например беше установено, че ограничаващият агент на коринебактериите, които образуват глутаминова киселина, е биотип в доза от 1–5 μg/L. Биотинът предизвиква структурни и функционални промени в клетъчната мембрана, като по този начин увеличава пропускливостта му за глутаминова киселина, напускаща клетката в културалната течност. Отделни щамове на производители са способни да натрупват повече от 50 g/l върху меласа среда.
Подобна е ролята на биотина и в случай на получаване на пролин, който е производно на глутаминовата киселина.
Простотата на тази технология и нейните предимства в сравнение с дълбоката ферментация ясно илюстрират опита на японската компания Tanabe Seiyaku. През 1973 г. тази компания разработи метод за получаване на аспарагинова киселина с помощта на имобилизирана бактериални клеткис аспартазна активност. Аспартазата катализира добавянето на амоняк към двойната връзка на фумарова киселина, т.е. аспарагинова киселина се образува на един етап и този биотехнологичен процес може да се класифицира като биотрансформация органични съединения. Ензимът, имобилизиран в гела, функционира добре, продължителността на неговото полуинактивиране е 1 месец. След това клетките производители се имобилизират в гела, като допълнително се стабилизират чрез химическо свързване една с друга и с гела. Продължителността на клетъчното полуинактивиране в този случай се увеличава до 4 месеца. Следователно технологията на биотрансформация на фумарова киселина може да бъде представена в следната последователност:
култивиране на клетки чрез дълбока ферментация и тяхното изолиране чрез центрофугиране;
имобилизиране на клетки биокатализатор в гел под формата на 2-3 mm гранули;
биотрансформация на амониев фумарат в колона с катализатор в проточен режим и получаване на разтвор на аспарагинова киселина;
кристализация, центрофугиране и промиване на кристали.
Производителността на системата за биотрансформация на аспарагинова киселина 1 m биореактор е 1700 кг.
3.5. Технология за производство на глутамат.
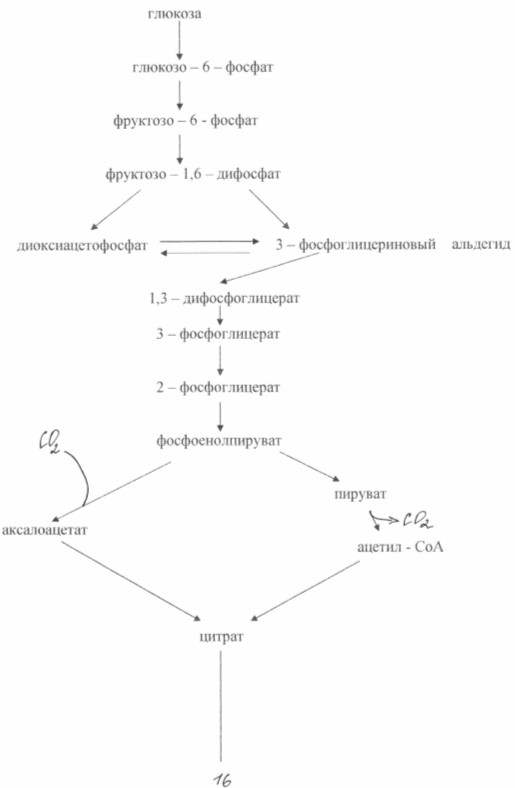
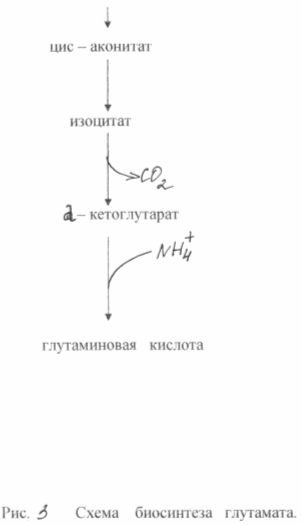
Свръхсинтезът на глутаминова киселина от глюкоза в тези бактерии се основава на два биохимични принципа: липса на ензима а-кетоглутарат дехидрогеназа и блокиране на биосинтеза на биотин. Неспособността на клетките да синтезират биотин води до увеличаване на пропускливостта на цитоплазмената мембрана, което увеличава екскрецията на глутамат. Образува се в резултат на аминирането на а-кетоглутарат, който не е способен на по-нататъшни трансформации в цикъла на трикарбоксилната киселина. Схема за биосинтеза на глутамат от глюкоза в от този типмутанти е показано на фиг. 3
По време на биосинтеза на глутаминова киселина, голямо значениеима концентрация на биотин в средата. Необходимо е да се осигури неговата концентрация от 1 - 5 mcg / l. В този случай нормалният синтез на мембранни фосфолипиди се нарушава и последните стават пропускливи за глутамат. При концентрация на биотин 15 μg/l се наблюдава интензивен растеж на биомасата. Пропускливостта на цитоплазмената мембрана за глутамат може също да бъде намалена чрез добавяне на пеницилин към средата по време на логаритмичната фаза на растеж. В този случай фосфолипидите се извличат от мембраната и глутаматният транспорт може да се осъществи в рамките на 40 - 50 часа. Бактериалният синтез на глутамат позволява да се получи приблизително 50% добив на продукта от захар и да се натрупат до 200 g/l глутамат във ферментационната среда. Известни методи за получаване на глутамат в етанолова среда (до 60 g/l) или ацетат (до 98 g/l).
4. ИНДУСТРИАЛЕН СИНТЕЗ НА АМИНОКИСЕЛИНИ
Промишленото производство на аминокиселини се извършва по два начина: микробиологичен и химичен.
4.1 Микробиологичен синтез
Микробиологичният синтез се основава на култивирането на определени видове микроорганизми върху хранителни среди с подходящ източник на въглерод. Най-често това са захари, съдържащи се например в меласата. Мутирали микроорганизми с нарушен азотен метаболизъм освобождават голямо количество от всяка една аминокиселина в разтвора. След края на процеса на ферментация аминокиселината се изолира от разтвора чрез химични методи.
Чрез микробиологична ферментация се получават по-голямата част от глутаминова киселина и целия лизин. Този процес има своите предимства и недостатъци. От една страна, той има няколко етапа и изисква сравнително просто и гъвкаво оборудване. От друга страна, живите микроорганизми, с които трябва да се работи, са много чувствителни към най-малката промяна в условията, а концентрацията на целевия продукт е ниска, което води до увеличаване на размера на апарата.
Съществува метод за микробиологично производство на фенилаланин, като се използва мутантът с дефицит на тирозин и метионин Brevibacteriumlactofermentum. В процес на периодична ферментация се постига концентрация на продукта от 24,8 g/l. Въпреки това, за този процесса необходими сложни и скъпи среди. От особен интерес представлява биосинтезата на фенилаланин от ауксотрофния мутант на E. coli, който може да се култивира в среда с глюкоза с фосфати. Процесът на ферментация се извършва по метода на топинг с рециркулация на биомаса. Биомасата в реактора на 60-ия час достига 45 – 50 g/l, а концентрацията на фенилаланин – 22,4 – 22,8 g/l. Производителност на системата 0,72-0,86 g/(lh); добив на продукт 0.11g.
4.2 Химичен синтез
Химическият синтез е по-гъвкав от микробиологичния синтез и прави възможно получаването на съединения с всякаква възможна структура. Тук се използват нехранителни минерални суровини, постига се всякаква концентрация на продукта, но като правило процесът е многоетапен и изисква по-сложно оборудване.
И двата метода осигуряват естествени аминокиселини с необходимата степен на химическа и оптична чистота. Така че в крайна сметка, когато става въпрос за индустриално производство, икономиката има последната дума: според чуждестранни експерти, с голям мащаб химични методистават по-рентабилни.
Най-широко разработеният промишлен синтез на метионин е аминокиселина, чийто основен потребител е птицевъдството. Изходният материал е пропилен, продукт на крекинг на масло. Пропиленът се окислява до акролеин, който в резултат на поредица от реакции се превръща в рацемичен метионин.

В резултат на химичния синтез обикновено се получава смес от равни количества L и D изомери на аминокиселини, докато протеините съдържат изключително L-изомери. Същите тези изомери са хранителни. D-изомерите обикновено не се абсорбират от тялото и са баласт. Следователно е необходимо отделяне, което неминуемо се отразява негативно на икономиката. Напоследък беше постигнат значителен напредък в областта на разцепването на рацемични смеси от аминокиселини. В произведенията на СВ. Рогожин и В.А. Даванков, беше показано, че оптически неактивните аминокиселини, като са ковалентно прикрепени към неразтворим полимерен носител, лесно образуват комплекси с мед, никел и др. друга рацемична аминокиселина в разтвор заема две свободни координационни места при металния атом и силата на комплексите от L - и D - изомери е различна. Колкото и малка да е тази разлика, която се повтаря многократно в процеса на хроматография, тя осигурява пълно или частично разделяне на оптичните антиподи. Най-добри резултати се получават с DL - пролин, който може да бъде предварително разделен на оптични изомери.
Усилията на много изследователи са насочени и към разработването на такъв химичен синтез, който да даде само един желан естествен оптически активен изомер - изомерът, синтезиран от живата природа - асиметричен синтез. В тази посока за последните годиние постигнат значителен напредък. В работите на А. Каган (Франция) и Е. Корн (САЩ) са постигнати почти количествени оптични добиви. Изключително изкушаващо е да се възпроизведат пътищата за синтез на аминокиселини от естествените ензимни системи. Голям бройтакива синтези се извършват от пироксал-зависими ензими и веднага се получава желаният оптичен изомер на аминокиселината. Голям принос за изследването на тези процеси има академик A.E. Браунщайн (Русия) и професор Ю. Снел (САЩ).
Руските учени си поставят за цел да намерят химични системи, които не само да симулират биохимични реакции, но и да осъществяват процеси, които не протичат в живия организъм. Като такава система са избрани комплекси от бази на Шиф от аминокиселини с йони на преходни метали. Предполагаше се, че салицилалдехидът в тези комплекси ще играе ролята на лиридоксал, повишавайки реактивността на CH връзката на аминокиселината, металният йон ще направи същото, но все пак ще поддържа системата в твърдо плоско състояние, което в природата осигурява ензимния протеин. Общата дисиметрия на комплекса ни позволи да се надяваме, че в природата протеинът на ензима осигурява. Цялостната дисиметрия на комплекса ни позволи да се надяваме, че реакцията може да се проведе стереоспецифично, т.е. което води до оптически активна киселина.
Такива реакции не се срещат в природата и тяхната практическа стойност се крие във факта, че в този случай незабавно се получава глутаминова киселина. Така се отваря пътят за нов общ синтез на аминокиселини, който протича при екстремни условия.
Несравнимо по-трудно е да се възпроизведе другата страна на действието на естествените ензими – асиметричния синтез. За това комплексите бяха разделени на оптически активни антиподи.

5. ИЗПОЛЗВАНЕ НА АМИНОКИСЕЛИНИ
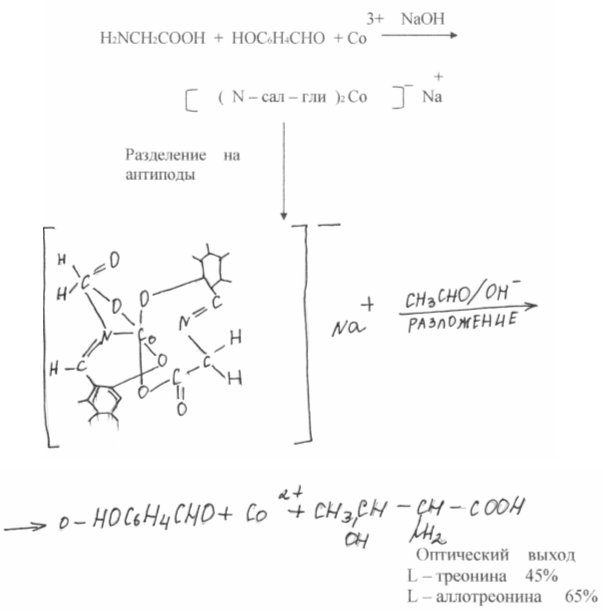
Протеините на всички организми от вируси до хора се състоят от 21 аминокиселини, които според тяхната биологична стойност се делят на неесенциални (тялото може да ги синтезира с достатъчна скорост за изграждане на протеини) и незаменими (не може да ги синтезира и трябва да ги получава отвън от храна). Всеки протеин съдържа определено количество от всяка аминокиселина. Ако в консумирания протеин на която и да е есенциална аминокиселина няма или е малко, протеинът на тялото няма да бъде изграден. Оттук и необходимостта от балансиране на диетата, което води до повишаване на хранителната им стойност.
На фигура (4) казеинът, хранителен животински протеин, се приема като етанол. Защрихованата част на всяка колона съответства на хранителната стойност на естествения протеин по отношение на PEF (коефициент на протеинова ефективност). Добавянето на определено количество лизин, първата ограничаваща аминокиселина, към продукта води до рязко повишаване на хранителната стойност, добавянето на втората ограничаваща аминокиселина повишава хранителната стойност до нивото на животинските протеини.
Ориз. 4 Увеличаване на хранителната стойност на протеина чрез добавяне на ограничаващи аминокиселини в CEB единици
Диетичното балансиране се използва широко в селско стопанство. Според М.Ф. Томе, И.Ф. Ткачев, включването на 0,2 - 0,5% лизин в диетата на прасенца и пилета може да намали консумацията на фуражни протеини с 25% и да увеличи продуктивността на животните с 10-13%. Обобщавайки резултатите от проучвания както на руски, така и на чуждестранни автори, получаваме, че при организиране на производството на 20 хиляди тона лизин годишно можете да получите допълнителни 1,2 милиона тона месо и да спестите 3,6 милиона тона протеинова храна. Според холандския икономист Н. Маргудер 0,125% лизин във фуражите за прасета, състоящи се от царевично брашно и фъстъци, дава чиста печалба от 100%.
Балансирането на зърнени продукти с чисти аминокиселини все още не е намерило широко приложение в хранително-вкусовата промишленост, въпреки че подобрява хранителните свойства на растителния протеин и следователно увеличава количеството протеин, използваем в храната. Последното е особено важно, тъй като има реална възможност за задоволяване на бързо нарастващото търсене на хранителни протеини без едновременни промени в естеството на диетите и органолептичните свойства на продуктите.Аминокиселините се използват не по-малко успешно в медицината. След тежки операции, изгаряния и др. човешкото тяло много често не може да усвои протеин в количеството, необходимо за процесите на регенерация, и това води до влошаване на състоянието на пациента. След това прибягвайте до хранене с аминокиселини. Отличният терапевтичен ефект, постигнат в тези случаи, предизвиква голяма нужда от смеси от аминокиселини. Със смес, която не съдържа фенилаланин, се хранят деца, страдащи от фенилпирувинова олигофрения.
Аминокиселините служат като изходни материали за синтеза на полипептиди, много от които са най-силните физиологично активни съединения, както и за създаването на други лекарства.
И накрая, в процеса на поликондензация, аминокиселините образуват полимери, които, макар и да не притежават биологичната активност на протеините, са подобни на тях по своята структура и ограничават някои от техните важни физични свойства. Изкуствената вълна, коприна и кожа, получени с участието на аминокиселини по отношение на производителността, не са по-ниски от естествените материали.
Въпреки широкото използване на аминокиселини в медицината, индустрията и селското стопанство, хранително-вкусовата промишленост остава техен основен потребител. И така, мононатриевият глутамат (натриевата сол на глутаминовата киселина) е мощен подобрител на вкуса. В много страни се добавя към всички продукти по време на консервиране, замразяване и дългосрочно съхранение; намира приложение както в общественото хранене, така и в домакинството под формата на смес с готварска сол. Състави, имитиращи вкуса и мириса на хранителни продукти, също са направени от смес от аминокиселини.
Потреблението на аминокиселини в света се увеличава всяка година с 10%. Тяхното производство се характеризира със следните цифри
Заключение
Това курсова работае посветен на индустриалния биосинтез на аминокиселини. Благодарение на тази работа разбрах, че има следните начини за получаване на аминокиселини:
1. Биосинтеза на аминокиселини, която включва едноетапни и двуетапни методи;
2. Индустриален синтез на аминокиселини – микробиологичен и химичен синтез.
Разгледахме производството на аминокиселини с помощта на имобилизирани ензими и клетки, както и технологията за производство на лизин и глутамат.
Установено е използването на аминокиселини не само в медицината, но и в селското стопанство, за да се намали консумацията на фуражни протеини; и в хранително-вкусовата промишленост като консерванти и подобрители на вкуса
Списък на използваните източници
1. Е.А. Строев. Биологична химия. М., висше училище, 1986.
2. М.Е. Бекер, Г.К. Лиепинин, Е.П. Райпулис. Биотехнология. М., ВО Агропромиздат, 1990г.
3. U.E. Viestur, I.A. Шмите, А.В. Жилевич. Биотехнология. Биотехнологични агенти, технология, оборудване. Рига, Зинатне, 1987 г.
4. Г.К. Лиепинин, М.Е. Dongce. Суровини и хранителни субстрати за промишлена биотехнология. Рига, Зинатне, 1986 г.
5. Н.П. Блинов. Основи на биотехнологиите. СПБ., Наука, 1995.
6. Л.И. Воробьов. Индустриална микробиология. Москва, Московски държавен университет, 1989 г.
7. S.D. Варфоломеев, С.В. Калюжни. Биотехнология. Кинетични основимикробиологични процеси. М., Висше училище, 1990г.
8. В.М. Беликов. Аминокиселини, техният химичен синтез и приложение. Вестн. Академия на науките на СССР, 1973 г.
9. Дж. Бейли, Д. Олис. Основи на биохимичното инженерство, т. 1. М „ Мир, 1989.
10. G.S. Муровцев, Р.Г. Бутенко, Т.Н. Тихоненко, М.И. Прокофиев. Основи на селскостопанската биотехнология. М., ВО Агропромиздат, 1990г.
11. Биотехнология: принципи и приложения. Изд. И. Хигинс, Д. Бест, Дж. Джоунс. М., Мир, 1988.
Практическата значимост на темата.Аминокиселините, които влизат в тялото с храната, могат да бъдат източници на въглеродни и азотни атоми за различни непротеинови съединения. По-специално, аминокиселините могат да влязат в реакции на взаимно преобразуване, което осигурява нуждите на организма от неесенциални аминокиселини, независимо от приема им отвън. Сред физиологично важните продукти, образувани от аминокиселини, са хем, креатин, холин, пуринови и пиримидинови нуклеотиди, някои хормони и невротрансмитери. Познаването на тези метаболитни пътища е важно за разбиране на патогенезата на някои хиповитаминози и вродени ферментопатии, разработване на методи за тяхната биохимична диагностика и корекция.
Целта на урока.След изучаване на тази тема студентът трябва да познава основните реакции на синтеза на неесенциални аминокиселини в човешкото тяло, начините за използване на аминокиселини за синтеза на непротеинови азотни съединения и възможните нарушения на тези процеси, да може да прилагат получените знания за решаване на теоретични и практически задачи.
Първоначално ниво на знания.
Структурата на аминокиселините (глицин, серин, метионин, цистеин, фенилаланин, тирозин).
Трансферни реакции на функционални групи в биологични системи.
Редукционно аминиране на α-кето киселини: ензими, роля в организма.
Трансаминиране на аминокиселини: реакции, роля в организма.
Коензимни функции на витамините (фолиева киселина, цианокобаламин).
Принципи на диагностика на вродени ензимни дефекти.
3.1. Биосинтеза на аминокиселини в тъканите.
3.1.1. В човешкото тяло е възможен синтеза на неесенциални аминокиселини, които включват: аланин, аргинин, аспартат, хистидин, глицин, глутамат, глутамин, пролин, серин, тирозин, цистеин. Липсата на някоя от тези аминокиселини в храната няма да бъде придружена от нейния дефицит в организма. Основните начини за образуване на неесенциални аминокиселини са: 1) трансаминиране на α-кето киселини, 2) редуктивно аминиране на α-кето киселини, 3) синтез с участието на незаменими аминокиселини.
3.1.2. трансаминиране(вижте тема 2). Източниците на въглеродни атоми в тези реакции са метаболитите на гликолизата и цикъла на Кребс, източниците на азотни атоми са други аминокиселини, най-често глутамат (виж Фигура 7).
3.1.3. Редукционно аминиране(вижте тема 2). Източникът на азотния атом на аминогрупата е амонячна молекула, източникът на въглерод са α-кето киселини, най-често α-кетоглутарат (виж фигура 3.1).
Фигура 3.1.Биосинтез на неесенциални аминокиселини в тъкани с помощта на въглеродния скелет на глюкоза (една звездичка показва реакции на трансаминиране, две - редуктивно аминиране).
3.1.4. Синтез, включващ незаменими аминокиселини.Несъществената аминокиселина тирозин може да се образува от несъществената аминокиселина фенилаланин:
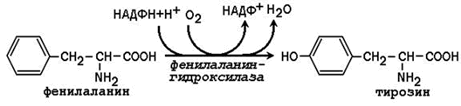
Фенилаланин хидроксилазата е типична цитохром Р 450-зависима хидроксилаза със смесена функция: единият кислороден атом е включен във водата, а другият в хидроксилната група на тирозина. Редуциращият агент е кофактор тетрахидробиоптерин, който се поддържа в редуцирано състояние от NADPH-зависимия ензим дихидробиоптерин редуктаза.
Неесенциалната аминокиселина цистеин се синтезира с участието на есенциалната аминокиселина метионин, която се използва като източник на серен атом. След даряването на метиловата група в реакциите на трансметилиране, метионинът се превръща в хомоцистеин. Когато взаимодейства с несъществената аминокиселина серин, се образува цистатионин:
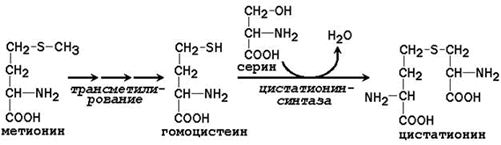
Цистатионинът претърпява разцепване за образуване на цистеин и хомозерин, които се подлагат на деаминиране до α-кетобутират:
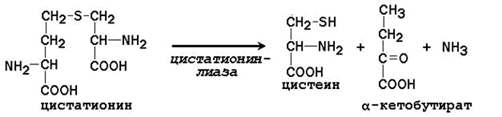
По този начин фенилаланинът и метионинът, доставени с храната, частично се използват за синтеза на неесенциални аминокиселини. Следователно дневната нужда от фенилаланин и метионин може да бъде значително намалена с приема на допълнителни количества съответно тирозин и цистеин.
