При постоянна температура обемът, зает от газ, е обратно пропорционален на неговото налягане.
Робърт Бойл - ярък примерджентълмен учен, син на една отминала епоха, когато науката е била владение на изключително богати хора, които са посвещавали свободното си време на нея. Повечето от изследванията на Бойл се отнасят до съвременна класификациякъм категорията химически опити, въпреки че той вероятно смяташе себе си натурфилософ(теоретичен физик) и натуралист(физик експериментатор). Очевидно той се е заинтересувал от поведението на газовете, след като е видял дизайна на една от първите в света въздушни помпи. След като проектира и конструира друга, подобрена версия на своята двустранна въздушно-вакуумна помпа, той решава да проучи как повишеното и намаленото налягане на газа в запечатан съд, към който е свързан новият му апарат, влияе върху свойствата на газовете. Като надарен експериментатор, Бойл в същото време се придържа към много нови и необичайни възгледи за онази епоха, вярвайки, че науката трябва да идва от емпирични наблюдения, а не да се основава единствено на спекулативни и философски конструкции.
Във формулировката на Бойл законът буквално звучи така: „Под въздействието на външна сила газът е еластично компресиран, а в отсъствието му се разширява, докато линейното компресиране или разширение е пропорционално на еластичната сила на газа.“ Представете си, че стискате надут балон. Тъй като има достатъчно свободно пространство между молекулите на въздуха, можете лесно, като приложите сила и извършите известна работа, да компресирате топката, намалявайки обема на газа вътре в нея. Това е една от основните разлики между газ и течност. В зрънце течна вода, например, молекулите са опаковани плътно една до друга, сякаш зърното е пълно с микроскопични пелети. Следователно, за разлика от въздуха, водата не се поддава на еластична компресия. (Ако не ми вярвате, опитайте да пъхнете плътно прилепнала тапа в гърлото на бутилка, пълна с вода до тапата.) Законът на Бойл-Мариот, заедно със закона на Чарлз, формират основата на уравнението на състоянието на идеален газ.
J. Trefil го нарича "закон на Бойл", но ние предпочетохме това, което беше прието Руска традицияиме на закона. — Забележка преводач.
Вижте също:
Робърт Бойл, 1627-91
Англо-ирландски физик и химик. Роден в замъка Лисмор, Ирландия, ставайки четиринадесетото дете на граф Корк, известен авантюрист от ерата на кралица Елизабет. След като завършва привилегированото Итънско училище, където е един от първите ученици сред „младите господа“, той тръгва на дългогодишно пътешествие из континентална Европа, по време на което продължава образованието си в Женевския университет. Връщайки се в родината си през 1648 г., той оборудва частна лаборатория и започва физични и химични изследвания на нейна база. През 1658 г. той се премества в Оксфорд, където Робърт Хук става негов ученик и лаборант. cm.Законът на Хук), бъдещ научен секретар на Кралското общество. Между другото, Бойл беше един от основателите и съоснователите на Кралското общество, което израсна от кръг от млади оксфордски учени. Проведени редица иновативни химически опити, включително експерименти за подробно изследване на свойствата на киселините и основите. Според някои сведения той е първият, който излага хипотеза за съществуването на химични елементи. Доказано е, че въздухът е необходим за изгаряне и дишане. В допълнение към изучаването на науката, той е съосновател и акционер на Източноиндийската компания и активно участва в мисионерска дейност с надеждата да обърне жителите на източните колонии на Британската империя към християнството.
) Други източници: MESBE
Законът на Бойл-Мариот , свързващ промените в обема на газа при постоянна температура с промените в неговата еластичност. Този закон, открит през 1660г от физика Бойл и по-късно, но независимо от него от Мариот във Франция, в своята простота и сигурност той заема много важно място в науката, въпреки че по-късните изследвания показват наличието на отклонения от него и че законът действително се прилага за така наречения идеален газ. Историята на откриването му е много поучителна. Франциск Линус, професор по математика в Лютих (1595-1675), не признава, че въздухът, толкова подвижна и лека субстанция, може да поддържа колона живак в барометрична тръба, въпреки че ученикът на Галилей Еванджелиста Торичели (1608-1647) несъмнено доказва че причината за това явление е атмосферното налягане. Дотогава всички предполагаха, че природата се отвращава от вакуум (horror vacui) и затова живакът, водата и всякакви течности се втурват в празните тръби. Когато се оказа, че водата в тръбата следва буталото на помпата само до височина малко повече от 30 фута, Галилео реши, че страхът от празнотата има граница. Лин обясни, че живакът се задържа в тръбата от невидими нишки (funiculus) и че той самият усеща тези нишки, когато затваря горния отвор на тръбата с пръста си, който след това се пълни с живак и обръща долния край в чаша с живак; в този случай живакът в достатъчно дълга тръба падна, но спря на определена височина. Тази интерпретация на опита на Торичели от Лийн подтиква Бойл да направи няколко нови експеримента, които той описва в своята „Защита на доктрината, засягаща пружината и тежестта на въздуха“ (Лондон, 1662 г.). За да докаже, че въздухът има способността да се съпротивлява, Бойл взема сифонообразна тръба, запечатана в късия край (фиг. 1). Когато живакът беше излят в дълъг лакът, той компресира въздуха, съдържащ се в късия лакът, толкова по-значително, колкото повече живак се изля в другия. Когато живакът в късия лакът достигне ниво AB, в дългия е на ниво CD, което означава, че еластичността на сгъстения въздух е такава, че може да поддържа налягане на живачен стълб с височина от AB до CD. И тъй като тази височина в първите експерименти на Б. е равна на височината на живака в барометъра, това доказва, че в барометъра живачната колона се поддържа от атмосферния въздух. Изливайки различни, все по-големи и по-големи количества живак в дългото коляно на тръбата, Б. записва височините на живачния стълб и съответните обеми сгъстен въздух, но отначало не обръща внимание на техните числени съотношения. Неговият ученик Ричард Таунли, разглеждайки числата в таблицата, забеляза, че обемите на уловения въздух са обратно пропорционални на натиска, упражняван върху него. Ако въздухът първо заемаше 12 инча дължина в тръбата и живакът в двете колена беше на една и съща височина, тогава когато толкова много живак беше излят в дългия лакът, че въздухът заемаше само 6 инча дължина, се оказа, че височината на поддържания живачен стълб беше 29 английски. инча. Първоначално въздухът, заключен в късо коляно, имаше същата еластичност като атмосферата, което можеше да поддържа живака в барометъра на 29 инча височина, а във втория случай затвореният въздух беше подложен на атмосферно налягане и налягане на живак от 29 инча. инча, тоест общо - налягане 29 х 2 инча: това означава, че когато обемът на въздуха е станал наполовина по-малък, неговата еластичност е станала два пъти по-голяма. След това Бойл многократно повтаря и разнообразява експериментите си и доказва, че същият закон важи и за случаите на увеличаване на обема на въздуха.
За да направи това, той използва цилиндричен съд (фиг. 2), който е пълен с живак; потапяне на тръба A с отворени краища, докато част AB остане над живака, равна на 1 инч дължина, B. затваря и запечатва отвор A и след това повдига тръбата. В същото време обемът AB нараства и накрая се превръща в обем AD - два пъти по-голям; живакът се издигна до височина B "D, което беше почти наполовина по-малко, 29¾ инча, тогавашната височина на живака в барометъра. Очевидно въздухът, съдържащ се в DA, нямаше достатъчна еластичност, за да притисне повърхността D с такава сила, колкото преди това е натиснал B; разликата в еластичността в двете позиции на тръбата е с размер на колона DB", чиято дължина се оказа 15⅜ инча. Следователно еластичността на въздуха в двоен обем AD е 29¾ без 15⅜, т.е. 14⅜ или почти точно половината от предишния. Когато тръбата беше повдигната, така че обемът AD да заема дължина от 10 инча, височината на живака DB" се оказа 26¾, следователно еластичността на въздуха беше измерена чрез разликата 29¾-26¾, т.е. 3 инча, която е почти точно 1/10 от първоначалната еластичност. Описание на тези експерименти се намира в „Нови експерименти, докосващи пружината на въздуха” (Oxf., 1660); рядък факт за въздуха” (Лондон, 1671); продължение” (Лондон, 1681), “Обща история на въздуха” (Лондон, 1692). Френският учен Мариот (Edme Mariotte, 1620-1684) провежда серия от експерименти по същия начин и открили същия закон, който обикновено се нарича по име; mouvement des eaux et des autres fluides” (част II, диск. 2) Не може да се отговори положително дали Мариот е знаел за експериментите на Бойл, въпреки че е известно, че Мариот е бил в отношения с английски учени още през 1668 г. Както и да е, Мариот извърши същите експерименти и измервания като Бойл, само с по-голяма точност и неговите експерименти станаха по-известни. Тръбата (фиг. 1) получи като устройство името Мариот и законът беше кръстен на него, въпреки че известно време с право се нарича закон на Бойл-Мариот; Може би ще е още по-справедливо да добавим името Тонли. Във всеки случай Мариот е толкова известен с другите си произведения, че въпреки доказателствата за числата е трудно да го заподозрем в липсата на независимост на работата, довела до вторичното откритие на важен физичен закон. Историята на физиката показва, че много важни закони, открити в една страна, биха могли за дълго времеда бъде непознат за друг; Така важен закон относно силата на галваничния ток, открит от Ом в Германия, беше открит отново няколко години по-късно във Франция от физика Пулие.
Тъй като обемът на въздуха намалява два или три пъти, неговата плътност непременно нараства в същото съотношение; температурата на газа при измерване на неговия обем трябва да бъде постоянна, в противен случай охлаждането или нагряването му само по себе си може да промени обема и еластичността; Освен това въздухът не трябва да съдържа вода или други течности. При спазване на всички тези условия законът на Бойл-Мариот трябва да бъде изразен, както следва: обемите на определено количество сух въздух при постоянна температура са обратно пропорционални на натиска, упражняван върху него, и следователно на неговата еластичност, плътността на въздуха е право пропорционална на това налягане; или накратко, обемът на въздуха е обратно пропорционален на налягането, упражнявано върху него. Ако означим първоначалния обем на газа с буквата v, а налягането, под което се намира, с буквата p, ако сгъстеният обем на газа е v", а налягането, винаги измервано с височината на живака колона, ще бъде p"; тогава законът на Б.-М. ще се изрази чрез пропорция: v: v" = p": p; откъдето pv = p"v", т.е. произведението от обема на газа и съответното налягане е постоянна стойност при постоянна температура. Други газове, както ще бъде обяснено по-късно, следват същия закон. Колкото и прости да изглеждат експериментите на Бойл и Мариот, обаче, дори и с ниската степен на точност на наличните по това време инструменти, те изискват спазването на много експериментални предпазни мерки. Неспазването на правилните правила вероятно е причината за различните противоречиви свидетелства на по-късни наблюдатели. Например, Без наблюдава в експериментите си под екватора намаляване на обема на въздуха в по-малко съотношение, отколкото увеличаване на неговата еластичност. Многобройни опити на Бугар на същите географски ширини, напротив, потвърждават закона на Б.-М. в допълнение, експериментите на Амонтон, Сгрейвсанд, Фонтана, Шукбург доведоха до същото заключение.
Но всички експерименти от онова време не достигаха високи налягания и не бяха толкова точни, че нямаше съмнение в правилността на закона. Sulzer (“Mém. de Berlin,” vol. IX, 1753), а след това Robison, заключиха от своите експерименти, че при налягания 7 или 8 пъти по-високи от атмосферното налягане, еластичността се увеличава в много по-малка степен, отколкото обемът намалява; но опитите на Винклер (1765) отново доказват приложимостта на закона на Б.-М. до 8 атмосфери. налягане. През този век (1826 г.) датските учени Oerstedt и Svensen отново потвърдиха валидността на закона до 8 atm. налягане; другите им експерименти, които се простират до 70 атмосфери, са направени с помощта на метод, който е по-малко надежден. Но дори в тези близки граници (до 8 атм.) някои газове не следват закона на Б.-М. През втората половина на 18в. Ван Марум се увери, че газът амоняк намалява обема си много по-бързо от въздуха; подобно на това Oerstedt и Svendsen много по-късно откриха сярна киселина за газа. Освен това беше открито, че и двата газа преминават в течно състояние при малко по-високо налягане; това свойство по-късно е доказано за други газове. Депрец с още по-прецизни експерименти (“Ann. de Chim. et de phys.”, 2, XXXIV, 1827) се убеди, че много газове не следват закона на B.-M. дори при налягания, които са далеч от тези, при които става втечняване на газовете. Депре провежда експерименти, използвайки метод, подобен на този, използван за първи път от Ван Марум. Две стъклени тръби, запечатани от единия край, едната от които беше пълна с въздух, а другата с друг газ, бяха потопени с отворените си краища във вана, пълна с живак, поставена на дъното на стъклен цилиндър, пълен с вода. Натискът върху водата се упражнявал с помощта на бутало, поставено в горната част на цилиндъра, водата притискала живака, който, влизайки в тръбите, компресирал газовете. Експериментите, направени с такова устройство, доведоха Депрес до заключението, че газовете амоняк, серен диоксид, сероводород и серен диоксид заемат по-малък обем от въздуха при същото налягане. Точността на измерванията беше толкова голяма, че разликата между компресията на тези газове и въздуха беше забележима дори когато обемът на последния беше намален само наполовина; Освен това обемите на тези газове са по-малко от половината от първоначалния обем. Според експериментите на Депрес водородният газ се компресира еднакво с въздуха до 1/15 от първоначалния си обем, но при двадесет атмосфери налягане обемът на водорода е по-голям от съответния обем въздух. Дюлонг и Араго („Mémoires de l'Académie des Sciences“, том X, „Annales de Chim. et de Phys.“, том XLIII, 1830) измерват компресията на въздуха до 27 атмосфери налягане; тяхното устройство се състоеше от тръба с дължина 1,7 м, в която беше компресиран въздух и свързана с нея с друга, съставена от 13 части, всяка с дължина 2 метра. Тази дълга композитна тръба беше прикрепена към дървена мачта, монтирана вътре във висока кула. Дюлонг и Араго установяват, че законът на Б.-М. вярно за въздуха, дори когато е компресиран до 1/24 от първоначалния му обем. По-късно френският физик Пулие провежда експерименти, използвайки метод, подобен на този, използван от Ерстед и Депре, но при високи налягания, и заключава, че кислородът, азотът, водородът, въглеродният оксид и азотният оксид следват същия закон за компресия до 100 атмосфери като въздух, но че шестте газа, посочени по-долу, са компресирани повече от въздуха и че разликата между техните обеми и обема на въздуха се увеличава с увеличаване на налягането. Тези газове са: сярна киселина, амоняк, въглероден диоксид, азотен оксид, нефт и блатни газове.
През 1847 г. обширните и точни изследвания на Regnault по този въпрос са публикувани („Mémoires de l'Académie des sciences de Paris“, XXI, 1847), които заедно с друга физическа работа, извършена от името на френското правителство, са описани в споменатите мемоари под заглавието „Relation des experiences entreprises par ordre de M. le ministre des travaux publics etc.“ Възползвайки се от подобренията в инструментите и методите за наблюдение, въведени от неговите предшественици, Regnault добави значителни нови подобрения, елиминирайки основната трудност при точното измерване на постепенно намаляващите обеми газ. Колкото и значителна да е била дължината на тръбата, в която газът е бил компресиран в експериментите на Араго и Дюлонг (1,7 метра), все пак при високи налягания обемът на газа става много малък и тогава всяка малка неточност в измерването на позицията на живака, блокиращ газа, става все по-осезаем в сравнение с непрекъснато намаляващия обем, който се измерва. В своите експерименти Regnault използва 3-метрова тръба за компресиране на газове и след измерване на пълния обем на газа и след това го компресира до половината от обема при определено подходящо налягане, той отново изпомпва газ в тази тръба, докато се изпълни напълно запълнена. Полученият голям обем газ, отново под налягане, b Опо-голям от оригинала, беше върнат до половината от обема чрез увеличаване на височината на живачната колона в дълга тръба. Използвайки този метод, Regnault винаги измерва големи обеми при много високо налягане (25 атмосфери за въздух); освен това той взе предвид много други експериментални предпазни мерки, които гарантираха точността на неговите заключения. Експериментите на Regnault доказаха, че важният закон на природата, посочен от Бойл и Мариот, не е формулиран точно математически чрез простите зависимости, които те му дадоха, че компресията или намаляването на обема на въздуха и азота се случва в малко по-голямо съотношение от увеличаването на налягането върху газа или от еластичността на последния, и че за водорода компресията, напротив, е малко по-слаба, отколкото би се очаквало в случай на точна приложимост на закона B.-M. Няколко цифри, взети от мемоарите на Regnault, поставени в следващата табличка, показват, че наблюдаваните отстъпления обикновено са малки, но ясно нарастват с увеличаване на натиска. Първите две колони на таблицата показват височината на живачния стълб, който притиска газа, изразена в атмосфери (в Regnault в милиметри), а височината от 760 милиона живачен стълб се приема като мярка за нормално атмосферно налягане. Числата в третата колона показват коефициентите, получени чрез разделяне на съотношението на първоначалния обем газ към обема, намален чрез компресия, на съотношението на последното налягане към първоначалното. Ако наречем буквите v, v 1 началния и редуцирания обем газ, а буквите. p и p 1 са съответните налягания на газа, тогава според закона на Б.-М. трябва да бъде: v: v 1 = p 1: p, следователно (v: v 1): (p 1: p) = 1, т.е. ако и двете написани релации са наистина равни, тогава частното от разделянето на една релация на друга трябва да бъде да бъде равно на 1. Но числата в третата колона стават все по-големи от 1 и бавно, но постоянно нарастват:
Което и да е число в третата колона показва коефициента, свързан с намаляването на обема на въздуха наполовина, когато налягането се премести от p (числото в първата колона) до p 1 (втората колона). От тези числа става ясно, че намаляването на обема на въздуха става в по-голямо съотношение, отколкото увеличаването на съответното налягане или еластичността на газа. Първоначално и двете съотношения се различават малко едно от друго, но при преминаване от 12 атм. с 24, намаляването на обема е 1,006366 пъти по-голямо от увеличението на налягането. Малко изчисление ни позволява да заключим, че 10 000 куб.м. сант. въздух при налягане 0,972 atm, подложен на налягане 24,9 пъти по-голямо, ще заеме обем от 396 кубични метра. сант. вместо 401 к.с., както е трябвало да бъде, ако законът на Б.-М. точно изразен законът на природата.
Компресията на азота представлява подобни, но малко по-малки отклонения от закона на B.-M, и тъй като атмосферният въздух се състои от кислород и азот, Regnault заключава, че кислородът се компресира повече от азота и въздуха. Следващата таблетка съдържа числата, получени по време на експерименти I с водород; Номерата на колоните имат същото значение като в таблица A.
Тъй като всички числа в третата колона са по-малки от единица и непрекъснато намаляват, обемът на компресирания водород винаги е по-голям от това, което би следвало според закона на Б.-М, и с увеличаване на налягането това отклонение се увеличава. Според Regnault водородът се компресира като пружина, все по-малко и по-малко с увеличаване на налягането. Що се отнася до въглероден диоксид , относително лесно свиваем, което, подобно на въздуха, представлява по-бързо намаляване на обема, отколкото увеличаване на еластичността, тогава той се отклонява от закона вече при относително слаби налягания при обикновени температури, но като се нагрява до точката на кипене на водата (100 ° C.), показва много по-малки отстъпления. Ако от изключително точните опити на Regnault следва да се заключи, че законът на B.-M. с много незначителни отклонения се прилага само за някои газове при налягания далеч от точката на втечняване и при значително висока температура, тогава изследването на въпроса не се изчерпва с тези резултати. Експериментите на Бойл и Реньо са разделени от период от време от почти 200 години. Свойствата на газовете бяха изследвани в много отношения през този период от време, списъкът на втечняемите газове непрекъснато се увеличаваше и преди няколко години, чрез трудовете на Pictet и Cailletet, беше направено окончателно обобщение, че с намаляване на обема на газовете чрез налягане и с намаляване на температурата всички те се превръщат в течност. В същото време изследванията върху компресията на газа бяха допълнени от други учени, които компресираха газ при налягания, далеч надвишаващи 25 и 30 атмосфери, на които Реньо и неговите непосредствени предшественици се спряха. По-горе беше споменато, че Пулие вече е довел налягане до 100 атм, но неговите експерименти не са подредени по такъв начин, че да могат да намерят отговор на значението на закона на B.-M. при високи налягания. Този отговор дават опитите на Натерер, Калете и Амаг за силни налягания и опитите на Д. И. Менделеев за слаби. Амага монтира устройството си на дъното на шахтата, която беше дълбока около 400 метра (около 190 фатома). Измерванията на обема на газа на такава дълбочина и огромната височина на натискащия живачен стълб бяха придружени от толкова големи технически трудности, че директно се изследваше само свиваемостта на азота. Законът за компресия на други газове в сравнение с азота е открит от Амага по метода на Депре и Пулие. В експериментите на Amag налягането достига 430¾ атмосфери, а обемът на азота намалява само 335¾ пъти. Кейлет спусна устройството си в артезиански кладенец с дълбочина 500 метра (около 230 фатома); височината на притискащия живачен стълб постепенно се увеличаваше, докато устройството се спускаше. Тръбата, в която се компресираше газът, беше позлатена отвътре; живакът, влизайки в него, амалгамира златото, така че върху позлата остава следа, граница между газа и живака, по която може да се измери обемът, зает от компресирания газ. Освен това Калет провежда експерименти за компресиране на въздух и водород в специално устройство, в което налягането е доведено до 605 атмосфери. Тези експерименти са предшествани от изследванията на Натерер (1851-1854), който с помощта на специално устройство за помпа под налягане довежда налягането на газа до 2790 атмосфери. Газът се концентрира в дебелостенен стоманен съд, който е снабден с добре направен клапан, постепенно натоварван с увеличаване на еластичността на газа, което се измерва чрез теглото на товара върху клапана. В края на компресирането на газа той се прекарва на части в друг съд с определен обем, където приема еластичност, равна на една атмосфера, и се определя последователно намаляване на еластичността на сгъстения газ, първо бързо , след това забавяйки все повече и повече. Числата, получени от тези измервания, предоставиха средство за определяне на еластичността на газовете, съответстваща на тяхното компресиране. Комбинацията от всички тези експерименти, в сравнение с тези на Regnault, доведе до заключението, че всички газове, с изключение на водорода, претърпяват такива промени в обема v и еластичността p, започвайки от една атмосфера, че продуктът vp намалява до налягането или еластичността достига определена граница и че с по-нататъшно увеличаване на налягането този продукт vp се увеличава. През първия период газовете се компресират повече, отколкото трябва да бъдат според закона на Б.-М, през втория период - по-малко. Границите, т.е. броят на атмосферите на налягането, при които трябва да се получи стойността на компресията според закона на B.-M, са показани по различен начин от различните изследователи, но няма съмнение, че за всеки газ има специално такова лимит; само водородът, при всички изпитвани налягания, се компресира по-малко, отколкото трябва според закона на B.-M. Оставаше да се допълнят тези изследвания чрез изучаване на връзката между еластичността и обема на газовете при налягане, по-ниско от атмосферното, тоест в разреден въздух; според експериментите с ниска точност на Бойл и Мариот, техният закон е верен и за разредения въздух. Точно изследване на закона за компресия на разредените газове е направено от Д. И. Менделеев в сътрудничество с М. Л. Кирпичев (опитите на Императорското руско техническо дружество, "За еластичността на газовете" от Д. Менделеев, част 1, Санкт Петербург, 1875, в 4°). Тази работа и други, свързани с нея, бяха извършени за сметка на Техническото дружество; Със същите средства е публикувано гореспоменатото есе, което описва техниките и инструментите на автора за измерване на еластичността и обемите на газовете. Проведени са експерименти с въздух, водород и въглероден диоксид. По-долу е дадена серия от експерименти, от които се виждат връзките между обемите на много разреден въздух и неговата еластичност.
От това се вижда, че с намаляване на налягането върху газ обемът му се увеличава в по-малка степен, отколкото намалява еластичността, следователно и обратно: с увеличаване на налягането обемът намалява в по-малка степен. Всъщност: второто налягане е 7,71 пъти по-малко от първото, а вторият обем е само 7,38 пъти повече от първия; третото налягане е 2,35 пъти по-малко от второто, а третият обем е 1,92 пъти по-голям от втория. Това означава, че компресията и разширението на въздуха при много ниско налягане се отклонява от закона на B.-M. в същата посока, както при много силен натиск; Подобно нещо се случи с въглеродния диоксид. Amaga и Zillestrom работиха по същия проблем, Regno също направи няколко измервания с въздух при еластичност от 300 милиметра. Regnault и Zillestrom стигнаха до извода, че разреденият въздух се отклонява от закона на B.-M. в същата посока, както при налягане малко над атмосферното; Експериментите на Амаг не го доведоха до надеждни резултати (вижте критичната оценка на експериментите на Р. и З., направена от Д. И. Менделеев в есето „За еластичността на газовете“, §§ 82, 92, 94.)
Обобщавайки всичко, което беше казано по отношение на въздуха, може да се види, че в разредено състояние той се компресира по-малко, отколкото следва според закона B.-M, че при плътност, близка до атмосферната или по-висока, въздухът се компресира повече, отколкото според законът на B.-M и накрая при много висока плътност отново отстъпва в същата посока, както при много ниска. Когато се движи от отстъпи в една посока към отстъпи в друга, въздухът трябва задължително да се компресира според закона на B.-M и това се случва само два пъти, варирайки от най-ниската изследвана еластичност (около ⅓ милиона) до най-високата. (2700 атмосфери). Други газове вероятно следват същия закон за променлива компресия, с изключение на водорода, който постоянно се компресира по-малко, отколкото според закона на B.-M.
Отдавна съществуват съмнения дали газовете могат да следват закона на Б.-М. при много високо налягане. Тъй като по време на компресията плътността на газа непрекъснато нараства до една и съща степен, би било възможно да се достигне точката, че компресираният газ ще бъде по-плътен от най-плътния метал, т.е. че газът, доведен чрез компресия до определен обем, ще бъде по-тежък , например платина, взета в същия обем. Неограниченото компресиране на газ не може да бъде разрешено поради това, че веществото на газа, което само по себе си заема определена част от пространството, поставя граница на компресията. Съвременната химия (вж. Менделеев, „За еластичността на газовете,” стр. 8-12) води до съображения, които не допускат възможността един газ да бъде доведен до много висока плътност чрез компресия. Но всъщност е отбелязан факт, че всички изпитвани газове при високи налягания заемат не толкова малък обем, колкото би следвало според закона на B.-M, и че отклоненията от този закон са толкова по-значителни, колкото по-голямо е налягането ; този факт показва, че намаляването на обема наближава определена граница. За някои газове при обикновени температури е установено такова ограничение, тъй като тези газове се превръщат в течност, а течностите при най-високи налягания съвсем леко намаляват обема си. Други газове, които не се превръщат в течност от едно компресиране без повече или по-малко значително намаляване на температурата, се отклоняват все повече и повече от закона на B.-M. Водород при 3000 атм. налягането заема обем само 1000 пъти по-малък от първоначалния, т.е. при това налягане обемът му е три пъти по-голям от очаквания, ако законът на B.-M е точен. Няколко експеримента на Regnault върху компресията на газовете при точката на кипене на водата показват, че с повишаване на температурата отклоненията от закона на B.-M. стават по-малко; това обстоятелство го доведе до заключението, че повишаването на температурата доближава газа до идеално състояние, в което той следва закона на Б.-М., но тази концепция за идеален газ все още не е достатъчно обоснована. В заключение трябва да се каже, че законът на Б.-М, всъщност изразяващ компресията на газовете само в някои гранични случаи, все пак служи като отправна точка за изследване на техните свойства. Заедно със закона на Гей-Лусак, който се отнася до разширяването на газовете от топлина, той представя математическа формула, която трябва да бъде модифицирана, за да представи напълно феномена на промените в обема на газовете. Формулата на Ван дер Валс (виж тази дума) вече прониква по-дълбоко в природата на газовете.
Въпреки многото експериментална работаотносно компресията на газове, науката може да очаква дори нови, още по-обширни изследвания. Би било желателно прецизните и трудни изследвания на силно разширените газове, направени от Д. И. Менделеев, водещи до важни заключения, да бъдат повторени и разпространени. Експериментите на Regnault ще останат водещи за дълго време, но точността на нашето време може да изглежда недостатъчна в близко бъдеще.
Учените, изучаващи термодинамичните системи, са установили, че промяната в един макропараметър на системата води до промяна в останалите. Например, увеличаването на налягането вътре в гумена топка, когато се нагрява, причинява увеличаване на нейния обем; Повишаването на температурата на твърдото тяло води до увеличаване на неговия размер и т.н.
Тези зависимости могат да бъдат доста сложни. Следователно, първо ще разгледаме съществуващите връзки между макропараметрите, като използваме примера на най-простите термодинамични системи, например за разредени газове. Експериментално установените функционални зависимости между физичните величини за тях се наричат газови закони.
Робърт Бойл (1627-1691). Известен английски физик и химик, който изучава свойствата на въздуха (маса и еластичност на въздуха, степента на неговото разреждане). Опитът показва, че точката на кипене на водата зависи от налягането среда. Изучавах и еластичността твърди вещества, хидростатика, светлина и електрически явления, за първи път изрази мнението си за сложния спектър бяла светлина. Въведе понятието „химичен елемент“.
Първо газов законе открит от английския учен Р. Бойлемпрез 1662 г., докато изучава еластичността на въздуха. Той взе дълга огъната стъклена тръба, запечатана в единия край, и започна да налива живак в нея, докато в късото коляно се образува малък затворен обем въздух (фиг. 1.5). След това той добави живак към дългия лакът, изучавайки връзката между обема на въздуха в затворения край на тръбата и налягането, създадено от живака в левия лакът. Предположението на учения, че между тях има определена връзка, се потвърди. Сравнявайки получените резултати, Бойлформулира следната позиция:
Съществува обратна връзка между налягането и обема на дадена маса газ при постоянна температура:p ~ 1/V.
 |
| Едм Мариот |
Edm Мариот(1620—1684) . Френски физик, който изучава свойствата на течности и газове, сблъсъци на еластични тела, трептения на махалото и природни оптични явления. Той установи връзката между налягането и обема на газовете при постоянна температура и обясни въз основа на това различни приложения, по-специално как да се намери надморската височина на дадена област с помощта на показанията на барометъра. Доказано е, че обемът на водата се увеличава при замръзване.
Малко по-късно, през 1676 г., френският учен Е. Мариотнезависимо от Р. Бойл, той като цяло формулира закона за газа, който сега се нарича Законът на Бойл-Мариот.Според него, ако при определена температура дадена масагазът заема обем V 1при натиск p1,а в друго състояние при същата температура неговото налягане и обем са равни p2И V 2,тогава е вярна следната връзка:
стр 1 /p 2 =V 2 /V 1или стр. 1V 1 = p2V 2.
Законът на Бойл-Мариот : ако при постоянна температура протича термодинамичен процес, в резултат на който газът преминава от едно състояние (p 1 иV 1)на друг (p2iV 2),тогава продуктът на налягането и обема на дадена маса газ при постоянна температура е постоянен:
pV = конст.Материал от сайта
Нарича се термодинамичен процес, протичащ при постоянна температура изотермичен(от гр. isos - равен, therme - топлина). Графично върху координатната равнина pVтя е представена чрез хипербола, наречена изотерма(фиг. 1.6). Различни температурисъответстват различни изотерми - колкото по-висока е температурата, толкова по-високо в координатната равнина pVима хипербола (T 2 >Т 1).Очевидно е, че на координатната равнина pTИ VTизотермите са изобразени като прави линии, перпендикулярни на температурната ос.
Законът на Бойл-Мариот инсталира връзката между налягането и обема на газаза изотермични процеси: при постоянна температура обемът V на дадена маса газ е обратно пропорционален на неговото налягане стр.
В урок 25 "" от курса " Химия за манекени„Ще разгледаме закона, свързващ налягането и обема на газа, както и графиките на зависимостта на налягането от обема и обема от налягането. Позволете ми да ви напомня, че в последния урок „” разгледахме структурата и принципа на работа на живачен барометър, а също така дадохме определение за налягане и разгледахме неговите мерни единици.
(1627-1691), на когото дължим първия практически правилно определение химичен елемент(научаваме в глава 6), също се интересуваше от явленията, възникващи в съдове с разреден въздух. Докато изобретява вакуумни помпи за изпомпване на въздух от затворени контейнери, той забелязва свойство, познато на всеки, който някога е надувал мехура на футболна топка или леко стискал балон: колкото повече се компресира въздухът в затворен контейнер, толкова повече се съпротивлява компресия. Бойл нарече този имот " еластичност» въздух и го измерва с помощта на просто устройство, показано на фиг. 3.2, а и б.

Бойл улови малко въздух в затворения край на извита тръба с живак (фиг. 3-2, а) и след това компресира този въздух чрез постепенно добавяне на живак към отворения край на тръбата (фиг. 3-2, b). Налягането, изпитвано от въздуха в затворената част на тръбата, е равно на сумата от атмосферното налягане и налягането на живачен стълб с височина h (h е височината, до която нивото на живака в отворен крайтръбата надвишава нивото на живак в затворения край). Измерванията на налягането и обема, получени от Бойл, са дадени в табл. 3-1. Въпреки че Бойл не е взел специални мерки за поддържане на постоянна температура на газа, очевидно в неговите експерименти тя се е променила само леко. Бойл обаче забеляза, че топлината от пламъка на свещта причинява значителни промени в свойствата на въздуха.
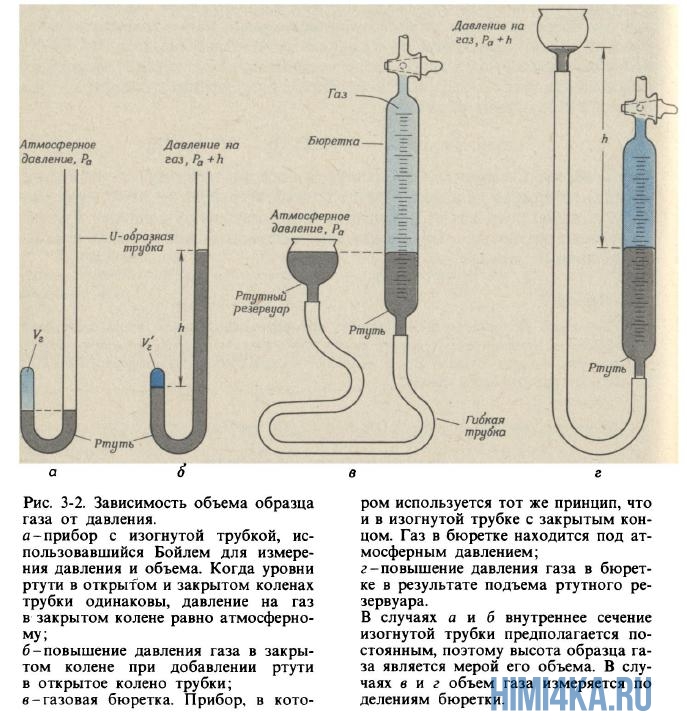
Анализ на данните за налягането и обема на въздуха по време на неговото компресиране
Таблица 3-1, който съдържа експерименталните данни на Бойл за връзката между налягането и обема на атмосферния въздух, се намира под спойлера.


След като изследователят получи данни, подобни на тези, дадени в табл. 3-1, той се опитва да намери математическо уравнение, като свързва две взаимно зависими величини, които измерва. Един от начините да се получи такова уравнение е да се начертае зависимостта на различни степени на едно количество от друго с надеждата да се получи праволинейна графика. Общо уравнениеправата линия изглежда така:
- y = ax + b (3-2)
където x и y са взаимосвързани променливи, а a и b са постоянни числа. Ако b е нула, права линия минава през началото.
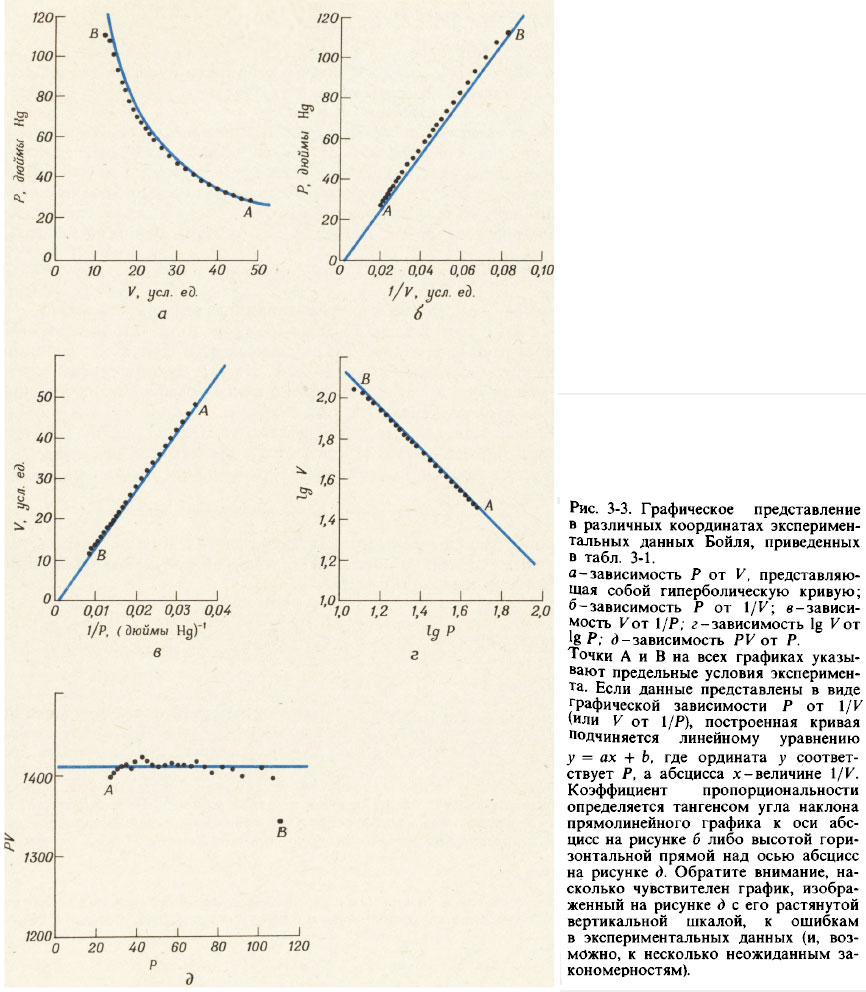
На фиг. 3-3 показва различни начини за графично представяне на данните за налягането P и обема V, дадени в табл. 3-1. Графиките на P спрямо 1/K и V спрямо 1/P са прави линии, минаващи през началото. Графиката на логаритъм P спрямо логаритъм V също е права линия с отрицателен наклон, чийто тангенс е равен на -1. И трите тези графики водят до еквивалентни уравнения:
- P = a / V (3-3a)
- V = a / P (3-3b)
- log V = log a - log P (3-3v)
Всяко от тези уравнения представлява една от опциите Законът на Бойл-Мариот, което обикновено се формулира по следния начин: за даден брой молове газ налягането му е пропорционално на обема му, при условие че температурата на газа остава постоянна.
Между другото, вероятно сте се чудили защо законът на Бойл-Мариот се нарича с двойно име. Това се случи, защото този закон, независимо от Робърт Бойл, който го откри през 1662 г., беше преоткрит от Едмус Мариот през 1676 г. Просто така.
Когато връзката между две измерени величини е толкова проста, както в този случай, тя може да се установи и числено. Ако всяка стойност на налягането P се умножи по съответната стойност на обема V, лесно може да се провери, че всички продукти за дадена проба от газ при постоянна температура са приблизително еднакви (вижте таблица 3-1). Така можем да напишем това
- P V = a ≈ 1410 (3-3g)
Уравнение (3-3g) описва хиперболичната връзка между стойностите на P и V (виж Фиг. 3-3,a). За да проверим дали графиката на зависимостта на P от V, изградена от експериментални данни, наистина съответства на хипербола, ще изградим допълнителна графика на зависимостта на продукта P V от P и ще се уверим, че това е хоризонтална права линия ( виж Фиг. 3-3,e) .
Бойл установи, че за дадено количество газ при постоянна температура връзката между налягането P и обема V е достатъчна
се описва задоволително от връзката
- P V = const (при постоянни T и n) (3-4)
Формула от закона на Бойл-Мариот
За да сравните обемите и наляганията на една и съща газова проба при различни условия(но постоянна температура) е удобно да си представим Законът на Бойл-Мариотв следната формула:
- P 1 ·V 1 = P 2 ·V 2 (3-5)
където индекси 1 и 2 съответстват на две различни условия.
Пример 4. Найлоновите торби с храна, доставени на платото Колорадо (вижте пример 3), често се спукват, защото въздухът в тях се разширява при издигане от морското равнище до надморска височина от 2500 m, при условия на ниско атмосферно налягане. Ако приемем, че вътре в чантата при атмосферно наляганесъответстващ на морското равнище, съдържа 100 cm 3 въздух, какъв обем трябва да заема този въздух при същата температура на платото Колорадо? (Да приемем, че за доставяне на продукти се използват набръчкани торбички, които не ограничават разширяването на въздуха; липсващите данни трябва да се вземат от Пример 3.)
Решение
Нека използваме закона на Бойл под формата на уравнение (3-5), където индекс 1 ще се отнася за условията на морското равнище, а индекс 2 за условията на надморска височина от 2500 m. Тогава трябва да се изчисли P 1 = 1000 atm, V 1 = 100 cm 3, P 2 = 0,750 atm и V 2 . така че
- P 1 ·V 1 = P 2 ·V 2
- 1.000 atm 100 cm 3 = 0.750 atm V 2
- V 2 = 133 см 3
Надявам се, че след изучаване на урок 25 "" ще запомните зависимостта на обема и налягането на газа един от друг, ако имате някакви въпроси, напишете ги в коментарите. Ако няма въпроси, преминете към следващия урок.
Започваме изследването на връзката между параметрите, характеризиращи състоянието на дадена маса газ, като изучаваме газовите процеси, които протичат, докато един от параметрите остава непроменен. английски учен Бойл(през 1669 г.) и френски учен Мариот(през 1676 г.) открива закон, който изразява зависимостта на промените в налягането от промените в обема на газа при постоянна температура. Нека проведем следния експеримент.
Чрез завъртане на дръжката ще променим обема на газа (въздуха) в цилиндър А (фиг. 11, а). Според показанията на манометъра отбелязваме, че налягането на газа също се променя. Ще променим обема на газа в съда (обемът се определя от скала B) и като забележим налягането, ще ги запишем в таблицата. 1. От него се вижда, че произведението от обема на газа и неговото налягане е почти постоянно: колкото пъти е намалял обемът на газа, толкова пъти се е увеличило налягането му.
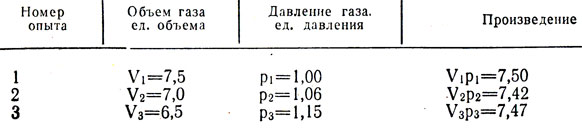
В резултат на подобни, по-точни експерименти беше открито: за дадена маса газ при постоянна температура налягането на газа се променя обратно пропорционално на промяната в обема на газа.
![]()
Това е формулировката на закона на Бойл-Мариот. Математически за две състояния ще бъде записано, както следва: Процесът на промяна на състоянието на газ при постоянна температура се наричаизотермичен.
Формулата на закона на Бойл-Мариот е уравнението на изотермичното състояние на газ. При постоянна температура средната скорост на молекулите не се променя. Промяната в обема на газа води до промяна в броя на ударите на молекулите върху стените на контейнера. Това е причината за промяната в налягането на газа. Нека изобразим този процес графично, например за случая. По абцисната ос ще нанесем обема на газа, а по ординатната - неговото налягане (фиг. 11, b). Нека намерим точките, съответстващи на всяка двойка стойности на V и p, и като ги свържем заедно, ще получим графика на изотермичния процес. Линията, изобразяваща връзката между обема и налягането на газ при постоянна температура, се нарича изотерма. Изотермичните процеси не се срещат в чист вид. Но често има случаи, когато температурата на газа се променя малко, например, когато компресор изпомпва въздух в цилиндри или когато горима смес се впръсква в цилиндъра на двигател с вътрешно горене. В такива случаи изчисленията на обема и налягането на газа се правят съгласно закона на Бойл-Мариот *.
