Tema 2. TRANSIZIONI DI FASE.
La transizione di fase (trasformazione di fase) è la transizione di una sostanza da una fase all'altra quando cambiano i canali esterni (ad esempio, temperatura, pressione, campi magnetici ed elettrici, ecc.), Accompagnati da una modifica delle proprietà fisiche e dei parametri della sostanza.
Il valore di temperatura, pressione o qualche altra quantità fisica alla quale avviene la transizione di fase è chiamato punto di transizione. Distingua la transizione di fase di due generi.
PRIMA TRANSAZIONI DI CAMBIAMENTO
Nella transizione di fase del primo ordine, tale termodinamica
caratteristiche di una sostanza, come densità, concentrazione di componenti, volume specifico, quantità di energia interna immagazzinata, ad es. una certa quantità di calore, chiamato calore di transizione, viene rilasciato o assorbito. E intendo il brusco cambiamento di queste quantità non nel tempo, ma in caso di un cambiamento di temperatura, pressione, ecc. Gli esempi più comuni di transizioni di fase del primo tipo:
- fusione e cristallizzazione
- evaporazione e condensa
- sublimazione e desublimazione
TRANSIZIONI DI SECONDA FASE
Con una transizione di fase di secondo ordine, la densità e l'energia interna non cambiano, quindi una tale transizione di fase può essere invisibile ad occhio nudo. Il salto è sperimentato dai loro derivati \u200b\u200brispetto alla temperatura e alla pressione: capacità termica, coefficiente di dilatazione termica, varie suscettibilità, ecc. le transizioni di fase del secondo ordine sono accompagnate da un cambiamento nella simmetria della struttura della sostanza e non dal rilascio o dall'assorbimento di energia (calore). Gli esempi più comuni di transizioni di fase del secondo tipo:
- sistema che passa attraverso un punto critico
- transizione paramagnet-ferromagnet
- transizione di metalli e leghe allo stato di superconduttività
- transizione superfluida di elio liquido
- la transizione di materiali amorfi in uno stato vetroso
La fisica moderna esplora anche i sistemi con transizioni di fase di terzo o superiore tipo. Di recente, il concetto di transizione di fase quantistica, ad es. una transizione di fase controllata non dalle fluttuazioni termiche classiche, ma da quelle quantistiche, che esistono anche a una temperatura zero assoluta, in cui la transizione di fase classica non può essere realizzata a causa del teorema di Nernst.
Consideriamo più in dettaglio i fenomeni che ci interessano associati alle transizioni di fase del primo tipo.
EVAPORAZIONE, CONDENSAZIONE, BOLLITURA.
VAPORI SATURI E INSATURATI.
In determinate condizioni, qualsiasi sostanza può trovarsi in vari stati di aggregazione: solida, liquida e gassosa. Le transizioni da uno stato di aggregazione al secondo sono transizioni di fase del primo tipo.
evaporazione e condensazione sono transizioni di fase tra le fasi liquida e gassosa di una sostanza.
tutto gas reali (ossigeno, azoto, idrogeno, ecc.) in determinate condizioni possono trasformarsi in liquido. Tuttavia, tale trasformazione può avvenire solo a temperature inferiori a un certo, cosiddetto temperatura critica T kr. Ad esempio, la temperatura critica per l'acqua è 647,3 K, per azoto 126 K, per ossigeno 154,3 K. A temperatura ambiente (≈ 300 K), l'acqua può trovarsi sia allo stato liquido che gassoso, e l'azoto e l'ossigeno esistono solo sotto forma di gas.
evaporazione chiamata transizione di fase da uno stato liquido a uno gassoso. Dal punto di vista della teoria molecolare-cinetica, l'evaporazione è un processo in cui le molecole più veloci volano fuori dalla superficie di un liquido, la cui energia cinetica supera l'energia del loro legame con altre molecole liquide. Ciò porta a una diminuzione dell'energia cinetica media delle molecole rimanenti, cioè al raffreddamento del liquido (se non vi è fornitura di energia dai corpi circostanti).
condensazione È l'opposto del processo di evaporazione. Al momento della condensazione, le molecole di vapore ritornano al liquido.
In una nave chiusa, il liquido e il suo vapore possono essere in uno stato equilibrio dinamicoquando il numero di molecole che escono dal liquido è uguale al numero di molecole che ritornano nel liquido dal vapore, cioè quando le velocità di evaporazione e di condensazione sono le stesse. Questo sistema è chiamato bifasico . Si chiama vapore in equilibrio con il suo liquido saturato.
Il numero di molecole che volano fuori dalla superficie unitaria di un liquido in un secondo dipende dalla temperatura del liquido. Il numero di molecole che ritornano dal vapore al liquido dipende dalla concentrazione delle molecole di vapore e dalla loro velocità media moto termico, che è determinato dalla temperatura del vapore. Ne consegue che per una data sostanza, la concentrazione di molecole di vapore all'equilibrio del liquido e del suo vapore è determinata dalla loro temperatura di equilibrio. Lo stabilimento di un equilibrio dinamico tra i processi di evaporazione e condensazione con l'aumento della temperatura avviene a concentrazioni più elevate di molecole di vapore. Poiché la pressione del gas (vapore) è determinata dalla sua concentrazione e temperatura, possiamo concludere: la pressione vapore saturo p 0 di una determinata sostanza dipende solo dalla sua temperatura e non dipende dal volume. Pertanto, isoterme di gas reali sull'aereo ( p, V) contengono sezioni orizzontali corrispondenti a un sistema bifase (Fig. 3.4.1).
All'aumentare della temperatura, la pressione del vapore saturo e la sua densità aumentano e la densità del liquido diminuisce a causa dell'espansione termica. A una temperatura uguale alla temperatura critica T cr per una data sostanza, la densità di vapore e liquido diventano uguali. a T > T scompaiono le differenze fisiche tra il liquido e il suo vapore saturo.
Se isotermicamente comprimere il vapore insaturo a T < T cr, quindi la sua pressione aumenterà fino a quando non diventa uguale alla pressione del vapore saturo. Con un'ulteriore diminuzione del volume, si forma un liquido sul fondo della nave e si stabilisce un equilibrio dinamico tra il liquido e il suo vapore saturo. Con una diminuzione del volume, una parte crescente del vapore si condensa e la sua pressione rimane invariata (sezione orizzontale sull'isoterma). Quando tutto il vapore si trasforma in un liquido, la pressione aumenta bruscamente con un'ulteriore diminuzione del volume a causa della bassa compressibilità del liquido.
Dallo stato gassoso al liquido si può passare bypassando la regione bifase. Per fare ciò, è necessario completare il processo bypassando il punto critico. K. Uno dei possibili processi di questo tipo è mostrato in Fig. 1 da una linea spezzata. ABC.
Nell'aria atmosferica, il vapore acqueo è sempre presente a una pressione parziale. p, che di solito è inferiore alla pressione di vapore saturo p 0. atteggiamento p / p Viene chiamato 0, espresso in percentuale umidità relativa l'aria.
| |
Il vapore insaturo può teoricamente essere descritto usando l'equazione di stato di un gas ideale sotto le consuete restrizioni per i gas reali: la pressione del vapore non dovrebbe essere troppo alta (praticamente p ≤ (10 6–10 7) Pa) e la sua temperatura è superiore a un determinato valore determinato per ciascuna sostanza. Le leggi di un gas ideale possono anche essere applicate approssimativamente a un vapore saturo, a condizione che per ogni temperatura T la pressione p 0 vapore saturo è determinato da curva di equilibriop 0 (T) per una determinata sostanza.
la pressione p 0 il vapore saturo aumenta molto rapidamente con la temperatura T. dipendenza p 0 (T) non può essere ottenuto dalle leggi del gas ideale. La pressione del gas a una concentrazione costante di molecole aumenta in proporzione diretta alla temperatura. In una coppia satura, con l'aumentare della temperatura, aumenta non solo l'energia cinetica media del movimento molecolare, ma anche la loro concentrazione. Pertanto, la pressione del vapore saturo aumenta più rapidamente con l'aumentare della temperatura rispetto alla pressione di un gas ideale a una concentrazione costante di molecole.
L'evaporazione può avvenire non solo dalla superficie, ma anche nel volume del liquido. Ci sono sempre minuscole bolle di gas in un liquido. Se la pressione di vapore saturo del liquido è uguale o maggiore della pressione esterna (cioè la pressione del gas nelle bolle), il liquido evapora all'interno delle bolle. Le bolle riempite di vapore si espandono e galleggiano in superficie. Questo processo è chiamato ebollizione . Pertanto, l'ebollizione di un liquido inizia a una temperatura alla quale la pressione dei suoi vapori saturi diventa uguale alla pressione esterna.
In particolare, alla normale pressione atmosferica, l'acqua bolle ad una temperatura di 100 ° C. Ciò significa che a questa temperatura la pressione del vapore acqueo saturo è di 1 atm. Quando si arrampicano montagne, la pressione atmosferica diminuisce e quindi il punto di ebollizione dell'acqua diminuisce (circa 1 ° C per ogni 300 metri di altitudine). Ad un'altitudine di 7 km, la pressione è di circa 0,4 atm e il punto di ebollizione scende a 70 ° C.
In una nave ermeticamente sigillata, il liquido non può bollire, perché ad ogni valore di temperatura viene stabilito un equilibrio tra il liquido e il suo vapore saturo. Lungo la curva di equilibrio p 0 (T) è possibile determinare il punto di ebollizione di un liquido a varie pressioni.
Il quadro delle isoterme di un gas reale rappresentato nella figura 1 descrive i processi di evaporazione e condensazione, cioè la transizione di fase tra le fasi gassosa e liquida di una sostanza. In effetti, questo quadro è incompleto, poiché qualsiasi sostanza può andare allo stato solido da gassosa e liquida. A una data temperatura T l'equilibrio termodinamico tra due fasi della stessa sostanza è possibile solo con una certa pressione nel sistema. Viene chiamata la dipendenza della pressione di equilibrio dalla temperatura curva di equilibrio di fase . Un esempio è la curva di equilibrio. p 0 (T) vapore saturo e liquido. Se le curve di equilibrio tra le varie fasi di una data sostanza sono costruite sul piano ( p, T), quindi suddividono questo piano in regioni separate in cui la sostanza esiste in uniforme stato di aggregazione - solido, liquido o gassoso (Fig. 2). Rappresentato nel sistema di coordinate ( p, T) vengono chiamate curve di equilibrio diagramma di fase .
Curva 0 Tcorrispondente all'equilibrio tra le fasi solida e gassosa viene chiamato curva di sublimazione. La curva TK viene chiamato l'equilibrio tra liquido e vapore curva di evaporazionelei si interrompe in un punto critico K. La curva TM viene chiamato l'equilibrio tra solido e liquido curva di fusione.
Le curve di equilibrio convergono in un punto Tin cui tutte e tre le fasi possono coesistere in equilibrio. Questo punto è chiamato punto triplo.
Per molte sostanze, la pressione p tr nel punto triplo è inferiore a 1 atm ≈ 10 5 Pa. Tali sostanze si sciolgono quando riscaldate a pressione atmosferica. Ad esempio, il punto triplo dell'acqua (Fig. 3) ha le coordinate T pf \u003d 273,16 K, p mp \u003d 6.02 · 10 2 Pa ed è usato come riferimento per la calibrazione della scala di temperatura assoluta in Kelvin.
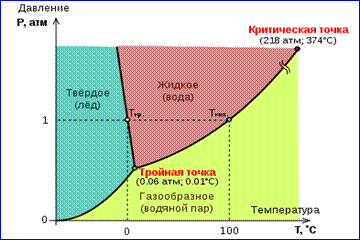 Tuttavia, ci sono anche tali fichi. 3 Diagramma di fase dell'acqua
Tuttavia, ci sono anche tali fichi. 3 Diagramma di fase dell'acqua
sostanze per le quali p mp
supera 1 atm. Quindi per
pressione di anidride carbonica (CO 2)
p mp \u003d 5,11 atm e temperatura
T mp \u003d 216,5 K. Pertanto, a livello atmosferico
tanica di anidride carbonica solida
esistono solo a basse temperature e allo stato liquido a p \u003d 1 atm, non esiste affatto. Allo stato solido, l'anidride carbonica è in equilibrio con il suo vapore a pressione atmosferica ad una temperatura di 173 K o –80 ° C. Questo è un "ghiaccio secco" ampiamente usato che non si scioglie mai, ma evapora solo (sublima).
In condizioni naturali, il vapore è considerato un gas. Potrebbe essere saturato e nena-saturazione, che dipende dalla sua densità, temperatura e pressione.
Il vapore in equilibrio dinamico con il proprio liquido è saturato.
Un equilibrio dinamico tra un liquido e un vapore si verifica quando il numero di molecole emesse dalla superficie libera del liquido è uguale al numero di molecole che vi ritornano.
In una nave aperta, l'equilibrio dinamico è disturbato e il vapore diventa nena-saturazione, poiché un certo numero di molecole evaporano nell'atmosfera e non ritornano al liquido.
Vapore saturo formata in una nave chiusa sopra la superficie libera del liquido.
saturato e desaturato vapore hanno proprietà diverse. Esplorali.
| Fig. 3.2. Compressione isotermica del vapore |
Concentrazione molecolare vapore saturo indipendente dal suo volume.
lasciare vapore insaturoa temperatura T situato nel cilindro con un pistone (Fig. 3.2). Iniziamo a comprimerlo lentamente per fornire un processo isotermico (sezione AB). Innanzitutto, se il vapore è significativamente rarefatto, la dipendenza dalla pressione sul volume corrisponderà alla legge Boyle-Mariotte per un gas ideale: pV \u003d const. Tuttavia, con una diminuzione del volume di vapore insaturo (aumento della sua densità), inizia a osservare una deviazione da esso. Un'ulteriore compressione isotermica del vapore porta al fatto che inizia a condensarsi (punto B), si formano delle gocce di liquido nel cilindro e il vapore si satura. La sua densità, e quindi la concentrazione di molecole, acquisisce il valore massimo per una data temperatura. Sono indipendenti dal volume occupato dal vapore saturo e sono determinati dalla sua pressione e temperatura.
Sotto compressione vapore saturo (Sezione BC) la sua pressione non cambierà ( p \u003d const). Ciò è spiegato dal fatto che con una diminuzione del volume, il vapore saturo si condensa, formando un liquido. La sua quota nel volume della bombola aumenta continuamente e il volume che occupa il vapore saturo diminuisce. Ciò accade fino a quando tutto il vapore saturo passa in uno stato liquido (punto C).
Un'ulteriore diminuzione del volume provoca un rapido aumento della pressione (sezione CC), poiché i liquidi difficilmente si comprimono. Materiale dal sito
Quindi, con compressione isotermica vapore non saturo prima (a bassa densità) mostra le proprietà di un gas ideale. Quando diventa vapore saturato, le sue proprietà obbediscono ad altre leggi. In particolare, a basse temperature, il suo stato è approssimativamente descritto dall'equazione p = nKT,quando la concentrazione di molecole è indipendente dal volume occupato dal gas. Grafico della dipendenza dalla pressione p per volume V, raffigurato in fig. 3.2 viene chiamato isoterma di gas reali.
Isoterme di gas reale caratterizza il suo stato di equilibrio con il liquido. La loro compatibilità consente di determinare la dipendenza della pressione. vapore saturo dalla temperatura.
In questa pagina, materiale sugli argomenti:
Qual è la caratteristica del vapore saturo da un punto di vista molecolare
Qual è la caratteristica di un punto di vista molecolare per una scommessa
Ciò che è caratteristico di un gas saturo dal punto di vista molecolare
Conoscenza scientifica
Vapore saturo
Domande su questo materiale:
I processi di evaporazione e condensazione sono continui e paralleli tra loro.
In una nave aperta, la quantità di fluido diminuisce nel tempo, perché l'evaporazione prevale sulla condensa.
Il vapore che si trova sopra la superficie del liquido quando l'evaporazione prevale sulla condensa o viene chiamato il vapore in assenza di liquido insaturi.
In una nave ermeticamente sigillata, il livello del liquido non cambia nel tempo, perché evaporazione e condensa si annullano a vicenda: quante molecole volano fuori dal liquido, quante ne ritornano nello stesso tempo, si verifica un equilibrio dinamico (mobile) tra il vapore e il suo liquido.
Si chiama vapore che è in equilibrio dinamico con il suo liquido saturi.
A una data temperatura, il vapore saturo di un liquido ha la più alta densità ( ) e crea la massima pressione ( ), che può avere vapore di questo liquido a questa temperatura.
La pressione e la densità del vapore saturo alla stessa temperatura dipendono dalla natura della sostanza: una pressione più alta crea vapore saturo del liquido che evapora più velocemente.Ad esempio, e
Proprietà del vapore insaturo:Le coppie insature obbediscono alle leggi sul gas di Boyle - Marriott, Gay-Lussac, Charles, e l'equazione di stato di un gas ideale può essere applicata a loro.
Proprietà del vapore saturo:1. Con un volume costante all'aumentare della temperatura, la pressione del vapore saturo aumenta, ma non in proporzione diretta (la legge di Charles non viene rispettata), la pressione cresce più velocemente di quella di un gas ideale. , con temperatura crescente ( ) , la massa del vapore aumenta e quindi aumenta la concentrazione di molecole di vapore () e la pressione del vapore saturo si scioglie per due motivi (
3 1 - vapore insaturo (gas ideale);
2 2 - vapore saturo; 3 Vapore insaturo
1 ottenuto da vapore saturo nella stessa
Volume quando riscaldato.
2. La pressione di vapore saturo a temperatura costante non dipende dal volume che occupa.
Con un aumento del volume, la massa di vapore aumenta e la massa del liquido diminuisce (parte del liquido diventa vapore), con una diminuzione del volume di vapore diventa più piccola e più (la parte del vapore diventa liquido), la densità e la concentrazione di molecole di vapore saturo rimangono costanti, quindi, la pressione rimane costante ().
fluido
(sat. vapore + liquido)
Insaturi. vapore
I vapori saturi non obbediscono alle leggi sul gas di Boyle - Marriott, Gay-Lussac, Charles, perché la massa di vapore nei processi non rimane costante e tutte le leggi sui gas sono ottenute per una massa costante. È possibile applicare l'equazione del gas saturo di stato di un gas ideale.
Così, il vapore saturo può essere convertito in vapore insaturo, riscaldandolo a volume costante o aumentando il volume a temperatura costante. Il vapore insaturo può essere convertito in vapore saturo, raffreddandolo a volume costante o comprimendolo a temperatura costante.
Condizione critica
La presenza di una superficie libera in un liquido consente di indicare dove si trova la fase liquida della sostanza e dove si trova quella gassosa. La netta differenza tra il liquido e il suo vapore è spiegata dal fatto che la densità del liquido è molte volte maggiore di quella del vapore. Se il liquido viene riscaldato in un recipiente ermeticamente chiuso, a causa dell'espansione, la sua densità diminuirà e la densità del vapore sopra di essa aumenterà. Ciò significa che la differenza tra il liquido e il suo vapore saturo viene attenuata e scompare completamente a una temperatura sufficientemente elevata. La temperatura alla quale differiscono proprietà fisiche tra il liquido e il suo vapore saturo e le loro densità diventano uguali, chiamatetemperatura critica.
Punto critico
Per la formazione di liquido dal gas, la media energia potenziale l'attrazione delle molecole deve superare la loro energia cinetica media.
Temperatura critica – la temperatura massima alla quale il vapore si trasforma in un liquido. La temperatura critica dipende dalla potenziale energia di interazione delle molecole ed è quindi diversa per i diversi gas. A causa della forte interazione delle molecole d'acqua, il vapore acqueo può essere trasformato in acqua anche a temperatura. Allo stesso tempo, la liquefazione dell'azoto si verifica solo a una temperatura inferiore a \u003d -147˚, perché le molecole di azoto interagiscono debolmente tra loro.
Un altro parametro macroscopico che influenza la transizione vapore-liquido è la pressione. Con l'aumentare della pressione esterna durante la compressione del gas, la distanza media tra le particelle diminuisce, aumenta la forza attrattiva tra loro e, di conseguenza, l'energia potenziale media della loro interazione.
la pressione viene chiamato vapore saturo alla sua temperatura critica critico. Questa è la massima pressione di vapore saturo possibile di una determinata sostanza.
Stato di sostanza con parametri critici viene chiamato critico(punto critico) . Ogni sostanza ha la sua temperatura e pressione critica.
In uno stato critico, il calore specifico della vaporizzazione e il coefficiente di tensione superficiale del liquido svaniscono. A temperature superiori a quelle critiche, anche a pressioni molto elevate, non è possibile convertire il gas in liquido, ad es. al di sopra della temperatura critica, il liquido non può esistere. A temperature supercritiche, è possibile solo lo stato di vapore della sostanza.
La liquefazione del gas è possibile solo a temperature inferiori alla temperatura critica. Per la liquefazione, i gas vengono raffreddati a una temperatura critica, ad esempio mediante espansione adiabatica, e quindi compressi isotermicamente.
ebollizione
Esternamente, il fenomeno si presenta così: Dall'intero volume del liquido, le bolle in rapida crescita salgono in superficie, esplodono in superficie e il vapore viene rilasciato nell'ambiente.
MKT spiega l'ebollizione in questo modo: ci sono sempre bolle d'aria in un liquido; l'evaporazione avviene da loro in un liquido. Il volume chiuso delle bolle è riempito non solo di aria, ma anche di vapore saturo. La pressione di vapore saturo in essi aumenta quando il liquido viene riscaldato, rispetto alla pressione dell'aria. Quando la pressione di vapore saturo nelle bolle in un liquido sufficientemente riscaldato diventa maggiore della pressione esterna, aumentano di volume e la forza di galleggiamento, superando la loro gravità, solleva le bolle in superficie. Le bolle emerse iniziano a scoppiare quando, a una certa temperatura, la pressione di vapore saturo in esse supera la pressione al di sopra del liquido. La temperatura del liquido, alla quale la pressione del suo vapore saturo nelle bolle è uguale o maggiore della pressione esterna sul liquido, è chiamata punto di ebollizione.
Il punto di ebollizione di vari liquidi è diversoperché la pressione di vapore saturo nelle loro bolle viene confrontata con la stessa pressione esterna a temperature diverse. Ad esempio, la pressione di vapore saturo nelle bolle è uguale alla normale pressione atmosferica per acqua a 100 ° C, per mercurio a 357 ° C, per alcool a 78 ° C, per etere a 35 ° C.
Il punto di ebollizione nel processo di ebollizione rimane costante, perché tutto il calore che viene fornito al fluido riscaldato viene speso per vaporizzazione.
Il punto di ebollizione dipende dalla pressione esterna sul liquido: all'aumentare della pressione, la temperatura aumenta; con la pressione decrescente, la temperatura diminuisce. Ad esempio, ad un'altitudine di 5 km sul livello del mare, dove la pressione è 2 volte inferiore a quella atmosferica, il punto di ebollizione dell'acqua è 83 ° C, nelle caldaie dei motori a vapore, dove la pressione del vapore è di 15 atm. (), la temperatura dell'acqua è di circa 200 ° C.
Umidità dell'aria
C'è sempre vapore acqueo nell'aria, quindi possiamo parlare dell'umidità dell'aria, che è caratterizzata dai seguenti valori:
1.Umidità assoluta È la densità del vapore acqueo nell'aria (o la pressione che questo vapore crea (.
L'umidità assoluta non dà un'idea del grado di saturazione dell'aria con il vapore acqueo. La stessa quantità di vapore acqueo a diverse temperature crea una diversa sensazione di umidità.
2.Umidità relativa è il rapporto tra la densità (pressione) del vapore acqueo contenuto nell'aria a una data temperatura e la densità (pressione) del vapore saturo alla stessa temperatura : o
- umidità assoluta a una data temperatura; - densità, pressione di vapore saturo alla stessa temperatura. La densità e la pressione del vapore acqueo saturo a qualsiasi temperatura sono riportate nella tabella. Dalla tabella si può vedere che maggiore è la temperatura dell'aria, maggiore dovrebbe essere la densità e la pressione del vapore acqueo nell'aria in modo che sia saturo.
Conoscendo l'umidità relativa, possiamo capire quanta percentuale di vapore acqueo nell'aria a una data temperatura è lontana dalla saturazione. Se il vapore nell'aria è saturo, allora. se , quindi allo stato di saturazione nell'aria non c'è abbastanza vapore.
Il fatto che il vapore nell'aria si satura è giudicato dalla comparsa di umidità sotto forma di nebbia, rugiada. Viene chiamata la temperatura alla quale il vapore acqueo nell'aria si satura punto di rugiada
Il vapore nell'aria può essere saturato se si aggiunge vapore a causa dell'ulteriore evaporazione del liquido senza modificare la temperatura dell'aria o se la quantità di vapore nell'aria è disponibile, abbassare la sua temperatura.
L'umidità relativa normale, più favorevole per l'uomo è del 40-60%. Di grande importanza è la conoscenza dell'umidità in meteorologia per la previsione meteorologica. Nell'industria della tessitura e della pasticceria, una certa umidità è necessaria per il normale corso del processo. La conservazione di opere d'arte e libri richiede il mantenimento dell'umidità dell'aria al livello richiesto.
Dispositivi per determinare l'umidità:
1. Igrometro a condensazione (consente di determinare il punto di rugiada).
2. Un igrometro per capelli (il principio di funzionamento si basa sulla dipendenza della lunghezza dei capelli senza grasso dall'umidità) misura l'umidità relativa in percentuale.
3. Lo psicrometro è composto da due termometri a secco e ad umido. Il serbatoio del termometro umidificato è avvolto in un panno imbevuto d'acqua. A causa dell'evaporazione dal tessuto, la temperatura di quella inumidita è inferiore a quella di quella asciutta. La differenza nelle letture dei termometri dipende dall'umidità dell'aria circostante: più secca è l'aria, più intensa è l'evaporazione dal tessuto, maggiore è la differenza nelle letture dei termometri e viceversa. Se l'umidità è del 100%, le letture dei termometri sono uguali, ad es. la differenza nelle letture è 0. Una tabella psicrometrica viene utilizzata per determinare l'umidità usando uno psicrometro.
Fusione e cristallizzazione
Quando si scioglie di un corpo solido, la distanza tra le particelle che formano il reticolo cristallino aumenta e il reticolo stesso viene distrutto. È necessario spendere energia nel processo di fusione. Quando un solido viene riscaldato, l'energia cinetica delle molecole vibranti aumenta e, di conseguenza, l'ampiezza delle loro vibrazioni. A una certa temperatura chiamata punto di fusione l'ordine nella disposizione delle particelle nei cristalli è disturbato, i cristalli perdono la loro forma. La sostanza si scioglie, passando da stato solido allo stato liquido.
Durante la cristallizzazionec'è un riavvicinamento delle molecole che formano il reticolo cristallino. La cristallizzazione può avvenire solo quando il liquido emette energia. Quando la sostanza fusa viene raffreddata, l'energia cinetica media e la velocità delle molecole diminuiscono. Le forze gravitazionali possono mantenere le particelle vicino a una posizione di equilibrio. A una certa temperatura chiamata temperatura di indurimento (cristallizzazione),tutte le molecole sono in una posizione di equilibrio stabile, la loro disposizione diventa ordinata - si forma un cristallo.
La fusione solida si verifica alla stessa temperatura alla quale questa sostanza si solidifica
Ogni sostanza ha il suo punto di fusione. Ad esempio, il punto di fusione dell'elio è -269,6 ° C, per il mercurio -38,9 ° C e per il rame 1083 ° C.
Durante il processo di fusione, la temperatura rimane costante. La quantità di calore fornita dall'esterno viene utilizzata per distruggere il reticolo cristallino.
Durante il processo di indurimento, nonostante il fatto che il calore venga rimosso, la temperatura non cambia. L'energia rilasciata durante la cristallizzazione viene utilizzata per mantenere una temperatura costante.
Fino a quando tutta la sostanza non si è sciolta o tutta la sostanza non si è solidificata, ad es. fintanto che le fasi solida e liquida della sostanza esistono insieme, la temperatura non cambia.
TV. + Ebreo. Ebreo. + TV.
, dove è la quantità di calore, è la quantità di calore richiesta per fondere la sostanza rilasciata durante la cristallizzazione di una sostanza con una massa di massa
- calore specifico di fusione– la quantità di calore richiesta per fondere una sostanza che pesa 1 kg in un punto di fusione.
Quanto calore viene speso durante lo scioglimento di una determinata massa di una sostanza, la stessa quantità di calore viene rilasciata durante la cristallizzazione di questa massa.
Chiamato anche calore specifico di cristallizzazione.
Alla temperatura di fusione, l'energia interna di una sostanza allo stato liquido è maggiore dell'energia interna della stessa massa di una sostanza allo stato solido.
Per un gran numero di sostanze, il volume durante la fusione aumenta e la densità diminuisce. All'indurimento, al contrario, il volume diminuisce e la densità aumenta. Ad esempio, cristalli di naftalene solido affogano in naftalene liquido.
Alcune sostanze, ad esempio bismuto, ghiaccio, gallio, ghisa, ecc., Vengono compresse durante la fusione e si espandono quando solidificate. Queste deviazioni dalla regola generale sono spiegate dalle caratteristiche strutturali dei reticoli cristallini. Pertanto, l'acqua è più densa del ghiaccio, il ghiaccio galleggia nell'acqua. L'espansione dell'acqua durante il congelamento porta alla distruzione delle rocce.
Il cambiamento nel volume dei metalli durante la fusione e la solidificazione è essenziale nel settore della fonderia.
L'esperienza lo dimostra variazione della pressione esterna materia solida influenza il punto di fusione di questa sostanza. Per quelle sostanze che si espandono allo scioglimento, un aumento della pressione esterna porta ad un aumento della temperatura di fusione, perché complica il processo di fusione. Se le sostanze vengono compresse durante la fusione, allora per loro un aumento della pressione esterna porta ad una diminuzione della temperatura di fusione, perché aiuta il processo di fusione. Solo un notevole aumento della pressione modifica sensibilmente la temperatura di fusione. Ad esempio, per abbassare la temperatura di fusione del ghiaccio di 1 ° C, la pressione deve essere aumentata di 130 atm. Viene chiamato il punto di fusione di una sostanza a pressione atmosferica normale punto di fusione della sostanza.
Dopo l'ebollizione, la temperatura dell'acqua smette di crescere e rimane invariata fino alla completa evaporazione. La vaporizzazione è il processo di transizione da uno stato liquido a vapore, che ha lo stesso indicatore di temperatura di un liquido in ebollizione. Questa evaporazione è chiamata vapore saturo. Quando tutta l'acqua evapora, ogni successiva aggiunta di calore aumenta la temperatura. Il vapore riscaldato dopo livello saturo è chiamato surriscaldamento. Il vapore saturo è comunemente usato nell'industria per riscaldamento, cottura, asciugatura o altre procedure. Il surriscaldamento viene utilizzato esclusivamente per le turbine. Diversi tipi di vapore hanno diverse energie del potenziale di scambio e questo giustifica il loro uso per scopi completamente diversi.
Vapore come uno dei tre stati fisici
Comprendere le proprietà del vapore può aiutare a comprendere la struttura molecolare e atomica generale di una sostanza, nonché applicare queste conoscenze su ghiaccio, acqua e vapore. Una molecola è la più piccola unità di qualsiasi elemento o composto. A sua volta, è costituito da particelle ancora più piccole chiamate atomi, che definiscono elementi di base come l'idrogeno e l'ossigeno. Combinazioni concrete di questi elementi atomici forniscono una combinazione di sostanze. Uno di questi composti è rappresentato dalla formula chimica H 2 O, le cui molecole sono costituite da 2 atomi di idrogeno e 1 atomo di ossigeno. Anche il carbonio è abbondante; è un componente chiave di tutte le sostanze organiche. La maggior parte dei minerali può esistere in tre stati fisici ( corpo solidoliquido e vapore), che sono chiamati fasi.
Processo di formazione del vapore
Quando la temperatura dell'acqua si avvicina al punto di ebollizione, alcune molecole ottengono abbastanza energia cinetica per raggiungere velocità che consentono loro di separarsi momentaneamente dal liquido nello spazio sopra la superficie prima di tornare. L'ulteriore riscaldamento provoca più eccitazione e aumenta il numero di molecole che desiderano lasciare il liquido. Alla pressione atmosferica, la temperatura di saturazione è di 100 ° C. Il vapore con un punto di ebollizione a questa pressione è chiamato vapore secco saturo. Come la transizione di fase dal ghiaccio all'acqua, anche il processo di evaporazione è reversibile (condensa). Il punto critico è la massima temperatura alla quale l'acqua può trovarsi allo stato liquido. Oltre questo punto, il vapore può essere considerato come gas. Lo stato gassoso è simile a quello diffuso, in cui le molecole hanno una possibilità quasi illimitata di movimento.
Relazione variabile
A una data temperatura, esiste una certa tensione di vapore che esiste in equilibrio con acqua liquida. Se questo indicatore aumenta, il vapore si surriscalda e viene chiamato a secco. Esiste una relazione tra pressione e temperatura: conoscendo un valore, è possibile definirne un altro. Lo stato del vapore è determinato da tre variabili: pressione, temperatura e volume. Il vapore secco saturo è una condizione in cui vapore e acqua possono essere presenti contemporaneamente. In altre parole, ciò accade quando la velocità di vaporizzazione è uguale alla velocità di condensazione.
Vapore saturo e sue proprietà
Quando si discute delle proprietà del vapore saturo, viene spesso confrontato con il gas ideale. Hanno qualcosa in comune o è un semplice errore? Innanzitutto, a un livello costante di temperatura, densità, densità non dipende dal volume. Visivamente, questo può essere immaginato come segue: è necessario ridurre visivamente il volume del serbatoio con il vapore, senza cambiare gli indicatori di temperatura. Il numero di molecole condensate supererà il numero di quelle evaporanti e il vapore tornerà allo stato di equilibrio. Di conseguenza, la densità sarà un parametro costante. In secondo luogo, caratteristiche come la pressione e il volume non dipendono l'una dall'altra. In terzo luogo, tenendo conto dell'invarianza delle caratteristiche volumetriche, la densità delle molecole aumenta all'aumentare della temperatura e diminuisce quando diminuisce. Infatti, quando riscaldato, l'acqua inizia ad evaporare più velocemente. In questo caso, la bilancia verrà sconvolta e non verrà ripristinata fino a quando la densità del vapore non tornerà alla posizione precedente. Durante la condensazione, al contrario, la densità del vapore saturo diminuirà. A differenza di un gas ideale, il vapore saturo non può essere definito un sistema chiuso, poiché è costantemente a contatto con l'acqua.

Benefici del riscaldamento
Saturo è chiamato vapore puro a contatto diretto con acqua liquida. Ha molte caratteristiche che lo rendono un'ottima fonte di energia termica, soprattutto per le alte temperature (sopra i 100 ° C). Alcuni di loro:

Diversi tipi di vapore
Il vapore è la fase gassosa dell'acqua. Usa il calore durante la sua formazione e successivamente rilascia una grande quantità di calore. Quindi lui
può essere usato come sostanza di lavoro per motori termici. Sono note le seguenti condizioni: saturo saturo, secco saturo e surriscaldato. Il vapore saturo è preferibile al vapore surriscaldato come refrigerante negli scambiatori di calore. Quando viene rilasciato nell'atmosfera dai tubi, parte di esso si condensa, si formano nuvole di evaporazione bianca bagnata, contenenti minuscole goccioline d'acqua. Il vapore surriscaldato non si condensa, anche se viene a diretto contatto con l'atmosfera. In uno stato surriscaldato, avrà un maggiore trasferimento di calore a causa dell'accelerazione del movimento delle molecole e della densità inferiore. La presenza di umidità provoca precipitazione, corrosione e una riduzione della durata di servizio delle caldaie o di altre apparecchiature di scambio termico. Pertanto, si preferisce il vapore secco poiché produce più energia e non provoca corrosione.

Secco e saturo: qual è la contraddizione
Molti sono confusi con i termini "secco" e "saturo". Come può qualcosa essere entrambi allo stesso tempo? La risposta sta nella terminologia che usiamo. Il termine "secco" è associato a una mancanza di umidità, cioè "non bagnato". "Saturo" significa "imbevuto", "bagnato", "allagato", "disseminato" e così via. Tutto ciò, sembrerebbe, conferma la contraddizione. Tuttavia, nell'ingegneria del vapore, il termine "saturo" ha un significato diverso e in questo contesto indica lo stato in cui si verifica l'ebollizione. Pertanto, la temperatura alla quale si verifica l'ebollizione è tecnicamente nota come temperatura di saturazione. Il vapore secco in questo contesto non contiene umidità. Se osservi un bollitore in ebollizione, puoi vedere l'evaporazione bianca che esce dal beccuccio del bollitore. In realtà, è una miscela di vapore secco, incolore e vapore umido, contenente gocce d'acqua che riflettono la luce e diventano bianche. Pertanto, il termine "vapore secco saturo" significa che il vapore è disidratato e non surriscaldato. Privo di particelle fluide, è una sostanza allo stato gassoso che non segue le leggi generali sul gas.
Sicuramente molti hanno dovuto guardare una foto di come un contenitore aperto con acqua dopo un po 'risulta essere vuoto. Se lo copri con un coperchio, l'acqua non scompare. Tutti conoscono il motivo: l'acqua evapora. La spiegazione di questo fenomeno è semplice: alcune molecole d'acqua hanno una velocità di movimento sufficientemente elevata da lasciare il liquido. Questo processo di transizione di un liquido in uno stato gassoso è chiamato evaporazione.
Un altro processo, vale a dire la conversione del vapore in liquido, si chiama condensazione. Questi due processi, evaporazione e condensazione, sono in corso: parte dell'acqua evapora, parte condensa. Se il volume sopra la superficie dell'acqua è illimitato, prevale il processo di evaporazione. L'acqua evaporata viene rimossa, come, ad esempio, si verifica sopra la superficie dell'acqua aperta e il liquido passa gradualmente in uno stato gassoso - vapore.
Ma se la quantità di spazio libero sopra il liquido è limitata, allora si presenta una situazione leggermente diversa. L'acqua evaporata non può lasciare questo volume e si forma vapore saturo sopra la superficie dell'acqua. Questo è il nome del vapore in equilibrio, quando la quantità di acqua evaporata e vapore condensato sono uguali. L'acqua non diminuisce e non arriva; uno stato di equilibrio si colloca tra evaporazione e condensa.
Ora sappiamo cos'è il vapore saturo e le sue proprietà potrebbero rivelarsi piuttosto interessanti per noi. Fin dall'inizio, abbiamo determinato che la quantità di spazio libero sopra la superficie del liquido è limitata. Il vapore saturo si è formato su di esso. E se ora per ridurre questo volume libero? Cosa succederà In questo caso, l'equilibrio stabilito tra condensa ed evaporazione è disturbato. Il processo di condensazione inizierà a prevalere, il volume di umidità aumenterà e il vapore diminuirà.
La pressione del vapore a cui è in equilibrio con il liquido viene chiamata Se riduciamo la quantità di spazio libero sopra l'acqua, allora la pressione del vapore aumenta. La conseguenza di ciò sarà la transizione del vapore in acqua. Se ingrandito, occupa meno spazio del vapore saturo. Ne deriva un'altra conclusione: se la temperatura è costante, la pressione di vapore saturo è la stessa per qualsiasi volume.
Esiste un'altra opzione per il comportamento del vapore: il volume sopra la superficie dell'acqua è ridotto e non si verifica la transizione del vapore in liquido. Ciò significa che c'è vapore insaturo sopra la superficie. Successivamente, con una diminuzione del volume a temperatura costante, il vapore inizia a trasformarsi in acqua, il che significa che si è formato vapore saturo. Ma non è stato inutile che fosse stabilita la condizione che tutto avvenisse a temperatura costante. Esiste un certo valore al quale il vapore può trasformarsi in un liquido.
Questo valore è chiamato temperatura critica. La sostanza rimane gas a una temperatura superiore a quella critica, se è inferiore a quella critica, il gas si trasforma in un liquido. Ogni sostanza ha il suo valore e vale la pena notare altre due caratteristiche del vapore: può essere vapore saturo umido o secco. Gocce d'acqua sono presenti nell'umido e il vapore secco non contiene umidità.
C'è anche il cosiddetto vapore surriscaldato - questo è vapore secco con una temperatura sopra critica. In questo caso, si ritiene che non vi sia più alcun liquido nel volume chiuso, ma è presente solo vapore. Il vapore surriscaldato viene utilizzato principalmente in ingegneria ed energia. il vapore surriscaldato ne consente il trasporto mediante linee del vapore e il suo utilizzo. A causa della mancanza di acqua nel vapore surriscaldato, la durata della turbina aumenta.
L'articolo considera ciò che costituisce il vapore saturo, i suoi tipi e proprietà, nonché il processo della sua formazione e trasformazione in un liquido.



