Родился в 1844 году в Вене. Больцман является первопроходцем и первооткрывателем в науке. Его работы и исследования часто были непонятны и отвергнуты обществом. Однако с дальнейшим развитием физики его труды были признаны и впоследствии опубликованы.
Научные интересы ученого охватывали такие фундаментальные области, как физика и математика. С 1867 года он работал преподавателем в ряде высших учебных заведений. В своих исследованиях он установил, что обусловлено хаотическими ударами молекул о стенки сосуда, в котором они находятся, в то время как температура напрямую зависит от скорости движения частиц (молекул), иными словами, от их Следовательно, чем с большей скоростью движутся эти частицы, тем выше и температура. Постоянная Больцмана названа в честь знаменитого австрийского ученого. Именно он внес неоценимый вклад в развитие статической физики.
Физический смысл данной постоянной величины
Постоянная Больцмана определяет связь между такими как температура и энергия. В статической механике она играет главную ключевую роль. Постоянная Больцмана равна k=1,3806505(24)*10 -23 Дж/К. Числа, находящиеся в круглых скобках, указывают на допустимую погрешность значения величины относительно последних цифр. Стоит отметить, что постоянная Больцмана также может быть получена из других физических постоянных. Однако эти вычисления достаточно сложны и трудновыполнимы. Они требуют глубоких познаний не только в области физики, но и
· −1
Постоя́нная Бо́льцмана ( k {\displaystyle k} или k B {\displaystyle k_{\rm {B}}} ) - физическая постоянная , определяющая связь между температурой и энергией . Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно :
k = 1,380 648 52 (79) × 10 − 23 {\displaystyle k=1{,}380\,648\,52(79)\times 10^{-23}} Дж / .Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины.
Связь между температурой и энергией [ | ]
В однородном идеальном газе , находящемся при абсолютной температуре T {\displaystyle T} , энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла , k T / 2 {\displaystyle kT/2} . При комнатной температуре (300 ) эта энергия составляет 2 , 07 × 10 − 21 {\displaystyle 2{,}07\times 10^{-21}} Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в 3 2 k T {\displaystyle {\frac {3}{2}}kT} .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона . В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет пять степеней свободы (при низких температурах, когда не возбуждены колебания атомов в молекуле).
Определение энтропии [ | ]
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z {\displaystyle Z} , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = k ln Z . {\displaystyle S=k\ln Z.}Коэффициент пропорциональности k {\displaystyle k} и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими ( Z {\displaystyle Z} ) и макроскопическими состояниями ( S {\displaystyle S} ), выражает центральную идею статистической механики.
Основное уравнение молекулярно-кинетической теории идеального газа несет в себе более глубокий смысл, чем обычная формула для определения давления иде-ального газа. Для его выяснения запишем это уравнение p = (1 / 3) . nm 0 v̅ 2 в несколько другом виде:
p = (2 / 3) . n . m 0 v̅ 2 / 2 = (2 / 3) . nE̅.
По определению m 0 v̅ 2 / 2 является средней кинетической энергией поступательного движения молекулы.
Давление газа пропорционально сред-ней кинетической энергии поступательного движения молекул.
Приняв во внимание, что n = N / V = N A / V M , уравнение p = (2 / 3) . nE̅ будет иметь вид:
pV M = (2 / 3) . N A E̅ .
С другой стороны, из уравнения состо-яния идеального газа
pV M = RT.
Сравнив оба этих уравнения, получим:
(2 / 3) . N A E̅ = RT.
E̅ = (3 / 2) . (R / N A) . T.
Из этого соотношения вытекает важный вывод:
средняя кинетическая энергия моле-кул газа прямо пропорциональна его абсо-лютной температуре.
Отношение универсальной газовой по-стоянной R к постоянной Авогадро N A так-же есть величина постоянная, которая на-зывается постоянной Больцмана k.
R / N A = k — постоянная Больц-мана .
Физический смысл постоянной Больцмана состоит в том, что она устанавливает соотноше-ние температуры, выраженной в энергетических (Дж) и тер-модинамических (K) единицах.
Постоянная Больцмана является фундамен-тальной константой, значение которой опре-делено довольно точно:
k = 1,38 . 10 -23 Дж / К.
E̅ = (3 / 2) . kT .
Если это выражение подставить в фор-мулу p = (2 / 3) . nE̅ , получим зависимость давления идеального газа от температуры и концентра-ции его молекул:
p = nkT.
Это соотношение подтверждает установ-ленный экспериментально закон Шарля , согласно которому давление данной массы газа прямо пропорционально абсо-лютной температуре: p ~ T. Из него следует также, что
при одинаковых давлении и тем-пературе концентрация молекул во всех газах одинакова.
Таким образом, температура как макро-параметр системы характеризует состояние ее термодинамического равновесия. Материал с сайта
Приближение температуры те-ла к абсолютному нулю ведет к уменьшению средней кинети-ческой энергии молекул. При абсолютном нуле их поступа-тельное движение прекращает-ся. Современная наука отри-цает возможность достижения абсолютного нуля температур .
В зависимости от избранной шкалы тем-пература измеряется в градусах Цельсия или Фаренгейта либо в кельвинах. Как микро-параметр системы температура определяет среднюю кинетическую энергию значитель-ного количества молекул; как ее мера она измеряется в джоулях. Коэффициентом свя-зи между этими ее определениями является постоянная Больцмана .
Несмотря на то, что вывод о связи температуры со средней кинетической энергией моле-кул установлен для газов, он справедлив также для жидкос-тей и твердых тел.
На этой странице материал по темам:
Молекулярно-кинетическое истолкование явления осмоса
Постоянные в молекулярно-кинетической физике
Молекулярно-кинетическое толкование температуры формулы
-
Больцман Людвиг (1844-1906) - великий австрийский физик, один из основоположников молекулярно-кинетической теории. В трудах Больцмана молекулярно-кинетическая теория впервые предстала как логически стройная, последовательная физическая теория. Больцман дал статистическое истолкование второго закона термодинамики. Им много сделано для развития и популяризации теории электромагнитного поля Максвелла. Борец по натуре, Больцман страстно отстаивал необходимость молекулярного истолкования тепловых явлений и принял на себя основную тяжесть борьбы с учеными, отрицавшими существование молекул.
В уравнение (4.5.3) входит отношение универсальной газовой постоянной R к постоянной Авогадро N A . Это отношение одинаково для всех веществ. Оно называется постоянной Больцмана, в честь Л. Больцмана, одного из основателей молекулярно-кинетической теории.
Постоянная Больцмана равна:
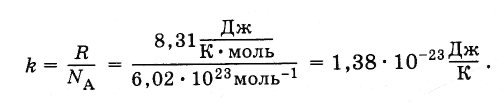 (4.5.4)
(4.5.4)Уравнение (4.5.3) с учетом постоянной Больцмана записывается так:
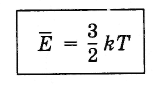 (4.5.5)
(4.5.5)Физический смысл постоянной Больцмана
Исторически температура была впервые введена как термодинамическая величина, и для нее была установлена единица измерения - градус (см. § 3.2). После установления связи температуры со средней кинетической энергией молекул стало очевидным, что температуру можно определять как среднюю кинетическую энергию молекул и выражать ее в джоулях или эргах, т. е. вместо величины Т ввести величину Т* так, чтобы
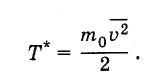
Определенная таким образом температура связана с температурой, выражаемой в градусах, следующим образом:
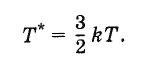
Поэтому постоянную Больцмана можно рассматривать как величину, связывающую температуру, выражаемую в энергетических единицах, с температурой, выраженной в градусах.
Зависимость давления газа от концентрации его молекул и температуры
Выразив Е из соотношения (4.5.5) и подставив в формулу (4.4.10), получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:
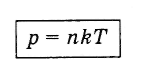 (4.5.6)
(4.5.6)Из формулы (4.5.6) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же.
Отсюда следует закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Средняя кинетическая энергия поступательного движения молекул прямо пропорциональна абсолютной температуре. Коэффициент пропорциональности - постоянную Больцмана k = 10 -23 Дж/К - надо запомнить.
§ 4.6. Распределение максвелла
В большом числе случаев знание одних средних значений физических величин недостаточно. Например, знание среднего роста людей не позволяет планировать выпуск одежды различных размеров. Надо знать приблизительное число людей, рост которых лежит в определенном интервале. Точно так же важно знать числа молекул, имеющих скорости, отличные от среднего значения. Максвелл первым нашел, как эти числа можно определять.
Вероятность случайного события
В §4.1 мы уже упоминали, что для описания поведения большой совокупности молекул Дж. Максвелл ввел понятие вероятности.
Как неоднократно подчеркивалось, в принципе невозможно проследить за изменением скорости (или импульса) одной молекулы на протяжении большого интервала времени. Нельзя также точно определить скорости всех молекул газа в данный момент времени. Из макроскопических условий, в которых находится газ (определенный объем и температура), не вытекают с необходимостью определенные значения скоростей молекул. Скорость молекулы можно рассматривать как случайную величину, которая в данных макроскопических условиях может принимать различные значения, подобно тому как при бросании игральной кости может выпасть любое число очков от 1 до 6 (число граней кости равно шести). Предсказать, какое число очков выпадет при данном бросании кости, нельзя. Но вероятность того, что выпадет, скажем, пять очков, поддается определению.
Что же такое вероятность наступления случайного события? Пусть произведено очень большое число N испытаний (N - число бросаний кости). При этом в N " случаях имел место благоприятный исход испытаний (т. е. выпадение пятерки). Тогда вероятность данного события равна отношению числа случаев с благоприятным исходом к полному числу испытаний при условии, что это число сколько угодно велико:
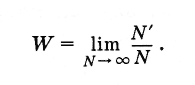 (4.6.1)
(4.6.1)Для симметричной кости вероятность любого выбранного числа очков от 1 до 6 равна .
Мы видим, что на фоне множества случайных событий обнаруживается определенная количественная закономерность, появляется число. Это число - вероятность - позволяет вычислять средние значения. Так, если произвести 300 бросаний кости, то среднее число выпаданий пятерки, как это следует из формулы (4.6.1), будет равно: 300 ·= 50, причем совершенно безразлично, бросать 300 раз одну и ту же кость или одновременно 300 одинаковых костей.
Несомненно, что поведение молекул газа в сосуде гораздо сложнее движения брошенной игральной кости. Но и здесь можно надеяться обнаружить определенные количественные закономерности, позволяющие вычислять статистические средние, если только ставить задачу так же, как в теории игр, а не как в классической механике. Нужно отказаться от неразрешимой задачи определения точного значения скорости молекулы в данный момент и попытаться найти вероятность того, что скорость имеет определенное значение.
