Въпрос 1. Какво обяснява разнообразието от белтъчни функции?
Разнообразието от функции на протеините се обяснява с разнообразието на тяхната структура. Както знаете, протеините могат да съдържат 20 вида аминокиселини. Но различни комбинации от аминокиселинни остатъци в полипептидна молекула (броят на техните имена и последователност) осигуряват огромно разнообразие от протеини. В допълнение, протеините могат да имат пространствена структурамолекули. Всичко това допринася за факта, че протеините изпълняват много функции.
Въпрос 2. Какви функции на протеините знаете?
Строителна (пластична) функция. Протеините са структурен компонент на биологичните мембрани и клетъчните органели, а също така са част от поддържащите структури на тялото, косата, ноктите и кръвоносните съдове.
Ензимна функция. Протеините служат като ензими, т.е. биологични катализатори, които ускоряват скоростта на био химически реакциидесетки и стотици милиони пъти. Пример за това е амилазата, която разгражда нишестето до монозахариди.
Контрактилна (моторна) функция. Извършва се от специални контрактилни протеини, които осигуряват движението на клетките и вътре клетъчни структури. Благодарение на тях хромозомите се движат по време на клетъчното делене, а флагелите и ресничките движат протозойните клетки. Съкратителните свойства на протеините актин и миозин са в основата на мускулната функция.
Транспортна функция. Протеините участват в транспорта на молекули и йони в тялото (хемоглобинът пренася кислород от белите дробове до органите и тъканите, серумният албумин участва в транспорта на мастни киселини).
Защитна функция. Състои се от защита на тялото от увреждане и нахлуване на чужди протеини и бактерии. Протеините на антителата, произведени от лимфоцитите, създават защита на тялото срещу чужда инфекция; тромбинът и фибринът участват в образуването на кръвен съсирек, като по този начин помагат на тялото да избегне големи загуби на кръв.
Регулаторна функция. Извършва се от хормонални протеини. Те участват в регулирането на дейността на клетките и всички жизненоважни процеси в организма. Така инсулинът регулира нивата на кръвната захар и ги поддържа на определено ниво.
Сигнална функция. Протеините, вградени в клетъчната мембрана, са способни да променят структурата си в отговор на дразнене. Така сигналите се предават от външната среда в клетката.
Енергийна функция. Реализира се от протеини изключително рядко. При пълно разграждане на 1 g протеин може да се освободи 17,6 kJ енергия. Протеините обаче са много ценно съединение за организма. Следователно разграждането на протеина обикновено се случва до аминокиселини, от които се изграждат нови полипептидни вериги.
Хормоналните протеини регулират дейността на клетката и всички жизнени процеси в организма. По този начин в човешкото тяло соматотропинът участва в регулирането на растежа на тялото, инсулинът поддържа нивото на кръвната захар на постоянно ниво.
Въпрос 4. Каква функция изпълняват ензимните протеини?
Ензимите са биологични катализатори, тоест ускоряват химичните реакции стотици милиони пъти. Ензимите имат строга специфичност за веществото, което реагира. Всяка реакция се катализира от собствен ензим.
Въпрос 5: Защо протеините рядко се използват като източник на енергия?
Аминокиселинните протеинови мономери са ценни суровини за изграждането на нови протеинови молекули. Следователно пълното разграждане на полипептидите до неорганични веществарядко се случва. Следователно, енергийната функция, която се състои в освобождаването на енергия, когато пълно разцепване, се извършва от протеини доста рядко.
Търсено на тази страница:
- какво обяснява разнообразието от функции на протеините
- какви функции на протеините знаете?
- защо протеините рядко се използват като източник на енергия
- каква функция изпълняват ензимните протеини?
- Каква е функцията на протеините и ензимите?
История на изследването
Антоан Франсоа дьо Фуркроа, основател на изследването на протеинитеПротеините са идентифицирани като отделен клас биологични молекули през 18 век в резултат на работата на френския химик Антоан Фуркроа и други учени, които отбелязват способността на протеините да коагулират (денатурират) под въздействието на топлина или киселини. По това време са изследвани протеини като албумин ("белтък от яйца"), фибрин (протеин от кръвта) и глутен от пшенично зърно. Холандският химик Герит Мулдер анализира състава на протеините и предположи, че почти всички протеини имат подобна емпирична формула. Терминът "протеин" за такива молекули е предложен през 1838 г. от шведския химик Якоб Берцелиус. Мълдер определя и продуктите от разрушаването на протеините - аминокиселините, като за една от тях (левцин) с малка степен на грешка определя молекулното тегло - 131 далтона. През 1836 г. Мълдер предлага първия модел химическа структурапротеини. Въз основа на теорията за радикалите той формулира концепцията за минималната структурна единица на протеиновия състав, C 16 H 24 N 4 O 5, която беше наречена „протеин“, а теорията беше наречена „протеинова теория“. С натрупването на нови данни за протеините теорията започва многократно да бъде критикувана, но до края на 1850 г., въпреки критиките, тя все още се счита за общоприета.
ДО края на 19 веквекове са изследвани повечето от аминокиселините, които изграждат протеините. През 1894 г. немският физиолог Албрехт Косел излага теория, според която аминокиселините са основните структурни елементи на протеините. В началото на 20 век немският химик Емил Фишер експериментално доказва, че протеините се състоят от аминокиселинни остатъци, свързани с пептидни връзки. Той също така извърши първия анализ на аминокиселинната последователност на протеин и обясни феномена на протеолизата.
Централната роля на протеините в организмите обаче не е призната до 1926 г., когато американският химик Джеймс Съмнър (по-късно носител на Нобелова награда) показва, че ензимът уреаза е протеин.
Трудността при изолирането на чисти протеини ги прави трудни за изследване. Следователно, първите изследвания са проведени с помощта на тези полипептиди, които могат да бъдат пречистени в големи количества, тоест кръвни протеини, кокоши яйца, различни токсини, както и храносмилателни/метаболитни ензими, освободени след клане. В края на 1950 г. компанията Armor Hot Dog Co.успя да пречисти килограм панкреатична рибонуклеаза A от говеда, която се превърна в експериментален обект за много учени.
Идеята, че вторичната структура на протеините е резултат от водородна връзка между аминокиселините, е предложена от Уилям Астбъри през 1933 г., но Линус Полинг се счита за първия учен, който успешно предсказва вторичната структура на протеините. По-късно Валтер Каузман, разчитайки на работата на Кай Линдерстрьом-Ланг, направи значителен принос за разбирането на законите за образуване на третичната структура на протеините и ролята на хидрофобните взаимодействия в този процес. През 1949 г. Фред Сангер определя аминокиселинната последователност на инсулина, демонстрирайки по този начин, че протеините са линейни полимери на аминокиселини, а не техните разклонени (като някои захари) вериги, колоиди или циклоли. Първите протеинови структури, базирани на рентгенова дифракция на едноатомно ниво, са получени през 60-те години на миналия век и чрез ЯМР през 80-те години. През 2006 г. Protein Data Bank съдържа приблизително 40 000 протеинови структури.
През 21 век изследванията на протеините преминаха на качествено ново ниво, когато се изучават не само отделни пречистени протеини, но и едновременни промени в количеството и пост-транслационни модификации голям бройпротеини на отделни клетки, тъкани или организми. Тази област на биохимията се нарича протеомика. Използвайки методите на биоинформатиката, стана възможно не само да се обработват данни от рентгеноструктурен анализ, но и да се предскаже структурата на протеин въз основа на неговата аминокиселинна последователност. Понастоящем криоелектронната микроскопия на големи протеинови комплекси и прогнозирането на малки протеини и домейни на големи протеини с помощта на компютърни програми се доближават до точността на разделяне на структури на атомно ниво.
Свойства
Размерът на протеина може да се измери в брой аминокиселини или в далтони (молекулно тегло), по-често поради относително големия размер на молекулата в нейните производни единици, килодалтони (kDa). Протеините на дрождите се състоят средно от 466 аминокиселини и имат молекулно тегло 53 kDa. Най-големият протеин, известен в момента, титин, е компонент на мускулните саркомери; молекулно теглонеговите различни изоформи варират от 3000 до 3700 kDa, той се състои от 38 138 аминокиселини (в човешкия солис мускул).
Протеините се различават по своята разтворимост във вода, но повечето протеини се разтварят в нея. Неразтворимите включват например кератин (протеинът, от който са изградени косата, козината на бозайниците, перата на птиците и др.) и фиброинът, който е част от коприната и паяжините. Протеините също се делят на хидрофилни и хидрофобни. Хидрофилните включват повечето протеини на цитоплазмата, ядрото и междуклетъчно вещество, включително неразтворим кератин и фиброин. Хидрофобните включват повечето от протеините, които изграждат биологичните мембрани на интегралните мембранни протеини, които взаимодействат с хидрофобните липиди на мембраната (тези протеини обикновено имат малки хидрофилни области).
Денатурация

Необратима денатурация на белтък от пилешко яйце под въздействието на висока температура
Като цяло, протеините запазват структурата и следователно физикохимичните свойства, като разтворимост, при условия като температура и температура, към които организмът е адаптиран. Промяната на тези условия, като нагряване или третиране на протеина с киселина или основа, води до загуба на кватернерната, третичната и вторичната структура на протеина. Загубата на протеин (или друг биополимер) от естествената му структура се нарича денатурация. Денатурацията може да бъде пълна или частична, обратима или необратима. Най-известният случай на необратима денатурация на протеини в ежедневието е приготвянето на пилешко яйце, когато под въздействието на висока температура прозрачният протеин овалбумин, разтворим във вода, става плътен, неразтворим и непрозрачен. Денатурацията в някои случаи е обратима, както в случая на утаяване (утаяване) на водоразтворими протеини с помощта на амониеви соли и се използва като метод за тяхното пречистване.
Прости и сложни протеини
В допълнение към пептидните вериги, много протеини съдържат и неаминокиселинни фрагменти; според този критерий протеините се класифицират в две големи групи - прости и сложни протеини(протеиди). Прости протеинисъдържат само аминокиселинни вериги; сложните протеини съдържат и неаминокиселинни фрагменти. Тези непротеинови фрагменти в сложни протеини се наричат „простетични групи“. В зависимост от химическа природаСред сложните протеини се разграничават следните класове протетични групи:
- Гликопротеини, съдържащи ковалентно свързани въглехидратни остатъци като простетична група и техния подклас - протеогликани, с мукополизахаридни протетични групи. Хидроксилните групи на серин или треонин обикновено участват в образуването на връзки с въглехидратни остатъци. Повечетоизвънклетъчни протеини, по-специално имуноглобулини - гликопротеини. В протеогликаните въглехидратната част съставлява ~95%; те са основният компонент на междуклетъчния матрикс.
- Липопротеини, съдържащи нековалентно свързани липиди като протетична част. Липопротеините се образуват от аполипопротеинови протеини, които свързват липидите с тях и изпълняват функцията на липиден транспорт.
- Металопротеини, съдържащи не-хем координирани метални йони. Сред металопротеините има протеини, които изпълняват складови и транспортни функции (например съдържащ желязо феритин и трансферин) и ензими (например съдържаща цинк карбоанхидраза и различни супероксиддисмутази, съдържащи йони на мед, манган, желязо и други метали като активни центрове)
- Нуклеопротеините, съдържащи нековалентно свързана ДНК или РНК, по-специално хроматинът, който изгражда хромозомите, е нуклеопротеин.
- Фосфопротеини, съдържащи ковалентно свързани остатъци от фосфорна киселина като простетична група. Хидроксилните групи на серин или треонин участват в образуването на естерна връзка с фосфат; по-специално млечният казеин е фосфопротеин.
- Хромопротеините са общото наименование за сложни протеини с цветни протетични групи от различно химично естество. Те включват много протеини с метал-съдържаща порфиринова простетична група, които изпълняват различни функции - хемопротеини (протеини, съдържащи хем - хемоглобин, цитохроми и др.) като простетична група, хлорофили; флавопротеини с флавинова група и др.
Структура на протеина
- Третична структура- пространствена структура на полипептидната верига (набор от пространствени координати на атомите, които изграждат протеина). Конструктивно се състои от елементи вторична структура, стабилизиран чрез различни видове взаимодействия, в които хидрофобните взаимодействия играят критична роля. В стабилизирането на третичната структура участват:
- ковалентни връзки (между два цистеинови остатъка - дисулфидни мостове);
- йонни връзки между противоположно заредени странични групи от аминокиселинни остатъци;
- водородни връзки;
- хидрофилно-хидрофобни взаимодействия. Когато взаимодейства със заобикалящите водни молекули, протеиновата молекула „се стреми“ да се сгъне, така че неполярните странични групи от аминокиселини да бъдат изолирани от воден разтвор; на повърхността на молекулата се появяват полярни хидрофилни странични групи.
- Кватернерна структура (или субединица, домен) - относителното разположение на няколко полипептидни вериги като част от един протеинов комплекс. Протеиновите молекули, които изграждат протеин с кватернерна структура, се образуват отделно върху рибозомите и едва след завършване на синтеза образуват обща супрамолекулна структура. Протеин с кватернерна структура може да съдържа както еднакви, така и различни полипептидни вериги. В стабилизирането на кватернерната структура участват същите видове взаимодействия, както и в стабилизирането на третичната структура. Супрамолекулните протеинови комплекси могат да се състоят от десетки молекули.
Протеинова среда
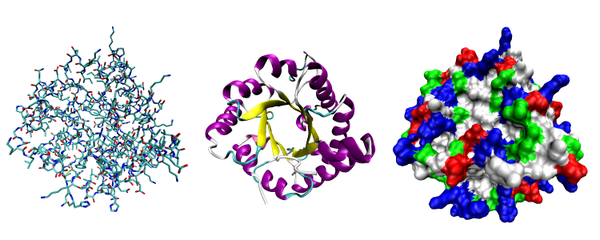
Различни начини за изобразяване на триизмерната структура на протеин, използвайки примера на ензима триозофосфат изомераза. Отляво е модел на „ядро“, изобразяващ всички атоми и връзките между тях; Цветовете показват елементите. Средата показва структурните мотиви, α-спирали и β-листове. Вдясно е контактната повърхност на протеина, конструирана, като се вземат предвид ван дер Ваалсовите радиуси на атомите; Цветовете показват характеристиките на активността на районите
от общ типСтруктурата на протеините може да бъде разделена на три групи:
Образуване и поддържане на протеиновата структура в живите организми
Способността на протеините да възстановяват правилната си триизмерна структура след денатурация е довела до хипотезата, че цялата информация за крайната структура на протеина се съдържа в неговата аминокиселинна последователност. Сега общоприетата теория е, че в резултат на еволюцията стабилната конформация на протеин има минимална свободна енергия в сравнение с други възможни конформации на този полипептид.
В клетките обаче има група протеини, чиято функция е да осигурят възстановяването на протеиновата структура след увреждане, както и създаването и дисоциацията на протеинови комплекси. Тези протеини се наричат шаперони. Концентрацията на много шаперони в клетката се увеличава с рязко повишаване на температурата среда, така че те принадлежат към групата на Hsp. протеини на топлинен шок- протеини на топлинен шок). Значението на нормалното функциониране на шапероните за функционирането на тялото може да се илюстрира с примера на шаперона α-кристалин, който е част от човешката очна леща. Мутациите в този протеин водят до помътняване на лещата поради агрегация на протеини и в резултат на това до катаракта.
Синтез на протеини
Химичен синтез
Късите протеини могат да бъдат синтезирани по химичен път с помощта на група методи, които използват органичен синтез - например химическо лигиране. Повечето методи за химичен синтез протичат в посока от С-терминал към N-терминал, за разлика от биосинтезата. По този начин е възможно да се синтезира къс имуногенен пептид (епитоп), който се използва за получаване на антитела чрез инжектиране в животни или чрез производство на хибридоми; химическият синтез също се използва за получаване на инхибитори на определени ензими. Химическият синтез прави възможно въвеждането на изкуствени аминокиселини, тоест аминокиселини, които не се срещат в обикновените протеини - например прикрепване на флуоресцентни маркери към страничните вериги на аминокиселините. Въпреки това химични методисинтезът е неефективен, когато протеините са по-дълги от 300 аминокиселини; в допълнение, изкуствените протеини могат да имат неправилна третична структура и аминокиселините на изкуствените протеини нямат пост-транслационни модификации.
Биосинтеза на протеини
Универсален метод: рибозомен синтез
Протеините се синтезират от живи организми от аминокиселини въз основа на информация, кодирана в гените. Всеки протеин се състои от уникална последователност от аминокиселини, която се определя от нуклеотидната последователност на гена, кодиращ протеина. Генетичният код е изграден от трибуквени „думи“, наречени кодони; всеки кодон е отговорен за свързването на една аминокиселина към протеина: например комбинацията AUG съответства на метионин. Тъй като ДНК се състои от четири вида нуклеотиди, тогава общ бройвъзможните кодони са 64; и тъй като протеините използват 20 аминокиселини, много аминокиселини са определени от повече от един кодон. Гените, кодиращи протеини, първо се транскрибират в нуклеотидни последователности на информационна РНК (mRNA) от РНК полимеразни протеини.
Процесът на протеинов синтез на базата на иРНК молекула се нарича транслация. По време на началния етап на протеинова биосинтеза, иницииране, обикновено кодонът на метионин се разпознава от малката субединица на рибозомата, към която е прикрепена РНК за трансфер на метионин (тРНК) с помощта на фактори на иницииране на протеин. След разпознаване на началния кодон, голямата субединица се присъединява към малката субединица и започва вторият етап на транслацията, елонгацията. При всяко движение на рибозомата от 5" до 3" края на иРНК, един кодон се чете чрез образуване на водородни връзки между три нуклеотида (кодон) на иРНК и неговия комплементарен антикодон трансферна РНК, към който е прикрепена съответната аминокиселина. Синтезът на пептидна връзка се катализира от рибозомна РНК (рРНК), която образува пептидил трансферазния център на рибозомата. Рибозомната РНК катализира образуването пептидна връзкамежду последната аминокиселина на нарастващия пептид и аминокиселината, прикрепена към тРНК, позиционирайки азотните и въглеродните атоми в позиция, благоприятна за протичане на реакцията. Аминоацил-тРНК синтетазните ензими прикрепват аминокиселини към техните тРНК. Третият и последен етап на транслацията, терминацията, настъпва, когато рибозомата достигне стоп кодона, след което протеиновите терминиращи фактори хидролизират последната тРНК от протеина, спирайки неговия синтез. Така в рибозомите протеините винаги се синтезират от N- към С-края.
Нерибозомен синтез
Посттранслационна модификация на протеини
След като транслацията приключи и протеинът се освободи от рибозомата, аминокиселините в полипептидната верига претърпяват различни химични модификации. Примери за посттранслационна модификация са:
- добавяне на различни функционални групи (ацетил, метил и фосфатни групи);
- добавяне на липиди и въглеводороди;
- промяна на стандартните аминокиселини в нестандартни (образуване на цитрулин);
- образуване на структурни промени (образуване на дисулфидни мостове между цистеините);
- отстраняване на част от протеина както в началото (сигнална последователност), така и в в някои случаив средата (инсулин);
- добавяне на малки протеини, които влияят на разграждането на протеини (сумоилиране и убиквитиниране).
В този случай видът на модификацията може да бъде или универсален (добавянето на вериги, състоящи се от убиквитинови мономери, служи като сигнал за разграждането на този протеин от протеазомата), или специфичен за даден протеин. В същото време един и същ протеин може да претърпи множество модификации. Така хистоните (протеини, които изграждат хроматина в еукариотите) могат да претърпят до 150 различни модификации при различни условия.
Функции на протеините в организма
Подобно на други биологични макромолекули (полизахариди, липиди) и нуклеинови киселини, протеините са основни компоненти на всички живи организми; те участват в повечето жизнени процеси на клетката. Протеините извършват метаболизма и енергийните трансформации. Протеините са част от клетъчни структури - органели, секретирани в извънклетъчното пространство за обмен на сигнали между клетките, хидролиза на храната и образуване на междуклетъчно вещество.
Трябва да се отбележи, че класификацията на протеините според тяхната функция е доста произволна, тъй като при еукариотите един и същ протеин може да изпълнява няколко функции. Добре проучен пример за такава гъвкавост е лизил-тРНК синтетазата, ензим от класа на аминоацил-тРНК синтетазите, който не само прикрепя лизин към тРНК, но също така регулира транскрипцията на няколко гена. Протеините изпълняват много функции благодарение на тяхната ензимна активност. Така ензимите са моторният протеин миозин, регулаторните протеини протеин кинази, транспортният протеин натриево-калиева аденозин трифосфатаза и др.
Каталитична функция
Най-известната роля на протеините в тялото е катализирането на различни химични реакции. Ензимите са група протеини, които имат специфични каталитични свойства, т.е. всеки ензим катализира една или повече подобни реакции. Ензимите катализират реакциите на разграждане на сложни молекули (катаболизъм) и техния синтез (анаболизъм), както и репликацията и възстановяването на синтеза на ДНК и матрицата на РНК. Известни са няколко хиляди ензима; Сред тях, като пепсин, разграждат протеините по време на храносмилането. По време на процеса на посттранслационна модификация някои ензими добавят или премахват химични групи върху други протеини. Известно е, че около 4000 реакции се катализират от протеини. Ускоряването на реакцията в резултат на ензимната катализа понякога е огромно: например реакция, катализирана от ензима оротат карбоксилаза, протича 10 17 пъти по-бързо от некатализирана (78 милиона години без ензим, 18 милисекунди с участието на ензим). Молекулите, които се свързват с ензим и се променят от реакцията, се наричат субстрати.
Въпреки че ензимите обикновено са съставени от стотици аминокиселини, само малка част от тях взаимодействат със субстрата, а още по-малък брой - средно 3-4 аминокиселини, често разположени далеч една от друга в първичната аминокиселинна последователност - са директно участващи в катализа. Частта от ензима, която прикрепя субстрата и съдържа каталитичните аминокиселини, се нарича активно място на ензима.
Структурна функция
Защитна функция
Има няколко вида защитни функции на протеините:
Регулаторна функция
Много процеси в клетките се регулират от протеинови молекули, които не служат нито като източник на енергия, нито като строителен материалза клетката. Тези протеини регулират транскрипцията, транслацията, сплайсинга, както и активността на други протеини и т.н. Протеините изпълняват своята регулаторна функция или чрез ензимна активност (например протеин киназа), или чрез специфично свързване с други молекули, което обикновено засяга взаимодействието с тези молекули ензими.
Хормоните се пренасят в кръвта. Повечето животински хормони са протеини или пептиди. Свързването на хормон с рецептор е сигнал, който предизвиква отговор в клетката. Хормоните регулират концентрациите на вещества в кръвта и клетките, растежа, възпроизводството и други процеси. Пример за такива протеини е инсулинът, който регулира концентрацията на глюкоза в кръвта.
Клетките взаимодействат една с друга с помощта на сигнални протеини, предавани през междуклетъчното вещество. Такива протеини включват, например, цитокини и растежни фактори.
Транспортна функция
Резервна (резервна) функция на протеините
Тези протеини включват така наречените резервни протеини, които се съхраняват като източник на енергия и материя в растителни семена и животински яйца; протеините на третичните черупки на яйцата (овалбумин) и основният протеин на млякото (казеин) също изпълняват главно хранителна функция. Редица други протеини се използват в тялото като източник на аминокиселини, които от своя страна са биологични прекурсори активни веществарегулиране на метаболитните процеси.
Рецепторна функция
Протеиновите рецептори могат да бъдат разположени в цитоплазмата или да бъдат вградени в клетъчната мембрана. Една част от рецепторната молекула възприема
Протеините (протеините, както и полипептидите) са органична материя, които са изградени от аминокиселини. В много случаи в образуването им участват около 20 аминокиселини. Именно техните комбинации създават много полипептиди.
Функциите на протеините в организма са много разнообразни. На първо място, протеините са най-важният компонент на храненето. Освен това те играят значителна роля в метаболизма. Без протеини нормалното функциониране на тялото е невъзможно: техният дефицит (както и излишъкът) неизбежно води до развитие на сериозни заболявания. Нека разгледаме предназначението на протеините в човешкото тяло.
Каталитична функция на протеините
Това е най-известната функция на протеина. Помага за ускоряване на различни химични реакции. Белтъчните елементи, които играят тази роля, се наричат ензими или ензими и се намират във всички живи клетки. Без тях би било невъзможно да се трансформира химикалипри други при нормални за тялото температурни условия. Катализаторите спомагат за увеличаване на скоростта на реакцията.
Има няколко вида ензими:
- активатори на окислителни и редукционни реакции;
- катализатори за транспортиране на химични групи от една субстратна молекула към друга;
- активатори на хидролиза;
- лиази – катализатори за разкъсване на химични връзки без хидролиза;
- активатори на структурни трансформации в молекулата на субстрата;
- катализатори за образуване химични връзкимежду субстрати, включващи дифосфатна АТФ връзка.
Структурна функция
Същността на структурната функция на протеините в тялото е следната. Връзките придават форма на всяка клетка, без тях тя не би могла да възникне. Той е в състояние да поддържа формата си благодарение на мономерите актин и тубулин, а колагенът и еластинът са основните компоненти на междуклетъчното вещество.
Кератинът, който също има структурна функция, е важна част от косата и ноктите. Ето защо, ако неговият синтез е нарушен, красотата на къдриците се губи и ноктите се чупят. Птичи пера, животински нокти и дори някои видове черупки също са направени от кератин.
Значението на тази функция на протеините е огромно. В крайна сметка протеините участват в образуването не само на клетъчни стени, но и на клетъчни органели. Благодарение на тази функция се осигурява формата на определена тъкан, както и очертанията на тялото.
Защитна функция
Без него е трудно да си представим нормалното функциониране на всеки организъм. В този случай протеините играят няколко роли.
На първо място, това е физическата защита на клетката. Осигурява се от колаген, който подпомага образуването на междуклетъчно вещество. Фибриногенът и фибринът също могат да бъдат класифицирани като такава група протеини, тъй като те спомагат за нормалното съсирване на кръвта.
Химическата защита е изключително важна за осигуряване на детоксикация на организма – извеждане на вредните вещества от него. Такива ензими се намират главно в черния дроб. Те разграждат отровите до състояние, което улеснява активното им елиминиране през органите на отделителната система.
Невъзможно е да си представим функционирането на тялото без имунна защита. При атакуване на чужди тела и тяхното неутрализиране активно участиеПриемат протеини. Антителата помагат за неутрализиране на чужди бактерии и вируси.
Нарушаването на защитната система е опасно за тялото, тъй като в този случай враждебните микроби проникват в него, допринасяйки за появата на инфекциозни и възпалителни процеси.
Сигнална и регулаторна способност
Тази функция се разбира като участие на полипептиди в регулирането на определени процеси в клетката. Това се дължи на факта, че тези вещества могат да приемат и предават информация.
Има няколко протеина, способни да изпълняват регулаторна функция.
- Рецептори. Това са полипептиди, които възприемат всякакви сигнали.
- Сигнални протеини. Това са вещества, които осъществяват междуклетъчна сигнализация. Те включват предимно хормони. Те могат да действат само върху онези клетки, които имат подходящи рецептори.
- Протеини, които регулират вътреклетъчните процеси. Тази група включва протеин кинази и протеин фосфатази.
Както вече споменахме, протеините действат като сигнални съединения. Въпросът е следният. Хормони, цитокини и други подобни вещества предават сигнали между тъканите и органите, както и клетките.
- Хормоните помагат за регулирането на определени вещества в тялото. Когато се свържат с клетъчен рецептор, в него се задейства необходимата реакция. Например, формирането на скелета зависи от растежния хормон. Благодарение на лептина се регулира апетита.
- С помощта на цитокини се осъществява взаимодействие между клетките. Благодарение на такива съединения е възможно тяхното оцеляване, стимулиране на растежа, диференциация, функционалност и координация на имунната, ендокринната и нервната система. Цитокините също влияят върху скоростта на туморен растеж или некроза.
Възможност за транспорт
В този случай протеините участват в процеса на транспортиране на вещества от клетката към междуклетъчното пространство и обратно. Този протеин е хемоглобин. Той пренася кислород от белите дробове до тъканите и след това въглероден диоксидв обратна посока.

Резервни и двигателни функции
Има резервни протеини, които могат да бъдат намерени в клетките и действат като аминокиселини. Какви функции изпълняват? Такива протеини помагат за регулиране на метаболизма.
Моторните протеини осигуряват движението на тялото, по-специално мускулната контракция. Най-важното вещество от тази серия е миозинът.
Норми за усвояване и потребление за възрастни
Усвояването на протеина започва в стомаха и след това продължава в тънките черва. Съответно заболяванията на тези органи влияят негативно на процеса.
Нуждата на организма от протеин зависи преди всичко от физическата активност и начина на живот на човека. Колкото повече се движите, толкова по-динамичен е денят ви, толкова по-бързи са биохимичните реакции и метаболитният процес. Тези, които тренират редовно, се нуждаят от почти два пъти повече протеини от на обикновен човек, водещи доста пасивен начин на живот. Липсата на протеин е напълно опасна за спортистите: дефицитът е изпълнен с „изсушаване“ на мускулите и изчерпване на силата на тялото.
норма от това веществоза възрастен се изчислява по следния принцип: средно един грам. Съответно мъжете се нуждаят от около 80-100 грама протеин на ден, жените – 55-67 грама. Спортистите трябва да увеличат това количество 1,5-2 пъти.
Какво съдържа протеинът?
Знаейки кои храни съдържат протеини и в какво количество помага да се формира балансирана диета.
- повече от 15 грама протеин се съдържат в 100 грама соя, ядки и боб;
- от 10 до 15 грама се намират в зърнени храни от грис и елда, просо, тестени изделия, овесени ядки и пшенично брашно;
- от 5 до 9 грама протеин се намират в зелен грах, перлен ечемик и ориз;
- в рамките на 4,5 грама намерени в картофи, карфиол и спанак;
- Почти всички зеленчуци, горски плодове и плодове съдържат малко количество (до 2 грама).
Последици от дефицит на вещество
Ролята на протеина в човешкото тялотолкова значителни, че с липсата на това вещество или неговото отсъствие възникват катастрофални повреди и смущения във функционирането на много системи и органи.
На първо място, в случай на дефицит на протеин, такъв важен елемент като калций престава да се абсорбира. Съответно костите стават крехки и процесът на образуване на нови клетки се нарушава. В резултат на това може да се развие мускулна атрофия.
Освен това човешкият имунитет намалява, хормоните се освобождават в недостатъчни количества. Функционирането се обърка нервна система. Освен това води до цироза на черния дроб и затлъстяване.
Последици от излишния протеин
Точно както липсата му, това тъжно се отразява на здравето. Лекият излишък от необходимото количество протеин няма да причини вреда, докато очевидната злоупотреба води до проблеми с бъбреците и черния дроб. Ако се консумират предимно животински протеини, концентрацията на холестерол в кръвта може да се повиши, а това е вредно за сърцето и кръвоносните съдове. В допълнение, тялото не получава достатъчно растителни влакна и фибри, което не позволява на червата да се почистват правилно.
Трябва да помним, че протеиновите продукти се разграждат на аминокиселини, което води до образуването на амоняк. Той е токсичен за централната нервна система и следователно излишъкът му е вреден за тялото.
Така че значението е трудно да се надцени. Почти нито един физиологичен процес не може да протече напълно и правилно без тяхно участие.
>> Функции на протеините
Функции на протеините
Важна е транспортната функция на протеините. Така хемоглобинът пренася кислород от белите дробове до клетките на други тъкани и органи. В мускулите тази функция се изпълнява от протеина миоглобин. Серумните протеини улесняват трансфера липидии мастни киселини, различни биологично активни вещества. Транспортни протеини в външна мембранаклетките се прехвърлят различни веществаот околната среда в цитоплазмата.
Специфични протеини изпълняват защитна функция. Те предпазват тялото от нахлуване на чужди протеини и микроорганизми и от увреждане. По този начин антителата, произведени от лимфоцитите, блокират чужди протеини; фибринът и тромбинът предпазват тялото от загуба на кръв.
Регулаторната функция е присъща на протеините - хормони. Те поддържат постоянни концентрации на вещества в кръвта и клетките, участват в растежа, възпроизводството и други жизненоважни функции. важни процеси. Например, инсулинът регулира кръвната захар.
Протеините също имат сигнал функция. Клетъчната мембрана съдържа протеини, които могат да променят своята третична структура в отговор на факторите на околната среда. Така се получават и предават сигнали от външната среда информацияв клетка.
Протеините могат да изпълняват енергийна функция, като един от източниците на енергия в клетката. Когато 1 g протеин се разгради напълно до крайни продукти, се освобождават 6 kJ енергия. Протеините обаче се използват изключително рядко като източник на енергия. Аминокиселините, освободени при разграждането на протеиновите молекули, се използват за изграждане на нови протеини.
Функции на протеините: строителна, двигателна, транспортна, защитна, регулаторна, сигнална, енергийна, каталитична. Хормон. Ензим.
1. Какво обяснява разнообразието от белтъчни функции?
2. Какви функции на протеините познавате?
3. Каква роля играят хормоналните протеини?
4. Каква функция изпълняват ензимните протеини? Защо протеините рядко се използват като източник на енергия?
Каменски А. А., Криксунов Е. В., Пасечник В. В. Биология 9 клас
Изпратено от читатели от сайта
