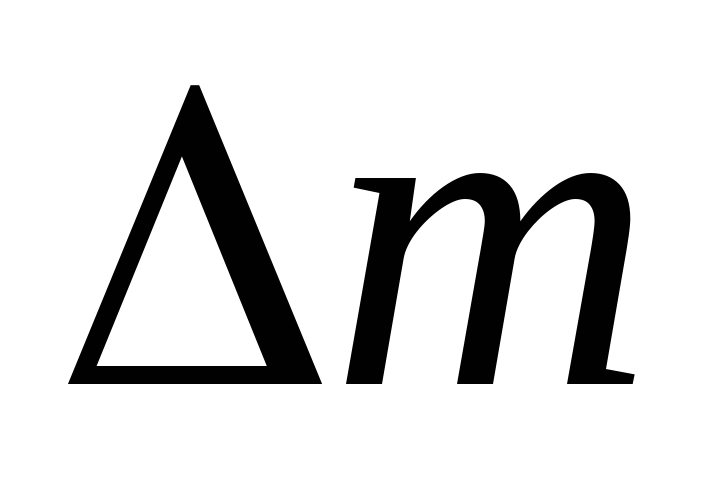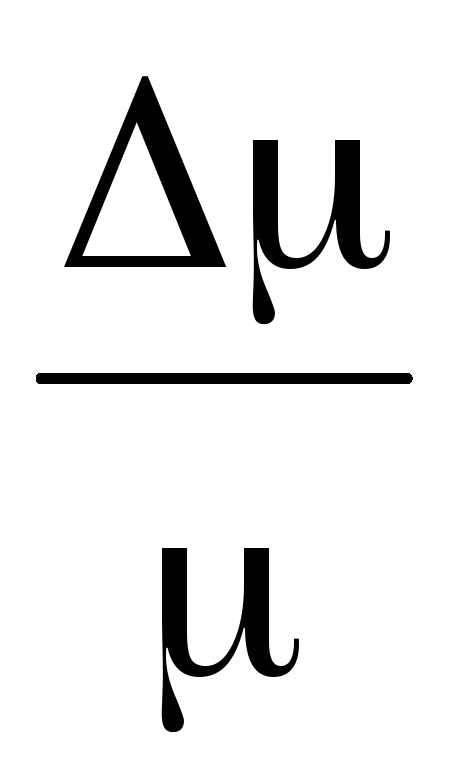Единица за измерване на моларна маса: g / mol. Тъй като молекулните маси на CO2 и H2O и атомната маса на кислорода са съответно 44; 18 и 16a.e.m., тогава техните молни маси са равни на: a) 44g / mol; б) 18 g / mol; в) 16 g / mol.
По същия начин молекулните маси на други съединения се изчисляват при химични изчисления. Молекулярната маса е характеристика на средната маса на молекулата; тя отчита изотопния състав на всички елементи, които образуват дадено химическо вещество. Този показател може да се определи и за смес от няколко вещества, чийто състав е известен. Този закон гласи, че при същите условия в един и същ обем на газ присъстват един и същ брой молекули.
Масата на определен известен обем газ се определя при определено налягане и температура. Този метод дава сравнително точни стойности на молекулните маси, които понякога дори се използват за определяне на атомните маси на химичните съединения. За груба оценка на молекулното тегло, газ обикновено се счита за идеален и не се правят допълнителни корекции.
Въздухът е необходим за нормалното съществуване на живи организми на Земята. В промишлеността и в ежедневието атмосферният кислород се използва за изгаряне на гориво за производство на топлина и механична енергия в двигателите с вътрешно горене. През 1754 г. Джоузеф Блек експериментално доказа, че въздухът е смес от газове, а не хомогенна субстанция. Първият символ е общоприетото изображение на елемента въздух. Третото изображение е триграм въздух в Книгата на промените.
Свободата е изтъкана от въздуха на човека. Следователно символът на въздуха на първо място е символ на свободата. Това е свобода, за която няма бариери, тъй като въздухът не може да бъде ограничен, не можете да го хванете и оформите.
Атмосферният въздух е смес от сух въздух и водна пара (от 0,2% до 2,6%). По този начин въздухът почти винаги може да се счита за влажен. Механична смес от сух въздух и водна пара се нарича влажен въздух или смес въздух-пара. Абсолютната влажност е масата пара в 1 м3 влажен въздух.
При гасене на пожар с вода се създават и двете условия: водата охлажда горящите предмети, а парата му затруднява достъпа на въздух до тях. Въпросът за състава на въздуха в науката не е решен веднага. През 1774 г. френският учен А. Лавоазие доказа, че въздухът е смес от главно два газа - азот и кислород. Освен това въздухът съдържа въглероден оксид (IV) и водна пара. Приблизителният състав на въздуха е показан в таблицата.
В инертна атмосфера на аргон се извършва електрическо заваряване на лесно окислени метали. Електрическите крушки изпълват неон, аргон, криптон и ксенон. Вече сте се запознали с изгарянето на вещества в кислорода. По време на изгарянето на вещества във въздуха, като правило, се образуват едни и същи продукти, т.е. различни оксиди. Изравнете броя на атомите на елементите, съставляващи изгорялото вещество: C6H6 + O2-\u003e 6CO2 + 3H2O3.
Тази техника се използва за гасене на пожари в случаи на изгаряне на масло и неговите продукти. Химичният състав на въздуха има важно хигиенно значение, тъй като той играе решаваща роля при осъществяването на дихателната функция на организма.
В жилищни, обществени и спортни съоръжения не се наблюдават значителни промени в съдържанието на кислород, тъй като външният въздух навлиза в тях. При продължително вдишване на въздух със съдържание на 1 - 1,5% въглероден диоксид човек се чувства по-зле и с 2-2,5% се откриват патологични промени.
Как да намерите моларната маса на въздуха
Атомите на елементите се характеризират с определена (присъща само на тях) маса. Стойностите на относителната молекулна маса се изчисляват от стойностите на относителната атомна маса, като се отчита броят на атомите на всеки елемент във формулната единица на сложно вещество. Сумата от масовите фракции на елементите, включени в сложното вещество, е 1 (100%). При химичните изчисления масата на газообразните реагенти и продукти често се заменя с техните обеми. Тази физическа константа е моларният обем на газа при нормални условия.
Те се основават на законите за запазване на масата, постоянството на състава, множеството отношения, както и на газовите закони - обемни отношения и Avogadro. При производството на тази основа се изчисляват материалните баланси. Законът винаги важи за газообразни и течни вещества. Законът на множеството отношения, подобно на закона за постоянството на състава, не е универсален и също така не е справедлив за веществата в твърдо състояние. Например при взаимодействието на 2 обема водород и 1 обем кислород се образуват 2 обема водна пара. Тези числа съвпадат със стехиометрични коефициенти в уравнението на реакцията.
Относителните атомни маси на известни елементи са дадени в таблицата „Периодична таблица с елементи D.I. Менделеев “. Количеството вещество В е физическо количество, което показва броя на формулните единици на веществото спрямо константата на Авогадро. Константата на Avogadro от своя страна показва броя на атомите, съдържащи се в 12 g въглероден изотоп 126С, или броя на атомните единици за маса в 1 g вещество.
10. Определяне на молекулните тегла на вещества в газообразно състояние.
Всъщност за изотопа на въглерода 126С Ar \u003d 12, а моларната маса на атомите (по дефиницията на термина „mol“) е 12 g / mol. При нормални условия (101.325 kPa; 273 K), моларният обем на всеки газ е 22.4 l / mol (по-точно Vn \u003d 22.4 l / mol). За неидеалните газове, наречени реални, молните обеми са различни и малко по-различни от точната стойност. Ако обемът и налягането на газа са изразени в други измервателни единици, тогава стойността на газовата константа в уравнението на Клапейрон-Менделеев ще приема различна стойност.
Затова те се използват за светещи знаци и в фарове.Горенето на вещества във въздуха. Определяне на молните маси на вещества в газообразно състояние Съгласно закона, Avogadroravnyh обеми от газове, взети при една и съща температура и при същото налягане, съдържат равен брой молекули. Молекулната маса на въздуха, подобно на други газове, може да се намери, използвайки закона на Авогадро.
Страница 1
Молекулното тегло на въздуха се изчислява, като се взема предвид процентът на различните компоненти. Под масата на въздушна молекула се разбира средната стойност на масите на молекулите, съдържащи се във въздуха, като се отчита тяхната относителна концентрация.
Молекулното тегло на въздуха се изчислява, като се взема предвид процентът на различните компоненти. Под масата на въздушна молекула се разбира средната стойност на масите на молекулите, съдържащи се във въздуха, като се отчита тяхната относителна концентрация.
К; M е молекулното тегло на въздуха; rzab - налягане на въздуха отстрани.
Rvzh - същото, над повърхността на изпаряващата течност, kg / m3, Мв - молекулно тегло на въздуха, равно на 29; МР е молекулното тегло на парите на изпаряващата течност.
И така, за да се изчисли броят на въздушните молекули в земната атмосфера, достатъчно е да се знае само въздушното налягане на морско ниво, молекулното тегло на въздуха, радиуса на Земята и ускорението на гравитацията g на нейната повърхност. Отговорът не включва височината на атмосферата, важно е само тя да е малка в сравнение с радиуса на Земята.
| Характеристики на въглеводородните компоненти на природния газ | Изчисляване на псевдокритична температура и налягане на природен газ. |
Следователно, за да се определи молекулното тегло на газ, е необходимо неговата умножителна граница (приета за въздух за 1) да се умножи по молекулното тегло на въздуха.
Ах, см, за 1 секунда с спад на налягането от двете страни на преградата Ar, dyne / cm2; M е молекулното тегло на въздуха, g / mol; R е универсалната газова константа, erg / mol е градус.
Въз основа на законите на идеалните газове може да се покаже, че специфичната гравитация на газ също е равна на съотношението на молекулното тегло на газа към молекулното тегло на въздуха.
Въпреки това може да има несъответствие между паропропускливостта на материала и въздухопропускливостта на конструкцията на оградата, направена от същия материал. Това се случва поради неизбежното наличие на течове и пропуски в структурата, които значително увеличават пропускливостта на оградата, а също и защото молекулното тегло на въздуха и водната пара не е едно и също.
За характеризиране на природните газове широко се използва неговата специфична гравитация. Относителната плътност на газа се изразява като съотношение на плътността на газа при атмосферно налягане и стандартна температура към плътността на въздуха при същото налягане и температура. Тъй като при атмосферно налягане и определена температура плътността на газовете е пряко пропорционална на молекулните им тегла, относителната плътност на газа може да бъде представена като съотношение на молекулното тегло на газа към молекулното тегло на въздуха. Относителната плътност на природните газове варира от 0 6 до 1 1 в зависимост от относителната концентрация на по-тежки въглеводороди в газа.
В инсталациите с въглероден диоксид производството на сух лед също трябва да отстранява въздуха от системата. В допълнение към споменатите по-рано пътища за проникване на въздух, в системи за производство на сух лед в ледогенератори, въздухът систематично навлиза в системата при отстраняване на блокове лед от ледогенераторите. След като леденият блок изпадне, обемът на ледогенератора се запълва с въздух, който при включване на ледогенератора се изсмуква от компресора и заедно с въглеродния диоксид влиза в кондензатора. Поради факта, че молекулното тегло на въглеродния диоксид е по-голямо от молекулното тегло на въздуха, естеството на линиите на графиката pa / (ga) е подобно на това за фреоните. Но тъй като молекулните тегла на въглеродния диоксид и въздуха не се различават много от фреоните, линиите на графиката в значителна област са близки до прави. Номограма за въглероден диоксид, конструирана от R. R. Skvarchenko (VNIIH), е показана на фиг.
В инсталациите с въглероден диоксид производството на сух лед също трябва да отстранява въздуха от системата. В допълнение към споменатите по-рано пътища за проникване на въздух, в системи за производство на сух лед в ледогенератори, въздухът систематично навлиза в системата при отстраняване на блокове лед от ледогенераторите. След като леденият блок изпадне, обемът на ледогенератора се запълва с въздух, който при включване на ледогенератора се изсмуква от компресора и заедно с въглеродния диоксид влиза в кондензатора. Поради факта, че молекулното тегло на въглеродния диоксид е по-голямо от молекулното тегло на въздуха, естеството на линиите на графиката f (ga) е подобно на това за фреоните. Но тъй като молекулните тегла на въглеродния диоксид и въздуха не се различават много от фреоните, линиите на графиката в значителна област са близки до прави.
Муромски институт (клон)
федерална държавна бюджетна образователна институция
висше професионално образование
„Владимирски държавен университет
кръстен на Александър Григориевич и
Николай Григориевич Столетовс
Отдел: "FPM"
Дисциплина: Физика
Лабораторна работа № 6.03
Одобрен по методологически
семинар на катедрата на FPM
Head. Председател ____________
Лабораторна работа № 6.03
ОПРЕДЕЛЯНЕ НА МОЛЕКУЛЯРНА ВЪЗДУШНА МАСА
Цел на работата- запознайте се с един от методите за определяне на молекулното тегло на газ и измерване на молекулното тегло на въздуха.
Устройства и аксесоари: въздушен цилиндър, машина за претегляне или технически баланс, манометър, баланс, вакуумна помпа.
БЕЗОПАСНОСТ
Работете внимателно със стъклената бутилка в платнената торбичка.
ТЕОРЕТИЧНА ИНФОРМАЦИЯ
Молекулна маса е съотношението на масата на молекула на дадено вещество към 1/12 от масата на въглеродния атом С.
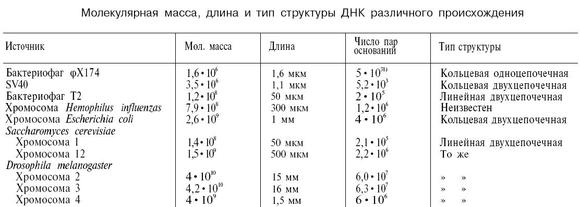
Молекулярната маса по дефиниция може да бъде представена като сбор от атомните маси на елементите, съставляващи молекулата
=
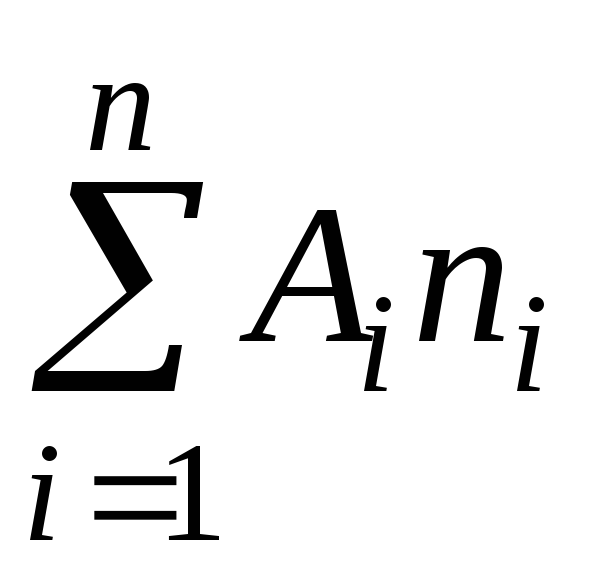 (1)
(1)
където А е атомната маса тата елемент, включен в състава на молекулата;
n е броят на атомите.
Методите за определяне на молекулната маса се разделят на две групи - абсолютна и статистическа. Абсолютните методи, които дават „истинската“ стойност на молекулното тегло, включват масспектроскопия. Други методи дават само средната стойност на молекулното тегло.
Определянето на молекулната маса на газовете се основава на уравнението на състоянието на газа
PV \u003d 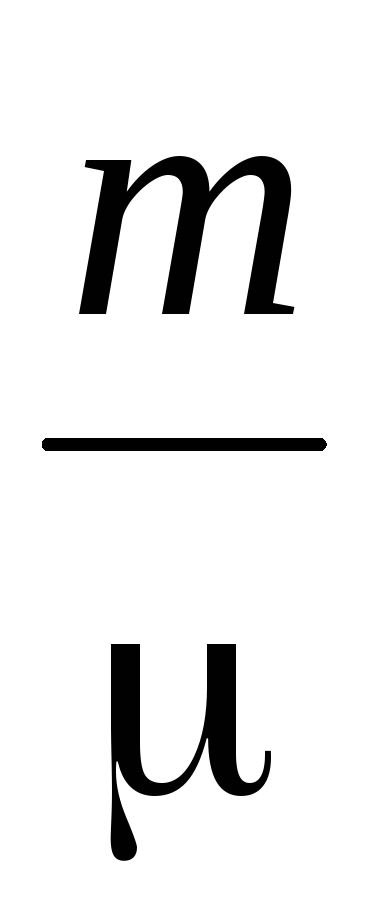 RT (2)
RT (2)
където P е налягането на газа
m, V - неговата маса и обем,
T - абсолютна температура
R е универсалната газова константа,
е средното молекулно тегло.
Уравнение 2 е валидно само за идеален газ. Идеален газ е такъв газ, между молекулите на който няма сили на взаимодействие (привличане и отблъскване). Молекулите на идеален газ са представени под формата на еластични топки с безкрайно малък размер. Реалните газове имат сили на взаимодействие между молекулите и не винаги молекулите могат да се считат за еластични топки с изчезващи малки размери, така че реалните газове се отклоняват от закона (2).
Въпреки това, при не твърде високи налягания, когато молекулите на газ могат да изминат свободно разстояния свободно преди сблъсък, взаимодействието на молекулите може да бъде пренебрегвано, размерът на молекулите също може да бъде пренебрегнат (когато обемът на газ е достатъчно голям), тогава реалният газ ще бъде близо до идеал и уравнението (2) може да се прилага. При атмосферно налягане и стайна температура много газове (азот, водород, хелий, кислород, въздух и др.) Могат да се считат за идеален газ с доста добро приближение.
Важна характеристика на молекулното движение е средният свободен път. Молекулите в газа са в състояние на непрекъснато и хаотично движение, се сблъскват помежду си и по някакъв път проходът преминава свободно между сблъсъците. Дължината на този път между двата сблъсъка е различна, но поради големия брой молекули и случайността на тяхното движение, можем да говорим за средния среден свободен път на молекулите. Средният среден свободен път на молекулите може да се определи по формулата
 =
=
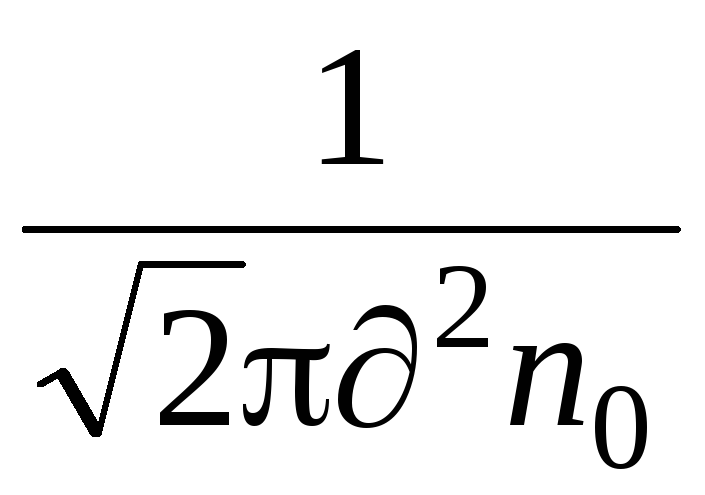 ,
,
където е ефективният диаметър на молекулата (за въздух \u003d 0,27 · 10 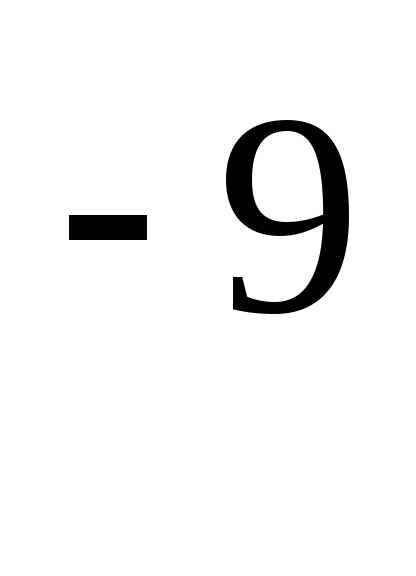 т),
т),
п  - броя на молекулите на единица обем.
- броя на молекулите на единица обем.
п  =
=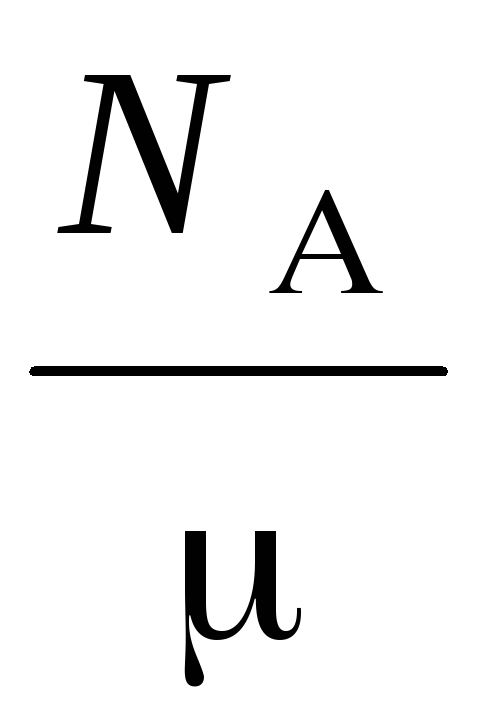
 ,
,
след това даде тази формула , за има формата:
=
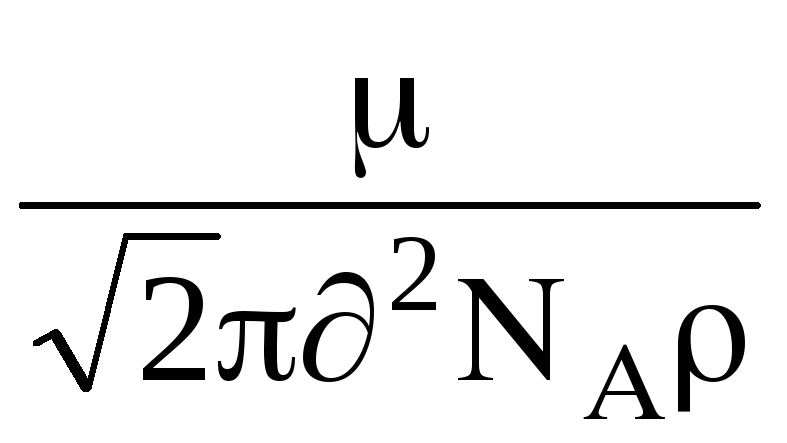 ,
,
където  - молекулна маса на газ, N
- молекулна маса на газ, N  - число Avogadro, - плътност на газа.
- число Avogadro, - плътност на газа.
Оставете въздуха в отворения цилиндър да поеме обем Vнеговата маса татмосферно налягане P; изпомпвайте въздух от цилиндъра до P  , Сега масата на въздуха в цилиндъра ще бъде m
, Сега масата на въздуха в цилиндъра ще бъде m  , За тези две състояния пишем уравнение (2)
, За тези две състояния пишем уравнение (2)
PV \u003d 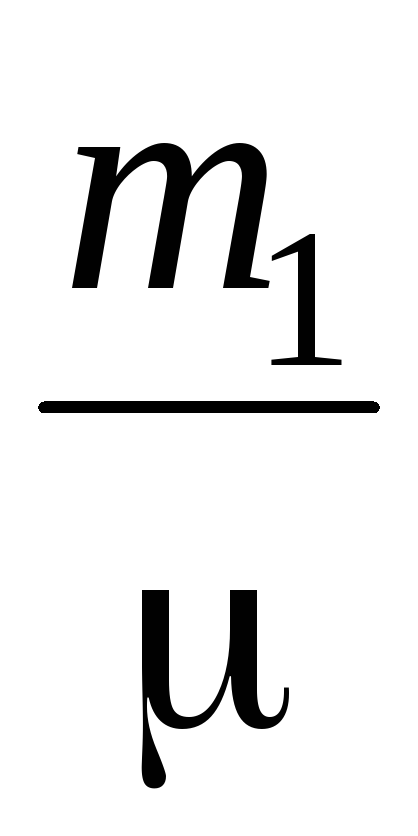 RT (3)
RT (3)
P  V \u003d
V \u003d 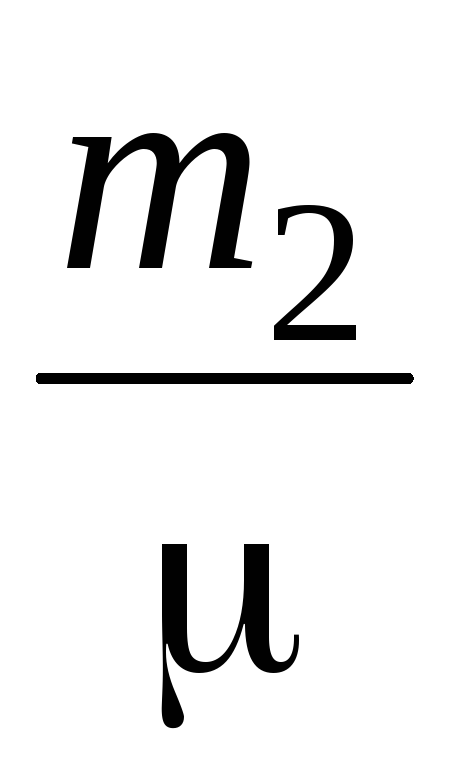 RT (4)
RT (4)
Изваждайки от (3) (4), изразяваме .
=
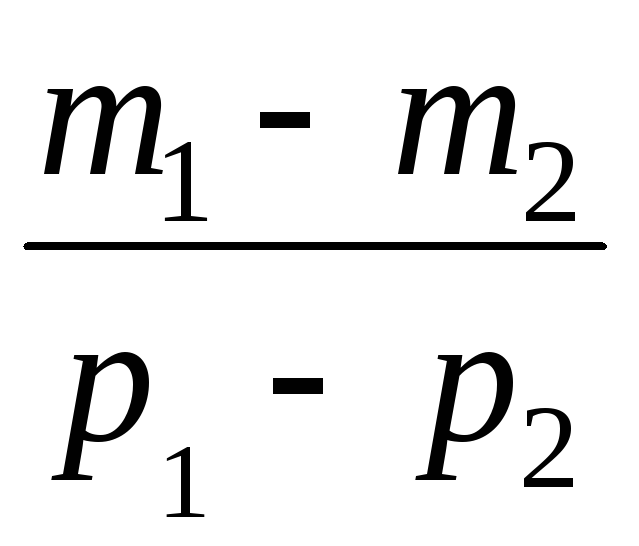
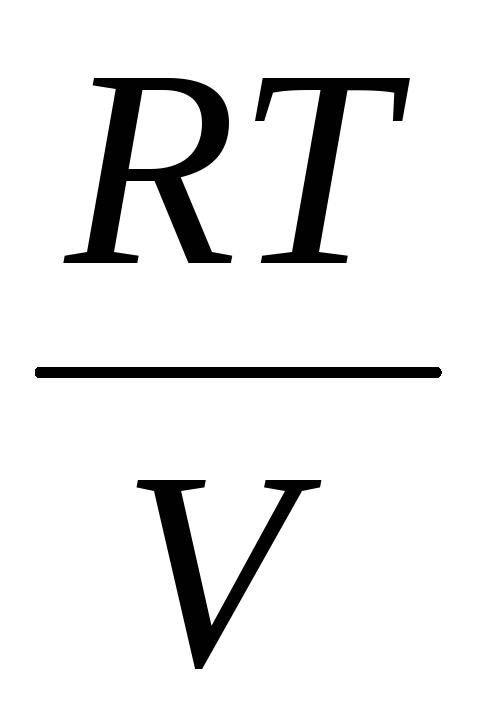 =
=
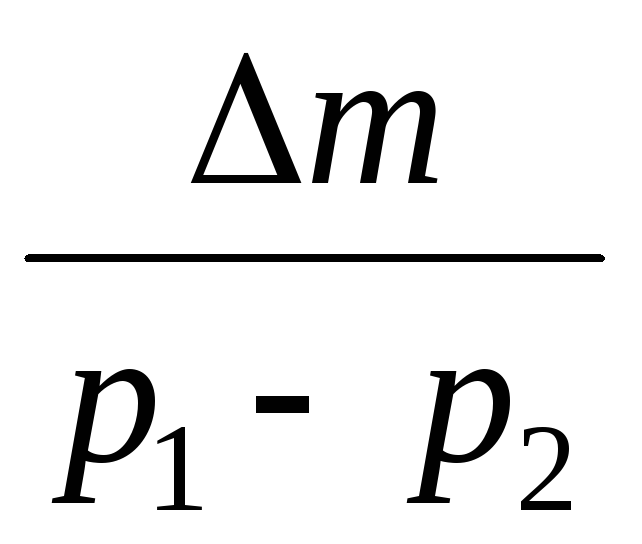
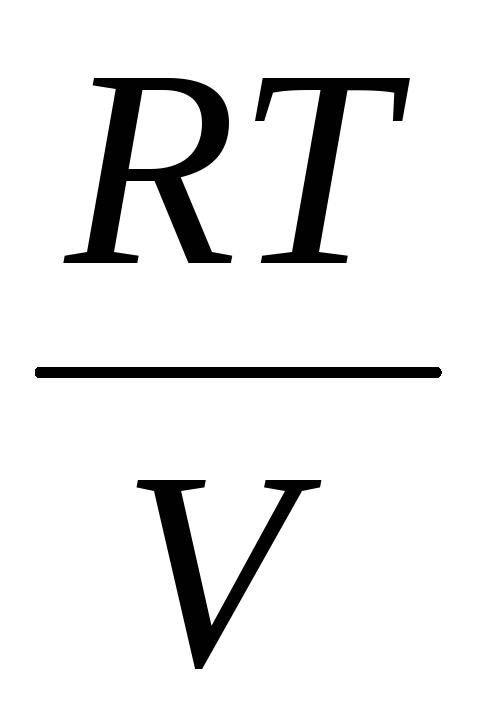 (5)
(5)
По този начин, знаейки промяната на масата с промените в налягането, можем да намерим молекулната маса на въздуха по формулата (5).
ОПИСАНИЕ НА МОНТАЖ
Общият изглед на инсталацията е показан на фиг. 1. Инсталацията се състои от вакуумна помпа (1) , клапан (2) (с помощта на клапан 2 системата е изключена от вакуумната помпа), вакуум манометър (3) Въртенето на показалеца на вакуума е пропорционално на вакуума, постигнат в системата, т.е. разликата между атмосферното налягане и налягането на въздуха в инсталацията. Нулевата стойност в скалата на габаритите съответства на атмосферното налягане в инсталацията. Устройството започва да се показва само при изпомпване на въздух от системата, т.е. при налягане на въздуха в инсталацията под атмосферното.
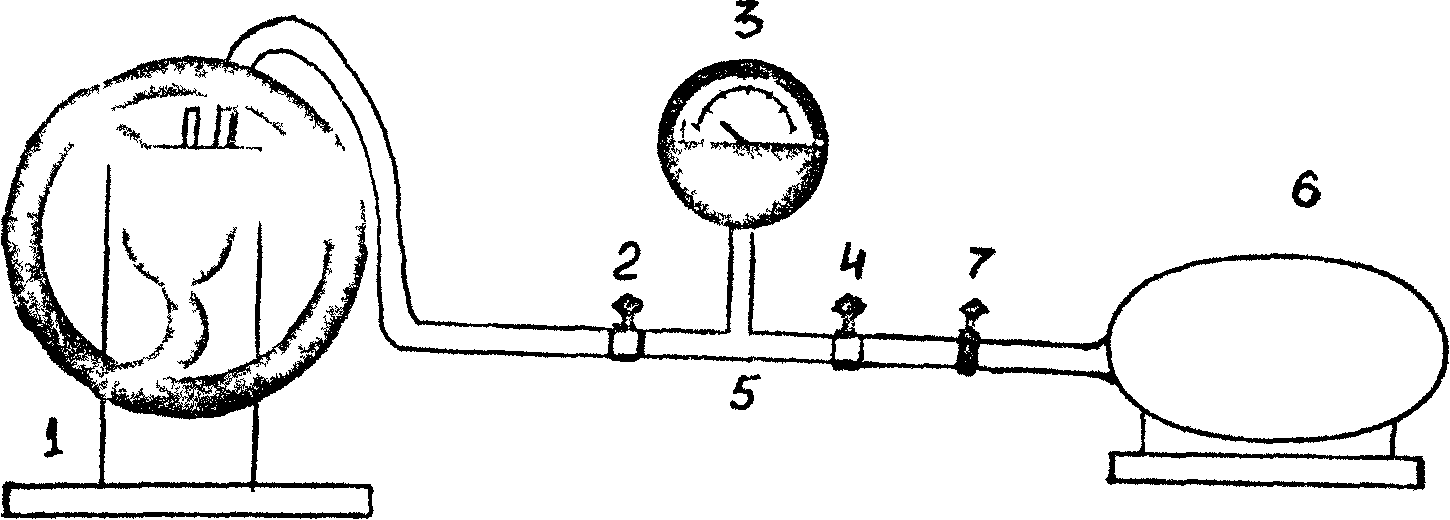
С помощта на кран 4 системата се свързва с атмосферата. На фиг. 1 е показана вакуумна тръба (5), подвижен цилиндър (6) (обем) аз/ 1225 мл) с гумена тръба и скоба (7), която служи за изключване на цилиндъра 6 от атмосферата при претегляне на цилиндъра.
Отидете на работа
Задача 1. Определяне на молекулната маса на въздуха.
1. Отворете крановете 2 и 4, скобата 7 и изключете цилиндъра 6 от инсталацията. Претеглете балона 6 заедно с гумената тръба и скобата 7 и запишете резултатите от измерванията в таблица I. Претеглянето трябва да се извърши с доста висока степен на точност и тази операция трябва да се отбележи особено.
2. Свържете цилиндъра 6 към инсталацията и изпомпвайте въздуха от цилиндъра, така че да се промени промяната на налягането  P \u003d 0,1
P \u003d 0,1 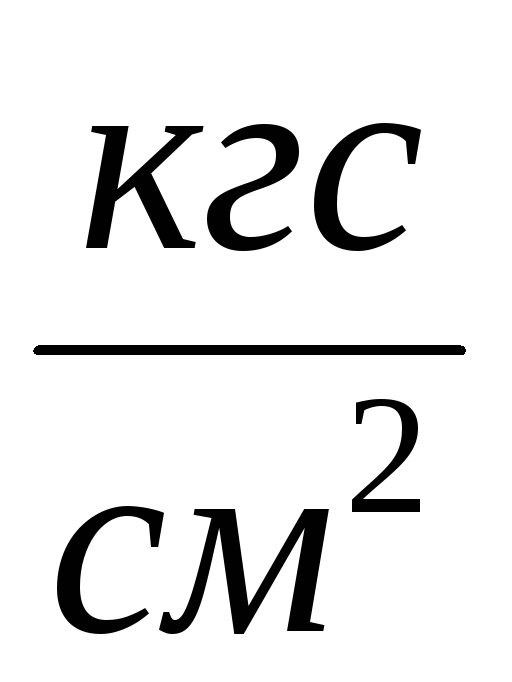 , Затворете крана 2 и въведете
, Затворете крана 2 и въведете  P към таблицата за измерване. Затворете вентила 4, натиснете 7 и изключете цилиндъра 6 от инсталацията и го претеглете. Резултатите от измерванията се въвеждат в таблицата.
P към таблицата за измерване. Затворете вентила 4, натиснете 7 и изключете цилиндъра 6 от инсталацията и го претеглете. Резултатите от измерванията се въвеждат в таблицата.
3. Отворена скоба 7, плавно отворени кранове 2 и 4 и стъпка 2 повторете още 4 пъти за други стойности  P.
P.
4. Въз основа на резултатите от измерването изчисляваме въздух и оценяваме грешката на измерването.
Задача 2, Определяне на плътността на въздуха.
Определяме плътността на въздуха, използвайки уравнението на Менделеев-Клайперон за идеални газове.
PV \u003d 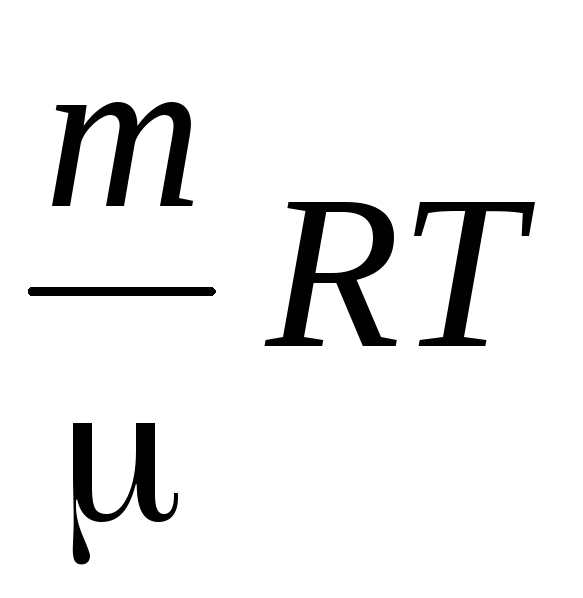 .
.
От това уравнение следва, че тъй като 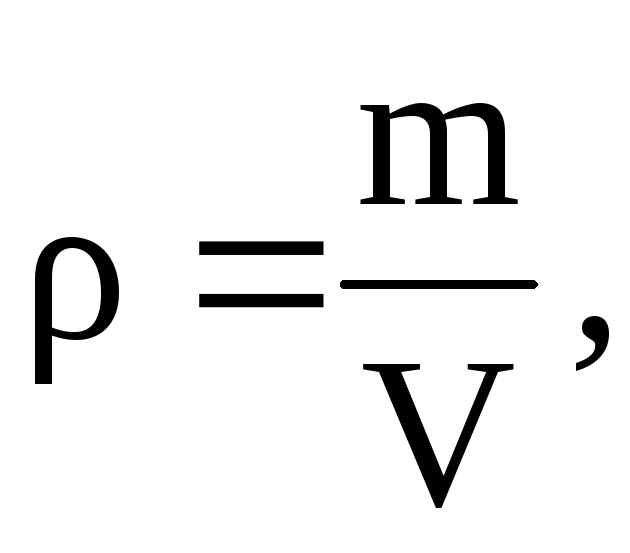 на
на
=
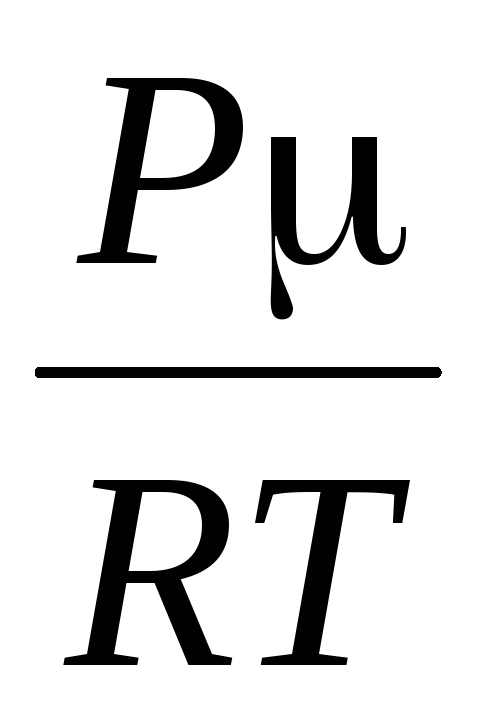 ,
,
където R \u003d 8,31 * 10 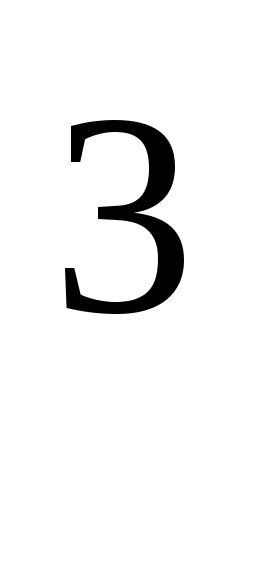 J / (kmol · K), универсална газова константа.
J / (kmol · K), универсална газова константа.
Първо определяме плътността на въздуха в цилиндъра преди евакуация, като приемаме, че налягането P \u003d P  равно на атмосферното налягане (P
равно на атмосферното налягане (P  \u003d 101 kPa). Тогава определяме плътността на въздуха при различни
\u003d 101 kPa). Тогава определяме плътността на въздуха при различни  P, взето от таблицата за измерване, като се приеме, че налягането в колбата е P \u003d P
P, взето от таблицата за измерване, като се приеме, че налягането в колбата е P \u003d P  -
- P.
P.
Въз основа на резултатите от изчисленията, изградете графика на плътността спрямо налягането P: 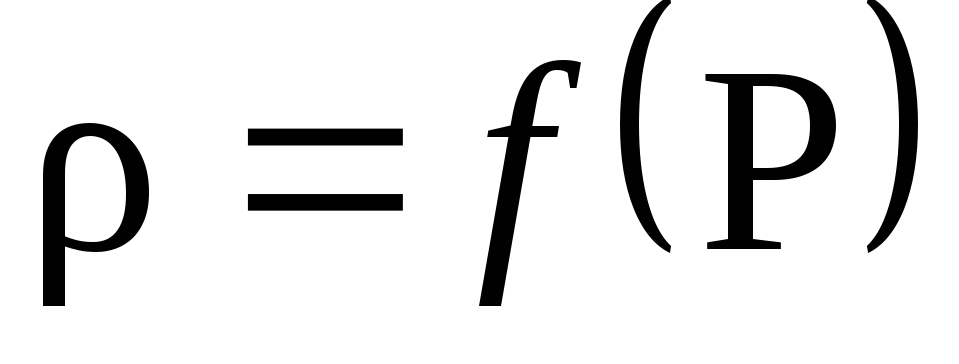
ТАБЛИЦА ЗА ИЗМЕРЕНИЯ
|
m |
|
|
|
|
|
| ||||||
Задача 3. Според изчислените изчисления определете средната свободна пътека path и постройте зависимостта на от : 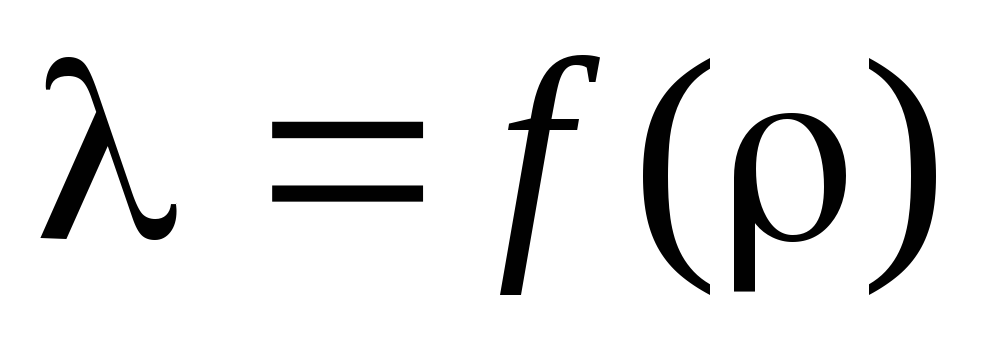 .
.
ВЪПРОСИ ЗА КОНТРОЛ
1. Избройте основните точки на молекулярно-кинетичната теория на идеалните газове.
2. Какви физични величини се наричат \u200b\u200bпараметри за състояние на газ, дайте тяхното определение.
3. Формулирайте законите на идеалните газове.
4. При какви условия газът се подчинява на законите на идеалния газ?
5. При какви условия е приложимо уравнението на Клапейрон-Менделеев за газове.
6. Какво е молекулно тегло, от какво зависи молекулното тегло.
7. Плътност на въздуха, от какво зависи?
8. Средният свободен път на газовите молекули и ефективният диаметър.
9. Извлечете формулите за изчисляване на и .
10. Какви измервания трябва да се направят, за да се изчисли молекулното тегло и плътността на въздуха .
Списък с референции
1. Савелиев И.В. Общ курс по физика. М .: Наука, 1970.V.1, § 98.
2. А.А. Детлаф Б.М. Jaworski. Курс по физика. М.: Издателство на висшето училище, 1973, с. 175-179.