Експериментите на А. Ръдърфорд
През 1911 г. Ръдърфорд провежда експерименти с изключително значение, които доказват съществуването на атомното ядро. За да изследва атома, Ръдърфорд използва неговото сондиране (бомбардиране) с помощта на алфа-частици, които възникват по време на разпадането на радий, полоний и някои други елементи. Ръдърфорд и неговите колеги в по-ранни експерименти през 1909 г. установяват, че α-частиците имат положителен заряд, равен по величина на два пъти заряда на електрона q =+2e,и маса, която съвпада с масата на хелиев атом, т.е
Въпреки това дъщерната страна на химическото разделяне е предназначена само да се разпадне, тъй като няма средства за попълване на запасите от преобразувани атоми. Ръдърфорд и Соди видяха това, което изглеждаше постоянна дейностуранът, торият и радият са свързани с периоди на полуразпад, които са дълги в сравнение с човешкия живот. Това разбиране преодолява главоблъсканицата в основата на всички предишни теории; защото ако общата радиоактивност във Вселената става все по-малка и има тенденция да изчезва, законът за запазване на енергията няма да бъде нарушен.
м А= 6,62 · 10 -27 кг,
което е около 7300 пъти масата на един електрон. По-късно беше открито, че α частиците са ядрата на хелиевите атоми. Ръдърфорд бомбардира атомите на тежките елементи с тези частици. Електроните, поради ниската си маса, не могат да променят траекторията на α-частицата. Тяхното разсейване (смяна на посоката на движение) може да бъде причинено само от положително заредената част на атома. По този начин, от разсейването на α-частиците е възможно да се определи естеството на разпределението на положителния заряд и следователно на масата вътре в атома.
Те считат радиоактивността за фундаментално свойство на природата, подходящо да се присъедини към избраната група от електричество, магнетизъм, светлина и гравитация. Най-малкото забележително нещо в тази теория, която заявяваше, че атомът не е неразрушим, беше непротиворечивият начин, по който беше приета. Освен възрастния и непроменлив лорд Келвин и постоянно противоречивия Хенри Армстронг, теорията за трансформацията среща малко съпротива, особено химиците, въпреки че нарушава идеята за неизменността на атомите, че те са „погълнати от майката мляко”, не може да опровергае доказателства и в най-добрия случай може да приеме очакваното отношение.
Известно е, че алфа частиците, излъчвани от полоний, летят със скорост 1,6-107 m/s. Полоният е поставен в оловен корпус, по който е пробит тесен канал. Сноп от α-частици, преминал през канала и диафрагмата, пада върху фолиото. Златното фолио може да бъде направено изключително тънко - с дебелина 4-10 -7 m (400 златни атома; този брой може да бъде оценен чрез познаване на масата, плътността и моларната маса на златото). След фолиото α-частиците падат върху полупрозрачен екран, покрит с цинков сулфид. Сблъсъкът на всяка частица с екрана беше придружен от проблясък на светлина (сцинтилация), причинен от флуоресценция, която се наблюдаваше през микроскоп.
До голяма степен Ръдърфорд прекарва следващите години в разработването на тази богата интерпретация. Работейки със Соди и използвайки нова машина за течен въздух, предоставена на Макгил от неговия богат благодетел, той кондензира еманацията при ниски температури, доказвайки, че е газ. Други тестове ги убедиха, че еманацията принадлежи към семейството на благородните газове, открити малко преди това от сър Уилям Рамзи. Подобна работа беше много важна, защото имаше много радиоелементи, чиято химическа идентичност и място в сериите на разпадане бяха несигурни.
При добър вакуум вътре в устройството (така че да няма разпръскване на частици от въздушни молекули), при липса на фолио, на екрана се появи светъл кръг от сцинтилации, причинени от тънък лъч от α-частици. Когато фолиото беше поставено на пътя на лъча, по-голямата част от α частиците все още не се отклониха от първоначалната си посока, тоест те преминаха през фолиото, сякаш беше празно пространство. Въпреки това имаше алфа частици, които промениха пътя си и дори се върнаха обратно.
Каква е логическата непоследователност на планетарния модел на атома?
Хелият, въпреки че не е радиоелемент, представлява особен интерес поради убеждението на Ръдърфорд, че като положителен йон той е идентичен на алфа частицата. И той смята алфа-частицата, която има значителна маса, за ключова в прехода от елемент с едно атомно тегло към елемент с друго. Той очарова Ръдърфорд и защото можеше да оцени огромната скорост и енергия, с които беше изхвърлен от разпадащия се атом.
Тъй като Болтууд остава в Ню Хейвън, Кънектикът, сътрудничеството му с Ръдърфорд се извършва по пощата. Тази работа продължи от определянето на количеството радий, присъстващо на грам уран в минералите, до предложението на Ръдърфорд, че ако количеството и скоростта на образуване на крайния продукт от серията са известни, възрастта на минерала може да бъде изчислена. Струт в Англия следва тази идея, използвайки хелий, открит в радиоактивни вещества; но променливото количество на този газ, което е излязло, позволява само минимално определяне на възрастта.
Марсдън и Гайгер, ученици и сътрудници на Ръдърфорд, преброиха повече от един милион сцинтилации и установиха, че приблизително една от 2 хиляди алфа частици е отклонена под ъгли, по-големи от 90°, и една от 8 хиляди от 180°. Беше невъзможно да се обясни този резултат въз основа на други модели на атома, по-специално на Томсън.
Изчисленията показват, че когато е разпределен върху целия атом, положителният заряд (дори без да се вземат предвид електроните) не може да създаде достатъчно интензивно електрическо поле, способно да изхвърли α частица обратно. Напрегнатостта на електрическото поле на еднакво заредена топка е максимална на повърхността на топката и намалява до нула, когато се приближи до центъра. Разсейването на α-частиците под големи ъгли се случва така, сякаш целият положителен заряд на атома е концентриран в неговото ядро - област, заемаща много малък обем в сравнение с целия обем на атома.
Дървото на болтовете показва универсално присъствие на олово с уранови минерали; смята го за крайния продукт на поредицата; и използвайки стойността на Ръдърфорд за времето на полуразпад на радия и тяхната стойност за количеството радий в урановата графика, успя да изчисли скоростта на образуване на олово. Възраст на някои от неговите екземпляри скалие на повече от един милиард години, предоставяйки за първи път количествени доказателства за древността на Земята.
Много други проблеми в областта на радиоактивността бяха преследвани от Ръдърфорд, понякога сам, понякога с един от студентите изследователи в силната школа, която той създаде. Сред проектите в неговата лаборатория бяха измервания на радиационната енергия, изследвания на свойствата на бета и гама лъчите, опити за промяна на скоростта на разпадане при екстремни температурни условия, опити за поставяне на актиний в серия от разпадане и изследвания на радиоактивността на земята и атмосфера.
Вероятността α-частиците да навлязат в ядрото и тяхното отклонение при големи ъгли е много малка, така че за повечето α-частици фолиото изглежда не съществува.
Ръдърфорд теоретично разглежда проблема с разсейването на α-частиците в кулоновото електрическо поле на ядрото и получава формула, която позволява да се определи броят на α-частиците, падащи върху ядрото, и измереният брой частици, разпръснати под определен ъгъл . Нелементарни положителни заряди +е, съдържащи се в ядрото на атомите на дадено разсейващо фолио. Експериментите показват, че броят Нравен на поредния номер на елемента в периодичната система на Д.И.Менделеев, т.е N=Z(за злато З= 79).
Той беше много търсен като лектор и често пътуваше до отдалечени райони на Съединените щати и Англия, за да изнесе лекция, поредица от беседи или летен курс. Въпреки че не можеше да му бъде отказана честта да говори в Кралския институт, лекцията на Бейкър в Кралското общество или лекциите на Силиман в Йейл, някои доброжелатели го призоваха да ограничи външните си ангажименти. Неговото време е използвано и при написването на Radio Activity, първият учебник по темата и признат за класически при публикуването му.
По този начин хипотезата на Ръдърфорд за концентрацията на положителен заряд в ядрото на атома направи възможно установяването на физическото значение на серийния номер на елемент в периодичната таблица на елементите. Неутрален атом също трябва да съдържа Зелектрони. Показателно е, че броят на електроните в атома, определен по различни методи, съвпада с броя на елементарните положителни заряди в ядрото. Това послужи като тест за валидността на ядрения модел на атома.
Напредъкът на науката обаче беше толкова бърз, че Ръдърфорд подготви второ издание на следващата година, което беше с 50 процента по-голямо. След като това беше направено, той беше изправен пред задачата да постави Лекциите на Силиман в книга. Не е изненадващо, че през следващите няколко години той ограничава писането си до списания.
Истинската загуба на чест започна да се стоварва върху него, продължавайки до края на живота му. Ръдърфорд много се радваше на това признание, защото, макар и не напразно, той беше напълно наясно със собствената си стойност. Докато беше щастлив в Макгил, Ръдърфорд искаше да се върне в Англия, където щеше да бъде по-близо до водещите научни центровемир.
Ядреният модел на атома на Б. Ръдърфорд
Обобщавайки резултатите от експериментите за разсейване на α-частици от златно фолио, Ръдърфорд установява:
♦ атомите по своята природа са до голяма степен прозрачни за алфа частици;
♦ отклонения на α-частици под големи ъгли са възможни само ако вътре в атома има много силно електрическо поле, създадено от положителен заряд, свързан с голяма маса, концентрирана в много малък обем.
Ръдърфорд привлича изключително талантлива група студенти-изследователи в Манчестър, които имат значителен принос във физиката и химията. При завръщането си в Англия Ръдърфорд разполага само с няколко милиграма радиоактивен материал, което не е достатъчно за собствените му изследвания. В щедър жест Австрийската академия на науките изпрати около 350 милиграма радиев хлорид от контролираните от нея уранови мини Йоахимстал като съвместен заем на Ръдърфорд и Рамзи. За съжаление, Рамзи искаше да запази притежанието си за неопределено време, докато и двамата виждаха мъдростта да оставят предложението неразделено: докато виенските власти не изпратят друг подобен източник на радий за изключителна употреба на Ръдърфорд, той беше ограничен до работа с „начертайте“ еманация, която Рамзи изпрати периодично от Лондон.
За да обясни тези експерименти, Ръдърфорд предложи ядрен модел на атома: целият положителен заряд и почти цялата маса на атома (99,9%) са концентрирани в ядрото на атома (област с линейни размери 10 -15 -10 -14 м). Около ядрото в област с линейни размери ~10 -10 m (размерите на атома се оценяват в молекулярно-кинетичната теория) се движат отрицателно заредени електрони в затворени орбити, чиято маса е само 0,1% от масата на ядро. Следователно електроните са разположени от ядрото на разстояние от 10 000 до 100 000 пъти диаметъра на ядрото, тоест по-голямата част от атома е празно пространство.
Посочете основния резултат от експеримента на Ръдърфорд
До известна степен това определя повечето от първоначалните изследвания на Ръдърфорд в Манчестър, обширно изследване на еманацията на радий: но той винаги намира, че еманацията и нейните активни разпадни продукти на депозита са по-удобни източници от самия радий.
Еманацията може лесно да се пречиства в течен въздух и Ръдърфорд скоро определя обема на този газ в равновесие с един грам радий. Камерън и, като потвърди изчислената му стойност, елиминира някои съмнения по отношение на точността на радиоактивните данни и теория. Използвайки копирния спектроскоп на Томас Ройдс, Ръдърфорд фотографира спектъра на еманацията, неизследван, тъй като визуалните наблюдения на Рамзи и Коли в тази работа го включват в научните спорове, които той обикновено се опитва да избегне; но след като Соди напусна лабораторията на Рамзи, приносът на последния към радиоактивността беше отбелязан с почти еднаквата им неравномерност.
Ядреният модел на атомите на Ръдърфорд наподобява слънчевата система: в центъра на системата има „слънце“ - ядрото, а около него „планети“ - електрони - се движат по орбити, поради което този модел се нарича планетарен.Електроните не падат върху ядрото, защото електрическите сили на привличане между ядрото и електроните се балансират от центробежните сили, причинени от въртенето на електроните около ядрото.
Въпреки че е експерт в обработката на малки количества редки газове, Рамзи никога не си е направил труда да се запознае задълбочено с радиоактивните техники. Неточната му работа, съчетана с силно желаниеполучаването на приоритет го накара бързо да публикува множество резултати, които Ръдърфорд и други в областта бяха принудени да коригират. Никога не ограничавайки обхвата на своите изследвания - той предпочита да се движи по широк път през радиоактивността - Ръдърфорд преследва „своите“ алфа частици.
Това бяха неговите любими: бета частиците бяха твърде малки и, тъй като бяха електрони, твърде често срещани. Алфите обаче бяха масивни, с атомни размери: и той можеше ясно да си ги представи как излизат от своите родителски атоми с огромна скорост и енергия. Разбира се, това ще бъде ключът към класическата цел на физика: разбиране на природата на материята. Дотогава нищо не е променило ранното убеждение на Ръдърфорд, че алфа частицата е двойно зареден атом на хелий, но той не е успял да докаже това убеждение. Сблъсъчна йонизация, процес, изучаван от бившия колега на Ръдърфорд в Кеймбридж, Дж.
През 1914 г., три години след създаването на планетарния модел на атома, Ръдърфорд изследва положителните заряди в ядрото. Като бомбардира водородни атоми с електрони, той открива, че неутралните атоми се превръщат в положително заредени частици. Тъй като водородният атом има един електрон, Ръдърфорд решава, че ядрото на атома е частица, носеща елементарен положителен заряд +e. Той нарече тази частица протон.
Таунсенд, предизвика увеличение на заряда на единична частица, достатъчно, за да даде на електрометъра измеримо "изпъкналост". Така те успяха да изчислят, за първи път точно и директно, броя алфа частици, излъчвани за секунда от грам радий. Този експеримент позволи на Ръдърфорд и Гайгер да потвърдят, че всяка алфа частица произвежда слаба, но дискретна светкавица, когато удари флуоресцентен екран от цинков сулфид и следователно води директно до широко разпространения метод на сцинтилационно броене.
Това е и произходът на електрическите и електронните методи за броене на частици, в които по-късно се основава Гайгер. Но по това време техниката на сцинтилация, която сега се оказа надеждна, беше по-удобна. Те измерват общия заряд от източника на радий и го разделят на количеството алфа, изчислено, за да даде заряда на частица. Но Ръдърфорд все още искаше решителни, преки доказателства; и тук неговият опитен стъклар му помогна.
Планетарният модел се съгласува добре с експериментите за разсейване на α-частици, но не може да обясни стабилността на атома. Помислете например за модел на водороден атом, съдържащ протонно ядро и един електрон, който се движи със скорост vоколо ядрото в кръгова орбита с радиус r.Електронът трябва да падне в спирала върху ядрото и честотата на неговото въртене около ядрото (и следователно честотата на електромагнитните вълни, излъчвани от него) трябва непрекъснато да се променя, тоест атомът е нестабилен и неговото електромагнитно излъчване трябва имат непрекъснат спектър.
Такава тръба се пълни с еманация и се поставя в по-голяма тръба от по-дебело стъкло. С течение на времето алфа частиците от разлагащата се еманация проникнаха и бяха уловени в пространството между вътрешната и външната тръба: когато Ройдс запали материала в това пространство, те видяха спектъра на хелия. Както в Монреал, Ръдърфорд намери химическа помощ в самия Манчестър високо качество. Болтууд прекарва с него една година, през която по-точно определят скоростта на производство на хелий от радий. Комбинирайки тези резултати с резултатите от експериментите с броене, споменати по-горе, те получиха числото на Авогадро, по-голямо от всякога.
В действителност се оказва, че:
а) атомът е стабилен;
б) атомът излъчва енергия само при определени условия;
в) излъчването на атома има линеен спектър, обусловен от неговата структура.
Така прилагането на класическата електродинамика към планетарния модел на атома доведе до пълно противоречие с експерименталните факти. Преодоляването на възникналите трудности изискваше създаването на качествено нов квантово– атомни теории. Но въпреки своята непоследователност, планетарният модел все още се приема като приблизителна и опростена картина на атома.
Имаше и нови изследователи на периодичната таблица - Александър Ръсел, Казимир Фаянс и Георг фон Хевеси, които създават информация и идеи, въз основа на които ще бъдат установени законите за изместване и концепцията за изотоп, както и работа върху разклоненията на сериите на разпад, периодите на краткоживеещи елементи и други радиохимични проблеми.
Най-голямото откритие на Ръдърфорд в Манчестър - всъщност в кариерата му - е ядрената структура на атома. В ретроспекция неговият произход може да се види в леките доказателства за разсейване на алфа частици в тънки метални фолиа или листове слюда, които той забеляза, докато беше в Макгил, и в подобно разсейване от въздушни молекули в по-късните му експерименти с електрическо броене с Гайгер. За да научите повече за това разсейване, както защото въведе експериментални трудности, водещи до по-малко точни резултати, така и защото беше свързано с озадачаващия въпрос за природата на абсорбцията алфа и бетав материята Гайгер прави количествено изследване на това явление.
МИНИСТЕРСТВО НА ВИСШЕТО И СРЕДНОТО СПЕЦИАЛНО ОБРАЗОВАНИЕ НА RF.
НОВОСИБИРСК ДЪРЖАВЕН АРХИТЕКТУРНО-СТРОИТЕЛЕН УНИВЕРСИТЕТ
Катедра по физика
АБСТРАКТ
Експериментите на Ръдърфорд
Завършено: Кузнецов И.А. (група 226)
Проверено: Berkhoer L.D.
Новосибирск 2000 г
Ърнест Ръдърфорд е един от най-известните физици от първата половина на 20 век. Някога Ръдърфорд беше първият, който направи дисекция на атом, откривайки ядро в него. Той изследва сложните явления, случващи се в тази удивително малка частица материя, а след това в лабораторията си разделя ядрата на атомите.
Докато все още е студент 2-ра година в университета, Ръдърфорд изнася презентация на една от конференциите на тема „Еволюция на елементите“. Ръдърфорд предполага, че всички химически елементи са сложни химически системи, състоящ се от същ елементарни частици. По това време атомът се смяташе за неделим - във физиката доминираше теорията на Далтън за неделимостта на атомите.
Първият опит за създаване на атомен модел въз основа на натрупаните експериментални данни е направен от Дж. Дж. Томсън. Електроните, както смята Томсън, са вградени в субминиатюрна сфера с диаметър 10–8 cm, в която положителните заряди са равномерно разпределени. Заедно с отрицателно заредените електрони, сферата е електрически неутрална. Това е атомът. По това време Ръдърфорд, който работи в същата лаборатория с Томсън, също мислеше така и дори не мечтаеше, че може да създаде по-усъвършенстван модел, базиран на нови идеи.
През 1896 г., докато изучава луминесценцията различни вещества, А. Бекерел случайно откри, че урановите соли излъчват без предварително осветяване. Това лъчение има голяма проникваща сила и е в състояние да въздейства върху фотографска плака, увита в черна хартия. Ръдърфорд незабавно започва да изучава Бекереловите лъчи. Той започва изследването си върху рентгеновите лъчи, като тества хипотезата си за връзката между рентгеновите лъчи и бекереловите лъчи. Тази идея му хрумна по много проста причина: и двете произвеждаха йонизация на въздуха. Тази идея не беше успешна.
Но най-важният резултат на Ръдърфорд е откриването на -частици в радиацията, излъчвана от урана. Ръдърфорд поставя източник на уран в силно магнитно поле и разделя радиацията на три различни вида. С други думи, след това той открива състава на радиоактивността: алфа и бета частици и гама лъчи.
След като получи частиците, Ръдърфорд веднага направи блестящото заключение, че те представляват мощен инструмент за проникване в дълбините на атома. Както по-късно беше потвърдено, това беше абсолютно вярно. В следващите си работи Ръдърфорд широко използва -астиците като снаряди, проникващи в сърцето на атома - атомното ядро.
Ръдърфорд открива излъчването на торий и доказва, че този радиоактивен газ, освободен от тория, е химичен елемент, различен от самия торий. По-късно той определя атомното тегло на еманацията и показва, че това е благороден газ от нулевата група на системата Д.И.
Ръдърфорд и Фредерик Соди са първите, които обясняват радиоактивния разпад като спонтанен преход на един елемент в друг. След еманацията на торий, Ръдърфорд открива еманацията на радий - радон. На учения беше ясно, че радият, излъчвайки частици, се превръща в нов активно вещество, подобно на еманацията на торий. Това откритие окончателно потвърди теорията за радиоактивния разпад.
В началото на 1903 г. Ръдърфорд се опитва експериментално да определи химичния състав на частиците. Идеята е да се сравни масата на една частица с масите на атомите на известни елементи. Опитът му позволява да бъде първият, който идентифицира частици с атоми на хелий. По-късно това беше потвърдено спектрографски.
През 1908 г. Ръдърфорд започва обширни експерименти в изследването на частиците, като ги брои с помощта на сцинтилационен брояч на Гайгер.
![]() Заедно с Гайгер и Ройдс Ръдърфорд провежда серия от експерименти, потвърждаващи, че -частиците не са нищо повече от двойно йонизирани (т.е. загубили 2 електрона) хелиеви атоми. това исторически опит, благодарение на което никой не може да се съмнява в правилността на неговата теория за разпадането, беше следното:
Заедно с Гайгер и Ройдс Ръдърфорд провежда серия от експерименти, потвърждаващи, че -частиците не са нищо повече от двойно йонизирани (т.е. загубили 2 електрона) хелиеви атоми. това исторически опит, благодарение на което никой не може да се съмнява в правилността на неговата теория за разпадането, беше следното:
Ръдърфорд постави известно количество радон, еманация на радий, в запечатана тръба 2. Дебелината на стената на тази тръба е 0,01 mm. Те са достатъчно тънки, така че частиците, излъчвани от радона, да могат да преминат през тях във външната тръба 3. Преди експеримента тръба 3 беше внимателно вакуумирана и линиите на хелий не можеха да бъдат открити в нея спектрографски. Няколко дни по-късно беше открито натрупване на газ в тръба 3. Чрез увеличаване на налягането в устройството, натрупаният газ може да се концентрира в тръба 1. електрически заряди тогава се оказа, че спектралният анализ в него показва характерни линии на хелий. В тръбата имаше хелий. Но може би е попаднал в тръба 2 чрез пропуск заедно с радона и оттам е проникнал в тръби 3 и 1? Контролният експеримент даде отрицателен отговор на този въпрос. В абсолютно същото устройство (в тръба 2) Ръдърфорд постави не радон, а чист хелий. Въпреки това, след няколко дни, не бяха открити линии на хелий в тръба 1. Хелият не можеше да премине през стъклените стени на тръба 2 в тръба 3. -частиците лесно преминаваха през стъклото и се натрупваха в тръба 3, след което се концентрираха в тръба 1, където бяха подложени на спектрален анализ, давайки линии на хелий.
След това Ръдърфорд, заедно с Гайгер и Марсдън, дирижира нова серияексперименти. Резултатите революционизираха физиката. Това беше най-драматичната глава в науката на нашето време. Ръдърфорд открива атомното ядро и с това основава нова и изключително важна наука - ядрената физика.
Що за експерименти бяха това? Ръдърфорд и Гайгер първоначално продължиха своите наблюдения на сцинтилации, причинени от γ-частици при удар с луминисцентен екран, направен от цинков сулфид. Първо, експериментите доведоха Ръдърфорд до заключението, че всяка светкавица (сцинтилация) се причинява от една частица. Така предположението, което направи по-рано, беше оправдано. Тогава Ръдърфорд написа, че наблюдаването на сцинтилации върху екран с цинков сулфид е много удобен начин за преброяване на частици, ако всяка частица предизвиква светкавица. Следователно, ако всяко изригване е причинено от една частица, тогава физиците имат възможност да наблюдават поведението на отделните атоми.
Ръдърфорд и Гайгер визуално изчисляват, че в течение на секунда 130 000 α-частици се излъчват от излъчвател от една хилядна от грам радий. Точността на преброяването беше безупречна. И двамата учени, към които по-късно се присъединява Марсдън, прекарват много часове в затъмнена лаборатория, правейки досадни сцинтилационни изчисления. Гайгер каза, че само той трябва да преброи общо милион частици.
Ученикът на Ръдърфорд Марсдън започва своята работа. Той имаше за задача да преброи частиците, преминаващи през тънки метални пластини. Тези плочи бяха поставени в устройството между излъчвателя на частици и луминесцентния екран.
Поверявайки тази работа на Марсдън, Ръдърфорд не очакваше да открие нещо интересно. При условие, че моделът на атома на Томсън е правилен (и по това време няма причина да се съмнява в него), експериментът трябва да покаже, че -частиците преминават свободно през метални бариери. Но все пак нещо принуди Ръдърфорд да предприеме този нов експеримент.
Марсдън беше поразен от факта, че частиците в този прост експеримент се държат по различен начин, отколкото би трябвало, ако приемем модела на атома, предложен от Томсън. Според модела на Томсън положителният заряд е разпределен в целия обем на атома и се балансира от отрицателния заряд на електроните, всеки от които има маса много по-малка от масата на частицата. Следователно дори и в в редки случаи, когато една частица се сблъска с електрон, който е много по-лек в сравнение с нея, тя може само леко да се отклони от правия си път. Но в експериментите на Марсдън частиците не преминават безпрепятствено през металната плоча. Не, някои от тях се отклониха след удар в плочата под ъгъл около 150o, т.е. почти обратно към излъчвателя. Имаше обаче много малко такива връщащи се частици. Когато експериментаторът блокира пътя на частиците с по-дебела плоча, в полезрението му се появяват повече частици, отклонени под големи ъгли. Това показва, че разсейването на частиците, наблюдавано от Марсдън, не представлява някакъв повърхностен ефект, т.е. не е свързан с повърхността на плочата. Но Марсдън не можа да изрази никакви мисли за странното поведение на частиците, които видя. Той докладва своите наблюдения подробно на Ръдърфорд.
По-късно Ръдърфорд признава, че докладът на Марсдън е имал невероятен ефект върху него: „Беше почти невероятно, сякаш сте изстреляли петнадесетфунтов снаряд по парче тишу и снарядът е отскочил и ви е ударил.“
Ръдърфорд веднага си представи, че ефектът, наблюдаван от Марсдън, може да възникне само в един случай: ако частицата, проникнала в атома, се натъкне на някакво масивно препятствие, присъстващо в него, и бъде изхвърлена назад, получавайки силен удар при сблъсък.
Въз основа на тези изследвания Ръдърфорд предлага ядрен (планетарен) модел на атома. Според този модел около положително ядро със заряд ze (z е поредният номер на елемента в периодичната система, e е елементарен заряд), размерът е 10 -15 - 10 -14 m, а масата е почти равна на масатаатом, в област с линейни размери от порядъка на 10 -10 m, електроните се движат по затворени орбити, образувайки електронна обвивкаатом. Тъй като атомите са неутрални, зарядът на ядрото е равен на общия заряд на електроните, т.е. z електроните трябва да се въртят около ядрото.
За простота приемаме, че електронът се движи около ядрото по кръгова орбита с радиус r. В този случай силата на Кулон на взаимодействие между електрона и ядрото придава центростремително ускорение на електрона. Вторият закон на Нютон за електрон, движещ се в кръг под въздействието на силата на Кулон, има формата ![]() , където m e и v са масата и скоростта на електрона в орбита с радиус r, и е електрическата константа.
, където m e и v са масата и скоростта на електрона в орбита с радиус r, и е електрическата константа.
Това уравнение съдържа две неизвестни: r и v. Следователно има безброй стойности на радиус и съответните стойности на скорост (и следователно енергия), които удовлетворяват това уравнение. Следователно стойностите на r, v (и следователно E) могат да се променят непрекъснато, т.е. Може да се излъчва всякаква и не много специфична порция енергия. Тогава спектрите на атомите трябва да са непрекъснати. В действителност опитът показва, че атомите имат линеен спектър. От този израз също следва, че при m скоростта на електроните е m/s, а ускорението е m/s 2. Според класическата електродинамика ускорените електрони трябва да излъчват електромагнитни вълнии в резултат на това непрекъснато губят енергия. В резултат на това електроните ще се приближат до ядрото и в крайна сметка ще паднат върху него. Така атомът на Ръдърфорд се оказва нестабилна система, което отново противоречи на реалността.
Опитите да се изгради модел на атома в рамките на класическата физика не доведоха до успех: моделът на Томсън беше опроверган от експериментите на Ръдърфорд, докато ядреният модел се оказа електродинамично нестабилен и противоречи на експерименталните данни. Преодоляването на възникналите трудности изисква създаването на качествено нова – квантова – теория на атома.
Първият започва през 1914 г световна войнаи Ръдърфорд трябваше да отложи изследването си за известно време. Но периодично, докато работи за военната индустрия, той се връща към собствените си експерименти. В следващите си експерименти Ръдърфорд планира да хакне атома.
Тези опити се увенчаха с пълен и зашеметяващ успех. Новият възход на гения на Ръдърфорд доведе до откритие, което впоследствие революционизира цялата наука и технологии на нашето време. Даден е първият сигнал за началото на атомната ера. Ръдърфорд раздели атомното ядро.
Идеята за това възниква у Ръдърфорд при наблюдение в облачна камера (по това време тя вече е изобретена и подобрена) и в светкавичен брояч на мистериозни следи (следи), много по-дълги от следите на частиците, добре известни на него от безброй експерименти. Той смяташе, че има някакви неизвестни причини за рязкото увеличаване на пътя на частиците. Друга възможност (която се оказа вярна) е дългите следи да са оставени от други неидентифицирани частици. Изследователят беше изправен пред задачата да разбере кое от двете предположения е вярно.
За да получи отговор на въпросите си, Ръдърфорд решава да проведе серия от експерименти за бомбардиране на различни вещества с частици. Той създаде устройство, което сега ни изглежда невероятно просто. Но също така трябва да признаем, че само той беше най-подходящ за визуално решение на проблема. В него мишените за бомбардиране трябваше да бъдат газове (т.е. леки атоми), а не металните пластини, обикновено използвани от Ръдърфорд в много от предишните му експерименти.
Действителното устройство, построено от Ръдърфорд, с което той успява да раздели ядрата на атомите на леките елементи за първи път, е показано схематично на фигурата.
Месингова тръба 6 дължини 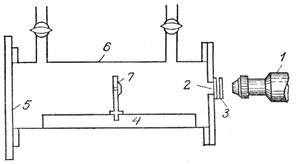 ох 20 см с два крана се пълни с газ. Вътре в тръбата има диск на радиоактивен излъчвател 7, излъчващ частици. Този диск е монтиран на стойка, движеща се по релса 4. По време на експеримента единият край на тръбата е покрит с матирано стъкло, а другият край със стъклена пластина (прикрепена с восък). Малък правоъгълен отвор в месинговата плоча беше затворен със сребърна плоча 3. Сребърната плоча имаше способността да задържа частици, еквивалентни на слой въздух с дебелина приблизително 5 cm. Срещу отвора беше поставен луминисцентен екран, направен от цинкова смес. За да преброи сцинтилациите, изследователят използва телескоп 1.
ох 20 см с два крана се пълни с газ. Вътре в тръбата има диск на радиоактивен излъчвател 7, излъчващ частици. Този диск е монтиран на стойка, движеща се по релса 4. По време на експеримента единият край на тръбата е покрит с матирано стъкло, а другият край със стъклена пластина (прикрепена с восък). Малък правоъгълен отвор в месинговата плоча беше затворен със сребърна плоча 3. Сребърната плоча имаше способността да задържа частици, еквивалентни на слой въздух с дебелина приблизително 5 cm. Срещу отвора беше поставен луминисцентен екран, направен от цинкова смес. За да преброи сцинтилациите, изследователят използва телескоп 1.
Когато Ръдърфорд напълни тръбата с азот, частици се появиха в зрителното поле, оставяйки много дълга следа, подобна на това, което той вече беше наблюдавал. Разбира се, Ръдърфорд прави още много експерименти, преди да стигне до окончателните заключения. Но окончателното заключение беше следното: когато β-частиците се сблъскат с азотни ядра, някои от тези ядра се разрушават, излъчвайки водородни ядра - протони, след което се образуват кислородни ядра.
Колосалното значение на това откритие беше ясно от самото начало на самия Ръдърфорд и неговите сътрудници. Разделянето е извършено за първи път атомни ядра. Непоклатими, както изглеждаше преди, идеи за "неразложимостта" химически елементибяха ясно опровергани. Откриха се напълно нови и невероятни възможности за изкуствено получаване на едни елементи от други, освобождаване на огромна енергия, съдържаща се в ядрата и т.н.
Продължавайки изследванията си, той получава експериментално потвърждение на позицията, която е установил по-рано - че малък брой азотни атоми се разпадат по време на бомбардировка, излъчвайки бързи протони - водородни ядра. В светлината на по-късните изследвания Ръдърфорд пише, „общият механизъм на тази трансформация е доста ясен. От време на време -частиците действително проникват в азотното ядро, като за момент образуват ново ядро като флуорното ядро с маса 18 и заряд 9. Това ядро, което не съществува в природата, е изключително нестабилно и веднага се разпада , излъчвайки протон и превръщайки се в стабилно ядро кислород с маса 17 ..."
В резултат на продължителни експерименти Ръдърфорд успя да причини ядрени реакциив 17 светлинни елемента.
Продължавайки експериментите си върху ядреното делене, Ръдърфорд стигна до следното заключение: въпреки че γ-частиците имат голяма енергия, те все още не са достатъчно мощни снаряди, за да проникнат в ядрата на елементите. Той решава да увеличи енергията на частиците, като ги ускори в инсталация с високо напрежение. Това беше първата стъпка в развитието на ускорителната технология.
-
препратки:
1) Ф. Федоров. „Верижна реакция на една идея“, изд. „Знание“, М., 1975 г.
2) Т.И.Трофимова. "Курс по физика", изд. " висше училище“, М., 1999.
3) „Ами обща физика“, Г. А. Зисман, О. М. Тодес, изд. "Еделвайс", Киев, 1994 г.
