Нека разгледаме зависимостта на някои свойства на атомите от структурата на техните електронни обвивки. Нека се спрем преди всичко на моделите на промени в атомните и йонните радиуси.
Електронните облаци нямат ясно очертани граници. Следователно концепцията за размера на атома не е строга. Но ако си представите атоми в кристали просто веществопод формата на топки, докосващи се една друга, тогава разстоянието между центровете на съседните топки (т.е. между ядрата на съседните атоми) може да се приеме равно на два пъти радиуса на атома. По този начин най-малкото междуядрено разстояние в медните кристали е равно на; това ни позволява да приемем, че радиусът на медния атом е равен на половината от тази стойност, т.е.
Зависимостта на атомните радиуси от заряда на ядрото на атом Z е периодична. В рамките на един период, когато Z се увеличава, се появява тенденция към намаляване на размера на атома, което се наблюдава особено ясно в кратки периоди (атомните радиуси са дадени в nm):
Това се обяснява с нарастващото привличане на електрони от външния слой към ядрото с увеличаване на заряда му.
С началото на изграждането на нов електронен слой, по-отдалечен от ядрото, т.е. по време на прехода към следващия период, атомните радиуси се увеличават (сравнете например радиусите на флуорните и натриевите атоми). В резултат на това в рамките на една подгрупа, с увеличаване на ядрения заряд, размерите на атомите се увеличават. Нека дадем като пример стойностите на атомните радиуси (в nm) на елементи от някои основни подгрупи:

Електроните на външния слой, които са най-слабо свързани с ядрото, могат да се отделят от атома и да се прикрепят към други атоми, като стават част от външния слой на последния.
Атомите, които са загубили един или повече електрони, стават положително заредени, тъй като зарядът на атомното ядро надвишава сумата от зарядите на останалите електрони. Напротив, атомите, които са добавили допълнителни електрони, стават отрицателно заредени. Получените заредени частици се наричат йони.
Йоните се обозначават със същите символи като атомите, показвайки техния заряд в горния десен ъгъл: например, положителен трикратно зареден алуминиев йон се обозначава с , отрицателен еднократно зареден хлорен йон се обозначава с .
Загубата на електронни атоми води до намаляване на неговия ефективен размер, а добавянето на излишни електрони води до увеличаване. Следователно радиусът на положително заредения йон (катион) винаги е по-малък, а радиусът на отрицателно заредения не (анион) винаги е по-голям от радиуса на съответния електрически неутрален атом. Така радиусът на калиевия атом е , а радиусът на йона, радиусите на хлорния атом и йон, съответно, са 0,099 и . В този случай радиусът на йона се различава толкова по-силно от радиуса на атома, колкото по-голям е зарядът на йона. Например, радиусите на хромния атом и йони са съответно 0,127, 0,083 и .
В рамките на една подгрупа радиусите на йони с еднакъв заряд се увеличават с увеличаване на ядрения заряд. Това се илюстрира със следните примери (йонните радиуси са дадени в nm):

Този модел се обяснява с увеличаването на броя на електронните слоеве и нарастващото разстояние на външните електрони от ядрото.
Атомът е електрически неутрална система, състояща се от положително заредено ядро и отрицателно заредени електрони.
Ядрата на атомите се състоят от два вида частици (нуклони) – протони (p) и неутрони (n). Зарядът на протона е равен по големина и противоположен по знак на заряда на електрона; масата му е приблизително една аму. Неутронът е незаредена частица с маса приблизително еднаква масапротон.
Линейните размери на атома са ~10 -8 cm, тези на ядрото са ~10-12 -10 -13 cm.
По-голямата част от атома е концентрирана в ядрото и се характеризира с масово число А, равно на сумата от броя на протоните (ядрения заряд) Z и неутроните N: A=Z+N.
Основната характеристикана атом е ядреният заряд (Z). Той определя броя на електроните около ядрото, т.е. принадлежността на атома към даден вид химичен елемент и съответства на атомния номер (в периодична таблицаелементи – пореден номер) на елемента.
Означението на атома на даден елемент отразява масовото число и броя на протоните - напр.
Относително атомна масана даден елемент е средната стойност на масовите числа на неговите естествени изотопи, като се вземе предвид степента на тяхното разпределение. Например хлорът в природата се среща главно под формата на два изотопа - (75,43%) и (24,57%). Относителната атомна маса на хлора е  .
.
Основа съвременна теорияСтруктурата на атома е законите и разпоредбите на квантовата (вълнова) механика - клон на физиката, който изучава движението на микрообекти.
Микрообектите имат както корпускулярни, така и вълнови свойства. За да се опише движението на микрочастиците, се използва вероятностен подход, тоест не се определя тяхната точна позиция, а вероятността да се намират в определена област на перинуклеарното пространство.
Състоянието на електрона в атома се описва с помощта на квантово-механичен модел - електронен облак, чиято плътност на съответните секции е пропорционална на вероятността за намиране на електрон. Обикновено под електронен облак се разбира областта на перинуклеарното пространство, която покрива приблизително 90% от електронния облак. Тази област от пространството се нарича още орбитала.
Съществува система от квантови числа, която определя състоянието на електрона в атома.
Главно квантово число nопределя енергията на електрона и размера на електронния облак. Може да приема цели числа от 1 до .
Набор от електронни състояния, които имат едно и също главно квантово число п, се нарича електронен слой или енергийно ниво.
Най-ниска стойностенергия E съответства п=1. Останалите квантови състояния съответстват на по-високи енергийни стойности. Електроните, намиращи се на тези енергийни нива, са по-малко свързани с ядрото.
За водородния атом квантовото състояние с п=1 съответства на най-ниската му енергия и се нарича фундаментална. държави п= 2, 3, 4... се наричат възбудени.
Орбитален(Страничното) квантово число определя орбиталния ъглов импулс на електрона и характеризира формата на електронния облак. Приема всички цели числа от 0 до ( п-1). На всички псъответства на определен брой стойности, тоест енергийното ниво е набор от енергийни поднива, малко по-различни по енергия. Броят на поднивата, на които е разделено енергийното ниво, е равен на номера на нивото(тоест числената стойност п). Тези поднива имат следните буквени обозначения:
Орбитално квантово число: 0 1 2 3 4
Подниво: s p d f g
Формите на орбиталите, съответстващи на различни стойности на са показани на следващата фигура.
плазма).
Свойства на атома, включително най-важната способност на атома да се образува химични съединения, се определят от особеностите на неговата структура.
Обща характеристика на структурата на атома. Атомът се състои от положително заредено ядро, заобиколено от облак от отрицателно заредени електрони. Размерите на атома като цяло се определят от размерите на неговия електронен облак и са големи в сравнение с размерите на ядрото (линейните размери на атома са ~ 10~8 cm, ядрото му ~ 10" -10" 13 cm). Електронният облак на атома няма строго определени граници, поради което размерите на атома са до голяма степен произволни и зависят от методите за определянето им. Ядрото на атома се състои от Z протони и Ннеутрони, задържани от ядрени сили. Положително протонен заряд и отрицателен. зарядът на електрона е идентичен по абсолютна стойност и равен на e = 1,60*10 -19 C; Неутронът няма електрически заряд. Ядреният заряд +Ze е основната характеристика на атома, която определя принадлежността му към определен химичен елемент. Пореден номер на елемента в периодичната таблица на Менделеев (атомен номер) равно на числотов сърцевината.
В електрически неутрален атом броят в облака е равен на броя на протоните в ядрото. Въпреки това, при определени условия той може да загуби или да получи електрони, ставайки съответно положителни или отрицателни. например Li +, Li 2+ или O -, O 2-. Когато говорим за атоми на определен елемент, имаме предвид както неутралните атоми, така и този елемент.
Масата на атома се определя от масата на неговото ядро; Масата на електрона (9,109 * 10 -28 g) е приблизително 1840 пъти по-малка от масата на протона или неутрона (1,67 * 10 -24 g), така че приносът към масата на атома е незначителен. Общ бройИ A = Z + Nнаречен . Масовото число и ядреният заряд се обозначават съответно с горни и долни индекси вляво от символа на елемента, например 23 11 Na. Изглед на атоми на един елемент с определена стойност Ннаречена . Атомите на един и същ елемент с еднакви Z и различни Ннаречен на този елемент Разликата в масите на изотопите има малък ефект върху техните химични и физични свойствао Най-значимите разлики се наблюдават при изотопите на водорода поради голямата относителна разлика в масите на обикновения (протиум), D и T. Точните стойности на атомните маси се определят чрез масспектрометрични методи.
атом Поради малкия си размер и голяма маса, ядрото на атома може да се разглежда приблизително като точка и в покой в центъра на масата на атома, а атомът може да се разглежда като система от електрони, движещи се около неподвижен център - ядрото. Общата енергия на такава система дравна на сумата от кинетичните енергии Твсеки и потенциална енергия U, който се състои от енергията на привличане от ядрото и енергията на взаимно отблъскване на електрони един от друг. Атомът се подчинява на законите на квантовата механика; нейната основна характеристика като квантова система е общата енергия Е -може да приеме само една от стойностите на дискретна серия E 1 ...; прекъсващ Един атом не може да има енергийни стойности. Всяка от "разрешените" стойности дсъответства на едно или повече стационарни (с енергия, която не се променя във времето) състояния на атома Енергия дможе да се промени само рязко - чрез квантов преход на атом от едно стационарно състояние в друго. Методите на квантовата механика могат да се използват за точно изчисляване дза едноелектронни атоми - водородни и водородоподобни: E= -hcRZ 2 /n 2,Къде ч-Константа на Планк с-скорост на светлината, цяло число п= 1, 2, 3, ... определя дискретни енергийни стойности и се извиква. главно квантово число; Ридбергова константа ( hcR = 13,6 eV). Когато се използва SI, формулата за изразяване на дискретни енергийни нива на едноелектронни атоми се записва като:

Къде т е -електронна маса, е електрическа константа. Възможните „разрешени“ енергийни стойности в атома са изобразени под формата на диаграма на енергийните нива - хоризонтални прави линии, разстоянията между които съответстват на разликите между тези енергийни стойности ( Фигура 1). най-ниското ниво на E 1, съответстващо на минималната възможна енергия, се нарича земя, всички останали се наричат възбудени. По подобен начин се наричат състоянията (основно и възбудено), на които съответстват посочените енергийни нива. С растеж пнивата се приближават и когато енергията на електрона се доближи до стойността, съответстваща на свободен (почиващ) електрон, отстранен от атома. Квантово състояние на атом с енергия днапълно описано вълнова функция, където r е радиус векторът на електрона на ядрото. Продуктът е равен на вероятността да се намери електрон в обема dV,тоест плътността на вероятността. Вълновата функция се определя от уравнението на Шрьодингер = , където операторът R обща енергия(Хамилтонов).
Заедно с енергията, движението на електрона около ядрото (орбитално движение) се характеризира с орбитален ъглов импулс (орбитален механичен импулс) M 1; квадратът на неговата величина може да приема стойности, определени от орбиталното квантово число l = 0, 1, 2, ...; ![]() , Къде . За дадено и квантово число l може да приема стойности от 0 до (и - 1). Проекцията на орбиталния импулс върху определена ос z също приема дискретна поредица от стойности M lz = , където m l е магнитно квантово число с дискретни стойности от - l до + l (-l,... - 1, 0, 1, ... + l), общо 2л+ 1 стойности. Оста z за атома при липса на външни сили се избира произволно, а в магнитно поле съвпада с посоката на вектора на напрегнатостта на полето. Електронът също има свой собствен ъглов момент -завъртанеи свързания спинов магнитен момент. Механичен момент на въртене на квадрат M S 2 = S(S+ + 1) се определя от спиновото квантово число С= 1/2 и проекцията на този момент върху оста z M sz = =- квантово число m s,вземане на полуцели стойности m s = 1/2И m s= - 1 / 2 .
, Къде . За дадено и квантово число l може да приема стойности от 0 до (и - 1). Проекцията на орбиталния импулс върху определена ос z също приема дискретна поредица от стойности M lz = , където m l е магнитно квантово число с дискретни стойности от - l до + l (-l,... - 1, 0, 1, ... + l), общо 2л+ 1 стойности. Оста z за атома при липса на външни сили се избира произволно, а в магнитно поле съвпада с посоката на вектора на напрегнатостта на полето. Електронът също има свой собствен ъглов момент -завъртанеи свързания спинов магнитен момент. Механичен момент на въртене на квадрат M S 2 = S(S+ + 1) се определя от спиновото квантово число С= 1/2 и проекцията на този момент върху оста z M sz = =- квантово число m s,вземане на полуцели стойности m s = 1/2И m s= - 1 / 2 .

ориз. 1. Диаграма на водородните енергийни нива (хоризонтални линии) и оптични преходи (вертикални линии). По-долу е част от атомния спектър на водородната емисия - две серии от спектрални линии; Пунктираната линия показва съответствието на линиите и преходите на електрона
Стационарното състояние на едноелектронен атом се характеризира уникално с четири квантови числа: n, l, m l и m s. Енергията на водородния атом зависи само от п, и ниво с дадено псъответства на редица състояния, различаващи се в стойностите на l, m l, m sДържави с посочени пи l обикновено се означава като 1s, 2s, 2p, 3sи т.н., където числата показват стойностите на k, а буквите s, p, d, f ипо-нататък в латинската азбука съответстват на стойностите l = 0, 1, 2, 3, ... Брой различни състояния с даден пи l е равно на 2(2l+ 1) броя на комбинациите от стойности m l и m s. Общ брой водолази. държави с даден правни 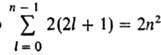 , т.е. нива със стойности п= 1, 2, 3, ... съответства на 2, 8, 18, ..., 2n 2 decomp. квантови състояния. Ниво, на което отговаря само едно квантово състояние (една вълнова функция), се нарича неизродено. Ако едно ниво съответства на две или повече квантови състояния, то се нарича изродено. Във водородния атом енергийните нива са изродени в стойностите на l и m l; израждането в m s възниква само приблизително, ако не вземем предвид взаимодействието на спина магнитен моментелектрон с магнитно поле, причинени от орбиталното движение на електрона в електрическото поле на ядрото. Това е релативистичен ефект, малък в сравнение с взаимодействието на Кулон, но е фундаментално значим, тъй като води до допълнително разделяне на енергийните нива, което се проявява в атомните спектри под формата на така наречената фина структура.
, т.е. нива със стойности п= 1, 2, 3, ... съответства на 2, 8, 18, ..., 2n 2 decomp. квантови състояния. Ниво, на което отговаря само едно квантово състояние (една вълнова функция), се нарича неизродено. Ако едно ниво съответства на две или повече квантови състояния, то се нарича изродено. Във водородния атом енергийните нива са изродени в стойностите на l и m l; израждането в m s възниква само приблизително, ако не вземем предвид взаимодействието на спина магнитен моментелектрон с магнитно поле, причинени от орбиталното движение на електрона в електрическото поле на ядрото. Това е релативистичен ефект, малък в сравнение с взаимодействието на Кулон, но е фундаментално значим, тъй като води до допълнително разделяне на енергийните нива, което се проявява в атомните спектри под формата на така наречената фина структура.
За дадени n, l и m l, квадратът на модула на вълновата функция определя средното разпределение на електронната плътност за електронния облак в атома. Различните квантови състояния на водородния атом се различават значително едно от друго в разпределението на електронната плътност (фиг. 2). Така при l = 0 (s-състояние) електронната плътност е различна от нула в центъра на атома и не зависи от посоката (т.е. тя е сферично симетрична); за други състояния тя е равна на нула при центъра на атома и зависи от посоката.

ориз. 2. Форма на електронни облаци за различните състояния на водорода
В многоелектронните атоми, поради взаимното електростатично отблъскване на електроните, силата на връзката им с ядрото значително намалява. Например, енергията на отстраняване на електрони от . He + е равен на 54,4 eV, в неутрален атом He е много по-малко - 24,6 eV. При по-тежките атоми връзката между външните електрони и ядрото е още по-слаба. Важна роля в многоелектронните атоми играят специфичните обменно взаимодействие,свързано с неразличимостта на електроните и факта, че електроните се подчиняват на принципа на Паули, според който всяко квантово състояние, характеризиращо се с четири квантови числа, не може да съдържа повече от един електрон. За многоелектронен атом има смисъл да се говори само за квантови състояния на целия атом като цяло. Въпреки това, приблизително, в така нареченото едноелектронно приближение, е възможно да се разгледат отделни квантови състояния и да се характеризира всяко едноелектронно състояние (определено орбитален,описано от съответната функция) от набор от четири квантови числа n, l, m l и m sКолекция 2(2l+1) в състояние с данни пи l образува електронна обвивка (наречена подниво, подобвивка); ако всички тези състояния са заети от електрони, обвивката се нарича запълнена (затворена). Тоталност 2n 2състояния с едно и също n, но различно l образува електронен слой (наричан още ниво, обвивка). За n= 1, 2, 3, 4, ... слоевете са обозначени със символи ДО,Л, М, Н,... Броят на електроните в обвивките и слоевете, когато са напълно запълнени, е даден в таблицата:
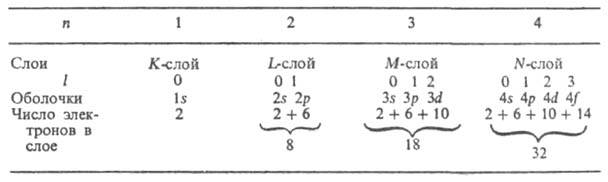
Силата на връзката на електрона в атома, тоест енергията, която трябва да бъде предадена на електрона, за да бъде отстранен от атома, намалява с увеличаване на n и за даден n - sувеличаване на l. Редът, в който електроните запълват черупки и слоеве в сложен атом, определя неговата електронна конфигурация, тоест разпределението на електроните между черупките в основното (невъзбудено) състояние на този атом и неговите . С това запълване електроните с нарастващи стойности на u и / се свързват последователно. Например за азотния атом (Z = 7) и неговите N + , N 2+ , N 3+ , N 4+ , N 5+ и N 6+ електронни конфигурации са съответно: Is 2 2s 2 2p 3 ; Е 2 2s 2 2p 2 ; Е 2 2s 2 2p; Е 2 2s 2 ; Е 2 2s; е 2; Е (броят на електроните във всяка обвивка се обозначава с индекса горе вдясно). Неутралните атоми на елементите със същия брой електрони имат същите електронни конфигурации като тези на азота: C, B, Be, Li, He, H (Z = 6, 5, 4, 3, 2, 1). Започвайки от n = 4, редът на запълване на черупките се променя: електрони с по-голям n,но с по-малко l те се оказват по-здраво свързани от електроните с по-малко пи голямо l (правило на Клечковски), например, 4s електроните са свързани по-здраво от 3d електроните и 4s обвивката се запълва първо, а след това 3г.При пълнене на черупките 3d, 4d, 5dполучават се групи от съответни преходни елементи; при пълнене 4f-и 5 f-черупки – респ. лантаниди и актиниди. Редът на запълване обикновено съответства на нарастваща сума от квантови числа ( п+л ); ако тези суми са равни за две или повече черупки, черупките с по-малката и се пълнят първи. Случва се следното. последователност от запълване на електронни обвивки:

За всеки период са посочени електронна конфигурацияблагороден газ, макс. брой електрони, а последният ред показва стойностите п+ л. Съществуват обаче отклонения от тази процедура на пълнене.
Между стационарни състоянияВ атома са възможни квантови преходи. При движение от повечевисоко ниво енергия E i към по-ниска E k атомът отдава енергия (E i - E k), а по време на обратния преход я получава. По време на радиационни преходи атомът излъчва или абсорбира квант електромагнитно излъчване (фотон). Възможни са и нерадиационни преходи, когато атом отдава или получава енергия при взаимодействие с други частици, с които се сблъсква (например в газове) или е свързан за дълго време (в молекули, течности итвърди вещества ). В атомните газове, в резултат на сблъсък на свободен атом с друга частица, той може да се премести на друго енергийно ниво - да преживее нееластичен сблъсък; по време на еластичен сблъсък се променя само кинетичната енергия на постъпателното движение на атома и неговата обща достава непроменена. Нееластичен сблъсък на свободен атом с бързо движещ се електрон, който предава кинетичната си енергия на този атом - възбуждане на атома чрез електронен удар - е един от методите за определяне на енергийните нива на атома.
Строеж и свойства на веществата.Химичните свойства се определят от структурата на външните електронни обвивки на атома, в които електроните са свързани относително слабо (енергии на свързване от няколко eV до няколко десетки eV). Структурата на външните обвивки на атомите на химичните елементи от една група (или подгрупа) е периодична. системите са подобни, което определя сходството химични свойстватези елементи. Тъй като броят на електроните в запълващата обвивка се увеличава, тяхната енергия на свързване, като правило, се увеличава; Електроните в затворена обвивка имат най-висока енергия на свързване. Следователно атомите с един или повече електрони в частично запълнена външна обвивка ги даряват на химически реакции. Атомите, на които липсва един или повече, за да образуват затворена външна обвивка, обикновено ги приемат. Атомите на благородния газ, които имат затворени външни обвивки, не влизат в химични реакции при нормални условия.
Структура вътрешни черупкиатоми, чиито електрони са свързани много по-здраво (енергия на свързване 10 2 -10 4 eV), се проявява само когато атомите взаимодействат с бързи частици и високоенергийни фотони. Такива взаимодействия определят естеството на рентгеновите спектри и разсейването на частици (електрони, неутрони) върху атомите. Масата на атома определя неговите физически свойства като импулс и кинетична енергия. Някои фини физически ефекти (ЯМР, ЯКР, хиперфина структура на спектралните линии) зависят от механичните и свързаните с тях магнитни и електрически моменти на атомното ядро.
По-слаби в сравнение с химичните връзки електростатични взаимодействиядва атома се проявяват във взаимната им поляризуемост - изместване спрямо ядрата и възникване на поляризационни сили на привличане между атомите. Атомът също е поляризиран външно електрически полета; В резултат на това енергийните нива се изместват и, най-важното, изродените нива се разделят. Атомът може също да бъде поляризиран под въздействието на електрическо поле, вълна от електромагнитно излъчване; поляризацията зависи от честотата на излъчване, което определя зависимостта от него на коефициента на пречупване на веществото, свързано с поляризуемостта на атома оптични свойстваатом с неговата електрическа свойствата са особено изразени в оптичните спектри.
Външните електрони на атома определят и магнитни свойствавещества. В атом със запълнени външни обвивки, неговият магнитен момент, подобно на общия ъглов момент (механичен момент), равен на нула. Атомите с частично запълнени външни обвивки имат по правило постоянни магнитни моменти, различни от нула; такива вещества са парамагнитни. Във външно магнитно поле всички нива на атомна енергия, за които магнитният момент не е нула, се разделят. Всички атоми имат диамагнетизъм, който се дължи на появата на индуциран магнитен момент под въздействието на външно магнитно поле.
Свойствата на атома в свързано състояние (например част от молекула) се различават от свойствата на свободните атоми; външни електрони, участвайки в химическа връзка; свойствата, определени от електроните на вътрешните обвивки, могат да останат практически непроменени. Някои свойства на атома могат да претърпят промени в зависимост от симетрията на околната среда на даден атом. Пример за това е разделянето на атомните енергийни нива в кристали и сложни съединения, което се случва под въздействието на електрически полета, създадени от околните или лиганди.
Литература:Карапетянц М. X., Дракин С. И., Структура на материята, 3 изд., М., 1978; Shlolevsky E.V., Атомна физика, 7 изд., том 1-2, М., 1984. М.А. Еляшевич.
Изберете първата буква от заглавието на статията:
атом(от старогръцки ἄτομος - неделим) - частица от вещество с микроскопични размери и маса, най-малката част от химичен елемент, която е носител на неговите свойства.Атомът се състои от атомно ядрои електрони. Ако броят на протоните в ядрото съвпада с броя на електроните, тогава атомът като цяло се оказва електрически неутрален. В противен случай той има някакъв положителен или отрицателен заряд и се нарича йон. В някои случаи атомите се разбират само като електрически неутрални системи, в които зарядът на ядрото е равен на общия заряд на електроните, като по този начин ги противопоставя на електрически заредените. йони.
Ядро, който носи почти цялата (повече от 99,9%) маса на атома, се състои от положително заредени протони и незаредени неутрони, свързани помежду си чрез силно взаимодействие. Атомите се класифицират според броя на протоните и неутроните в ядрото: броят на протоните Z съответства на поредния номер на атома в периодичната таблица и определя принадлежността му към определен химичен елемент, а броят на неутроните N - a специфичен изотоп на този елемент. Числото Z също определя общия положителен резултат електрически заряд(Ze) на атомното ядро и броя на електроните в неутрален атом, който определя неговия размер.
Атоми различни видовев различни количества, свързани с междуатомни връзки, образуват молекули.
Свойства на атома
По дефиниция всеки два атома с еднакъв брой протони в ядрата си принадлежат към един и същ химичен елемент. Атомите с еднакъв брой протони, но различен брой неутрони се наричат изотопи на даден елемент. Например, водородните атоми винаги съдържат един протон, но има изотопи без неутрони (водород-1, понякога наричан още протий - най-често срещаната форма), с един неутрон (деутерий) и два неутрона (тритий). Познатите елементи образуват непрекъснат естествен ред според броя на протоните в ядрото, като се започне от водородния атом с един протон и се стигне до атома унунокций, който има 118 протона в ядрото. Всички изотопи на елементите на периодичната таблица, започвайки с номер 83 (бисмут), са радиоактивни.
Тегло
Тъй като протоните и неутроните имат най-голям принос към масата на атома, общият брой на тези частици се нарича масово число. Останалата маса на атома често се изразява в единици за атомна маса (a.m.u.), което също се нарича далтон (Da). Тази единица се определя като 1⁄12 от масата на покой на неутрален атом въглерод-12, което е приблизително равно на 1,66 × 10−24 g. Водородът-1 е най-лекият изотоп на водорода и атомът с най-малка маса атомно тегло около 1,007825 a. e.m. Масата на атома е приблизително равна на произведението от масовото число и единицата за атомна маса. Най-тежкият стабилен изотоп е 207,9766521 а. е.м.
Тъй като масите дори на най-тежките атоми в обикновени единици (например грамове) са много малки, моловете се използват в химията за измерване на тези маси. Един мол от всяко вещество, по дефиниция, съдържа същия брой атоми (приблизително 6,022·1023). Това число (числото на Авогадро) е избрано по такъв начин, че ако масата на даден елемент е 1 a. e.m., тогава един мол атоми на този елемент ще има маса 1 g. Например въглеродът има маса 12 a. e.m., така че 1 мол въглерод тежи 12 g.
Размер
Атомите нямат ясно дефинирана външна граница, така че техните размери се определят от разстоянието между ядрата на съседни атоми, които са образували химична връзка (ковалентен радиус) или от разстоянието до най-отдалечената стабилна електронна орбита в електронната обвивка на този атом (атомен радиус). Радиусът зависи от позицията на атома в периодичната таблица, вида на химическата връзка, броя на близките атоми (координационно число) и квантово механично свойство, известно като спин. В периодичната таблица на елементите размерът на атома се увеличава, когато се движите надолу по колона и намалява, когато се движите надолу по ред отляво надясно. Съответно най-малкият атом е атом на хелий с радиус 32 pm, а най-големият е атом на цезий (225 pm). Тези размери са хиляди пъти по-малки от дължината на вълната на видимата светлина (400-700 nm), така че атомите не могат да се видят с оптичен микроскоп. Отделни атоми обаче могат да се наблюдават с помощта на сканиращ тунелен микроскоп.
Малкостта на атомите се демонстрира от следните примери. Човешкият косъм е милион пъти по-дебел от въглероден атом. Една капка вода съдържа 2 секстилиона (2 1021) кислородни атома и два пъти повече водородни атоми. Един карат диамант с тегло 0,2 g се състои от 10 секстилиона въглеродни атома. Ако една ябълка може да бъде увеличена до размера на Земята, тогава атомите ще достигнат първоначалния размер на ябълката.
Учени от Харковския физико-технологичен институт представиха първите снимки на атом в историята на науката. За да получат изображения, учените са използвали електронен микроскоп, който записва радиация и полета (полево-емисионен електронен микроскоп, FEEM). Физиците последователно поставят десетки въглеродни атоми във вакуумна камера и пропускат през тях електрически разряд от 425 волта. Излъчването на последния атом във веригата върху фосфорен екран направи възможно получаването на изображение на облак от електрони около ядрото.
Молекула(novolat. молекула, съкратено от латински. moles-маса), микрочастица, образувана от два или повече атома и способна на независимо съществуване. Той има постоянен състав (качествен и количествен) на включените в него атомни ядра и фиксиран брой електрони и има набор от свойства, които позволяват да се разграничи една молекула от други, включително от молекули със същия състав. Молекулата, като система, състояща се от взаимодействащи електрони и ядра, може да бъде в различни състояния и да преминава от едно състояние в друго принудително (под въздействието на външни влияния) или спонтанно. Всички молекули от даден тип се характеризират с определен набор от състояния, които могат да служат за идентифициране на молекулите. Като независима формация, молекулата има във всяко състояние определен набор от физични свойства; тези свойства се запазват в една или друга степен по време на прехода от молекулите към съставеното от тях вещество и определят свойствата на това вещество. По време на химичните трансформации молекулите на едно вещество обменят атоми с молекули на друго вещество, разпадат се на молекули с по-малко атоми и също така влизат в други видове химични реакции. Следователно химията изучава веществата и техните трансформации в неразривна връзка със структурата и състоянието на молекулите
Обикновено една молекула е електрически неутрална частица; ако една молекула носи електрически заряд (положителен или отрицателен), тогава говорим за молекулни йони (съответно катиони или аниони). В едно вещество положителните йони винаги съществуват заедно с отрицателните. Молекулите, които са в състояния с множественост, различна от единица (обикновено в дублетни състояния), се наричат радикали. Свободните радикали при нормални условия, като правило, не могат да съществуват дълго време. Известни са обаче свободни радикали със сравнително сложна структура, които са доста стабилни и могат да съществуват при нормални условия.
В зависимост от броя на атомните ядра, включени в молекулата, молекулите се разграничават като двуатомни, триатомни и т.н. Ако броят на атомите в една молекула надвишава стотици и хиляди, молекулата се нарича макромолекула. Сумата от масите на всички атоми, които изграждат молекулата, се счита за молекулна маса (виж също Молекулна маса на полимер. Разпределение на молекулната маса). По размер молекулно теглоВсички вещества условно се разделят на ниско- и високомолекулни.
атом(от старогръцки ἄτομος - неделим) - частица от вещество с микроскопични размери и маса, най-малката част от химичен елемент, която е носител на неговите свойства.
Идеята за атомите като неделими най-малки частици материя възниква в древността, но едва през 18 век чрез трудовете на А. Лавоазие, М. В. Ломоносов и други учени е доказана реалността на съществуването на атомите.
Обща характеристика на структурата на атома. Атомът се състои от положително заредено ядро, заобиколено от облак от отрицателно заредени електрони. Размерите на атома като цяло се определят от размерите на неговия електронен облак и са големи в сравнение с размерите на атомното ядро (линейните размери на атома са ~ 10~8 cm, ядрото му ~ 10" -10" 13 см). Електронният облак на атома няма строго определени граници, така че размерът на атома означава. градусите са произволни и зависят от методите за тяхното определяне (виж Атомни радиуси). Ядрото на атома се състои от Z протони и N неутрони, държани заедно от ядрени сили (вижте Атомно ядро). Положително протонен заряд и отрицателен. зарядът на електрона е еднакъв в абсолютно изражение. магнитуд и са равни на e = 1,60*10 -19 C; неутронът няма електричество. такса. Ядрен заряд +Ze - основен. характеристика на атома, която определя принадлежността му към определен химикал. елемент. Поредният номер на елемента в периодичния период. периодична система (атомен номер) е равен на броя на протоните в ядрото.
В електрически неутрален атом броят на електроните в облака е равен на броя на протоните в ядрото. Въпреки това, при определени условия, той може да загуби или да спечели електрони, съответно да се обърне. в положителен или отричам. йон, напр. Li +, Li 2+ или O -, O 2-. Когато говорим за атоми на определен елемент, имаме предвид както неутрални атоми, така и йони на този елемент.
Атомен строеж и свойствавещества. Chem. Светците се определят от структурата на екстериора. електронни обвивки на атоми, в които електроните са свързани относително слабо (енергии на свързване от няколко eV до няколко десетки eV). Външна структура обвивки на химически атоми. елементи от една група (или подгрупа) периодични. системите са подобни, което определя сходството на химикалите. St. в тези елементи (1) С увеличаване на броя на електроните в запълващата обвивка, тяхната енергия на свързване, като правило, се увеличава; макс. електроните в затворена обвивка имат енергия на свързване. Следователно атомите с един или повече. електрони в частично запълнено вътр. обвивката се дава на химикала. р-ции. Atoms, Крим липсва един или повече. електрони за образуване на затворен външен. черупките обикновено ги приемат. Атоми на благородни газове със затворен външен черупки, при нормални условия не влизат в химични реакции. области.
Вътрешна структура обвивки на атоми, чиито електрони са свързани много по-здраво (енергия на свързване 10 2 -10 4 eV), се появява само по време на взаимодействие. атоми с бързи частици и високоенергийни фотони. Такива взаимодействия определят естеството на рентгеновите спектри и разсейването на частици (електрони, неутрони) върху атоми (виж Дифракционни методи). Масата на атома определя неговите физически свойства. свят, като импулс, кинетичен. енергия. От механични и свързани с тях магнити. и електрически моментите на атомното ядро зависят от някои фини физически фактори. ефекти (ЯМР, ЯКР, хиперфина структура на спектрални линии, виж Спектроскопия).
1 бележка под линия: Електрон-волт(рядко електронволт; Руско обозначение: eV, международен: eV) - извънсистемна единица енергия, използвана в атомната и ядрената физика, във физиката на елементарните частици и в близки и сродни области на науката (биофизика, физикохимия, астрофизика и др.). В Руската федерация електронволтът е одобрен за използване като извънсистемна единица без ограничение за периода на приложение.
Ядрен модел на атома
В началото на 20 век в резултат на изследването на катодните лъчи са открити отрицателни частици - електрони със заряд 1,6. 10‾ 19 С, маса 9,11. 10‾ 31 kg, открито рентгеново електромагнитно излъчване. Обобщавайки тези открития, Дж. Томсън през 1897 г. предлага своя модел на атома - това е положително заредена сфера, в която са разпръснати отрицателни електрони (като стафиди в пудинг). Ако този модел е правилен, тогава металното фолио е филм от положително електричество, съдържащ електрони и потокът от α-частици трябва лесно да прониква през него, без да променя посоката.
През 1909 г. служители на англ. ученият Е. Ръдърфорд провери това. 1 от 100 000 α-частици, когато преминават през златно фолио, се разпръскват под големи ъгли и дори се връщат обратно. Анализирайки резултатите от експеримента, Ръдърфорд заключава, че масата и зарядът на атома са концентрирани в малка част от обема, наречена ядро. Тези α-частици, които се сблъскват с ядра, се отхвърлят. Повечето α частици преминават през пространството между ядрата. Моделът на структурата на атома, предложен от Е. Ръдърфорд, приличаше на слънчевата система. Нарича се планетарен модел. Според нея в центъра на атома има положително ядро, в което е съсредоточена цялата маса на атома. Електроните се движат около ядрото по кръгови орбити. Зарядът на ядрото и броят на електроните са еднакви, т.е. атомът е неутрална частица.
През 1913г Английският физик Моузли измерва дължините на вълните на рентгеновите лъчи, излъчвани от различни метали в катодна тръба, и начертава зависимостта на обратния корен квадратен от дължината на вълната на рентгеновите лъчи от атомния номер на елемента. Тази графика (фиг. 1) показва, че серийният номер отразява някои важни характеристики на елемента. Моузли предположи, че тази характеристика е зарядът на ядрото на атома и че той се увеличава с единица при преминаване от един елемент към следващия по ред. Той нарече атомното число атомното число - З.
Законът на Моузли:
Корен квадратен от реципрочната стойност на дължината на вълната на рентгеновите лъчи, излъчвани от атоми на различни елементи, се намира в линейна зависимостот серийния номер на елемента.
Това е закон, който свързва честотата на спектралните линии на характеристичното рентгеново лъчение на атом на химичен елемент с неговия атомен номер.
където е дължината на вълната, А– постоянна стойност, З– пореден номер на елемента (ядрен заряд).
По-късно стана известно, че атомният номер е равен на броя на протоните в ядрото. По този начин атомният номер е равен на заряда на ядрото и също така определя наличието на протони (положителни частици) в него. И тъй като атомите са неутрални, броят на електроните в атома трябва да е равен на броя на протоните. Но масите на атомите се оказаха по-големи от общата маса на протоните. За да се обясни излишната маса, се предполага съществуването на неутрони. Тези частици трябва да имат същата маса като протон, но нулев заряд (1,675 - 10 - 27 kg). Неутронът е открит от сътрудника на Ръдърфорд Чадвиг през 1932 г. Окончателно е установено, че атомът се състои от ядро и електрони, а ядрото от протони и неутрони. Тяхната сума се нарича нуклонномер или масивна - А.
А= З+ Н,
З- брой протони, Н- брой неутрони.
Атоми с различен брой протони ( З) и неутрони ( Н), но със същия брой нуклони А, наречена изобари . например,
Изотопи – атоми с еднакъв брой протони ( З), нос различни числануклони
Изотони – атоми с еднакъв брой неутрони ( Н)
По този начин дробните стойности на атомните маси в периодичната таблица се обясняват с наличието на изотопи за същия елемент.
Атомно ядро- централната част на атома, в която е концентрирана по-голямата част от неговата маса (повече от 99,9%). Ядрото е положително заредено; зарядът на ядрото се определя от химичния елемент, към който е приписан атомът. Размерите на ядрата на различни атоми са няколко фемтометра, което е повече от 10 хиляди пъти по-малко от размера на самия атом.
Спектрална линия- характеристика на част от спектъра, изразяваща се в локално повишаване (светлина, емисионни линии, спектрални максимуми) или намаляване (тъмни линии, абсорбционни линии, спектрални минимуми) на нивото на сигнала.
Остатъчен интензитетнаречено усилване/затихване на радиация в спектрална линия в сравнение с непрекъснат спектър.
Функцията, характеризираща зависимостта на остатъчния интензитет от честотата, се нарича профил на линията.
Рентгеново лъчение- електромагнитни вълни, чиято енергия на фотоните лежи в скалата на електромагнитните вълни между ултравиолетовото лъчение и гама лъчение, което съответства на дължини на вълните от 10 −2 до 10 2 Å (от 10 −12 до 10 −8 m).
Фотон(от древногръцки φῶς, роден пад. φωτός, „светлина“) - елементарна частица, квант електромагнитно излъчване (в тесния смисъл на светлината). Това е безмасова частица, способна да съществува във вакуум само като се движи със скоростта на светлината.
