Aihe 2. VAIHEEN SIIRTYMÄT.
Vaiheensiirto (vaihemuutos) on aineen siirtymistä vaiheesta toiseen, kun ulkoiset kanavat muuttuvat (esimerkiksi lämpötila, paine, magneettikentät ja sähkökentät jne.), Johon liittyy aineen fysikaalisten ominaisuuksien ja parametrien muutos.
Lämpötilan, paineen tai muun fysikaalisen määrän arvoa, jolla vaihesiirto tapahtuu, kutsutaan siirtymäpisteeksi. Erota kahden suvun vaihesiirto.
ENSIMMÄINEN VAIHTO SIIRTYMÄT
Ensimmäisen kertaluvun vaihesiirtymissä tällainen termodynaaminen
aineen ominaisuudet, kuten tiheys, komponenttien konsentraatio, ominaistilavuus, varastoidun sisäisen energian määrä, ts. tietty määrä lämpöä, jota kutsutaan siirtymälämpöä, vapautuu tai absorboituu. Ja tarkoitan näiden määrien äkillistä muutosta ei ajassa, vaan lämpötilan, paineen jne. Muutoksissa. Yleisimmät esimerkit ensimmäisen tyyppisistä vaihesiirtymistä:
- sulaminen ja kiteytyminen
- haihtuminen ja kondensoituminen
- sublimointi ja subublimointi
TOINEN VAIHEEN SIIRTYMINEN
Toisen asteen vaihesiirtymän tapauksessa tiheys ja sisäinen energia eivät muutu, joten tällainen vaihesiirto saattaa olla näkymätön paljaalla silmällä. Hyppy tapahtuu niiden johdannaisten suhteen lämpötilaan ja paineeseen: lämpökapasiteetti, lämpölaajenemiskerroin, erilaiset herkkyydet jne. toisen kertaluvun vaihesiirtymisiin liittyy muutos aineen rakenteen symmetriassa, ei energian (lämmön) vapautumisen tai imeytymisen kanssa. Yleisimmät esimerkit toisen tyyppisistä vaihesiirtymistä:
- järjestelmä kulkee kriittisen pisteen läpi
- paramagneetti-ferromagneetti-siirtymä
- metallien ja seosten siirtyminen suprajohtavuuden tilaan
- nestemäisen heliumin supernesteinen siirtyminen
- amorfisten materiaalien siirtyminen lasimaiseen tilaan
Moderni fysiikka tutkii myös järjestelmiä, joissa on kolmannen tai korkeamman vaiheen muutokset. Äskettäin käsitys kvanttifaasimuutoksesta, ts. vaihesiirtymää, jota ei hallita klassisilla lämpövaihteluilla, vaan kvanttivaiheilla, joita esiintyy jopa absoluuttisessa nollalämpötilassa, jossa klassista vaihesiirtymää ei voida toteuttaa Nernst-lauseen takia.
Tarkastellaan yksityiskohtaisemmin meitä kiinnostavia ilmiöitä, jotka liittyvät ensimmäisen tyyppisiin vaihesiirtymiin.
SUORITTAMINEN, JÄÄHDYTYS, Kiehuminen.
Tyydyttyneet ja tyydyttämättömät upporat.
Tietyissä olosuhteissa mikä tahansa aine voi olla erilaisissa aggregaatiotiloissa - kiinteä, nestemäinen ja kaasumainen. Siirtymät yhdentymistilasta toiseen ovat ensimmäisen tyyppisiä vaihesiirtymiä.
haihtuminen ja kondensaatio ovat vaihesiirtymiä aineen neste- ja kaasumaisten vaiheiden välillä.
kaikki oikeat kaasut (happi, typpi, vety jne.) voivat tietyissä olosuhteissa muuttua nestemäisiksi. Tällainen muutos voi kuitenkin tapahtua vain lämpötiloissa, jotka ovat tiettyä, ns kriittinen lämpötila T kr. Esimerkiksi veden kriittinen lämpötila on 647,3 K, typen 126 K, hapen 154,3 K. Huoneenlämpötilassa (≈ 300 K) vesi voi olla sekä nestemäisessä että kaasumaisessa tilassa ja typpi ja happi ovat olemassa vain kaasujen muodossa.
haihtuminen kutsutaan vaihesiirtymistä nesteestä kaasumaiseen tilaan. Molekyyli-kineettisen teorian kannalta haihtuminen on prosessi, jossa nopeimmat molekyylit lentävät nesteen pinnalta, jonka kineettinen energia ylittää niiden sitoutumisen muihin nestemäisiin molekyyleihin energian. Tämä johtaa jäljellä olevien molekyylien keskimääräisen kineettisen energian laskuun, ts. Nesteen jäähtymiseen (jos ympäröivistä kappaleista ei tule energiaa).
kondensaatio Onko päinvastainen haihtumisprosessille. Kondensoitumisen yhteydessä höyrymolekyylit palautuvat nesteeseen.
Suljetussa astiassa neste ja sen höyry voivat olla tilassa dynaaminen tasapainokun nesteestä poistuvien molekyylien lukumäärä on yhtä suuri kuin niiden molekyylien lukumäärä, jotka palautuvat nesteeseen höyrystä, ts. kun haihtumis- ja kondensoitumisnopeudet ovat samat. Tätä järjestelmää kutsutaan biphasic . Höyryä, joka on tasapainossa nesteen kanssa, kutsutaan tyydyttynyt.
Nesteen yksikköpinta-alalta ulos sekunnissa lentävien molekyylien lukumäärä riippuu nesteen lämpötilasta. Höyrystä nesteeseen palaavien molekyylien lukumäärä riippuu höyrymolekyylien pitoisuuksista ja niiden keskimääräisestä nopeudesta lämpöliike, jonka määrää höyryn lämpötila. Tästä seuraa, että tietylle aineelle höyrymolekyylien konsentraatio nesteen ja sen höyryn tasapainossa määritetään niiden tasapainolämpötilan perusteella. Dynaamisen tasapainon muodostuminen haihtumis- ja kondensaatioprosessien välillä lämpötilan noustessa tapahtuu korkeampien höyrymolekyylipitoisuuksien yhteydessä. Koska kaasun (höyryn) paine määritetään sen pitoisuuden ja lämpötilan perusteella, voidaan päätellä: paine kylläinen höyry s Tietyn aineen 0 riippuu vain sen lämpötilasta eikä tilavuudesta. Siksi todellisten kaasujen isotermit tasossa ( p, V) sisältävät vaakasuorat leikkeet, jotka vastaavat kaksivaiheista järjestelmää (kuva 3.4.1).
Lämpötilan noustessa kylläisen höyryn paine ja sen tiheys kasvavat, ja nesteen tiheys vähenee lämpölaajenemisesta johtuen. Lämpötilassa, joka on yhtä suuri kuin kriittinen lämpötila T cr tietylle aineelle, höyryn ja nesteen tiheydestä tulee sama. at T > T cr fysikaaliset erot nesteen ja sen tyydyttyneen höyryn välillä katoavat.
Tiivistä tyydyttymättömät höyryt isotermisesti T < T cr, sitten sen paine kasvaa, kunnes siitä tulee yhtä suuri kuin tyydyttyneen höyryn paine. Tilavuuden pienentyessä edelleen, astian pohjaan muodostuu neste, ja nesteen ja sen tyydyttyneen höyryn välille muodostuu dynaaminen tasapaino. Tilavuuden pienentyessä kasvava osa höyrystä kondensoituu ja sen paine pysyy muuttumattomana (vaakasuora osa isotermissä). Kun kaikki höyry muuttuu nesteeksi, paine kasvaa jyrkästi vähentämällä tilavuutta entisestään nesteen alhaisen puristuvuuden vuoksi.
Kaasumaisesta tilasta nesteeseen voidaan kulkea ohittamalla kaksivaiheinen alue. Voit tehdä tämän sinun täytyy suorittaa prosessi ohittamalla kriittinen piste. K. Yksi mahdollisista tämän tyyppisistä prosesseista on esitetty kuviossa 1 katkoviivalla. ABC.
Ilmakehän ilmassa vesihöyryä on aina läsnä jossain osapaineessa. p, joka on yleensä pienempi kuin kyllästetty höyrynpaine p 0. asenne p / p Osoitetaan prosenttina ilmaistuna suhteellinen kosteus ilmaa.
| |
Tyydyttymättömät höyryt voidaan teoreettisesti kuvata käyttämällä ideaalikaasun tilan yhtälöä todellisten kaasujen tavanomaisten rajoitusten mukaisesti: höyrynpaine ei saa olla liian korkea (käytännössä p ≤ (10 6 –10 7) Pa), ja sen lämpötila on korkeampi kuin kullekin aineelle määritetty arvo. Ihanteellisen kaasun lakeja voidaan myös soveltaa suunnilleen tyydyttyneeseen höyryyn edellyttäen, että jokaista lämpötilaa varten T paine p 0 tyydyttynyt höyry määritetään tasapainokäyräp 0 (T) tietylle aineelle.
paine p 0 tyydyttynyt höyry kasvaa erittäin nopeasti lämpötilan noustessa T. riippuvuus p 0 (T) ei voida saada ideaalikaasun laeista. Kaasunpaine jatkuvassa molekyylipitoisuudessa kasvaa suorassa suhteessa lämpötilaan. Kyllästetyssä parissa lämpötilan noustessa molekyylin liikkeen keskimääräinen kineettinen energia ei kasva, vaan myös niiden pitoisuus. Siksi tyydyttyneen höyryn paine nousee nopeammin lämpötilan noustessa kuin ihanteellisen kaasun paine molekyylien vakiokonsentraatiossa.
Haihtumista voi tapahtua paitsi pinnalta myös nestetilavuudesta. Nesteessä on aina pieniä kaasukuplia. Jos nesteen tyydyttynyt höyrynpaine on yhtä suuri tai suurempi kuin ulkoinen paine (ts. Kuplan kaasunpaine), neste haihtuu kuplia sisältä. Höyryllä täytetyt kuplat laajenevat ja kelluvat pinnalle. Tätä prosessia kutsutaan kiehuva . Siten nesteen kiehuminen alkaa lämpötilassa, jossa sen kyllästettyjen höyryjen paine tulee yhtä suureksi kuin ulkoinen paine.
Erityisesti normaalissa ilmanpaineessa vesi kiehuu lämpötilassa 100 ° C. Tämä tarkoittaa, että tässä lämpötilassa tyydyttyneen vesihöyryn paine on 1 atm. Vuorikiipeilyssä ilmakehän paine laskee ja siksi veden kiehumispiste laskee (noin 1 ° C jokaista 300 metriä korkeudesta). 7 km korkeudessa paine on noin 0,4 atm ja kiehumispiste laskee 70 ° C: seen.
Hermeettisesti suljetussa astiassa neste ei voi kiehua, koska jokaisessa lämpötila-arvossa tasapaino muodostuu nesteen ja sen kyllästetyn höyryn välillä. Tasapainokäyrää pitkin p 0 (T) on mahdollista määrittää nesteen kiehumispiste eri paineissa.
Kuvassa 1 esitetty todellisen kaasun isotermien kuva kuvaa haihtumis- ja kondensoitumisprosesseja, ts. Vaihesiirtymää aineen kaasumaisen ja nestefaasin välillä. Itse asiassa tämä kuva on epätäydellinen, koska mikä tahansa aine voi mennä kiinteään tilaan kaasumaisesta ja nestemäisestä. Tietyssä lämpötilassa T termodynaaminen tasapaino saman aineen kahden vaiheen välillä on mahdollista vain tietyllä paineella järjestelmässä. Tasapainon paineen riippuvuutta lämpötilasta kutsutaan vaihetasapainokäyrä . Esimerkki on tasapainokäyrä. p 0 (T) kyllästetty höyry ja neste. Jos tietyn aineen eri vaiheiden väliset tasapainotekäyrät rakennetaan tasolle ( p, T), sitten ne rikkovat tämän tason erillisiksi alueiksi, joilla aine esiintyy yhtenäisenä aggregaation tila - kiinteä, nestemäinen tai kaasumainen (kuva 2). Kuvailtu koordinaattijärjestelmässä ( p, T) tasapainokäyrät kutsutaan vaihekaavio .
Käyrä 0 Tkutsutaan kiinteän ja kaasumaisen faasin välistä tasapainoa vastaavaksi sublimaatiokäyrä. Käyrä TK nesteen ja höyryn tasapainoa kutsutaan haihtumiskäyrähän katkeaa kriittisessä pisteessä K. Käyrä TM kiinteän ja nesteen tasapainoa kutsutaan sulamiskäyrä.
Tasapainokäyrät lähentyvät pisteessä Tjossa kaikki kolme vaihetta voivat esiintyä tasapainossa. Tätä kohtaa kutsutaan kolminkertainen piste.
Monille aineille paine p tr kolminkertaisessa pisteessä on alle 1 atm ≈ 10 5 Pa. Tällaiset aineet sulavat kuumennettaessa ilmakehän paineessa. Esimerkiksi veden kolminkertaisella pisteellä (kuva 3) on koordinaatit T sp \u003d 273,16 K, p sp. \u003d 6,02 · 10 2 Pa ja sitä käytetään referenssinä kelvinin absoluuttisen lämpötila-asteikon kalibrointiin.
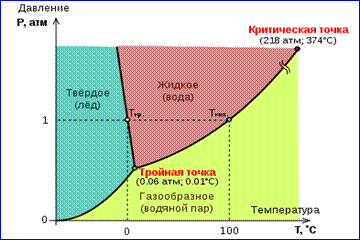 On kuitenkin olemassa myös sellaisia \u200b\u200bkuvioita. 3 Vaihekaavio vedestä
On kuitenkin olemassa myös sellaisia \u200b\u200bkuvioita. 3 Vaihekaavio vedestä
aineet, joille p sp
ylittää 1 atm. Joten
hiilidioksidin (CO 2) paine
p sp. \u003d 5,11 atm ja lämpötila
T sp. \u003d 216,5 K. Siksi, ilmakehän paine
kiinteä hiilidioksidi voi
esiintyy vain matalissa lämpötiloissa ja nestemäisessä tilassa p \u003d 1 atm, sitä ei ole ollenkaan. Kiinteässä tilassa hiilidioksidi on tasapainossa höyrynsä kanssa ilmakehän paineessa lämpötilassa 173 K tai –80 ° C. Tämä on laajalti käytetty "kuivajää", joka ei koskaan sula, vaan vain haihtuu (sublimoituu).
Luonnollisissa olosuhteissa höyryä pidetään kaasuna. Hän voi olla tyydyttynyt ja nena-kylläisyys, joka riippuu sen tiheydestä, lämpötilasta ja paineesta.
Höyry dynaamisessa tasapainossa omalla nesteellä on tyydyttynyt.
Dynaaminen tasapaino nesteen ja höyryn välillä tapahtuu, kun nesteen vapaalta pinnalta emittoituneiden molekyylien lukumäärä on yhtä suuri kuin siihen palavien molekyylien lukumäärä.
Avoimessa astiassa dynaaminen tasapaino häiriintyy ja höyrystä tulee nena-kylläisyys, koska tietty määrä molekyylejä haihtuu ilmakehään eivätkä palaudu nesteeseen.
Tyydyttynyt höyry muodostettu suljettuun astiaan nesteen vapaan pinnan yläpuolelle.
tyydyttynyt ja desaturated höyry on erilaisia \u200b\u200bominaisuuksia. Tutki heitä.
| Kuva 3.2. Isoterminen höyrykompressio |
Molekyylipitoisuus kylläinen höyry riippumaton sen tilavuudesta.
päästää tyydyttymätön höyrylämpötilassa T sijaitsee sylinterissä männän kanssa (kuva 3.2). Alamme puristaa sitä hitaasti isotermisen prosessin aikaansaamiseksi (osa AB). Ensinnäkin, jos höyryä on huomattavasti harvemmin, paineen riippuvuus tilavuudesta vastaa Boyle-Mariotte-lakia ihanteelliselle kaasulle: pV \u003d const. Siitä huolimatta, kun tyydyttymättömän höyryn tilavuus vähenee (sen tiheys kasvaa), alkaa havaita poikkeama siitä. Höyryn jatkuva isoterminen puristus johtaa siihen, että se alkaa tiivistyä (piste B), sylinteriin muodostuu nestemäisiä pisaroita ja höyry kyllästyy. Sen tiheys ja siten molekyylien konsentraatio saavat maksimiarvon annetulle lämpötilalle. Ne ovat riippumattomia tyydyttyneen höyryn käyttämästä tilavuudesta, ja ne määritetään sen paineen ja lämpötilan mukaan.
Pakkauksen alaisena kylläinen höyry (BC-osa) sen paine ei muutu ( p \u003d vakio). Tämä selitetään sillä, että tilavuuden pienentyessä tyydyttynyt höyry kondensoituu muodostaen nesteen. Sen osuus sylinteritilavuudesta kasvaa koko ajan ja tyydyttyneen höyryn käyttämä tilavuus pienenee. Näin tapahtuu, kunnes kaikki tyydyttynyt höyry siirtyy nestemäiseen tilaan (piste C).
Tilavuuden lisälasku aiheuttaa nopean paineen nousun (tasainen osa), koska nesteet tuskin puristuvat. Materiaali sivustolta
Joten isotermisellä pakkauksella ei tyydyttynyt höyry ensin (pienellä tiheydellä) sillä on ihanteellisen kaasun ominaisuudet. Milloin höyrystä tulee tyydyttynyt, sen ominaisuudet noudattavat muita lakeja. Erityisesti matalissa lämpötiloissa sen tila kuvataan suunnilleen yhtälöllä p = nKT,kun molekyylien konsentraatio on riippumaton kaasun käyttämästä tilavuudesta. Paine-riippuvuusgraafi p tilavuuden mukaan V, kuvattu kuviossa 1 3.2 kutsutaan todellisten kaasujen isotermi.
Oikean kaasun isotermit karakterisoida sen tasapainotila nesteen kanssa. Niiden yhteensopivuus mahdollistaa paineen riippuvuuden määrittämisen. kylläinen höyry lämpötilasta.
Tällä sivulla materiaalia aiheista:
Mikä on tyypillistä tyydyttyneelle höyrylle molekyylin näkökulmasta
Mikä on ominaista vedon molekyylin kannalta
Mikä on tyypillistä tyydyttyneelle kaasulle molekyylin kannalta
Tieteellinen tieto
Tyydyttynyt höyry
Kysymyksiä tästä materiaalista:
Haihdutus- ja kondensoitumisprosessit ovat jatkuvia ja samansuuntaisia.
Avoimessa astiassa nesteen määrä vähenee ajan myötä, koska haihtuminen on etusijalla kondensaation suhteen.
Höyryä, joka on nesteen pinnan yläpuolella, kun haihtuminen, vallitsee kondensoitumisen yli tai höyryä nesteen puuttuessa tyydyttymättömiä.
Ilmatiiviisti suljetussa astiassa nestetaso ei muutu ajan myötä, koska haihtuminen ja kondensoituminen poistavat toisiaan: kuinka monta molekyyliä lentää nesteestä, kuinka monta niistä palaa siihen samanaikaisesti, höyryn ja sen nesteen välillä tapahtuu dynaaminen (liikkuva) tasapaino.
Höyryä, joka on dynaamisessa tasapainossa nesteensä kanssa, kutsutaan tyydyttynyt.
Tietyssä lämpötilassa nesteen tyydyttyneellä höyryllä on suurin tiheys ( ) ja luo maksimipaineen ( ), jossa voi olla tämän nesteen höyryä tässä lämpötilassa.
Kyllästetyn höyryn paine ja tiheys samassa lämpötilassa riippuvat aineen luonteesta: korkeampi paine tuottaa nesteen kyllästetyn höyryn, joka haihtuu nopeammin.Esimerkiksi ja
Tyydyttymättömät höyryominaisuudet:Tyydyttymättömät parit noudattavat Boyle - Marriottin, Gay-Lussacin, Charlesin kaasulakeja ja ihanteellisen kaasun tilan yhtälöä voidaan soveltaa heihin.
Tyydyttyneet höyryominaisuudet:1. Vakiotilavuudessa lämpötilan noustessa kylläinen höyrynpaine kasvaa, mutta ei suoraan suhteessa (Charlesin lakia ei noudateta), paine kasvaa nopeammin kuin ihanteellinen kaasu. , lämpötilan noustessa ( ) , höyryn massa kasvaa ja siksi höyrymolekyylien () pitoisuus kasvaa ja kylläisen höyryn paine sulaa kahdesta syystä (
3 1 - tyydyttymätön höyry (ihanteellinen kaasu);
2 2 - tyydyttynyt höyry; 3 Tyydyttymättömät höyry
1 saatu kyllästetystä höyrystä samassa
Tilavuus lämmitettäessä.
2. Kyllästetyn höyryn paine vakiolämpötilassa ei riipu sen käyttämästä tilavuudesta.
Tilavuuden kasvaessa höyryn massa kasvaa ja nesteen massa pienenee (osa nesteestä menee höyryksi), höyryn tilavuuden pienentyessä siitä tulee pienempi ja enemmän (osa höyrystä menee nesteeksi), tyydyttyneiden höyrymolekyylien tiheys ja konsentraatio pysyvät vakiona, paine pysyy vakiona ().
neste
(kyll. höyry + neste)
Tyydyttymättömiä. höyry
Tyydyttyneet höyryt eivät noudata Boylen - Marriott, Gay-Lussac, Charles - kaasulakeja, koska prosessien höyryn massa ei pysy vakiona, ja kaikki kaasulait saadaan vakiomassalle. Ideaalikaasun tyydyttyneen kaasun yhtälöä voidaan käyttää.
siten, tyydyttynyt höyry voidaan muuttaa tyydyttymättömäksi höyryksi joko kuumentamalla sitä vakiona tilavuudella tai lisäämällä sen tilavuutta vakiona lämpötilassa. Tyydyttymättömät höyryt voidaan muuttaa tyydyttyneiksi höyryiksi joko jäähdyttämällä ne vakiona tilavuudella tai puristamalla niitä vakiolämpötilassa.
Kriittinen tila
Vapaan pinnan läsnäolo nesteessä antaa mahdollisuuden osoittaa, missä aineen nestemäinen faasi sijaitsee ja missä on kaasumainen. Nesteen ja sen höyryn välinen terävä ero selitetään sillä, että nesteen tiheys on monta kertaa suurempi kuin höyryn. Jos nestettä lämmitetään ilmatiiviisti suljetussa astiassa, paisutumisen vuoksi sen tiheys vähenee ja sen yläpuolella oleva höyryntiheys kasvaa. Tämä tarkoittaa, että ero nesteen ja sen tyydyttyneen höyryn välillä tasoittuu ja häviää kokonaan riittävän korkeassa lämpötilassa. Lämpötila, jossa erot fysikaaliset ominaisuudet nesteen ja sen tyydyttyneen höyryn välillä, ja niiden tiheydet muuttuvat samoiksi, nimeltäänkriittinen lämpötila.
Kriittinen kohta
Nesteen muodostukseen kaasusta keskimääräinen potentiaalinen energia molekyylien vetovoiman on ylitettävä niiden keskimääräinen kineettinen energia.
Kriittinen lämpötila – maksimilämpötila, jossa höyry muuttuu nesteeksi. Kriittinen lämpötila riippuu molekyylien mahdollisesta vuorovaikutusenergiasta, ja siksi se on erilainen eri kaasuille. Vesimolekyylien voimakkaan vuorovaikutuksen takia vesihöyry voi muuttua vedeksi jopa lämpötilassa. Samaan aikaan typen nesteytys tapahtuu vain lämpötilassa, joka on alle \u003d -14714, koska typpimolekyylit ovat heikosti vuorovaikutuksessa keskenään.
Toinen makroskooppinen parametri, joka vaikuttaa höyry-neste-siirtymiseen, on paine. Kun ulkoinen paine kasvaa kaasunpuristuksen aikana, hiukkasten välinen keskimatka pienenee, niiden välinen houkutteleva voima kasvaa ja vastaavasti niiden vuorovaikutuksen keskimääräinen potentiaalienergia.
paine kyllästettyä höyryä kriittisessä lämpötilassaan kutsutaan kriittinen. Tämä on tietyn aineen suurin mahdollinen kyllästetty höyrynpaine.
Aineen tila kriittisillä parametreilla kutsutaan kriittinen(kriittinen piste) . Jokaisella aineella on oma kriittinen lämpötila ja paine.
Kriittisessä tilassa nesteen ominainen höyrystymislämpö ja nesteen pintajännityskerroin katoavat. Kriittisissä lämpötiloissa, jopa erittäin korkeissa paineissa, kaasua ei voida muuttaa nesteeksi, ts. kriittisen lämpötilan yläpuolella, nestettä ei voi olla. Ylikriittisissä lämpötiloissa vain aineen höyrytila \u200b\u200bon mahdollista.
Kaasun nesteyttäminen on mahdollista vain kriittisen lämpötilan alapuolella olevissa lämpötiloissa. Nesteyttämistä varten kaasut jäähdytetään kriittiseen lämpötilaan esimerkiksi adiabaattisella paisutuksella ja sitten puristetaan isotermisesti.
kiehuva
Ulkoisesti ilmiö näyttää tältä: Koko nestetilavuudesta nopeasti kasvavat kuplat nousevat pintaan, ne räjähtää pinnalle ja höyry vapautuu ympäristöön.
MKT selittää kiehumisen näin: nesteessä on aina ilmakuplia; nesteestä haihtuu niistä. Kuplien suljettu tilavuus on paitsi täytetty ilmalla, myös kylläisellä höyryllä. Niissä tyydyttynyt höyrynpaine kasvaa nestettä kuumennettaessa kuin ilmanpaine. Kun kyllästetyn höyryn paine riittävän kuumennetussa nesteessä olevissa kuploissa tulee suuremmiksi kuin ulkoinen paine, niiden tilavuus kasvaa, ja nostovoima, joka ylittää niiden painovoiman, nostaa kuplat pinnalle. Pinnoitetut kuplat alkavat räjähtää, kun tietyssä lämpötilassa niiden tyydyttynyt höyrynpaine ylittää nesteen yläpuolella olevan paineen. Nesteen lämpötilaa, jossa sen kyllästetyn höyryn paine kuploissa on yhtä suuri tai suurempi kuin nesteen ulkoinen paine, kutsutaan kiehumispiste.
Eri nesteiden kiehumispiste on erilainenkoska niiden kuplien tyydyttynyttä höyrynpainetta verrataan samaan ulkoiseen paineeseen eri lämpötiloissa. Esimerkiksi kuplien tyydyttynyt höyrynpaine on yhtä suuri kuin normaali ilmakehän paine vedelle 100 ° C: ssa, elohopealle 357 ° C: ssa, alkoholille 78 ° C: ssa, eetterille 35 ° C: ssa.
Kiehumispiste kiehumisprosessissa pysyy vakiona, koska kaikki lämmitettyyn nesteeseen syötetty lämpö kulutetaan höyrystymiseen.
Kiehumispiste riippuu nesteen ulkoisesta paineesta: paineen noustessa lämpötila nousee; paineen laskiessa lämpötila laskee. Esimerkiksi 5 km: n korkeudessa merenpinnan yläpuolella, missä paine on kaksi kertaa matalampi kuin ilmakehä, veden kiehumispiste on 83 ° C, höyrykoneiden kattiloissa, joissa höyrynpaine on 15 atm. (), veden lämpötila on noin 200 ° C.
Ilman kosteus
Ilmassa on aina vesihöyryä, joten voidaan puhua ilman kosteudesta, jolle on tunnusomaista seuraavat arvot:
1.Absoluuttinen kosteus Onko vesihöyryn tiheys ilmassa (tai tämän höyryn aiheuttama paine (.
Absoluuttinen kosteus ei anna käsitystä ilman kyllästymisasteesta vesihöyryllä. Sama määrä vesihöyryä eri lämpötiloissa luo erilaisen kosteuden tunteen.
2.Suhteellinen kosteus on ilmassa tietyssä lämpötilassa olevan vesihöyryn tiheyden (paineen) suhde kylläisen höyryn tiheyteen (paine) samassa lämpötilassa : tai
- absoluuttinen kosteus annetussa lämpötilassa; - tiheys, tyydyttynyt höyrynpaine samassa lämpötilassa. Kyllästetyn vesihöyryn tiheys ja paine missä tahansa lämpötilassa löytyvät taulukosta. Pöydästä voidaan nähdä, että mitä korkeampi ilman lämpötila, sitä suuremman pitäisi olla vesihöyryn tiheyden ja paineen ilmassa, jotta se olisi kylläinen.
Suhteellisen kosteuden tietäessä voimme ymmärtää, kuinka suuri prosenttiosuus ilmassa olevista vesihöyryistä on kaukana kylläisyydestä. Jos ilman höyry on kylläistä, niin. jos , sitten ilman kylläisyyden tilaan ei ole tarpeeksi höyryä.
Sitä, että ilman höyry kyllästyy, arvioidaan kosteuden muodossa sumun, kasteen muodossa. Lämpötilaa, jolla vesihöyry ilmassa tulee kylläiseksi, kutsutaan kastepiste.
Ilman höyry voi olla kylläinen, jos lisäät höyryä nesteen ylimääräisen haihtumisen vuoksi ilman lämpötilaa muuttamatta, tai jos ilmassa on höyryä, laske sen lämpötilaa.
Ihmisille edullisin normaali suhteellinen kosteus on 40-60%. Sääennusteiden kannalta on erittäin tärkeää meteorologian kosteuden tuntemus. Kudonta- ja konditoriateollisuudessa tietty kosteus on välttämätöntä prosessin normaalille kululle. Taideteosten ja kirjojen varastointi vaatii ilman kosteuden pitämistä vaaditulla tasolla.
Laitteet kosteuden määrittämiseksi:
1. Kondenssin kosteusmittari (voit määrittää kastepisteen).
2. Hiuksen kosteusmittari (toimintaperiaate perustuu rasvattomien hiusten pituuden riippuvuuteen kosteudesta) mittaa suhteellisen kosteuden prosenteina.
3. Psykrometri koostuu kahdesta kuivasta ja märästä lämpömittarista. Kostutetun lämpömittarin säiliö kääritään veteen kastettuun kankaaseen. Kankaasta haihtumisen vuoksi kostutetun lämpötila on alhaisempi kuin kuivan. Eri lämpömittarien lukemissa riippuu ympäröivän ilman kosteudesta: mitä kuivempi ilma, sitä voimakkaampi haihtuminen kankaasta, sitä suurempi ero on lämpömittarien lukemissa ja päinvastoin. Jos kosteus on 100%, niin lämpömittarien lukemat ovat samat, ts. ero lukemissa on 0. Psykrometrista taulukkoa käytetään kosteuden määrittämiseen psykrometrin avulla.
Sulaminen ja kiteytys
Kun sulaa Kiinteästä kappaleesta etäisyys kidehilan muodostavien hiukkasten välillä kasvaa ja hila itse tuhoutuu. Sulamisprosessiin on tarpeen kuluttaa energiaa. Kun kiinteää ainetta kuumennetaan, värisevien molekyylien kineettinen energia kasvaa ja vastaavasti niiden värähtelyjen amplitudi. Tietyssä lämpötilassa, jota kutsutaan sulamispiste järjestys kiteiden hiukkasten järjestelyssä on häiriintynyt, kiteet menettävät muodonsa. Aine sulaa, ohi kiinteä tila nestemäisessä tilassa.
Kiteytyksen aikanakidehilan muodostavien molekyylien lähentyminen tapahtuu. Kiteytyminen voi tapahtua vain, kun neste antaa energiaa. Kun sula aine jäähdytetään, keskimääräinen kineettinen energia ja molekyylien nopeus vähenevät. Painovoimat voivat pitää hiukkasia lähellä tasapainotilaa. Tietyssä lämpötilassa, jota kutsutaan kovettumislämpötila (kiteytyminen),kaikki molekyylit ovat vakaassa tasapainossa, niiden järjestelyt järjestetään - muodostuu kide.
Kiinteä sulaminen tapahtuu samassa lämpötilassa, jossa tämä aine jähmettyy
Jokaisella aineella on oma sulamispiste. Esimerkiksi heliumin sulamispiste on -269,6 ° C, elohopean -3,8,9 ° C ja kuparin 1083 ° C.
Sulamisprosessin aikana lämpötila pysyy vakiona. Ulkopuolelta toimitettua lämpömäärää käytetään kidehilan tuhoamiseen.
Kovettumisen aikana lämpötila ei muutu huolimatta lämmön poistumisesta. Kiteytymisen aikana vapautunutta energiaa käytetään vakiolämpötilan ylläpitämiseen.
Kunnes kaikki aine on sulanut tai kaikki aine on jähmettynyt, ts. niin kauan kuin aineen kiinteät ja nestemäiset faasit ovat yhdessä, lämpötila ei muutu.
TV. + Juutalainen. Juutalainen. + TV.
, missä on lämmön määrä, on lämmön määrä, joka tarvitaan aineen sulamiseen vapautuneen aineen kiteyttämisen aikana massan kanssa
- erityinen sulamislämpö– lämpömäärä, joka tarvitaan 1 kg: n painoisen aineen sulamiseen sulamispisteessä.
Kuinka paljon lämpöä kuluu tietyn massan aineen sulamisen aikana, sama määrä lämpöä vapautuu tämän massan kiteytymisen aikana.
Kutsutaan myös kiteytymisen ominaislämpö.
Sulamislämpötilassa nestemäisen aineen sisäinen energia on suurempi kuin kiinteän aineen saman massan sisäinen energia.
Suurella joukolla aineita tilavuus sulamisen aikana kasvaa ja tiheys pienenee. Kovettuessa päinvastoin, tilavuus pienenee ja tiheys kasvaa. Esimerkiksi kiinteät naftaleenikiteet hukkuu nestemäiseen naftaleeniin.
Jotkut aineet, esimerkiksi vismutti, jää, gallium, valurauta jne., Puristetaan sulamisen aikana ja laajenevat kiinteytyessään. Nämä poikkeamat yleisestä säännöstä selitetään kidehilan rakenteellisilla ominaisuuksilla. Siksi vesi on tiheämpää kuin jää, jää kelluu vedessä. Veden paisuminen jäätymisen aikana johtaa kivien tuhoutumiseen.
Metallien määrän muutos sulamisen ja jähmettymisen aikana on välttämätöntä valimoalalla.
Kokemus osoittaa sen ulkoisen paineen muutos kiinteä aine vaikuttaa tämän aineen sulamispisteeseen. Niille aineille, jotka laajenevat sulaessa, ulkoisen paineen nousu johtaa sulamislämpötilan nousuun, koska vaikeuttaa sulamisprosessia. Jos aineet puristetaan sulamisen aikana, niin ulkoisen paineen lisääntyminen johtaa niiden sulamislämpötilan laskuun, koska auttaa sulatusprosessia. Vain erittäin suuri paineen nousu muuttaa sulamislämpötilaa huomattavasti. Esimerkiksi jään sulamislämpötilan alentamiseksi 1 ° C: lla painetta on nostettava 130 atm. Aineen sulamispistettä normaalissa ilmanpaineessa kutsutaan aineen sulamispiste.
Kiehumisen jälkeen veden lämpötila lakkaa kasvamasta ja pysyy muuttumattomana täydelliseen haihtumiseen saakka. Höyrystys on siirtymävaihe nestemäisestä tilasta höyryyn, jolla on sama lämpötilaindikaattori kuin kiehuvalla nesteellä. Tätä haihdutusta kutsutaan kylläiseksi höyryksi. Kun kaikki vesi haihtuu, kaikki myöhemmät lämmön lisäykset nostavat lämpötilaa. Lämmitettyä höyryä kylläisen tason jälkeen kutsutaan ylikuumenetuksi. Kyllästettyä höyryä käytetään yleisesti teollisuudessa lämmitykseen, keittämiseen, kuivaamiseen tai muihin toimenpiteisiin. Kuumennettua käytetään yksinomaan turbiineihin. Erityyppisillä höyryillä on erilainen vaihtopotentiaalienergia ja tämä oikeuttaa niiden käytön täysin eri tarkoituksiin.
Höyry yhtenä kolmesta fyysisestä tilasta
Höyryn ominaisuuksien ymmärtäminen voi auttaa ymmärtämään aineen yleistä molekyyli- ja atomirakennetta sekä soveltamaan tätä tietoa jäästä, vedestä ja höyrystä. Molekyyli on minkä tahansa alkuaineen tai yhdisteen pienin yksikkö. Se puolestaan \u200b\u200bkoostuu vielä pienemmistä hiukkasista, joita kutsutaan atomeiksi, jotka määrittelevät peruselementit, kuten vety ja happi. Näiden atomielementtien konkreettiset yhdistelmät tarjoavat aineiden yhdistelmän. Yhtä näistä yhdisteistä edustaa kemiallinen kaava H20, jonka molekyylit koostuvat 2 vetyatomista ja 1 happiatomista. Hiiltä on myös runsaasti, se on avaintekijä kaikissa orgaanisissa aineissa. Suurin osa mineraaleista voi esiintyä kolmessa fyysisessä tilassa ( vankka runkoneste ja höyry), joita kutsutaan vaiheiksi.
Höyrynmuodostusprosessi
Kun veden lämpötila lähestyy kiehumispistettä, jotkut molekyylit saavat tarpeeksi kineettistä energiaa saavuttaakseen nopeuden, jonka avulla ne voivat hetkellisesti erota nesteestä pinnan yläpuolella olevassa tilassa ennen paluutaan. Lisäkuumennus aiheuttaa enemmän jännitystä ja nestettä poistuvien molekyylien lukumäärä kasvaa. Ilmanpaineessa kyllästyslämpötila on 100 ° C. Höyryä, jonka kiehumispiste on tässä paineessa, kutsutaan kuivaksi kylläiseksi höyryksi. Kuten vaihemuutos jäästä veteen, myös haihtumisprosessi on palautuva (kondensoituminen). Kriittinen piste on korkein lämpötila, jossa vesi voi olla nestemäisessä tilassa. Tämän kohdan yläpuolella höyryä voidaan pitää kaasuna. Kaasumainen tila on samanlainen kuin diffuusio, jossa molekyyleillä on melkein rajoittamaton mahdollisuus liikkua.
Muuttuva suhde
Tietyssä lämpötilassa on tietty höyrynpaine, joka on tasapainossa nestemäisen veden kanssa. Jos tämä ilmaisin nousee, höyry ylikuumenee ja sitä kutsutaan kuivaksi. Paineen ja lämpötilan välillä on yhteys: Kun tiedät yhden arvon, voit määritellä toisen. Höyryn tila määritetään kolmella muuttujalla: paine, lämpötila ja tilavuus. Kuiva tyydyttynyt höyry on tila, jossa höyryä ja vettä voi olla läsnä samanaikaisesti. Toisin sanoen tämä tapahtuu, kun höyrystymisnopeus on yhtä suuri kuin kondensoitumisnopeus.
Tyydyttynyt höyry ja sen ominaisuudet
Kun keskustellaan tyydyttyneen höyryn ominaisuuksista, sitä verrataan usein ihanteelliseen kaasuun. Onko heillä jotain yhteistä vai onko tämä yksinkertainen virhe? Ensinnäkin, vakiona lämpötilan ollessa tiheys, tiheys ei ole riippuvainen tilavuudesta. Visuaalisesti tämä voidaan kuvitella seuraavasti: on tarpeen visuaalisesti vähentää säiliön tilavuutta höyryllä muuttamatta lämpötilan ilmaisimia. Kondensoituneiden molekyylien lukumäärä ylittää haihtuneiden molekyylien määrän, ja höyry palaa tasapainotilaan. Seurauksena on, että tiheys on vakioparametri. Toiseksi sellaiset ominaisuudet kuin paine ja tilavuus eivät ole riippuvaisia \u200b\u200btoisistaan. Kolmanneksi, kun otetaan huomioon tilavuusominaisuuksien invarianssi, molekyylien tiheys kasvaa lämpötilan noustessa ja pienenee, kun se laskee. Itse asiassa vesi kuumennettaessa alkaa haihtua nopeammin. Tässä tapauksessa tasapaino on järkyttynyt eikä sitä palauteta ennen kuin höyryn tiheys palaa aikaisempaan asemaansa. Kondensoitumisen aikana kyllästetyn höyryn tiheys päinvastoin vähenee. Toisin kuin ihanteellinen kaasu, kyllästettyä höyryä ei voida kutsua suljetuksi järjestelmäksi, koska se on jatkuvasti kosketuksissa veden kanssa.

Lämmityksen edut
Kyllästetyksi kutsutaan puhdasta höyryä, joka on suorassa kosketuksessa nestemäisen veden kanssa. Sillä on monia ominaisuuksia, jotka tekevät siitä erinomaisen lämpöenergian lähteen, etenkin korkeissa lämpötiloissa (yli 100 ° C). Jotkut heistä:

Erityyppisiä höyryjä
Höyry on veden kaasumainen vaihe. Se käyttää muodostumisensa aikana lämpöä ja vapauttaa sen jälkeen suuren määrän lämpöä. Siksi hän
voidaan käyttää työaineena lämpömoottoreissa. Seuraavat olosuhteet tunnetaan: tyydyttynyt kylläinen, kuiva kyllästetty ja ylikuumennettu. Tyydyttynyt höyry on edullista kuin ylikuumennettu höyry jäähdytysnesteenä lämmönvaihtimissa. Kun se vapautuu ilmakehään putkista, osa siitä tiivistyy, muodostuu valkoisen märän haihtumispilviä, jotka sisältävät pieniä vesipisaroita. Ylikuumennettu höyry ei tiivisty, vaikka se olisi suorassa kosketuksessa ilmakehän kanssa. Ylikuumentuneessa tilassa sillä on parempi lämmönsiirto johtuen molekyylien liikkeen kiihtyvyydestä ja pienemmästä tiheydestä. Kosteuden esiintyminen aiheuttaa saostumista, korroosiota ja kattiloiden tai muiden lämmönvaihtolaitteiden käyttöiän lyhenemistä. Siksi kuiva höyry on edullinen, koska se tuottaa enemmän energiaa eikä aiheuta korroosiota.

Kuiva ja kylläinen: mikä on ristiriita?
Monet ovat sekoittuneet termeihin "kuiva" ja "kylläinen". Kuinka jokin voi olla molemmat samanaikaisesti? Vastaus löytyy käyttämästämme terminologiasta. Termiin "kuiva" liittyy kosteuden puute, toisin sanoen "ei märkä". ”Tyydyttynyt” tarkoittaa ”liotettua”, “märkää”, “tulvattua”, “kuivutettua” ja niin edelleen. Vaikuttaa siltä, \u200b\u200bettä kaikki tämä vahvistaa ristiriidan. Höyrytekniikassa termi "kylläinen" on kuitenkin erilainen merkitys ja tarkoittaa tässä yhteydessä tilaa, jossa kiehuu. Siksi lämpötila, jossa kiehuu tapahtuu, tunnetaan teknisesti kyllästymislämpötilana. Kuivassa höyryssä ei tässä ole kosteutta. Jos tarkkailet kiehuvaa vedenkeitintä, voit nähdä valkoisen höyrystymisen tulevan vedenkeitin noasta. Itse asiassa se on kuiva, väritön höyry ja seos, joka sisältää vesipisaroita, jotka heijastavat valoa ja muuttuvat valkoisiksi. Siksi termi “kuiva tyydyttynyt höyry” tarkoittaa, että höyry on kuivunut eikä ole ylikuumentunut. Ilman nestemäisiä hiukkasia, se on kaasumaisessa tilassa oleva aine, joka ei noudata yleisiä kaasulakeja.
Totisesti monien piti katsoa kuvaa siitä, kuinka avoin vesisäiliö jonkin ajan kuluttua osoittautui tyhjäksi. Jos peität kannen, vesi ei katoa. Kaikki tietävät syyn - vesi haihtuu. Selitys ilmiölle on yksinkertainen: joillakin vesimolekyyleillä on riittävän suuri liikkeenopeus nesteen poistumiseen. Tätä nesteen muuttumista kaasumaiseen tilaan kutsutaan haihdutukseksi.
Toista prosessia, nimittäin höyryn muuttamista nesteeksi, kutsutaan kondensoitumiseksi. Nämä kaksi prosessia, haihtuminen ja kondensoituminen, ovat käynnissä: osa vedestä haihtuu, osa kondensoituu. Jos tilavuus vedenpinnan yläpuolella on rajoittamaton, niin haihtumisprosessi vallitsee. Haihtunut vesi poistetaan, kuten esiintyy esimerkiksi avoimen veden pinnan yläpuolella, ja neste siirtyy vähitellen kaasumaiseen tilaan - höyryyn.
Mutta jos nesteen yläpuolella olevan vapaan tilan määrää on rajoitettu, syntyy hiukan erilainen tilanne. Haihtunut vesi ei voi jättää tätä tilavuutta, ja tyydyttynyt höyry muodostuu veden pinnan yläpuolelle. Tämä on höyryn nimi tasapainossa, kun haihtuneen veden ja kondensoituneen höyryn määrä on yhtä suuri. Vesi ei vähene eikä saavu; tasapainotila on haihtumisen ja tiivistymisen välillä.
Nyt tiedämme, mikä on kylläinen höyry, ja sen ominaisuudet voivat osoittautua meille melko mielenkiintoisiksi. Alusta alkaen määrittelimme, että vapaan tilan määrää nesteen pinnan yläpuolella on rajoitettu. Sen päälle muodostui tyydyttynyttä höyryä. Ja jos nyt vähentää tätä ilmaista määrää? Mitä tapahtuu? Tässä tapauksessa vakiintunut tasapaino kondensoitumisen ja haihtumisen välillä on häiriintynyt. Kondensaatioprosessi alkaa vallita, kosteuden määrä kasvaa ja höyry vähenee.
Höyrynpainetta, jolla se on tasapainossa nesteen kanssa, kutsutaan Jos vähentämme vapaan tilan määrää veden yläpuolella, höyrynpaine nousee. Seurauksena on höyryn siirtyminen veteen. Suurennettuna se vie vähemmän tilaa kuin kylläinen höyry. Tästä seuraa vielä yksi johtopäätös: jos lämpötila on vakio, tyydyttyneen höyrynpaine on sama kaikille tilavuuksille.
Höyryn käyttäytymiselle on myös toinen vaihtoehto - vedenpinnan yläpuolella oleva tilavuus pienenee, eikä höyryä muutu nesteeksi. Tämä tarkoittaa, että pinnan yläpuolella on tyydyttymättömiä höyryjä. Myöhemmin, kun tilavuus pienenee vakiolämpötilassa, höyry alkaa muuttua vedeksi - mikä tarkoittaa, että kylläinen höyry on muodostunut. Mutta ei ollut turhaa, että edellytettiin, että kaikki tapahtuu vakiona lämpötilassa. On tietty arvo, jolla höyry voi muuttua nesteeksi.
Tätä arvoa kutsutaan kriittiseksi lämpötiloksi. Aine pysyy kaasuna lämpötilassa, joka on yli kriittisen, jos se on alle kriittisen, kaasu muuttuu nesteeksi. Jokaisella aineella on oma arvonsa. On huomionarvoista huomata vielä kaksi höyryn ominaisuutta: se voi olla joko märkä tai kuiva tyydyttynyt höyry. Kosteassa tilassa on vesipisaroita, ja kuiva höyry ei sisällä kosteutta.
Siellä on myös ns. Ylikuumennettu höyry - tämä on kuiva höyry, jonka lämpötila on yli kriittisen. Tässä tapauksessa uskotaan, että suljetussa tilavuudessa ei enää ole nestettä, vaan siinä on vain höyryä. Kuumennettua höyryä käytetään pääasiassa tekniikassa ja energiassa. ylikuumennetun höyryn avulla voit kuljettaa sitä höyryputkistoilla ja käyttää sisään. Kuumennetun höyryn veden puutteesta johtuen turbiinin käyttöikä kasvaa.
Artikkelissa tarkastellaan mitä muodostuu tyydyttynyt höyry, sen tyypit ja ominaisuudet, samoin kuin sen muodostumis- ja muuttumisprosessit nesteeksi.



