8.doc
87Aineen aggregoidut tilat ja niiden väliset siirtymät. Kaasujen, nesteiden ja kiinteiden aineiden ominaisuudet.
8.1. Aineen aggregoidut tilat ja niiden väliset siirtymät riippuen
lämpötila ja paine
Aine on suuren määrän hiukkasten (atomien, molekyylien, ionien) aggregaatti. Aine voi olla olemassa ja sillä voi olla tietty rakenne vain tietyistä vuorovaikutuksista aineosiensa välillä. Lisäksi aineen rakenne, sen fysikaaliset ominaisuudet riippuvat suuresti näiden vuorovaikutusten energiasta ja suhteesta hiukkasten liikkeen lämpöenergiaan.
Useimmilla aineilla on neljä selvästi erillistä tilaa, joiden välillä tapahtuu siirtyminen lämpötilan muuttuessa. Näitä tiloja kutsutaan aggregaattiksi: kiinteäksi, nestemäiseksi, kaasumaiseksi, plasmaksi.
Jokaisella aineella on lämpötila, jossa sen hiukkasten välinen sitoutumisenergia ylittää niiden lämpövärähtelyjen energian. Tässä tapauksessa värähtelevä liike ei tietenkään lopu, mutta se ei riitä katkaisemaan hiukkasten välisiä sidoksia. Tässä tapauksessa hiukkaset muodostavat yleensä oikean geometrisen rakenteen. Tätä aineen tilaa kutsutaan kiinteä.
Lämpötilan noustessa tulee hetki, jolloin lämpövärähtelyjen energia ylittää hiukkasten välisten sidosten energian ja ne alkavat kääntyä. Geometrinen rakenne romahtaa. Vaikka translaation liikkeen energia ei ole niin suuri, että hiukkaset voivat lopulta irtautua toisistaan: ne liikkuvat pitäen vakiona etäisyyden keskenään. Tätä aineen tilaa kutsutaan neste.
Lämpötilan lisäntyessä edelleen, translaation lämpöliikkeen energia ylittää partikkeleiden välisten vuorovaikutusten energian, ja ne voivat irtautua toisistaan.
Koska vuorovaikutusvoima pienenee etäisyyden kasvaessa, hiukkaset sijaitsevat niin pitkällä etäisyydellä toisistaan \u200b\u200bkuin niiden konsentraatio voi tapahtua. Tätä tilaa kutsutaan kaasua.
Erittäin korkeissa lämpötiloissa tai erittäin korkean jännitteen sähkökentässä syntyy neljäs tila - plasmassa.Tarkkaan ottaen tämä on toinen aine, koska sille on ominaista suuri määrä ionisoituja molekyylejä ja vapaita elektroneja.
Valtion kaaviot
Aineen siirtymä aggregaatiotilasta toiseen määräytyy paitsi lämpötilan, myös paineen perusteella. Viimeinen riippuvuus neste-kaasu-siirtymästä on erityisen vahva. Matalassa lämpötilassa ja korkeissa paineissa aine on kiinteässä tilassa, lämpötilan ja paineen laskiessa se muuttuu nestemäiseksi ja kaasumaiseksi. Lisäksi jokaisella yksittäisellä aineella näillä muutoksilla on tiukat määrälliset ominaisuudet, jotka näkyvät visuaalisesti tilan ns. Vaihekaaviona. Tämä on kaksiulotteinen diagrammi, jonka akseleille on merkitty lämpötilan ja paineen arvot, ja kaavio itsessään on yksinkertaisimmassa tapauksessa kolme pistettä, jotka lähentyvät yhdessä pisteessä. Nämä viivat erottavat ne lämpötilan ja paineen alueet, jotka vastaavat nestemäisiä, kiinteitä ja kaasumaisia \u200b\u200btiloja (kuva 16).
Tilakaavio ja sen ominaisuudet kuvataan yksityiskohtaisesti fysiikan kurssilla.
^ 8.2. Kaasujen, nesteiden ja kiinteiden aineiden ominaisuudet.
1. Kaasut. Kaasumaisessa tilassa on yleensä kovalenttisia pienimolekyylipainoisia aineita ja jalokaasuja. Kaasuissa olevien ainehiukkasten välinen etäisyys on paljon suurempi kuin itse hiukkasten koko ja vuorovaikutus niiden välillä on vähäinen
Vähän verrattuna lämpöenergiaan. Sen mukaisesti kaasut laajenevat ja supistuvat helposti. Kaasuilla ei ole omaa muotoaan ja tilavuuttaan, ja ne ottavat niitä sisältävän astian muodon ja tilavuuden samalla, kun ne painostavat säiliön seinät kaikkiin suuntiin samalla tavalla. Kaikki kaasut sekoitetaan keskenään missä tahansa suhteessa.
2. Nesteet. Nestemäisessä tilassa normaaleissa olosuhteissa on yleensä kovalenttisia aineita (joilla ei ole atomikitehilaa) ja joitain metalleja (elohopea). Nesteessä olevien hiukkasten välinen etäisyys ei ole paljon erilainen kuin kiinteässä tilassa, mutta hiukkaset ovat liikkuvia toisiinsa nähden. Siksi nesteillä ei ole omaa muotoaan ja ne ovat astian muodossa, mutta niillä on oma tilavuus ja ne ovat yleensä käytännössä puristamattomia.
3. Kiinteät aineet. Kiinteä tila on ominaista aineille, joissa on kaiken tyyppisiä sidoksia (metalli, ioninen, kovalentti). Tässä tapauksessa aineet, joissa on ioni- ja atomisyyppisiä sidoksia normaaleissa olosuhteissa, ovat aina kiinteitä. Hiukkasten välinen etäisyys on pieni, vuorovaikutukset ovat voimakkaita, hiukkaset ovat liikkumattomia toistensa suhteen (jos pieniä värähtelyliikkeitä ei oteta huomioon). Lisäksi ne muodostavat pysyvän rakenteen. Siksi kiinteillä aineilla on oma muoto ja tilavuus, jotka ovat käytännössä riippumattomia paineesta ja lämpötilasta (tietysti kiinteän tilan vaiheen kaavion alueella).
Joten kiinteän tai nestemäisen aineen määrä tietyssä tilavuudessa on käytännössä riippumaton lämpötilasta ja paineesta, ja se määritetään tiheydellä, joka on yksilöllinen jokaiselle aineelle ja jota ei käytännössä voida laskea ilman tarkkaa tietoa rakenteesta. Tämä ei kuitenkaan pidä paikkaansa kaasuissa, joissa nämä riippuvuudet noudattavat yleisiä lakeja. Näiden lakien tuntemus on välttämätöntä monien kemiallisten ongelmien ratkaisemiseksi, ja harkitsemme niitä nyt.
^ 8.3. Gazassa. Kaasulait.
Kaasumaisen aineen tilalle on karakterisoitu täysin seuraavat parametrit:
M- aineen molekyylipaino m - kaasun massa P - paine
V- kaasulle toimitettu määrä
T- kaasun lämpötila (kaasulakeissa käytetään lämpötilaa Kelvin-asteikolla)
Lait, jotka yhdistävät nämä parametrit ja joita me nyt tarkastelemme, ovat erittäin lähellä kaikkia kaasuja, ja niitä voidaan pitää samoina. Tarkkaan ottaen ne ovat ehdottoman tarkkoja täydellinen kaasujossa hiukkasten välillä ei ole mitään vuorovaikutusta ja joiden hiukkaset ovat materiaalipisteitä. Vastaavasti näiden lakien soveltamista todellisiin kaasuihin kutsutaan ihanteelliseksi kaasun lähentämiseksi. Mitä nämä lait ovat?
1. Avogadro-laki. Sama tilavuus mitä tahansa kaasua samassa lämpötilassa ja paineessa sisältää saman määrän molekyylejä, ts.
m / m= const at P, V, T \u003dconst kaikille kaasuille.
2. Boyle-Marriott -laki. Kaasun vakion massan ja vakion lämpötilan ollessa kaasun paine on käänteisesti verrannollinen sen käyttämään tilavuuteen, ts.
PV \u003d const at Tm= const
3. Gay-Lussac-laki. Kaasun jatkuvan massan ja paineen ollessa kaasun käyttämä tilavuus on suoraan verrannollinen sen lämpötilaan, ts.
Const klo P, m= const
4. Kaarlen laki. Kaasun jatkuvalla massalla ja tilavuudella kaasun paine on suoraan verrannollinen lämpötilaan, ts.
P / T= const kohdassa V, m \u003d const
^ 8.4. Mendelejev-Clapeyron-yhtälö
Kolmen viimeisen lain yhdistäminen tekee siitä helpon saat yhdistetyn kaasulain:
P 1 V 1 / T1 \u003d P 2 V 2 / T 2 tai PV / T \u003d const kohdassa m \u003d const Tämä laki ei ole vielä yleinen - vakio on erilainen eri kaasujen samoille massoille. Jos kuitenkin otamme huomioon Avogadro-lain, joka yhdistää kaikki kaasut yhteiseen omaisuuteen, saamme sen kaikille kaasuille
PV / T \u003d (m / M) vakio,
Ja nyt vakio on yhteinen kaikille kaasuille. Mihin se on yhtä suuri? Kokeellisesti todettiin, että at normaalit olosuhteet (P= minäatm \u003d 1,013 10 5 Pa, T \u003d273 K) yksi mooli kaasua vie saman tilavuuden, nimittäin 22,4 litraa. Korvataan nämä arvot saatuun yhtälöön ja pohditaan
M, että - on moolien lukumäärä, saamme vakion arvon
8,3144 J / (mol K). Sitä kutsutaan yleiseksi kaasuvakioksi ja sitä merkitään symbolilla R.
Siten olemme saaneet yleisen yhtälön, joka liittyy kaikkiin kaasumaisen aineen tilaan karakterisoiviin parametreihin. Sitä kutsutaan Mendelejev-Clapeyron-yhtälöksi.
PV=(m / M) RTTätä yhtälöä käyttämällä voidaan löytää mikä tahansa tuntematon parametri mille tahansa kaasulle, jos muut ovat tiedossa. Tarkastelemme tämän yhtälön kahta käytännössä tärkeätä seurausta.
1. On helppo nähdä, että kaasun tiheys vakiopaineessa ja lämpötilassa
p \u003dm / v= const M
Toisin sanoen minkä tahansa kaasun tiheys samoissa olosuhteissa riippuu vain sen kaasusta molekyylipaino. Tämän avulla voit löytää tuntemattoman kaasun molekyylimassan, jos sen suhteellinen tiheys tiedetään.
D \u003d 1 / 2 .
Kaasulle, jonka molekyylipaino on tunnettu, koska
Joten, jos kaasun suhteellinen tiheys vedyssä on 22, niin sen molekyylipaino on 44 (hiilidioksidi). Suhteellista ilman tiheyttä käytetään usein. Tässä tapauksessa ilman molekyylimassana pidetään yhtä kuin 29.
2. Mendelejev-Clapeyron-yhtälöstä on myös helppo päätellä, että jos tosiasia, että kaasuihin liittyvä reaktio tapahtuu suljetussa astiassa vakiona lämpötilassa, niin paine astiassa
Suoraan verrannollinen kaasumoolien kokonaismäärään.
3. Kaasujen ominaisuuksien yleismaailmallisuus antaa meille mahdollisuuden ottaa käyttöön keskimääräisen molekyylipainon käsite kaasuseokselle (sitä käytetään usein ongelmissa). Jos esittelemme merkinnän
V \u003d m / M - (moolien lukumäärä), sitten keskimääräinen molekyylipaino:
Koska seoksen kaasut ovat aina samoissa olosuhteissa, niihin sovelletaan Avogadro-lakia ja keskimääräisen moolimassan määritelmä voidaan kirjoittaa korvaamalla moolien määrä tilavuudeltaan:

^ 8.5. Avogadro-laki, moolitilavuus
Koska kaasut ovat yksinkertaisin tutkimuskohde, niiden ominaisuuksia ja reaktioita kaasumaisten aineiden välillä on tutkittu kattavimmin.
Ranskalainen tiedemies F, L. Gay-Lussac perustettu volyymilaki:

Esimerkiksi 1 litra klooria yhdistyy 1 litraan vetyä muodostaen 2 litraa vetykloridia; 2 litraa rikkidioksidia (IV) yhdistetään 1 litraan happea, jolloin muodostuu 2 litraa rikkioksidia (VI).
Tämä laki antoi italialaiselle tutkijalle A. Avogadro olettaa, että yksinkertaisten kaasujen (vety, happi, typpi, kloori jne.) Molekyylit koostuvat kahdesta identtisestä atomista. Kun vety ja kloori yhdistyvät, niiden molekyylit hajoavat atomiksi; ja jälkimmäiset muodostavat vetykloridimolekyylejä. Mutta koska yhdestä molekyylistä muodostuu kaksi vetykloridimolekyyliä, jälkimmäisen tilavuuden tulisi olla yhtä suuri kuin lähdekaasujen tilavuuksien summa, ts.
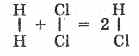
Siten tilavuussuhteet selitetään helposti, jos aloitamme ideasta yksinkertaisten kaasumolekyylien (H2, Cl2, O2, N2, jne.) Diatomisuudesta. Tämä puolestaan \u200b\u200btoimii todisteena näiden aineiden molekyylien piimaanteestä.
Kaasujen ominaisuuksien tutkiminen antoi A. Avogadroa esittää hypoteesin, joka vahvistettiin myöhemmin kokeellisilla tiedoilla, ja sen vuoksi se tunnetaan nimellä avogadro-laki:
Tärkeä seuraus seuraa Avogadro-laista: identtisissä olosuhteissa 1 mooli kaasua vie saman tilavuuden. Tämä tilavuus voidaan laskea, jos 1 litran kaasun massa tunnetaan. Normaaliolosuhteissa, ts. lämpötila 273 K (0 ° C) ja paine 101325 Pa, yhden litran vedyn massa on 0,09 g, sen moolimassa on 1,008 2 \u003d 2,016 g / mol. Sitten yhden moolin vedyn käyttämä tilavuus on
2,016 g / mol
(2,016 g / mol) / 0,09 g / l \u003d 22,4 l / mol.
Samoissa olosuhteissa 1 litran hapen massa on 1,429 g; moolimassa 32 g / mol. Sitten tilavuus on
32 g / mol / 1,429 g / l \u003d 22,4 l / mol.
siksi,

^ 1 Tarkka arvo 22,4135 ± 0,0006 l / mol
jossa V m - kaasun moolitilavuus (mitta m 3 / mol tai l / mol); V- systeemisen aineen tilavuus; n - aineen määrä järjestelmässä. Levyesimerkki: V m kaasu (n.o.) \u003d 22,4 l / mol.
Muistakaa, että vuonna 1860 Karlsruhessa pidetyssä kansainvälisessä kemikongressissa A. Avogadro sai opetuksensa yleisesti.
Kongressi antoi voimakkaan sysäyksen atomi-molekyyliteorian kehittämiselle. Mutta se sai erityisen nopeaa kehitystä sen jälkeen, kun D. I. Mendeleev löysi kemiallisten alkuaineiden jaksollisen lain.
Avogadro-lain perusteella määritetään kaasumaisten aineiden moolimassat. Mitä suurempi kaasumolekyylien massa on, sitä suurempi on saman tilavuuden kaasumäärä. Samoissa määrissä erilaisia \u200b\u200bkaasuja samoissa olosuhteissa sisältyy sama määrä molekyylejä ja siten kaasumoleja. Kaasujen yhtä suureiden tilavuuksien massajen suhde on yhtä suuri kuin niiden moolimassojen suhde:
m 1:m 2 = M 1:M 2 ,
jossa m 1 - ensimmäisen kaasun tietyn tilavuuden massa; m 2 - toisen kaasun saman tilavuuden massa; M 1 ja M 2 - ensimmäisen ja toisen kaasun moolimassat.

M 1 / M 2 \u003d D, siis M 1 \u003d DM 2 .
Kaasun tiheys määritetään tyypillisesti kevyimmästä kaasusta - vedystä (merkitsevät D H2). Molaarinen massa vety on 2,016 g / mol tai noin 2 g / mol. Siksi saamme:
M \u003d 2D H2 .
Usein kaasun tiheys määritetään suhteessa ilmaan (D in). Vaikka ilma on sekoitus kaasuja, ne puhuvat silti sen keskimääräisestä moolimassasta. Se on 29 g / mol. Ilman keskimääräinen moolimassa on helppo laskea, kun otetaan huomioon, että ilma koostuu noin 4 tilavuudesta typpeä (moolimassa 28 g / mol) ja 1 tilavuudesta happea (moolimassa 32 g / mol), ts. 4N202. sitten:
(4 28 1 32). (4 1) \u003d 28,8 g / mol (pyöristetty 29 g / mol).
Tässä tapauksessa moolimassa määritetään lausekkeella:
M \u003d29D c.
Moolimassien määritys osoitti, että yksinkertaiset kaasumolekyylit koostuvat kahdesta atomista (H2, F2, Cl2, O2, N2) ja jalokaasumolekyylit koostuvat yhdestä atomista (He, Ne, Ar, Kr, Xe, Rn ). Jalokaasuilla käsitteet "molekyyli" ja "atomi" ovat vastaavat. Joidenkin muiden yksinkertaisten aineiden molekyylit koostuvat kuitenkin kolmesta tai useammasta atomista, esimerkiksi otsonimolekyyleistä O 3, fosfori P4, rikkihöyry korkeissa lämpötiloissa S 8.
Avogadro-lain perusteella suoritetaan useita laskelmia - kaasujen tilavuuden, massan, tiheyden normaaleissa olosuhteissa laskeminen, kaasumaisten aineiden moolimassa sekä kaasujen suhteellinen tiheys.
8.6. nesteet
Nestemäinen tila on välitila kaasumaisen ja kiteisen välillä (katso kohta 8.2). Joissakin ominaisuuksissa nesteet ovat lähellä kaasuja, ja toisissa ne ovat lähellä kiinteitä aineita. Ensinnäkin niiden isotropia ja juoksevuus yhdistävät nestemäiset kaasut; jälkimmäinen määrittää nesteen kyvyn muuttaa helposti ulkoista muotoaan. Nesteiden korkea tiheys ja matala puristuvuus tuovat ne kuitenkin lähemmäksi kiinteitä aineita.
Nesteiden kyky muuttaa muotoaan helposti osoittaa, että niissä ei ole molekyylinvälisen vuorovaikutuksen jäykkiä voimia. Samanaikaisesti nesteiden heikko puristuvuus, joka määrää kyvyn ylläpitää vakiotilavuutta tietyssä lämpötilassa, osoittaa hiukkasten välisten, vaikkakaan ei jäykien, mutta silti merkittävien vuorovaikutusvoimien läsnäolon.
Jokaiselle aggregaattitilalle on ominaista oma suhde ainepartikkelien potentiaalisten ja kineettisten energioiden välillä. Kiintoaineille hiukkasten keskimääräinen potentiaalienergia on suurempi kuin niiden keskimääräinen kineettinen energia. Siksi kiinteissä aineissa hiukkaset vievät tietyn aseman toisiinsa nähden ja värähtelevät vain näiden asemien ympärillä. Kaasujen energiasuhde on päinvastainen, minkä seurauksena kaasumolekyylit ovat aina kaoottisen liikkeen tilassa ja molekyylien välillä ei käytännössä ole koheesiovoimia, joten kaasu vie aina koko sille annetun tilavuuden. Nesteiden tapauksessa partikkelien kineettinen ja potentiaalinen energia ovat suunnilleen samat, ts. hiukkaset on kytketty toisiinsa, mutta ei jäykästi. Siksi nesteet ovat nestemäisiä, mutta niiden tilavuus on vakio tietyssä lämpötilassa.
Nesteiden rakenneanalyysimenetelmien soveltamisen tuloksena havaittiin, että nesteen rakenne on samanlainen kuin amorfiset elimet. Useimmissa nesteissä havaitaan lyhyen kantaman järjestys - kunkin molekyylin lähimpien naapureiden lukumäärä ja niiden suhteelliset sijainnit ovat suunnilleen samat tämän nesteen koko tilavuudessa.
Hiukkasten järjestysaste eri nesteissä on erilainen. Lisäksi se muuttuu lämpötilan mukana. Matalassa lämpötilassa, ylittäen jonkin verran tietyn aineen sulamispistettä, tietyn nesteen hiukkasten järjestäytymisaste on suuri. Lämpötilan noustessa se laskee, ja kun nesteen ominaisuudet tulevat yhä lähempänä kaasun ominaisuuksia. Kun kriittinen lämpötila saavutetaan, ero nesteen ja kaasun välillä katoaa.
Nesteiden ja amorfisten kappaleiden sisäisen rakenteen samankaltaisuuden vuoksi jälkimmäisiä pidetään usein nesteinä, joilla on erittäin korkea viskositeetti, ja kiinteisiin aineisiin viitataan vain kiteisessä tilassa. Amorfisia kappaleita verrattaessa nesteisiin on kuitenkin muistettava, että amorfisissa kappaleissa, toisin kuin tavallisissa nesteissä, hiukkasilla on vähän liikkuvuutta - sama kuin kiteissä.
^ 8.7. Kiintoaineita. Tärkeimmät kidehilat: kuutio- ja kuusikulmainen
Kiinteässä tilassa useimmilla aineilla on kiteinen rakenne. Tämä voidaan helposti tarkistaa jakamalla kappale kappaleesta ja tutkimalla syntynyt murtuma. Yleensä murtuman kohdalla (esimerkiksi sokeri, rikki, metallit) eri kulmissa olevat hienot kidepinnat ovat selvästi näkyvissä, hehkuvat johtuen niiden erilaisesta valonheijastuksesta. Tapauksissa, joissa kiteet ovat hyvin pieniä, aineen kiderakenne voidaan määrittää mikroskoopilla.
Jokainen aine muodostaa yleensä tietyn muodon kiteitä. Esimerkiksi natriumkloridi kiteytyy kuutioiden kertoimissa, aluna oktaedrien muodossa, natriumnitraatti prismien muodossa jne. Kiteinen muoto on yksi kiinteiden aineiden ominaisuuksista.
Kidemuotojen luokittelu perustuu kiteiden symmetriaan. Erilaisia \u200b\u200bkiteisen polyhedran symmetriatapauksia tutkitaan yksityiskohtaisesti kristallografiakursseilla.
Monet aineet, erityisesti rauta, kupari, timantti, natriumkloridi, kiteytyvät kuutiojärjestelmässä. Tämän järjestelmän yksinkertaisimmat muodot ovat kuutio, oktaedri, tetraedri. Magnesium, sinkki, jää, kvartsi kiteytyvät kuusikulmaisessa järjestelmässä. Tämän järjestelmän päämuoto on kuusikulmainen prisma ja bipyramid.
Aihe: Kiinteiden aineiden, nesteiden ja kaasujen ominaisuudet.
Tarkoitus: Vakiinnuttaa tietoja kehon tilasta.
Harkitse kiinteiden aineiden, nesteiden ja kaasujen ominaisuuksia.
Muodostaa ideoita muodonmuutoksista, kimmoisuudesta ja plastisuudesta.
Oppitunnin kulku.
Opiskelijoiden järjestäminen oppitunnille. Mikä tiede tutkii elimiä, aineita, luonnon ilmiöitä ja tekniikkaa? (Physics).
Mikä on ruumis? Esimerkit.
Mikä on aine? Esimerkit.
Missä olosuhteissa aineet voivat olla?
Mitä ominaisuuksia aineilla on kiinteissä, nestemäisissä, kaasumaisissa tiloissa?
Uuden materiaalin oppiminen.
Tiedämme, että meitä ympäröivät monet elimet, jotka koostuvat aineista. Ne ovat hyvin erilaisia. Yritä kuvailla veden, sokerin, parafiinin ominaisuuksia. Miksi nämä aineet ovat niin erilaisia? Fysiikan tiede auttaa meitä vastaamaan tähän kysymykseen. Mistä aloitamme?
Kiinteiden aineiden ominaisuudet.
Ota kirja ja yritä muuttaa sen muotoa ja määrää.
Tee johtopäätös: mitä ominaisuuksia kiinteillä aineilla on?
(Jäykät rungot pystyvät pitämään muodonsa ja tilavuutensa ennallaan.)
Nesteiden ominaisuudet.
Kiinnitä vesimäärä mittakuppiin, kaada vesi pulloon ja sitten takaisin lasiin.
Onko veden määrä muuttunut?
Onko nesteen muoto muuttunut?
Tee johtopäätös: mitä ominaisuuksia nesteillä on?
Kirjoita tutkimustulokset taulukkoon. (Nesteet pystyvät pitämään tilavuuden, mutta eivät pysty pitämään muotoa.)
Kaasujen ominaisuudet.
Täytä ilmapallo. Mikä muoto pallo on?
Vapauta ilma ilmapalloista. Mihin ilma meni?
Onko ilmatila muuttunut?
Muuttui ilman muoto?
Tee johtopäätös: mitä ominaisuuksia kaasuilla on?
Kirjoita tutkimustulokset taulukkoon. (Kaasut eivät säilytä muotoaan ja vievät koko niille annetun tilavuuden.)
pohdintaa:
Mikä on yhteistä kiinteiden ja nesteiden ominaisuuksissa? Mikä on heidän ero?
Mikä on yhteistä kaasujen ja nesteiden ominaisuuksissa? Mikä on heidän ero?
Aiheesta tiedetään, että se säilyttää hyvin tilavuuden ja muodon. Missä tilassa aine, josta tämä esine koostuu? (kiinteässä tilassa.)
Muodonmuutoksia.
Ota metallinauha ja käännä sen päät eri suuntiin. Mitä tapahtui Onko nauhan muoto muuttunut? (Nauhan muoto muuttui voiman vaikutuksesta.)
Määrittele:
Muodonmuutos - muodon, koon ja kehon tilavuuden muutos.
Kimmoisuutta.
Venytä kuminauha ja vapauta sitten. Mitä tapahtui (Voiman vaikutuksesta nauhan muoto ja tilavuus muuttuivat, ja voiman päättymisen jälkeen nauha sai alkuperäisessä muodossaan.)
Määrittele:
Joustavuus - kehon ominaisuus muuttaa muotoa ja tilavuutta muiden elinten vaikutuksesta ja palauttaa ne toiminnan päättymisen jälkeen.
Missä elastisuusominaisuutta käytetään? (Teknologian kevät.)
Plastisuus.
Muovoi plastiliinin palasista pallo, sitten pallo - kuutio. Onko plastiliinin muoto muuttunut?
Laita hahmo pöydälle. Onko plastiliinin alkuperäinen muoto palautettu?
Määrittele:
Plastivuus - elinten ominaisuus muuttaa muotoa muiden elinten vaikutuksesta ja säilyttää se toiminnan päättymisen jälkeen.
Missä materiaalien plastiikkaominaisuus pätee? (Keramiikka - savituotteet, mallinnus savista, kynttilöiden tekeminen vahasta tai parafiinista.)
Lomakkeen alku
Lomakkeen loppu
Heijastus: Tutki veden ominaisuuksia ja täytä taulukko.
|
Veden tila |
Aineen tila |
||
|
säästää |
|||
|
Vesihöyry |
Ei säästä |
Kotitehtäviä. Toista kiinteiden aineiden, nesteiden ja kaasujen perusominaisuudet; Löydä esimerkkejä näiden ominaisuuksien käytöstä arkielämässä.
Kaikki kehot koostuvat atomista tai molekyyleistä (ainehiukkasista), jotka liikkuvat satunnaisesti ja ovat myös vuorovaikutuksessa vetovoiman ja heijastusvoimien kanssa. Ne ovat erot lämpöliike Näiden hiukkasten samoin kuin niiden vuorovaikutus eri olosuhteissa määrittelee aineessa useiden aggregaattitilojen olemassaolon: kaasumainen, nestemäinen, kiinteä. Näiden tilojen ominaisuudet ovat tämän oppitunnin aihe.
Atomi koostuu positiivisesti varautuneesta ytimestä ja negatiivisesti varautuneista elektroneista, jotka pyörivät ytimen ympärillä. Atomi, kuten molekyyli, on sähköisesti neutraali.
Harkitse hiukkasten välisen vuorovaikutuksen voimakkuutta käyttämällä kahden kiinteän molekyylin esimerkkiä.
Luonnonkappaleiden välillä on gravitaatio- ja sähkömagneettisia voimia. Koska molekyylien massat ovat erittäin pieniä, niiden välistä painovoiman vuorovaikutuksen voimia ei voida ottaa huomioon. Suurilla etäisyyksillä molekyylien välillä ei myöskään ole sähkömagneettista vuorovaikutusta.
Kun hiukkasten välinen etäisyys pienenee (katso kuva 1), ne alkavat orientoitua siten, että toisiinsa nähden olevilla puolilla on erilaiset varaukset merkissä (yleensä molekyylit pysyvät tässä tapauksessa neutraaleina), ja seurauksena molekyylien välillä syntyy houkuttelevia voimia (suurin vetovoima molekyylin 2-3 halkaisijan etäisyydellä). Kun molekyylien välinen etäisyys vähenee, molekyylien atomien negatiivisesti varautuneiden elektronikuorien vuorovaikutuksen seurauksena syntyy karkottavia voimia. Siksi voimien summa vaikuttaa molekyyliin: vetovoima ja vastenmielisyys (suurilla etäisyyksillä vetovoima vallitsee, pienillä etäisyyksillä - karkottava voima).
Kuva 1. Molekyylien välinen vuorovaikutus
Kuvio 2 esittää kaavion molekyylien välisen vuorovaikutusvoiman riippuvuudesta niiden välisestä etäisyydestä. Punainen viiva osoittaa vetovoimaa, sininen viiva näyttää heijastusvoimaa, vihreä viiva näyttää voimien lopullisen kuvaajan. Arvo on molekyylien välinen etäisyys, jolla houkuttelevat voimat ovat yhtä suuret kuin torjuvat voimat (vakaan tasapainon sijainti).
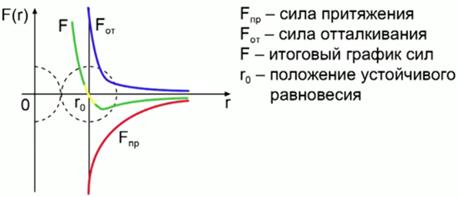
Kuva 2. Kaavio molekyylien välisen vuorovaikutusvoiman riippuvuudesta riippuen niiden välisestä etäisyydestä
Molekyylit, jotka sijaitsevat etäisyydellä toisistaan \u200b\u200bja on kytketty sähkömagneettisilla voimilla potentiaalinen energia. Vakaassa tasapainotilassa molekyylien potentiaalienergia on minimaalinen. Aineessa jokainen molekyyli on vuorovaikutuksessa samanaikaisesti monien naapurimolekyylien kanssa, mikä vaikuttaa myös niiden minimipotentiaalisen energian arvoon. Lisäksi kaikki aineen molekyylit ovat jatkuvassa liikkeessä, ts. Niillä on kineettinen energia. Täten aineen rakenne ja sen ominaisuudet (kiinteät, nestemäiset, kaasumaiset kappaleet) määritetään molekyylien vuorovaikutuksen pienimmän potentiaalienergian ja niiden lämpöliikkeen kineettisen energian varastosuhteen suhteella.
Kaasuhiukkasten keskimääräinen etäisyys on paljon suurempi kuin itse hiukkasten koko, joten törmäysten välisillä väleillä kaasuhiukkaset kulkevat matkoja, jotka ovat useita kertaluokkia suurempia kuin niiden omat mitat. Esimerkiksi ilmassa (normaaleissa olosuhteissa) molekyylin keskimääräinen vapaa polku on tuhat kertaa molekyylin keskimääräinen koko.
Tällaisilla suurilla etäisyyksillä molekyylien välillä molekyylien välisen vuorovaikutuksen voimat ovat hyvin pienet. Energian kannalta tämä tarkoittaa, että molekyylien vuorovaikutuksen potentiaalinen energia (verrattuna niiden liikkeen kineettiseen energiaan) voidaan jättää huomiotta.
Jos tarkastellaan kineettistä energiaa, toisin sanoen kaasumolekyylien liikettä, on syytä huomata, että kukin niistä ei osallistu vain translaatio-, vaan myös pyörimisliikkeeseen (jos se ei ole monatominen kaasu) ja jos otamme huomioon kaasumolekyylien hyvin pienen vuorovaikutuksen, niin nämä molekyylit osallistuu värähtelevään liikkeeseen (katso kuva 3).
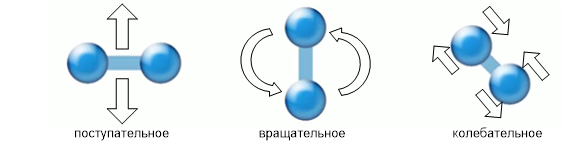
Kuva 3. Tyypit molekyylin liikkeet
Siten mikä tahansa kaasumolekyyli, ilman kovaa vuorovaikutusta naapureidensa kanssa, voi olla missä tahansa astian paikassa milloin tahansa, joten he sanovat, että kaasut eivät säilytä muotoa tai tilavuutta. Tätä kaasujen ominaisuutta käytetään laajasti nykytekniikassa (pneumaattiset laitteet, lämpömoottorit jne.).
Kiinteät aineet ovat täysin vastakohtia kaasuille. Niissä ei ole hiukkasten vapaata liikkuvuutta. Molekyylit sijaitsevat kidehilan solmuissa (katso kuva 4). Toisin sanoen kiinteiden aineiden muodostavien hiukkasten järjestelyssä on tiukka jaksollinen järjestys.
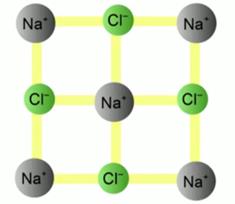
Kuva 4. NaCl: n (natriumkloridin) kidehila
Kiinteissä aineissa vuorovaikutuksen potentiaalienergia on erittäin merkittävä, kineettinen energia potentiaaliin verrattuna ei ole suuri. Atomit, molekyylit tai ionit tekevät vain värähteleviä liikkeitä lähellä tasapainotilaa. Vierekkäisten hiukkasten väliset etäisyydet ovat suunnilleen yhtä suuret kuin itse hiukkasten koko.
Kristalttien tyypit eroavat aineesta riippuen (pääasia on taajuus ja järjestys). Avaruuspisteitä, joissa kiinteän aineen hiukkaset sijaitsevat, kutsutaan kidehilan solmuiksi.
Koska hiukkasten järjestely on stabiili ja järjestyksessä kidehilan solmuissa, fyysikot sanovat, että kiinteillä aineilla on pitkän ja lyhyen kantaman järjestykset ainepartikkelien järjestelyssä (katso alla).
Kiinteät aineet säilyttävät muodonsa ja tilavuutensa (jos esimerkiksi altistat jousille muodonmuutoksille, se palaa aikaisempaan muotoonsa muuttamatta tilavuutta).
Jokaista nestemäistä molekyyliä, vaikka ne eivät sijaitse niin tiukasti ja järjestyksessä kuin kiinteässä rungossa, ympäröi sama määrä "naapurimolekyylejä" (ks. Kuva 5). Mutta jos tarkastellaan nestemäisiä molekyylejä kaukaa, emme voi puhua mistään järjestyksestä nesteessä, havaitsemme kaaoksen. Siksi sanotaan, että kiinteissä aineissa on lyhyen kantaman ja pitkän kantaman järjestys, kun taas nesteessä on vain lyhyen kantaman järjestys. Kaasumaisissa kappaleissa sekä lyhyen että pitkän kantaman järjestys puuttuu.

Kuva 5. Asentoaineiden hiukkasten järjestely pitkän ja lyhyen matkan järjestyksessä
Nesteillä, toisin kuin kiinteillä aineilla, on lähialuejärjestys ainepartikkelien järjestelyssä.
Nestemäisissä kappaleissa olevat hiukkaset on “pakattu” tiukasti ja, kuten kiinteissä aineissakin, värähtelevät tasapainotilan ympärillä. Yritys puristaa neste nopeasti johtaa molekyylien muodonmuutoksiin ja kohtaa nesteen voimakkaan vastuksen. Eli nesteet eivät käytännössä ole puristettavissa.
Vaikka nesteen molekyylit sijaitsevat melkein samat kuin kiinteässä aineessa, neste on nestettä. Tämä selitetään sillä, että toisin kuin kiinteässä rungossa, molekyylien värähtelyt nesteen tasapainotilan lähellä eivät ole ikuisia, jossain vaiheessa molekyyli "hyppää", siirtyen toiseen sijaintiin. Siksi neste säilyttää tilavuutensa hyvin, mutta ei säilytä muotoaan.
Energeettisestä näkökulmasta neste vie välituotteen kiinteän aineen ja kaasun välillä - nestehiukkasilla on kineettinen liikeenergia, joka on merkittävä mikroskooppisella tasolla, samoin kuin potentiaalinen vuorovaikutusenergia.
Kehon amorfista tilaa kutsutaan välituoteksi kiinteän ja nestemäisen välillä. Esimerkki tällaisesta aineesta on plastiliini, hartsi, lasi.
Amorfisten aineiden molekyylit sijaitsevat kuten nesteessä olevat molekyylit, ts. Niillä on lyhyen kantaman järjestys, mutta niillä ei ole pitkän kantaman järjestystä.
Tietyllä ehdollisuudella amorfisia kappaleita voidaan kutsua erittäin viskoosiksi nesteiksi. Voit tarkistaa tämän tarkastelemalla muinaisten linnajen ikkunaikkunoiden profiilia. Yläosassa nämä lasit ovat paljon kapeampia kuin alaosassa - monien vuosien ajan lasit “virtaavat” alas (katso kuva 6) muuttamatta sen sisäistä rakennetta. Itse asiassa esimerkiksi jäätiköt voivat myös virtaa alas. Mutta tämä johtuu jäätikön sulamisesta ja veden edelleen kiteytymisestä.

Kuva 6. Ikkunan lasiprofiili vanhassa linnassa
Kiinteissä aineissa hiukkasilla on merkittävä potentiaalienergia ja suhteellisen pieni kineettinen energia, koska ne tekevät värähtelyliikkeitä lähellä tasapainotilaa.
Väliaseman käyttävät nesteet, koska nestemäisillä hiukkasilla on merkittävä liikkeen kineettinen energia ja potentiaalinen vuorovaikutusenergia, ja kaasuissa molekyyleillä on suuri liikkeen kineettinen energia ja suhteellisen pieni (vähäinen) potentiaalinen vuorovaikutusenergia.
Viitteet
- GY Myakishev, B.B. Bukhovtsev, N.N. Constables. Fysiikka 10. - M .: Koulutus, 2008.
- Gendenshtein L.E., Dick Yu.I. Fysiikka 10. luokka. - M .: Ileksa, 2005.
- Kasyanov V.A. Fysiikka 10. luokka. - M .: Bustard, 2010.
- Luokka-fizika.spb.ru ().
- Kaf-fiz-1586.narod.ru ().
- Esitys ().
läksyt
- Kysymykset (1-4) 47 kohdan lopussa (s. 229); Kasyanov V.A. Fysiikan luokka 10 (ks. Luettelo suositeltavasta kirjallisuudesta) ().
- Mitä eroa on kaasu-, nestemäisten ja kiinteiden molekyylien ratojen välillä?
- Ilman voimakkaan jäähdytyksen avulla siitä voidaan tehdä nestemäinen. Samaan aikaan ilman käyttämä tilavuus vähenee lähes 700 kertaa. Tee johtopäätös tästä tosiasiasta: mikä osuus kaasun tilavuudesta on itse molekyylien tilavuus?
- Kaasu kykenee rajoittamattomaan laajentumiseen. Miksi maan ilmapiiri on olemassa?
Nesteiden, kaasujen ja kiinteiden aineiden fysikaaliset ominaisuudet.
Jotta ymmärretään paremmin kiinteiden, nestemäisten ja kaasumaisten jatkuvien väliaineiden käsitettä, tarkastelemme puhtaan (vakio kemiallinen koostumus) materiaalit. Otetaan esimerkki vedestä. Fysiikasta tiedetään, että puhtaat aineet voivat olla neljässä aggregaattitilassa: kiteisessä, nestemäisessä, kaasumaisessa ja plasmassa. Alla on esimerkki vesikaaviokaaviosta.
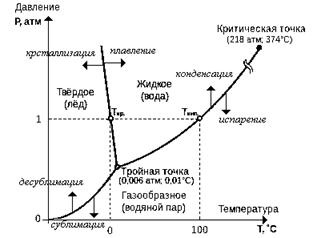 Kuva 1.1. Veden vaihekaavio. Kuva 1.1. Veden vaihekaavio. |
Materiaalien fysikaaliset ominaisuudet määräytyvät niiden molekyylien välisen (interatomisen) vuorovaikutuksen perusteella. Alhaisissa lämpötiloissa (alhaiset energiat) tapahtuu molekyylin kiderakenne tai atomit ovat tiukasti kytketty toisiinsa ja värähtelevät kidehilan keskipisteiden ympärillä, ja väliainetta kutsutaan yleensä kristalli. Fysiikassa on tapana sanoa, että tapahtuu pitkän kantaman järjestys. Tässä tapauksessa sen hila voi olla läsnä itse hilassa - siirrot, avoimet työpaikat (atomin puuttuminen hilakohdasta) jne. Meitä kiinnostaa ensisijaisesti kysymys jatkuvan väliaineen ominaisuuksien muuttamisesta voimien vaikutuksesta.
rasitus (lat. defogmatio - ”vääristymä”) - kehon hiukkasten suhteellisen sijainnin muutos, joka liittyy niiden liikkeeseen suhteessa toisiinsa. Muodostumat ovat seurausta muutoksista interatomisissa etäisyyksissä ja atomilohkojen uudelleenjärjestelyissä.
Kristallin muodonmuutos vaatii huomattavia ponnisteluja sen tekemiseksi, siksi kiteisiä (kiinteitä) kappaleita pidetään puristamattomina. Tarkastellaan kiinteän materiaalin tankoa, jolla on vakio poikkileikkaus, jonka päihin kohdistetaan jännite (kuva 1.2.). Lineaarinen kanta voidaan kuvata mitatta suurella
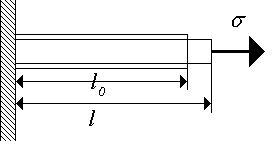 Kuva 1.2. Tangon vetolujuus. Kuva 1.2. Tangon vetolujuus. |
Alla (kuva 1.3.) On kaavioita jännityksen riippuvuudesta lineaarisella rasituksella.

Kuva 1.3. Venymäkaaviot yleistetylle materiaalille.
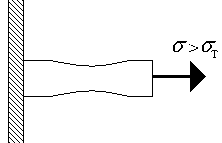
Useimmille kiinteille materiaaleille tapahtuu lineaarinen leikkaus, kun taas jännite ei ylitä arvoa - suhteellisuusraja. Hooken laki on voimassa tällä alueella. Tässä osassa muodonmuutos on palautuva - kuorman poistamisen jälkeen muodonmuutos katoaa, tällaista muodonmuutosta kutsutaan joustava -. Tätä seuraa kohta, jolla on epälineaarinen riippuvuus ja pysyvä muodonmuutos ( muovi), joka muodostuu purkamisen jälkeen. Samanaikaisesti useilla materiaaleilla on selkeästi määritelty myötöpiste (näytteen muodonmuutos jatkuu jopa kuvan 1.3.a vakiokuormalla), kun taas useilla materiaaleilla ei ole (kuva 1.3.b). Ensimmäisille materiaaleille annetaan arvo - myötölujuus, toisille johdetaan ehdollista myötölujuutta - jännitys, jossa muovien muodonmuutos purkamisen jälkeen on 0,2% tai 0,002. Ensimmäisessä tapauksessa kohta on plastisen muodonmuutoksen paikka, kohta on tuottokohta. Huomaa, että materiaalivirtaus tapahtuu tasaisesti koko pisin sauva.
 Kuva 1.4. Kaulan muodostuminen. Kuva 1.4. Kaulan muodostuminen. |
Lisäkuorman lisäys johtaa muodonmuutosten epätasaiseen jakautumiseen pitkää sauvaa pitkin (kuva 1.4) - jossain paikassa voit huomata kaulan muodostumisen (kuva 1.4.). Materiaalin muodonmuutos pisteessä A (kuva 1.3.a) koostuu myös muovista ja elastisesta. Kuorman lisäys edelleen johtaa materiaalin tuhoutumiseen, kun se saavuttaa lopullisen lujuuden.
Stressi, material tämä materiaali kestää käytännössä, romahtamatta ja ilman vaarallisia muodonmuutoksia, nimeltään hyväksyttävä ja merkitsevät. Yleensä kaikki laskelmat perustuvat Hooken lakeihin. Lujuuden varmistamiseksi kaikissa olosuhteissa sallittu jännitys valitaan osana vetolujuutta erityisesti metalleille [s] \u003d 0,2 s m ja puulle [s] \u003d 0,1 s m. On huomattava, että suurimmat muodonmuutokset, jotka kestävät materiaalia ei määritetä sadon pinta-alan perusteella. Jos saantoalue on suuri, materiaalia kutsutaan yleensä muovi. Materiaali, kuten teräs, kestää suuria kuormia rikkomatta. Päinvastoin, jos saantoalue on pieni, tämä materiaali on hauras. Hauraat materiaalit, kuten valurauta, tuhoutuvat muodonmuutoksella. Joissakin tapauksissa muovimateriaalit voivat myös rikkoutua pienten muodonmuutosten seurauksena (esimerkiksi teräs alhaisissa lämpötiloissa). Kiinteiden materiaalien lujuusominaisuudet riippuvat olennaisesti materiaalin lämpötilasta.
Energian lisääntyessä kidehilan rikkomusten lukumäärä kasvaa, ja tämä prosessi etenee dynamiikassa (jostain ne katoavat, ja jossain ne muodostuvat uudelleen). Tietyn energiakynnyksen saavuttamisen jälkeen joustavuus katoaa. Tässä tapauksessa tapahtuu lyhyen kantaman tilaus, ja tällaista materiaalia kutsutaan yleensä neste. Nesteen ja kehon kiteen molekyylien (atomien) keskimääräinen ominainen etäisyys on suunnilleen sama ja yhtä suuri kuin ʼʼ (3¸4) 10-6 m. Neste- ja kidefaasien tiheydet ovat myös suunnilleen samat. Joten veden tiheys, bensiinien, kerosiinin, dieselpolttoaineiden, öljyjen tiheys. Tässä tapauksessa joukkovelkakirjojen hajoamisesta johtuva neste hankkii uuden omaisuuden sujuvuus - kyky muodonmuutos mielivaltaisesti pienten ulkoisten vaikutusten vaikutuksesta, kunnes sisäiset tangentiaaliset jännitykset muuttuvat nollaksi. Lämpötilan noustessa kehon juoksevuus kasvaa.. Tässä tapauksessa neste, kuten kiinteä kappale, on puristamaton (tiheys pysyy melkein muuttumattomana). Lämpötilan nousu edelleen johtaa sidosten täydelliseen katkeamiseen (lyhyen kantaman järjestyksen puute). Tässä tilassa olevaa materiaalia kutsutaan yleensä kaasu. Kaasumaisten kappaleiden tyypillinen piirre on kaoottinen liike ja molekyylien törmäys avaruudessa. Tästä syystä kaasuilla ei ole vain juoksevuutta, vaan myös kokoonpuristuvuus.
Harkitse nesteellä täytettyä astiaa, jonka pohja-ala ja pystysuorat seinät ovat. Käytämme voimaa ja nostamme tilavuuden painetta dp (Kuva 1.5). Samanaikaisesti jatkuva väliaine puristetaan, vähentämällä sen tilavuutta määrällä. Empiirisesti saadaan, että tilavuuden muutoksen ja linjan paineen välinen suhde - на, ᴛ.ᴛ. jokaiselle nesteelle voit syöttää vakion, jota kutsutaan tilavuuden laajenemiskerroimeksi (vakiolämpötilassa):
 .
(1.3.2)
.
(1.3.2)
Tilavuuspuristuskerroimella on ulottuvuus (Pa) -1. Miinusmerkki osoittaa, että äänenvoimakkuutta vähennetään pakkaamalla.
Käänteistä moduulia kutsutaan yleensä massan kimmokerrokseksi:
Nämä molemmat arvot riippuvat nesteen lämpötilasta ja tyypistä T \u003d 293 ° K on yhtä suuri kuin \u003d 2 × 109 Pa - 20000 kgf / cm2.
Jos vesi ilmakehän paineen lisäksi ( p a \u003d 101325 Pa tai 1,033 kgf / cm2), sama paine toimii lisäksi, sitten veden tilavuus vähenee noin 1/20000, ᴛ.ᴇ. melkein mahdotonta huomata. Siksi vettä ja muita nesteitä voidaan pitää puristamattomina ja niiden tiheysvakiot pysyvät vakiona ( r \u003d const), joka on riippumaton paineesta. Useimpien nesteiden tiheys laskee lämpötilan noustessa, paitsi vettä, jonka tiheyden enimmäisarvo on 4 ° C. Analogisesti kohdan (1.3.2) kanssa voidaan ottaa käyttöön tilavuuslämpötilan laajenemiskerroin.
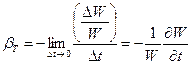 ,
,
sitten nesteen tiheys lasketaan kaavalla:
tässä tiheys standardiolosuhteissa () on lämpötila Celsius-asteina.
Kuten edellä jo todettiin, pääasiallinen ero kaasun ja nesteen välillä on siinä, että kaasu puristetaan helposti. Siinä äänen etenemisnopeus (ja siten kaikki mekaaniset häiriöt) on paljon pienempi kuin nesteessä. Tämä kaasun ominaisuus olisi otettava huomioon, kun liikkeen nopeus (tai siinä olevan kiinteän aineen liikkeen nopeus) tulee verrattavissa äänen nopeuteen tai ylittää sen.
Päinvastoin kuin kaasu, nesteellä on selvästi määritelty rajapinta sen ja sitä ympäröivän kaasun välillä, jota yleisesti kutsutaan vapaaksi pintaksi. Painovoiman alalla nesteen vapaalla pinnalla on vaakasuora profiili. Nollan painovoiman ollessa pintajännityksen takia vapaa pinta on pallo. Tämä nesteen ominaisuus, samoin kuin sen matala puristuvuus, johtuu naapurimolekyylien jatkuvasta vuorovaikutuksesta. Kaasussa molekyylit ovat vuorovaikutuksessa keskenään vain törmäyksen hetkellä, suurin osa ajan kuluessa ne liikkuvat vapaasti avaruudessa, tässä yhteydessä kaasun taipumus jakautuu tasaisesti koko tilan suljettuun osaan liikkeen satunnaisuuden vuoksi. Jos tilaa ei ole suljettu, kaasumäärä voi kasvaa rajattomasti.
Kaasussa on mahdollista alentaa painetta rajattomasti ja nostaa lämpötilaa, ja näin toimiessaan kaasun ominaisuudet muuttuvat jatkuvasti. Nesteessä paine voi laskea tiettyyn arvoon, jonka alapuolella alkaa kaasukuplien muodostuminen sen sisällä ja alkavat vaihesiirtymät, jotka muuttavat kvalitatiivisesti nesteen ominaisuuksia. Sama asia voi tapahtua, kun nesteen lämpötila nousee. Valtion yhtälö. Oma asiakaskeskus on usein käytetty kaksi-parametri tai yksinkertainen Keskiviikkona. Toisin sanoen väliaine, jonka koko termodynaaminen parametri lasketaan kahdessa suhteiden avulla, joita kutsutaan tilan yhtälöt .
Tilayhtälöitä on kahta tyyppiä.
lämpö- tilan yhtälö
lämpö- tilan yhtälö
Tässä on ominainen (massayksikköä kohti) sisäinen energia.
Kaasun suhteen voidaan melko tehokkaasti käyttää kaasumallia, jota kuvataan Klaiperonin - Mendelejevin - valtion lämpöyhtälössä.
jossa D - kaasuvakio, sellaista kaasua kutsutaan täydellinen tai (termisesti täydellinen.
, G o\u003d 8,3144 J / (mol × K) on yleinen kaasuvakio.
Kaasun moolimassa, \u003d kg / mol.
Van der Waalsin tilayhtälöä käytetään usein, ĸᴏᴛᴏᴩᴏᴇ on voimassa laajemmalla lämpötila- ja painealueella:
Kertoimet Van Der Waltz -yhtälössä
Huomaa myös, että Van Der Waltz -yhtälöä käytetään myös nesteiden kuvaamiseen, mutta tavallisissa olosuhteissa se antaa vain laadullisen kuvauksen.
Pisaranesteille, joiden puristuvuus on erittäin pieni, laajalla paineenmuutosalueella, tiheyden ja virtapaineen välinen suhde on:
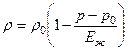 ,
,
Missä painetta vastaava tiheys on massapuristuskerroin, jonka järjestys on 104 MPa.
Korkeisiin paineisiin ja lämpötiloihin binominen tilayhtälö on edullinen:
![]()
Joten vedelle käytetään seuraavia vakioiden arvoja: ![]()
Adiabaattiselle prosessille (kun lämmön ja massan siirto ei ole allokoidun kaasumäärän ja ympäristön välillä) on ominaista seuraava riippuvuus:
jossa - adiabaattinen kaasuvakio (adiabaattinen indeksi); kanssa v - kaasun lämpökapasiteetti vakiona tilavuudessa; p - sama vakiopaineessa. Tällaista kaasua kutsutaan termisesti ja kalorisesti täydelliseksi tai polytrooppinen.
Nesteiden ja kaasujen viskositeetti. Nesteiden reologiset ominaisuudet. viskositeetti on tapana kutsua nesteen ominaisuutta, ĸᴏᴛᴏᴩᴏᴇ muodostuu siinä sisäisten voimien esiintymisestä, jotka estävät sen muodonmuutosta, ᴛ.ᴇ. sen osien suhteellisen sijainnin muutos. Tarkastellaan ideaalikaasun - yksinkertaisen leikkausvirtauksen - molekyylikineettisen teorian erikoistapausta (kuva 1.6).
 Kuva 1.6. Nesteiden ja kaasujen viskoosit rasitukset Kuva 1.6. Nesteiden ja kaasujen viskoosit rasitukset |
Kerrosten 1 ja 2 erottavan pinnan ala-alue liikkuu nesteen mukana. Tässä tapauksessa nestekerros 1 liukuu kerrosta 2 pitkin suhteellisella nopeudella. Kaasumolekyylit osallistuvat kahdentyyppisiin liikkeisiin:
1. tilattu (pitkittäissuuntainen) nopeudella;
2. kaoottinen, epäjärjestysinen lämpöliike, jonka nopeus on yleensä kaksi suuruusluokkaa suurempi kuin tilatun liikkeen nopeus.
Kaasun viskositeetti johtuu molekyylien siirrosta niiden lämpöliikkeen (diffuusion) aikana alustan läpi, joka sijaitsee tasossa, joka erottaa kaksi kerrosta, joilla on erilaiset pitkittäisnopeudet ja liikkeen määrä näiden kerrosten nopeuserosta johtuvien erojen vuoksi. Molekyylit liikkuvat satunnaisesti satunnaisesti samalla kun ne siirtyvät kerrokselta toiselle ylittäen alueen. Molekyylit, joilla on määrätty nopeus, siirtyvät kerros 2 ja hidastaa sen liikettä, ja sama määrä kerrokseen 1 loukkuun jääneitä kerroksia 2 kiihdyttää kerrosta 1. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, väliaineen viskositeetti ilmenee vain, kun väliaine liikkuu.
On tärkeätä huomata, että jatkuvassa väliaineessa uskotaan, että leikkausjännitys vaikuttaa paikan päälle kompensoimaan molekyylien lämpöliikkeestä johtuvaa momentinsiirtoa. Molekyyli-kineettisen teorian mukaan tämä leikkausjännitys
![]() (1.3.6)
(1.3.6)
jossa h - dynaaminen viskositeettikerroin (dynaaminen viskositeetti) kaasua. Sen arvo määräytyy väliaineen fysikaalisten ominaisuuksien perusteella. Stressin merkki on kuin se "yrittäisi" vähentää kerrosten nopeuden eroa.
Riippuvuus (1.3.6) pätee useimpiin kaasuihin ja nesteisiin, ja sitä kutsutaan yleensä newtonin laki viskoosille rasituksille.Vastoin kuivaa kitkaa koskevaa lakia, leikkausleikkausjännitys on riippumaton normaalista rasituksesta.
Määritelmän (1.3.6) mukaan dynaaminen viskositeettikerroin h SI-järjestelmässä on seuraava yksikkö:

Käytännössä, joskus yhtenä kokonaisuutena h käytä P \u003d g / cm × s, jota kutsutaan Poiseksi (ranskalaisen lääkärin A. Poiseuillen kunniaksi, joka teki perustutkimuksia viskoosisen nesteen liikkeestä): Pa × s \u003d 10 × P.
On syytä sanoa, että puristamattomien materiaalien () kohdalla on suositeltavaa käyttää arvoa
![]() . (1.3.7)
. (1.3.7)
nimeltään kinemaattinen viskositeettikerroin(kinemaattinen viskositeetti). Käytännössä käytetään arvoa St \u003d cm 2 / s, jota yleensä kutsutaan Stokeksi (englantilaisen hydromekaniikan J. Stokesin kunniaksi, joka muotoili viskoosisen nesteen liikeerotteluyhtälöt): 1St \u003d 10 - 4 m 2 / s.
Viskositeetin mittaamiseksi instrumentit nimeltään viskosimetrillä.
Läpinäkyviin nesteisiin käytetään Stokesin viskosimetriä - korkeaa lasia, jossa on jako, johon johdetaan ylhäältä alhaisia \u200b\u200baineita, joiden tiheys on lähellä nesteen tiheyttä, ja pallon nopeus mitataan. Koska paino, Archimedeksen voima ja vetovoima tunnetaan pienillä nopeuksilla ja pallo liikkuu tasaisesti, viskositeettikerroin lasketaan helposti.
On syytä sanoa, että läpinäkymättömille nesteille käytetään Engleriä, jolla määritetään ehdollinen viskositeetti, joka mitataan Englerin noin E-asteina. Engler-asteiden lukumäärä määritetään suhteella, joka kuluu testinesteen loppumisesta tietyssä lämpötilassa viskosimetristä, jotta tislattu vesi poistuisi samasta laitteesta normaalissa lämpötilassa (20 ° C). Englerin asteiden muuntaminen kinemaattisen viskositeetin yksiköiksi (Stokes) suoritetaan empiirisen Ubellode-kaavan mukaan:
![]() . (1.3.8)
. (1.3.8)
Taulukossa. Kuvio 1.1 näyttää h, r, n -arvot joillekin nesteille ja kaasuille ja kuva 1.7 esittää lämpötilan ja veden riippuvuutta vedestä ja ilmasta.
Taulukko 1.1
Joillekin nesteille ja kaasuille H, r, n -arvot

Kuva 1.7. Kinemaattisen viskositeettikerroksen riippuvuus lämpötilasta.
Yllä olevista tiedoista seuraa, että veden viskositeetti laskee lämpötilan noustessa 0 - 100 ° C melkein seitsemän kertaa, ja ilman viskositeetti kasvaa lämpötilan noustessa 20-50 ° C: seen 25% . Huomaa, että kaasuissa viskositeetti ja diffuusio johtuvat samasta fyysisestä mekanismista - molekyylien termisestä kaoottisesta liikkeestä. Tästä syystä kinemaattisen viskositeetin kerroin n on yksi suuruusluokka molekyylidiffuusiokerroimen kanssa. Nesteissä viskositeetilla ja diffuusiolla on erilainen fysikaalinen luonne. Tämän seurauksena diffuusiokerroin nesteessä on satoja kertoja pienempi kuin viskositeettikerroin.
Kun kaasun lämpötila nousee, molekyylien kaoottisen liikkumisen nopeus kasvaa, mikä johtaa paikan ylittävien molekyylien lukumäärän lisääntymiseen aikayksikköä kohti, ja siksi liikkumisen siirtäminen kerrokselta toiselle ja vastaavasti myös leikkausjännitys. Kohdan (1.3.6) mukaan tämä tarkoittaa sitä kanssa lämpötilan noustessa kaasun viskositeetin dynaaminen kerroin kasvaa .
nesteettärkein syy vauhdin siirtymiselle on kerrosten välisen rajan vastakkaisilla puolilla sijaitsevien molekyylien vuorovaikutus eikä molekyylien siirtyminen tämän rajan läpi. Tästä syystä kanssa lämpötilan noustessa nesteen dynaaminen viskositeettikerroin laskee(toisin kuin kaasut).
Suunnittelulaskennassa käytetään laskelmiin veden viskositeetin kinemaattisen kertoimen likimääräistä arvoa n \u003d 0,01 cm 2 / s \u003d 0,01 St.
On kuitenkin monia nesteitä, joihin Newtonin lakia ei noudateta. Tällaisia \u200b\u200bnesteitä kutsutaan ei-newtoninen, ja tiede riippuvuuden luonteesta ![]() yleisesti nimeltään reologia (kreikka. reo - flow, logot - opetus). Niiden ominaisuuksista keskustellaan yksityiskohtaisemmin myöhemmin 4. luvussa.
yleisesti nimeltään reologia (kreikka. reo - flow, logot - opetus). Niiden ominaisuuksista keskustellaan yksityiskohtaisemmin myöhemmin 4. luvussa.
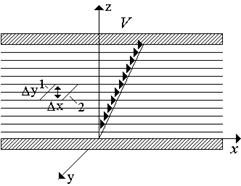
Elatusaineiden välisessä rajapinnassa olevat molekyylit joko houkuttelevat tai hylkivät viereisen väliaineen. Tämän seurauksena vetovoimien tulisi ilmetä tulostusmateriaalin kaarevalle rajapinnalle yrittäen suoristaa rajapinta.
Vetojännitystä (voima pituusyksikköä kohti) kutsutaan pintajännityskerroimeksi. Veden ja ilman rajalla (vapaa pinta) T \u003d 293 K ° \u003d 72,8 ∙ 10-3 N / m. Pintajännityskerroin pienenee lämpötilan noustessa ja on käytännössä riippumaton paineesta. Pintajännitystä tulisi vähentää pinta-aktiivisilla aineilla (pinta-aktiivisilla aineilla), joihin sisältyy pesuaineita. Tämä nesteiden ominaisuus ilmenee selkeimmin kolmen väliaineen (kaasu, neste, kiinteä) rajapinnalla. Siellä on kostuttavia ja kostumattomia nesteitä, kuva 16. Kulma - kutsutaan yleisesti kostutuskulmaksi.
Kuva 1.8. Kostuttavat ja kostumattomat nesteet.
Pintavoimien aiheuttama painehäviö kaarevalle pinnalle on laskettava käyttämällä Laplace-kaavaa
 , (1.3.9)
, (1.3.9)
missä ovat pinnan tärkeimmät kaarevuudet. On tärkeätä huomata, että pallomaisissa muodostumissa (pudotus, kupla, pallo) kaava on muodossa:
Tässä on pallomaisen muodon säde.
Veden osalta seuraava suhde on totta:
![]() ,
,
Tässä on lämpötila Celsius-asteina.
Yhteenvetona voidaan todeta, että MSS toimii jatkuvan välineen malleilla. Taulukossa 1. esitetään yhteenveto kolmen perusmallin pääominaisuuksista.
Taulukko 1. Jatkuvan median mallin pääpiirteet.
Mallin käyttö todellisen ympäristön ominaisuuksien kuvaamiseen määräytyy ympäristön sijaintiolosuhteiden perusteella. Joten esimerkiksi jos kaasun nopeus on pieni (Mach-luku, joka on yhtä suuri kuin nopeuden ja äänen nopeuden suhde, on alle 0,2), kaasua voidaan pitää puristamattomana nesteenä.
Lasia kuvataan yleensä kiinteänä muodonmuutoskappaleena, mutta fysikaalisesti se on epänormaalin korkea viskositeetineste. Nesteet, esimerkiksi korkeissa paineissa ja lämpötiloissa, räjähdykset tai suuret syvyydet, muuttuvat puristuviksi.
Kiinnitä huomiota jälleen kuvaan 1.1. Siitä seuraa, että sama aine, olosuhteista (paine ja lämpötila) lähtien, voi olla erilaisissa aggregaatiotiloissa. Yhdistymisen tilan muutokseen liittyy aina järjestelmän energian muutos (ensimmäisen tyyppiset vaihesiirtymät). Tämä kaavio ja vastaavat vastaavat kemiallisesti homogeenisten aineiden tasapainoprosessien tapausta. Käytännössä näin ei aina ole. Siksi kuumennettava neste voi muuttua höyryksi kiehuessaan, tässä tapauksessa uusi faasi muodostuu kuplien muodossa joko astian kuumennetulle pinnalle tai itse nesteeseen. Samoin, kun nesteessä paine laskee jyrkästi, siihen muodostuu höyrykuplia, tätä ilmiötä kutsutaan kavitaatio (lat. cavita - tyhjyys). Myöhemmin kuplat liikkuvat alueelle lisääntyneellä paineella ja romahtavat, jolloin muodostuu iskuaalto, mikä johtaa nesteen virtaviivaisten kiinteiden pintojen tuhoamiseen.
Useista aineista koostuvissa väliaineissa vaihesiirtymillä on omat erityispiirteensä. Joten kaasuseoksissa (ilma, maakaasu) kondensoitumista tapahtuu eri komponenteille eri paineissa ja lämpötiloissa. Tätä ominaisuutta käytetään erottamaan kaikki kaasuosat.
Eri nesteille kaasujen liukoisuus on erilainen ja vaihtelee paineen kasvaessa.
Nesteeseen liuenneen kaasun suhteellista tilavuutta, kunnes se on täysin kylläinen, voidaan pitää suoraan verrannollisena paineeseen:
missä on liuenneen kaasun tilavuus, on nestetilavuus, on kaasun lopullinen ja lähtöpaine, on liukoisuuskerroin. Ilman liukoisuuskerroin k on seuraavat merkitykset, kun t\u003d 20 ° C:
- vedelle k= 0,016;
- petrolille k= 0,127;
- muuntajaöljylle k= 0,083;
- teollisuusöljylle k= 0,076.
Kun paine nesteessä laskee, siihen liuennut kaasu vapautuu ja kaasua vapautuu nesteestä intensiivisemmin kuin se liukenee siihen.
1.4. Menetelmät jatkuvan väliaineen liikkeen kuvaamiseksi. Paikallinen ja merkittävä johdannainen.
liike - Olennainen aineen ominaisuus, tältä osin ympäröivässä maailmassa kohtaamme jatkuvasti erityyppisiä liikkeitä, mukaan lukien ja erilaisten medioiden liikkuvuus. Öljy- ja kaasualalla on siis käsiteltävä nesteiden ja kaasun liikkumista putkien läpi ja erilaisten koneiden ja mekanismien sisällä; suodattamalla suodattavia nesteitä ja kaasuja huokoisen väliaineen läpi; erityyppisten rakenteiden (säiliöiden, säiliöiden, vaimentimien jne.) muodonmuutos, geologiset muutokset. Tästä syystä on tärkeää tuntea nesteiden ja kaasujen vuorovaikutusvirtarajojen lait (etenkin putkien, käytävien, rakenteiden, suuttimien kestävyyslait), suurten nopeuksien virtausten epätasainen jakautuminen, nesteiden ja kaasujen suodatuslaki huokoisen väliaineen välillä sekä nesteiden ja kappaleiden tasapaino tasapainossa. nestemäinen pinta, aaltojen ja tärinän eteneminen kiinteissä ja nesteissä.
Kinematiikan tehtävä - kuvaus väliaineen liikkeestä, riippumatta ulkoisista olosuhteista, jotka liikkeen aloittavat ja tukevat. Kinemaattiset ominaisuudet sisältävät hiukkaskoordinaatit, nopeuden, kiihtyvyyden. Jatkuvan välineen liikkeen kuvaamiseksi on olemassa kaksi lähestymistapaa. Menetelmällä Lagrangen Kunkin nestehiukkasen liike otetaan huomioon.
Tarkastellaan hiukkasen liikettä tietyssä suorakulmaisten ja suoraviivaisten koordinaattien järjestelmässä Oxyz, jota sovimme kutsuvan kiinteäksi (tarkkailijajärjestelmä). Anna hiukkasten sijainnin koordinaattien kanssa alkuperäisellä ajanhetkellä. Tässä tapauksessa pisteen koko liikkeen kuvaamiseksi on erittäin tärkeää tietää sen liikkeen yhtälö ᴛ.ᴇ. ![]() missä on pisteen sädevektori.
missä on pisteen sädevektori.
Kutsutaan käyrää, joka kuvataan liikkuvan pisteen peräkkäisissä kohdissa polku.
Pisteen liike määritetään, jos sen koordinaatit on määritelty x, y, z, ajan t jatkuvina funktioina:
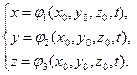 (1.4.1)
(1.4.1)
Nämä yhtälöt määrittävät liikkuvan hiukkasen sijainnin milloin tahansa. t ja edustavat trajektoriarvoa parametrimuodossa. Muuttujia kutsutaan lagrange-muuttujat. Lagrangian koordinaatit - nämä ovat parametrit, jotka kuvaavat väliaineen kutakin pistettä eivätkä muutu hiukkasen liikkeen aikana. ᴏϬᴩᴀᴈᴏᴍ, Lagrange-näkökulma perustuu kuvaukseen jatkuvan välineen kunkin pisteen liikehistoriasta erikseen.
Liikkuvan pisteen nopeus on yhtä suuri kuin liikkuvan hiukkasen sädevektorin aikajohdannainen ja on projektioilla varustettu vektori:
Aikaan perustuva geometrinen piste. Tästä syystä nopeuskenttä määritetään geometristen koordinaattien ja ajan funktiona:
![]() (1.4.4)
(1.4.4)
Nykyinen rivi on tapana kutsua linja tangentti, joka kullakin ajanhetkellä osuu nopeusvektorin suuntaan. Siksi virtaviivojen yhtälö on muoto:
Jatkuvan väliaineen ominaisuuksia (nopeuskenttä, painekenttä, jännityskenttä jne.), Joihin viitataan geometrisen tilan kiinteinä liikkumattomina elementeinä (pisteet, viivat, pinnat, tilavuudet), ja näitä elementtejä itse kutsutaan eulerian muuttujat.
Euler-menetelmässä nopeus on sekä koordinaattien että ajan funktio. Tästä syystä kiihtyvyys, samoin kuin muut hydromekaaniset määrät, jotka vaihtelevat nestetilavuuden liikkeen mukaan, ilmaistaan \u200b\u200bjohdannaisen erityismuodon kautta, joka on tietyllä tavalla yhteydessä nopeuskenttään. Tämä johdannainen on kuitenkin liitettävä nesteen tai kaasun (aineen) hiukkasten liikkeeseen. Tätä johdannaista kutsutaan täysi tai merkittävä
Oppitunti 41: 7 solua
Aihe: Kaasujen ominaisuudet. nesteet ja kiinteät aineet
Oppitunnin tavoite: Muodostaa ideoita aineen rakenteesta aggregoitumisen eri tiloissa. Selitä ehdoin molekyyliteoria houkuttelevia piirteitä aineiden sisäinen rakenne kaasumaisissa, nestemäisissä ja kiinteissä olosuhteissa.
Oppitunnin tavoitteet:
Koulutus: Kiinteiden aineiden, nesteiden ja kaasujen mekaanisia ominaisuuksia koskevan tiedon kehittäminen ideoiden avulla aineen molekyylirakenteesta.
Kehittäminen: Jatketaan taitojen muodostumista syy-yhteyksien selvittämiseksi tosiasioiden, ilmiöiden ja niitä synnyttäneiden syiden välillä, esitetään hypoteesit, perustellaan ne ja varmistetaan luotettavuus.
Vanhemmuus: Jatketaan kognitiivisen kiinnostuksen muodostumista aiheesta "Fysiikka"
Oppitunnin tyyppi: uuden materiaalin oppiminen
LESSON STROKE
I. Organisaation osa (tervehdys, oppituntiin valmistautumisen tarkistaminen, tunnepito)
Hei kaverit! Tänään jatkamme sivujen avaamista ympäröivän maailman tietoon. Mielenkiintoisia löytöjä odottaa meitä. Oletko valmis? Kyllä! Aloitetaan sitten ...
II. Tavoitteiden asettaminen ja motivaatio
Muinaisista ajoista lähtien ihminen on yrittänyt selittää luonnossa esiintyviä ilmiöitä, tuntea paitsi kuultavan, myös kuulumattoman, ei vain näkyvän, mutta myös näkymättömän.
Mitkä kolme ryhmää voidaan jakaa seuraaviin aineisiin: vesi, kivi, ilma, tina, alkoholi, sokeri, maakaasu, jää, happi, kasviöljy, alumiini, maito, typpi (nämä aineet annetaan huoneenlämpötilassa).
Jaoit aineet kolmeen ryhmään: kiinteät, nestemäiset ja kaasumaiset. Olemme tottuneet näkemään monia heistä yhdessä valtiossa. Esimerkiksi rauta - kiinteässä kasviöljyssä - nestemäisessä muodossa, vety - kaasumaisena. On kuitenkin niitä, jotka elämässämme löytyvät kolmesta valtiosta kerralla, MIKÄ? esimerkiksi vesi: veden kiinteä tila - jää, nestemäinen vesi, kaasumainen - vesihöyry. Yritetään selvittää, miten nämä aineet eroavat toisistaan.
Kuinka luulette oppituntemme aiheen kuulostavan?
Tämän päivän oppitunnin teema
« Kaasujen ominaisuudet. nesteet ja kiinteät aineet» .- kirjoittaminen muistikirjaan
Mikä on mielestäsi tavoitteemme tässä oppitunnissa?
Asetamme tänään tavoitteemme on selvittää, mitkä kiinteiden aineiden, nesteiden ja kaasujen ominaisuudet ovat, selittää nämä ominaisuudet molekyylien järjestelyn, liikkumisen ja vetovoiman erojen tuntemuksen perusteella.
Kirjoittaminen taululle (tavoite opiskelijoille)
Kiinteiden aineiden, nesteiden ja kaasumaisten kappaleiden ominaisuudet
Molekyylien järjestely kiinteissä, nesteissä ja kaasumaisissa kappaleissa
Molekyylien liikkuminen kiinteissä, nestemäisissä ja kaasumaisissa kappaleissa
Kiinteiden, nestemäisten ja kaasumaisten kappaleiden molekyylien vuorovaikutus
III. Uuden tiedon ensisijainen omaksuminen
Järjestämään tietomme aineen rakenteesta, kehon ominaisuuksista eri yhdistelmätiloissa täyttämällä taulukko: (lomake lapsille pöydällä)
Tutkimustehtävät
Tehtävä 1: "Kaasujen ominaisuuksien tutkimus." Varusteet: ilmapallo, lääkäriruisku. Suorita koe ja vastaa kysymyksiin:
1. Täytä pallo. Mikä pallo täyttää ilman? Mikä on kaasun muoto?
2. Purista palloa käsin (muuta sen muotoa). Onko ilmatila säilynyt? Onko sen muoto säilynyt?
3. Täytä ruisku ilmalla vetämällä mäntä ulos. Sulje reikä sormella ja yritä purista se. Onko kaasua helppo puristaa?
Tehtävä 2: "Nesteiden ominaisuuksien tutkimus." Varustus: astia vedellä, dekantterilasi, 2-3 erimuotoista astiaa, lääketieteellinen ruisku. Suorita kokeilu ja vastaa kysymyksiin:
1. Mittaa nesteen tilavuus dekantterilasiin?
2. Kaada vettä erimuotoisiin astioihin? Mikä astian osa nestettä täyttää? Pitääkö neste muodonsa?
3. Mittaa nesteen määrä uudelleen. Onko sen määrä muuttunut?
4. Täytä ruisku vedellä. Sulje reikä sormella ja yritä purista se. Onko nesteen puristaminen helppoa?
Tehtävä 3: "Kiinteän aineen ominaisuuksien tutkimus." Laitteet: joukko kiintoaineita eri aineista (metalli, puu, muovi jne.) Suorita koe ja vastaa kysymyksiin: Onko kiinteillä aineilla oma muoto? 2. Säilyttävätkö he volyyminsa?
3. Yritä puristaa vartaloa kädelläsi. Onko sitä helppo puristaa?
Täytä taulukko tutkimustulosten perusteella
Ei ole muotoaEi säästä äänenvoimakkuutta
puristaa
Ei ole muotoa
Säästää äänenvoimakkuutta
Ei puristuva
neste
Tallentaa muodon
Säästää äänenvoimakkuutta
Ei puristuva
Molekyylin järjestely
Suuren etäisyyden päässä toisistaan, kaoottisesti
Tiiviisti pakattu eli lyhyen matkan päässä toisistaan
Määrällisesti, muodostaen kidehilan
Molekyylin liike
Liikkuu vapaasti koko äänenvoimakkuuden
Epäröi paikallaan, hyppää paikasta toiseen
Epäröi paikallaan, lähellä yhtä tasapainotilaa
Molekulaarinen vuorovaikutus
kehno
voimakas
Erittäin vahva
Mitä kiinteiden aineiden ominaisuuksia tiedät? Pidä muoto ja tilavuus
Mitä nesteiden ominaisuuksia tiedät? Pidä äänenvoimakkuutta, mutta muuta niiden muotoa helposti
Mitä kaasujen ominaisuuksia tiedät? Älä säilytä muotoa ja tilavuuttaKiinteiden aineiden ominaisuudet.
Mikä on ympärillämme olevien kehojen tila - työpöydät, kirjat, muistikirjat? (Kiinteä)
Mieti muutama kiintoaine.
Mikä muoto heillä on? (oikea, suuntaissärmiö, sylinteri)
Yritetään muuttaa niiden muotoa: purista tai venyttää. Onko tämä helppoa? (Nro)
Voimmeko määrittää kiinteiden aineiden määrän? Määritä ruudun tilavuus.
johtopäätös: Kiinteät aineet säilyttävät muodonsa ja tilavuutensa. (Tulosteiden kirjoittaminen taululle ja taulukkoon).
Nesteiden ominaisuudet.
Nyt määrittelemme nesteiden ominaisuudet. Voimme siirtää sen erilaisiin aluksiin. (Opettaja kaataa vettä erimuotoisiin astioihin, ensimmäistä ja viimeistä kertaa dekantterilasiin tilavuuden määrittämiseksi)
Mitä tapahtuu nestemäiselle muodolle? (hän muuttuu)
Missä muodossa neste otetaan joka kerta? (aluksen muoto)
Onko nesteen määrä muuttunut? (Ei)
johtopäätös: neste muuttaa helposti muotoaan, mutta säilyttää tilavuuden. (Tulosteiden kirjoittaminen taululle ja taulukkoon). Näitä nestemäisiä ominaisuuksia käytetään lasituotteiden valmistuksessa.
Kaasujen ominaisuudet.
Selvitä, mitä ominaisuuksia kaasuilla on. Koe kumipallo: sitoa pallo keskeltä langalla, puhalta toinen puoli ilmalla, katkaise sitten lanka. Ilma käyttää koko ilmapalloa.
Joten kaasut vievät koko annetun tilavuuden. Yritä nyt puristaa pallo. Onnistuimme helposti.
Mitä voimme sanoa kaasujen ominaisuuksista?
johtopäätös: Kaasu vie koko sille annetun tilavuuden ja on helposti puristettavissa. (Tallenna lähtö taulukkoon)
Kuinka nämä ominaisuudet selitetään? Loppujen lopuksi vesi, jää, vesihöyry ovat saman aineen tiloja, mikä tarkoittaa, että molekyylit eivät eroa toisistaan. Siksi meidän on selvitettävä, kuinka nämä molekyylit sijaitsevat ja miten ne liikkuvat.
Gazassa. Koska kaasut täyttävät koko annetun tilavuuden, niillä ei ole muotoa ja ne ovat helposti puristuvia, tulisi olettaa, että molekyylien välinen etäisyys on monta kertaa suurempi kuin itse molekyylit, niitä melkein ei houkutella ja ne liikkuvat vapaasti. Tämä todistetaan myös diffuusiolla, joka tapahtuu nopeammin kaasuissa kuin nesteissä ja kiinteissä aineissa. Mutta jos kaasut puristetaan voimakkaasti tai jäähdytetään, ne muuttuvat nestemäisiksi. (Tulosteiden kirjoittaminen taululle ja taulukkoon).
Neste. Nesteet eivät säilytä muotoaan, ne voivat virtata, ne ovat helposti ylivuotoisia. Mutta niiden puristaminen on vaikeaa. Tämä voidaan selittää vain sillä, että kaikille niiden välisille molekyyleille, jotka lähestyvät toisiaan, tapahtuu heijastus, koska molekyylit sijaitsevat lähellä toisiaan, etäisyys niiden välillä on verrattavissa molekyylien kokoon. He muuttavat paikkaa epäsäännöllisesti - "hyppää". (Tulosteiden kirjoittaminen taululle ja taulukkoon).
Kiintoaineita. Kiinteät aineet säilyttävät muodon ja tilavuuden. Tämä tarkoittaa, että molekyylit sijaitsevat etäisyyksillä, jotka ovat verrattavissa molekyylien kokoon. Molekyylit on järjestetty järjestyksessä muodostaen kiteisen hilan, kun taas ne värähtelevät tietyn pisteen ympäri. (Tulosteiden kirjoittaminen taululle ja taulukkoon).
Työskentele piirtämisen oppikirjan kanssa (28.6 s. 125).
4. Uuden aineiston yleistämisen ja yhdistämisen vaihe
Onko mahdollista täyttää astia kaasulla puolella tilavuudesta? Miksi?
Voivatko ne olla huoneenlämmössä nestemäisessä tilassa: happea?
Voivatko ne olla kaasumaisessa tilassa huoneenlämmössä: rauta?
Pakkasena talvipäivänä joen koiruohan yli muodostui sumu. Mikä on aineen tila?
Huoneessa, jossa valkaisuaine sijaitsee, sen haju tuntuu aina. Selitä, missä tilassa valkaisuainetta on?
5. Viimeinen vaihe
Mitä opimme kehon ominaisuuksista eri aggregaatiotiloissa?
Kuinka nämä ominaisuudet voidaan selittää ottaen huomioon aineen molekyylirakenne?
6. Heijastus
Oppitunnissa työskentelinaktiivinen / passiivinen
Työssäni oppitunnilla minä
tyytyväinen / ei tyytyväinen
Oppitunti näytti minulle
lyhyt / pitkä
Oppitunnille i
ei väsynyt / väsynyt
Minun mielialani
parani / paheni
Oppitunnin materiaali oli
ymmärrä / ei ymmärrä
hyödyllinen / hyödytön
mielenkiintoinen / tylsä
Mielestäni kotitehtäviä
helppo / vaikea
mielenkiintoinen / ei mielenkiintoinen
Vastauksissa korostetaan
D / s s 28,29, exp takana s. 127
VARAUSKysymykset:
Miksi kaasut eivät pidä tilavuutta ja puristuvat helposti? (Etäisyys molekyylien välillä on suuri, houkuttelevat voimat ovat heikkoja, joten molekyylit poistuvat helposti toisistaan \u200b\u200bja aivan yhtä helposti kootaan yhteen.
Miksi kaasuilla ei ole muotoa ja ne täyttävät koko annetun tilavuuden? (Syynä on molekyylien vapaa liikkuvuus ja niiden heikko vetovoima)
Miksi nesteet säilyttävät tilavuuden? (Molekyylien välinen vuorovaikutus on suurta, joten ne eivät pysty "repimään itsensä pois" toisistaan)
Miksi nesteet eivät ole muotoiltuja ja virtaavia? (Nestemäiset molekyylit ovat liikkuvia, ne kykenevät hyppäämään paikasta toiseen. Jos ulkoinen voima, kuten painovoima, vaikuttaa maan päälle, hiukkasten hyppy tapahtuu pääasiassa sen toiminnan suuntaan (ts. Alas).
Mikä selittää nesteiden puristamattomuuden? (Etäisyys molekyylien välillä on melko pieni. Kun lähestyt, heijastusvoimat kasvavat voimakkaasti, eivätkä anna molekyylien tulla yhteen)
Miksi kiinteät aineet säilyttävät muodonsa? (Syynä on molekyylien liikkeen luonne. Ne värähtelevät tasapainotilan ympärillä eivätkä pysty liikkumaan vapaasti)
Miksi kiinteät aineet säilyttävät tilavuutensa? (Kiinteän aineen molekyylien välinen vuorovaikutus on valtava, joten ne eivät voi repeytyä toisistaan)
Mikä selittää kiinteiden aineiden puristamattomuuden? (Molekyylien välinen etäisyys on pieni (verrannollinen molekyylien kokoon.) Lähestyessään repeävät voimat kasvavat voimakkaasti estäen molekyylejä lähestymästä).
