· -1
Boltzmannova konštanta ( k (\\ displaystyle k) alebo k B (\\ displaystyle k _ (\\ rm (B)))) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej táto konštanta hrá kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
k \u003d 1380 648 52 (79) × 10 - 23 (\\ displaystyle k \u003d 1 (,) 380 \\, 648 \\, 52 (79) \\ krát 10 ^ (- 23)) J /.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty.
Vzťah medzi teplotou a energiou[ | ]
V homogénnom ideálnom plyne pri absolútnej teplote T (\\ displaystyle T), energia priraditeľná každému stupňu slobody prekladu je rovnaká, ako vyplýva z Maxwellovej distribúcie, k T / 2 (\\ displaystyle kT / 2), Pri izbovej teplote (300) je táto energia 2, 07 × 10 - 21 (\\ displaystyle 2 (,) 07 \\ krát 10 ^ (- 21)) J alebo 0,013 eV. V ideálnom monatomickom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu v 3 2 k T (\\ displaystyle (\\ frac (3) (2)) kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú štvorcovú rýchlosť atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmoty. Rms rýchlosť pri izbovej teplote sa pohybuje od 1370 m / s pre hélium do 240 m / s pre xenón. V prípade molekulárneho plynu je situácia komplikovanejšia, napríklad kremelinový plyn má päť stupňov voľnosti (pri nízkych teplotách, keď nie sú excitované atómové vibrácie v molekule).
Definícia entropie[ | ]
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z (\\ displaystyle Z)zodpovedajúci danému makroskopickému stavu (napríklad stav s danou celkovou energiou).
S \u003d k ln \u2061 Z. (\\ displaystyle S \u003d k \\ ln Z.)Koeficient proporcionality k (\\ displaystyle k) a existuje Boltzmannova konštanta. Tento výraz definuje vzťah medzi mikroskopickými ( Z (\\ displaystyle Z)) a makroskopické stavy ( S (\\ displaystyle S)), predstavuje ústrednú myšlienku štatistickej mechaniky.
Základná rovnica teórie molekulárnej kinetiky Ideálny plyn má hlbší význam ako obvyklý vzorec na určenie ideálneho tlaku plynu. Aby sme to zistili, píšeme túto rovnicu p \u003d (1/3). n m 0v̅ 2 v trochu inej forme:
p \u003d (2/3). n. m 0v̅ 2/2 \u003d (2/3). nIE.
Podľa definíciem 0v̅ 2/2je priemerná kinetická energia translačného pohybu molekuly.
Tlak plynu je úmerný priemernej kinetickej energii translačného pohybu molekúl.
Ak vezmeme do úvahy, že n \u003d N /V \u003dN A /V mrovnice p \u003d (2/3). nIE bude vyzerať takto:
pV M \u003d (2/3). N A E̅.
Na druhej strane z rovnice stavu ideálneho plynu
pV M \u003d RT.
Porovnaním oboch týchto rovníc dostaneme:
(2 / 3) . N A E̅ \u003dRT.
E̅ \u003d (3/2). (R /N A) . T.
Z tohto vzťahu vyplýva dôležitý záver:
priemerná kinetická energia molekúl plynu je priamo úmerná jej absolútnej teplote.
Univerzálny konštantný pomer plynu R do konštantnej Avogadro N a existuje aj konštanta, ktorá sa nazýva boltzmannova konštanta k.
R /N A \u003dk - boltzova mana konštanta.
Fyzický význam boltzmannova konštanta spočíva v tom, že stanovuje pomer teploty vyjadrený v energii (J) a termodynamickej (K) jednotiek.
Boltzmannova konštanta je základná konštanta, ktorej hodnota sa určuje celkom presne:
k \u003d 1,38. 10 - 23 J/ K.
E̅ \u003d (3/2). kT.
Ak je tento výraz vo vzorci nahradený p \u003d (2/3). nIE, získame závislosť ideálneho tlaku plynu od teploty a koncentrácie jeho molekúl:
p \u003dnKT.
Tento vzťah je experimentálne potvrdený charlesov zákon, podľa ktorého je tlak danej hmotnosti plynu priamo úmerný absolútnej teplote: p ~T. Z toho tiež vyplýva, že
pri rovnakom tlaku a teplote je koncentrácia molekúl vo všetkých plynoch rovnaká.
Teplota ako makro-parameter systému teda charakterizuje stav svojej termodynamickej rovnováhy. Materiál zo stránky
Prístup telesnej teploty k absolútnej nule vedie k poklesu priemernej kinetickej energie molekúl. V absolútnej nule sa ich translačný pohyb zastaví. Moderná veda popiera možnosť dosiahnuť absolútne nulové teploty.
V závislosti od zvolenej stupnice sa teplota meria v stupňoch Celzia alebo Fahrenheita alebo v kelvinoch. Ako mikro-parameter systému určuje teplota priemernú kinetickú energiu významného počtu molekúl; ako miera sa meria v jouloch. Spojovací koeficient medzi týmito definíciami je boltzmannova konštanta.
Napriek tomu, že záver, že teplota súvisí s priemernou kinetickou energiou molekúl, je stanovený pre plyny, platí to aj pre kvapaliny a pevné látky.
Na tejto stránke materiál na témy:
Molekulárno-kinetická interpretácia fenoménu osmózy
Konštanty v molekulárnej kinetickej fyzike
Molekulárna kinetická interpretácia teploty vzorca
-
Boltzmannova konštanta ( k (\\ displaystyle k) alebo k B (\\ displaystyle k _ (\\ rm (B)))) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej táto konštanta hrá kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
k \u003d 1380 648 52 (79) × 10 - 23 (\\ displaystyle k \u003d 1 (,) 380 \\, 648 \\, 52 (79) \\ krát 10 ^ (- 23)) J /.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty.
Vzťah medzi teplotou a energiou
V homogénnom ideálnom plyne pri absolútnej teplote T (\\ displaystyle T), energia priraditeľná každému stupňu slobody prekladu je rovnaká, ako vyplýva z Maxwellovej distribúcie, k T / 2 (\\ displaystyle kT / 2), Pri izbovej teplote (300) je táto energia 2, 07 × 10 - 21 (\\ displaystyle 2 (,) 07 \\ krát 10 ^ (- 21)) J alebo 0,013 eV. V ideálnom monatomickom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu v 3 2 k T (\\ displaystyle (\\ frac (3) (2)) kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú štvorcovú rýchlosť atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmoty. Rms rýchlosť pri izbovej teplote sa pohybuje od 1370 m / s pre hélium do 240 m / s pre xenón. V prípade molekulárneho plynu je situácia komplikovanejšia, napríklad kremelinový plyn má päť stupňov voľnosti (pri nízkych teplotách, keď nie sú excitované atómové vibrácie v molekule).
Definícia entropie
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z (\\ displaystyle Z)zodpovedajúci danému makroskopickému stavu (napríklad stav s danou celkovou energiou).
S \u003d k ln \u2061 Z. (\\ displaystyle S \u003d k \\ ln Z.)Koeficient proporcionality k (\\ displaystyle k) a existuje Boltzmannova konštanta. Tento výraz definuje vzťah medzi mikroskopickými ( Z (\\ displaystyle Z), ktorá sa konala 17. - 21. októbra 2011, prijala uznesenie
Boltzmann Ludwig (1844-1906)- Veľký rakúsky fyzik, jeden zo zakladateľov molekulárno-kinetickej teórie. V Boltzmannovych dielach sa molekulárno-kinetická teória najskôr objavila ako logicky koherentná, konzistentná fyzikálna teória. Boltzmann dal štatistickú interpretáciu druhého termodynamického zákona. Urobil veľa pre rozvoj a popularizáciu teórie elektromagnetického poľa Maxwell. Boltzmann, zápasiaci od prírody, vášnivo bránil potrebu molekulárnej interpretácie tepelných javov a prevzal nápor boja s vedcami, ktorí popierali existenciu molekúl.
Rovnica (4.5.3) zahŕňa pomer univerzálnej plynovej konštanty R do konštantnej Avogadro N . Tento pomer je rovnaký pre všetky látky. Nazýva sa Boltzmannova konštanta, na počesť L. Boltzmanna, jedného zo zakladateľov molekulárno-kinetickej teórie.
Boltzmannova konštanta sa rovná:
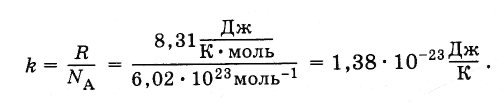 (4.5.4)
(4.5.4)Rovnica (4.5.3) berúc do úvahy Boltzmannovu konštantu sa píše takto:
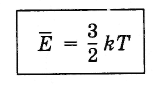 (4.5.5)
(4.5.5)Fyzikálny význam Boltzmannovej konštanty
Z historického hľadiska sa teplota najprv zaviedla ako termodynamická veličina a pre ňu sa stanovila merná jednotka - stupeň (pozri § 3.2). Po zistení vzťahu teploty s priemernou kinetickou energiou molekúl sa ukázalo, že teplotu možno definovať ako priemernú kinetickú energiu molekúl a vyjadrenú v jouloch alebo ergách, t. J. Namiesto Tzadajte hodnotu T *tak to
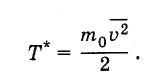
Takto určená teplota sa vzťahuje na teplotu vyjadrenú v stupňoch takto:
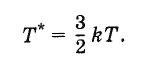
Boltzmannova konštanta sa preto môže považovať za hodnotu spájajúcu teplotu vyjadrenú v energetických jednotkách a teplotu vyjadrenú v stupňoch.
Závislosť tlaku plynu od koncentrácie jeho molekúl a teploty
vyjadrujúce Ez vzťahu (4.5.5) a substitúciou do vzorca (4.4.10) získame vyjadrenie, ktoré ukazuje závislosť tlaku plynu od koncentrácie molekúl a teploty:
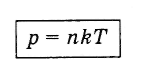 (4.5.6)
(4.5.6)Z vzorca (4.5.6) vyplýva, že pri rovnakých tlakoch a teplotách je koncentrácia molekúl pre všetky plyny rovnaká.
Odtiaľ nasleduje Avogadrov zákon: rovnaké objemy plynov pri rovnakých teplotách a tlakoch obsahujú rovnaký počet molekúl.
Priemerná kinetická energia translačného pohybu molekúl je priamo úmerná absolútnej teplote. Koeficient proporcionality- boltzmannova konštantak \u003d 10 - 23 J / K - treba pamätať.
§ 4.6. Maxwell distribúcia
Vo veľkom počte prípadov nestačí iba znalosť priemerných hodnôt fyzických veličín. Napríklad znalosť priemernej výšky ľudí neumožňuje plánovanie výroby odevov rôznych veľkostí. Musíte poznať približný počet ľudí, ktorých rast leží v určitom intervale. Podobne je dôležité poznať počet molekúl, ktoré majú iné rýchlosti, ako je priemer. Maxwell ako prvý zistil, ako je možné tieto čísla určiť.
Pravdepodobnosť náhodnej udalosti
V § 4.1 sme už spomínali, že pri popise správania veľkej skupiny molekúl predstavil J. Maxwell koncept pravdepodobnosti.
Ako bolo opakovane zdôrazňované, v zásade nie je možné sledovať zmenu rýchlosti (alebo hybnosti) jednej molekuly počas dlhého časového intervalu. Je tiež nemožné presne určiť rýchlosti všetkých molekúl plynu v danom čase. Z makroskopických podmienok, v ktorých sa plyn nachádza (určitý objem a teplota), sa určité hodnoty molekulových rýchlostí nevyžadujú nevyhnutne. Rýchlosť molekuly sa môže považovať za náhodnú premennú, ktorá môže pri rôznych makroskopických podmienkach nadobudnúť rôzne hodnoty, rovnako ako pri hádzaní kockami môže klesnúť akýkoľvek počet bodov od 1 do 6 (počet kostných plôch je šesť). Nie je možné predpovedať, koľko bodov klesne počas danej kocky. Pravdepodobnosť, že povedzme, päť bodov bude vynechaných, je však možné určiť.
Aká je pravdepodobnosť náhodnej udalosti? Nechajte vyrobiť veľmi veľké množstvo Ntest (N je počet kostí). Navyše v roku 2007 N" v prípadoch bol pozitívny výsledok testov (t. J. Strata piatich). Pravdepodobnosť tejto udalosti sa potom rovná pomeru počtu prípadov s priaznivým výsledkom k celkovému počtu pokusov za predpokladu, že tento počet je svojvoľne vysoký:
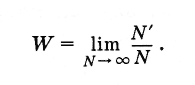 (4.6.1)
(4.6.1)V prípade symetrickej kosti je pravdepodobnosť ľubovoľného vybraného počtu bodov od 1 do 6 rovnaká.
Vidíme, že na pozadí mnohých náhodných udalostí je odhalená určitá kvantitatívna pravidelnosť, objavuje sa číslo. Toto číslo - pravdepodobnosť - umožňuje vypočítať priemery. Ak teda urobíte 300 roliek, priemerný počet piatich vypadnutých rastlín, ako vyplýva zo vzorca (4.6.1), bude: 300 · \u003d 50 a je úplne irelevantné valiť tú istú kosť 300 krát alebo 300 identických kostí súčasne. ,
Niet pochýb o tom, že správanie molekúl plynu v nádobe je oveľa komplikovanejšie ako pohyb opustených kockami. Ale tu je tiež možné dúfať, že nájdeme určité kvantitatívne pravidlá, ktoré umožňujú vypočítať štatistické priemery, ak je úloha nastavená rovnakým spôsobom ako v teórii hry, a nie ako v klasickej mechanike. Je potrebné opustiť nerozpustný problém stanovenia presnej hodnoty rýchlosti molekuly v danom okamihu a pokúsiť sa nájsť pravdepodobnosť, že rýchlosť má určitú hodnotu.
Boltzmannova konštanta ( k (\\ displaystyle k) alebo k B (\\ displaystyle k _ (\\ rm (B)))) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej táto konštanta hrá kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
k \u003d 1380 648 8 (13) × 10 - 23 (\\ displaystyle k \u003d 1 (,) 380 \\, 648 \\, 8 (13) \\ krát 10 ^ (- 23)) J /.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty. V prirodzenom systéme Planckových jednotiek sa prírodná jednotka teploty nastaví tak, aby Boltzmannova konštanta bola rovná jednote.
Encyklopedická služba YouTube
1 / 3
Tepelné žiarenie. Stefan-Boltzmann zákon
Fyzika. MKT: Mendeleev-Clapeyronova rovnica pre ideálny plyn. Foxford Online Learning Center
Viedenský zákon o vysídlení
titulky
Vzťah medzi teplotou a energiou
V homogénnom ideálnom plyne pri absolútnej teplote T (\\ displaystyle T), energia priraditeľná každému stupňu slobody prekladu je rovnaká, ako vyplýva z Maxwellovej distribúcie, k T / 2 (\\ displaystyle kT / 2), Pri izbovej teplote (300) je táto energia 2, 07 × 10 - 21 (\\ displaystyle 2 (,) 07 \\ krát 10 ^ (- 21)) J alebo 0,013 eV. V ideálnom monatomickom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu v 3 2 k T (\\ displaystyle (\\ frac (3) (2)) kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú štvorcovú rýchlosť atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmoty. Rms rýchlosť pri izbovej teplote sa pohybuje od 1370 m / s pre S \u003d k ln \u2061 Z. (\\ displaystyle S \u003d k \\ ln Z.)
Koeficient proporcionality k (\\ displaystyle k) a existuje Boltzmannova konštanta. Tento výraz definuje vzťah medzi mikroskopickými ( Z (\\ displaystyle Z)) a makroskopické stavy ( S (\\ displaystyle S). Táto údajná fixácia je spojená s túžbou predefinovať jednotku termodynamickej teploty kelvin, spojiť jej hodnotu s hodnotou Boltzmannovej konštanty.
