В тази статия ще научите за 10-те най-ежедневни химически реакции в живота!
Реакция № 1 - Фотосинтеза
Растенията използват химическа реакция. фотосинтезада превръща въглеродния диоксид във вода, храна и кислород. фотосинтеза - една от най-често срещаните и важни химични реакции в живота. Само чрез фотосинтеза растенията произвеждат храна за себе си и животните, превръща ли въглеродния диоксид в кислород. 6 CO2 + 6 H2O + светлина → C6H12O6 + 6 O2
 Реакция № 2 - Аеробно клетъчно дишане
Реакция № 2 - Аеробно клетъчно дишане
Аеробно клетъчно дишане - Това е обратният процес на фотосинтеза, тъй като енергията на молекулите в комбинация с кислорода, който дишаме, за да се освободи енергията, необходима на нашите клетки, плюс въглероден диоксид и вода. Енергията, използвана от клетките, е химическа реакция във формат ATP.
Общото уравнение за аеробно клетъчно дишане: C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + енергия (36 ATP)
Реакция № 3 - анаеробно дишане
За разлика от аеробното клетъчно дишане, анаеробно дишане описва набор от химични реакции, които позволяват на клетките да получават енергия от сложни молекули без кислород. Вашите клетки в мускулите извършват анаеробно дишане, когато ви изтече кислород, доставен от тях, например, по време на интензивни или продължителни упражнения. Анаеробното дишане на дрожди и бактерии се използва за ферментация, производство на етанол, въглероден диоксид и други химикали, които произвеждат сирене, вино, бира, хляб и много други хранителни продукти.
Общо химично уравнение за анаеробно дишане: C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + енергия
Реакция № 4 - изгаряне
Всеки път, когато запалите кибрит, запалите свещ, запалите огън или запалите скара, виждате реакция на изгаряне. Реакция на горене комбинира енергийни молекули с кислород за образуване на въглероден диоксид и вода.
Например реакцията на изгаряне на пропан, открита в газови решетки и някои камини, е: C3H8 + 5O2 → 4H20 + 3CO2 + енергия
 Реакция № 5 - ръжда
Реакция № 5 - ръжда
С течение на времето желязото се зачервява, наречен бутер покрив ръжда, Това е пример за реакция на окисляване. Други предмети от домакинството включват формирането на медна глава.
Химическото уравнение на ръжданото желязо: Fe + O 2 + H 2 O → Fe 2 O 3. XH20
 Реакция № 6 - Смесване на химикали
Реакция № 6 - Смесване на химикали
Ако смесите оцет с сода за хляб или мляко с бакпулвер в рецептата, ще видите как ще протече обменът на реакции. Съставките се рекомбинират, за да образуват въглероден диоксид и вода. Въглероден диоксид образува мехурчета и спомага печенето.
На практика тази реакция е доста проста, но често се състои от няколко етапа. Ето генерала химично уравнение за реакцията на сода с оцет: HC 2 H 3 O 2 (aq) + NaHCO 3 (aq) → NaC 2 H 3 O 2 (aq) + H 2 O () + CO 2 (g)
 Реакция № 7 - батерия
Реакция № 7 - батерия
Електрохимични или редокс-реакции батерия използва се за преобразуване на химическа енергия в електрическа. Спонтанни редокс реакции се появяват в галванични клетки, докато спонтанни редокс реакции се появяват в електролизаторите.

Реакция № 8 - храносмилане
В процеса възникват хиляди химически реакции. стомашно разстройство, След като поставите храна в устата си, ензим в слюнката си, амилазазапочва да разгражда захарта и други въглеводороди в по-прости форми, за да можете да абсорбирате храната. Солна киселина в стомаха, той реагира с храната, за да го разгради, докато ензимите разграждат протеини и мазнини, така че да преминат през кръвта през чревните стени.
 Реакция № 9 - киселинно-алкална
Реакция № 9 - киселинно-алкална
Всеки път, когато комбинирате киселини с основа, изпълнявате киселинно-алкална реакция, Това е реакцията на неутрализиране на киселината и основата до образуване на сол и вода.
Химическо уравнение за киселинно-алкална реакциякойто произвежда калиев хлорид: HCl + KOH → KCl + H20
 Реакция № 10 - Сапун и перилни препарати
Реакция № 10 - Сапун и перилни препарати
Сапуните и почистващите препарати се получават чрез чисти химически реакции. сапун превръща мръсотията в емулсия, което означава, че петна от масло са свързани със сапун, така че да могат да бъдат отстранени с вода. перилни препарати действат като повърхностно активни вещества, намалявайки повърхностното напрежение на водата, така че те да взаимодействат с масла, да ги изолират и изплакнат.
12. ФИЗИЧНИ И ХИМИЧНИ ФЕНОМЕНИ.
УРАВНЕНИЯ НА ХИМИЧНИТЕ РЕАКЦИИ.
От курса по природни науки и физика знаете, че с телата и веществата има промени, които се делят на физични и химични
Всяка химическа реакция е придружена от външни признаци, по които преценяваме нейния ход. Това е:
1. Поява на утайка.
2.Промяна на цвета
3. Еволюцията на газа.
4. Поглъщане или отделяне на топлина.
За да възникне химическа реакция, са необходими няколко условия. Първият е контакт на реагиращи вещества; второто е смилането на веществата (най-голямо смилане се постига чрез разтваряне на веществата); трето, за да се появят много реакции, е необходимо реагиращите вещества да се нагряват до определена температура.
Химичните реакции могат да бъдат изразени писмено, като се използват уравненията на химичните реакции, които често се наричат \u200b\u200bхимични уравнения. Какво е това?
Химическото уравнение е условен запис на химическа реакция, използвайки химични формули и коефициенти.
При съставянето на уравненията на реакциите е необходимо да се използва законът за запазване на масата на веществата, открити от M.V. Ломоносов и А. Лавоазие. Масата на веществата, влезли в реакция, е равна на масата на веществата, получени от нея. Но знаете, че веществата са съставени от атоми, така че при съставянето на химични уравнения ще използваме правилото: броят на атомите на всеки химичен елемент от изходните материали трябва да е равен на броя на атомите в продуктите на реакцията.Алгоритъм за съставяне на уравнения на реакцията.
Помислете алгоритъма за съставяне на химични уравнения, като използвате примера за взаимодействието на прости вещества: метали и неметали помежду си. Нека взаимодействат фосфор и кислород (реакция на горене).
1. Напишете тези вещества един до друг, поставете знак "+" между тях (тук ще вземем предвид, че кислородът е диатомична молекула) и след тях стрелката е като знак за равенство.
P + O 2
2. Записваме формулата на реакционния продукт след стрелката:
P + O 2 P 2 O 5
3. От диаграмата се вижда, че отляво има кислород-2 атома, отдясно-5, и в съответствие със закона за запазване на масата на веществата броят на атомите на даден химичен елемент трябва да е еднакъв. За да изравним техния брой, намираме най-малкото общо число. За 2 и 5 това ще бъде числото 10. Разделете най-малкото общо кратно по броя на атомите във формулите. 10: 2 \u003d 5, 10: 5 \u003d 2, това ще бъдат коефициентите, поставени преди кислород O2 и фосфорен оксид (V) P 2 O 5, съответно.
P + 5O 2 2P 2 O 5
кислород вляво и вдясно стана 10 (5 · 2 \u003d 10, 2 · 5 \u003d 10)4. Коефициентът се отнася до цялата формула и се поставя пред нея. След като го зададете вдясно, фосфорът стана 2 · 2 \u003d 4 атома. А отляво е 1 (коефициент 1 не е зададен) .Така поставяме коефициент 4 пред фосфора.
4P + 5O 2 2P 2 O 5
Това е окончателният запис на химичното уравнение.
Той гласи: четири ne плюс пет о-две е равно на две не-две о-пет.
физически те наричат \u200b\u200bтакива явления, при които няма трансформация на някои вещества в други, но техните агрегатни състояния, форма и размер на телата се променят.
примери: топене на лед, изтегляне на тел, трошене на гранит, изпаряване на водата.
химически наречете такива явления, при които има трансформация на едни вещества в други.
примери: изгаряне на дърва, почерняване на мед, ръжда на желязо.
В бъдеще ще наречем химичните явления химически реакции.
Признаци на химическа реакция, Те могат да се използват за преценка дали е преминала или не химическа реакция между реагентите. Тези признаци обикновено се приписват на следното:
· Промяна на цвета: CuSO4 (циан) \u003d Cu 2+ + SO4 2-
· Валежи: CO 2 + Ca (OH) 2 CaCO 3 + H20
· Еволюция на газ: CaCO3 + HCl CaCl2 + CO 2 + H20
· Образуването на слабо отделени вещества: 2NaOH + H2S04 \u003d Na2S04 + 2H20
· Освобождаване на енергия (топлинна или светлина): 2H2 (g) + 0 (g) \u003d 2H2O (g) + 572 kJ
1. Тесен контакт на реагиращите вещества (необходимо): H 2 SO 4 + Zn \u003d ZnSO 4 + H 2 2. Загряване (евентуално) a) за стартиране на реакцията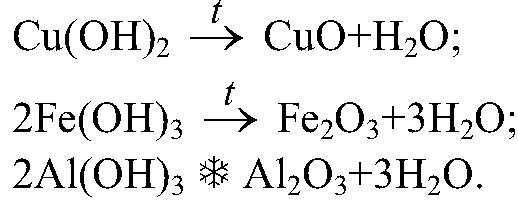 б) постоянно Класификация на химичните реакции според различни критерии 1.При наличието на фазова граница всички химически реакции се разделят на хомогенен и хетерогенен Извиква се химична реакция, възникнала в рамките на една фаза хомогенна химична реакция, Нарича се химична реакция, възникнала на границата на фазата хетерогенна химична реакция, При многоетапна химическа реакция някои етапи могат да бъдат хомогенни, докато други могат да бъдат хетерогенни. Подобни реакции се наричат хомогенна хетерогенна , В зависимост от броя на фазите, които образуват изходните материали и продуктите на реакцията, химичните процеси могат да бъдат хомофазни (изходните материали и продуктите са в една и съща фаза) и хетерофазни (изходните материали и продуктите образуват няколко фази). Хомо- и хетерофазността на реакцията не е свързана с това дали реакцията е хомо- или хетерогенна. Следователно могат да бъдат разграничени четири типа процеси: Хомогенни реакции (хомофазни), В реакции от този тип, реакционната смес е хомогенна, а реагентите и продуктите принадлежат към една и съща фаза. Пример за такива реакции са йонообменните реакции, например неутрализиране на киселинен разтвор с алкален разтвор: Хетерогенни хомофазни реакции, Компонентите са в една и съща фаза, но реакцията протича във фазовата граница, например, на повърхността на катализатора. Пример може да бъде хидрирането на етилен върху никелов катализатор: Хомогенни хетерофазни реакции, Реагентите и продуктите в такава реакция съществуват в рамките на няколко фази, но реакцията протича в една фаза. По този начин може да се извърши окисляването на въглеводородите в течна фаза с газообразен кислород. Хетерогенни хетерофазни реакции, В този случай реагентите са в различно фазово състояние, реакционните продукти също могат да бъдат във всяко фазово състояние. Реакционният процес протича на фазовата граница. Пример е реакцията на соли на въглеродна киселина (карбонати) с Бронстед киселини: 2. Чрез промяна на степента на окисляване на реагентите [редактиране | редактиране на wiki текст] В този случай има реакции на Redox, при които атомите на един елемент (окислител) се възстановяват
, тоест те намаляват окислителното си състояние и атомите на друг елемент (редуциращ агент) окислява
, т. е. увеличаване на окислителното им състояние. Специфичен случай на окислително-възстановителни реакции е реакцията на диспропорционалност, при която окислителят и редуциращият агент са атоми на един и същи елемент, които са в различни степени на окисление. Пример за окислително-възстановителна реакция е изгарянето на водород (редуциращ агент) в кислород (окислител), за да се образува вода: Пример за реакция на непропорционалност е реакция на разлагане на амониев нитрат при нагряване. В този случай окислителят е азотна (+5) нитрогрупа, а редуциращият агент е азот (-3) от амониевия катион: Не се прилага при окислително-редукционни реакции, при които няма промяна в степента на окисляване на атомите, например: 3. От термичния ефект на реакцията реакциите са придружени от освобождаване или усвояване на енергия. Когато химическите връзки се разрушат в реактивите, се отделя енергия, която главно отива към образуването на нови химически връзки. В някои реакции енергиите на тези процеси са близки и в този случай общият топлинен ефект на реакцията се доближава до нула. В други случаи можем да различим: екзотермични реакции, които протичат с отделянето на топлина (положителен термичен ефект) СН 4 + 2О 2 \u003d СО 2 + 2Н 2 О + енергия (светлина, топлина); CaO + H20 \u003d Ca (OH) 2 + енергия (топлина). ендотермични реакции, по време на които топлината се поглъща (отрицателен топлинен ефект) от околната среда. Ca (OH) 2 + енергия (топлина) \u003d CaO + H 2 O Термичният ефект на реакцията (реакционна енталпия, Δ r H), който често е много важен, може да се изчисли съгласно закона на Хес, ако са известни енталпиите на образуване на реагенти и продукти. Когато сумата на енталпиите на продуктите е по-малка от сумата на енталпиите на реагентите (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) - усвояване. 4. По вида на трансформацията на реагиращите частици [редактиране | редактиране на текст на уики] съединения: разлагания: замествания: обмен (включително вида на реакцията - неутрализация): Химическите реакции винаги са придружени от физически ефекти: абсорбция или освобождаване на енергия, промяна на цвета на реакционната смес и др. Тези физически ефекти често се преценяват за хода на химичните реакции. Съединение реакция-химична реакция, в резултат на която два или повече изходни вещества образуват само един нов.И двете прости и сложни вещества могат да влязат в такива реакции. Реакция на разлагане-химична реакция, в резултат на която от едно вещество се образуват няколко нови вещества. Само сложни съединения влизат в реакции от този тип и двете сложни и прости вещества могат да бъдат техни продукти. Реакция на заместване-химична реакция, в резултат на която атомите на един елемент, които са част от обикновено вещество, заместват атомите на друг елемент в сложното му съединение. Както следва от определението, при такива реакции един от изходните материали трябва да е прост, а другият сложен. Обменни реакции- реакция, в резултат на която две сложни вещества обменят съставните си части 5. Според посоката на потока химичните реакции се разделят на необратим и обратим необратимо
б) постоянно Класификация на химичните реакции според различни критерии 1.При наличието на фазова граница всички химически реакции се разделят на хомогенен и хетерогенен Извиква се химична реакция, възникнала в рамките на една фаза хомогенна химична реакция, Нарича се химична реакция, възникнала на границата на фазата хетерогенна химична реакция, При многоетапна химическа реакция някои етапи могат да бъдат хомогенни, докато други могат да бъдат хетерогенни. Подобни реакции се наричат хомогенна хетерогенна , В зависимост от броя на фазите, които образуват изходните материали и продуктите на реакцията, химичните процеси могат да бъдат хомофазни (изходните материали и продуктите са в една и съща фаза) и хетерофазни (изходните материали и продуктите образуват няколко фази). Хомо- и хетерофазността на реакцията не е свързана с това дали реакцията е хомо- или хетерогенна. Следователно могат да бъдат разграничени четири типа процеси: Хомогенни реакции (хомофазни), В реакции от този тип, реакционната смес е хомогенна, а реагентите и продуктите принадлежат към една и съща фаза. Пример за такива реакции са йонообменните реакции, например неутрализиране на киселинен разтвор с алкален разтвор: Хетерогенни хомофазни реакции, Компонентите са в една и съща фаза, но реакцията протича във фазовата граница, например, на повърхността на катализатора. Пример може да бъде хидрирането на етилен върху никелов катализатор: Хомогенни хетерофазни реакции, Реагентите и продуктите в такава реакция съществуват в рамките на няколко фази, но реакцията протича в една фаза. По този начин може да се извърши окисляването на въглеводородите в течна фаза с газообразен кислород. Хетерогенни хетерофазни реакции, В този случай реагентите са в различно фазово състояние, реакционните продукти също могат да бъдат във всяко фазово състояние. Реакционният процес протича на фазовата граница. Пример е реакцията на соли на въглеродна киселина (карбонати) с Бронстед киселини: 2. Чрез промяна на степента на окисляване на реагентите [редактиране | редактиране на wiki текст] В този случай има реакции на Redox, при които атомите на един елемент (окислител) се възстановяват
, тоест те намаляват окислителното си състояние и атомите на друг елемент (редуциращ агент) окислява
, т. е. увеличаване на окислителното им състояние. Специфичен случай на окислително-възстановителни реакции е реакцията на диспропорционалност, при която окислителят и редуциращият агент са атоми на един и същи елемент, които са в различни степени на окисление. Пример за окислително-възстановителна реакция е изгарянето на водород (редуциращ агент) в кислород (окислител), за да се образува вода: Пример за реакция на непропорционалност е реакция на разлагане на амониев нитрат при нагряване. В този случай окислителят е азотна (+5) нитрогрупа, а редуциращият агент е азот (-3) от амониевия катион: Не се прилага при окислително-редукционни реакции, при които няма промяна в степента на окисляване на атомите, например: 3. От термичния ефект на реакцията реакциите са придружени от освобождаване или усвояване на енергия. Когато химическите връзки се разрушат в реактивите, се отделя енергия, която главно отива към образуването на нови химически връзки. В някои реакции енергиите на тези процеси са близки и в този случай общият топлинен ефект на реакцията се доближава до нула. В други случаи можем да различим: екзотермични реакции, които протичат с отделянето на топлина (положителен термичен ефект) СН 4 + 2О 2 \u003d СО 2 + 2Н 2 О + енергия (светлина, топлина); CaO + H20 \u003d Ca (OH) 2 + енергия (топлина). ендотермични реакции, по време на които топлината се поглъща (отрицателен топлинен ефект) от околната среда. Ca (OH) 2 + енергия (топлина) \u003d CaO + H 2 O Термичният ефект на реакцията (реакционна енталпия, Δ r H), който често е много важен, може да се изчисли съгласно закона на Хес, ако са известни енталпиите на образуване на реагенти и продукти. Когато сумата на енталпиите на продуктите е по-малка от сумата на енталпиите на реагентите (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) - усвояване. 4. По вида на трансформацията на реагиращите частици [редактиране | редактиране на текст на уики] съединения: разлагания: замествания: обмен (включително вида на реакцията - неутрализация): Химическите реакции винаги са придружени от физически ефекти: абсорбция или освобождаване на енергия, промяна на цвета на реакционната смес и др. Тези физически ефекти често се преценяват за хода на химичните реакции. Съединение реакция-химична реакция, в резултат на която два или повече изходни вещества образуват само един нов.И двете прости и сложни вещества могат да влязат в такива реакции. Реакция на разлагане-химична реакция, в резултат на която от едно вещество се образуват няколко нови вещества. Само сложни съединения влизат в реакции от този тип и двете сложни и прости вещества могат да бъдат техни продукти. Реакция на заместване-химична реакция, в резултат на която атомите на един елемент, които са част от обикновено вещество, заместват атомите на друг елемент в сложното му съединение. Както следва от определението, при такива реакции един от изходните материали трябва да е прост, а другият сложен. Обменни реакции- реакция, в резултат на която две сложни вещества обменят съставните си части 5. Според посоката на потока химичните реакции се разделят на необратим и обратим необратимо 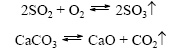 химични реакции, които протичат само в една посока (" отляво надясно"), в резултат на което изходните материали се превръщат в продукти на реакцията. Те казват за такива химични процеси, че те протичат" до края ". реакции на горенесъщо реакции, придружени от образуването на слабо разтворими или газообразни вещества обратим
химични реакции, които протичат само в една посока (" отляво надясно"), в резултат на което изходните материали се превръщат в продукти на реакцията. Те казват за такива химични процеси, че те протичат" до края ". реакции на горенесъщо реакции, придружени от образуването на слабо разтворими или газообразни вещества обратим 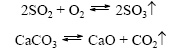 Назовават се химични реакции, които протичат едновременно в две противоположни посоки („отляво надясно“ и „отдясно наляво“). В уравненията на такива реакции знакът на равенството се заменя с две противоположно насочени стрелки. Между две едновременно протичащи реакции, директен (тече „отляво надясно“) и обратното(постъпва от „отдясно наляво“). Тъй като по време на обратима реакция, изходните материали се консумират и образуват едновременно, те не се превръщат напълно в продукти на реакцията. Затова се казва, че обратимите реакции не продължават до края. Резултатът винаги е смес от изходни материали и продукти от реакцията. 6. Въз основа на участието на катализаторите химичните реакции се разделят на каталитичен и некаталитична Каталитичен 2SO 2 + O 2 → 2SO 3 (V 2 O 5 катализатор) се определя като реакции, протичащи в присъствието на катализатори.В уравненията на такива реакции химическата формула на катализатора е обозначена с равен или обратим знак, понякога заедно със състояние на потока. Реакциите от този тип включват много реакции на разлагане и съединения. Некаталитичен 2NO + O2 \u003d 2NO2 се отнася до много реакции, които протичат в отсъствие на катализатори, като например реакции на обмен и заместване.
Назовават се химични реакции, които протичат едновременно в две противоположни посоки („отляво надясно“ и „отдясно наляво“). В уравненията на такива реакции знакът на равенството се заменя с две противоположно насочени стрелки. Между две едновременно протичащи реакции, директен (тече „отляво надясно“) и обратното(постъпва от „отдясно наляво“). Тъй като по време на обратима реакция, изходните материали се консумират и образуват едновременно, те не се превръщат напълно в продукти на реакцията. Затова се казва, че обратимите реакции не продължават до края. Резултатът винаги е смес от изходни материали и продукти от реакцията. 6. Въз основа на участието на катализаторите химичните реакции се разделят на каталитичен и некаталитична Каталитичен 2SO 2 + O 2 → 2SO 3 (V 2 O 5 катализатор) се определя като реакции, протичащи в присъствието на катализатори.В уравненията на такива реакции химическата формула на катализатора е обозначена с равен или обратим знак, понякога заедно със състояние на потока. Реакциите от този тип включват много реакции на разлагане и съединения. Некаталитичен 2NO + O2 \u003d 2NO2 се отнася до много реакции, които протичат в отсъствие на катализатори, като например реакции на обмен и заместване. 3 Въпрос 3
Развитието на идеи за структурата на материята:
Химични реакции в нашето ежедневие Участници в проекта: 1. Савостянова Евгения Константиновна 9 клас 2. Задорина Елизавета Вадимовна 8 клас 3. Ермаков Павел Игоревич 9 клас 4. Дмитриев Иля Алексеевич 9 клас 5. Катасонов Никита Сергеевич 9 клас Ръководител: Лазарева Елена Александровна 2014 г. година Общинска бюджетна образователна институция "Средно училище 17"
Уместността на избраната тема В наши дни са известни милиони различни вещества. Много от тях се използват не само в промишлеността и селското стопанство, но и в ежедневието. За съжаление не всички хора имат основни химични познания за веществата и техните трансформации. Вярваме, че дори от училище е необходимо да се насажда химическа грамотност. Затова темата „Химическите реакции в нашето ежедневие“ ще бъде актуална.


Изгарянето на природен газ Русия е лидер по запаси и производство на природен газ. Следователно в нашите домове използваме реакцията на горене на природен газ, за \u200b\u200bда произвеждаме топлинна енергия. Природният газ е смес от газове, образувани в недрата на Земята по време на анаеробно разлагане на органични вещества. Химичен състав: етан (C2H6), пропан (C3H8) бутан (C4H10). Както и други невъглеводородни вещества: водород (H2), сероводород (H2S), въглероден диоксид (CO 2), азот (N2), хелий (He). Основната част от природния газ е метан (СН 4) от 92 до 98%. Това е безцветен, лек, запалим газ, без мирис, почти неразтворим във вода. Смес от метан във въздуха е експлозивна. Реакция на изгаряне на метан CH 4 + 2O 2 \u003d CO 2 + 2H 2 O + Q. Метанът гори със синкав или почти безцветен пламък, отделяйки голямо количество топлина (879 kJ / mol). Когато използвате газово оборудване в къща, е необходимо: да проверите комина, да проветрите стаята, да следите състоянието на газопроводите и да не оставяте работещо газово оборудване без надзор.

Изгаряне на мачове С голям избор от различни запалки, мачовете са много популярни. Какви процеси възникват по време на запалването на клечка? Тук я удариха по кутиите. Имаше пламък и остра миризма на „сяра“. Процесът започна под действието на триенето. Първо, червеният фосфор се запали, който се намираше на кибритена кутия 4Р + 5О 2 \u003d 2Р 2 О 5 Фосфор, който дава силно триене по време на триене, подпали смес от сярна и Бертолитова сол в кибритна глава S + O 2 \u003d SO 2 (SO 2 - серен диоксид, източник на остра миризма). Главата подпали дърва С 6 Н 10 О 5 + 6О 2 \u003d 6СО 2 + 5Н 2 О Почти всички горивни продукти са вредни за организма. Само когато един кибрит е изгорен, се освобождава незначително количество от тях, което няма съществен ефект върху човек. Но когато използва кибрити, химически образованият човек трябва да помни, че „МАТЧИТЕ НЕ СА НАТУРА!“

Хидролиза на сапуна В производството и ежедневието сапунът е наименованието за технически смеси от водоразтворими соли на по-високи мастни киселини, често с добавяне на някои други вещества, които имат детергент. Основата на смесите обикновено е съставена от натриеви (по-рядко калиеви и амониеви) соли на наситени и ненаситени мастни киселини с броя на въглеродните атоми в молекулата от 12 до 18 (стеаринова, палмитинова, миристинова, лауринова и олеинова). Сапуните често включват също соли на нафтенови и смолни киселини, а понякога и други съединения с детергент в разтвори. Сапуните са образувани от силна основа и слаба киселина, поради което те лесно се хидролизират: C 17 H 35 COONa + H 2 O \u003d C 17 H 35 COOH + NaOH Алкалната среда за хидролиза, следователно, сапуните са доста агресивни към кожата и честото им използване обезмаслява , Има много разновидности и марки сапун и преди да изберете най-подходящия, трябва да определите типа на кожата си. Мазната кожа блести често поради силна пот и мазно отделяне, обикновено големи пори върху нея. 2 часа след измиване, мазна кожа петна върху салфетка, нанесена върху лицето. Такава кожа изисква сапун с мек дрениращ ефект. Сухата кожа е тънка и много чувствителна към вятъра и времето, а порите й са малки и тънки; тя се напуква лесно, тъй като не е достатъчно гъвкава. Такава кожа трябва да създаде максимален комфорт и нежно третиране, по-добре е да използвате скъпи сортове сапун. Нормалната кожа е мека, гладка, има пори със среден размер.

Водороден пероксид Водородният пероксид е най-простият представител на пероксидите. Безцветна течност с „метален“ вкус, безкрайно разтворима във вода, алкохол и етер. Егото често се използва в ежедневието като белина и антисептик. Когато водородният пероксид се разлага (когато лекуваме рана), се отделя вода и газообразен кислород. 2Н 2 О 2 \u003d О 2 + 2Н 2 О При не големи дози се отделя съответно малко количество кислород. В малък обем чистият кислород не е опасен, но в голям обем? А с голямо количество чистият кислород е токсичен и може да причини белодробна форма на отравяне с кислород и вреден ефект върху централната нервна система. Първата експозиция е придружена от такива симптоми: дразнене на белодробната тъкан. Тя може да започне с леко дразнене на фаринкса и последваща кашлица. В тежки случаи може да се появи продължително парене в гърдите и неконтролирана кашлица. Белодробното кислородно отравяне също може да доведе до намаляване на белодробния капацитет и капацитета за обмен на газ, въпреки че тези усложнения са изключително редки. Симптомите на втория ефект (токсично увреждане на централната нервна система) включват: зрително увреждане (зрение на тунела, невъзможност за фокусиране), нарушение на слуха (звънене в ушите, поява на външни звуци), гадене, конвулсивни контракции (особено на лицевите мускули), повишена чувствителност към външни дразнители и замаяност , Но всичко това е възможно само при използване на големи обеми водороден пероксид, а обичайният 3% пероксид е неспособен за това.

Сода за гасене с оцет Процесът на гасене на сода с оцет се използва при смесване на тесто за кифлички и палачинки. Содата за хляб, когато е изложена на висока температура или кисела среда, дава засилена реакция за отделяне на въглероден диоксид, което от своя страна води до разкош и порьозност. CH 3 COOH + NaHCO 3 \u003d CH 3 COONa + H 2 O + CO 2 Въпросът „гаси или не гаси сода с оцет по време на печене“ е толкова вечен, колкото и въпросът: „какво се е случило преди - пиле или яйце“. Въпреки това, задълбавайки се в литературата, като си отдъхнах от куп сайтове, включително и чужди, стигнах до извода, че голяма част от рецептите на древната руска кухня не намериха нито една, която да споменава сода поради силата на години. Печенето в нашата страна беше предимно мая или без да се добавят никакви ускорители за повдигане и разхлабване. И така, содата за хляб е изобретена от френския химик ЛеБлан в края на 18 век. Това изобретение дойде в Русия много по-късно, след като получи нов метод за неговото производство. Щом руските домакини имаха продукт като сода, те започнаха да го използват и готвят. Защо беше решено да се гасят сода? Да, просто защото нашата традиция е всичко „с топлина, с топлина” в този случай - това е само вредно. Содата за бързо изпичане при горещо печене има много неприятен „сапунен“ вкус. Това, което беше „коригирано“ чрез неговото гасене, а именно чрез добавяне на вряща вода към содата или ферментиралите млечни продукти. За палачинките този метод сега дава много добри резултати. Можете ли обаче да си представите какво ще се случи с сладкиша с къс сос, ако изсипете чаша вряла вода там? Отговорът е очевиден. Затова се е замислило да се замени вряла вода или млечни продукти с разреден 9% оцет или лимонов сок.

Заключение Можем да наблюдаваме много химични реакции не само в часовете по химия, но и в ежедневието. Тези реакции са не само безопасни (при спазване на правилата за безопасност), но някои от тях са безполезни. Например: гасене сода с оцет, всеки опитен готвач би казал, че това е загуба на време. Но без реакции като хидролиза и изгаряне, ние просто нямаме представа за по-нататъшно съществуване. По време на тези химични реакции се отделят газове. Те са безопасни (в определено количество). Когато използвате химикали в ежедневието, е необходимо спазването на правилата за безопасност.

Източници на информация 1. Kritsman, VA, Stanzo, VV Енциклопедичен речник на младия химик [Текст] -М. : Педагогика, Лаврова, С.А. Развлекателна химия [Текст] -М. : White City, Ryumin, V. Развлекателна химия [Текст] -М .: Център Полиграф, Курдюмов, Г. М. Въпрос по химия [Текст] -М. : World, Binom, Guzey, L.S., Kuznetsov, V.N. Нов справочник по химия [Текст] -М. : Ursa Major, Wikipedia [Електронен ресурс] - Режим на достъп: ru.wikipedia.org 7. Egorova, A.S. Учител по химия [Текст] -М. : Феникс, Химия и живот [Електронен ресурс] - Режим на достъп: http: //www.hij.ru 9. Химия около нас [Електронен ресурс] - Режим на достъп:

