Tässä artikkelissa opit kymmenestä jokapäiväisimmästä kemialliset reaktiot elämässä!
Reaktio nro 1 - fotosynteesi
Kasvit käyttävät kemiallista reaktiota. fotosynteesihiilidioksidin muuttamiseksi vedeksi, ruokaa ja happea. fotosynteesi - yksi yleisimmistä ja tärkeimmistä kemiallisista reaktioista elämässä. Kasvit tuottavat ruokaa itselleen ja eläimille vain fotosynteesin avulla. Muuttaako se hiilidioksidin happea. 6 CO2 + 6 H2O + valo → C6H12O6 + 6 O2
 Reaktio nro 2 - Aerobinen soluhengitys
Reaktio nro 2 - Aerobinen soluhengitys
Aerobinen soluhengitys - Tämä on päinvastainen fotosynteesiprosessi siinä mielessä, että molekyylien energia yhdessä hengitetyn hapen kanssa vapauttaaksemme solujemme tarvitseman energian sekä hiilidioksidin ja veden. Solujen käyttämä energia on kemiallinen reaktio ATP-muodossa.
Yleinen yhtälö aerobiselle soluhengitykselle: C 6 H 12 O 6 + 6 O 2 → 6CO 2 + 6H 2 O + energia (36 ATP)
Reaktio nro 3 - Anaerobinen hengitys
Toisin kuin aerobinen soluhengitys, anaerobinen hengitys kuvaa joukon kemiallisia reaktioita, joiden avulla solut voivat vastaanottaa energiaa monimutkaisista molekyyleistä ilman happea. Lihassolusi tekevät anaerobista hengitystä, kun niiden tarjoama happi loppuu esimerkiksi intensiivisen tai pitkäaikaisen harjoituksen aikana. Hiivan ja bakteerien anaerobista hengitystä käytetään käymiseen, etanolin, hiilidioksidin ja muiden kemikaalien tuotantoon, jotka tuottavat juustoa, viiniä, olutta, leipää ja monia muita elintarvikkeita.
Anaerobisen hengityksen yleinen kemiallinen yhtälö: C6H12O6 → 2C2H5OH + 2CO 2 + energia
Reaktio nro 4 - Palaminen
Joka kerta kun sytytät ottelun, sytytä kynttilä, sytyttää tulipalon tai sytyttää grilli, näet palavan reaktion. Palamisreaktio yhdistää energiamolekyylit hapen kanssa hiilidioksidin ja veden muodostamiseksi.
Esimerkiksi kaasugrilleissä ja joissakin takkaissa havaittu propaanin palamisreaktio on: C 3 H 8 + 5 O 2 → 4 H 2 O + 3 C 2 + energia
 Reaktio nro 5 - ruoste
Reaktio nro 5 - ruoste
Ajan myötä rauta muuttuu punaiseksi, puhekansi nimeltään ruoste. Tämä on esimerkki hapettumisreaktiosta. Muihin taloustavaroihin sisältyy lanka-kuparipään muodostuminen.
Ruostumattoman raudan kemiallinen yhtälö: Fe + O 2 + H 2 O → Fe 2 O 3. XH20
 Reaktio nro 6 - Kemikaalien sekoittaminen
Reaktio nro 6 - Kemikaalien sekoittaminen
Jos sekoitat etikasta ruokasoodaa tai maitoa leivinjauheen kanssa reseptissä, näet kuinka reaktioiden vaihto tapahtuu. Ainesosat yhdistyvät hiilidioksidin ja veden muodostamiseksi. Hiilidioksidi muodostaa kuplia ja auttaa leipoa nousemaan.
Käytännössä tämä reaktio on melko yksinkertainen, mutta koostuu usein useista vaiheista. Tässä on kenraali kemiallinen yhtälö soodan reaktiolle etikan kanssa: HC 2 H 3 O 2 (aq) + NaHCO 3 (aq) → NaC 2 H 3 O 2 (aq) + H 2 O () + CO 2 (g)
 Reaktio nro 7 - akku
Reaktio nro 7 - akku
Sähkökemialliset tai redox-reaktiot akku käytetään muuntamaan kemiallinen energia sähköenergiaksi. Spontaanit redox-reaktiot tapahtuvat galvaanisissa soluissa, kun taas spontaanit redox-reaktiot tapahtuvat elektrolyyseissä.

Reaktio nro 8 - Digestointi
Tuhansia kemiallisia reaktioita tapahtuu prosessissa. ruoansulatushäiriöt. Kun olet laittanut ruokaa suuhun, entsyymi sylkeen, amylaasialkaa hajottaa sokeria ja muita hiilivetyjä yksinkertaisemmiksi muodoiksi, jotta voit imeä ruokaa. Kloorivetyhappo mahassa se reagoi ruoan kanssa hajottaakseen sen, kun taas entsyymit hajoavat proteiineja ja rasvoja niin, että ne voivat kulkeutua veren läpi suolistoseinien läpi.
 Reaktio nro 9 - happo-emäksinen
Reaktio nro 9 - happo-emäksinen
Aina kun yhdistät hapot emäksen kanssa, suoritat happo-emäsreaktio. Tämä reaktio on hapon ja emäksen neutralointi muodostamalla suola ja vesi.
Kemiallinen yhtälö happo-emäsreaktiojoka tuottaa kaliumkloridia: HCl + KOH → KCl + H20
 Reaktio nro 10 - saippua ja pesuaineet
Reaktio nro 10 - saippua ja pesuaineet
Saippuat ja pesuaineet saadaan puhtaalla kemiallisella reaktiolla. saippua muuttaa lian emulsioksi, mikä tarkoittaa öljypisteiden sitoutumista saippualle, jotta ne voidaan poistaa vedellä. pesuaineet toimivat pinta-aktiivisina aineina, alentaen veden pintajännitystä, jotta ne voivat olla vuorovaikutuksessa öljyjen kanssa, eristää ja huuhdella ne.
12. FYSIKAALISET JA KEMIALLISET FENOMENAAT.
KEMIALLISTEN REAKTIOIDEN YRITYKSET.
Luonnontieteiden ja fysiikan kurssista tiedät, että ruumiissa ja aineissa tapahtuu muutoksia, jotka on jaettu fysikaalisiin ja kemiallisiin
Jokaiseen kemialliseen reaktioon liittyy ulkoisia merkkejä, joiden perusteella arvioimme sen kulkua. Tämä on:
1. Sedimentin ulkonäkö.
2.Väri muutos.
3. Kaasun kehitys.
4. Lämmön imeytyminen tai vapauttaminen.
Kemiallisen reaktion tapahtumiseksi tarvitaan useita olosuhteita. Ensimmäinen on reagoivien aineiden saattaminen kosketukseen; toinen on aineiden jauhaminen (suurin jauhaminen saavutetaan liuottamalla aineet); kolmanneksi, jotta tapahtuu monia reaktioita, on tarpeen lämmittää reagoivat aineet tiettyyn lämpötilaan.
Kemialliset reaktiot voidaan ilmaista kirjallisesti käyttämällä kemiallisten reaktioiden yhtälöitä, joita usein kutsutaan kemiallisiksi yhtälöiksi. Mikä tämä on?
Kemiallinen yhtälö on ehdollinen tietue kemiallisesta reaktiosta kemiallisia kaavoja ja kertoimia käyttämällä.
Reaktioyhtälöitä laatiessaan on käytettävä lakia, jonka mukaan M.V. Lomonosov ja A. Lavoisier. Reaktioon joutuneiden aineiden massa on yhtä suuri kuin reaktiosta saatujen aineiden massa. Mutta tiedät, että aineet koostuvat atomista, joten kemiallisia yhtälöitä laatiessamme käytämme sääntöä: lähtöaineiden kunkin kemiallisen elementin atomien lukumäärän tulisi olla yhtä suuri kuin reaktiotuotteissa olevien atomien lukumäärä.Algoritmi reaktioyhtälöiden laatimiseksi.
Harkitse algoritmia kemiallisten yhtälöiden laatimiseksi käyttämällä esimerkkiä yksinkertaisten aineiden: metallien ja muiden kuin metallien vuorovaikutuksesta. Anna fosforin ja hapen olla vuorovaikutuksessa (palamisreaktio).
1. Kirjoita nämä aineet vierekkäin, laita niiden väliin “+” -merkki (tässä otamme huomioon, että happi on piimaan mukainen molekyyli), ja niiden jälkeen nuoli on kuin yhtälö.
P + O 2
2. Kirjoitamme reaktiotuotteen kaavan nuolen jälkeen:
P + O 2 P 2 O 5
3. Kaaviosta voidaan nähdä, että vasemmalla on happea-2-atomia, oikealla-5, ja aineiden massan säilyttämistä koskevan lain mukaisesti tietyn kemiallisen alkuaineen atomien lukumäärän on oltava sama. Heidän lukumäärän tasoittamiseksi löydämme vähiten yleisen kerrannaisen. 2: lle ja 5: lle se on luku 10. Jaa vähiten yleinen kerrannainen kaavojen atomien lukumäärällä. 10: 2 \u003d 5, 10: 5 \u003d 2, nämä ovat kertoimet, jotka asetetaan ennen happea 02 ja fosforioksidia (V) P205, vastaavasti.
P + 5O 2 2P 2 O 5
happea vasemmalta ja oikealta tuli 10 (5 · 2 \u003d 10, 2 · 5 \u003d 10)4. Kerroin viittaa koko kaavaan ja asetetaan sen eteen. Kun se oli asetettu oikealle, fosforista tuli 2,2 - 4 atomia. Ja vasemmalla on 1 (kerrointa 1 ei ole asetettu.) Joten laitamme kertoimen 4 fosforin eteen.
4P + 5O 2 2P 2 O 5
Tämä on kemiallisen yhtälön viimeinen tietue.
Se kuuluu: neljä ne plus viisi o-kaksi on yhtä suuri kuin kaksi ne-kaksi o-viisi.
fyysinen he kutsuvat sellaisia \u200b\u200bilmiöitä, joissa joissain aineissa ei tapahdu muutoksia toisiksi, mutta niiden aggregaattitilat, kehon muoto ja koko muuttuvat.
esimerkkejä: jään sulaminen, viiran vetäminen, graniitin murskaus, veden haihtuminen.
kemiallinen kutsua sellaisia \u200b\u200bilmiöitä, joissa jotkut aineet muuttuvat toisiksi.
esimerkkejä: puun polttaminen, kuparin tummeneminen, raudan ruostuminen.
Kutsumme tulevaisuudessa kemiallisia ilmiöitä kemiallisiksi reaktioiksi.
Kemiallisen reaktion merkit. Niitä voidaan käyttää arvioimaan onko kemiallinen reaktio reagenssien välillä kulunut vai ei. Nämä merkit johtuvat yleensä seuraavista:
· Värinvaihto: CuSO4 (syaani) \u003d Cu2 + + SO4 2-
· Sademäärä: CO 2 + Ca (OH) 2 CaCO 3 + H20
· Kaasun kehitys: CaCO 3 + HCl CaCl2 + CO 2 + H20
· Hieman dissosioituneiden aineiden muodostuminen: 2NaOH + H2S04 \u003d Na2S04 + 2H20
· Energian vapautuminen (lämpö tai valo): 2H 2 (g) + O 2 (g) \u003d 2 H 2 O (g) + 572 kJ
1. Reagoivien aineiden läheinen kosketus (tarpeen): H2S04 + Zn \u003d ZnSO4 + H2 2. Kuumennus (mahdollisesti) a) reaktion käynnistämiseksi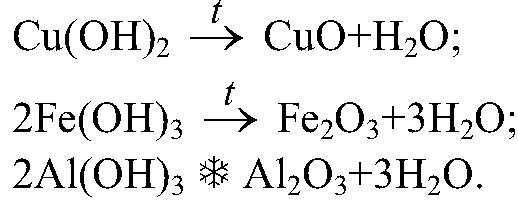 b) jatkuvasti Kemiallisten reaktioiden luokittelu eri kriteerien perusteella 1.Jos vaiheraja on läsnä, kaikki kemialliset reaktiot jaetaan homogeeninen ja heterogeeninen Yhdessä vaiheessa tapahtuvaa kemiallista reaktiota kutsutaan homogeeninen kemiallinen reaktio. Vaiherajassa tapahtuvaa kemiallista reaktiota kutsutaan heterogeeninen kemiallinen reaktio. Monivaiheisessa kemiallisessa reaktiossa jotkut vaiheet voivat olla homogeenisia, kun taas toiset voivat olla heterogeenisiä. Sellaisia \u200b\u200breaktioita kutsutaan homogeeninen heterogeeninen . Lähtöaineiden ja reaktiotuotteiden muodostavien vaiheiden lukumäärästä riippuen kemialliset prosessit voivat olla homofaasisia (lähtöaineet ja tuotteet ovat samassa vaiheessa) ja heterofaasisia (lähtöaineet ja tuotteet muodostavat useita faaseja). Reaktion homo- ja heterofaasisuus ei liity siihen, onko reaktio homo- vai heterogeeninen. Siksi voidaan erottaa neljä prosessityyppiä: Homogeeniset reaktiot (homofaasiset). Tämän tyyppisissä reaktioissa reaktioseos on homogeeninen ja reagenssit ja tuotteet kuuluvat samaan faasiin. Esimerkki sellaisista reaktioista on ioninvaihtoreaktiot, esimerkiksi happoliuoksen neutralointi alkaliliuoksella: Heterogeeniset homofaasireaktiot. Komponentit ovat samassa vaiheessa, mutta reaktio etenee faasin rajalla, esimerkiksi katalyytin pinnalla. Esimerkki olisi eteenin hydraus nikkelikatalysaattorilla: Homogeeniset heterofaasireaktiot. Tällaisessa reaktiossa olevat reagenssit ja tuotteet esiintyvät useissa vaiheissa, mutta reaktio etenee yhdessä vaiheessa. Siten nestemäisessä faasissa olevien hiilivetyjen hapettuminen kaasumaisella hapella voi tapahtua. Heterogeeniset heterofaasiset reaktiot. Tässä tapauksessa reagenssit ovat eri faasitilassa, myös reaktiotuotteet voivat olla missä tahansa faasitilassa. Reaktioprosessi etenee vaiherajalla. Esimerkki on hiilihapon (karbonaattien) suolojen reaktio Bronsted-happojen kanssa: 2. Muuttamalla reagenssien hapetusasteita [muokkaa | muokkaa wiki-tekstiä] Tässä tapauksessa on olemassa Redox-reaktioita, joissa yhden elementin atomit (hapetin) ovat toipumassa
, ts. ne alentavat hapetustilaansa ja toisen elementin (pelkistimen) atomit hapetettu
, toisin sanoen lisätä niiden hapetustilaa. Erityinen tapaus redox-reaktioissa on suhteettomuuden reaktio, jossa hapetin ja pelkistin ovat saman alkuaineen atomeja, jotka ovat erilaisissa hapetusasteissa. Esimerkki redox-reaktiosta on vedyn (pelkistävän aineen) palaminen happea (hapettava aine) veden muodostamiseksi: Esimerkki suhteellisesta reaktiosta on ammoniumnitraatin hajoaminen kuumennettaessa. Tässä tapauksessa hapettava aine on typpi- (+5) nitroryhmiä ja pelkistävä aine on ammoniumkationin typpi (-3): Ei sovelleta redoksireaktioihin, joissa atomien hapettumisaste ei muutu, esimerkiksi: 3. Reaktion lämpövaikutuksella kaikki kemialliset reaktioihin liittyy energian vapautumista tai imeytymistä. Kun kemialliset sidokset hajoavat reagensseissa, energiaa vapautuu, mikä menee pääasiassa uusien kemiallisten sidosten muodostumiseen. Joissakin reaktioissa näiden prosessien energiat ovat lähellä, ja tässä tapauksessa reaktion kokonaislämpövaikutus lähestyy nollaa. Muissa tapauksissa voimme erottaa: eksotermiset reaktiot, jotka tapahtuvat lämmön vapautumisen yhteydessä (positiivinen lämpövaikutus) CH 4 + 2О 2 \u003d СО 2 + 2Н 2 О + energia (valo, lämpö); CaO + H20 \u003d Ca (OH) 2 + energia (lämpö). endotermiset reaktiot, joiden aikana lämpö absorboidaan ympäristöstä (negatiivinen lämpövaikutus). Ca (OH) 2 + energia (lämpö) \u003d CaO + H 2 O Reaktion lämpövaikutus (reaktion entalpia, Δ r H), joka on usein erittäin tärkeä, voidaan laskea Hessin lain mukaan, jos tunnetaan reagenssien ja tuotteiden muodostumisen entalpiat. Kun tuotteiden entalpioiden summa on pienempi kuin reagenssien entalpioiden summa (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) on absorptio. 4. Reagoivien hiukkasten muutostyypin mukaan [muokkaa | muokkaa wiki-tekstiä] yhdisteet: hajoamiset: substituutiot: vaihto (mukaan lukien reaktion tyyppi - neutralointi): Kemiallisiin reaktioihin liittyy aina fyysisiä vaikutuksia: energian imeytyminen tai vapautuminen, reaktioseoksen värinmuutos jne. Nämä fysikaaliset vaikutukset arvioidaan usein kemiallisten reaktioiden kulusta. Yhdistereaktio-kemiallinen reaktio, jonka tuloksena kaksi tai useampi lähtöaine muodostaa vain yhden uuden, sekä yksinkertaiset että monimutkaiset aineet voivat käydä sellaisissa reaktioissa. Hajoamisreaktio-kemiallinen reaktio, jonka seurauksena yhdestä aineesta muodostuu useita uusia aineita. Vain monimutkaiset yhdisteet osallistuvat tämän tyyppisiin reaktioihin, ja sekä kompleksiset että yksinkertaiset aineet voivat olla niiden tuotteita. Substituutioreaktio-kemiallinen reaktio, jonka seurauksena yhden elementin atomit, jotka ovat osa yksinkertaista ainetta, korvaavat toisen elementin atomit sen monimutkaisessa yhdisteessä. Kuten määritelmästä seuraa, tällaisissa reaktioissa yhden lähtöaineiden tulisi olla yksinkertaisia \u200b\u200bja toisen monimutkaisia. Vaihda reaktioita- reaktio, jonka seurauksena kaksi kompleksista ainetta vaihtavat aineosat 5. Virtaussuunnan mukaan kemialliset reaktiot jaetaan peruuttamaton ja palautuva peruuttamattomasti
b) jatkuvasti Kemiallisten reaktioiden luokittelu eri kriteerien perusteella 1.Jos vaiheraja on läsnä, kaikki kemialliset reaktiot jaetaan homogeeninen ja heterogeeninen Yhdessä vaiheessa tapahtuvaa kemiallista reaktiota kutsutaan homogeeninen kemiallinen reaktio. Vaiherajassa tapahtuvaa kemiallista reaktiota kutsutaan heterogeeninen kemiallinen reaktio. Monivaiheisessa kemiallisessa reaktiossa jotkut vaiheet voivat olla homogeenisia, kun taas toiset voivat olla heterogeenisiä. Sellaisia \u200b\u200breaktioita kutsutaan homogeeninen heterogeeninen . Lähtöaineiden ja reaktiotuotteiden muodostavien vaiheiden lukumäärästä riippuen kemialliset prosessit voivat olla homofaasisia (lähtöaineet ja tuotteet ovat samassa vaiheessa) ja heterofaasisia (lähtöaineet ja tuotteet muodostavat useita faaseja). Reaktion homo- ja heterofaasisuus ei liity siihen, onko reaktio homo- vai heterogeeninen. Siksi voidaan erottaa neljä prosessityyppiä: Homogeeniset reaktiot (homofaasiset). Tämän tyyppisissä reaktioissa reaktioseos on homogeeninen ja reagenssit ja tuotteet kuuluvat samaan faasiin. Esimerkki sellaisista reaktioista on ioninvaihtoreaktiot, esimerkiksi happoliuoksen neutralointi alkaliliuoksella: Heterogeeniset homofaasireaktiot. Komponentit ovat samassa vaiheessa, mutta reaktio etenee faasin rajalla, esimerkiksi katalyytin pinnalla. Esimerkki olisi eteenin hydraus nikkelikatalysaattorilla: Homogeeniset heterofaasireaktiot. Tällaisessa reaktiossa olevat reagenssit ja tuotteet esiintyvät useissa vaiheissa, mutta reaktio etenee yhdessä vaiheessa. Siten nestemäisessä faasissa olevien hiilivetyjen hapettuminen kaasumaisella hapella voi tapahtua. Heterogeeniset heterofaasiset reaktiot. Tässä tapauksessa reagenssit ovat eri faasitilassa, myös reaktiotuotteet voivat olla missä tahansa faasitilassa. Reaktioprosessi etenee vaiherajalla. Esimerkki on hiilihapon (karbonaattien) suolojen reaktio Bronsted-happojen kanssa: 2. Muuttamalla reagenssien hapetusasteita [muokkaa | muokkaa wiki-tekstiä] Tässä tapauksessa on olemassa Redox-reaktioita, joissa yhden elementin atomit (hapetin) ovat toipumassa
, ts. ne alentavat hapetustilaansa ja toisen elementin (pelkistimen) atomit hapetettu
, toisin sanoen lisätä niiden hapetustilaa. Erityinen tapaus redox-reaktioissa on suhteettomuuden reaktio, jossa hapetin ja pelkistin ovat saman alkuaineen atomeja, jotka ovat erilaisissa hapetusasteissa. Esimerkki redox-reaktiosta on vedyn (pelkistävän aineen) palaminen happea (hapettava aine) veden muodostamiseksi: Esimerkki suhteellisesta reaktiosta on ammoniumnitraatin hajoaminen kuumennettaessa. Tässä tapauksessa hapettava aine on typpi- (+5) nitroryhmiä ja pelkistävä aine on ammoniumkationin typpi (-3): Ei sovelleta redoksireaktioihin, joissa atomien hapettumisaste ei muutu, esimerkiksi: 3. Reaktion lämpövaikutuksella kaikki kemialliset reaktioihin liittyy energian vapautumista tai imeytymistä. Kun kemialliset sidokset hajoavat reagensseissa, energiaa vapautuu, mikä menee pääasiassa uusien kemiallisten sidosten muodostumiseen. Joissakin reaktioissa näiden prosessien energiat ovat lähellä, ja tässä tapauksessa reaktion kokonaislämpövaikutus lähestyy nollaa. Muissa tapauksissa voimme erottaa: eksotermiset reaktiot, jotka tapahtuvat lämmön vapautumisen yhteydessä (positiivinen lämpövaikutus) CH 4 + 2О 2 \u003d СО 2 + 2Н 2 О + energia (valo, lämpö); CaO + H20 \u003d Ca (OH) 2 + energia (lämpö). endotermiset reaktiot, joiden aikana lämpö absorboidaan ympäristöstä (negatiivinen lämpövaikutus). Ca (OH) 2 + energia (lämpö) \u003d CaO + H 2 O Reaktion lämpövaikutus (reaktion entalpia, Δ r H), joka on usein erittäin tärkeä, voidaan laskea Hessin lain mukaan, jos tunnetaan reagenssien ja tuotteiden muodostumisen entalpiat. Kun tuotteiden entalpioiden summa on pienempi kuin reagenssien entalpioiden summa (Δ r H< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) on absorptio. 4. Reagoivien hiukkasten muutostyypin mukaan [muokkaa | muokkaa wiki-tekstiä] yhdisteet: hajoamiset: substituutiot: vaihto (mukaan lukien reaktion tyyppi - neutralointi): Kemiallisiin reaktioihin liittyy aina fyysisiä vaikutuksia: energian imeytyminen tai vapautuminen, reaktioseoksen värinmuutos jne. Nämä fysikaaliset vaikutukset arvioidaan usein kemiallisten reaktioiden kulusta. Yhdistereaktio-kemiallinen reaktio, jonka tuloksena kaksi tai useampi lähtöaine muodostaa vain yhden uuden, sekä yksinkertaiset että monimutkaiset aineet voivat käydä sellaisissa reaktioissa. Hajoamisreaktio-kemiallinen reaktio, jonka seurauksena yhdestä aineesta muodostuu useita uusia aineita. Vain monimutkaiset yhdisteet osallistuvat tämän tyyppisiin reaktioihin, ja sekä kompleksiset että yksinkertaiset aineet voivat olla niiden tuotteita. Substituutioreaktio-kemiallinen reaktio, jonka seurauksena yhden elementin atomit, jotka ovat osa yksinkertaista ainetta, korvaavat toisen elementin atomit sen monimutkaisessa yhdisteessä. Kuten määritelmästä seuraa, tällaisissa reaktioissa yhden lähtöaineiden tulisi olla yksinkertaisia \u200b\u200bja toisen monimutkaisia. Vaihda reaktioita- reaktio, jonka seurauksena kaksi kompleksista ainetta vaihtavat aineosat 5. Virtaussuunnan mukaan kemialliset reaktiot jaetaan peruuttamaton ja palautuva peruuttamattomasti 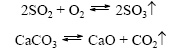 kemialliset reaktiot, jotka tapahtuvat vain yhdessä suunnassa (" vasemmalta oikealle"), jonka seurauksena lähtöaineet muunnetaan reaktiotuotteiksi. He sanovat sellaisista kemiallisista prosesseista, että ne etenevät" loppuun ". palamisreaktiotsamoin reaktiot, joihin liittyy heikosti liukenevien tai kaasumaisten aineiden muodostuminen palautuva
kemialliset reaktiot, jotka tapahtuvat vain yhdessä suunnassa (" vasemmalta oikealle"), jonka seurauksena lähtöaineet muunnetaan reaktiotuotteiksi. He sanovat sellaisista kemiallisista prosesseista, että ne etenevät" loppuun ". palamisreaktiotsamoin reaktiot, joihin liittyy heikosti liukenevien tai kaasumaisten aineiden muodostuminen palautuva 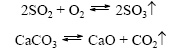 Kemiallisia reaktioita, jotka tapahtuvat samanaikaisesti kahdessa vastakkaisessa suunnassa (“vasemmalta oikealle” ja “oikealta vasemmalle”), kutsutaan. Tällaisten reaktioiden yhtälöissä yhtälö korvataan kahdella vastakkaisella suunnalla osoitetulla nuolella. suora (virtaa "vasemmalta oikealle") ja päinvastoin(etenee “oikealta vasemmalle”.) Koska palautuvan reaktion aikana lähtöaineet kulutetaan ja muodostetaan samanaikaisesti, ne eivät muutu täysin reaktiotuotteiksi. Siksi sanotaan, että palautuvat reaktiot eivät etene loppuun. Tuloksena on aina sekoitus lähtöaineita ja reaktiotuotteita. 6. Katalyyttien osallistumisen perusteella kemialliset reaktiot jaetaan katalyyttinen ja ei-katalyyttinen Katalyyttinen 2SO 2 + O 2 → 2SO 3 (V 2 O 5 -katalyytti) määritellään reaktioiksi, jotka tapahtuvat katalyyttien läsnä ollessa. Tällaisten reaktioiden yhtälöissä katalyytin kemiallinen kaava on merkitty yhtä suurella tai palautuvalla merkillä, joskus yhdessä virtausolosuhteiden kanssa. Tämän tyyppisiin reaktioihin sisältyy monia hajoamisreaktioita ja yhdisteitä. Ei-katalyyttinen 2NO + O2 \u003d 2NO 2 viittaa moniin reaktioihin, jotka tapahtuvat ilman katalyyttejä, kuten esimerkiksi vaihto- ja substituutioreaktiot.
Kemiallisia reaktioita, jotka tapahtuvat samanaikaisesti kahdessa vastakkaisessa suunnassa (“vasemmalta oikealle” ja “oikealta vasemmalle”), kutsutaan. Tällaisten reaktioiden yhtälöissä yhtälö korvataan kahdella vastakkaisella suunnalla osoitetulla nuolella. suora (virtaa "vasemmalta oikealle") ja päinvastoin(etenee “oikealta vasemmalle”.) Koska palautuvan reaktion aikana lähtöaineet kulutetaan ja muodostetaan samanaikaisesti, ne eivät muutu täysin reaktiotuotteiksi. Siksi sanotaan, että palautuvat reaktiot eivät etene loppuun. Tuloksena on aina sekoitus lähtöaineita ja reaktiotuotteita. 6. Katalyyttien osallistumisen perusteella kemialliset reaktiot jaetaan katalyyttinen ja ei-katalyyttinen Katalyyttinen 2SO 2 + O 2 → 2SO 3 (V 2 O 5 -katalyytti) määritellään reaktioiksi, jotka tapahtuvat katalyyttien läsnä ollessa. Tällaisten reaktioiden yhtälöissä katalyytin kemiallinen kaava on merkitty yhtä suurella tai palautuvalla merkillä, joskus yhdessä virtausolosuhteiden kanssa. Tämän tyyppisiin reaktioihin sisältyy monia hajoamisreaktioita ja yhdisteitä. Ei-katalyyttinen 2NO + O2 \u003d 2NO 2 viittaa moniin reaktioihin, jotka tapahtuvat ilman katalyyttejä, kuten esimerkiksi vaihto- ja substituutioreaktiot. 3 Kysymys 3
Aineen rakennetta koskevien ideoiden kehittäminen:
Kemialliset reaktiot jokapäiväisessä elämässä Projektin osanottajat: 1. Savostyanova Evgenia Konstantinovna luokka 9 2. Zadorina Elizaveta Vadimovna luokka 8 3. Ermakov Pavel Igorevich luokka 9 4. Dmitriev Ilja Aleksejevitš 9. luokka 5. Katasonov Nikita Sergeevich luokka 9 Johtaja: Lazareva Elena Alexandrovna 2014 vuosi Kunnan budjettioppilaitos "Secondary school 17"
Valitun aiheen relevanssi Nykyään tunnetaan miljoonia erilaisia \u200b\u200baineita. Monia niistä käytetään teollisuuden ja maatalouden lisäksi myös arjessa. Valitettavasti kaikilla ihmisillä ei ole kemiallista perustietoa aineista ja niiden muutoksista. Uskomme, että jopa koulusta lähtien on tarpeen lisätä kemiallista lukutaitoa. Siksi aihe "Kemialliset reaktiot jokapäiväisessä elämässämme" on ajankohtainen.


Maakaasupoltto Venäjä on johtava maakaasuvarannoissa ja tuotannossa. Siksi kodeissamme käytämme maakaasun palamisreaktiota lämpöenergian tuottamiseen. Maakaasu on seos kaasuja, jotka muodostuvat maan suolistossa orgaanisten aineiden anaerobisen hajoamisen aikana. Kemiallinen koostumus: etaani (C2H6), propaani (C3H8) butaani (C4H10). Sekä muut kuin hiilivetyaineet: vety (H2), rikkivety (H2S), hiilidioksidi (CO 2), typpi (N2), helium (He). Suurin osa maakaasusta on metaania (CH4) 92 - 98%. Se on väritön, kevyt, syttyvä kaasu, hajuton, veteen lähes liukenematon. Ilmassa oleva metaaniseos on räjähtävä. Metaanin palamisreaktio CH4 + 2O2 \u003d CO 2 + 2H 2 O + Q. Metaani palaa sinertävällä tai melkein väritöntä liekillä vapauttaen suuren määrän lämpöä (879 kJ / mol). Kun käytät kaasulaitteita talossa, on välttämätöntä: tarkistaa savupiippu, tuulettaa huone, seurata kaasuputkien tilaa, äläkä jätä toimivia kaasulaitteita vartioimatta.

Palavat tulitikut Koska laaja valikoima erilaisia \u200b\u200bsytyttimiä, tulitikut ovat erittäin suosittuja. Mitä prosesseja tapahtuu ottelun syttyessä? Täällä he löivät häntä laatikoista. Siellä oli liekki ja pistävä "rikin" haju. Prosessi alkoi kitkan vaikutuksesta. Ensin punainen fosfori syttyi tulipaloon, joka oli tulitikkurasiassa 4Р + 5О 2 \u003d 2Р 2 О 5 fosforia, joka antaa kitkaa kitkan aikana, sytyttää rikki- ja bertoliittisuolan seokselle tulitikun päässä S + O 2 \u003d SO 2 (SO 2 - rikkidioksidi, pistävän hajun lähde). Pään sytytys puulle С 6 Н 10 О 5 + 6О 2 \u003d 6СО 2 + 5Н 2 О Lähes kaikki palamistuotteet ovat haitallisia keholle. Vain kun yksi tulitikku palaa, niistä vapautuu merkityksetön määrä, jolla ei ole merkittävää vaikutusta henkilölle. Mutta käytettäessä tulitikkuja, kemiallisesti koulutetun ihmisen tulisi muistaa, että ”KATSAUKSET EI OLE KUORMA!”

Saippuan hydrolyysi Tuotannossa ja jokapäiväisessä elämässä saippua on korkealaatuisten rasvahappojen vesiliukoisten suolojen teknisten seosten nimi, usein lisättynä joihinkin muihin aineisiin, joilla on pesuainevaikutus. Seosten perusta koostuu yleensä tyydyttyneiden ja tyydyttymättömien rasvahappojen natrium- (harvemmin kalium- ja ammonium-) suoloista, joiden hiiliatomien lukumäärä molekyylissä on 12-18 (steariini, palmitiini, myristiikka, lauriini ja öljyhappo). Saippuat sisältävät usein myös nafteeni- ja hartsihappojen suoloja ja joskus muita yhdisteitä pesuaineen kanssa liuoksissa. Saippuat muodostuvat voimakkaasta emäksestä ja heikosta haposta, joten ne hydrolysoituvat helposti: C 17 H 35 COONa + H 2 O \u003d C 17 H 35 COOH + NaOH Emäksinen hydrolyysiväliaine, siksi saippuat ovat melko aggressiivisia iholle ja niiden usein käytetty rasvanpoisto . Saippualla on hyvin monia lajikkeita ja merkkejä, ja ennen kuin valitset sopivimman, sinun on määritettävä ihotyyppi. Rasvainen iho paistaa usein voimakkaan hiki ja rasvaisen erottelun takia, yleensä suuret huokoset siinä. 2 tuntia pesun jälkeen rasvainen iho tahroittuu kasvoille levitetyllä lautasliinalla. Tällainen iho vaatii saippuaa, jolla on lievä tyhjennysvaikutus. Kuiva iho on ohut ja erittäin herkkä tuulelle ja säälle, ja sen huokoset ovat pienet ja ohuet; se halkeilee helposti, koska se ei ole riittävän joustava. Tällaisen ihon on luotava maksimaalinen mukavuus ja hellävarainen hoito, on parempi käyttää kalliita saippualajikkeita. Normaali iho on pehmeää, sileää, siinä on keskikokoiset huokoset.

Vetyperoksidi Vetyperoksidi on yksinkertaisin peroksidien edustaja. Väritön neste, jolla on ”metalli” maku, liukenematon veteen, alkoholiin ja eetteriin. Egoa käytetään usein arjessa valkaisuaineena ja antiseptisenä aineena. Kun vetyperoksidia hajoaa (kun käsittelemme haavaa), vettä ja kaasumaista happea vapautuu. 2Н 2 О 2 \u003d О 2 + 2Н 2 О Jos ei ole suuria annoksia, vapautuu vastaavasti pieni määrä happea. Pienessä tilavuudessa puhdas happi ei ole vaarallinen, mutta suuressa tilavuudessa? Ja suuri määrä puhdasta happea on myrkyllistä ja voi aiheuttaa happimyrkytyksen keuhkojen muodossa ja vahingollisen vaikutuksen keskushermostoon. Ensimmäiseen altistumiseen liittyy tällaisia \u200b\u200boireita: keuhkokudoksen ärsytys. Se voi alkaa lievästä nielun ärsytyksestä ja sitä seuraavasta yskästä. Vakavissa tapauksissa voi ilmetä pitkittynyttä rinnassa polttamista ja hallitsematonta yskää. Keuhkohappimyrkytys voi myös vähentää keuhkojen kapasiteettia ja kaasunvaihtokapasiteettia, vaikka nämä komplikaatiot ovatkin erittäin harvinaisia. Toisen vaikutuksen (keskushermoston myrkylliset vauriot) oireita ovat: näkövamma (tunnelinäkö, kyvyttömyys keskittyä), kuulovamma (korvien soiminen, vieraiden äänien esiintyminen), pahoinvointi, kouristuvat supistukset (erityisesti kasvojen lihakset), lisääntynyt herkkyys ulkoisille ärsyttäjille ja huimaus. . Mutta kaikki tämä on mahdollista vain käytettäessä suuria määriä vetyperoksidia, ja tavallinen 3% peroksidi ei kykene tähän.

Sammutuskarbonaatti etikalla Sammutusmenetelmää etikan kanssa käytetään sekoittamalla taikinaa pulloihin ja pannukakkuihin. Leivosooda altistettuna korkealle lämpötiolle tai happamalle ympäristölle antaa tehostetun reaktion hiilidioksidin vapautumiseen, mikä puolestaan \u200b\u200bjohtaa loistoon ja huokoisuuteen. CH 3 COOH + NaHCO 3 \u003d CH 3 COONa + H 2 O + CO 2 Kysymys "sammuta tai ei jäähdytä sooda etikan avulla paistamisen aikana" on yhtä ikuinen kuin kysymys: "mitä tapahtui ennen - kana tai muna". Tutkimalla kuitenkin kirjallisuutta, ottamalla tauon joukosta sivustoja, mukaan lukien ulkomaiset, päädyin siihen johtopäätökseen, että monista muinaisen venäläisen keittiön resepteistä ei löytynyt yhtään mainintaa soodaa vuosien vahvuuden takia. Maissamme leipominen oli ennen kaikkea hiivaa, tai ilman mitään nosto- ja irronnuskiihdyttimiä. Joten ranskalainen kemisti LeBlanc keksi ruokasoodan 1700-luvun lopulla. Tämä keksintö tuli Venäjälle paljon myöhemmin saatuaan uuden menetelmän sen valmistamiseksi. Heti kun venäläisillä kotiäidillä oli tuotetta, kuten sooda, he alkoivat käyttää sitä ruoanlaitossa. Miksi soodan sammuttamista päätettiin? Kyllä, yksinkertaisesti siksi, että perinteemme on tässä tapauksessa kaikki "lämmöllä, lämmöllä" - se on vain haitallista. Nopea ruokasooda kuumassa leipomisessa on erittäin epämiellyttävä “saippuainen” maku. Mitä "korjattiin" sen sammutuksella, nimittäin lisäämällä kiehuvaa vettä soodaan tai käyneisiin maitotuotteisiin. Pannukakkujen osalta tämä menetelmä antaa nyt erittäin hyviä tuloksia. Kuitenkin voit kuvitella, mitä tapahtuu ohukaiselle leivonnaisille, jos kaadetaan sinne lasillinen kiehuvaa vettä? Vastaus on ilmeinen. Siksi ajateltiin korvata kiehuva vesi tai maitotuotteet laimennetulla 9-prosenttisella etikalla tai sitruunamehulla.

Johtopäätös Voimme havaita monia kemiallisia reaktioita paitsi kemian oppitunneissa myös jokapäiväisessä elämässä. Nämä reaktiot eivät ole vain turvallisia (turvallisuussääntöjen alaisia), mutta osa niistä on hyödyttömiä. Esimerkiksi: sammuttamalla sooda etikalla, mikä tahansa taitava kokki sanoo, että tämä on ajanhukkaa. Mutta ilman reaktioita, kuten hydrolyysi ja palaminen, meillä ei yksinkertaisesti ole aavistustakaan olemassaolosta. Näiden kemiallisten reaktioiden aikana kaasuja vapautuu. Ne ovat turvallisia (tietty määrä). Kun käytät kemikaaleja jokapäiväisessä elämässä, turvallisuusmääräysten noudattaminen on välttämätöntä.

Tietolähteet 1. Kritsman, VA, Stanzo, VV Encyclopedic Dictionary of Nuori Kemisti [Teksti] -M. : Pedagogy, Lavrova, S.A. Viihdyttävä kemia [Teksti] -M. : White City, Ryumin, V. Viihdyttävä kemia [teksti] -M .: Center Polygraph, Kurdyumov, G. M. Kemiallinen kysymys [teksti] -M. : World, Binom, Guzey, L.S., Kuznetsov, V.N. Uusi kemian hakuteos [Teksti] -M. : Ursa Major, Wikipedia [sähköinen resurssi] - Käyttötila: ru.wikipedia.org 7. Egorova, A.S. Kemian ohjaaja [Teksti] -M. : Phoenix, kemia ja elämä [sähköinen resurssi] - käyttötila: http: //www.hij.ru 9. Kemia ympärillämme [sähköinen resurssi] - käyttötila:

