8.doc
87Агрегатные состояния вещества и переходы между ними. Свойства газов, жидкостей и твердых тел.
8.1. Агрегатные состояния вещества и переходы между ними в зависимости от
температуры и давления
Веществом называется совокупность большого количества частиц (атомов, молекул, ионов). Вещество может существовать и иметь определенное строение только за счет тех или иных взаимодействий между составляющими его частицами. При этом структура вещества, его физические свойства очень сильно зависят от энергии этих взаимодействий и ее соотношения с тепловой энергией движения частиц.
Для большинства веществ существуют четыре ясно отличающихся друг от друга состояния, переход между которыми осуществляется при изменении температуры. Эти состояния называются агрегатными: твердое, жидкое, газообразное, плазменное.
Для каждого вещества существует температура, при которой энергия связи между его частицами превышает энергию их тепловых колебаний. При этом колебательное движение, конечно, не прекращается, но его недостаточно для разрыва связей между частицами. При этом частицы обычно образуют правильную геометрическую структуру. Это состояние вещества называется твердым.
При повышении температуры наступает момент, когда энергия тепловых колебаний превышает энергию связей между частицами и они начинают поступательное движение. Геометрическая структура разрушается. Однако пока энергия поступательного движения не настолько велика, чтобы частицы могли окончательно оторваться друг от друга: они двигаются, сохраняя между собой постоянное расстояние. Такое состояние вещества называется жидким.
При дальнейшем повышении температуры энергия поступательного теплового движения превышает энергию взаимодействий между частицами, и они могут оторваться друг от друга.
Поскольку с увеличением расстояния сила взаимодействия падает, частицы располагаются на таком расстоянии друг от друга, какое возможно при их концентрации. Это состояние называется газообразным.
При сверхвысоких температурах либо в электрическом поле очень высокого напряжения возникает четвертое состояние - плазма. Строго говоря, это уже другое вещество, поскольку характеризуется наличием большого количества ионизированных молекул и свободных электронов.
Диаграммы состояния
Переход вещества из одного агрегатного состояния в другое определяется не только температурой, но и давлением. Особенно сильна последняя зависимость для перехода жидкость - газ. При низких температурах и высоких давлениях вещество находится в твердом состоянии, при понижении температуры и давления переходит в жидкое и газообразное. При этом для каждого индивидуального вещества эти переходы имеют строгие количественные характеристики, которые наглядно отображаются так называемой фазовой диаграммой состояния. Это двумерная диаграмма, на осях которой отложены значения температуры и давления, а сама диаграмма в простейшем случае представляет собой три линии, сходящиеся в одной точке. Эти линии разделяют собой те области температуры и давления, которые соответствуют жидкому, твердому и газообразному состояниям (рис. 16).
Подробно о диаграмме состояния и ее свойствах рассказывается в курсе физики.
^ 8.2. Характерные свойства газов, жидкостей и твердых тел.
1. Газы. В газообразном состоянии обычно находятся ковалентные низкомолекулярные вещества и благородные газы. Расстояние между частицами вещества в газах много больше размеров самих частиц и взаимодействие между ними пренебрежимо
Мало по сравнению с тепловой энергией. Соответственно газы легко расширяются и сжимаются. Газы не имеют собственной формы и объема и принимают форму и объем содержащего их сосуда, оказывая при этом на стенки сосуда одинаковое давление во всех направлениях. Все газы смешиваются друг с другом в любом соотношении.
2. Жидкости. В жидком состоянии при нормальных условиях обычно Находятся ковалентные вещества (не имеющие атомной кристаллической решетки) и некоторые металлы (ртуть). Расстояние между частицами в жидкости не намного отличается от такового в твердом состоянии, но частицы подвижны относительно друг друга. Соответственно жидкости не имеют собственной формы и принимают форму сосуда, однако имеют собственный объем и, как правило, практически несжимаемы.
3. Твердые вещества. Твердое состояние характерно для веществ со всеми типами связей (металлическими, ионными, ковалентными). При этом вещества с ионным и атомным типами связей при нормальных условиях всегда твердые. Расстояние между частицами мало, взаимодействия сильны, частицы неподвижны относительно друг друга (если не учитывать малые колебательные движения). При этом они образуют постоянную структуру. Поэтому твердые тела имеют собственные форму и объем, которые практически не зависят от давления и температуры (разумеется, в области фазовой диаграммы, отвечающей твердому состоянию).
Итак, количество твердого или жидкого вещества в заданном объеме практически не зависит от температуры и давления и определяется плотностью, которая индивидуальна для каждого вещества и практически не может быть рассчитана без точного знания структуры. Однако это не так для газов, у которых эти зависимости подчиняются общим законам. Знание этих законов необходимо для решения многих химических проблем, и мы их сейчас рассмотрим.
^ 8.3. Газы. Газовые законы.
Состояние газообразного вещества полностью характеризуется следующими параметрами:
М - молекулярная масса вещества m - масса газа P - давление
V - предоставленный газу объем
Т - температура газа (в газовых законах используется температура в шкале Кельвина)
Законы, которые связывают эти параметры и которые мы сейчас рассмотрим, для всех газов очень близки, и их можно считать одинаковыми. Строго говоря, они абсолютно точны для идеального газа, у которого между частицами полностью отсутствует взаимодействие и частицы которого представляют собой материальные точки. Соответственно, применение этих законов к реальным газам называют приближением идеального газа. Каковы эти законы?
1. Закон Авогадро. В одинаковом объеме любого газа при одинаковой температуре и давлении содержится одинаковое количество молекул, т.е.
m/M = const при P,V,T= const для любого газа.
2. Закон Бойля-Мариотта. При постоянной массе газа и постоянной температуре давление газа обратно пропорционально занимаемому им объему, т.е.
Р V= const при Т, m = const
3. Закон Гей-Люссака. При постоянных массе газа и давлении объем, занимаемый газом, прямо пропорционален его температуре, то есть
Const при P , m = const
4. Закон Шарля. При постоянных массе газа и его объеме давление газа прямо пропорционально температуре, то есть
P/T = const при V, m=const
^ 8.4. Уравнение Менделеева-Клапейрона
Объединив последние три закона, легко получить объединенный газовый закон:
P 1 V 1 /T1=P 2 V 2 /T 2 или PV/T=const при m=const Этот закон пока не общий - константа будет разной для одинаковых масс разных газов. Однако если учесть закон Авогадро, связывающий общим свойством все газы, получим, что для любого газа
PV/T=(m/M) const,
Причем теперь константа общая для всех газов. Чему она равна? Экспериментальным путем было установлено, что при нормальных условиях (P = I атм=1,013 10 5 Па, Т= 273 К) один моль любого газа занимает один и тот же объем, а именно 22,4 л. Подставляя эти значения в полученное нами уравнение и учитывая,
M что - - это количество моль, получаем, что значение константы
8,3144 Дж/(моль К). Ее называют универсальной газовой постоянной и обозначают символом R.
Таким образом, мы получили универсальное уравнение, связывающее все параметры, характеризующие состояние газообразного вещества. Оно называется уравнением Менделеева-Клапейрона.
PV =(m/M)RT Используя это уравнение, можно найти любой неизвестный параметр для любого газа, если известны остальные. Рассмотрим два практически важных следствия из этого уравнения.
1. Легко видеть, что при постоянных давлении и температуре плотность газа
р= m/V = const М,
То есть плотность любого газа при одинаковых условиях зависит только от его молекулярной массы. Это позволяет найти молекулярную массу неизвестного газа, если известна его относительная плотность
D= 1 / 2 .
По газу с известной молекулярной массой, ведь
Так, если относительная плотность газа по водороду составляет 22, то его молекулярная масса 44 (углекислый газ). Часто используется относительная плотность по воздуху. При этом молекулярная масса воздуха принимается равной 29.
2. Также легко вывести из уравнения Менделеева-Клапейрона тот I факт, что если реакция с участием газов происходит в замкнутом сосуде при постоянной температуре, то давление в сосуде
Прямо пропорционально общему количеству молей газов.
3. Универсальность свойств газов позволяет ввести понятие средней молекулярной массы для смеси газов (оно часто используется в задачах). Если ввести обозначение
V=m/M - (количество моль), то средняя молекулярная масса:
Поскольку газы в смеси всегда находятся при одинаковых условиях, то к ним применим закон Авогадро, и определение средней молярной массы можно переписать, заменив число молей на объем:

^ 8.5. Закон Авогадро, молярный объем
Поскольку газы являются наиболее простым объектом исследования, то их свойства и реакции между газообразными веществами изучены наиболее полно.
Французский ученый Ж, Л. Гей-Люссак установил закон объемных отношений:

Например, 1 л хлора соединяется с 1 л водорода, образуя 2 л хлороводорода; 2 л оксида серы (IV) соединяются с 1 л кислорода, Образуя 2 л оксида серы (VI).
Этот закон позволил итальянскому ученому А. Авогадро предположить, что молекулы простых газов (водорода, кислорода, азота, хлора и т.д.) состоят из двух одинаковых атомов. При соединении водорода с хлором их молекулы распадаются на атомы; а последние образуют молекулы хлороводорода. Но поскольку из одной молекулы образуются две молекулы хлороводорода, объем последнего должен быть равен сумме объемов исходных газов, т.е.
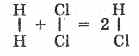
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (Н 2 , Сl 2 , О 2 , N 2 и др.). Это служит, в свою очередь, доказательством двухатомности молекул этих веществ.
Изучение свойств газов позволило А. Авогадро высказать гипотезу, которая впоследствии была подтверждена опытными данными, а потому стала называться законом Авогадро:
Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, т.е. температуре 273 К (0° С) и давлении 101325 Па, масса 1 л водорода равна 0,09 г, молярная масса его равна 1,008 2 = 2,016 г/моль. Тогда объем, занимаемый 1 молем водорода, равен
2,016 г/моль
(2,016 г/моль)/0,09 г/л=22,4 л/моль.
При тех же условиях масса 1 л кислорода 1,429 г; молярная масса 32 г/моль. Тогда объем равен
32 г/моль/1,429 г/л =22,4 л/моль.
Следовательно,

^ 1 Точное значение 22,4135±0,0006 л/моль
Где V m - молярный объем газа (размерность м 3 /моль или л/моль); V - объем вещества системы; n - количество вещества системы. Пример записи: V m газа (н.у.) 22,4 л/моль.
Вспомним, что в 1860 г. на международном съезде химиков в Карлсруэ учение А. Авогадро получило всеобщее признание.
Съезд дал сильный толчок развитию атомно-молекулярного учения. Но особенно бурное развитие оно получило после открытия Д. И. Менделеевым периодического закона химических элементов.
На основании закона Авогадро определяют молярные массы газообразных веществ. Чем больше масса молекул газа, тем больше масса одного и того же объема газа. В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул, а следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
m 1:m 2 = M 1:M 2 ,
Где m 1 - масса определенного объема первого газа; m 2 - масса такого же объема второго газа; M 1 и М 2 - молярные массы первого и второго газов.

M 1 /M 2 =D, отсюда М 1 =DM 2 .
Обычно плотность газа определяют по отношению к самому легкому газу - водороду (обозначают D H2 ). Молярная масса водорода равна 2,016 г/моль или приблизительно 2 г/моль. Поэтому получаем:
М=2 D H2 .
Часто плотность газа определяют по отношению к воздуху (D в). Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она равна 29 г/моль. Среднюю молярную массу воздуха легко вычислить, если учесть, что воздух состоит приблизительно из 4 объемов азота (молярная масса 28 г/моль) и 1 объема кислорода (молярная масса 32 г/моль), т.е. 4N 2 O 2 . Тогда:
(4 28 1 32).(4 1)=28,8 г/моль (округленно 29 г/моль).
В этом случае молярная масса определяется выражением:
М= 29D в.
Определение молярных масс показало, что молекулы простых газов состоят из двух атомов (Н 2 , F 2 , Сl 2 ,O 2 , N 2), а молекулы благородных газов - из одного атома (Не, Ne, Ar, Kr, Xe, Rn). Для благородных газов понятия «молекула» и «атом» равнозначны. Однако молекулы некоторых других простых веществ состоят из трех и более атомов, например молекулы озона О 3 , фосфора Р 4 , паров серы при высоких температурах S 8 .
На основании закона Авогадро осуществляют различные расчеты - вычисление объема, массы, плотности газов при нормальных условиях, молярной массы газообразных веществ, а также относительной плотности газов.
8.6. Жидкости
Жидкое состояние является промежуточным между газообразным и кристаллическим (см. §8.2). По одним свойствам жидкости близки к газам, а по другим - к твердым телам. С газами жидкости сближает прежде всего их изотропность и текучесть; последнее обусловливает способность жидкости легко изменять внешнюю форму. Однако высокая плотность и малая сжимаемость жидкостей приближает их к твердым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жестких сил межмолекулярного взаимодействия. В то же время малая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объем, указывает на присутствие хотя и не жестких, но все же значительных сил взаимодействия между частицами.
Для каждого агрегатного состояния характерно свое отношение между потенциальной и кинетической энергиями частиц вещества. У твердых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твердых телах частицы занимают определенное положение друг относительно друга и лишь колеблются около этих положений. Для газов соотношение энергий обратное, вследствие чего молекулы газа всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объем. В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жестко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объем.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок - число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всем объеме данной жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры. При низких температурах, незначительно превышающих температуру плавления данного вещества, степень: упорядоченности расположения частиц данной жидкости велика. С ростом температуры она падает, и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствие сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твердым телам относятся только вещества в кристаллическом состоянии. Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах, в отличие от обычных жидкостей, частицы имеют незначительную подвижность - такую же, как в кристаллах.
^ 8.7. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные
В твердом состоянии большинство веществ имеет кристаллическое строение. В этом легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствие различного отражения ими света. В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Каждое вещество обычно образует кристаллы определенной формы. Например, хлорид натрия кристаллизуется в форе кубов, квасцы в форме октаэдров, нитрат натрия в форме призм и т.д. Кристаллическая форма - одно из характерных свойств твердых веществ.
Классификация кристаллических форм основана на симметрии кристаллов. Различные случаи симметрии кристаллических многогранников подробно разбираются в курсах кристаллографии.
Многие вещества, в частности железо, медь, алмаз, хлорид натрия, кристаллизуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр. Магний, цинк, лед, кварц кристаллизуются в гексагональной системе. Основная форма этой системы - шестигранная призма и бипирамида.
Тема: Свойства твёрдых тел, жидкостей и газов.
Цель: Закрепить знания о состояниях тел.
Рассмотреть свойства твёрдых тел, жидкостей и газов.
Сформировать представления о деформации, упругости, пластичности.
Ход урока.
Организация учащихся на урок. Какая наука изучает тела, вещества, явления в природе и технике? (Физика).
Что такое тело? Примеры.
Что такое вещество? Примеры.
В каких состояниях могут находиться вещества?
Какие свойства имеют вещества в твёрдом, жидком, газообразном состояниях?
Изучение нового материала.
Мы знаем, что нас окружает множество тел, которые состоят из веществ. Они очень разные. Попробуйте описать свойства воды, сахара, парафина. Почему такие эти вещества такие разные? На этот вопрос нам поможет ответить наука Физика. С чего мы начнём?
Свойства твёрдых тел.
Возьми книгу, попробуй изменить её форму и объём.
Сделай вывод: какими свойствами обладают твёрдые тела?
(Твёрдые тела способны сохранять неизменными форму и объём.)
Свойства жидкостей.
Зафиксируй количество воды в мерном стакане, перелей воду в колбу, затем – обратно в стакан.
Изменился ли объём воды?
Изменялась ли форма жидкости?
Сделай вывод: какими свойствами обладают жидкости?
Запиши результаты своих исследований в таблицу. (Жидкости способны сохранять объём, но не способны сохранять форму.)
Свойства газов.
Надуй воздушный шарик. Какую форму принимает шарик?
Выпусти воздух из шарика. Куда делся воздух?
Изменился ли объём воздуха?
Изменялась ли форма воздуха?
Сделай вывод: какими свойствами обладают газы?
Запиши результаты своих исследований в таблицу. (Газы не сохраняют форму и занимают весь объём, который им предоставлен.)
Рефлексия:
Что общего в свойствах твёрдых тел и жидкостей? В чём их различие?
Что общего в свойствах газов и жидкостей? В чём их различие?
О предмете известно, что он хорошо сохраняет свой объём и форму. В каком состоянии находится вещество, из которого состоит этот предмет? (в твёрдом состоянии.)
Деформация.
Возьмите металлическую полоску и поверните её концы в разные стороны. Что произошло? Изменилась ли форма полоски? (Под действием силы изменилась форма полоски.)
Дайте определение:
Деформация – изменение формы, размеров и объёма тела .
Упругость.
Растяните резиновую ленту, а потом отпустите. Что произошло? (Под действием силы изменилась форма и объём ленты, а после прекращения действия силы лента приняла первоначальный вид.)
Дайте определение:
Упругость – свойство тела изменять форму и объём под действием других тел и восстанавливать их после прекращения действия.
Где применяется свойство упругости? (Пружина в технике.)
Пластичность.
Из кусочков пластилина слепите шарик, затем из шарика – кубик. Изменилась ли форма пластилина?
Положите фигурку на стол. Возвратилась ли первоначальная форма пластилина?
Дайте определение:
Пластичность – свойство тел менять форму под действием других тел и сохранять её после прекращения действия.
Где применяется свойство пластичности материалов? (Керамика – изделия из глины, лепка из пластилина, изготовление свечек их воска или парафина.)
Н ачало формы
Конец формы
Рефлексия: Исследуй свойства воды и заполни таблицу.
|
Состояние воды |
Состояние вещества |
||
|
Сохраняет |
|||
|
Водяной пар |
Не сохраняет |
Домашнее задание. Повторить основные свойства твёрдых тел, жидкостей и газов; найти примеры применения в быту этих свойств.
Все тела состоят из атомов или молекул (частицы вещества), которые беспорядочно двигаются, а также взаимодействуют с силами притяжения и отталкивания. Именно различиями в тепловом движении этих частиц, а также их взаимодействием при разных условиях обуславливается факт существования у вещества нескольких агрегатных состояний: газообразное, жидкое, твёрдое. Особенностям этих состояний посвящён этот урок.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые вращаются вокруг ядра. Атом, как и молекула, электрически нейтрален.
Рассмотрим силу взаимодействия между частицами на примере двух неподвижных молекул.
Между телами в природе существуют гравитационные и электромагнитные силы. Так как массы молекул крайне малы, то силы гравитационного взаимодействия между ними можно не рассматривать. На больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
При уменьшении расстояния между частицами (см. Рис. 1) они начинают ориентироваться так, что их обращённые друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются при этом нейтральными), и, в итоге, между молекулами возникают силы притяжения (максимальная сила притяжения на расстоянии 2-3 диаметров молекулы). При уменьшении расстояния между молекулами возникают силы отталкивания как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул. Следовательно, на молекулу действует сумма сил: притяжения и отталкивания (на больших расстояниях преобладает сила притяжения, на малых - сила отталкивания).
Рис. 1. Взаимодействие между молекулами
На рисунке 2 изображён график зависимости силы взаимодействия между молекулами от расстояния между ними. Красной линией показана сила притяжения, синей линией - сила отталкивания, зелёной линией - итоговый график сил. Величина - это такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания (положение устойчивого равновесия).
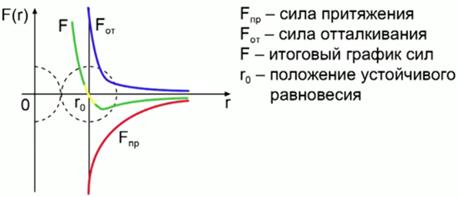
Рис. 2. График зависимости силы взаимодействия между молекулами в зависимости от расстояния между ними
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией. В положении устойчивого равновесия потенциальная энергия молекул минимальна. В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину их минимальной потенциальной энергии. Кроме того, все молекулы вещества находятся в непрерывном движении, то есть обладают кинетической энергией. Таким образом, структура вещества и его свойства (твёрдых, жидких, газообразных тел) определяется соотношением между минимальной потенциальной энергией взаимодействия молекул и их запасом кинетической энергии теплового движения.
Среднее расстояние между частицами газа намного превышает размеры самих частиц, таким образом, в промежутках между столкновениями частицы газа проходят расстояния, на несколько порядков превышающие собственные размеры. Например, в воздухе (при нормальных условиях) длина свободного пробега молекулы составляет , что в тысячу раз больше среднего размера молекулы.
При таких больших расстояниях между молекулами силы межмолекулярного взаимодействия между ними очень малы. С энергетической точки зрения это означает, что потенциальной энергией взаимодействия молекул (по сравнению с кинетической энергией их движения) можно пренебречь.
Если рассматривать кинетическую энергию, то есть движение молекул газа, то стоит отметить, что каждая из них участвует не только в поступательном, но и во вращательном движении (если это не одноатомный газ), а если учитывать очень малое взаимодействие молекул газа, то эти молекулы будут принимать участие и в колебательном движении (см. Рис. 3).
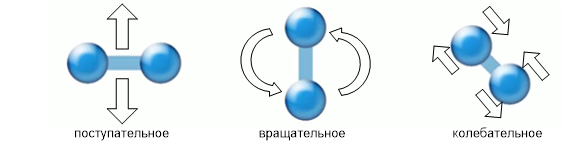
Рис. 3. Виды движений молекул
Таким образом, любая молекула газа, не испытывая сильного взаимодействия с соседними, может оказаться в произвольном месте сосуда в любой момент времени, поэтому говорят, что газы не сохраняют ни форму, ни объём. Такое свойство газов широко используется в современной технике (пневматическое оборудование, тепловые двигатели и т. д.).
Твёрдые тела являются полной противоположностью газам. В них не происходит свободного передвижения частиц. Молекулы находятся в узлах кристаллической решётки (см. Рис. 4). То есть существует строгий периодический порядок в расположении частиц, составляющих твёрдое тело.
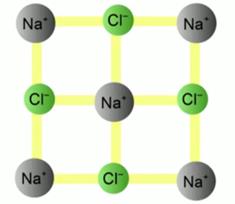
Рис. 4. Кристаллическая решётка NaCl (поваренная соль)
В твёрдых телах потенциальная энергия взаимодействия очень существенна, кинетическая энергия, по сравнению с потенциальной, не велика. Атомы, молекулы или ионы совершают лишь колебательные движения возле положения равновесия. Расстояния между соседними частицами примерно равны размерам самих частиц.
Виды кристаллических решёток отличаются в зависимости от вещества (главное - это периодичность и порядок). Точки пространства, в которых находятся частицы твёрдого тела, называются узлами кристаллической решётки.
Из-за стабильности и порядка в расположении частиц в узлах кристаллической решётки, физики говорят, что твёрдые тела обладают дальним и ближним порядками в расположении частиц вещества (см. далее).
Твёрдые тела сохраняют форму и объём (для примера, если подвергнуть пружинку деформации, она вернётся к предыдущей форме, не изменив при этом объём).
Каждую молекулу жидкости, хотя они не расположены так строго и упорядоченно, как в твёрдом теле, окружает одинаковое число молекул-«соседок» (см. Рис. 5). Но если посмотреть на молекулы жидкости издалека, то ни о каком порядке в жидкости речь идти не может, будем наблюдать хаос. Поэтому говорят, что в твёрдых телах есть ближний порядок и дальний порядок, а в жидкости только ближний порядок. В газообразных телах отсутствуют и ближний, и дальний порядок.

Рис. 5. Дальний и ближний порядок в расположении частиц вещества
Жидкости, в отличие от твёрдых тел, обладают ближним порядком в расположении частиц вещества.
Частицы в жидких телах «упакованы» плотно и, как в твёрдых телах, совершают колебания около положения равновесия. Попытка сжать жидкость быстро приводит к деформации молекул и встречает мощное сопротивление со стороны жидкости. То есть жидкости практически не сжимаемы.
Хотя молекулы жидкости расположены почти так же, как в твёрдом теле, жидкость обладает текучестью. Это объясняется тем, что, в отличие от твёрдого тела, колебания молекул около положения равновесия в жидкости не вечны, в какой-то момент времени молекула совершает «скачок», переходя в другое положение. Следовательно, жидкость хорошо сохраняет объём, но не сохраняет форму.
С энергетической точки зрения жидкость занимает промежуточное положение между твёрдым телом и газом - частицы жидкости обладают существенной на микроскопическом уровне, как кинетической энергией движения, так и потенциальной энергией взаимодействия.
Аморфное состояние тела называют промежуточным между твёрдым и жидким. Примером такого вещества является пластилин, смола, стекло.
Молекулы в аморфных веществах расположены подобно молекулам в жидкости, то есть обладают ближним порядком, но не обладают дальним порядком.
Можно с определённой долей условности назвать аморфные тела очень вязкими жидкостями. Убедиться в этом можно, если посмотреть на профиль оконных стёкол в старинных замках. Вверху эти стёкла гораздо уже, чем внизу - стекло за многие годы «стекает» вниз (см. Рис. 6), при этом не изменяя своего внутреннего строения. Ведь, например, ледники также могут стекать вниз. Но это связано с таянием ледника и дальнейшей кристаллизацией воды.

Рис. 6. Профиль оконного стекла в старинном замке
В твёрдых телах частицы обладают существенной потенциальной энергией и относительно небольшой кинетической энергией, так как они совершают колебательные движения вблизи положения равновесия.
Промежуточное положение занимают жидкости, так как частицы жидкости обладают существенной как кинетической энергией движения, так и потенциальной энергией взаимодействия, а в газах молекулы обладают большой кинетической энергией движения и сравнительно малой (пренебрежимо малой) потенциальной энергией взаимодействия.
Список литературы
- Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика 10. - М.: Просвещение, 2008.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. - М.: Дрофа, 2010.
- Class-fizika.spb.ru ().
- Kaf-fiz-1586.narod.ru ().
- Презентация ().
- Вопросы (1-4) в конце параграфа 47 (стр. 229); Касьянов В.А. Физика 10 класс (см. список рекомендованной литературы) ().
- Чем отличаются траектории движения молекул газа, жидкости и твёрдого тела?
- При сильном охлаждении воздуха его можно сделать жидким. При этом объем, который занимает воздух, уменьшается почти в 700 раз. Сделайте вывод из этого факта: какую долю объема газа составляет объем самих молекул?
- Газ способен к неограниченному расширению. Почему существует атмосфера Земли?
Физические свойства жидкостей, газов и твердых тел.
Чтобы лучше разобраться с понятием твердых, жидких и газообразных сплошных сред, рассмотрим свойства чистых (постоянного химического состава) материалов. В качестве примера возьмем воду. Из физики известно, что чистые вещества могут находиться в четырех агрегатных состояниях: кристаллическом, жидком, газообразном и плазменным. Ниже для иллюстрации приведена фазовая диаграмма для воды.
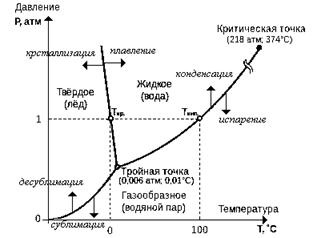 Рис.1.1. Фазовая диаграмма воды.
Рис.1.1. Фазовая диаграмма воды.
|
Физические свойства материалов определяются их межмолекулярным (межатомным) взаимодействием. При низких температурах (малых энергиях) имеет место кристаллическая структура молекулы или атомы жестко связаны между собой и колеблются около центров кристаллической решетки, а среда принято называть кристаллической . В физике принято говорить, что имеет место дальний порядок . При этом в самой решетке могут присутствовать ее нарушения – дислокации, вакансии (отсутствие атома в узле решетки) и т.д. Нас в первую очередь будет интересовать вопрос об изменении характеристик сплошной среды под действием сил.
Деформация (от лат. defoгmatio - ʼʼискажениеʼʼ) - изменение взаимного положения частиц тела, связанное с их перемещением относительно друг друга. Деформация представляет собой результат изменения межатомных расстояний и перегруппировки блоков атомов.
Для деформации кристалла требуется приложить к нему большие усилия, в связи с этим кристаллические (твердые) тела считаются несжимаемыми. Рассмотрим стержень из твердого материала, постоянного поперечного сечения, к концам которого приложено напряжение (рис. 1.2.). Линейную деформацию можно описать безразмерной величиной
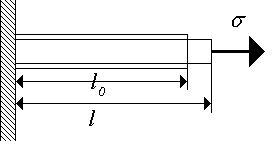 Рис. 1.2. Растягивающая деформация стержня.
Рис. 1.2. Растягивающая деформация стержня.
|
Ниже (рис.1.3.) приведены диаграммы зависимости напряжения от линейной деформации .

Рис. 1.3. Диаграммы растяжения для обобщенного материала.
Для большинства твердых материалов имеет место линейный участок, пока напряжение не превышает значения - предела пропорциональности . В этой области справедлив закон Гука. Для этого участка деформация обратима – после снятия нагрузки деформация исчезает, такая деформация принято называть упругой - . За ним следует участок с нелинейной зависимостью , при этом имеет место остаточная деформация (пластическая ) , которая образуется после снятия нагрузки. При этом ряд материалов имеет четко выраженную площадку текучести (образец продолжает деформироваться и при постоянной нагрузке рис. 1.3.а), а ряд материалов – нет (рис.1.3.б). Для первых материалов вводится значение - предел текучести, для вторых вводится условный предел текучести – напряжение при котором пластическая деформация, после снятия нагрузки, составляет 0,2% или 0,002. В первом случае участок - участок пластической деформации, участок - участок текучести. Отметим, что течение материала происходит равномерно по всей длине стержня.
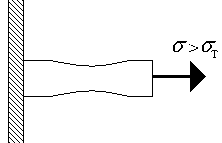 Рис.1.4. Образование шейки.
Рис.1.4. Образование шейки.
|
Дальнейшее увеличение нагрузки приводит к неравномерности распределения деформации по длине стержня (рис. 1.4) - в некотором месте можно заметить образование шейки (рис.1.4.). Деформация материала в точке А (рис.1.3.а) также состоит из пластической и упругой . Дальнейшее увеличение нагрузки приводит к разрушению материала при достижении - предела прочности.
Напряжение, ĸᴏᴛᴏᴩᴏᴇ данный материал может выдержать на практике, не разрушаясь и не получая опасной деформации, называют допустимым и обозначают . Обычно , и все расчёты проводят на базе законов Гука. Чтобы обеспечить прочность при всех обстоятельствах допустимое напряжение выбирается как часть предела прочности, в частности, для металлов [s] = 0.2s м, а для дерева [s] = 0.1s м. Следует отметить, что наибольшие деформации, которые может выдержать материал, не определяются протяженностью области текучести. В случае если область текучести велика, то материал принято называть пластичным . Такой материал, как сталь, способен выдерживать большие нагрузки без разрушения. Наоборот, в случае если область текучести невелика, то данный материал хрупок. Хрупкие материалы, как к примеру чугун, разрушаются при деформациях . В ряде случаев пластичные материалы могут разрушаться и при малых деформациях (к примеру, сталь при низких температурах). Прочностные характеристики твердых материалов существенным зависят от температуры материала.
С повышение энергии количество нарушений кристаллической решетки растет, причем данный процесс идет в динамике (где то они исчезают, а где то снова образуются). По достижению некоторого энергетического порога упругость пропадает. В этом случае имеет место ближний порядок , а такой материал принято называть жидким . Среднее характерное расстояние между молекулами (атомами) жидкости и кристалла тела примерно одинаковы и равны ʼʼ (3¸4)10 -6 м. Так же примерно одинаковы и плотности жидкой и кристаллической фаз. Так плотность воды , плотность бензинов , керосинов - , дизельных топлив - , нефтей . При этом, жидкость вследствие разрыва связей приобретает новое свойство текучесть - способность деформироваться под действием сколь угодно малых внешних воздействий, до тех пор пока внутренние касательные напряжения не станут равными нулю. С повышением температуры текучесть тела увеличивается . При этом жидкость, как и твердое тело – несжимаема (плотность остается практически неизменной). Дальнейшее повышение температуры приводит к полному разрыву связей (отсутствию ближнего порядка). Материал в таком состоянии принято называть газом . Для газообразных тел характерной особенностью является хаотическое движение и столкновение молекул в пространстве. По этой причине газы обладают не только текучестью, но и сжимаемостью .
Рассмотрим сосуд, заполненный жидкостью, с площадью основания и вертикальными стенками. Приложим силу и увеличим давление в объёме на величину Dp (рис.1.5). Сплошная среда при этом сожмётся, уменьшив свой объём на величину . Эмпирически получено, что связь между изменением объёма и давлением линейна, ᴛ.ᴇ. для каждой жидкости можно ввести константу, которую называют коэффициентом объёмного расширения (при постоянной температуре):
 .
(1.3.2)
.
(1.3.2)
Коэффициент объёмного сжатия имеет размерность (Па) -1 . Знак минус показывает, что объём уменьшается под действием сжатия.
Модулем объёмной упругости принято называть величина, обратная :
Обе эти величины зависят от температуры и вида жидкости.Модуль объёмной упругости для воды при Т = 293°К равен = 2×10 9 Па ʼʼ20000 кгс/см 2 .
В случае если на воду помимо атмосферного давления (р а =101325 Па или 1.033 кгс/см 2), будет дополнительно действовать такое же давление, то объём воды уменьшится приблизительно на 1/20000, ᴛ.ᴇ. практически это заметить невозможно. Следовательно, воду и другие жидкости можно считать несжимаемыми и принимать их плотность постоянной (r = const), не зависящей от давления. Для большинства жидкостей с повышением температуры плотность падает, исключением является вода плотность которой имеет максимум при 4 о С. По аналогии с (1.3.2) можно ввести коэффициент объёмного теплового расширения
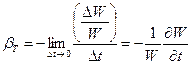 ,
,
тогда плотность жидкости должна быть рассчитана по формуле:
здесь плотность при стандартных условиях (), - температура в градусах Цельсия.
Как уже было отмечено выше, основное отличие газа от жидкости состоит по сути в том, что газ легко сжимается. В нём скорость распространения звука (а следовательно и всех механических возмущений) значительно меньше, чем в жидкости. Эта особенность газа должна учитываться, когда скорость движения (или скорость движения в нём твёрдого тела) становится соизмеримой со скоростью звука или превышает её.
В отличие от газа жидкость имеет четко выраженную граничную поверхность между ней и окружающим её газом, которая принято называть свободной поверхностью. В поле сил тяжести свободная поверхность жидкости имеет горизонтальный профиль. В условиях невесомости, благодаря поверхностному натяжению, свободная поверхность сферична. Это свойство жидкости, как и её малая сжимаемость, обусловлено постоянным взаимодействием соседних молекул. В газе молекулы взаимодействуют друг с другом только в момент столкновения, большую часть времени они свободно движутся в пространстве, в связи с этим вследствие хаотичности движения газ стремится равномерно распределиться по всей замкнутой части пространства. В случае если пространство не замкнуто, то объём газа может неограниченно возрастать.
В газе можно неограниченно уменьшать давление и повышать температуру, и при этом свойства газа будут меняться непрерывно. В жидкости давление может уменьшаться до некоторого значения, ниже которого начинается образование внутри неё газовых пузырьков, и начинаются фазовые переходы, которые качественно меняют свойства текучей среды. То же самое может происходить и при повышении температуры жидкости. Уравнение состояния . В МСС часто используется двухпараметрическая или простая среда. То есть среда, все термодинамические параметры которой бывают вычислены через два, посредством соотношений называемых уравнениями состояния .
Уравнения состояния бывают двух типов.
Термическое уравнение состояния
Калорическое уравнение состояния
Здесь - удельная (отнесенная к единице массы) внутренняя энергия.
Для газа можно достаточно эффективно использовать модель газа, описываемого термическим уравнением состояния Клайперона - Менделеева:
где Г – газовая постоянная, такой газ принято называть совершенным или (термически совершенным .
, Г o =8,3144 Дж/(моль×К) – универсальная газовая постоянная.
Молярная масса газа, =кг/моль.
Часто используется уравнение состояния Ван-Дер-Ваальса, ĸᴏᴛᴏᴩᴏᴇ справедливо в более широком диапазоне температур и давлений:
Коэффициенты в уравнении Ван-Дер-Вальса
Отметим так же, что уравнение Ван-Дер-Вальса, используется и для описания жидкостей, но в обычных условиях оно дает только качественное описание.
Для капельных жидкостей, сжимаемость для которых чрезвычайно мала, в большом диапазоне изменения давления связь между плотностью и давлением линейна:
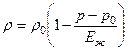 ,
,
Где - плотность, соответствующая давлению - модуль объёмного сжатия, порядок которого равен 10 4 МПа.
Для больших давлений и температур предпочтительней двучленное уравнение состояния:
![]()
Так для воды используются следующие значения определяющих констант: ![]()
Для адиабатического процесса (когда отсутствует тепло и массообмен между выделенным объёмом газа и окружающей средой) характерна следующая зависимость:
где - адиабатическая постоянная газа (показатель адиабаты); с v - теплоёмкость газа при постоянном объёме; с р - то же при постоянном давлении. Такой газ принято называть термически и калорически совершенным или политропным .
Вязкость жидкостей и газов . Реологические свойства жидкостей . Вязкостью принято называть свойство текучей среды, ĸᴏᴛᴏᴩᴏᴇ состоит в возникновении в ней внутренних сил, препятствующих её деформации, ᴛ.ᴇ. изменению относительного положения её частей. Рассмотрим частный случай молекулярно-кинетической теории идеального газа - простое сдвиговое течение (рис.1.6).
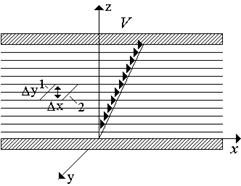 Рис.1.6. Вязкие напряжения в жидкостях и газах
Рис.1.6. Вязкие напряжения в жидкостях и газах
|
Элементарная площадка поверхности, разделяющей слои 1 и 2, движется вместе с жидкостью. При этом слой жидкости 1 скользит по слою 2 с относительной скоростью . Молекулы газа участвуют в движениях двух видов:
1. упорядоченном (продольном) со скоростью ;
2. хаотическом, неупорядоченном тепловом движении, скорость которого обычно на два порядка выше скорости упорядоченного движения.
Вязкость газа обусловлена переносом молекулами при их тепловом движении (диффузии) через элементарную площадку , лежащую в плоскости, которая разделяет два слоя, имеющие различные продольные скорости и , количества движения, обусловленного разностью скоростей этих слоев. Молекулы движутся хаотически беспорядочно, при этом они переходят из одного слоя в другой, пересекая площадку . Молекулы, имеющие упорядоченную скорость , переходят в слой 2 и замедляют его движение, а такое же количество молекул, попавшее в слой 1 из слоя 2, ускоряет слой 1. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, вязкость среды проявляет себя только при движении среды.
Важно заметить, что для сплошной среды, считают, что на площадке действует касательное напряжение, компенсирующее перенос количества движения, обусловленный тепловым движением молекул. Согласно молекулярно-кинетической теории это касательное напряжение
![]() (1.3.6)
(1.3.6)
где h - динамический коэффициент вязкости (динамическая вязкость) газа. Ее значение определяется физическими свойствами среды. Знак напряжения таков, как будто оно "пытается" уменьшить разность скоростей слоев.
Зависимость (1.3.6) справедлива для большинства газов и жидкостей и принято называть законом Ньютона для вязких напряжений. В отличие от закона для сухого трения сдвиговое касательное напряжение не зависит от нормального напряжения.
Согласно определению (1.3.6) динамический коэффициент вязкости h в системе СИ имеет следующую единицу измерения:

На практике иногда в качестве единицы h используют П = г/см×с, которая называется пуаз (в честь французского врача А. Пуазейля, выполнившего фундаментальные исследования движения вязкой жидкости) : Па×с = 10×П.
Стоит сказать, что для несжимаемых сред () целесообразно использовать величину
![]() . (1.3.7)
. (1.3.7)
называемую кинематическим коэффициентом вязкости (кинематической вязкостью ). На практике часто для используется величина Ст = см 2 /с, которая принято называть стокс (в честь английского гидромеханика Дж. Стокса, который сформулировал дифференциальные уравнения движения вязкой жидкости): 1Ст = 10 -4 м 2 /с.
Для измерения вязкости используют приборы называемые визкозиметры .
Для прозрачных жидкостей используется визкозиометр Стокса – высокий стакан с делениями, в которых сверху вводят мелкие шарики из вещества с плотность близкой к плотности жидкости и замеряют скорость падения шарика. Так как вес, сила Архимеда и сила сопротивления , для малых скоростей движения известны, а шарик движется равномерно, то коэффициент вязкости легко вычисляется.
Стоит сказать, что для непрозрачных жидкостей используют Энглера, с помощью которого определяют условную вязкость, которая измеряется в о Е – градусах Энглера. Число градусов Энглера определяется отношением времени истечения испытуемой жидкости при данной температуре из вискозиметра ко времени истечения дистиллированной воды из того же прибора при нормальной температуре (20 °C). Перевод градусов Энглера в единицы кинематической вязкости (стоксы) производится по эмпирической формуле Убеллоде:
![]() . (1.3.8)
. (1.3.8)
В табл. 1.1 приведены значения h, r, n для некоторых жидкостей и газов, а на рис.1.7 зависимость для воды и воздуха от температуры.
Таблица 1.1
Значения h, r, n для некоторых жидкостей и газов

Рис.1.7. Зависимость коэффициента кинематической вязкости от температуры.
Из приведенных данных следует, что вязкость воды уменьшается с увеличением температуры от 0 до 100° Спочти в семь раз, а вязкость воздуха возрастает с увеличением температуры от 20 до 50°С на 25%. Отметим, что в газах вязкость и диффузия обусловлены одним и тем же физическим механизмом - тепловым хаотическим движением молекул. По этой причине коэффициент кинематической вязкости n имеет один порядок величины с коэффициентом молекулярной диффузии. В жидкостях вязкость и диффузия имеют различную физическую природу. Как следствие этого коэффициент диффузии в жидкости в сотни раз меньше коэффициента вязкости .
С увеличением температуры в газе скорость хаотического движения молекул возрастает, что приводит к увеличению количества молекул, пересекающих в единицу времени площадку , и следовательно, увеличивается и перенос количества движения из одного слоя в другой и, соответственно, касательное напряжение . Согласно (1.3.6) это означает, что с увеличением температуры динамический коэффициент вязкости газа возрастает.
В жидкости основной причиной переноса количества движения является взаимодействие молекул, расположенных по разные стороны границы между слоями, а не перенос молекул через эту границу. По этой причине, с увеличением температуры динамический коэффициент вязкости жидкости уменьшается (в отличие от газов).
Для расчетов в инженерной практике пользуются ориентировочным значением кинематического коэффициента вязкости воды n = 0,01 см 2 /с = 0,01 Ст.
При этом существует много жидкостей, для которых закон Ньютона не выполняется. Такие жидкости называются неньютоновскими
, а наука о характере зависимости ![]() принято называть реологией (греч. reo - течь, logos - учение). Более подробно их свойства будут рассмотрены позднее в 4-ой главе.
принято называть реологией (греч. reo - течь, logos - учение). Более подробно их свойства будут рассмотрены позднее в 4-ой главе.
Молекулы, находящиеся на границе раздела сред, либо притягиваются, либо отталкиваются соседней средой. Вследствие этого на искривлённой поверхности раздела сред должны возникать растягивающие усилия, стремящиеся выпрямить границу раздела.
Растягивающие напряжение (сила на единицу длины) принято называть коэффициентом поверхностного натяжения . Для границы воды и воздуха (свободной поверхности) при Т = 293 К° = 72,8∙10-3 Н/м. Коэффициент поверхностного натяжения падает с ростом температуры и практически не зависит от давления. Поверхностное натяжение должна быть снижено с помощью поверхностно-активных веществ (ПАВ), к числу которых относятся моющие средства. Наиболее четко данное свойство жидкостей проявляется на границе раздела трех сред (газ, жидкость, твердое тело). Различают смачивающие и несмачивающиеся жидкости рис.16. Угол - принято называть углом смачивания.
Рис. 1.8. Смачивающая и несмачивающая жидкости.
Перепад давления, создаваемый поверхностными силами на криволинейной поверхности, должна быть вычислен по формуле Лапласа
 , (1.3.9)
, (1.3.9)
где - главные кривизны поверхности. Важно заметить, что для сферических образований (капля, пузырь, шар) формула принимает вид:
Здесь - радиус сферического образования.
Для воды справедлива зависимость:
![]() ,
,
Здесь - температура в градусах Цельсия.
Подводя итоги, напомним, что МСС оперирует с моделями сплошной среды. В таблице 1. приведены основные характеристики трех базовых моделей.
Таблица 1. Основные характеристики моделей сплошных сред.
Использование какой-либо модели для описания характеристик реальной среды, определяется условиями, в которых находится данная среда. Так, к примеру, в случае если скорость газа мала (число Маха, равное отношению скорости к скорости звука, меньше 0,2) газ можно считать несжимаемой жидкостью.
Стекло обычно описывается как твердое деформируемое тело, но с физической точки зрения является жидкостью с аномально высокой вязкостью. Жидкости, при высоких давлениях и температурах, к примеру взрыве или на большой глубине, становится сжимаемой.
Обратим еще раз внимание на рис.1.1. Из него следует, что одно и тоже вещество исходя из условий (давления и температуры) может находиться в различных агрегатных состояниях. Изменение агрегатного состояния всегда сопровождается изменением энергии системы (фазовые переходы первого рода). Данная диаграмма и ей подобные, отвечают случаю равновесных процессов для химически однородных веществ. На практике это не всегда выполняется. Так жидкость, подвергающаяся нагреву, может переходить в пар при кипении, в данном случае новая фаза образуется в виде пузырьков либо на нагреваемой поверхности сосуда, либо в самой жидкости. Аналогичным образом, при резком падении давления в жидкости в ней образуются паровые пузырьки, данное явление носит название кавитация (от лат. cavita - пустота) . В дальнейшем пузырьки перемещаются в область с повышенным давлением и схлопываются, с образованием ударной волны, что приводит к разрушению обтекаемых жидкостью твердых поверхностей.
В средах, состоящих из нескольких веществ, фазовые переходы имеют свою специфику. Так в газовых смесях (воздух, природный газ), конденсация идет для различных компонент при различных давлениях и температурах. Это свойство используется для отделения какой-либо газовой фракции.
Для различных жидкостей растворимость газов различна и изменяется с увеличением давления.
Относительный объём газа, растворенный в жидкости до ее полного насыщения, можно считать прямо пропорциональным давлению:
где - объём растворенного газа, - объём жидкости, - конечное и начальное давления газа, - коэффициент растворимости. Коэффициент растворимости воздуха k имеет следующие значения при t = 20 °С:
– для воды k = 0,016;
– для керосина k = 0,127;
– для трансформаторного масла k = 0,083;
– для индустриального масла k = 0,076.
При понижении давления в жидкости происходит выделение растворенного в ней газа, причем газ выделяется из жидкости интенсивнее, чем растворяется в ней.
1.4. Методы описания движения сплошной среды. Локальная и субстанциональная производная.
Движение - неотъемлемое свойство материи, в связи с этим в окружающем нас мире мы постоянно сталкиваемся с различными видами движения, в т.ч. и движением различных сред. Так в нефтегазовом деле приходится сталкиваться с движением жидкостей и газа по трубам и внутри различных машин и механизмов; с фильтрацией фильтрацию жидкостей и газов через пористую среду; с деформацией различного рода конструкций (баков, резервуаров, заслонок и т.д.), геологическими сдвигами. По этой причине немаловажно знать законы взаимодействия жидкости и газа с границами потока (особенно законы сопротивления труб, пропускных устройств, сужений, сопел), неравномерностью распределения скоростных потоков, законами фильтрацию жидкостей и газов через пористую среду, равновесие жидкостей и тел, плавающих на поверхности жидкости, распространением волн и вибраций в твёрдых и жидких телах.
Задача кинематики - описание движения среды независимо от внешних условий, которые инициируют и поддерживают движение. К кинематическим характеристикам относятся координаты частицы, скорость, ускорение. Существует два подхода к описанию движения сплошной среды. По методу Лагранжа рассматривается движение каждой частицы жидкости.
Рассмотрим движение частицы в некоторой определённой системе прямоугольных и прямолинейных координат Oxyz
, которую условимся называть неподвижной (системой наблюдателя). Пусть в начальный момент времени частица занимает положение с координатами . В этом случае, для описания полного движения точки крайне важно знать уравнение её движения ᴛ.ᴇ. ![]() , где - радиус-вектор точки.
, где - радиус-вектор точки.
Кривая, описываемая последовательными положениями движущейся точки, принято называть траекторией .
Движение точки определено, в случае если заданы её координаты x, y, z, как непрерывные функции времени t:
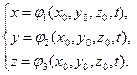 (1.4.1)
(1.4.1)
Эти уравнения определяют положение движущейся частицы в каждый момент времени t и представляют в параметрической форме уравнение траектории. Переменные , называются переменными Лагранжа . Лагранжевы координаты - это параметры, которые характеризуют каждую точку среды и не меняются в процессе движения частицы. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, точка зрения Лагранжа опирается на описание истории движения каждой точки сплошной среды в отдельности.
Скорость движущейся точки равна производной по времени от радиуса-вектора движущейся частицы и представляет собой вектор с проекциями:
Геометрической точке исходя из времени. По этой причине поле скорости задаются как функция геометрических координат и времени:
![]() (1.4.4)
(1.4.4)
Линией тока принято называть линия, касательная к которой в каждый момент времени совпадает с направлением вектора скорости. Следовательно, уравнение линий тока имеет вид:
Характеристики сплошной среды (поле скорости, поле давлений, поле напряжений и т.п.), отнесённые к фиксированным неподвижным элементам геометрического пространства (точкам, линиям, поверхностям, объёмам), и сами эти элементы называют эйлеровыми переменными .
Для метода Эйлера скорость есть функция как координат, так и времени. По этой причине ускорение, а также другие гидромеханические величины, которые меняются вместе с движением объёма жидкости, выражаются через специальный вид производной, которая определённым образом связана с полем скорости. Вместе с тем эта производная должна быть связана с движением частиц жидкости или газа (субстанции). Такую производную называют полной или субстанциальной
Урок №41 7 кл
ТЕМА:Свойства газов. жидкостей и твердых тел
Цель урока: Сформировать представления о строении вещества в различных агрегатных состояниях. Объяснить с точки зрения молекулярной теории характерные особенности внутреннего строения веществ в газообразном, жидком и твердом состояниях.
Задачи урока:
Обучающая: Развитие знаний о механических свойствах твердых тел, жидкостей и газов на основе представлений о молекулярном строении вещества.
Развивающая: Продолжить формирование умений устанавливать причинно-следственные связи между фактами, явлениями и причинами, их вызвавшими, выдвигать гипотезы, их обосновывать и проверять достоверность.
Воспитывающая: Продолжить формирование познавательного интереса к предмету «Физика»
Тип урока: изучение нового материала
ХОД УРОКА
I. Организационная часть (приветствие, проверка готовности к уроку, эмоционального настроя)
Здравствуйте, ребята! Сегодня мы продолжим открывать страницы в познании окружающего нас мира. Впереди нас ждут интересные открытия. Готовы? Да! Тогда приступим…
II. Целеполагание и мотивация
Человек издавна пытался объяснить явления, происходящие в природе, познать не только слышимое, но и неслышимое, не только видимое, но и не видимое.
На какие три группы можно разделить следующие вещества: вода, камень, воздух, олово, спирт, сахар, природный газ, лед, кислород, растительное масло, алюминий, молоко, азот (данные вещества даны при комнатной температуре).
Вы разделили вещества на три группы: твердые, жидкие и газообразные. Многие из них мы привыкли видеть в каком-либо одном состоянии. Например, железо – в твердом, растительное масло – в жидком, водород – в газообразном. Однако есть и такие, которые в нашей жизни встречаются сразу в трех состояниях, КАКИЕ? например, вода: твердое состояние воды – лед, жидкое – вода, газообразное – водяной пар. Давайте попробуем разобраться, чем эти вещества отличаются друг от друга.
Как, по вашему мнению может звучать тема нашего урока?
Тема нашего сегодняшнего урока
« Свойства газов. жидкостей и твердых тел » .- запись в тетради
Как вы думаете, какая цель будет стоять перед нами на этом уроке?
Цель, которую мы ставим сегодня перед собой: выяснить какими свойствами обладают твёрдые тел, жидкости и газы, объяснить эти свойства на основе знаний о различиях в расположении, движении и притяжении молекул.
Запись на доске (цель для учащихся)
Свойства твердых, жидких и газообразных тел
Расположение молекул в твердых, жидких и газообразных телах
Движение молекул в твердых, жидких и газообразных телах
Взаимодействие молекул твердых, жидких и газообразных телах
III. Первичное усвоение новых знаний
Чтобы систематизировать наши полученные знания о строении вещества, свойствах тел в разных агрегатных состояниях, заполним таблицу: (бланк у детей на столе)
Задания для исследовательской работы
Задание 1: «Исследование свойств газов». Оборудование: воздушный шарик, медицинский шприц Проведите эксперимент и ответьте на вопросы:
1. Надуйте шарик. Какую часть шарика заполняет воздух? Какова форма газа?
2. Сожмите шарик рукой (измените его форму). Сохранился ли объём воздуха? Сохранилась ли его форма?
3. Заполните шприц воздухом, вытягивая поршень. Закройте отверстие пальцем и попробуйте его сжать. Легко ли сжать газ?
Задание 2: «Исследование свойств жидкостей». Оборудование: сосуд с водой, мензурка, 2-3 сосуда разной формы, медицинский шприц. Проведите эксперимент и ответьте на вопросы:
1. Измерьте объём жидкости с помощью мензурки?
2. Переливайте воду в сосуды разной формы? Какую часть сосуда заполняет жидкость? Сохраняет ли жидкость свою форму?
3. Вновь измерьте объём жидкости. Изменился ли её объём?
4. Заполните шприц водой. Закройте отверстие пальцем и попробуйте её сжать. Легко ли сжать жидкость?
Задание 3: «Исследование свойств твердых тел». Оборудование: набор твердых тел из разного вещества (металла, дерева, пластмассы и т.д.) Проведите эксперимент и ответьте на вопросы: Имеют ли твердые тела свою форму? 2. Сохраняют ли они свой объём?
3. Попробуйте сдавить тело рукой. Легко ли его сжать?
По результатам исследовательской работы заполняем таблицу
Не имеет формыНе сохраняет объем
Сжимаем
Не имеет формы
Сохраняет объём
Не сжимаема
Текуча
Сохраняет форму
Сохраняет объем
Не сжимаемо
Расположение молекул
На большом расстоянии друг от друга, хаотично
Плотно упакованы, т.е. на небольшом расстоянии друг от друга
Упорядоченно, образуя кристаллическую решётку
Характер движения молекул
Движутся свободно по всему объему
Колеблются на месте, перескакивая с места на место
Колеблются на месте, около одного положения равновесия
Взаимодействие молекул
Слабое
Сильное
Очень сильное
Какие свойства твёрдых тел вам известны? Сохраняют форму и объём
Какие свойства жидкостей вы знаете? Сохраняют объём, но легко меняют свою форму
Какие свойства газов вам известны? Не сохраняют форму и объём Свойства твердых тел.
В каком состоянии находятся окружающие нас тела – парты, книги, тетради? (твердом)
Рассмотрим несколько твердых тел.
Какую форму они имеют? (правильную, параллелепипеда, цилиндра)
Попробуем изменить их форму: сжать или растянуть. Легко это сделать? (Нет.)
Можем мы определить объем твердых тел? Определим объем параллелепипеда.
Вывод: Твердые тела сохраняют форму и имеют объем. (Запись вывода на доске и в таблице).
Свойства жидкостей.
Теперь определим свойства жидкостей. Мы можем перелить её в различные сосуды. (Учитель переливает воду в сосуды различной формы, первый и последний раз в мензурки, для определения объема)
Что происходит с формой жидкости? (она меняется)
Какую форму принимает каждый раз жидкость? (форму сосуда)
Изменился ли при этом объем жидкости? (нет)
Вывод: жидкость легко меняет форму, но сохраняет объем. (Запись вывода на доске и в таблице). Эти свойства жидкости применяют при изготовлении изделий из стекла.
Свойства газов.
Выясним, какими свойствами обладают газы. Опыт с резиновым шариком: перевязывают шарик посредине ниткой, надувают одну половину воздухом, затем разрезают нить. Воздух занимает весь шарик.
Итак, газы занимают весь предоставленный объем. Теперь пробуем сжать шарик. Это нам легко удалось.
Что можем сказать о свойствах газов?
Вывод: Газ занимает весь предоставленный ему объем и легко сжимаем. (Запись вывода в таблице)
Как же можно объяснить эти свойства? Ведь вода, лед, водяной пар – это состояния одного и того же вещества, а значит, молекулы не отличаются друг от друга. Следовательно, нам надо выяснить, как эти молекулы расположены и как они движутся.
Газы. Так как газы заполняют весь предоставленный объём, не имеют формы и легко сжимаются, то следует предположить, что расстояние между молекулами во много раз больше самих молекул, они почти не притягиваются и свободно движутся. Это доказывает и диффузия, которая в газах происходит быстрее, чем в жидкостях и твёрдых телах. Но если газы сильно сжать или охладить они переходят в жидкое состояние. (Запись вывода на доске и в таблице).
Жидкости. Жидкости не сохраняют форму, они могут течь, их легко перелить. Но сжать их трудно. Это можно объяснить только тем, что при любом сближении молекул между ними возникает отталкивание, т.к. молекулы расположены близко друг к другу, расстояние между ними сравнимо с размером молекул. Они скачками меняют свое место – “прыгают”. (Запись вывода на доске и в таблице).
Твердые тела. Твердые тела сохраняют форму и объем. Это значит, что молекулы расположены на расстояниях, сравнимых с размером молекул. Молекулы расположены упорядоченно, образуя кристаллическую решётку, при этом они совершают колебания около определенной точки. (Запись вывода на доске и в таблице).
Работа с учебником по рисунку (28.6 стр. 125) .
4. Этап обобщения и закрепления нового материала
Можно ли заполнить газом сосуд на половину его объема? Почему?
Могут ли быть в жидком состоянии при комнатной температуре: кислород?
Могут ли быть в газообразном состоянии при комнатной температуре: железо?
В зимний морозный день над полыньей в реке образовался туман. Какое это состояние вещества?
В копомещении, где находится хлорка, всегда чувствуется её запах. Объясните, в каком состоянии пребывает хлорка?
5. Заключительный этап
Что мы узнали о свойствах тел в различных агрегатных состояниях?
Как можно объяснить эти свойства, учитывая молекулярное строение вещества?
6. Рефлексия
На уроке я работалактивно / пассивно
Своей работой на уроке я
доволен / не доволен
Урок для меня показался
коротким / длинным
За урок я
не устал / устал
Мое настроение
стало лучше / стало хуже
Материал урока мне был
понятен / не понятен
полезен / бесполезен
интересен / скучен
Домашнее задание мне кажется
легким / трудным
интересно / не интересно
Ответы подчеркнуть
Д/з п 28,29, эксп зад стр 127
РЕЗЕРВ Вопросы:
Почему газы не сохраняют объем и легко сжимаются? (Расстояние между молекулами велико, силы притяжения слабые, поэтому молекулы легко удаляются друг от друга и так же легко сближаются.
Почему газы не имеют формы и заполняют весь предоставленный объем? (Причина в свободном движении молекул и слабом их притяжении)
Почему жидкости сохраняют объем? (Взаимодействие между молекулами велико, следовательно они не способны “отрываться” друг от друга)
Почему жидкости не имеют своей формы и текучи? (Молекулы жидкости подвижны, они способны перескакивать с места на место. В случае, если на жидкость подействует внешняя сила, например, притяжение к Земле, перескоки частиц будут происходить, в основном, в направлении ее действия (то есть вниз).
Чем объясняется не сжимаемость жидкостей? (Расстояние между молекулами достаточно мало. При сближении силы отталкивания резко возрастают, не позволяя молекулам сближаться)
Почему твердые тела сохраняют свою форму? (Причина кроется в характере движения молекул. Они колеблются около положений равновесия и свободно перемещаться не могут)
Почему твердые тела сохраняют свой объём? (Взаимодействие между молекулами твердого тела огромное, поэтому они не могут отрываться друг от друга)
Чем объясняется не сжимаемость твердых тел? (Расстояние между молекулами мало (соизмеримо с размерами молекул). При сближении силы отталкивания резко возрастают, не позволяя молекулам сближаться).
