V tomto článku sa dozviete o 10 najčastejších chemické reakcie v živote!
Reakcia č. 1 - Fotosyntéza
Rastliny používajú chemickú reakciu. fotosyntézapremieňať oxid uhličitý na vodu, jedlo a kyslík. fotosyntéza - jedna z najbežnejších a najdôležitejších chemických reakcií v živote. Rastliny produkujú len pre seba a pre zvieratá iba fotosyntézou, premieňajú oxid uhličitý na kyslík. 6 CO2 + 6 H2O + svetlo → C6H12O6 + 6 O2
 Reakcia č. 2 - Aeróbne bunkové dýchanie
Reakcia č. 2 - Aeróbne bunkové dýchanie
Aeróbne dýchanie buniek - Toto je opačný proces fotosyntézy v tom, že energia molekúl v kombinácii s kyslíkom, ktorý dýchame, aby uvoľnila energiu potrebnú pre naše bunky, plus oxid uhličitý a vodu. Energia použitá bunkami je chemická reakcia vo formáte ATP.
Všeobecná rovnica pre dýchanie aeróbnych buniek: C6H12O6 + 6O2 → 6CO2 + 6H20 + energia (36 ATP)
Reakcia č. 3 - Anaeróbne dýchanie
Na rozdiel od aeróbneho dýchania buniek, anaeróbne dýchanie opisuje súbor chemických reakcií, ktoré umožňujú bunkám prijímať energiu z komplexných molekúl bez kyslíka. Vaše bunky vo svaloch vykonávajú anaeróbne dýchanie, keď vám dôjde kyslík, ktorý dodáva, napríklad počas intenzívneho alebo dlhodobého cvičenia. Anaeróbne dýchanie kvasiniek a baktérií sa používa na fermentáciu, výrobu etanolu, oxidu uhličitého a ďalších chemikálií, ktoré produkujú syry, víno, pivo, chlieb a mnoho ďalších potravín.
Všeobecná chemická rovnica pre anaeróbne dýchanie: C6H12O6 → 2C2H5OH + 2CO2 + energia
Reakcia č. 4 - Spaľovanie
Zakaždým, keď zapálite zápalku, zapálite sviečku, zapálite oheň alebo zapáli gril, vidíte horiacu reakciu. Spaľovacia reakcia kombinuje energetické molekuly s kyslíkom za vzniku oxidu uhličitého a vody.
Napríklad reakcia spaľovania propánu v plynových griloch a niektorých krboch je: C3H8 + 5O2-4H20 + 3C02 + energia
 Reakcia č. 5 - Rez
Reakcia č. 5 - Rez
V priebehu času železo zčervenalo, tzv. Obláčikový poťah hrdza, Toto je príklad oxidačnej reakcie. Medzi ďalšie predmety pre domácnosť patrí tvorba priadze z priadze.
Chemická rovnica pre hrdzavé železo: Fe + 02 + H20 → Fe203. XH20
 Reakcia č. 6 - Miešanie chemikálií
Reakcia č. 6 - Miešanie chemikálií
Ak v recepte zmiešate ocot s jedlou sódou alebo mliekom s práškom do pečiva, uvidíte, ako dôjde k výmene reakcií. Zložky sa spájajú za vzniku oxidu uhličitého a vody. Oxid uhličitý vytvára bubliny a pomáha pri vypaľovaní.
V praxi je táto reakcia pomerne jednoduchá, ale často pozostáva z niekoľkých fáz. Tu je všeobecné chemická rovnica pre reakciu sódy s octom: HC2H302 (vod.) + NaHC03 (vod.) → NaC2H302 (vod.) + H20 () + CO2 (g)
 Reakcia č. 7 - Batéria
Reakcia č. 7 - Batéria
Elektrochemické alebo redoxné reakcie batérie používa sa na konverziu chemickej energie na elektrickú energiu. Spontánne redoxné reakcie sa vyskytujú v galvanických bunkách, zatiaľ čo spontánne redoxné reakcie sa vyskytujú v elektrolyzéroch.

Reakcia č. 8 - Trávenie
V tomto procese sa vyskytujú tisíce chemických reakcií. zažívacie ťažkosti, Akonáhle si dáte jedlo do úst, enzým do slín, amylázyZačne štiepiť cukor a ďalšie uhľovodíky na jednoduchšie formy, takže môžete absorbovať jedlo. Kyselina chlorovodíková v žalúdku reaguje s jedlom a rozkladá ho, zatiaľ čo enzýmy štiepia proteíny a tuky, takže môžu prechádzať krvou cez črevné steny.
 Reakcia č. 9 - Kyselina alkalická
Reakcia č. 9 - Kyselina alkalická
Kedykoľvek skombinujete kyseliny so zásadou, budete vykonávať acidobázická reakcia, Táto reakcia je neutralizáciou kyseliny a bázy za vzniku soli a vody.
Chemická rovnica pre acidobázická reakciaktorý vyrába chlorid draselný: HCI + KOH → KCl + H20
 Reakcia č. 10 - Mydlo a saponáty
Reakcia č. 10 - Mydlo a saponáty
Mydlá a detergenty sa získavajú čistými chemickými reakciami. mydlo premení špinu na emulziu, čo znamená, že škvrny od oleja sú viazané na mydlo, takže ich možno odstrániť vodou. detergenty pôsobia ako povrchovo aktívne látky, znižujú povrchové napätie vody, takže môžu interagovať s olejmi, izolovať ich a opláchnuť.
12. FYZIKÁLNE A CHEMICKÉ FENOMÉNY.
VYBAVENIE CHEMICKÝCH REAKCIÍ.
Z prírodných vied a fyziky viete, že s telom a látkami existujú zmeny, ktoré sú rozdelené na fyzikálne a chemické
Akákoľvek chemická reakcia je sprevádzaná vonkajšími znakmi, podľa ktorých posudzujeme jej priebeh. Toto je:
1. Vzhľad sedimentu.
2. Zmena farby.
3. Vývoj plynu.
4. Absorpcia alebo uvoľnenie tepla.
Na uskutočnenie chemickej reakcie je potrebných niekoľko podmienok. Prvým je kontaktovanie reagujúcich látok; druhým je mletie látok (najväčšie mletie sa dosiahne rozpustením látok); po tretie, na to, aby došlo k mnohým reakciám, je potrebné zahriať reakčné látky na určitú teplotu.
Chemické reakcie sa dajú vyjadriť písomne \u200b\u200bpomocou rovníc chemických reakcií, ktoré sa často nazývajú chemické rovnice. Čo je to?
Chemická rovnica je podmienený záznam chemickej reakcie pomocou chemických vzorcov a koeficientov.
Pri zostavovaní reakčných rovníc je potrebné použiť zákon o zachovaní hmotnosti látok objavený M.V. Lomonosov a A. Lavoisier. Hmotnosť látok, ktoré vstúpili do reakcie, sa rovná hmotnosti látok, ktoré z nej vyplývajú. Ale viete, že látky sa skladajú z atómov, takže pri zostavovaní chemických rovníc použijeme pravidlo: počet atómov každého chemického prvku východiskových materiálov by sa mal rovnať počtu atómov v reakčných produktoch.Algoritmus na zostavenie reakčných rovníc.
Zvážte algoritmus na zostavovanie chemických rovníc pomocou príkladu vzájomného pôsobenia jednoduchých látok: kovov a nekovov. Nechajte fosfor a kyslík interagovať (spaľovacia reakcia).
1. Tieto látky si zapíšte vedľa seba, medzi ne vložte znamienko „+“ (tu vezmeme do úvahy, že kyslík je kremelina) a za nimi je šípka ako rovnaké znamienko.
P + 02
2. Za šípku zapíšeme vzorec reakčného produktu:
P + 02 P205
3. Z diagramu je zrejmé, že vľavo sú atómy kyslíka-2, vpravo-5 av súlade so zákonom o zachovaní hmoty látok musí byť počet atómov daného chemického prvku rovnaký. Aby sme vyrovnali ich počet, nájdeme najmenší spoločný násobok. Pre 2 a 5 to bude číslo 10. Najmenší spoločný násobok vydeľte počtom atómov vo vzorcoch. 10: 2 \u003d 5, 10: 5 \u003d 2, budú to koeficienty, ktoré sú umiestnené pred kyslíkom 02 a oxidom fosforečným (V) P205.
P + 5O2 2P205
kyslík vľavo a vpravo sa stal 10 (5,2 \u003d 10, 2,5 \u003d 10)4. Koeficient sa vzťahuje na celý vzorec a je umiestnený pred ním. Po nastavení doprava sa fosfor stal 2, 2 \u003d 4 atómy. A vľavo je 1 (koeficient 1 nie je nastavený), preto sme pred fosfor umiestnili koeficient 4.
4P + 5O2 2P205
Toto je konečný záznam chemickej rovnice.
Znie: štyri ne plus päť o-dva sa rovná dvom ne-dva o-päť.
fyzický nazývajú sa javy, pri ktorých nedochádza k premene niektorých látok na iné, ale mení sa ich celkový stav, tvar a veľkosť telies.
príklady: topenie ľadu, ťahanie drôtu, drvenie žuly, odparovanie vody.
chemický nazvať také javy, v ktorých dochádza k premene niektorých látok na iné.
príklady: horiace drevo, sčernenie medi, hrdzavenie železa.
V budúcnosti budeme nazývať chemické javy chemické reakcie.
Znaky chemickej reakcie, Môžu sa použiť na posúdenie, či chemická reakcia medzi reaktantmi prešla alebo nie. Tieto príznaky sa zvyčajne pripisujú:
· Zmena farby: CuSO4 (azúrová) \u003d Cu 2+ + S04 2-
· Zrážky: C02 + Ca (OH) 2 CaC03 + H20
· Vývoj plynu: CaC03 + HCI CaCl2 + C02 + H20
· Tvorba mierne disociovaných látok: 2NaOH + H2S04 \u003d Na2S04 + 2H20
· Uvoľňovanie energie (tepelné alebo ľahké): 2H2 (g) + 02 (g) \u003d 2H20 (g) + 572 kJ
1. Blízky kontakt reagujúcich látok (nevyhnutný): H2SO4 + Zn \u003d ZnSO4 + H2 2. Zahrievanie (prípadne) a) naštartovanie reakcie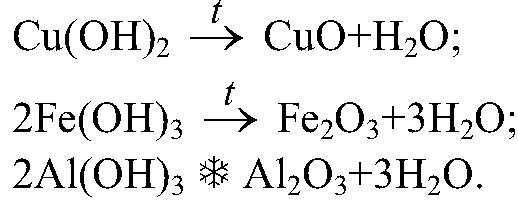 b) neustále Klasifikácia chemických reakcií podľa rôznych kritérií 1.V prítomnosti fázovej hranice sú všetky chemické reakcie rozdelené do homogénna a heterogénne Nazýva sa chemická reakcia vyskytujúca sa v jednej fáze homogénna chemická reakcia, Nazýva sa chemická reakcia vyskytujúca sa na hranici fázy heterogénna chemická reakcia, Pri viacstupňovej chemickej reakcii môžu byť niektoré stupne homogénne, zatiaľ čo iné môžu byť heterogénne. Takéto reakcie sa nazývajú homogénny heterogénny , V závislosti od počtu fáz, ktoré tvoria východiskové materiály a reakčné produkty, môžu byť chemické procesy homofázické (východiskové materiály a produkty sú v rovnakej fáze) a heterofázické (východiskové materiály a produkty tvoria niekoľko fáz). Homo- a heterofázicita reakcie nesúvisí s tým, či je reakcia homo- alebo heterogénna. Preto je možné rozlišovať štyri typy procesov: Homogénne reakcie (homofázické), Pri reakciách tohto typu je reakčná zmes homogénna a reaktanty a produkty patria do rovnakej fázy. Príkladom takýchto reakcií sú iónomeničové reakcie, napríklad neutralizácia kyslého roztoku alkalickým roztokom: Heterogénne homofázové reakcie, Zložky sú v rovnakej fáze, ale reakcia prebieha na fázovej hranici, napríklad na povrchu katalyzátora. Príkladom by mohla byť hydrogenácia etylénu na niklovom katalyzátore: Homogénne heterofázové reakcie, Činidlá a produkty v takejto reakcii existujú v niekoľkých fázach, reakcia však prebieha v jednej fáze. Môže tak dôjsť k oxidácii uhľovodíkov v kvapalnej fáze plynným kyslíkom. Heterogénne heterofázické reakcie, V tomto prípade sú reakčné činidlá v odlišnom fázovom stave, reakčné produkty môžu byť tiež v akomkoľvek fázovom stave. Reakčný proces pokračuje na hranici fázy. Príkladom je reakcia solí kyseliny uhličitej (uhličitanov) s Bronstedovými kyselinami: 2. Zmenou stupňov oxidácie reagencií [upraviť | editovať wiki text] V tomto prípade existujú redoxné reakcie, v ktorých atómy jedného prvku (oxidačné činidlo) sa zotavujú
, to znamená, že znižujú svoj oxidačný stav a atómy iného prvku (redukčné činidlo) oxiduje
, to znamená, že sa zvyšuje ich oxidačný stav. Konkrétnym prípadom redoxných reakcií je reakcia disproporcionácie, pri ktorej oxidačné činidlo a redukčné činidlo sú atómy toho istého prvku, ktoré sú v rôznych stupňoch oxidácie. Príkladom redoxnej reakcie je spaľovanie vodíka (redukčné činidlo) v kyslíku (oxidačné činidlo) za vzniku vody. Príkladom disproporcionačnej reakcie je rozkladná reakcia dusičnanu amónneho po zahriatí. V tomto prípade je oxidačným činidlom dusík (+5) nitroskupiny a redukčným činidlom je dusík (-3) amónneho katiónu: Neaplikujte sa na redoxné reakcie, pri ktorých nedochádza k zmene stupňa oxidácie atómov, napríklad: 3. Tepelným účinkom reakcie Celá chemická látka reakcie sú sprevádzané uvoľňovaním alebo absorpciou energie. Keď sa v činidlách rozbijú chemické väzby, uvoľní sa energia, ktorá vedie hlavne k tvorbe nových chemických väzieb. Pri niektorých reakciách sú energie týchto procesov blízke a v tomto prípade sa celkový tepelný účinok reakcie blíži nule. V iných prípadoch môžeme rozlíšiť: exotermické reakcie, ku ktorým dochádza pri uvoľňovaní tepla (pozitívny tepelný účinok) CH 4 + 2О 2 \u003d СО 2 + 2Н 2 О + energia (svetlo, teplo); CaO + H20 \u003d Ca (OH) 2 + energia (teplo). endotermické reakcie, počas ktorých sa teplo absorbuje (negatívny tepelný efekt) z prostredia. Ca (OH) 2 + energia (teplo) \u003d CaO + H20 Tepelný účinok reakcie (reakčná entalpia, RAH), ktorý je často veľmi dôležitý, sa môže vypočítať podľa Hessovho zákona, ak sú známe entalpie tvorby reaktantov a produktov. Ak je súčet entalpií produktov menší ako súčet entalpií reakčných zložiek (ΔrH< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) je absorpcia. 4. Podľa typu transformácie reagujúcich častíc [upraviť | editovať wiki text] zlúčeniny: rozklady: substitúcie: výmena (vrátane typu reakcie - neutralizácia): Chemické reakcie sú vždy sprevádzané fyzikálnymi účinkami: absorpcia alebo uvoľnenie energie, zmena farby reakčnej zmesi, atď. Tieto fyzikálne účinky sa často posudzujú. o priebehu chemických reakcií. Zložená reakcia- chemická reakcia, v dôsledku ktorej dva alebo viac východiskových materiálov tvoria iba jednu novú. Do týchto reakcií môžu vstúpiť jednoduché aj zložité látky. Reakcia rozkladu- chemická reakcia, v dôsledku ktorej sa z jednej látky vytvorí niekoľko nových látok. Reakcie tohto typu vstupujú iba komplexné zlúčeniny a ich zložkami môžu byť zložité aj jednoduché látky. Substitučná reakcia- chemická reakcia, v dôsledku ktorej atómy jedného prvku, ktoré sú súčasťou jednoduchej látky, nahradia atómy iného prvku vo svojej komplexnej zlúčenine. Ako vyplýva z definície, pri takýchto reakciách by mal byť jeden z východiskových materiálov jednoduchý a druhý komplexný. Výmenné reakcie- reakcia, pri ktorej si dve zložité látky vymieňajú svoje základné zložky. 5. Podľa smeru toku sa chemické reakcie delia na nezvratný a reverzibilný nevratne
b) neustále Klasifikácia chemických reakcií podľa rôznych kritérií 1.V prítomnosti fázovej hranice sú všetky chemické reakcie rozdelené do homogénna a heterogénne Nazýva sa chemická reakcia vyskytujúca sa v jednej fáze homogénna chemická reakcia, Nazýva sa chemická reakcia vyskytujúca sa na hranici fázy heterogénna chemická reakcia, Pri viacstupňovej chemickej reakcii môžu byť niektoré stupne homogénne, zatiaľ čo iné môžu byť heterogénne. Takéto reakcie sa nazývajú homogénny heterogénny , V závislosti od počtu fáz, ktoré tvoria východiskové materiály a reakčné produkty, môžu byť chemické procesy homofázické (východiskové materiály a produkty sú v rovnakej fáze) a heterofázické (východiskové materiály a produkty tvoria niekoľko fáz). Homo- a heterofázicita reakcie nesúvisí s tým, či je reakcia homo- alebo heterogénna. Preto je možné rozlišovať štyri typy procesov: Homogénne reakcie (homofázické), Pri reakciách tohto typu je reakčná zmes homogénna a reaktanty a produkty patria do rovnakej fázy. Príkladom takýchto reakcií sú iónomeničové reakcie, napríklad neutralizácia kyslého roztoku alkalickým roztokom: Heterogénne homofázové reakcie, Zložky sú v rovnakej fáze, ale reakcia prebieha na fázovej hranici, napríklad na povrchu katalyzátora. Príkladom by mohla byť hydrogenácia etylénu na niklovom katalyzátore: Homogénne heterofázové reakcie, Činidlá a produkty v takejto reakcii existujú v niekoľkých fázach, reakcia však prebieha v jednej fáze. Môže tak dôjsť k oxidácii uhľovodíkov v kvapalnej fáze plynným kyslíkom. Heterogénne heterofázické reakcie, V tomto prípade sú reakčné činidlá v odlišnom fázovom stave, reakčné produkty môžu byť tiež v akomkoľvek fázovom stave. Reakčný proces pokračuje na hranici fázy. Príkladom je reakcia solí kyseliny uhličitej (uhličitanov) s Bronstedovými kyselinami: 2. Zmenou stupňov oxidácie reagencií [upraviť | editovať wiki text] V tomto prípade existujú redoxné reakcie, v ktorých atómy jedného prvku (oxidačné činidlo) sa zotavujú
, to znamená, že znižujú svoj oxidačný stav a atómy iného prvku (redukčné činidlo) oxiduje
, to znamená, že sa zvyšuje ich oxidačný stav. Konkrétnym prípadom redoxných reakcií je reakcia disproporcionácie, pri ktorej oxidačné činidlo a redukčné činidlo sú atómy toho istého prvku, ktoré sú v rôznych stupňoch oxidácie. Príkladom redoxnej reakcie je spaľovanie vodíka (redukčné činidlo) v kyslíku (oxidačné činidlo) za vzniku vody. Príkladom disproporcionačnej reakcie je rozkladná reakcia dusičnanu amónneho po zahriatí. V tomto prípade je oxidačným činidlom dusík (+5) nitroskupiny a redukčným činidlom je dusík (-3) amónneho katiónu: Neaplikujte sa na redoxné reakcie, pri ktorých nedochádza k zmene stupňa oxidácie atómov, napríklad: 3. Tepelným účinkom reakcie Celá chemická látka reakcie sú sprevádzané uvoľňovaním alebo absorpciou energie. Keď sa v činidlách rozbijú chemické väzby, uvoľní sa energia, ktorá vedie hlavne k tvorbe nových chemických väzieb. Pri niektorých reakciách sú energie týchto procesov blízke a v tomto prípade sa celkový tepelný účinok reakcie blíži nule. V iných prípadoch môžeme rozlíšiť: exotermické reakcie, ku ktorým dochádza pri uvoľňovaní tepla (pozitívny tepelný účinok) CH 4 + 2О 2 \u003d СО 2 + 2Н 2 О + energia (svetlo, teplo); CaO + H20 \u003d Ca (OH) 2 + energia (teplo). endotermické reakcie, počas ktorých sa teplo absorbuje (negatívny tepelný efekt) z prostredia. Ca (OH) 2 + energia (teplo) \u003d CaO + H20 Tepelný účinok reakcie (reakčná entalpia, RAH), ktorý je často veľmi dôležitý, sa môže vypočítať podľa Hessovho zákona, ak sú známe entalpie tvorby reaktantov a produktov. Ak je súčet entalpií produktov menší ako súčet entalpií reakčných zložiek (ΔrH< 0) наблюдается выделение тепла, в противном случае (Δ r H > 0) je absorpcia. 4. Podľa typu transformácie reagujúcich častíc [upraviť | editovať wiki text] zlúčeniny: rozklady: substitúcie: výmena (vrátane typu reakcie - neutralizácia): Chemické reakcie sú vždy sprevádzané fyzikálnymi účinkami: absorpcia alebo uvoľnenie energie, zmena farby reakčnej zmesi, atď. Tieto fyzikálne účinky sa často posudzujú. o priebehu chemických reakcií. Zložená reakcia- chemická reakcia, v dôsledku ktorej dva alebo viac východiskových materiálov tvoria iba jednu novú. Do týchto reakcií môžu vstúpiť jednoduché aj zložité látky. Reakcia rozkladu- chemická reakcia, v dôsledku ktorej sa z jednej látky vytvorí niekoľko nových látok. Reakcie tohto typu vstupujú iba komplexné zlúčeniny a ich zložkami môžu byť zložité aj jednoduché látky. Substitučná reakcia- chemická reakcia, v dôsledku ktorej atómy jedného prvku, ktoré sú súčasťou jednoduchej látky, nahradia atómy iného prvku vo svojej komplexnej zlúčenine. Ako vyplýva z definície, pri takýchto reakciách by mal byť jeden z východiskových materiálov jednoduchý a druhý komplexný. Výmenné reakcie- reakcia, pri ktorej si dve zložité látky vymieňajú svoje základné zložky. 5. Podľa smeru toku sa chemické reakcie delia na nezvratný a reverzibilný nevratne 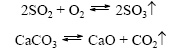 chemické reakcie, ktoré sa vyskytujú iba v jednom smere (" zľava doprava"), v dôsledku čoho sa východiskové materiály premieňajú na reakčné produkty. Hovoria o takých chemických procesoch, ktoré pokračujú„ až do konca ". spaľovacie reakcierovnako reakcie sprevádzané tvorbou ťažko rozpustných alebo plynných látok obojstranný
chemické reakcie, ktoré sa vyskytujú iba v jednom smere (" zľava doprava"), v dôsledku čoho sa východiskové materiály premieňajú na reakčné produkty. Hovoria o takých chemických procesoch, ktoré pokračujú„ až do konca ". spaľovacie reakcierovnako reakcie sprevádzané tvorbou ťažko rozpustných alebo plynných látok obojstranný 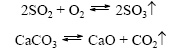 nazývajú sa chemické reakcie, ktoré sa vyskytujú súčasne v dvoch opačných smeroch („zľava doprava“ a „sprava doľava“). V rovniciach takýchto reakcií je rovnaké znamienko nahradené dvoma opačne nasmerovanými šípkami. priamy (toky "zľava doprava") a opak(postupuje od „zľava zľava“). Pretože pri reverzibilnej reakcii sa východiskové materiály súčasne spotrebúvajú a formujú, nedochádza k ich úplnému premene na reakčné produkty. Preto sa hovorí, že reverzibilné reakcie neprichádzajú do konca. Výsledkom je vždy zmes východiskových materiálov a reakčných produktov. 6. Na základe účasti katalyzátorov sa chemické reakcie delia na katalytické a nekatalytického Katalytický katalyzátor 2SO2 + 02 → 2SO3 (katalyzátor V205) je definovaný ako reakcia prebiehajúca v prítomnosti katalyzátorov. V rovniciach takýchto reakcií je chemický vzorec katalyzátora označený rovnakou alebo reverzibilnou značkou, niekedy spolu s prietokovou podmienkou. Reakcie tohto typu zahŕňajú mnoho reakcií rozkladu a zlúčenín. Nekatalytická 2NO + O2 \u003d 2NO2 sa týka mnohých reakcií, ktoré sa vyskytujú v neprítomnosti katalyzátorov, ako sú napríklad výmenné a substitučné reakcie.
nazývajú sa chemické reakcie, ktoré sa vyskytujú súčasne v dvoch opačných smeroch („zľava doprava“ a „sprava doľava“). V rovniciach takýchto reakcií je rovnaké znamienko nahradené dvoma opačne nasmerovanými šípkami. priamy (toky "zľava doprava") a opak(postupuje od „zľava zľava“). Pretože pri reverzibilnej reakcii sa východiskové materiály súčasne spotrebúvajú a formujú, nedochádza k ich úplnému premene na reakčné produkty. Preto sa hovorí, že reverzibilné reakcie neprichádzajú do konca. Výsledkom je vždy zmes východiskových materiálov a reakčných produktov. 6. Na základe účasti katalyzátorov sa chemické reakcie delia na katalytické a nekatalytického Katalytický katalyzátor 2SO2 + 02 → 2SO3 (katalyzátor V205) je definovaný ako reakcia prebiehajúca v prítomnosti katalyzátorov. V rovniciach takýchto reakcií je chemický vzorec katalyzátora označený rovnakou alebo reverzibilnou značkou, niekedy spolu s prietokovou podmienkou. Reakcie tohto typu zahŕňajú mnoho reakcií rozkladu a zlúčenín. Nekatalytická 2NO + O2 \u003d 2NO2 sa týka mnohých reakcií, ktoré sa vyskytujú v neprítomnosti katalyzátorov, ako sú napríklad výmenné a substitučné reakcie. 3 Otázka 3
Vývoj myšlienok o štruktúre hmoty:
Chemické reakcie v našom každodennom živote Účastníci projektu: 1. ročník Savostyanova Evgenia Konstantinovna 9. ročník 2. Zadorina Elizaveta Vadimovna 8. 3. ročník Ermakov Pavel Igorevič 9. 4. ročník Dmitriev Ilya Alekseevich 9. 5. Katasonov Nikita Sergeevich 9. ročník Vedúci: Lazareva Elena Alexandrovna 2014 ročník Mestská rozpočtová vzdelávacia inštitúcia „Stredná škola 17“
Relevantnosť zvolenej témy V súčasnosti sú známe milióny rôznych látok. Mnohé z nich sa používajú nielen v priemysle a poľnohospodárstve, ale aj v každodennom živote. Bohužiaľ, nie všetci ľudia majú základné chemické znalosti o látkach a ich premenách. Sme presvedčení, že aj zo školy je potrebné vštepiť chemickú gramotnosť. Preto bude relevantná téma „Chemické reakcie v našom každodennom živote“.


Spaľovanie zemného plynu Rusko je lídrom v oblasti zásob a výroby zemného plynu. Preto v našich domácnostiach využívame spaľovaciu reakciu zemného plynu na výrobu tepelnej energie. Zemný plyn je zmes plynov, ktorá sa tvorí v vnútorných častiach Zeme počas anaeróbneho rozkladu organických látok. Chemické zloženie: etán (C2H6), propán (C3H8) bután (C4H10). Rovnako ako iné neuhľovodíkové látky: vodík (H2), sírovodík (H2S), oxid uhličitý (CO2), dusík (N2), hélium (He). Prevažná časť zemného plynu je metán (CH4) od 92 do 98%. Je to bezfarebný, ľahký, horľavý plyn, bez zápachu, takmer nerozpustný vo vode. Zmes metánu vo vzduchu je výbušná. Metánová spaľovacia reakcia CH 4 + 2O 2 \u003d CO2 + 2H 2 O + Q. Metán horí namodralým alebo takmer bezfarebným plameňom a uvoľňuje veľké množstvo tepla (879 kJ / mol). Pri používaní plynových zariadení v dome je potrebné: skontrolovať komín, vetrať miestnosť, monitorovať stav plynovodov a nenechávať pracovné plynové zariadenia bez dozoru.

Horiace zápalky S veľkým výberom rôznych zapaľovačov sú zápalky veľmi populárne. Aké procesy sa vyskytujú počas zapaľovania zápasu? Tu ju udreli o boxy. Zaznel plameň a štipľavý zápach „síry“. Proces sa začal pôsobením trenia. Najskôr zapálil červený fosfor, ktorý bol na zápalkovom boxe 4Р + 5О 2 \u003d 2Р 2 О 5 Fosfor, ktorý počas trenia spôsobuje vysoké trenie, zapálil zmes síry a bertholitu v zápalnej hlave S + O 2 \u003d S02 (S02 - oxid siričitý, zdroj štipľavého zápachu). Hlavová palba zapálila drevo С 6 Н 10 О 5 + 6О 2 \u003d 6СО 2 + 5Н 2 О Takmer všetky produkty spaľovania sú pre telo škodlivé. Iba v prípade popálenia jedného zápasu sa uvoľní zanedbateľné množstvo, čo nemá na osobu významný vplyv. Ale pri používaní zápasov by si chemicky vzdelaný človek mal pamätať, že „HODINY NIE SÚ NÁKLADOM!“

Hydrolýza mydla Vo výrobe a každodennom živote je mydlo názov pre technické zmesi vo vode rozpustných solí vyšších mastných kyselín, často s pridaním niektorých ďalších látok, ktoré majú detergentný účinok. Základom zmesí sú obvykle sodné (menej často draselné a amóniové) soli nasýtených a nenasýtených mastných kyselín s počtom atómov uhlíka v molekule od 12 do 18 (stearová, palmitová, myristická, laurová a olejová). Mydlá často tiež zahŕňajú soli nafténovej a živicovej kyseliny a niekedy aj iné zlúčeniny s detergentom v roztokoch. Mydlá sú tvorené silnou zásadou a slabou kyselinou, preto sa ľahko hydrolyzujú: C 17 H 35 COONa + H20 \u003d C 17 H 35 COOH + NaOH Alkalické médium na hydrolýzu preto mydlá sú pre pokožku dosť agresívne a ich časté použitie odmasťuje. , Existuje veľa odrôd a značiek mydla a pred výberom najvhodnejšieho z nich musíte určiť typ pleti. Mastná pokožka často žiari kvôli silnému potu a mastnému oddeľovaniu, zvyčajne na nej veľké póry. 2 hodiny po umytí sa na obrúsku nanášajú mastné škvrny na pokožku. Takáto pokožka vyžaduje mydlo s miernym odtokom. Suchá pokožka je tenká a veľmi citlivá na vietor a počasie a jej póry sú malé a tenké; ľahko praskne, pretože nie je dostatočne flexibilný. Takáto pokožka musí vytvárať maximálny komfort a šetrné ošetrenie, je lepšie používať drahé odrody mydla. Normálna pokožka je jemná, hladká, má póry strednej veľkosti.

Peroxid vodíka Peroxid vodíka je najjednoduchším predstaviteľom peroxidov. Bezfarebná kvapalina s „kovovou“ chuťou, nekonečne rozpustná vo vode, alkohole a éteri. Ego sa často používa v každodennom živote ako bielidlo a antiseptikum. Pri rozklade peroxidu vodíka (pri ošetrovaní rany) sa uvoľňuje voda a plynný kyslík. 2Н 2 О 2 \u003d О 2 + 2Н 2 О Pri nie veľkých dávkach sa zodpovedajúcim spôsobom uvoľňuje malé množstvo kyslíka. Čistý kyslík nie je v malom množstve nebezpečný, ale vo veľkom množstve? A s veľkým množstvom je čistý kyslík toxický a môže spôsobiť pľúcnu formu otravy kyslíkom a škodlivé účinky na centrálny nervový systém. Prvá expozícia je sprevádzaná takýmito príznakmi: podráždenie pľúcneho tkaniva. Môže začať ľahkým podráždením hltanu a následným kašľom. V závažných prípadoch môže dôjsť k dlhodobému horeniu v hrudníku a nekontrolovateľnému kašľu. Otrava pľúcnym kyslíkom môže tiež spôsobiť zníženie pľúcnej kapacity a kapacity výmeny plynov, hoci tieto komplikácie sú veľmi zriedkavé. Medzi príznaky druhého účinku (toxické poškodenie centrálneho nervového systému) patria: zrakové poškodenie (videnie tunela, neschopnosť zaostriť), sluchové poškodenie (zvonenie v ušiach, výskyt cudzích zvukov), nevoľnosť, kŕče (najmä svaly tváre), precitlivenosť na vonkajšie dráždivé účinky a závraty. , To všetko je však možné iba pri použití veľkých objemov peroxidu vodíka a zvyčajný 3% peroxid nie je schopný.

Hasiaca sóda s octom Proces hasenia sódy s octom sa používa pri miešaní cesta na buchty a palacinky. Jedlá sóda na pečenie, keď je vystavená vysokej teplote alebo kyslému prostrediu, poskytuje zvýšenú reakciu na uvoľňovanie oxidu uhličitého, čo zase vedie k nádhere a pórovitosti. CH 3 COOH + NaHCO 3 \u003d CH 3 COONa + H 2 O + CO 2 Otázka „uhasiť alebo nezhasnúť sódu octom počas pečenia“ je večná ako otázka: „čo sa stalo predtým - kurča alebo vajce.“ Po preštudovaní literatúry, prestávke od mnohých miest, vrátane zahraničných, som dospela k záveru, že veľké množstvo receptov starovekej ruskej kuchyne nenašlo jedinú, ktorá spomínala sódu z dôvodu sily rokov. Pečenie bolo u nás hlavne kvasinkami alebo bez pridania akýchkoľvek urýchľovačov zdvíhania a uvoľňovania. Sódu na pečenie vynašiel francúzsky chemik LeBlanc koncom 18. storočia. Tento vynález prišiel do Ruska oveľa neskôr, po získaní nového spôsobu jeho výroby. Hneď ako ruské ženy v domácnosti mali výrobok ako sóda, začali ho používať a použili na varenie. Prečo bolo rozhodnuté uhasiť sódu? Áno, jednoducho preto, že naša tradícia je v tomto prípade všetko „s teplom, s teplom“ - je to len škodlivé. Rýchla sóda na pečenie v horúcom pečení má veľmi nepríjemnú „mydlovú“ chuť. Čo bolo „napravené“ jeho ochladením, konkrétne pridaním vriacej vody do sódy alebo fermentovaných mliečnych výrobkov. Pokiaľ ide o palacinky, táto metóda teraz poskytuje veľmi dobré výsledky. Môžete si však predstaviť, čo sa stane s krehkým pečivom, ak tam nalejete pohár vriacej vody? Odpoveď je zrejmá. Preto sa uvažovalo o nahradení vriacej vody alebo mliečnych výrobkov zriedeným 9% octom alebo citrónovou šťavou.

Záver Mnoho chemických reakcií môžeme pozorovať nielen na hodinách chémie, ale aj v každodennom živote. Tieto reakcie sú nielen bezpečné (podliehajú bezpečnostným pravidlám), ale niektoré z nich sú zbytočné. Napríklad: hasenie sódy octom, ktorýkoľvek skúsený kuchár by povedal, že je to strata času. Ale bez reakcií, ako je hydrolýza a spaľovanie, jednoducho nemáme predstavu o ďalšej existencii. V priebehu týchto chemických reakcií sa uvoľňujú plyny. Sú bezpečné (v určitom množstve). Pri používaní chemikálií v každodennom živote je nevyhnutné dodržiavať bezpečnostné predpisy.

Zdroje informácií 1. Kritsman, VA, Stanzo, VV Encyklopedický slovník mladého chemika [Text] -M. : Pedagogy, Lavrova, S.A. Zábavná chémia [Text] -M. : White City, Ryumin, V. Zábavná chémia [Text] -M .: Center Polygraph, Kurdyumov, G.M. Otázka o chémii [Text] -M. : World, Binom, Guzey, L.S., Kuznetsov, V.N. Nová referenčná príručka o chémii [Text] -M. : Ursa Major, Wikipedia [Elektronický zdroj] - Režim prístupu: ru.wikipedia.org 7. Egorova, A.S. Učiteľ chémie [Text] -M. : Phoenix, Chemistry and Life [Electronic resource] - Režim prístupu: http: //www.hij.ru 9. Chémia okolo nás [Electronic resource] - Režim prístupu:

