Téma 2. FÁZOVÉ PRECHODY.
Fázový prechod (fázová transformácia) je prechod látky z jednej fázy do druhej, keď sa menia vonkajšie podmienky (napríklad teplota, tlak, magnetické a elektrické polia atď.) Sprevádzané zmenami fyzikálnych vlastností a parametrov látky.
Hodnota teploty, tlaku alebo inej fyzickej veličiny, pri ktorej dochádza k fázovému prechodu, sa nazýva prechodový bod. Rozlišujte fázový prechod dvoch rodov.
FÁZOVÉ PRECHODY PRVÉHO DRUHU
Pri fázovom prechode prvého druhu sa takéto termodynamické zmeny náhle zmenia
charakteristiky látky, ako je hustota, koncentrácia zložiek, špecifický objem, množstvo vnútornej energie, t.j. Určité množstvo tepla sa uvoľňuje alebo absorbuje, nazývané teplo prechodu. Okrem toho máme na mysli postupnú zmenu týchto veličín nie v čase, ale so zmenou teploty, tlaku atď. Najbežnejšími príkladmi fázových prechodov prvého druhu sú:
- tavenie a kryštalizácia
- odparovanie a kondenzácia
- sublimácia a desublimácia
FÁZOVÉ PRECHODY DRUHÉHO DRUHU. \\ T
Vo fázovom prechode druhého rádu sa hustota a vnútorná energia nemenia, takže takýto fázový prechod môže byť neviditeľný voľným okom. Ich deriváty s ohľadom na teplotu a tlak zažívajú skok: tepelnú kapacitu, koeficient tepelnej rozťažnosti, rôzne citlivosti atď. fázové prechody druhého druhu sú sprevádzané zmenou symetrie štruktúry hmoty, a nie uvoľňovaním alebo absorpciou energie (tepla). Najbežnejšími príkladmi fázových prechodov druhého rádu sú:
- prejsť systémom kritickým bodom
- prechodný paramagnet-feromagnet
- prechod kovov a zliatin do stavu supravodivosti
- prechod kvapalného hélia do prebytočného stavu
- prechod amorfných materiálov do sklovitého stavu
Moderná fyzika tiež skúma systémy s fázovými prechodmi tretieho alebo vyššieho druhu. V poslednej dobe sa koncept kvantového fázového prechodu rozšíril, t. fázový prechod, riadený nie klasickými tepelnými výkyvmi, ale kvantovými, ktoré existujú aj pri absolútnych nulových teplotách, kde klasický fázový prechod nie je možné realizovať v dôsledku Nernstovej vety.
Uvažujme podrobnejšie o javoch, ktoré nás zaujímajú a ktoré súvisia s fázovými prechodmi prvého druhu.
ODOLNENIE, KONDENZÁCIA, KOTOL.
SATUROVANÉ A NESPRÁVNE PAIRY.
Akákoľvek látka za určitých podmienok môže byť v rôznych agregačných stavoch - tuhá, kvapalná a plynná. Prechody z jedného stavu agregácie na druhý sú fázové prechody prvého druhu.
vyparovanie a kondenzácie sú fázové prechody medzi kvapalnou a plynnou fázou látky.
Všetko reálnych plynov (kyslík, dusík, vodík, atď.) sa za určitých podmienok môže zmeniť na kvapalinu. Takáto transformácia však môže nastať len pri teplotách pod určitým, tzv kritická teplota T Kr. Napríklad kritická teplota pre vodu je 647,3 K, pre dusík 126 K, pre kyslík 154,3 K. Pri teplote miestnosti (≈ 300 K) môže byť voda v kvapalnom aj plynnom skupenstve a dusík a kyslík existujú iba vo forme plynov.
vyparovanie nazývaný fázový prechod z kvapalného do plynného stavu. Z hľadiska molekulárno-kinetickej teórie je odparovanie proces, pri ktorom najrýchlejšie molekuly lietajú z povrchu kvapaliny, ktorej kinetická energia presahuje energiu ich väzby so zvyškom kvapalných molekúl. To vedie k zníženiu priemernej kinetickej energie zostávajúcich molekúl, to znamená k ochladeniu kvapaliny (ak nedochádza k dodávke energie z okolitých telies).
kondenzácie - Toto je opačný proces odparovania. Po kondenzácii sa molekuly pary vracajú do kvapaliny.
V uzavretej nádobe môže byť kvapalina a jej výpary v stave dynamická rovnováhakeď sa počet molekúl emitovaných z kvapaliny rovná počtu molekúl, ktoré sa vracajú z pary do kvapaliny, to znamená, keď sú rýchlosti odparovania a kondenzácie rovnaké. Tento systém sa volá dve fázy , Pára, ktorá je v rovnováhe s kvapalinou, sa nazýva nasýtený.
Počet molekúl emitovaných z jednotkovej povrchovej plochy kvapaliny za jednu sekundu závisí od teploty kvapaliny. Počet molekúl vracajúcich sa z pary do kvapaliny závisí od koncentrácie molekúl pary a od ich priemernej tepelnej rýchlosti, ktorá je určená teplotou pary. Z toho vyplýva, že pre danú látku je koncentrácia molekúl pary v rovnováhe kvapaliny a jej pary určená ich rovnovážnou teplotou. Vytvorenie dynamickej rovnováhy medzi procesmi odparovania a kondenzácie so zvyšujúcou sa teplotou nastáva pri vyšších koncentráciách molekúl pary. Pretože tlak plynu (pary) je určený jeho koncentráciou a teplotou, môžeme konštatovať: tlak nasýtená para p 0 táto látka závisí len od jej teploty a nezávisí od objemu, Preto izotermy reálnych plynov v rovine ( p, V) obsahujú horizontálne úseky zodpovedajúce dvojfázovému systému (obr. 3.4.1).
So zvyšujúcou sa teplotou sa zvyšuje tlak nasýtenej pary a jej hustota a hustota kvapaliny klesá v dôsledku tepelnej rozťažnosti. Pri teplote rovnajúcej sa kritickej teplote T cr pre danú látku, hustoty pary a kvapaliny sa stávajú rovnakými. na T > T cr miznú fyzikálne rozdiely medzi kvapalinou a jej nasýtenou parou.
Ak je izotermicky stlačená desaturovaná para na T < T kr, potom sa jeho tlak zvýši, až kým sa nebude rovnať tlaku nasýtených pár. S ďalším poklesom objemu sa kvapalina tvorí na dne nádoby a medzi kvapalinou a jej nasýtenými parami sa vytvára dynamická rovnováha. S poklesom objemu kondenzuje zvyšujúca sa väčšina pár a jeho tlak zostáva konštantný (horizontálna časť izotermy). Keď sa všetka para zmení na kvapalinu, tlak prudko stúpa s ďalším poklesom objemu v dôsledku nízkej stlačiteľnosti kvapaliny.
Z plynného stavu do kvapalného stavu môže prechádzať, obchádzajúc dvojfázovú oblasť. Ak to chcete urobiť, musíte vykonať proces na obídenie kritického bodu. K, Jeden z možných spôsobov tohto druhu je znázornený na obr. 1 prerušovanou čiarou. ABC.
Atmosférický vzduch vždy obsahuje vodnú paru pri určitom čiastočnom tlaku. pktorá je zvyčajne nižšia ako tlak nasýtených pár p 0. postoj p / p 0, vyjadrené ako percento relatívna vlhkosť vzduchu.
| |
Nenasýtené pary je možné teoreticky opísať pomocou stavovej rovnice ideálneho plynu za bežných podmienok pre skutočné plyny: tlak pary by nemal byť príliš veľký (prakticky p ≤ (106 - 107) Pa) a jeho teplota je nad určitou špecifickou hodnotou pre každú látku. Zákony ideálneho plynu môžu byť tiež približne aplikované na nasýtený pár, za predpokladu, že pre každú teplotu T tlak p 0 nasýtená para je určená rovnovážna krivkap 0 (T) pre danú látku.
tlak p Nasýtená para sa zvyšuje s rastúcou teplotou veľmi rýchlo T, závislosť p 0 (T) nemožno získať zo zákonov ideálneho plynu. Tlak plynu pri konštantnej koncentrácii molekúl sa zvyšuje priamo úmerne teplote. V nasýtenej pare, ako stúpa teplota, sa zvyšuje nielen priemerná kinetická energia molekulového pohybu, ale aj ich koncentrácia. Tlak nasýtenej pary so stúpajúcou teplotou sa preto zvyšuje rýchlejšie ako tlak ideálneho plynu pri konštantnej koncentrácii molekúl.
Odparovanie môže nastať nielen z povrchu, ale aj z objemu kvapaliny. V kvapaline sú vždy malé bublinky plynu. Ak je tlak pary kvapaliny rovný alebo väčší ako vonkajší tlak (t.j. tlak plynu v bublinách), kvapalina sa odparí do vnútra bublín. Bubliny naplnené parou expandujú a plávajú na povrch. Tento proces sa nazýva vriacej , Varenie kvapaliny teda začína pri teplote, pri ktorej sa tlak nasýtených pár rovná vonkajšiemu tlaku.
Najmä pri normálnom atmosférickom tlaku sa voda varí pri teplote 100 ° C. To znamená, že pri tejto teplote je tlak nasýtenej vodnej pary 1 atm. Pri stúpaní v horách klesá atmosférický tlak, a preto sa teplota varu vody znižuje (približne o 1 ° C na každých 300 metrov nadmorskej výšky). V nadmorskej výške 7 km je tlak približne 0,4 atm a bod varu klesá na 70 ° C.
V hermeticky uzavretej nádobe nemôže kvapalina variť, pretože pri každej teplote je stanovená rovnováha medzi kvapalinou a jej nasýtenou parou. Pozdĺž rovnovážnej krivky p 0 (T) je možné určiť teplotu varu kvapaliny pri rôznych tlakoch.
Obrázok izotermy reálneho plynu znázorneného na obrázku 1 opisuje procesy odparovania a kondenzácie, to znamená fázový prechod medzi plynnými a kvapalnými fázami látky. V skutočnosti je tento obraz neúplný, pretože z plynnej a kvapalnej látky sa môže každá látka premeniť v tuhý stav. Pri danej teplote T termodynamická rovnováha medzi dvoma fázami tej istej látky je možná len pri určitej hodnote tlaku v systéme. Vyvoláva sa závislosť rovnovážneho tlaku na teplote krivka fázovej rovnováhy , Príkladom je rovnovážna krivka p 0 (T) nasýtená para a kvapalina. Ak sa rovnováha zakriví medzi rôznymi fázami látky, ktorá sa má vytvoriť v rovine ( p, T), delia túto rovinu do samostatných oblastí, v ktorých látka existuje v homogénnom stave agregácie - tuhé, kvapalné alebo plynné (obr. 2). Zobrazený v súradnicovom systéme ( p, Ta) Vyvolanie rovnovážnych kriviek fázový diagram .
Krivka 0 Tzodpovedá rovnováhe medzi pevnou a plynnou fázou sublimačná krivka, krivka TK rovnováha medzi kvapalinou a parou sa nazýva krivka odparovaniazlomí sa v kritickom bode K, krivka TM sa nazýva rovnováha medzi pevnou látkou a kvapalinou krivka topenia.
Rovnovážne krivky sa zbiehajú na Tv ktorom všetky tri fázy môžu koexistovať v rovnováhe. Tento bod sa nazýva trojitý bod.
Pre mnoho látok tlak p mp v trojitom bode je menej ako 1 atm ~ 105 Pa. Takéto látky sa topia pri zahrievaní na atmosférický tlak. Trojitý bod vody (obr. 3) má napríklad súradnice T mp = 273,16 K, p tp = 6,02.102 Pa a používa sa ako referencia pre kalibráciu absolútnej stupnice Kelvinovej teploty.
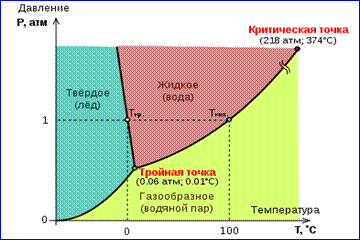 Existujú však také Rice. 3 fázový graf vody
Existujú však také Rice. 3 fázový graf vody
látok, v ktorých p t.t.
presahuje 1 atm. Tak pre
tlak oxidu uhličitého (CO 2)
p Teplota topenia = 5,11 atm a teplota
T t.t. = 216,5 K. Preto pri atmosférickom tlaku
tuhý oxid uhličitý
existujú len pri nízkej teplote a v kvapalnom stave pri p = 1 atm vôbec neexistuje. V tuhom stave v rovnováhe so svojimi parami pri atmosférickom tlaku je oxid uhličitý pri teplote 173 K alebo –80 ° C. Toto je široko používaný "suchý ľad", ktorý sa nikdy neroztopí, ale len odparí (sublimuje).
Za prirodzených podmienok sa para považuje za plyn. Môže byť nasýtený a nena-nasýteniazávisí od jeho hustoty, teploty a tlaku.
Pary, ktoré sú v dynamickej rovnováhe s vlastnou tekutinou nasýtený.
Dynamická rovnováha medzi kvapalinou a parou vzniká vtedy, keď sa počet molekúl emitovaných z voľného povrchu kvapaliny rovná počtu molekúl, ktoré sa do nej vracajú.
V otvorenej nádobe je narušená dynamická rovnováha a stáva sa parou nena-nasýteniaPretože určitý počet molekúl sa vyparuje do atmosféry a nevráti sa do kvapaliny.
Nasýtená para vytvorená v uzavretej nádobe nad voľným povrchom kvapaliny.
nasýtený a desaturated parný majú rôzne vlastnosti. Skúmame ich.
| Obr. 3.2. Izotermická kompresia pár |
Koncentrácia molekuly nasýtená para nezávisí od jeho objemu.
nechať nenasýtená parapri teplote T je vo valci s piestom (obr. 3.2). Začneme ju pomaly komprimovať, aby sme zabezpečili izotermický proces (časť AB). Najprv, ak je para výrazne riedka, závislosť tlaku na objeme bude zodpovedať Boley-la-Mariottovmu zákonu pre ideálny plyn: pV = const. Avšak pri poklese objemu nenasýtenej pary (zvýšenie jej hustoty) sa začína odchyľovať od nej. Ďalšia izotermická kompresia pary vedie k tomu, že začína kondenzovať (bod B), vo valci sa tvoria kvapky kvapaliny a para sa nasýti. Jeho hustota, a teda koncentrácia molekúl, nadobúda maximálnu hodnotu pre danú teplotu. Nezávisia od objemu, ktorý zaberá nasýtená para, a sú určené jeho tlakom a teplotou.
Pri stlačení nasýtená para (časť BC) jeho tlak sa nezmení ( p = const). To je vysvetlené tým, že pri poklese objemu kondenzuje nasýtená para a vytvára kvapalinu. Jeho podiel na objeme valca sa neustále zvyšuje a objem, ktorý obsadzuje nasýtená para, klesá. K tomu dôjde, kým nie je všetka nasýtená para v kvapalnom stave (bod C).
Ďalší pokles objemu spôsobí rýchle zvýšenie tlaku (DC sekcia), pretože kvapaliny sa takmer nezrážajú. Materiál z lokality
Takže pri izotermickej kompresii nesaturovaná para najprv (pri nízkej hustote) vykazuje vlastnosti ideálneho plynu. Kedy sa stane para nasýtený, jeho vlastnosti podliehajú iným zákonom. Najmä pri nízkych teplotách je jeho stav približne opísaný rovnicou p = nKT,keď koncentrácia molekúl nezávisí od objemu plynu. Graf závislosti tlaku p z objemu V, znázornené na obr. 3.2 izoterma reálneho plynu.
Izotermy reálneho plynu charakterizujú jeho rovnovážny stav kvapalinou. Ich kompatibilita umožňuje určiť závislosť tlaku nasýtená para od teploty.
Táto stránka obsahuje materiál o témach:
Čo je charakteristické pre nasýtenú paru z molekulárneho hľadiska
Scho je charakteristické pre molekulárny pohľad na účely stávkovania
Čo je charakteristické pre nasýtený plyn z molekulárneho hľadiska
Stručné zhrnutie vedeckých poznatkov
Stručné zhrnutie nasýtenej pary
Otázky týkajúce sa tohto materiálu:
Procesy odparovania a kondenzácie sú kontinuálne a paralelné.
V otvorenej nádobe množstvo kvapaliny klesá s časom, pretože vyparovanie prevláda nad kondenzáciou.
Výpary, ktoré sú nad povrchom kvapaliny, keď vyparovanie prevláda nad kondenzáciou alebo parami v neprítomnosti kvapaliny, sa nazývajú nenasýtené.
V hermeticky uzavretej nádobe sa hladina kvapaliny nemení s časom, pretože Odparovanie a kondenzácia sa navzájom kompenzujú: pretože mnoho molekúl letí z kvapaliny, pretože mnohí z nich sa vracajú do nej v rovnakom čase, dynamická (pohyblivá) rovnováha nastáva medzi parou a jej kvapalinou.
Pára, ktorá je v dynamickej rovnováhe s tekutinou, sa nazýva nasýtený.
Pri tejto teplote má nasýtená para akejkoľvek kvapaliny najvyššiu hustotu ( ) a vytvára maximálny tlak ( ), ktorá môže mať pri tejto teplote výpary tejto kvapaliny.
Tlak a hustota nasýtenej pary pri rovnakej teplote závisí od typu látky: viac tlaku vytvára nasýtenú paru kvapaliny, ktorá sa odparuje rýchlejšie.Napríklad a
Vlastnosti nenasýtených pár: \\ tNenasýtené páry dodržiavajú zákony o plyne Boyle - Mariotte, Gay-Lussac, Charles, pre nich môžete použiť stavovú rovnicu ideálneho plynu.
Vlastnosti nasýtených pár:1. Pri konštantnom objeme so stúpajúcou teplotou sa tlak nasýtenej pary zvyšuje, ale nie priamo úmerný (Charlesov zákon nie je splnený), tlak rastie rýchlejšie ako tlak ideálneho plynu. , so zvyšujúcou sa teplotou ( ) vzrastá hmotnosť pary, a preto sa koncentrácia molekúl pary zvyšuje () a tlak nasýtených pár sa taví z dvoch dôvodov (
3 1 - nenasýtená para (ideálny plyn);
2 2 - nasýtená para; 3 - nenasýtená para, \\ t
1 odvodené od nasýtenej pary
Objem pri zahrievaní.
2. Tlak nasýtenej pary pri konštantnej teplote nezávisí od objemu, ktorý zaberá.
Ako sa objem zvyšuje, hmotnosť pary sa zvyšuje a hmotnosť kvapaliny sa znižuje (časť kvapaliny sa mení na pary), keď sa objem znižuje, para sa znižuje a kvapalina sa zvyšuje (časť pary ide do kvapaliny), hustota a koncentrácia molekúl nasýtených pár zostávajú konštantné, a teda tlak zostáva konštantný ().
kvapaliny
(so. para + kvapalina)
Nenasýtené. parný
Nasýtené páry nedodržiavajú zákony o plyne Boyle - Mariotte, Gay-Lussac, Charles, pretože hmota pár v procesoch nezostáva konštantná a všetky plynárenské zákony sa získajú pre konštantnú hmotnosť. Pre nasýtený pár, môžete použiť ideálnu rovnicu stavu plynu.
To znamená, nasýtená para môže byť premenená na nenasýtenú paru, buď zahrievaním na konštantný objem, alebo zvýšením jej objemu pri konštantnej teplote. Nenasýtená para môže byť premenená na nasýtenú paru, buď ochladením na konštantný objem, alebo jej stláčaním pri konštantnej teplote.
Kritická podmienka
Prítomnosť voľného povrchu kvapaliny umožňuje indikovať, kde je kvapalná fáza látky a kde je plynná. Prudký rozdiel medzi kvapalinou a jej parami sa vysvetľuje tým, že hustota kvapaliny je mnohonásobne väčšia ako hustota pary. Ak zohrejete kvapalinu v hermeticky uzavretej nádobe, potom v dôsledku expanzie sa jej hustota zníži a hustota pár nad ňou sa zvýši. To znamená, že rozdiel medzi kvapalinou a jej nasýtenými parami sa vyhladí a úplne zmizne pri dostatočne vysokej teplote. Teplota, pri ktorej sa strácajú rozdiely vo fyzikálnych vlastnostiach medzi kvapalinou a jej nasýtenými parami a ich hustoty sú rovnaké.kritická teplota.
Kritický bod
Na vytvorenie kvapaliny z plynu musí priemerná potenciálna energia príťažlivosti molekúl prekročiť ich priemernú kinetickú energiu.
Kritická teplota – maximálna teplota, pri ktorej sa para mení na kvapalinu. Kritická teplota závisí od potenciálnej energie interakcie molekúl, a preto je odlišná pre rôzne plyny. Vďaka silnej interakcii molekúl vody sa vodná para môže premeniť na vodu aj pri teplote. Súčasne sa skvapalňovanie dusíka vyskytuje len pri teplotách nižších ako -147 °, pretože molekuly dusíka navzájom slabo interagujú.
Ďalším makroskopickým parametrom ovplyvňujúcim prechod pary a kvapaliny je tlak. Pri zvýšení vonkajšieho tlaku počas kompresie plynu sa priemerná vzdialenosť medzi časticami zmenšuje, zvyšuje sa sila príťažlivosti medzi nimi a tým aj priemerná potenciálna energia ich interakcie.
tlak nasýtená para pri kritickej teplote kritický, Toto je najvyšší možný tlak pár danej látky.
Stav veci s kritickými parametrami kritický(kritický bod) . Každá látka má svoju vlastnú kritickú teplotu a tlak.
V kritickom stave mizne špecifické teplo odparovania a povrchové napätie kvapaliny. Pri teplotách nad kritickým, dokonca ani pri veľmi vysokých tlakoch, nie je možné premeniť plyn na kvapalinu, t.j. nad kritickou teplotou kvapalina nemôže existovať. Pri nadkritických teplotách je možný len parný stav hmoty.
Skvapalňovanie plynu je možné len pri teplotách pod kritickou teplotou. Na skvapalňovanie sa plyny ochladzujú na kritickú teplotu, napríklad počas adiabatickej expanzie a potom izotermicky stlačujú.
vriacej
Externe tento jav vyzerá takto: z celého objemu kvapaliny, rýchlo rastúce bubliny stúpajú na povrch, prasknú na povrchu a para sa uvoľňuje do životného prostredia.
MKT vysvetľuje varu nasledovne: V kvapaline sú vždy vzduchové bubliny, v nich sa odparuje. Uzavretý objem bublín sa naplní nielen vzduchom, ale aj nasýtenou parou. Tlak nasýtenej pary v nich pri zahrievaní kvapaliny rastie rýchlejšie ako tlak vzduchu. Keď je v dostatočne ohrievanej kvapaline tlak nasýtených pár v bublinách väčší ako vonkajší tlak, zvyšujú sa objem a vztlaková sila, ktorá presahuje ich gravitačnú silu, zvyšuje bubliny na povrch. Prebublávacie bubliny začnú prasknúť, keď pri určitej teplote tlak nasýtených pár v nich prekročí tlak nad kvapalinou. Teplota kvapaliny, pri ktorej sa tlak nasýtených pár v bublinách rovná alebo prevyšuje vonkajší tlak na kvapalinu, sa nazýva bod varu.
Teplota varu rôznych kvapalín je odlišná.pretože tlak nasýtenej pary v ich bublinách sa porovnáva s rovnakým vonkajším tlakom pri rôznych teplotách. Napríklad tlak nasýtenej pary v bublinách sa rovná normálnemu atmosférickému tlaku vo vode pri 100 ° C, v ortuti pri 357 ° C, v alkohole pri 78 ° C a v éteri pri 35 ° C.
Teplota varu počas varu zostáva konštantná. pretože všetko teplo, ktoré je privádzané do ohrievanej tekutiny, je použité na odparovanie.
Teplota varu závisí od vonkajšieho tlaku na kvapalinu: s rastúcim tlakom stúpa teplota; pri klesajúcom tlaku teplota klesá. Napríklad vo výške 5 km nad hladinou mora, kde je tlak 2 krát nižší ako atmosférický, je bod varu vody 83 ° C, v kotloch parných strojov, kde tlak pár je 15 atm. (), teplota vody je asi 200˚С.
Vlhkosť vzduchu
Vo vzduchu je vždy vodná para, takže môžeme hovoriť o vlhkosti vzduchu, ktorá sa vyznačuje nasledujúcimi hodnotami:
1.Absolútna vlhkosť - je hustota vodných pár vo vzduchu (alebo tlak, ktorý táto para vytvára (.
Absolútna vlhkosť neposkytuje predstavu o stupni nasýtenia vzduchu vodnou parou. Rovnaké množstvo vodnej pary pri rôznych teplotách vytvára odlišný pocit vlhkosti.
2.Relatívna vlhkosť - je pomer hustoty (tlaku) vodnej pary obsiahnutej vo vzduchu pri danej teplote k hustote (tlaku) nasýtenej pary pri rovnakej teplote : alebo
- absolútna vlhkosť pri danej teplote; - hustota, tlak nasýtenej pary pri rovnakej teplote. Hustota a tlak nasýtených vodných pár pri akejkoľvek teplote sa nachádza v tabuľke. Tabuľka ukazuje, že čím vyššia je teplota vzduchu, tým väčšia musí byť hustota a tlak vodných pár vo vzduchu, aby bola nasýtená.
S vedomím relatívnej vlhkosti môžete pochopiť, koľko percent vodnej pary vo vzduchu pri danej teplote je ďaleko od nasýtenia. Ak sú výpary vo vzduchu nasýtené, potom. ak , potom nie je dostatok vzduchu na nasýtenie vo vzduchu.
Skutočnosť, že para vo vzduchu sa nasýti, sa posudzuje podľa vzhľadu vlhkosti vo forme hmly, rosy. Teplota, pri ktorej sa nasýti vodná para, sa nazýva rosný bod.
Para vo vzduchu môže byť nasýtená pridaním pary v dôsledku dodatočného odparovania kvapaliny, bez zmeny teploty vzduchu, alebo znížením jej teploty s množstvom pary vo vzduchu.
Normálna relatívna vlhkosť, najvýhodnejšia pre osobu je 40 - 60%. Veľmi dôležitá je znalosť vlhkosti v meteorológii predpovedať počasie. V tkaní, cukroviniek pre normálny priebeh procesu vyžaduje určitú vlhkosť. Skladovanie umeleckých diel a kníh vyžaduje udržiavanie vlhkosti vzduchu na požadovanej úrovni.
Nástroje na určovanie vlhkosti:
1. Vlhkomer kondenzácie (umožňuje určiť rosný bod).
2. Vlhkomer na vlasy (princíp činnosti je založený na dĺžke netukovej srsti na vlhkosti) meria relatívnu vlhkosť v percentách.
3. Psychrometer sa skladá z dvoch teplomerov, suchých a mokrých. Nádrž zvlhčeného teplomera je zabalená v látke namočenej vo vode. V dôsledku odparovania z tkaniny je teplota navlhčeného materiálu nižšia ako teplota suchej. Rozdiel v údajoch teplomerov závisí od vlhkosti okolitého vzduchu: čím je sušený vzduch, tým intenzívnejšie je odparovanie z tkaniva, tým väčší je rozdiel v údajoch teplomeru a naopak. Ak je vlhkosť 100%, potom sú teplomery rovnaké, t. rozdiel v údajoch 0. Na určenie vlhkosti pomocou psychrometra sa používa psychrometrická tabuľka.
Teplota topenia a kryštalizácia
Pri tavení pevné teleso zväčšuje vzdialenosť medzi časticami tvoriacimi kryštálovú mriežku a samotná mriežka je zničená. Proces tavenia je nevyhnutný na vynakladanie energie. Keď sa tuhá látka zohreje, kinetická energia oscilujúcich molekúl sa zvyšuje, a teda aj amplitúda ich oscilácií. Pri určitej teplote, volal bod topenia poriadok je narušený v usporiadaní častíc v kryštáloch, kryštály strácajú svoj tvar. Látka sa roztopí a prejde z tuhého do kvapalného stavu.
Počas kryštalizácieexistuje konvergencia molekúl, ktoré tvoria kryštálovú mriežku. Kryštalizácia môže nastať len vtedy, keď tekutina uvoľní energiu. Pri ochladzovaní roztavenej látky sa znižuje priemerná kinetická energia a rýchlosť molekúl. Príťažlivé sily môžu zadržiavať častice okolo rovnovážnej polohy. Pri určitej teplote, volal teplota tuhnutia (kryštalizácia)všetky molekuly sú v pozícii stabilnej rovnováhy, ich usporiadanie je usporiadané - vzniká kryštál.
K topeniu pevného telesa dochádza pri rovnakej teplote, pri ktorej táto látka stvrdne.
Každá látka má svoj vlastný bod topenia. Napríklad teplota topenia hélia je -269,6 ° C, zatiaľ čo teplota ortuti je 38,9 ° C a teplota medi je 1083 ° C.
Počas procesu tavenia zostáva teplota konštantná. Množstvo tepla dodávaného zvonku ide do zničenia kryštálovej mriežky.
Počas procesu tuhnutia, napriek tomu, že teplo je odstránené, sa teplota nemení. Energia uvoľnená počas kryštalizácie sa spotrebuje na udržanie konštantnej teploty.
Kým sa látka neroztopí alebo celá látka nestvrdne, t. pokiaľ tuhá a kvapalná fáza látky existujú spoločne, teplota sa nemení.
TV + Yid + TV.
, kde je množstvo tepla, je množstvo tepla potrebného na roztavenie látky uvoľnenej počas kryštalizácie látky s hmotnosťou
- špecifické tavné teplo– množstvo tepla potrebného na roztavenie látky s hmotnosťou 1 kg pri teplote topenia.
Koľko tepla sa vynakladá, keď sa určitá hmota látky roztopí, keď sa táto hmota kryštalizuje, uvoľní sa rovnaké množstvo tepla.
Tiež volal špecifické kryštalizačné teplo.
V bode topenia je vnútorná energia látky v kvapalnom stave väčšia ako vnútorná energia rovnakej hmotnosti látky v pevnom stave.
Pri veľkom počte látok sa objem zvyšuje pri tavení, zatiaľ čo hustota klesá. Pri stuhnutí sa naopak objem znižuje a hustota sa zvyšuje. Napríklad kryštály tuhého naftalénu klesajú v kvapalnom naftaléne.
Niektoré látky, napríklad bizmut, ľad, gália, liatina atď., Sa počas tavenia zmršťujú a pri vytvrdzovaní expandujú. Tieto odchýlky od všeobecného pravidla sú vysvetlené štrukturálnymi vlastnosťami kryštálových mriežok. Voda je teda hustejšia ako ľad, ľad sa vznáša vo vode. Rozšírenie vody počas zamrznutia vedie k zničeniu hornín.
Zmena objemu kovov počas tavenia a tuhnutia je v zlievarenskom podnikaní nevyhnutná.
Skúsenosti to ukazujú zmena vonkajšieho tlaku na pevnú látku ovplyvňuje teplotu topenia tejto látky, Pre tie látky, ktoré expandujú počas tavenia, vedie zvýšenie vonkajšieho tlaku k zvýšeniu teploty tavenia, pretože komplikuje proces tavenia. Ak sa pri tavení látky stláčajú, vedie ich zvýšenie vonkajšieho tlaku k poklesu teploty tavenia pomáha procesu tavenia. Iba veľmi veľké zvýšenie tlaku výrazne mení bod tavenia. Napríklad, aby sa teplota topenia ľadu znížila o 1 ° C, tlak sa musí zvýšiť o 130 atm. Nazýva sa teplota topenia látky pri normálnom atmosférickom tlaku bod topenia látky.
Po varení teplota vody prestane rásť a zostane nezmenená až do úplného odparenia. Odparovanie je proces prechodu z kvapaliny na paru, ktorý má rovnaký teplotný index ako vriaca kvapalina. Toto odparovanie sa nazýva nasýtená para. Keď sa všetka voda odparí, každé následné pridanie tepla zvýši teplotu. Ohriata para po nasýtenej úrovni sa nazýva prehriata. Priemysel zvyčajne používa na vykurovanie, varenie, sušenie alebo iné postupy nasýtenú paru. Prehriatie sa používa výlučne pre turbíny. Rôzne druhy pary majú rôzne energie výmenného potenciálu a to odôvodňuje ich použitie na úplne iné účely.
Para ako jeden z troch fyzických stavov
Pochopenie všeobecnej molekulárnej a atómovej štruktúry látky, ako aj použitie tejto znalosti ľadu, vody a pary, môže pomôcť lepšie pochopiť vlastnosti pary. Molekula je najmenšia jednotka akéhokoľvek prvku alebo zlúčeniny. Na druhej strane sa skladá z ešte menších častíc, nazývaných atómy, ktoré definujú základné prvky, ako je vodík a kyslík. Špecifické kombinácie týchto atómových prvkov poskytujú kombináciu látok. Jedna z týchto zlúčenín je reprezentovaná chemickým vzorcom H20, ktorého molekuly sa skladajú z dvoch atómov vodíka a 1 atómu kyslíka. Uhlík je tiež bohatý, je kľúčovou zložkou všetkých organických látok. Väčšina minerálov môže existovať v troch fyzikálnych stavoch (tuhé, kvapalné a parné), ktoré sa nazývajú fázy.
Proces výroby pary
Keď sa teplota vody blíži bodu varu, niektoré molekuly dostávajú dostatok kinetickej energie na dosiahnutie rýchlostí, ktoré im umožnia okamžite sa oddeliť od kvapaliny v priestore nad povrchom pred návratom. Ďalšie zahrievanie spôsobuje väčšie vzrušenie a zvyšuje sa počet molekúl, ktoré chcú opustiť kvapalinu. Pri atmosférickom tlaku je teplota nasýtenia 100 ° C. Para s bodom varu pri tomto tlaku sa nazýva suchá nasýtená para. Ako fázový prechod z ľadu na vodu je proces odparovania tiež reverzibilný (kondenzácia). Kritickým bodom je najvyššia teplota, pri ktorej môže byť voda v kvapalnom stave. Nad týmto bodom možno paru považovať za plyn. Plynný stav je difúzna zdanie, v ktorom molekuly majú takmer neobmedzenú možnosť pohybu.
Prepojenie premenných
Pri danej teplote existuje určitý tlak pary, ktorý existuje v rovnováhe s kvapalnou vodou. Ak sa toto číslo zvýši, para sa prehreje a nazýva sa suchá. Existuje vzťah medzi tlakom a teplotou: poznať jednu hodnotu, môžete určiť inú. Stav pary je určený tromi premennými: tlakom, teplotou a objemom. Suchá nasýtená para je stav, pri ktorom môže byť súčasne prítomná para a voda. Inými slovami, toto nastane, keď rýchlosť odparovania sa rovná rýchlosti kondenzácie.
Nasýtená para a jej vlastnosti
Pri diskusii o vlastnostiach nasýtenej pary sa často porovnáva s ideálnym plynom. Majú niečo spoločné alebo je to jednoduchá mylná predstava? Po prvé, s konštantnou úrovňou teploty-t-tu-ry hustota nie je v závislosti od objemu-e-ma. Vizuálne sa to dá predstaviť nasledovne: je potrebné vizuálne znížiť objem nádrže s parou, bez toho, aby sa zmenili hodnoty teploty. Počet kondenzovateľných molekúl bude zvyšovať počet odparovania a para sa vráti do stavu rovnováhy. Výsledkom je, že hustota bude konštantným parametrom. Po druhé, také charakteristiky ako dav-le -tion a volume-e-m nezávisia od seba. Po tretie, s prihliadnutím na invariantnosť objemových charakteristík sa hustota molekúl zvyšuje, keď sa teplota zvyšuje a stáva sa menej, keď sa znižuje. V skutočnosti, keď sa zahrieva, voda sa začne odparovať rýchlejšie. Váha v tomto prípade bude narušená a nebude obnovená, kým sa hustota páru nevráti do svojich predchádzajúcich polôh. Pri kondenzácii sa naopak hustota nasýtenej pary zníži. Na rozdiel od ideálneho plynu nemožno nasýtenú paru nazvať uzavretým systémom, pretože neustále kontaktuje vodu.

Výhody v oblasti vykurovania
Nasýtená para je čistá para v priamom kontakte s kvapalnou vodou. Má mnoho vlastností, ktoré z neho robia vynikajúci zdroj tepelnej energie, najmä pri vysokých teplotách (nad 100 ° C). Niektoré z nich sú:

Rôzne druhy pary
Para je plynná fáza vody. Využíva teplo počas jeho tvorby a potom uvoľňuje veľké množstvo tepla. Preto on
môže byť použitý ako pracovná látka pre tepelné motory. Sú známe nasledujúce podmienky: vlhké nasýtené, suché nasýtené a prehriaty. Nasýtená para je vhodnejšia ako prehriata para ako chladivo vo výmenníkoch tepla. Keď sa uvoľní do atmosféry z rúr, časť z nich kondenzuje, vytvárajú sa mraky bieleho mokrého odparovania, ktoré obsahujú najmenšie kvapky vody. Prehriatá para nebude vystavená kondenzácii, dokonca ani pri priamom kontakte s atmosférou. V prehriatom stave bude mať väčší prestup tepla v dôsledku zrýchlenia pohybu molekúl a nižšej hustoty. Prítomnosť vlhkosti spôsobuje zrážky, koróziu a zníženú životnosť kotlov alebo iných zariadení na výmenu tepla. Preto je výhodná suchá para, pretože produkuje viac energie a nespôsobuje koróziu.

Suché a nasýtené: čo je rozpor
Mnohí sú zmätení termínmi "suchý" a "nasýtený". Ako môže byť niečo súčasne? Odpoveď spočíva v terminológii, ktorú používame. Termín "suchý" je spojený s nedostatkom vlhkosti, to znamená "nie mokré". „Nasýtený“ znamená „namočený“, „namočený“, „zaplavený“, „posiaty“ a tak ďalej. Zdá sa, že toto všetko potvrdzuje rozpor. Avšak v parnom inžinierstve má termín "nasýtený" iný význam a v tomto kontexte znamená stav, v ktorom dochádza k varu. Teplota, pri ktorej dochádza k varu, je teda technicky známa ako teplota nasýtenia. Suchá para v tomto kontexte neobsahuje vlhkosť. Ak sa pozeráte na varnú kanvicu, môžete vidieť biely výpar vychádzajúci z hrdla kanvice. V skutočnosti je to zmes suchej, bezfarebnej pary a vlhkej pary, ktorá obsahuje kvapky vody, ktoré odrážajú svetlo a stmavnú. Výraz "suchá nasýtená para" teda znamená, že para je dehydratovaná a nie je prehriata. Bez častíc, to je plynná látka, ktorá nie je nasledovaná všeobecnými zákonmi o plyne.
Iste, mnohí museli sledovať obraz, pretože nádoba s vodou otvorenou sa po čase ukázala byť prázdna. Ak ho zakryjete vekom, voda sa nikam nedostane. Dôvod je známy všetkým - voda sa odparuje. Vysvetlenie tohto javu je jednoduché: niektoré molekuly vody majú dostatočne veľkú rýchlosť pohybu, aby opustili kvapalinu. Tento proces prechodu kvapaliny do plynného stavu sa nazýva odparovanie.
Ďalší proces, menovite premena pary na kvapalinu, sa nazýva kondenzácia. Tieto dva procesy, odparovanie a kondenzácia, pokračujú neustále: časť vody sa odparuje, niektoré kondenzujú. Ak je objem nad hladinou vody neobmedzený, prevláda proces odparovania. Odparená voda sa odstraňuje, ako sa napríklad vyskytuje nad povrchom otvorenej vody, a kvapalina postupne prechádza do plynného stavu - pary.
Ak je však množstvo voľného priestoru nad kvapalinou obmedzené, vzniká mierne odlišná situácia. Odparená voda nemôže opustiť tento objem a nad povrchom vody sa vytvára nasýtená para. Toto je názov pary, ktorá je v rovnováhe, keď je množstvo odparenej vody a kondenzovanej pary rovnaké. Voda sa neznižuje a nedorazí, nastáva stav rovnováhy medzi odparovaním a kondenzáciou.
Teraz vieme, čo je nasýtená para a jej vlastnosti budú pravdepodobne pre nás dosť zvedavé. Od samého začiatku sme zistili, že objem voľného priestoru nad povrchom kvapaliny je obmedzený. Nad ním sa vytvorila nasýtená para. A ak teraz zníži tento voľný objem? Čo sa stane? V tomto prípade sa ustáli rovnováha medzi kondenzáciou a odparovaním. Proces kondenzácie začne prevládať, objem vlhkosti sa zvýši a para sa zníži.
Tlak pary, pri ktorom je v rovnováhe s kvapalinou, sa nazýva, ak znížime objem voľného priestoru nad vodou, tlak pary sa zvýši. Dôsledkom toho je prechod pary do vody. So zvýšenou trvá menej miesta ako nasýtená para. Z toho vyplýva ďalší záver: ak je teplota konštantná, potom je tlak nasýtenej pary pri ľubovoľnom objeme rovnaký.
Existuje aj iná verzia správania pary - objem nad hladinou vody sa znižuje a para sa neprenáša do kvapaliny. Takže nad povrchom je nenasýtená para. Následne, s poklesom objemu pri konštantnej teplote, sa para začne premieňať na vodu, čo znamená, že sa vytvorila nasýtená para. Nebolo však nič, že podmienka bola stanovená tak, že všetko sa deje pri konštantnej teplote. Existuje určitá hodnota, pri ktorej sa para môže premeniť na kvapalinu.
Táto hodnota sa nazýva kritická teplota. Látka zostáva plyn pri teplote nad kritickou, ak je pod kritickou hodnotou, plyn sa zmení na kvapalinu. Každá látka má svoju vlastnú hodnotu a za zmienku stoja ďalšie dve vlastnosti: môže to byť vlhká aj suchá nasýtená para. Vo vlhkom prostredí sú kvapky vody a suchá para neobsahuje vlhkosť.
Je tu aj tzv. Prehriata para - to je suchá para s teplotou nad kritickou. V tomto prípade sa predpokladá, že v uzavretom objeme nie je žiadna kvapalina a je prítomná iba para. Prehriata para sa používa hlavne v strojárstve a energetike. prehriata para umožňuje prepravu pomocou parných potrubí a ich použitie, pretože v prehriatej pare chýba voda, životnosť turbíny sa zvyšuje.
Článok sa zaoberá tým, čo je to nasýtená para, jej typy a vlastnosti, ako aj proces jej tvorby a premeny na kvapalinu.



