Sähkökemia on fysikaalisen kemian haara, jossa tutkitaan ionisten järjestelmien fysikaalis-kemiallisia ominaisuuksia, samoin kuin prosessit ja ilmiöt vaiherajoilla, joissa on varautuneita hiukkasia.
Sähkövirran johtimet jaetaan sähköisiin (ensimmäisen tyyppiset johtimet) ja ionisiin (toisen tyyppisiin johtimiin).
Ensimmäisen tyyppiset johtimet ovat kiinteässä ja sulassa tilassa olevia metalleja. Niissä sähkövirta suoritetaan elektronikaasun elektronien liikkeellä. Lisäksi sähkövirran kulkemiseen ensimmäisen tyyppisissä johtimissa ei liity kemiallisia muutoksia niiden materiaalissa.
Toisen tyyppisiä johtimia ovat jotkut suolojen, happojen ja emästen liuokset, samoin kuin jotkut aineet, pääasiassa suolat, sulassa tilassa. Niissä oleva sähkövirta suoritetaan ionien (sekä positiivisten että negatiivisten) liikkeellä.
Elektrolyytit ovat kemiallisia yhdisteitä, jotka liukenevat (kokonaan tai osittain) ioneiksi. Dissosiaatio johtaa ionien erottumiseen, erottumiseen molekyylistä tai kiteestä ionien vuorovaikutuksen seurauksena liuotinmolekyylien kanssa.
Liuottimien molekyylit, joilla on hyvä dissosiointikyky, ovat erittäin polaarisia, ja siksi sellaisilla liuottimilla on korkea dielektrisyysvakio.
Elektrolyytti-ionien luomien sähkökenttien vaikutuksesta ionit vetävät polaarisia liuotinmolekyylejä, orientoituvat niiden ympärille ja puolestaan \u200b\u200bvetämällä ioneja itseensä heikentävät ionien välistä sidosta.
Samalla tavoin ne vaikuttavat ioneihin, jotka muodostavat esimerkiksi ionisen kiteen hilan. Kummankin merkin ionien lukumäärä määritetään stökiometrisillä kertoimilla elektrolyyttikaavassa, jollei elektrooneutraalisuuden laista muuta johdu - positiivisten varausten summa on yhtä suuri kuin negatiivisten summa. Täten, ionien läsnäolosta huolimatta, elektrolyyttiliuos pysyy sähköisesti neutraalina.
Elektrolyyttiionin sähköstaattinen vuorovaikutus liuotinmolekyylien kanssa - solvaattio - johtaa molekyylikompleksin, solvaatin, muodostumiseen ionin ympärille. Ionia ympäröivä joukko liuotinmolekyylejä on solvaatiokuori. Vesiliuoksissa tapahtuvaa liukenemista kutsutaan hydraatioksi.
Erota vahvat ja heikot elektrolyytit.
Vahvat elektrolyytit hajoavat liuoksessa melkein kokonaan. Vesiliuoksissa monet mineraalihapot (HN03, HC1, HC104 jne.), Emäkset (alkalit) ja useimmat suolat ovat vahvoja elektrolyyttejä.
Heikot elektrolyytit hajoavat liuoksessa vain osittain. Lähes kaikki orgaaniset hapot ja emäkset ovat heikkoja elektrolyyttejä vesiliuoksissa.
Vahvat ja heikot elektrolyytit ovat kemiallisten yhdisteiden (elektrolyyttien) kaksi eri tilaa, riippuen liuottimen luonteesta. Yhdessä liuottimessa tämä elektrolyytti voi olla vahvaa elektrolyyttiä, toisessa - heikko.
Heikkojen elektrolyyttien dissosioitumisprosessi on palautuva, koska vastakkaisen merkin ionit, jotka kohtaavat liuoksessa, voivat yhdistyä molekyyleissä.
Tarkastellaan yksinkertainta tapausta heikosti voimakkaasti laimennetusta binaarisesta yksiarvoisesta elektrolyytistä, joka hajoaa järjestelmän mukaisesti
MA<=> M + + A -
Tärkeät elektrolyyttiominaisuudet:
Dissosiaatioaste α - dissosioituneiden molekyylien osuus alun perin otettujen lukumäärästä
Disosiaatiovakio Kd, jota voidaan tässä tapauksessa esittää (toimivien massojen lakia käyttämällä - vakiolämpötilassa, tämän reaktion nopeus on suoraan verrannollinen reagoivien aineiden konsentraatioiden tuloon, ja jokainen konsentraatio osallistuu asteeseen, yksinkertaisissa tapauksissa yhtä suureksi kuin yhtälössä tämän aineen kaavan edessä oleva kertoin. reaktiot) muodossa
Esimerkiksi
![]()
Jos niin ![]() , pienille arvoille a<0,03, (1-a) » 1, следовательно - это математическое выражение ostwaldin laimennuslaki
joka kuuluu seuraavasti:
, pienille arvoille a<0,03, (1-a) » 1, следовательно - это математическое выражение ostwaldin laimennuslaki
joka kuuluu seuraavasti:
Heikon elektrolyytin dissosioitumisaste liuoksessa on sitä korkeampi, mitä laimeampi liuos on, ts. äärettömästi laimennetussa liuoksessa minkä tahansa elektrolyytin dissosioitumisaste on 1.
Sähköisten ja kemiallisten energiamuotojen keskinäinen muutos tapahtuu sähkökemiallisissa järjestelmissä, jotka koostuvat:
1) toisen tyyppiset (/) elektrolyyttien johtimet,
2) ensimmäisen tyyppiset johtimet (//), (///), jotka ovat kosketuksissa elektrolyytin kanssa.
3) johtimet (IV) - ulkoinen piiri - virran kuljettamiseksi johtimien (7 /) ja (III) välillä. Kahden vaiheen (/ - // ja I - III) rajapinnalla siirtyy sähkövaraus - tapahtuu sähkökemiallinen reaktio.
Anodi on elektrodi, jolla tapahtuu hapettumisreaktio.
Katodi on elektrodi, jolla tapahtuu pelkistysreaktio. Siksi, sähkökemiassa, pelkistysreaktioita kutsutaan yleensä katodisiksi ja hapettumista anodisiksi.
Kemiallisessa sähkövirran lähteessä - galvaanisessa kennossa - kemiallisen prosessin energia menee sähköenergiaan.
Sähkön määrän ja reagoineiden aineiden massojen välinen suhde elektrodien sähkökemiallisissa reaktioissa ilmaistaan \u200b\u200bFaradayn laeilla.
Faradayn ensimmäinen laki. Aineen massa m, jolle kemiallinen muutos tapahtui sähkövirran vaikutuksesta, on verrannollinen virtaavan sähkön määrään q
t \u003d k 3 q
jossa uh - sähkökemiallinen ekvivalentti (g / C) - reagoituneen aineen massa yhden coulombin sähkövirran aikana.
Toinen Faraday-laki. Kun kuljetetaan saman määrän sähköä eri elektrolyyttien läpi, elektrodireaktioon osallistuvien erilaisten aineiden massat ovat verrannollisia niiden ekvivalenttien (M-ekvivalenttien) moolimassoihin:
t x: t 2: t b \u003d M eq]: M eq 2: M eq 3
Seuraus.Minkä tahansa aineen 1-mooliekvivalentin sähkökemiallinen muuntaminen vaatii saman määrän sähköä F \u003d eN A - 96485 C / mol-ekvivalentti
(tai 26,8 A / mol-ekvivalentti), kutsutaan Faradayn vakio.
Kaava, joka yhdistää molemmat Faradayn lait:
jossa M on aineen moolimassa, 1 - virran voimakkuus T - prosessointiaika z -sähkökemialliseen reaktioon osallistuvien elektronien lukumäärä.
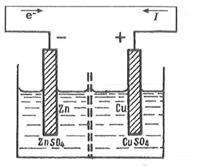 Mieti kemiallisen energian muuntamista sähköenergiaksi galvaanisen kennon esimerkillä Daniel Jacobi.
Mieti kemiallisen energian muuntamista sähköenergiaksi galvaanisen kennon esimerkillä Daniel Jacobi.
Kun sähkökemiallisia järjestelmiä tallennetaan kaavamaisesti, käytetään seuraavaa merkintää:
1. elektrodin ja liuoksen välinen raja on merkitty pystysuoralla yhtenäisellä viivalla
2. Elektrolyyttien välinen raja on merkitty kahdella pystysuoralla viivalla.
Daniel-Jacobi -elementti koostuu sinkki- ja kuparielektrodeista, upotettuna vastaavasti sinkin ja kuparisulfaattien liuoksiin, erotettuna huokoisella kalvolla niiden sekoittumisen estämiseksi.
Sähkökemiallisten elementtien piirien tallennussääntö.
Sähkökemiallisen kennon EMF katsotaan positiiviseksi, jos sähkökemiallinen piiri on kirjoitettu siten, että kationit solun toiminnan aikana kulkevat liuoksessa vasemmasta elektrodista oikealle ja elektronit liikkuvat samaan suuntaan ulkoisessa piirissä. Daniel Jacobi -elementtikaavio
(-) Zn | ZnSQ 4 || CuS0 4 | Cu (+)
Kun metalli upotetaan liuokseen, metalli-ionit alkavat voimakkaasti poolisten vesimolekyylien vaikutuksesta kulkea vesikerrokseen metallipinnan vieressä.
Tässä tapauksessa metallin pintakerros ehtyy kationeina, se saa ylimääräisen negatiivisen varauksen, ja sen ja liuoksessa olevien kationien välillä syntyy potentiaaliero, joka estää muita kationeja poistumasta metallista - tasapaino muodostuu.
Daniel-Jacobi-kennossa sinkkielektrodilla, jolla on suurempi kyky vapauttaa ioneja liuokseen kuin kuparilla, on suurempi negatiivinen varaus. Jos liität elektrodit metallijohtimeen, ylimääräiset elektronit kulkevat sinkkilevystä kupariputkeen.
Tämä häiritsee tasapainoa kunkin elektrodin pinnalla. Sinkkielektrodissa (elementin negatiivinen napa - anodi) sinkin hapetus jatkuu Zn \u003d Zn 2+ + 2e ~.
Kuparielektrodissa (elementin positiivinen napa - katodi) kuparin Cu 2+ + 2e ~ \u003d Cu pelkistys jatkuu.
Siten toteutetaan spontaanisti etenevä prosessi, jossa sinkkilevy liukenee, metallinen kupari vapautuu kuparista ja sähkövirta virtaa ulkoiseen piiriin. Kokonaisredox-reaktio:
Cu 2+ + Zn -\u003e Cu + Zn 2+
Toisaalta, jos kemiallisen reaktion aikana aineen mol-ekvivalentteja vapautuu tai liukenee jokaisessa elektrodissa (Faradayn lain mukaan zF Cl virtaa ulkoisessa piirissä), niin maksimaalinen työ, jonka galvaaninen kenno suorittaa varauksensiirron zF elektrodien välillä erotuksella potentiaalit E on yhtä suuri kuin zFE.
Elementin E sähkömoottorivoimaa (EMF) kutsutaan potentiaalieroksi palautuvan sähkökemiallisen elementin napojen välillä.
![]() ,
,
missä R on kaasuvakio,
F on Faradayn luku (96 500 C / mol),
T on absoluuttinen lämpötila
n on prosessiin osallistuvien elektronien lukumäärä.
298 K lämpötilassa tämä yhtälö on seuraava:
![]() .
.
missä E on ehdollinen vakioelektrodipotentiaali vetyasteikolla.
Tasapainoisen elektrodipotentiaalin määrittämiseksi vetyasteikolla muodostavat elementin tästä elektrodista ja tavallisesta vetyelektrodista. Mikä on upotettu platinalanka
elektrolyytti, jota pitkin vetykaasua johdetaan, H + | H2, Pt) s
vetyionien aktiivisuus liuoksessa, joka on yhtä suuri kuin yhden vetypaine ja 1 atm. Sen potentiaali missä tahansa lämpötilassa on ehdollisesti yhtä suuri kuin nolla.
Tässä tapauksessa: standardi vetyelektrodi asetetaan vasemmalle.
Esimerkiksi sinkki-elektrodin potentiaalin määrittämiseksi tehdään sähkökemiallinen piiri
Pt, H2 | H + || Zn2 + | Zn
Elektrodireaktio kirjataan pelkistysreaktioksi, ts. elektronien kiinnitys: tässä esimerkissä vedyllä (vasen)
elektrodi 2H + + 2e ~ \u003d H2, sinkkielektrodilla (oikealla) Zn 2+ + 2e ~ \u003d Zn. Kokonaisreaktio kirjoitetaan erotuksena oikean ja vasemman elementin reaktioiden välillä
H2 + Zn2 + \u003d 2H + + Zn
Vakioelektrodipotentiaalia pidetään positiivisena, jos elektrodi on ladattu positiivisemmin kuin tavallinen vetyelektrodi. Tässä tapauksessa sähkövirta virtaa elementin sisällä vasemmalta oikealle ja elementin EMF on positiivinen.
Vakioelektrodipotentiaalia pidetään negatiivisena, jos elektrodi on ladattu negatiivisemmin kuin tavallinen vetyelektrodi. Tässä tapauksessa sähkövirta virtaa elementin sisällä oikealta vasemmalle ja elementin EMF on negatiivinen.
Tarkasteltavassa esimerkissä Н 2 + Zn 2+ \u003d 2Н + + Zn elementissä oleva virta virtaa sinkkielektrodista vedyyn (oikealta vasemmalle) ja elementin EMF, kuten sitä vastaava sinkkipotentiaali, on negatiivinen merkki.
Vedyn määrittämät vakioelektrodipotentiaalit asteikko 25 ° C: ssa (298 K) asetetaan yleensä riviin. Esimerkiksi
Redox-prosessi, pakolla virtausta sähkövirran vaikutuksesta kutsutaan elektrolyysiksi.
Elektrolyysi suoritetaan elektrolyyttillä täytetyssä elektrolysaattorissa, johon elektrodit upotetaan, kytkettynä ulkoiseen virtalähteeseen.
Ulkoisen virtalähteen negatiiviseen napaan kytkettyä elektrodia kutsutaan katodi. Katodilla tapahtuu elektrolyyttihiukkasten talteenottoprosesseja. Virran lähteen positiiviseen napaan kytkettyä elektrodia kutsutaan anodi. Anodilla elektrolyyttihiukkasten tai elektrodimateriaalin hapettuminen etenee.
Anodiprosessit riippuvat elektrolyytin luonteesta ja anodimateriaalista. Tässä suhteessa erotetaan elektrolyysi inertillä ja liukoisella anodilla.
Anodia kutsutaan inertiksi, jonka materiaali ei hapettu elektrolyysin aikana. Inertteihin elektrodeihin kuuluvat esimerkiksi grafiitti (hiili) ja platina.
Liukeneva on anodi, jonka materiaali voi hapettua elektrolyysin aikana. Suurin osa metallelektromeista on liukoisia.
Elektrolyyttinä voidaan käyttää liuoksia tai sulaa. Liuoksessa tai sulassa elektrolyytissä ionit ovat kaoottisessa liikkeessä. Sähkövirran vaikutuksesta ionit saavat suunnatun liikkeen: kationit siirtyvät katodiin ja anionit - anodiin ja vastaavasti ne voidaan purkaa elektrodoille.
Elektrolyysin aikana inertti elektrodi sulaa katodilla vain metallikationit voidaan pelkistää, ja anodilla anionien hapettuminen on mahdollista.
Veden elektrolyysissä ratkaisut metallikationien lisäksi vesimolekyylit voidaan pelkistää katodilla ja vetyionit H + happoliuoksissa. Seuraavat kilpailevat reaktiot ovat siis mahdollisia katodilla:
(-) K: Minä n + + nē → minä
2H20 + 2 ē → H 2 + 2 OH -
2H + + 2 ē
→ H2 ![]()
Katodilla reaktio, jolla on suurin elektrodipotentiaalin arvo, etenee ensin.
Veden elektrolyysissä liukoiset anodiliuoksetanionien hapettumisen lisäksi ovat mahdollisia itse elektrodin, vesimolekyylien ja hydroksidi-ionien (OH -) emäksisten liuosten hapettumisreaktiot:
(+) A: minä - n ē → minä n +
anionin hapettuminen E 0
2H20 - 4 ē
O 2 + 4 H + ![]()
4OH - - 4 ē
\u003d O2 + 2H20 ![]()
Anodilla reaktio, jolla on alhaisin elektrodipotentiaalin arvo, etenee ensin.
Elektrodireaktioissa tasapainopotentiaalit annetaan ilman sähkövirtaa.
Elektrolyysi on epätasapainoinen prosessi, joten virran alla olevien elektrodireaktioiden potentiaalit eroavat tasapainoarvoistaan. Elektrodipotentiaalin muutosta tasapainoarvostaan \u200b\u200bulkoisen virran vaikutuksesta kutsutaan elektrodin polarisaatioksi. Polarisaation suuruutta kutsutaan ylijännitteeksi. Ylijännitteen suuruuteen vaikuttavat monet tekijät: elektrodimateriaalin luonne, virrantiheys, lämpötila, pH-ympäristö jne.
Katodisen metallin erotuksen ylijännitteet ovat suhteellisen pienet.
Suurilla ylijännitteillä, yleensä, kaasujen, kuten vedyn ja hapen, muodostumisprosessi etenee. Vetyjen pienin ylijännite katodissa happamissa liuoksissa havaitaan Pt: ssä (h \u003d 0,1 V) ja suurin lyijyn, sinkin, kadmiumin ja elohopean kohdalla. Ylijännite muuttuu, kun happamat liuokset korvataan alkalisilla. Esimerkiksi alkalipitoisessa väliaineessa olevalla platinalla vedyn ylijännite on h \u003d 0,31 V (katso liite).
Anodinen hapen kehitys liittyy myös ylijännitteeseen. Hapen muodostumisen minimaalinen ylijännite havaitaan Pt-elektrodoissa (h \u003d 0,7 V) ja suurin - sinkissä, elohopeassa ja lyijyssä (katso liite).
Edellä esitetystä seuraa, että vesipitoisten liuosten elektrolyysissä:
1) katodiin palautetaan metalli-ioneja, joiden elektrodipotentiaalit ovat suurempia kuin veden pelkistyspotentiaalit (-0,82 V). Metalli-ioneja, joilla on enemmän negatiivisia elektrodipotentiaaleja kuin -0,82 V, ei palauteta. Näitä ovat alkali- ja maa-alkalimetalli-ionit ja alumiini.
2) inertillä anodilla, ottaen huomioon hapen ylijännite, tapahtuu niiden anionien hapettuminen, joiden potentiaali on pienempi kuin veden hapettumispotentiaali (+ 1,23 V). Tällaisia \u200b\u200banioneja ovat esimerkiksi I-, Br-, Cl-, N02-, OH-. Anionit CO 3 2, PO 4 3, N 3 -, F - - eivät hapettu.
3) liukoisella anodilla tapahtuvan elektrolyysin aikana neutraaliin ja happamaan väliaineeseen liuotetaan näiden metallien elektrodit, joiden elektrodipotentiaali on alle + 1,23 V ja alkalisessa - alle + 0,413 V.
Katodin ja anodin prosessien kokonaistuotteet ovat sähköisesti neutraaleja aineita.
Elektrolyysiprosessin suorittamiseksi elektrodeihin on kytkettävä jännite. Elektrolyysijännite U elza on katodin ja anodin reaktioihin tarvittava potentiaaliero. Teoreettinen elektrolyysijännite ( U elsa, teoria) ottamatta huomioon ylijännitettä, ohmisen jännitteen pudotusta ensimmäisen tyyppisissä johtimissa ja elektrolyytissä
U el, teoria \u003d E a - E k, (7)
jossa E ja, E k - anodisten ja katodisten reaktioiden potentiaalit.
Elektrolyysin aikana vapautuneen aineen määrän ja elektrolyytin läpi kulkevan virran määrän välinen suhde ilmaistaan \u200b\u200bkahdella Faradayn lailla.
Minä Faradayn laki.Elektrolyysin aikana elektrodille muodostuvan aineen määrä on suoraan verrannollinen elektrolyyttiliuoksen (sula) läpi kulkevan sähkön määrään:
jossa k- sähkökemiallinen ekvivalentti, g / C tai g / A · h; Q- sähkön määrä, riipus, Q=se; t-aika, s; minänykyinen, A; F\u003d 96500 C / mol (A · s / mol) \u003d 26,8 A · h / mol - Faradayn vakio; E on aineen vastaava massa, g / mol.
Sähkökemiallisissa reaktioissa aineen ekvivalentti massa määritetään:
n –Aineen muodostuessa elektrodireaktioon osallistuvien elektronien lukumäärä.
Faradayn toinen laki.Kun kulkee saman määrän sähköä eri elektrolyyttien läpi, elektrodien vapautuneiden aineiden massat ovat verrannollisia niiden vastaaviin massoihin:
jossa m 1 ja m 2 - aineiden 1 ja 2 massat, E 1 ja E 2, g / mol - ekvivalentit massat aineet 1 ja 2.
Käytännössä, usein kilpailevien redox-prosessien esiintymisen takia, elektrodeihin muodostuu vähemmän ainetta kuin vastaa ratkaisun läpi kulkevaa sähköä.
Sähkön menetyksen karakterisoimiseksi elektrolyysin aikana otetaan käyttöön "virrantuotannon" käsite. Nykyinen lähtö Vuonna ttosiasiallisesti saadun elektrolyysituotteen määrän prosentuaalista suhdetta kutsutaan m tosiasia. teoreettisesti laskettu m teoria: 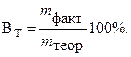
Esimerkki 10. Mitä prosesseja tapahtuu natriumsulfaatin vesiliuoksen elektrolyysin aikana hiilianodin kanssa? Mitä aineita vapautuu elektrodeista, jos hiilielektrodi korvataan kuparilla?
ratkaisu: Natriumsulfaattiliuoksessa elektrodiprosesseissa natriumionit Na +, SO4 2- ja vesimolekyylit voivat osallistua. Hiilielektrodit ovat inerttejä elektrodeja.
Seuraavat talteenottoprosessit ovat mahdollisia katodilla:
(-) K: Na + + ē
→ Na ![]()
2H20 + 2 ē
→ H 2 + 2 OH - ![]()
Katodilla reaktio, jolla on suurin elektrodipotentiaalin arvo, etenee ensin. Siksi vesimolekyylien palautuminen tapahtuu katodilla, jota seuraa vedyn vapautuminen ja hydroksidi-ionien OH muodostuminen - katoditilaan. Katodissa läsnä olevat natriumionit Na + yhdessä OH-ionien kanssa muodostavat NaOH-alkaliliuoksen.
(+) A: 2SO 4 2 - 2 ē
→ S 2 O 8 2 ![]()
2H20 - 4 ē
→ 4H + + 02 ![]() .
.
Anodilla reaktio, jolla on alhaisin elektrodipotentiaalin arvo, etenee ensin. Siksi vesimolekyylien hapettuminen hapen kehittyessä tapahtuu anodilla, ja H + -ionit kerääntyvät anoditilaan. Anodin läsnä olevat SO 4 2– -ionit, joissa on H + -ioneja, muodostavat rikkihapon H2SO4-liuoksen.
Elektrolyysin kokonaisreaktio ilmaistaan \u200b\u200byhtälöllä:
2 Na2S04 + 6H2O \u003d 2H2 + 4 NaOH + O2 + 2H2S04.
katodituotteet anodituotteet
Kun korvataan hiilen (inertin) anodi kuparilla anodilla, toinen hapettumisreaktio on mahdollista - kuparin liukeneminen:
Cu - 2 ē
→ Cu 2+ ![]()
Tälle prosessille on ominaista alempi potentiaaliarvo kuin muille mahdollisille anodiprosesseille. Siksi Na2S04: n elektrolyysin aikana kuparianodilla tapahtuu kuparin hapettuminen anodilla ja kuparisulfaatti CuSO4 kertyy anoditilaan. Elektrolyysin kokonaisreaktio ilmaistaan \u200b\u200byhtälöllä:
Na2S04 + 2H20 + Cu \u003d H2 + 2 NaOH + CuSO4.
katodituotteet anodituote
Esimerkki 11. Tee yhtälö prosesseista, jotka tapahtuvat nikkelikloridin NiCl2: n vesiliuoksen elektrolyysin aikana inertillä anodilla.
ratkaisu: Nikkelikloridi Ni 2+ -, Cl - ja vesimolekyylit voivat osallistua nikkelikloridiliuokseen elektrodiprosesseissa. Grafiittielektrodia voidaan käyttää inerttinä anodina.
Seuraavat reaktiot ovat mahdollisia katodilla:
(-) K: Ni 2+ + 2 ē
→ Ni ![]()
2H20 + 2 ē
→ H 2 + 2 OH - ![]()
Ensimmäisen reaktion potentiaali on suurempi, joten nikkeli-ionit vähenevät katodilla.
Seuraavat reaktiot ovat mahdollisia anodilla:
(+) A: 2CI - 2 ē
→ Cl 2 ![]()
2H20 - 4 ē
O 2 + 4 H + ![]() .
.
Anodin vakioelektrodipotentiaalien arvojen mukaan
happi on vapautettava. Itse asiassa korkean hapen ylijännitteen vuoksi elektrodi vapautuu klooria. Ylijännitteen suuruus riippuu materiaalista, josta elektrodi on valmistettu. Grafiitin hapen ylijännite on 1,17 V virrantiheydellä 1a / cm2, mikä lisää veden hapetuspotentiaalin 2,4 V: iin.
Siksi nikkelikloridiliuoksen elektrolyysi etenee muodostaen nikkeliä ja klooria:
Ni 2+ + 2Cl - \u003d Ni + Cl 2.
katodilla anodilla
Esimerkki 12. Laske aineen massa ja inertteille elektrodeille vapautuneen kaasun tilavuus AgNO 3-hopeanitraatin vesiliuoksen elektrolyysin aikana, jos elektrolyysiaika on 25 minuuttia ja virran voimakkuus 3 A.
Päätös. AgN03: n vesiliuoksen elektrolyysin aikana liukenemattoman anodin (esimerkiksi grafiitin) tapauksessa elektrodeissa tapahtuu seuraavat prosessit:
(-) K: Ag + + ē
→ Ag ![]() ,
,
2H20 + 2 ē → H2 + 2OH -.
Ensimmäisen reaktion potentiaali on suurempi, joten hopea-ionit vähenevät katodilla.
(+) A: 2H20 - 4 ē
O 2 + 4 H + ![]() ,
,
anioni NO 3 - ei hapettu.
G tai litroina ![]() l.
l.
toimeksiantoja
5. Kirjaa elektrolyysireaktiot inertteihin elektrodeihin ja laske katodilla saadun aineen massa ja anodista vapautuneen kaasun tilavuus elektrolyyttiliuosten elektrolyysin aikana, jos elektrolyysiaika on 20 minuuttia, virta minä\u003d 2A, jos virran lähtö Vt \u003d 100%. Mitkä aineet vapautuvat elektrodoista, kun korvataan inertti anodi tehtävässä määritellyllä metallilla?
| №№ | elektrolyytin | Metallielektrodi |
| CuSO 4 | cu | |
| MgCl2 | ni | |
| Zn (NO 3) 2 | zn | |
| Snf 2 | sn | |
| CdSO 4 | CD | |
| FeCl 2 | Fe | |
| AgNO 3 | Ag | |
| HCl: | co | |
| CoSO 4 | co | |
| NiCl 2 | ni |
Pöydän pää
Kun elektrolyyttiionit saavuttavat tasavirtalähteen napoihin kytkettyihin elektrodeihin, positiiviset ionit vastaanottavat puuttuvat elektronit negatiivisesta elektrodista ja pelkistysreaktion aikana muuttuvat neutraaleiksi atomiksi (molekyyleiksi); Negatiiviset ionit antavat elektroneja positiiviselle elektrodille ja muuttuvat hapettumisreaktion aikana neutraaleiksi atomiksi. Aineen vapautumisen ilmiötä elektrodeilla redox-reaktion aikana virran kulkiessa elektrolyytin läpi kutsutaan elektrolyysillä. Elektrolyysi havaittiin ensimmäisen kerran vuonna 1803 Pietarissa - V.P. Petrov. Vuosina 1833-1834. Englantilainen fyysikko M. Faraday löysi elektrolyysin lait, jotka määrittävät mistä elektrolyysin aikana vapautuvan aineen massa riippuu ja kuinka se riippuu.
Ohjaamalla saman voiman virran eri elektrolyyttien läpi yhtäjaksoisesti, Faraday havaitsi, että elektrodit vapauttavat eri määrät ainetta. Joten, virta sisään 1 a varten 1 sekuntia päästää hopeanitraatin liuoksesta 1,118 mg hopea, kuparisulfaatin liuoksesta - 0,328 mg kupari. Tämä tarkoittaa, että elektrolyysin aikana vapautuneen aineen massa riippuu aineesta. Skalaarimäärä, mitattuna elektrolyysin aikana vapautuneen aineen massalla virran ollessa1 avarten1 sekuntia, jota kutsutaan sähkökemialliseksi ekvivalentiksi (merkitty k). Sähkökemiallisella vastineella on nimi kg / a * sek tai kg / k.
Jos pieni virta johdetaan kuparisulfaattiliuoksen läpi ajanjakson t aikana, niin katodi on heikosti päällystetty kuparilla, ja jos virta on vahvempi, katodiin vapautuu enemmän kuparia samanaikaisesti. Jätä nykyinen vahvuus sama, mutta lisää nyt aikaa. Huomaa, että kuparia on allokoitu vielä enemmän. Ohjaamalla erilaisia \u200b\u200bvirtauksia erilaisten elektrolyyttien läpi ja mittaamalla huolellisesti jokaisesta elektrolyytistä elektrodeihin vapautuneen aineen massa, Faraday löysi ensimmäisen elektrolyysin lain: Elektrolyysien aikana vapautuneen aineen massa elektrodoilla on suoraan verrannollinen virran voimakkuuden tuotteeseen ja aikaan, jonka se kulki elektrolyytin läpi.
Virta sisään 1 a 1 sekunnin aikana elektrolyysin aikana se säteilee elektrodille k kg ainetta ja virta voimalla Minä a ajoissa t sek - sisään se kertaa enemmän:
m \u003d klt, tai m \u003d kq.
Nämä ovat kaavoja ensimmäisestä Faraday-laista elektrolyysille.
Jokainen ioni kantaa mukanaan tietyn määrän ainetta ja varauksen, joten mitä enemmän ioneja lähestyy elektrodia, ts. Mitä voimakkaampi virta on elektrolyytissä, sitä enemmän aineita vapautuu elektrodista.
Faraday ohitti saman virran peräkkäin useiden eri elektrolyyttien läpi ja huomasi, että elektrodien vapautuneen aineen massa ei ollut sama, vaikka virran voimakkuus ja aika, jonka se kuljetti eri elektrolyyttien läpi, olivat samat (kuva 109). Punnittuaan vapautetut aineet tarkasti, Faraday huomasi, että niiden paino ei ollut vahingossa, vaan riippui pikemminkin aineen kemiallisesta luonteesta. Jokaisesta vapautuneesta vedyn grammasta se osoittautui aina 107,9 g hopea; 31,8 g kupari; 29,35 g nikkeliä. Kemiallisen ekvivalentin - atomimassan (painon) ja valenssisuhteen - käyttöönoton jälkeen kävi ilmi, että nämä luvut ovat näiden aineiden kemiallisia ekvivalentteja. Koska atomimassa A ja valenssi n ovat abstrakteja lukuja, lukumäärän suhde on abstrakti.
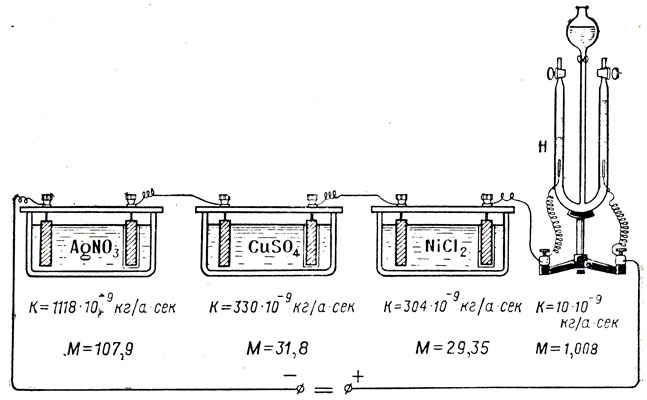
Jakamalla aineiden sähkökemialliset ekvivalentit kemiallisiksi ekvivalenteiksi, (k / M)saamme:
eli sama numero 1036 * 10 - 11 kg / a * sek tai 1036 * 10 - 11 kg / k. Allekirjoittamalla tämä vakioarvo kirjaimella C, kirjoitamme: C \u003d 1036 * 10 - 11 kg / a * sek. Täten siis sähkökemiallinen ekvivalentti
k \u003d CM.
Tämä on kaava toisesta Faraday-laista elektrolyysille, joka kuuluu seuraavasti: aineiden sähkökemialliset ekvivalentit ovat suoraan verrannollisia niiden kemiallisiin ekvivalentteihin.
Korvaamalla sähkökemiallinen ekvivalentti ensimmäisen Faraday-lain kaavassa saamme kaavan yleiseen Faraday-lakiin elektrolyysille:
![]()
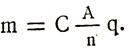
Elektrolyysin aikana vapautuvien aineiden massat ovat suoraan verrannollisia niiden atomipainoihin ja elektrolyytin läpi kulkevaan varaukseen, ja kääntäen verrannollisia aineen valenssiin.
Faradayn lait ovat seurausta elektrolyytin virran ionisesta johtavuudesta. Selitetään tämä sellaisilla esimerkeillä. Oletetaan, että suoritettiin yksiarvoisten aineiden elektrolyysi, esimerkiksi NaCl- ja AgNO3-liuokset. Na- ja Ag-ionien varaukset ovat samat. Kun ionit siirtävät samansuuruisia varauksia, sekä siinä että toisessa ratkaisussa, sama määrä ioneja sopii vastaaviin elektrodeihin. Mutta yhtä suurella määrällä sopivia ioneja, talletettujen aineiden Na ja Ag massat eivät ole samat, koska itse Na- ja Ag-atomien massat ovat erilaisia. Natriumin atomimassa on 22,997; hopea - 107,88; siksi vapautuu melkein viisi kertaa enemmän hopeaa. Tämä tarkoittaa, että elektrolyysin aikana vapautuvan aineen määrä on suoraan verrannollinen sen atomimassaan, mikä Faradayn lailla vahvistetaan.
Siinä tapauksessa, että elektrolyysiin osallistuu erilaisia \u200b\u200bvalensseja sisältäviä ioneja, esimerkiksi Al: n valenssi on 3 ja Na: n valenssi on 1, saman varauksen sisältävien Al- ja Na-ionien lukumäärä on erilainen. Mitä suurempi ionin valenssi, ts. Mitä suurempi sen varaus on, sitä vähemmän ioneja tarvitaan tämän varauksen siirtämiseen (esimerkiksi Al-ionit tarvitsevat kolme kertaa vähemmän kuin Na-ionit). Tällainen ionin valenssin ja varauksen välinen suhde selitetään sillä, että elektrolyysin aikana vapautuneen aineen massa on käänteisesti verrannollinen sen valenssiin.
Saatujen tuotteiden yksinkertaisuuden, edullisuuden ja korkean puhtauden ansiosta elektrolyysiä on käytetty teollisuudessa laajalti alumiinin uuttamiseksi bauksiittimalmeista, metallien (esimerkiksi kupari, sinkki, kulta, hopea) puhdistamiseksi epäpuhtauksista, metalliesineiden päällystämiseksi toisen metallikerroksen kanssa niiden suojaamiseksi ruosteelta. niiden pinnan kovuus (nikkelöinti, kromipinnoitus) korujen valmistukseen (hopeointi, kulta), metallikopioiden hankkiminen helpotuskohteista (esimerkiksi gramofonilevyjen valmistuksessa) haisee, matriisit, kliseet).
Tehtävä 30. Ydinvoimalla käytetty erittäin puhdas lyijy saadaan sähköpuhdistuksella. Laske lyijyn massa, joka on varattu vuodelle 1 tunti virrantiheys 0,02 a / cm2 ja jännitystä 0,5 tuumaa Nykyinen hyötysuhde on 95%. Mikä on allokoinnin energiankulutus? 1 kg johtaa? Katodien kokonaispoikkileikkauspinta-ala, joille lyijy on sijoitettu, 10 m 2.

Kun elektrolyyttisen kylvyn hyötysuhde on 100% kaikesta kulutetusta sähköstä A \u003d UIt lyijy erottuisi m \u003d kltsiksi valinnassa 1 kg lyijyn kuluttama energia ![]() tai
tai
Laskemme
Ans.: M \u003d 7,5 kg; A - 470 kJ / kg.
Faradayn ensimmäinen laki:
Elektrodien vapautuneen aineen massa on suoraan verrannollinen liuoksen läpi kuljetetun sähkön määrään
Faradayn toinen laki:
Kun sähköä johdetaan sulan tai elektrolyytin 96500 Cl liuoksen läpi, elektroneihin vapautuu 1 moolia ekvivalenttia ainetta.
Aineen sähkökemiallinen vastine.
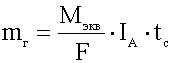 - Faradayn yhdistetty laki.
- Faradayn yhdistetty laki.
Elektrolyysin polarisaatio
Elektrolyysin aikana tapahtuva polarisaatio koostuu todellisesta polarisaatiosta, joka on jaettu kemialliseen ja konsentraatio- sekä ylijännitteeseen.
Kemiallinen polarisaatio
Ent n th solarisoituminen tapahtuu, kun käytetään inerttejä elektrodeja.
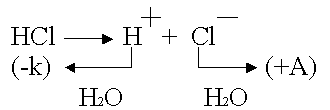 .
.
Minkä inertit elektrodit ovat (Pt, C, keramiikka), ne kaikki adsorboivat kaasuja erittäin hyvin.
Platinum - anodi on kyllästetty kloorilla; platina - katodi imee vetyä.
Klooria voidaan pelkistää vain, vety voidaan hapettaa:
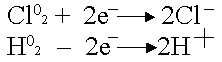 .
.
Elektrolyzeriin muodostuu galvaaninen kenno:
.
Tuloksena olevan galvaanisen kennon sähkövoima kohdistuu ulkoista jännitettä vastaan \u200b\u200bja heikentää sitä.
Tämän tyyppistä polarisaatiota kutsutaan kemialliseksi siitä syystä, että elektrodit näyttävät muuttavan kemiallista luonnettaan.
Polarisaatiolla on kielteinen rooli, koska se johtaa liialliseen sähkönkulutukseen.
Kemiallisesta polarisaatiosta taistellaan kemiallisesti. Aineita, jotka puhdistavat absorboituneiden kaasujen elektrodit, lisätään liuokseen.
Pitoisuuden polarisaatio
Tämä polarisaatio tapahtuu aktiivisella anodilla, esimerkiksi hopealla
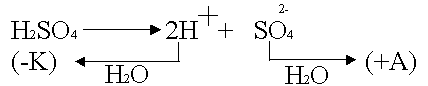
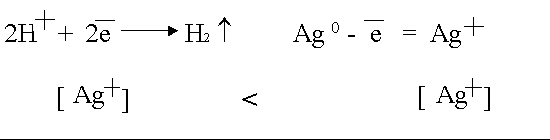 .
.
Diffuusion takia anodista tulevat hopea-ionit taipuvat katodiin, missä ne alkavat palautua vahvemmina hapettimina.
Koska diffuusio nesteissä on hidasta, Ag-ionien konsentraatio anoditilassa on paljon korkeampi kuin katodissa.
Tämän seurauksena elektrolysaattoriin syntyy galvaaninen pitoisuuskenno.
Tuloksena olevan pitoisuuselementin EMF on suunnattu myös ulkoista jännitettä vastaan \u200b\u200bja heikentää sitä.
Pitoisuuspolarisaatio on paljon helpompaa kuin kemiallinen polarisaatio. Se eliminoidaan sekoittamalla liuosta.
Elektrodin ylijännite
Elektrodin ylijännite on ero todellisen ja teoreettisen elektrodipotentiaalin välillä.
Metallien ylikuormitus on niin pieni, että se jätetään huomiotta. Vedyn ja hapen ylijännite on suuri.
Vetyylijännite on korkea seuraavissa olosuhteissa:
- pienet virrantiheydet
- alhaiset liuoslämpötilat.
Ylijännite riippuu myös katodimateriaalista.
Vetyylijännite on suurin niissä metalleissa, jotka sijaitsevat lähellä vetyä jännitesarjassa.
Vetyylijännitteellä voi olla sekä negatiivinen että positiivinen rooli.
Sillä on kielteinen rooli, jos on tarpeen saada vetyä elektrolyyttisesti.
Ylijännitteen positiivinen rooli saadaan tarvittaessa minkä tahansa metallin elektrolyysillä jännitesarjassa vetyyn saakka.
On mahdollista luoda olosuhteet (virrantiheys, liuoksen lämpötila, katodimateriaali, vieraat ionit liuoksessa), joissa metalleista peräisin olevan vedyn korkean ylijännitteen vuoksi on mahdollista saada metallit talteen jännitejärjestyksessä vetyksi (alumiiniin saakka).
Nämä lait määräävät elektrodille muodostetun tuotteen massan ja elektrolyytin läpi kulkevan sähkömäärän (sähkövarauksen) suhteen.
Faradayn ensimmäisen lain mukaan elektrodille muodostuvan aineen massa on verrannollinen siirretyn sähkön määrään. Sähkövarauksen kvantitatiivinen mitta on faraday-yksikkö. Faraday on varaus, joka kuljettaa yhden moolin elektronia tai yhden moolin yksin varautuneita ioneja.
Muista, että luku on Avogadro-luku (katso kohta 4.2).
Hopea-ionien purkautuminen katodilta hopeanitraattiliuoksen elektrolyysin aikana kuvataan puolireaktioyhtälöllä
![]()
Tämän seurauksena 1 Faradayn sähköinen varaus (yksi mooli elektronia) purkaa 1 mooli hopea-ioneja, minkä seurauksena muodostuu 1 mooli hopea-atomeja. Tämä tarkoittaa, että 2 faradipäivän varauksen läpivienti johtaa 2 moolin hopeatomien muodostumiseen, 3 varauksen faradayn ohittaminen johtaa 3 moolin hopeaatomien muodostumiseen jne.
Toisessa Faraday-laissa todetaan, että minkä tahansa ionin yhden moolin purkaamiseksi elektrodille on välttämätöntä, että elektrolyytin läpi viedään sellainen määrä varausta faradipäivänä, joka on yhtä suuri kuin tämän ionin alkuainevarausten lukumäärä.
2 moolin mooli 1 moolia Joten yhden moolin ionien purkamiseksi katodiin, sen läpi on johdettava 2 varausta faradaya (2 moolia elektronia).
Moth 3 mol I mol
Yhden moolin alumiini-ionien purkamiseksi katodista on kuljettava 3 varausta perjantaina (3 moolia elektronia) sen läpi.
Koi 1 mol 2 mol
Yhden moolin bromimolekyylien saamiseksi seurauksena, että kaksi moolia bromi-ioneja purkautuu anodille, on kuljettava 2 varausta perjantaina sen läpi. Siksi yhden moolin bromi-ionien purkamiseksi tarvitaan yksi faraday-varaus.
Faraday ei voinut saada systemaattista koulutusta lapsuudessa. 14-vuotiaana hänestä tuli kirjansidonnan avustaja. Mutta hän kiinnostui pian tieteestä ja kuultuaan kuuluisan kemisti Humphrey Davy'n luentoa, kirjoitti hänelle ja lähetti muistiinpanot luentoon. Davy otti hänet avustajakseen laboratorioonsa Lontoon kuninkaallisessa instituutissa. Faraday oli silloin 21-vuotias.

Michael Faraday pitää joululuentoa kuninkaallisessa instituutissa (Lontoo, 1955) kuninkaallisen perheen jäsenten läsnä ollessa: edessään hänet ovat kuningattaren aviomies, vasemmalla Walesin prinssi (myöhemmin Edward VII), oikealla Edinburghin herttua.
Seuraavina vuosina Faraday löysi kaksi uutta hiilikloridia. Hän onnistui myös laittamaan kloorin ja muut kaasut nestemäiseen tilaan. Vuonna 1825 hän onnistui eristämään bentseenin ja samana vuonna nimitettiin laboratorion päälliköksi. Useiden vuosien ajan hän harjoitti elektrolyysin kokeellista tutkimusta ja lopulta muotoili vuonna 1834 kuuluisat elektrolyysin lait. Siihen mennessä hän oli jo löytänyt sähkömagneettisen induktion ilmiön.
Faradaystä tuli kuninkaallisen yhdistyksen presidentti ja hän kirjoitti useita kirjoja, muun muassa "Kemian ja fysiikan kokeelliset tutkimukset" (1858). Vuonna 1855 muistin heikentymisen vuoksi hänet pakotettiin lopettamaan tutkimustyö. Vuonna 1867 Faraday kuoli.
