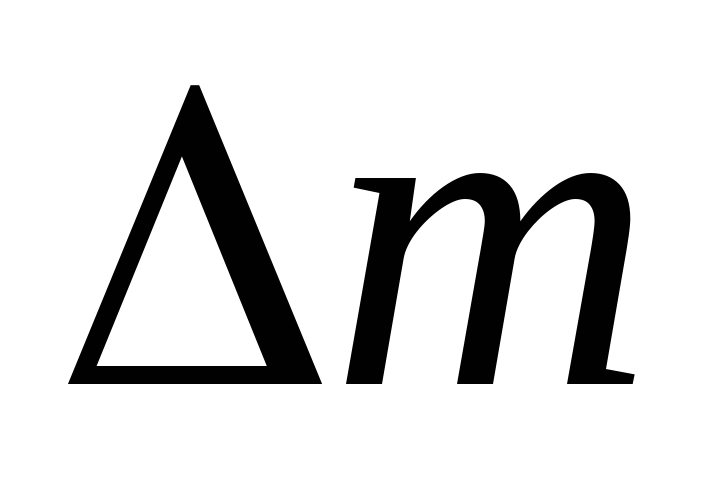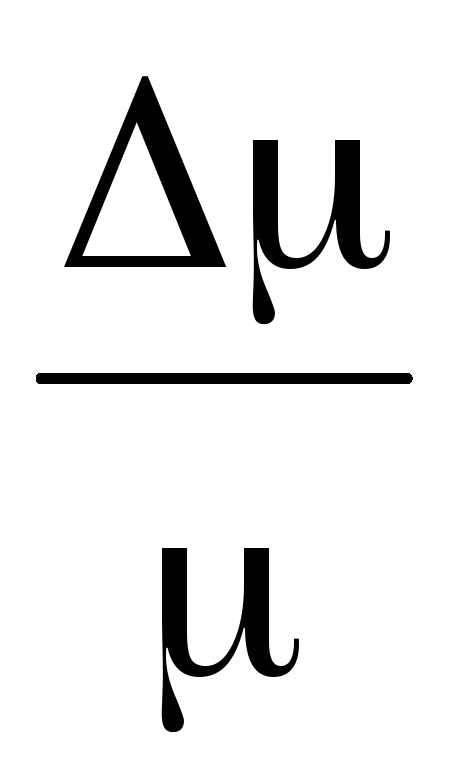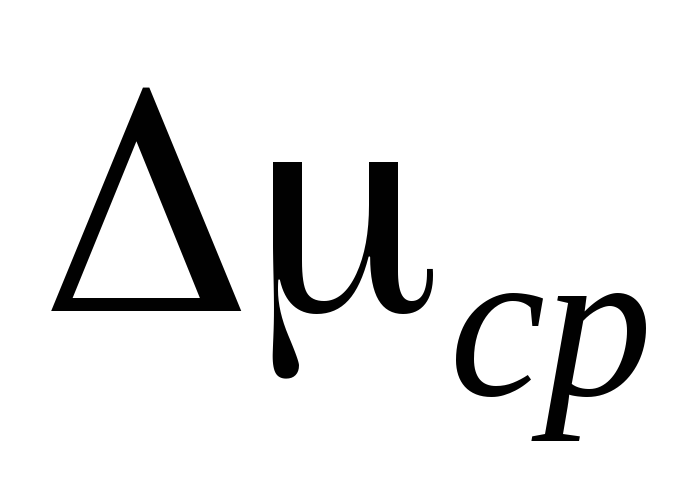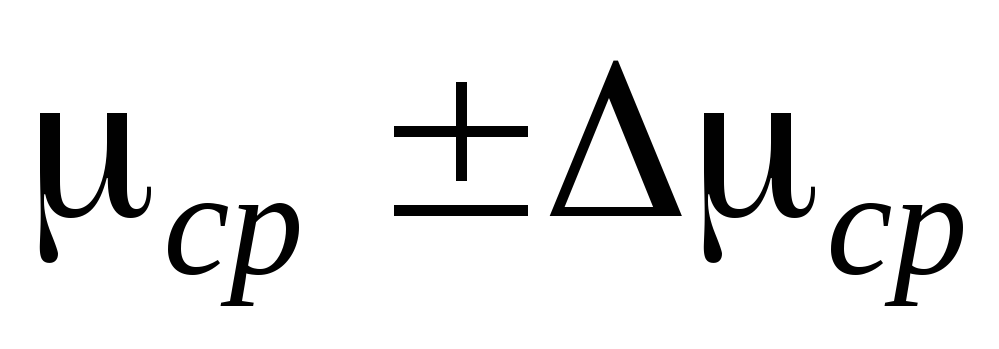Moolimassan mittayksikkö: g / mol. Koska CO2: n ja H2O: n molekyylimassat ja hapen atomimassat ovat vastaavasti 44; 18 ja 16a.e.m., niiden moolimassat ovat yhtä suuret: a) 44 g / mol; b) 18 g / mol; c) 16 g / mol.
Samalla tavalla muiden yhdisteiden molekyylimassat lasketaan kemiallisissa laskelmissa. Molekyylimassa on ominaisuus molekyylin keskimääräiselle massalle; se ottaa huomioon kaikkien tiettyä kemiallista ainetta muodostavien elementtien isotooppisen koostumuksen. Tämä indikaattori voidaan määrittää myös useiden aineiden seoksille, joiden koostumus on tiedossa. Tämän lain mukaan samoissa olosuhteissa sama määrä molekyylejä on läsnä samoissa kaasumäärissä.
Tiettyjen tunnettujen kaasumäärien massa määritetään tietyssä paineessa ja lämpötilassa. Tämä menetelmä antaa melko tarkkoja molekyylimassien arvoja, joita joskus käytetään jopa kemiallisten yhdisteiden atomimassien määrittämiseen. Karkeaksi arvioimiseksi molekyylipainosta kaasua pidetään yleensä ihanteellisena, eikä lisäkorjauksia tehdä.
Ilma on välttämätön elävien organismien normaalille olemassaololle maan päällä. Teollisuudessa ja jokapäiväisessä elämässä ilmakehän happea käytetään polttamaan polttoainetta lämmön ja mekaanisen energian tuottamiseksi polttomoottoreissa. Vuonna 1754 Joseph Black osoitti kokeellisesti, että ilma on kaasuseos eikä homogeeninen aine. Ensimmäinen symboli on yleisesti hyväksytty kuva elementtiilmasta. Kolmas kuva on muutoksen kirjassa oleva ilmapiiri.
Vapaus kudotaan ihmisen ilmasta. Siksi ilman symboli on ensinnäkin vapauden symboli. Tämä on vapaus, jolle ei ole esteitä, koska ilmaa ei voida rajoittaa, et voi kiinni ja muokata sitä.
Ilmakehän ilma on sekoitus kuivaa ilmaa ja vesihöyryä (0,2% - 2,6%). Siten ilmaa voidaan melkein aina pitää kosteana. Kuivan ilman ja vesihöyryn mekaanista seosta kutsutaan kosteaksi ilmaksi tai ilma-höyryseokseksi. Absoluuttinen kosteus on höyryn massa 1 m3 kosteaa ilmaa.
Sammuttamalla tulipalo vedellä, luodaan molemmat olosuhteet: vesi jäähdyttää palavia esineitä ja sen höyry estää ilman pääsyä niihin. Kysymystä ilman koostumuksesta tieteessä ei ratkaistu välittömästi: ranskalainen tutkija A. Lavoisier osoitti vuonna 1774, että ilma on sekoitus pääasiassa kahdesta kaasusta - typestä ja hapesta. Lisäksi ilma sisältää hiilimonoksidia (IV) ja vesihöyryä. Ilman arvioitu koostumus on esitetty taulukossa.
Argonin inertissä ilmakehässä suoritetaan helposti hapettuneiden metallien sähköhitsaus. Hehkulamput täyttävät neonin, argonin, kryptonin ja ksenonin. Olet jo perehtynyt hapen aineiden palamiseen. Aineiden palamisen aikana ilmassa muodostuu pääsääntöisesti samoja tuotteita, ts. Erilaisia \u200b\u200boksideja. Korjaa palaneen aineen muodostavien elementtien atomien lukumäärä: C6H6 + O2-\u003e 6CO2 + 3H2O3.
Tätä tekniikkaa käytetään palojen sammuttamiseen, jos poltetaan öljyä ja sen tuotteita. Ilman kemiallisella koostumuksella on tärkeä hygieeninen merkitys, koska sillä on ratkaiseva merkitys kehon hengityselinten toteuttamisessa.
Asuinrakennuksissa, julkisissa tiloissa ja urheilutiloissa happipitoisuuden merkittäviä muutoksia ei havaita, koska ulkoilma saapuu niihin. Ilman pitkäaikaisessa hengittämisessä, jonka hiilidioksidipitoisuus on 1 - 1,5%, tuntuu olleen pahempaa, ja patologiset muutokset havaitaan 2 - 2,5%: lla.
Kuinka löytää ilman moolimassa
Elementtien atomille on ominaista tietty (vain niille luontainen) massa. Suhteellisen molekyylimassan arvot lasketaan suhteellisen atomimassan arvoista ottaen huomioon kunkin alkuaineen atomien lukumäärä kompleksisen aineen kaavayksikössä. Monimutkaiseen aineeseen sisältyvien alkuaineiden massaosuuksien summa on 1 (100%). Kemiallisissa laskelmissa kaasumaisten reagenssien ja tuotteiden massa korvataan usein niiden tilavuuksilla. Tämä fysikaalinen vakio on kaasun moolitilavuus normaaleissa olosuhteissa.
Ne perustuvat massan säilyttämislakeihin, koostumuksen pysyvyyteen, monisuhteisiin sekä kaasulakeihin - tilavuussuhteisiin ja Avogadroun. Tämän perusteella tuotannossa materiaalitaseet lasketaan. Laki on aina totta kaasumaisiin ja nestemäisiin aineisiin. Monisuhteiden laki, kuten koostumuksen pysyvyyslaki, ei ole universaali eikä myöskään kohtuullinen kiinteiden aineiden suhteen. Esimerkiksi 2 tilavuusosan vedyn ja 1 tilavuuden hapen vuorovaikutuksessa muodostuu 2 tilavuusosa vesihöyryä. Nämä luvut ovat yhtäpitäviä stoikiometristen kertoimien kanssa reaktioyhtälössä.
Tunnettujen elementtien suhteelliset atomimassat on esitetty taulukossa ”Alkuaineiden jaksollinen taulukko D.I. Mendeleev. " Aineen B määrä on fysikaalinen määrä, joka ilmaisee aineen kaavayksiköiden lukumäärän suhteessa Avogadro-vakioon. Avogadro-vakio puolestaan \u200b\u200bosoittaa 12 g: n hiili-isotoopin 126C sisältämien atomien lukumäärän tai atomimassan yksiköiden lukumäärän 1 grammassa ainetta.
10. Kaasumaisessa tilassa olevien aineiden molekyylipainojen määrittäminen.
Itse asiassa hiili-isotoopin 126С Ar \u003d 12 ja atomien moolimassa (termin "mol" määritelmällä) on 12 g / mol. Normaaliolosuhteissa (101,325 kPa; 273 K) minkä tahansa kaasun moolitilavuus on 22,4 l / mol (tarkemmin sanoen, Vn \u003d 22,4 l / mol). Ei-ihanteellisille kaasuille, joita kutsutaan todellisiksi, moolitilavuudet ovat erilaisia \u200b\u200bja hieman erilaisia \u200b\u200bkuin tarkka arvo. Jos kaasun tilavuus ja paine ilmaistaan \u200b\u200bmuissa mittayksiköissä, Clapeyron-Mendelejev-yhtälössä oleva kaasuvakion arvo on eri arvo.
Siksi niitä käytetään valaistuihin merkkeihin ja majakoihin. Aineiden palaminen ilmassa. Kaasumaisessa tilassa olevien aineiden moolimassien määrittäminen: Lain mukaan samassa lämpötilassa ja samassa paineessa otettujen kaasumäärien Avogadroravnyh sisältää yhtä suuri määrä molekyylejä. Ilman molekyylimassa, kuten muutkin kaasut, voidaan löytää käyttämällä Avogadro-lakia.
Sivu 1
Ilman molekyylipaino lasketaan ottaen huomioon eri komponenttien prosenttiosuus. Ilmamolekyylin massalla tarkoitetaan ilmassa olevien molekyylien massojen keskimääräistä arvoa ottaen huomioon niiden suhteellinen pitoisuus.
Ilman molekyylipaino lasketaan ottaen huomioon eri komponenttien prosenttiosuus. Ilmamolekyylin massalla tarkoitetaan ilmassa olevien molekyylien massojen keskimääräistä arvoa ottaen huomioon niiden suhteellinen pitoisuus.
K; M on ilman molekyylipaino; rzab - ilmanpaine sivulla.
Rvzh - sama haihtuvan nesteen pinnan yläpuolella, kg / m3, Мв - ilman molekyylipaino, joka on yhtä suuri kuin 29; MP on haihduttavan nesteen höyryn molekyylipaino.
Joten ilman ilmamolekyylien laskemiseksi maan ilmakehässä, riittää, että tiedät vain merenpinnan ilmanpaineen, ilman molekyylipainon, Maan säteen ja gravitaation kiihtyvyyden g sen pinnalla. Vastaukseen ei sisälly ilmakehän korkeutta, on vain tärkeää, että se on pieni verrattuna maan säteeseen.
| Maakaasun hiilivetykomponenttien ominaisuudet Maakaasun pseudokriittisen lämpötilan ja paineen laskeminen. |
Siksi kaasun molekyylipainon määrittämiseksi on tarpeen kertoa sen ominaispaino (määritettynä ilmalle 1) ilman molekyylipainolla.
Ah, cm, yhden sekunnin ajan painehäviöllä väliseinän molemmille puolille Ar, dyne / cm2; M on ilman molekyylipaino, g / mol; R on yleinen kaasuvakio, erg / mol on aste.
Ideaalikaasujen lakien perusteella voidaan osoittaa, että kaasun ominaispaino on yhtä suuri kuin kaasun molekyylipainon ja ilman molekyylipainon välinen suhde.
Samasta materiaalista valmistetun aidan suunnittelussa voi kuitenkin olla myös epäsuhta materiaalin höyrynläpäisevyydessä ja ilmanläpäisevyydessä. Tämä johtuu siitä, että rakenteessa on väistämättä vuotoja ja rakoja, jotka lisäävät merkittävästi aidan läpäisevyyttä, ja myös siitä syystä, että ilman ja vesihöyryn moolimassa ei ole sama.
Luonnonkaasujen karakterisoimiseksi sen ominaispainoa käytetään laajasti. Suhteellinen kaasutiheys ilmaistaan \u200b\u200bkaasun tiheyden ilmakehän paineessa ja standardilämpötilassa suhteessa ilman tiheyteen samassa paineessa ja lämpötilassa. Koska ilmakehän paineessa ja tietyssä lämpötilassa kaasujen tiheydet ovat suoraan verrannollisia niiden molekyylipainoihin, kaasun suhteellista tiheyttä voidaan esittää kaasun molekyylipainon suhteena ilman molekyylipainoon. Luonnonkaasujen suhteellinen tiheys vaihtelee välillä 0 - 1 1 riippuen raskaampien hiilivetyjen suhteellisesta pitoisuudesta kaasussa.
Hiilidioksidilaitoksissa kuivajään tuotannon on myös poistettava ilma järjestelmästä. Edellä mainittujen ilman tunkeutumisreittien lisäksi, jäägeneraattoreissa kuivajääjää tuottavissa järjestelmissä, ilma menee systemaattisesti järjestelmään poistaessaan jääpaloja jäägeneraattoreista. Kun jääpala putoaa, jääpalakoneen tilavuus täytetään ilmalla, joka kompressori imee jääpalakoneen päälle kytkettäessä ja tulee yhdessä hiilidioksidin kanssa lauhduttimeen. Koska hiilidioksidin moolimassa on suurempi kuin ilman molekyylipaino, kuvaajan pa / (ga) viivojen luonne on samanlainen kuin freonien. Mutta koska hiilidioksidin ja ilman molekyylipainot eivät eroa paljon freoneista, graafin viivat merkitsevällä alueella ovat lähellä suoraa. R. R. Skvarchenkon (VNIIH) rakentama hiilidioksidin nimikirja on esitetty kuviossa 3.
Hiilidioksidilaitoksissa kuivajään tuotannon on myös poistettava ilma järjestelmästä. Edellä mainittujen ilman tunkeutumisreittien lisäksi, jäägeneraattoreissa kuivajääjää tuottavissa järjestelmissä, ilma menee systemaattisesti järjestelmään poistaessaan jääpaloja jäägeneraattoreista. Kun jääpala putoaa, jääpalakoneen tilavuus täytetään ilmalla, joka kompressori imee jääpalakoneen päälle kytkettäessä ja tulee yhdessä hiilidioksidin kanssa lauhduttimeen. Koska hiilidioksidin moolimassa on suurempi kuin ilman molekyylipaino, kuvaajan f (ga) viivojen luonne on samanlainen kuin freonien. Mutta koska hiilidioksidin ja ilman molekyylipainot eivät eroa paljon freoneista, graafin viivat merkitsevällä alueella ovat lähellä suoraa.
Murom-instituutti (sivuliike)
liittovaltion budjettioppilaitos
korkea-asteen ammatillinen koulutus
"Vladimirin valtion yliopisto
nimetty Alexander Grigorjevitšin ja
Nikolai Grigorievich Stoletovs
Osasto: "FPM"
Kurinalaisuus: Fysiikka
Laboratoriotyö nro 6.03
Hyväksytty metodologisella pohjalla
fPM-osaston seminaari
Pää. Tuoli ____________
Laboratoriotyö nro 6.03
MOLEKULAARINEN MASSAN MÄÄRITTÄMINEN
Työn tarkoitus- tutustua yhteen menetelmistä kaasun molekyylipainon määrittämiseksi ja mitata ilman molekyylipaino.
Laitteet ja tarvikkeet: ilmasylinteri, punnituslaite tai tekninen vaaka, painemittari, vaaka, tyhjiöpumppu.
TURVALLISUUS
Käsittele kangaslaukussa olevaa lasipulloa varovasti.
TEOREETTISET TIEDOT
Molekyylimassa on tietyn aineen molekyylin massan suhde 1/12: aan hiiliatomin C massasta.
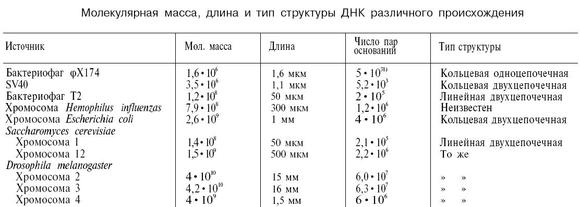
Molekyylimassa, määritelmän mukaan, voidaan esittää molekyylin muodostavien elementtien atomimassojen summana
=
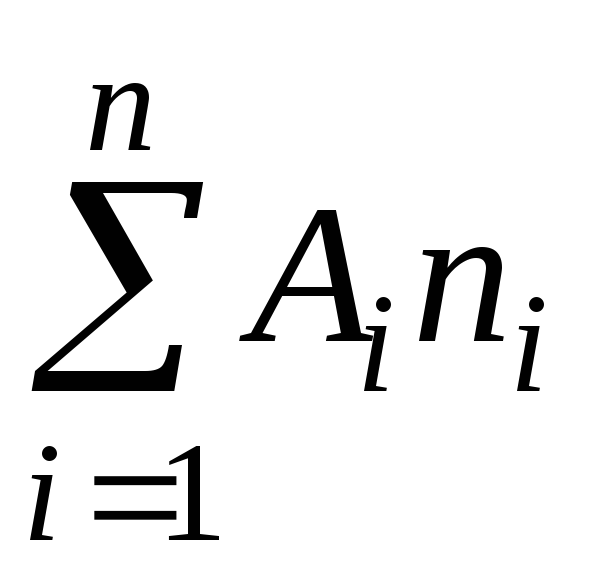 (1)
(1)
missä A on atomimassa th elementti, joka sisältyy molekyylin koostumukseen;
n on atomien lukumäärä.
Molekyylimassamääritysmenetelmät jaetaan kahteen ryhmään - absoluuttisiin ja tilastollisiin. Absoluuttisiin menetelmiin, jotka antavat "todellisen" molekyylipainon arvon, sisältyy massaspektroskopia. Muut menetelmät antavat vain molekyylipainon keskiarvon.
Kaasujen molekyylimassan määritys perustuu kaasun tilan yhtälöön
PV \u003d 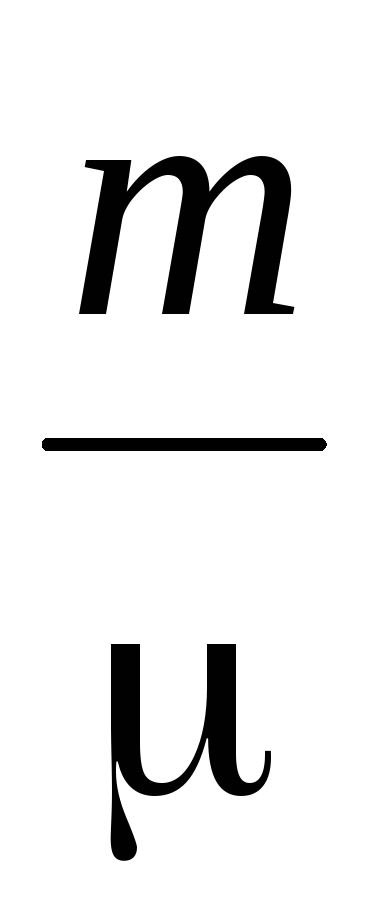 RT (2)
RT (2)
missä P on kaasun paine
m, V - sen massa ja tilavuus,
T - absoluuttinen lämpötila
R on yleinen kaasuvakio,
on keskimääräinen molekyylipaino.
Yhtälö 2 on voimassa vain ihanteelliselle kaasulle. Ihanteellinen kaasu on sellainen kaasu, jonka molekyylien välillä ei ole vuorovaikutusvoimia (vetovoima ja heijastus). Ihanteellisen kaasun molekyylit esitetään elastisten pallojen muodossa, joiden koko on äärettömän pieni. Oikeilla kaasuilla on vuorovaikutusvoimia molekyylien välillä, eikä molekyylejä aina voida pitää elastisina palloina, joiden koko on häviävän pieni, joten oikeat kaasut poikkeavat laista (2).
Kuitenkin ei liian korkeissa paineissa, kun kaasumolekyylit voivat kulkea suuria matkoja vapaasti ennen törmäystä, molekyylien vuorovaikutus voidaan jättää huomiotta, molekyylien koko voidaan myös jättää huomiotta (kun kaasun tilavuus on riittävän suuri), todellinen kaasu on lähellä ideaalia ja yhtälö (2) voi sovellettava. Ilmakehän paineessa ja huoneenlämpötilassa monia kaasuja (typpi, vety, helium, happi, ilma jne.) Voidaan pitää ihanteellisena kaasuna, jolla on melko hyvä arvio.
Tärkeä ominaisuus molekyyliliikkeelle on keskimääräinen vapaa polku. Kaasussa olevat molekyylit ovat jatkuvan ja kaoottisen liikkeen tilassa, törmäävät keskenään, ja jokin polku проходят kulkee vapaasti törmäysten välillä. Tämän reitin pituus kahden törmäyksen välillä on erilainen, mutta molekyylien suuren määrän ja niiden liikkumattomuuden vuoksi voimme puhua molekyylien keskimääräisestä vapaasta polusta. Molekyylien keskimääräinen keskimääräinen vapaa polku voidaan määrittää kaavalla
 =
=
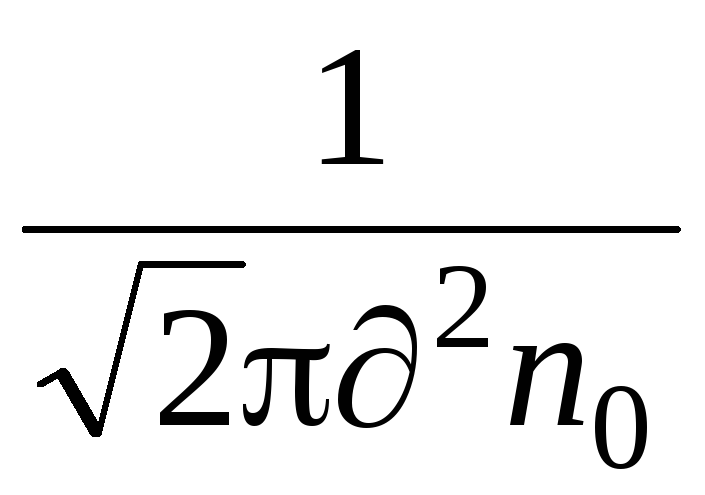 ,
,
missä on molekyylin efektiivinen halkaisija (ilmalle, \u003d 0,27 · 10 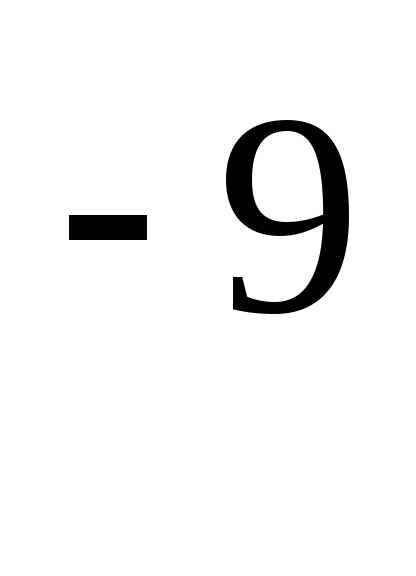 m),
m),
n  - molekyylien lukumäärä tilavuusyksikköä kohti.
- molekyylien lukumäärä tilavuusyksikköä kohti.
n  =
=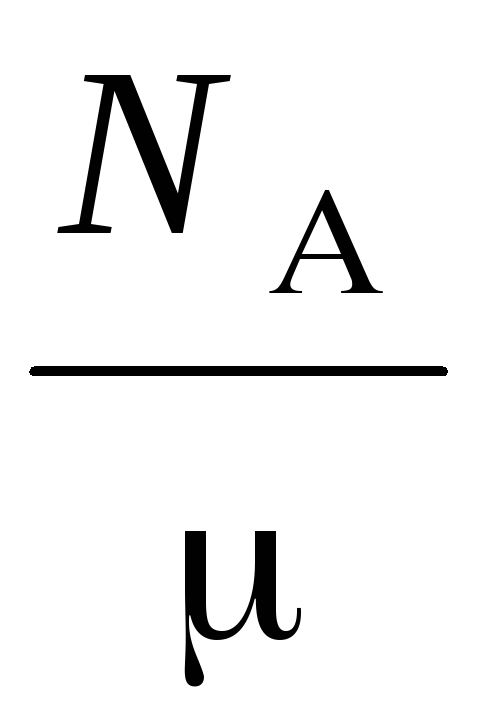
 ,
,
sitten annettiin tämä kaava , sillä on muoto:
=
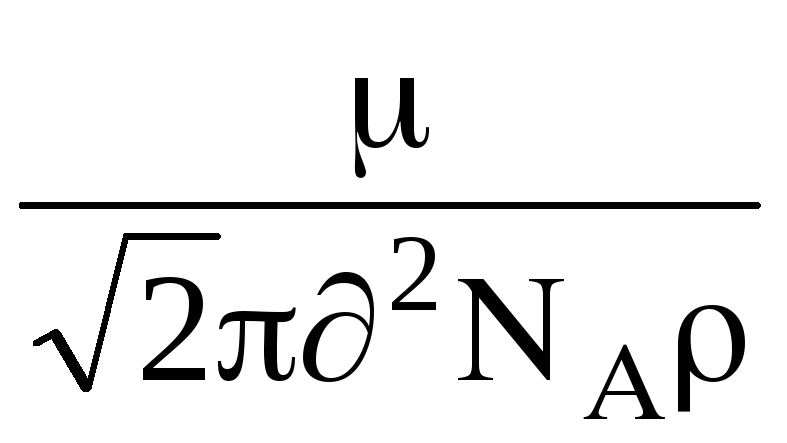 ,
,
jossa  - kaasun molekyylimassa, N
- kaasun molekyylimassa, N  - Avogadro-luku, - kaasutiheys.
- Avogadro-luku, - kaasutiheys.
Anna avoimen sylinterin ilman ottaa tilavuuden Vsen massa tilmakehän paine P; pumppaa ilmaa sylinteristä P: ään  . Nyt sylinterissä olevan ilman massa on m
. Nyt sylinterissä olevan ilman massa on m  . Näille kahdelle tilalle kirjoitetaan yhtälö (2)
. Näille kahdelle tilalle kirjoitetaan yhtälö (2)
PV \u003d 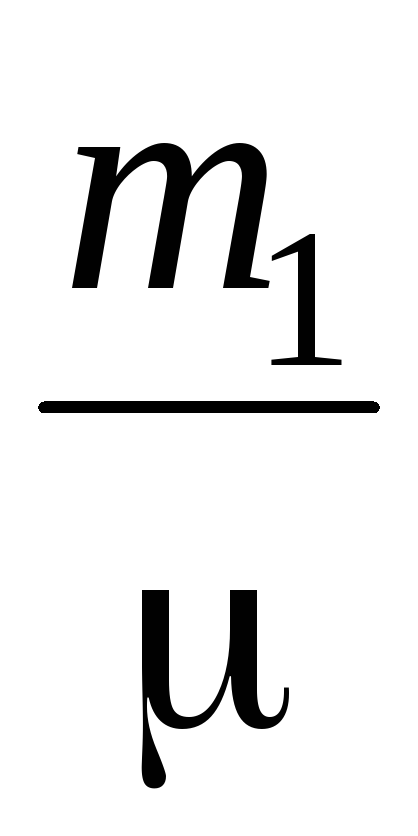 RT (3)
RT (3)
P  V \u003d
V \u003d 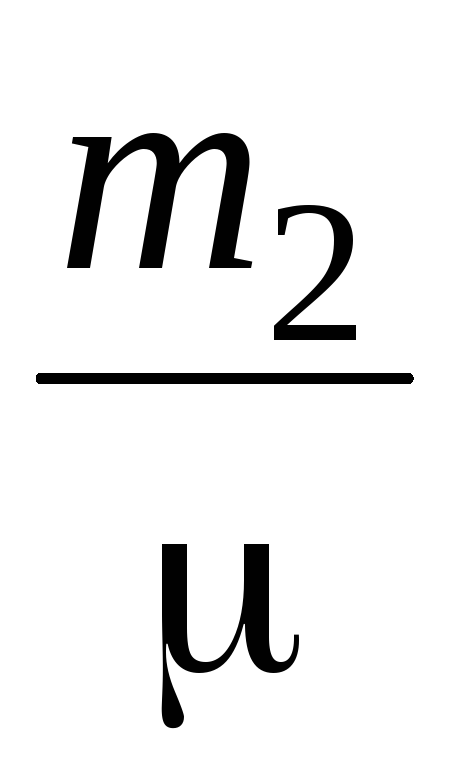 RT (4)
RT (4)
Vähentämällä kohdasta (3) (4) ilmaistaan \u200b\u200b.
=
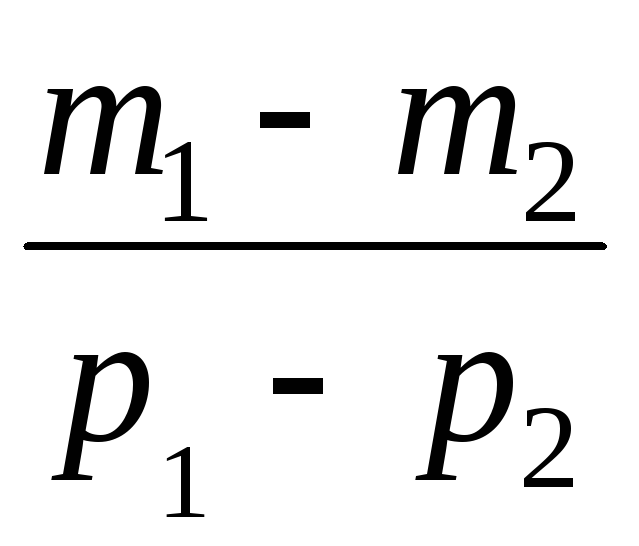
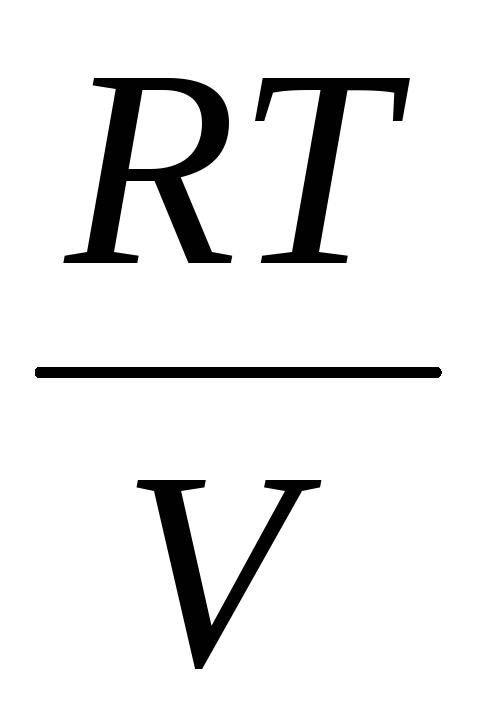 =
=
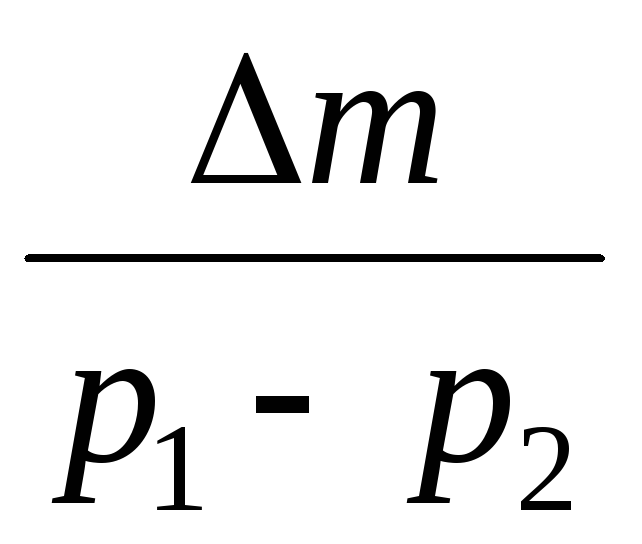
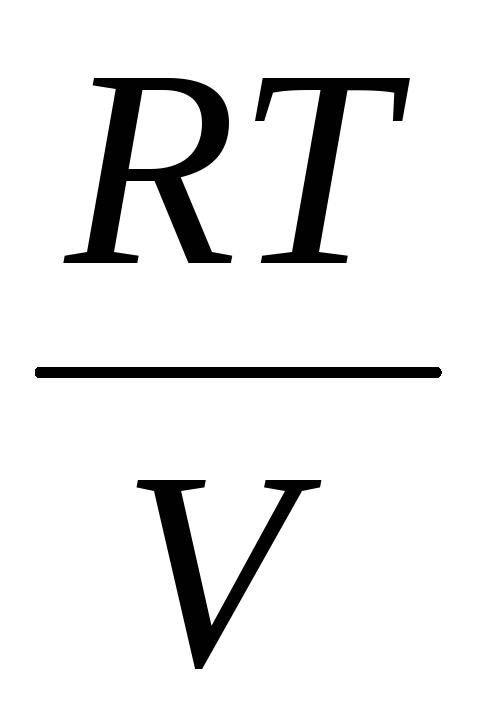 (5)
(5)
Siten, kun tiedämme massan muutoksen paineen muutosten kanssa, voimme löytää ilman molekyylimassan kaavalla (5).
ASENNUKSEN KUVAUS
Asennuksen yleiskuva on esitetty kuvassa. 1. Asennus koostuu tyhjiöpumpusta (1) , venttiili (2) (venttiilin 2 avulla järjestelmä irroitetaan tyhjiöpumpusta), tyhjiömittari (3). Tyhjiömittarin osoittimen kierto on verrannollinen järjestelmässä saavutettuun tyhjiöön, ts. ilmakehän paineen ja ilmanpaineen välinen ero laitoksessa. Mitta-asteikon nolla-arvo vastaa ilmakehän paineita laitoksessa. Laite alkaa näyttää vain pumppaamalla ilmaa järjestelmästä, ts. ilmanpaineessa laitoksessa ilmakehän alapuolella.
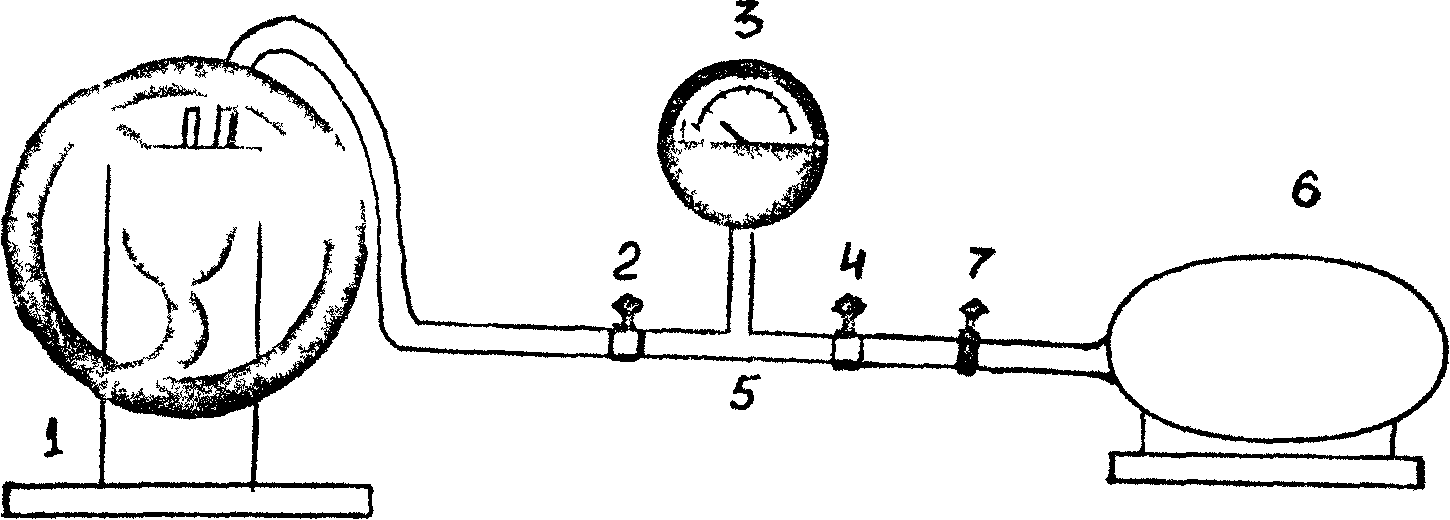
Nosturilla 4 järjestelmä yhdistetään ilmakehään. Kuvassa 1 Kuviossa 1 on esitetty tyhjöputki (5), irrotettava sylinteri (6) (tilavuus minä/ 1225 ml) kumiputkella ja puristimella (7), jonka tarkoituksena on irrottaa sylinteri 6 ilmakehästä punnittaessa.
Mennä töihin
Tehtävä 1. Ilman molekyylimassan määrittäminen.
1. Avaa hanat 2 ja 4, puristin 7 ja irrota sylinteri 6 asennuksesta. Punnitaan ilmapallo 6 yhdessä kumiputken ja puristimen 7 kanssa ja merkitään mittaustulokset taulukkoon I. Punnitseminen on suoritettava melko suurella tarkkuudella, ja tämä toiminta on erityisen huomattava.
2. Liitä sylinteri 6 asennukseen ja pumppaa ilma pois sylinteristä niin, että paine muuttuu  P \u003d 0,1
P \u003d 0,1 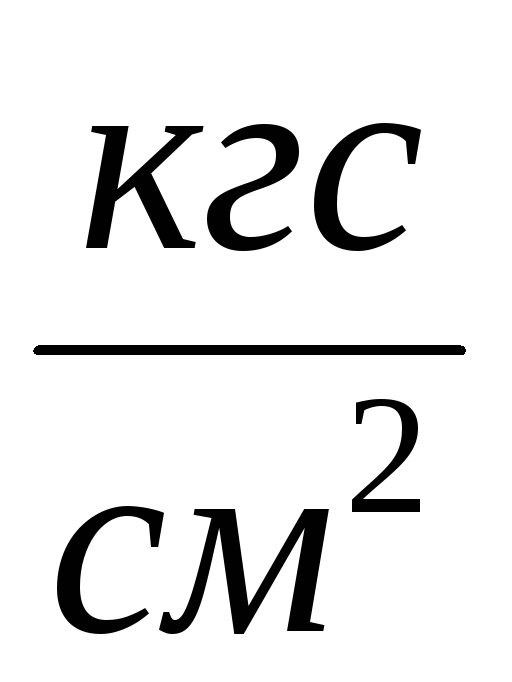 . Sulje hana 2 ja kirjoita
. Sulje hana 2 ja kirjoita  P mittaustaulukkoon. Sulje venttiili 4, paina 7 ja irrota sylinteri 6 asennuksesta ja punnitse se. Mittaustulokset syötetään taulukkoon.
P mittaustaulukkoon. Sulje venttiili 4, paina 7 ja irrota sylinteri 6 asennuksesta ja punnitse se. Mittaustulokset syötetään taulukkoon.
3. Avaa puristin 7, avaa hanat 2 ja 4 tasaisesti ja vaihe 2 toista vielä 4 kertaa muille arvoille  P.
P.
4. Laskemme mittaustulosten perusteella ilman ja arvioimme mittausvirheen.
Tehtävä 2. Ilman tiheyden määrittäminen.
Ilman tiheys määritetään käyttämällä Mendelejev-Klaiperon-yhtälöä ihanteellisille kaasuille.
PV \u003d 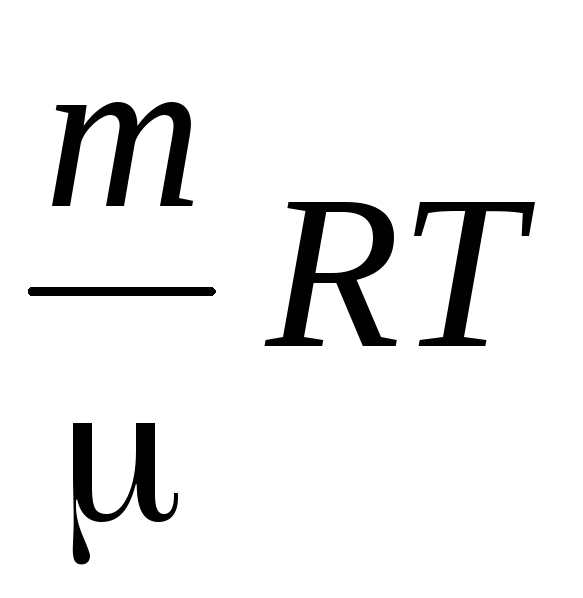 .
.
Tästä yhtälöstä seuraa, että vuodesta 2001 lähtien 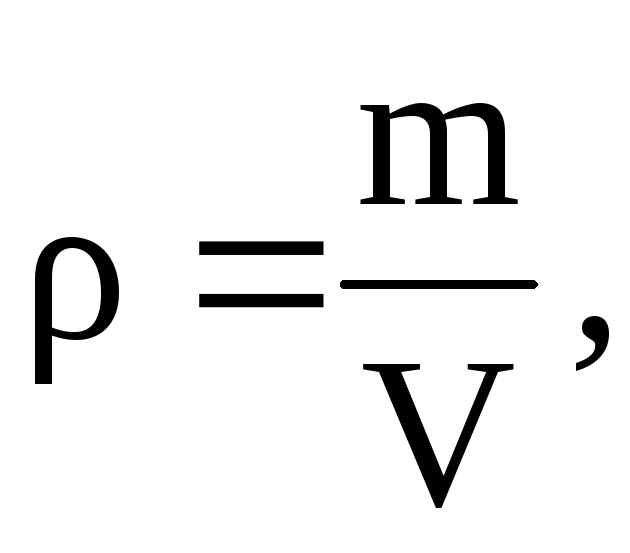
=
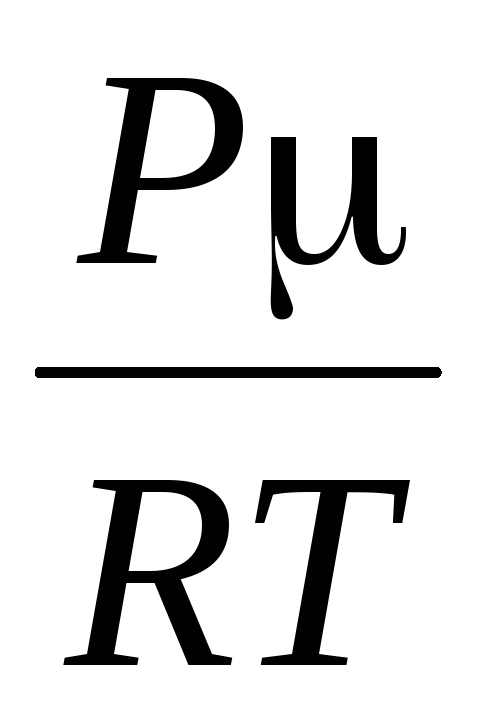 ,
,
jossa R \u003d 8,31 * 10 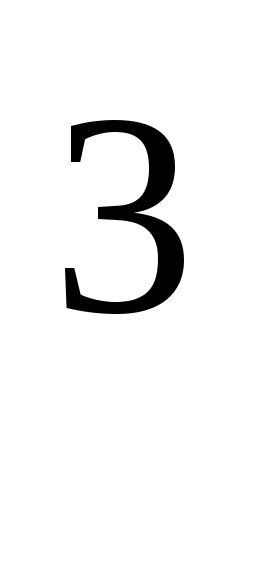 J / (kmol · K), yleinen kaasuvakio.
J / (kmol · K), yleinen kaasuvakio.
Ensin määritetään ilman tiheys sylinterissä ennen evakuointia olettaen, että paine P \u003d P  yhtä suuri kuin ilmanpaine (P
yhtä suuri kuin ilmanpaine (P  \u003d 101 kPa). Sitten määritetään ilman tiheys erilaisilla
\u003d 101 kPa). Sitten määritetään ilman tiheys erilaisilla  P otetaan mittataulusta olettaen, että pullon paine on P \u003d P
P otetaan mittataulusta olettaen, että pullon paine on P \u003d P  -
- P.
P.
Laadi laskelmatulosten perusteella kuvaaja tiheyden riippuvuudesta paineesta P: 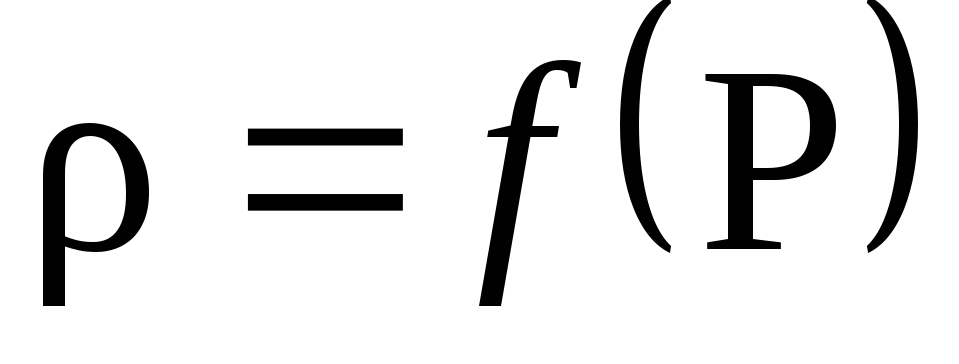
MITTAUSPÖYTÄ
|
m |
|
|
|
|
|
| ||||||
Tehtävä 3. Lasketaan laskettujen laskelmien perusteella keskimääräinen vapaa polku ja piirretään : n riippuvuus : sta: 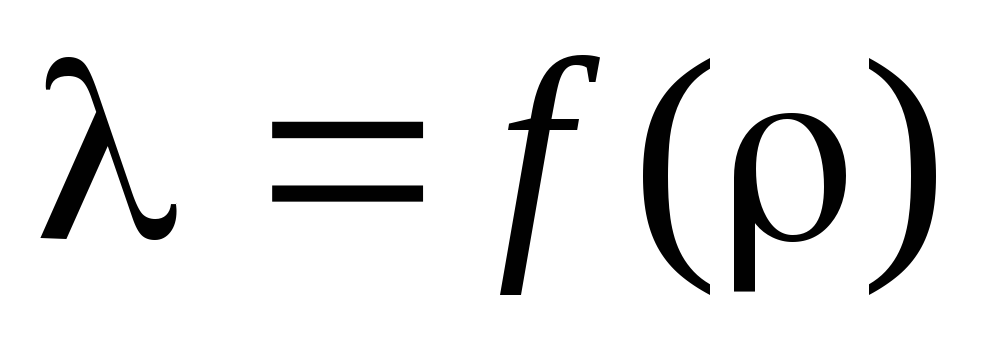 .
.
VALVONTAKYSYMYKSET
1. Luettele ideaalikaasujen molekyylis-kineettisen teorian pääkohdat.
2. Mitä fyysisiä määriä kutsutaan kaasutilan parametreiksi, anna niiden määritelmä.
3. Formuloi ihanteellisten kaasujen lait.
4. Missä olosuhteissa kaasu noudattaa ihanteellisen kaasun lakeja?
5. Missä olosuhteissa Clapeyron-Mendeleev-yhtälöä voidaan soveltaa kaasuihin.
6. Mikä on molekyylipaino, mistä molekyylipaino riippuu.
7. Ilman tiheys, mistä se riippuu?
8. Kaasumolekyylien keskimääräinen vapaa polku ja efektiivinen halkaisija.
9. Johda kaavat : n ja : n laskemiseen.
10. Mitkä mittaukset tulisi tehdä molekyylipainon ja ilman tiheyden laskemiseksi.
Luettelo viitteistä
1. Saveliev I.V. Yleinen fysiikan kurssi. M .: Nauka, 1970.V.1, § 98.
2. A.A. Detlaf B.M. Jaworski. Fysiikan kurssi. M .: Yliopiston kustantamo, 1973, sivut 175 - 179.