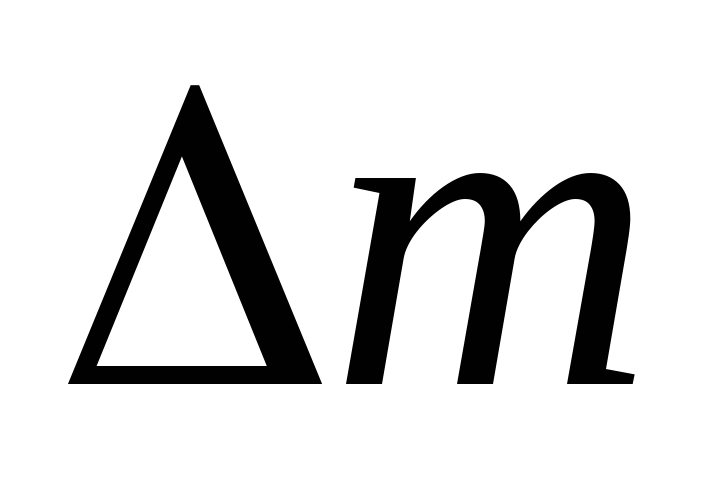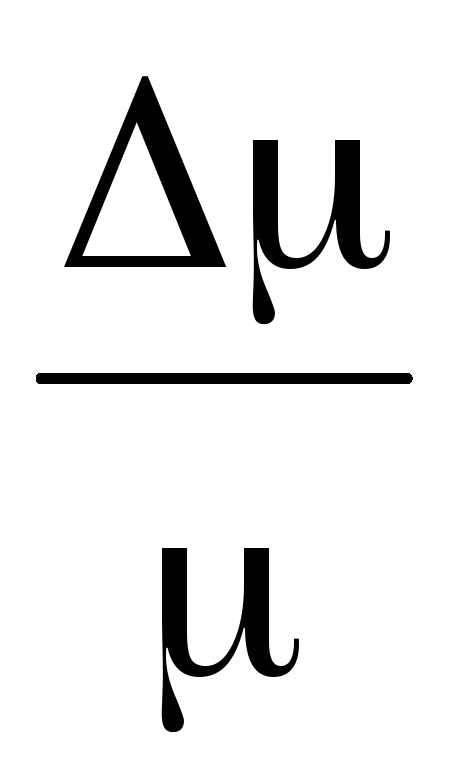Jednotka merania molárnej hmotnosti: g / mol. Pretože molekulové hmotnosti CO2 a H2O a atómová hmotnosť kyslíka sú 44; 18 a 16a.e.m., potom sa ich molárna hmotnosť rovná: a) 44 g / mol; b) 18 g / mol; c) 16 g / mol.
Rovnakým spôsobom sa molekulové hmotnosti ostatných zlúčenín počítajú chemickými výpočtami. Molekulová hmotnosť je charakteristickým znakom priemernej hmotnosti molekuly, zohľadňuje izotopové zloženie všetkých prvkov, ktoré tvoria danú chemickú látku. Tento ukazovateľ je možné určiť aj pre zmes niekoľkých látok, ktorých zloženie je známe. Tento zákon uvádza, že za rovnakých podmienok je rovnaký počet molekúl prítomný v rovnakých objemoch plynu.
Hmotnosť určitého známeho objemu plynu sa určuje pri určitom tlaku a teplote. Táto metóda poskytuje pomerne presné hodnoty molekulových hmotností, ktoré sa niekedy používajú aj na stanovenie atómových hmotností chemických zlúčenín. Pre hrubý odhad molekulovej hmotnosti sa plyn zvyčajne považuje za ideálny a nevykonávajú sa žiadne ďalšie korekcie.
Na normálnu existenciu živých organizmov na Zemi je potrebný vzduch. V priemysle a v každodennom živote sa atmosférický kyslík používa na spaľovanie paliva na výrobu tepla a mechanickej energie v spaľovacích motoroch. V roku 1754 Joseph Black experimentálne dokázal, že vzduch je zmesou plynov a nie homogénnou látkou. Prvým symbolom je všeobecne akceptovaný obraz prvku vzduchu. Tretí obrázok predstavuje trigram vzduchu v knihe zmien.
Sloboda je tkaná zo vzduchu človeka. Symbol vzduchu je preto predovšetkým symbolom slobody. Je to sloboda, pre ktorú neexistujú žiadne prekážky, pretože vzduch nemožno obmedzovať, nemôžete ju chytiť a tvarovať.
Atmosférický vzduch je zmesou suchého vzduchu a vodnej pary (od 0,2% do 2,6%). Vzduch možno teda takmer vždy považovať za vlhký. Mechanická zmes suchého vzduchu a vodnej pary sa nazýva vlhký vzduch alebo zmes vzduch-para. Absolútna vlhkosť je hmotnosť pary v 1 m3 vlhkého vzduchu.
Pri hasení požiaru vodou sa vytvárajú obidve podmienky: voda ochladzuje horiace predmety a jej para bráni prístupu vzduchu. Otázka zloženia vzduchu vo vede nebola okamžite vyriešená V roku 1774 francúzsky vedec A. Lavoisier dokázal, že vzduch je zmesou hlavne dvoch plynov - dusíka a kyslíka. Okrem toho vzduch obsahuje oxid uhoľnatý (IV) a vodnú paru. Približné zloženie vzduchu je uvedené v tabuľke.
V inertnej atmosfére argónu sa vykonáva elektrické zváranie ľahko oxidovaných kovov. Žiarovky vyplnia neón, argón, kryptón a xenón. Už ste sa oboznámili so spaľovaním látok v kyslíku. Pri spaľovaní látok vo vzduchu sa spravidla vytvárajú rovnaké produkty, to znamená rôzne oxidy. Vyrovnajte počet atómov prvkov, ktoré tvoria spálenú látku: C6H6 + O2-\u003e 6CO2 + 3H2O3.
Táto technika sa používa na hasenie požiarov v prípade horenia oleja a jeho produktov. Chemické zloženie vzduchu má dôležitý hygienický význam, pretože zohráva rozhodujúcu úlohu pri vykonávaní respiračných funkcií tela.
V obytných, verejných a športových zariadeniach sa nepozorujú významné zmeny v obsahu kyslíka, pretože do nich vstupuje vonkajší vzduch. Pri dlhodobej vdýchnutí vzduchu s obsahom 1 - 1,5% oxidu uhličitého sa človek cíti horšie a sú zistené 2 až 2,5% patologické zmeny.
Ako nájsť molárnu hmotnosť vzduchu
Atómy prvkov sa vyznačujú určitou hmotnosťou (ktorá je pre ne len vlastnou). Hodnoty relatívnej molekulovej hmotnosti sa počítajú z hodnôt relatívnej atómovej hmotnosti, pričom sa berie do úvahy počet atómov každého prvku v jednotke vzorca komplexnej látky. Súčet hmotnostných podielov prvkov obsiahnutých v komplexnej látke je 1 (100%). Pri chemických výpočtoch sa hmotnosť plynných činidiel a produktov často nahrádza ich objemami. Táto fyzikálna konštanta je molárny objem plynu za normálnych podmienok.
Sú založené na zákonoch zachovania hmotnosti, stálosti zloženia, viacnásobných vzťahov, ako aj na zákonoch o plyne - objemových vzťahoch a Avogadre. Pri výrobe sa na tomto základe vypočítavajú materiálové bilancie. Zákon platí vždy pre plynné a kvapalné látky. Zákon viacnásobných vzťahov, rovnako ako zákon nemennosti zloženia, nie je univerzálny a tiež nie je spravodlivý pre látky v pevnom stave. Napríklad pri interakcii 2 objemov vodíka a 1 objem kyslíka sa tvoria 2 objemy vodnej pary. Tieto čísla sa zhodujú so stechiometrickými koeficientmi v reakčnej rovnici.
Relatívne atómové hmotnosti známych prvkov sú uvedené v tabuľke „Periodická tabuľka prvkov D.I. Mendeleev. “ Množstvo látky B je fyzikálne množstvo, ktoré udáva počet jednotiek vzorca vo vzťahu k Avogadrovej konštante. Avogadrova konštanta zase ukazuje počet atómov obsiahnutých v 12 g izotopu 126C uhlíka alebo počet atómových hmotností v 1 g látky.
10. Stanovenie molekulových hmotností látok v plynnom stave.
V skutočnosti pre izotop uhlíka 126 Ar \u003d 12 a molárna hmotnosť atómov (podľa definície termínu „mol“) je 12 g / mol. Za normálnych podmienok (101,325 kPa; 273 K) je molárny objem akéhokoľvek plynu 22,4 l / mol (presnejšie Vn \u003d 22,4 l / mol). V prípade neideálnych plynov, ktoré sa nazývajú skutočné, sú molárne objemy odlišné a mierne odlišné od presnej hodnoty. Ak je objem a tlak plynu vyjadrený v iných merných jednotkách, potom hodnota plynovej konštanty v Clapeyron-Mendeleevovej rovnici bude mať inú hodnotu.
Používajú sa preto na osvetlené značky a majáky, na spaľovanie látok vo vzduchu. Stanovenie molárnej hmotnosti látok v plynnom stave: Podľa zákona obsahuje Avogadroravnyh objemy plynov odobratých pri rovnakej teplote a rovnakom tlaku rovnaký počet molekúl. Molekulová hmotnosť vzduchu, podobne ako iné plyny, sa dá zistiť podľa Avogadrovho zákona.
Strana 1
Molekulová hmotnosť vzduchu sa počíta s ohľadom na percento rôznych zložiek. Hmotnosťou molekuly vzduchu sa rozumie priemerná hodnota hmotnosti molekúl obsiahnutých vo vzduchu, berúc do úvahy ich relatívnu koncentráciu.
Molekulová hmotnosť vzduchu sa počíta s ohľadom na percento rôznych zložiek. Hmotnosťou molekuly vzduchu sa rozumie priemerná hodnota hmotnosti molekúl obsiahnutých vo vzduchu, berúc do úvahy ich relatívnu koncentráciu.
K; M je molekulová hmotnosť vzduchu; rzab - tlak vzduchu na strane.
Rvzh - rovnaké, nad povrchom odparovacej kvapaliny, kg / m3, Мв - molekulová hmotnosť vzduchu rovná 29; MP je molekulová hmotnosť pary odparovanej kvapaliny.
Na výpočet počtu molekúl vzduchu v zemskej atmosfére stačí poznať iba tlak vzduchu na hladine mora, molekulovú hmotnosť vzduchu, polomer Zeme a zrýchlenie gravitácie g na jeho povrchu. Odpoveď nezahŕňa výšku atmosféry, je dôležité iba to, aby bola malá v porovnaní s polomerom Zeme.
| Vlastnosti uhľovodíkových zložiek zemného plynu Výpočet pseudokritickej teploty a tlaku zemného plynu. |
Preto na stanovenie molekulovej hmotnosti plynu je potrebné vynásobiť jeho špecifickú hmotnosť (prijatú pre vzduch pre 1) molekulovou hmotnosťou vzduchu.
Ah, cm, na 1 sekundu s tlakovým poklesom na oboch stranách septum Ar, dyn / cm2; M je molekulová hmotnosť vzduchu, g / mol; R je univerzálna plynová konštanta, erg / mol je deg.
Na základe zákonov ideálnych plynov je možné preukázať, že merná hmotnosť plynu sa rovná aj pomeru molekulovej hmotnosti plynu k molekulovej hmotnosti vzduchu.
Môže však existovať aj nesúlad medzi priepustnosťou materiálu pre pary a priepustnosťou pre vzduch pri konštrukcii plotu vyrobeného z toho istého materiálu. To sa deje v dôsledku nevyhnutnej prítomnosti netesností a medzier v štruktúre, ktoré významne zvyšujú priepustnosť plotu, a tiež preto, že molekulová hmotnosť vzduchu a vodnej pary nie sú rovnaké.
Na charakterizáciu prírodných plynov sa široko používa jej špecifická hmotnosť. Relatívna hustota plynu je vyjadrená ako pomer hustoty plynu pri atmosférickom tlaku a štandardnej teplote k hustote vzduchu pri rovnakom tlaku a teplote. Pretože pri atmosférickom tlaku a určitej teplote sú hustoty plynov priamo úmerné ich molekulovým hmotnostiam, relatívna hustota plynu môže byť predstavovaná ako pomer molekulovej hmotnosti plynu k molekulovej hmotnosti vzduchu. Relatívna hustota prírodných plynov sa pohybuje od 0,6 do 11 v závislosti od relatívnej koncentrácie ťažších uhľovodíkov v plyne.
V zariadeniach na výrobu oxidu uhličitého musí výroba suchého ľadu tiež odstraňovať vzduch zo systému. Okrem skôr uvedených ciest prieniku vzduchu v systémoch na výrobu suchého ľadu v generátoroch ľadu vzduch systematicky vstupuje do systému pri odstraňovaní blokov ľadu z generátorov ľadu. Po vypadnutí bloku ľadu sa objem výrobníka ľadu naplní vzduchom, ktorý sa po zapnutí výrobníka ľadu odsaje kompresorom a spolu s oxidom uhličitým vstupuje do kondenzátora. Vzhľadom na skutočnosť, že molekulová hmotnosť oxidu uhličitého je vyššia ako molekulová hmotnosť vzduchu, je povaha čiar grafu pa / (ga) podobná ako u freónov. Ale pretože sa molekulové hmotnosti oxidu uhličitého a vzduchu veľmi nelíšia od freónov, čiary grafu vo významnej oblasti sú blízko priamych čiar. Nomogram oxidu uhličitého, ktorý skonštruoval R. R. Skvarchenko (VNIIH), je znázornený na obr.
V zariadeniach na výrobu oxidu uhličitého musí výroba suchého ľadu tiež odstraňovať vzduch zo systému. Okrem skôr uvedených ciest prieniku vzduchu v systémoch na výrobu suchého ľadu v generátoroch ľadu vzduch systematicky vstupuje do systému pri odstraňovaní blokov ľadu z generátorov ľadu. Po vypadnutí bloku ľadu sa objem výrobníka ľadu naplní vzduchom, ktorý sa po zapnutí výrobníka ľadu odsaje kompresorom a spolu s oxidom uhličitým vstupuje do kondenzátora. Vzhľadom na skutočnosť, že molekulová hmotnosť oxidu uhličitého je vyššia ako molekulová hmotnosť vzduchu, je povaha čiar v grafe f (ga) podobná ako u freónov. Ale pretože sa molekulové hmotnosti oxidu uhličitého a vzduchu veľmi nelíšia od freónov, čiary grafu vo významnej oblasti sú blízko priamych čiar.
Muromský inštitút (pobočka)
federálna štátna rozpočtová vzdelávacia inštitúcia
vyššie odborné vzdelávanie
„Vladimír Štátna univerzita
pomenovaný po Alexander Grigoryevich a
Nikolai Grigorievich Stoletovs
Oddelenie: "FPM"
Disciplína: Fyzika
Laboratórna práca č. 6.03
Schválené z metodického hľadiska
seminár katedry FPM
Head. Stolička ____________
Laboratórna práca č. 6.03
STANOVENIE MOLEKULÁRNEJ HMOTNOSTI
Účel práce- zoznámiť sa s jednou z metód stanovenia molekulovej hmotnosti plynu a zmeraním molekulovej hmotnosti vzduchu.
Zariadenia a príslušenstvo: pneumatický valec, vážiaci stroj alebo technická váha, tlakomer, vyváženie, vákuové čerpadlo.
BEZPEČNOSŤ
So sklenenou fľašou manipulujte v plátennom vrecku opatrne.
TEORETICKÉ INFORMÁCIE
Molekulová hmotnosť je pomer hmotnosti molekuly danej látky k 1/12 hmotnosti atómu uhlíka C.
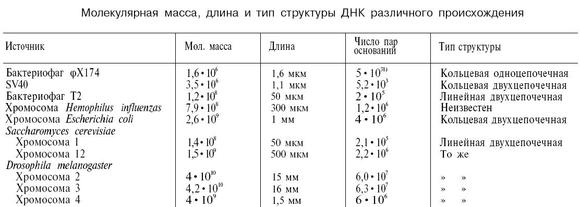
Molekulová hmotnosť môže byť podľa definície predstavovaná ako súčet atómových hmotností prvkov, ktoré tvoria molekulu
=
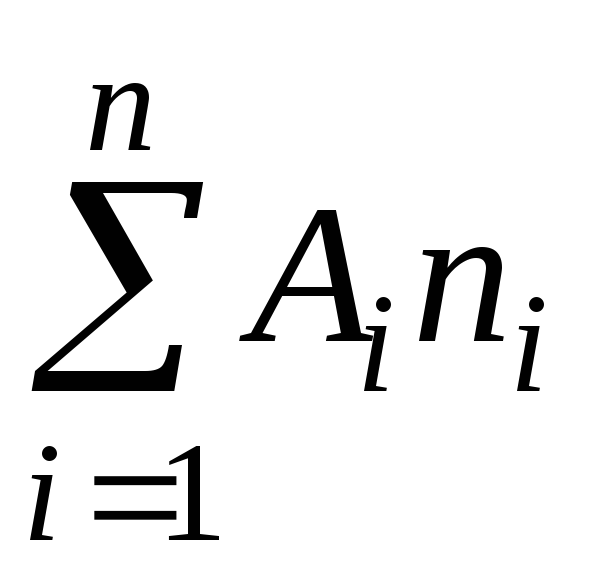 (1)
(1)
kde A je atómová hmotnosť th prvok obsiahnutý v zložení molekuly;
n je počet atómov.
Metódy stanovenia molekulovej hmotnosti sú rozdelené do dvoch skupín - absolútna a štatistická. Absolútne metódy, ktoré dávajú „skutočnú“ hodnotu molekulovej hmotnosti, zahŕňajú hmotnostnú spektroskopiu. Iné metódy poskytujú iba priemernú hodnotu molekulovej hmotnosti.
Stanovenie molekulovej hmotnosti plynov je založené na rovnici stavu plynu
PV \u003d 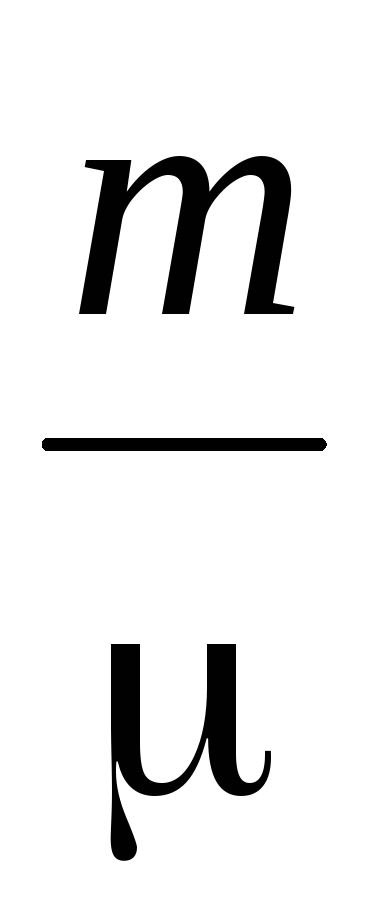 RT (2)
RT (2)
kde P je tlak plynu
m, V - jeho hmotnosť a objem,
T - absolútna teplota
R je univerzálna plynová konštanta,
je priemerná molekulová hmotnosť.
Rovnica 2 platí iba pre ideálny plyn. Ideálny plyn je taký plyn, medzi molekulami, ktoré nevyvolávajú interakcie (príťažlivosť a odpor). Molekuly ideálneho plynu sú zastúpené vo forme elastických guličiek nekonečne malej veľkosti. Reálne plyny majú interakcie medzi molekulami a nie vždy sa molekuly môžu považovať za elastické gule miznúco malých rozmerov, takže skutočné plyny sa odchyľujú od zákona (2).
Avšak pri nie príliš vysokých tlakoch, keď molekuly plynu môžu voľne cestovať na veľké vzdialenosti pred kolíziou, môže sa zanedbávať interakcia molekúl, môže sa zanedbávať aj veľkosť molekúl (keď je objem plynu dosť veľký), potom sa skutočný plyn bude blížiť ideálu a rovnica (2) sa môže ktoré sa majú použiť. Pri atmosférickom tlaku a izbovej teplote možno veľa plynov (dusík, vodík, hélium, kyslík, vzduch atď.) Považovať za ideálny plyn s pomerne dobrou aproximáciou.
Dôležitou charakteristikou molekulárneho pohybu je stredná voľná cesta. Molekuly v plyne sú v stave nepretržitého a chaotického pohybu, vzájomne sa zrážajú a niektorá cesta проходят voľne prechádza medzi zrážkami. Dĺžka tejto cesty medzi týmito dvoma zrážkami je rôzna, ale vzhľadom na veľký počet molekúl a náhodnosť ich pohybu môžeme hovoriť o priemernej priemernej voľnej ceste molekúl. Priemerná stredná voľná cesta molekúl môže byť určená vzorcom
 =
=
 ,
,
kde je efektívny priemer molekuly (pre vzduch \u003d 0,27,10 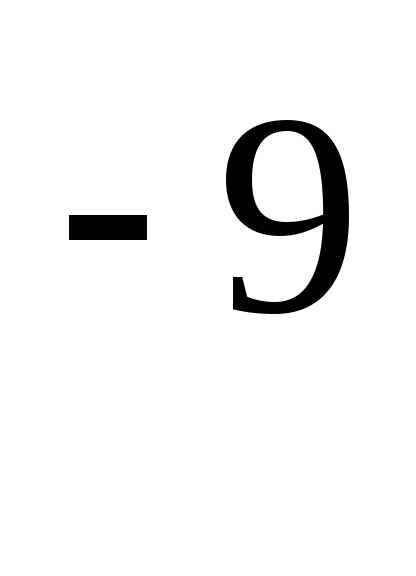 m),
m),
n  - počet molekúl na jednotku objemu.
- počet molekúl na jednotku objemu.
n  =
=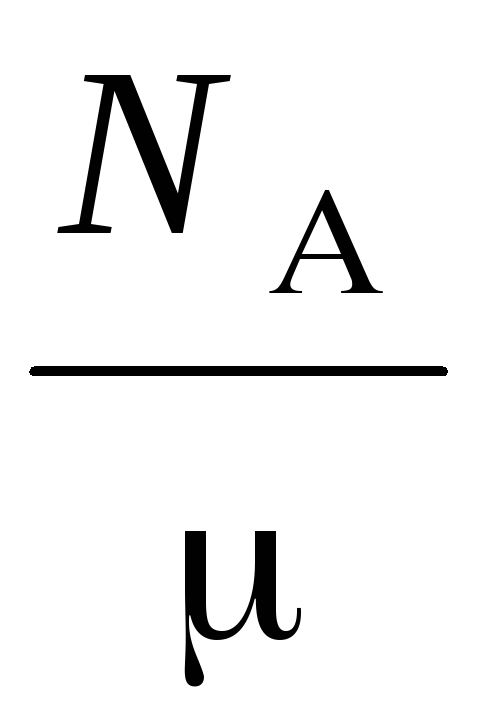
 ,
,
potom dostal tento vzorec , pre má tvar:
=
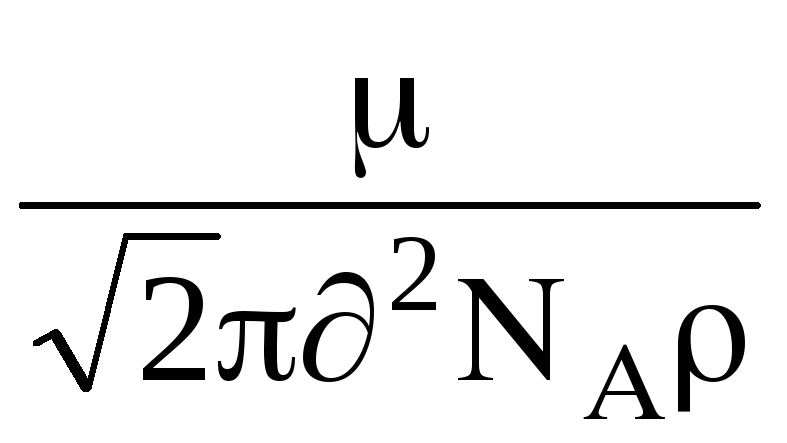 ,
,
kde  - molekulová hmotnosť plynu, N
- molekulová hmotnosť plynu, N  - Avogadrovo číslo, - hustota plynu.
- Avogadrovo číslo, - hustota plynu.
Nechajte vzduch v otvorenom valci naberať objem Vjeho hmotnosť tatmosférický tlak P; pumpujte vzduch z valca do P  , Teraz bude hmotnosť vzduchu vo valci m
, Teraz bude hmotnosť vzduchu vo valci m  , Pre tieto dva stavy píšeme rovnicu (2)
, Pre tieto dva stavy píšeme rovnicu (2)
PV \u003d 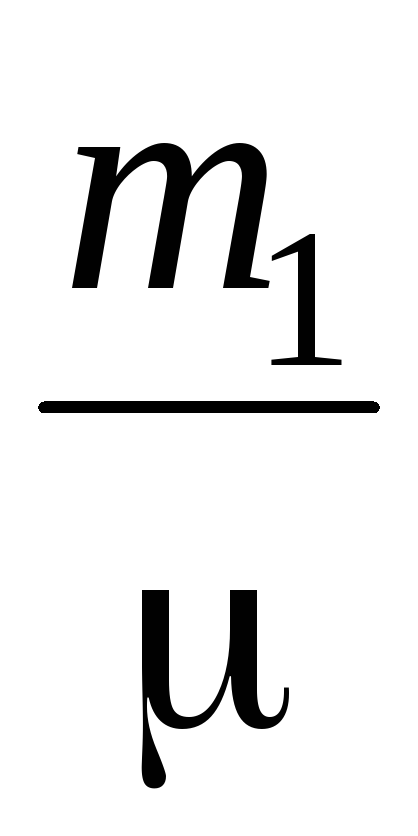 RT (3)
RT (3)
P  V \u003d
V \u003d 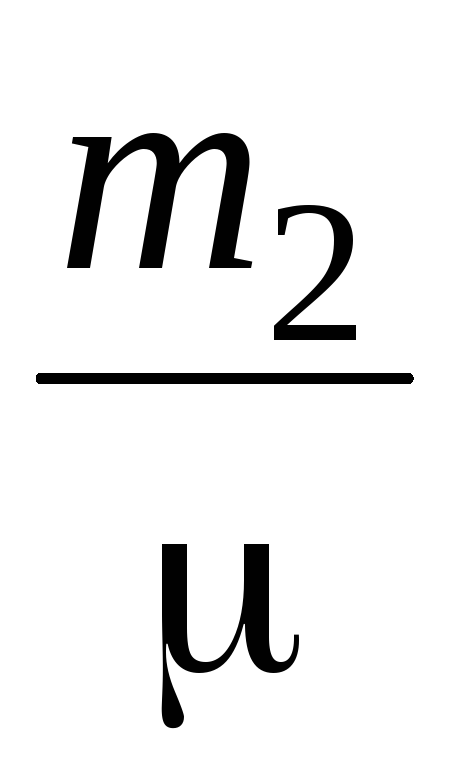 RT (4)
RT (4)
Odčítaním od (3) (4) vyjadríme .
=
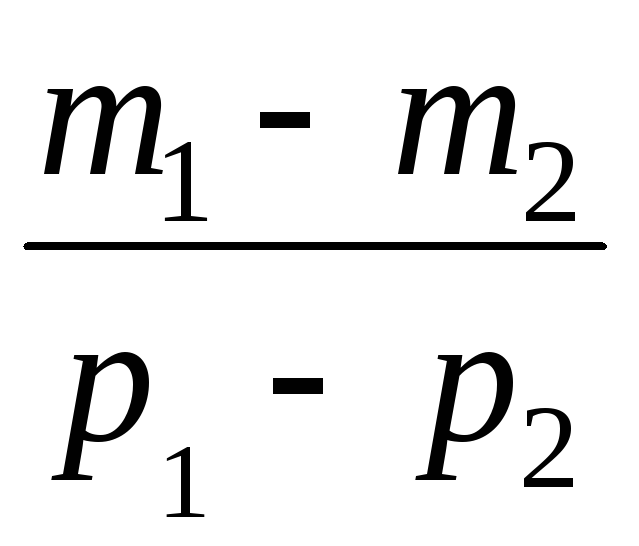
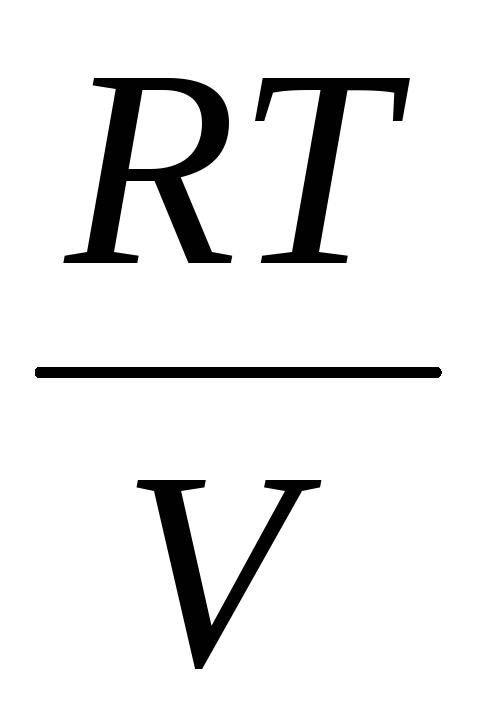 =
=
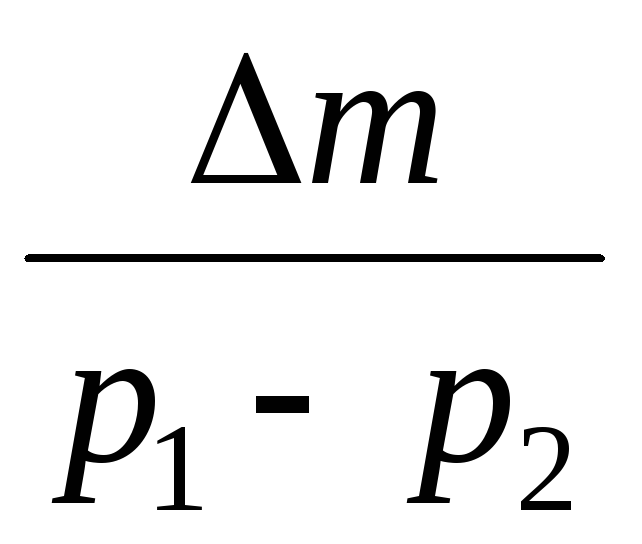
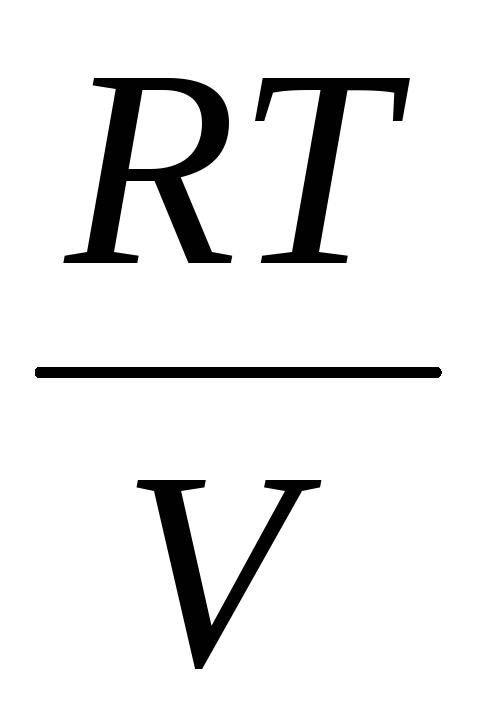 (5)
(5)
Takže, poznajúc zmenu hmotnosti so zmenami tlaku, môžeme nájsť molekulovú hmotnosť vzduchu pomocou vzorca (5).
OPIS INŠTALÁCIE
Celkový pohľad na zariadenie je znázornený na obr. 1. Inštalácia pozostáva z vákuového čerpadla (1) , ventil (2) (pomocou ventilu 2 je systém odpojený od vákuovej pumpy), podtlakomer (3). Rotácia ukazovateľa podtlaku je úmerná podtlaku dosiahnutému v systéme, t.j. rozdiel medzi atmosférickým tlakom a tlakom vzduchu v zariadení. Nulová hodnota na mierke zodpovedá atmosférickému tlaku v zariadení. Zariadenie sa začne zobrazovať iba pri čerpaní vzduchu zo systému, t.j. pri tlaku vzduchu v zariadení pod atmosférickým tlakom.
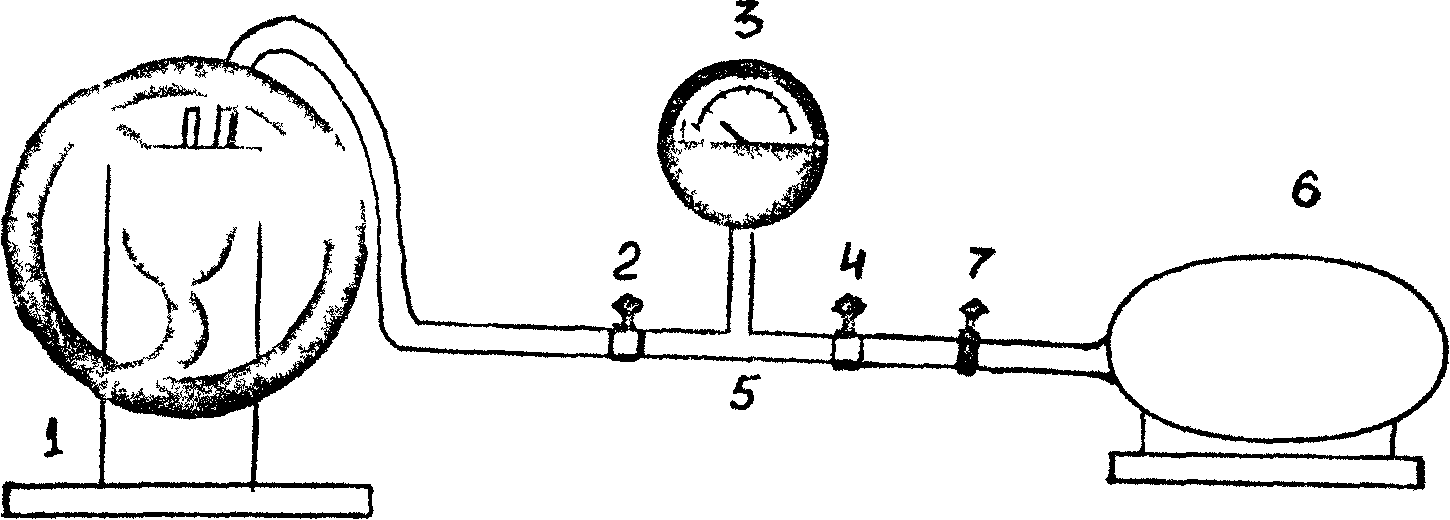
Pomocou žeriavu 4 je systém pripojený k atmosfére. Na obr. 1 je znázornená podtlaková rúrka (5), odnímateľný valec (6) (objem ja1225 ml) s gumovou trubicou a svorkou (7), ktorá slúži na odpojenie valca 6 od atmosféry pri vážení valca.
Chodiť do práce
Úloha 1. Stanovenie molekulovej hmotnosti vzduchu.
1. Otvorte kohútiky 2 a 4, svorku 7 a odpojte valec 6 od zariadenia. Odvážte balónik 6 spolu s gumovou trubicou a svorkou 7 a výsledky merania zaznamenajte do tabuľky I. Váženie sa musí vykonávať s pomerne vysokou mierou presnosti a túto operáciu je potrebné osobitne poznamenať.
2. Pripojte valec 6 k inštalácii a odsajte vzduch z valca tak, aby došlo k zmene tlaku  P \u003d 0,1
P \u003d 0,1 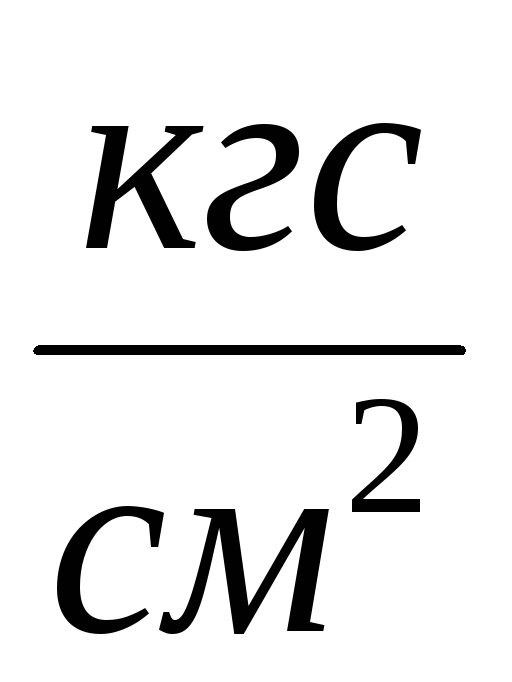 , Zatvorte kohútik 2 a zadajte
, Zatvorte kohútik 2 a zadajte  P do meracej tabuľky. Zatvorte ventil 4, stlačte 7 a odpojte valec 6 od zariadenia a odvážte ho. Výsledky merania sú uvedené v tabuľke.
P do meracej tabuľky. Zatvorte ventil 4, stlačte 7 a odpojte valec 6 od zariadenia a odvážte ho. Výsledky merania sú uvedené v tabuľke.
3. Otvorte svorku 7, plynulo otvorte vodovodné kohúty 2 a 4 a krok 2 opakujte 4 krát pre ďalšie hodnoty  P.
P.
4. Na základe výsledkov merania vypočítame vzduch a vyhodnotíme chybu merania.
Úloha 2, Stanovenie hustoty vzduchu.
Hustotu vzduchu určujeme pomocou Mendeleev-Klaiperonovej rovnice pre ideálne plyny.
PV \u003d 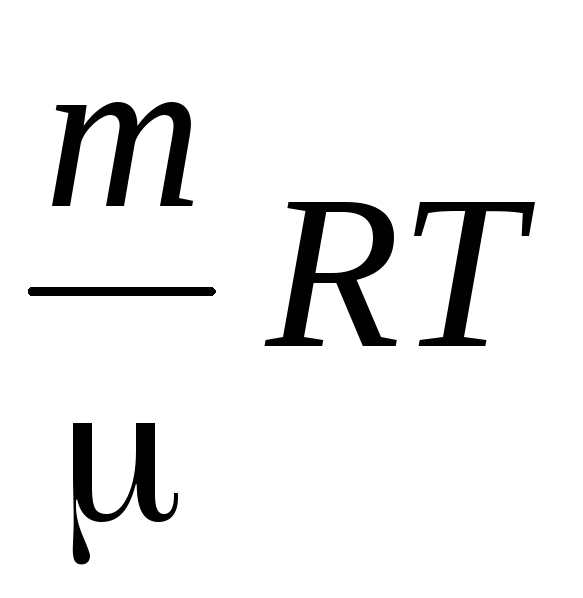 .
.
Z tejto rovnice vyplýva, že od 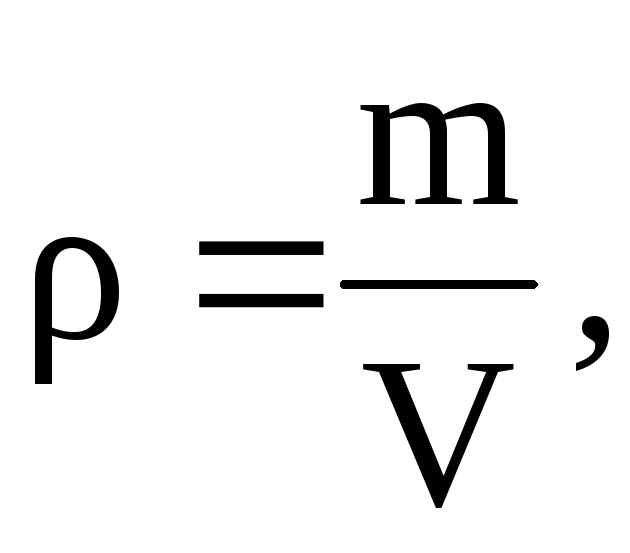
=
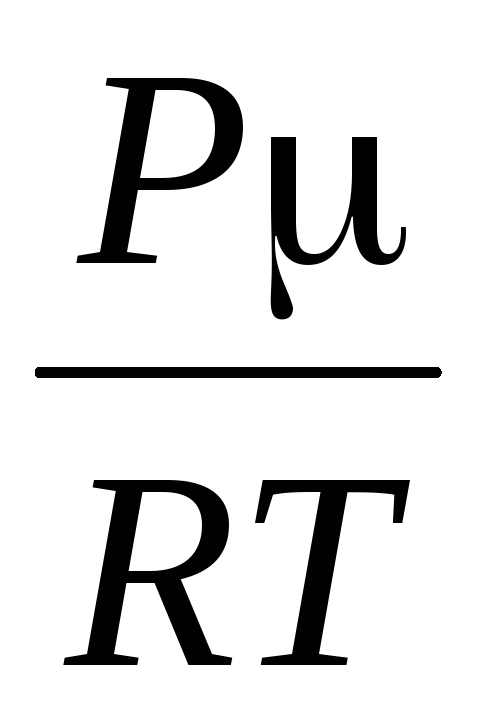 ,
,
kde R \u003d 8,31 * 10 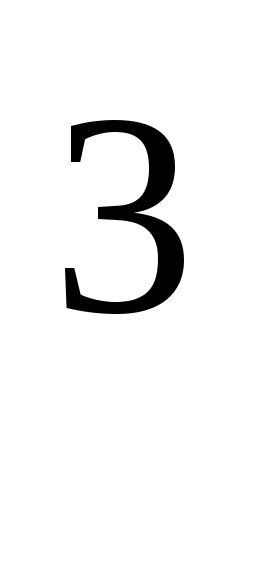 J / (kmol · K), univerzálna plynová konštanta.
J / (kmol · K), univerzálna plynová konštanta.
Najprv stanovíme hustotu vzduchu vo valci pred evakuáciou za predpokladu, že tlak P \u003d P  rovný atmosférickému tlaku (P
rovný atmosférickému tlaku (P  \u003d 101 kPa). Potom stanovíme hustotu vzduchu pri rôznych
\u003d 101 kPa). Potom stanovíme hustotu vzduchu pri rôznych  P odobraté z tabuľky merania za predpokladu, že tlak v banke je P \u003d P
P odobraté z tabuľky merania za predpokladu, že tlak v banke je P \u003d P  -
- P.
P.
Na základe výsledkov výpočtu skonštruujte graf závislosti hustoty na tlaku P: 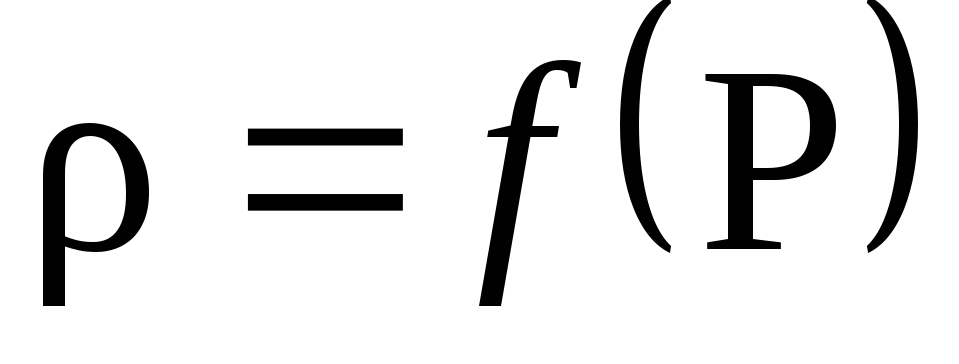
TABUĽKA MERANIA
|
m |
|
|
|
|
|
| ||||||
Úloha 3. Podľa vypočítaných výpočtov stanovte priemernú voľnú cestu a zakreslite závislosť od : 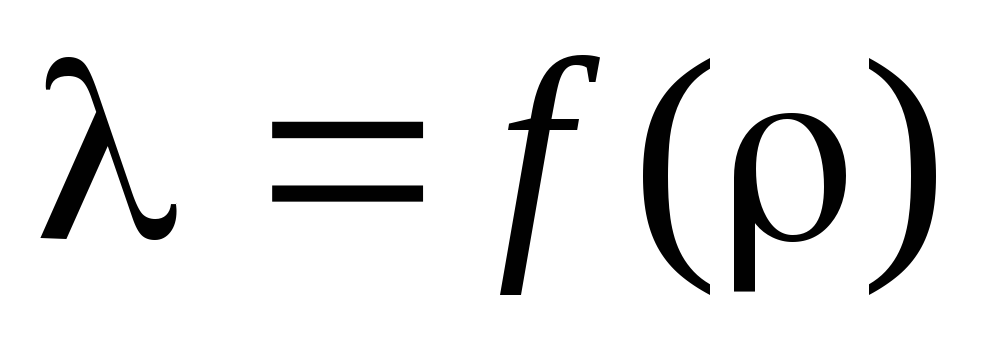 .
.
OTÁZKY KONTROLY
1. Uveďte hlavné body molekulárno-kinetickej teórie ideálnych plynov.
2. Aké fyzikálne veličiny sa nazývajú parametre stavu plynu, uveďte ich definíciu.
3. Formulovať zákony ideálnych plynov.
4. Za akých podmienok sa plyn riadi zákonmi ideálneho plynu?
5. Za akých podmienok je Clapeyron-Mendeleevova rovnica uplatniteľná na plyny.
6. Čo je to molekulová hmotnosť, na čom závisí molekulová hmotnosť.
7. Hustota vzduchu, od čoho závisí?
8. Priemerná voľná dráha molekúl plynu a efektívny priemer.
9. Odvodte vzorce na výpočet a .
10. Aké merania by sa mali vykonať na výpočet molekulovej hmotnosti a hustoty vzduchu .
Zoznam odkazov
1. Saveliev I.V. Kurz všeobecnej fyziky. M.: Nauka, 1970.V.1, § 98.
2. A.A. Detlaf B.M. Jaworski. Kurz fyziky. M .: Higher School Publishing House, 1973, s. 175-179.