Согласно модели идеального газа молекулы все время находятся в беспо-рядочном движении, сталкиваются между собой и со стенками сосуда, в котором пре-бывают. В момент столкновения молекулы со стенкой она действует на нее с силой, им-пульс которой, согласно второму закону Нью-тона, равняется изменению ее импульса (количества движения): F̅ t = Δ(m ͞ v). Это значит, что изменение модуля импульса всех мо-лекул ΣΔ(mv i) при ударе равнозначно дей-ствию усредненного значения силы F̅ в течение времени t. Это суммарное действие молекул вызывает давление газа, которое по определению равно p = F / S .
Давление газа вызывают уда-ры о стенку сосуда большого количества молекул, передаю-щих ему импульс.
Рассмотрим идеальный газ, который на-ходится в сосуде объемом V. Для простоты расчетов выберем его в форме параллеле-пипеда (рис. 1.15). Пусть в нем находится N молекул массой m 0 каждая; их концентра-ция равна n = N / V . Поскольку молекулы дви-жутся беспорядочно (условие динамичес-кого хаоса для идеального газа), то до-статочно определить давление на одну из стенок, поскольку на другие стенки мо-лекулы будут создавать такое же давление. Для простоты изложения сначала будем счи-тать, что все они имеют одинаковые ско-рости V.
Представим отдельный слой газа, перпенди-кулярный координатной плоскости ZY. В си-лу хаотичности движения количество моле-кул, влетающих в этот слой справа, равня-ется количеству молекул, вылетающих из него слева. Очевидно, что и те и другие передают данному слою импульс: влета-ющие слева (рис. 1.16) несут импульс m 0 v x , где v x — проекция скорости на ось Х ; вы-летающие из него выносят импульс — m 0 v x , в целом передавая ему импульс 2 m 0 v x . Итак, со стороны всех молекул Z , влетающих в отдельный слой, стенка получает импульс 2 Zm 0 v x .
Количество молекул Z , которые сталки-ваются со стенкой площадью S за время t, можно определить по их концентрации в объеме отдельного слоя: Z = nv x tS, где n — концентрация молекул. Поскольку к стенке долетают лишь те молекулы, которые имеют положительную проекцию скорости на ось X (v x > 0), то их количество будет составлять половину от числа молекул, пересекающих плоскость отдельного слоя газа:
Z = nv x tS / 2.
Итак, со стороны всех молекул, нахо-дящихся в отдельном слое, стенка получает общий импульс:
F x t = 2 . nv x tSm 0 v x / 2.
Разделив левую и правую части равен-ства на St, получим:
F x / S = p = nm 0 v 2 x .
Предположения, что скорости всех мо-лекул одинаковы, было сделано с целью упрощения вывода уравнений. На самом же деле диапазон их значений довольно широк — от 0 до определенного максималь-ного значения v max . Поэтому в предыдущем уравнении для определения давления газа правильнее будет брать средний квадрат проекции скорости v x . Тогда оно будет иметь вид:
p = nm 0 v̅ 2 х.
Понятно, что аналогичные соображения будут справедливы для стенок, лежащих в других координатных плоскостях:
p = nm 0 v̅ 2 y ,
p = nm 0 v̅ 2 z .
Средний квадрат скорости имеет смысл среднестатистического значения скорости. Материал с сайта
Очевидно, что вследствие хаотического движения молекул v̅ 2 x = v̅ 2 y = v̅ 2 z . По мате-матическому определению средний квадрат скорости равен v̅ 2 = (v̅ 2 x + v̅ 2 y + v̅ 2 z). Отсюда v̅ 2 x = (1 / 3) . v̅ 2 . Подставив это выражение в урав-нение p = nm 0 v̅ 2 х , получим окончательное уравне-ние для определения давления идеального газа :
p = (1 / 3) . nm 0 v̅ 2 .
Эта формула является основным уравне-нием молекулярно-кинетической теории (МКТ) иде-ального газа, которое определяет связь меж-ду макропараметром термодинамической си-стемы — давлением идеального газа и харак-теристиками его микроскопического состо-яния. Таким образом, оно определяет дав-ление газа как статистическую величину по-средством микропараметров системы — кон-центрации, массы и скорости молекулы.
Поскольку nm 0 = ρ , где ρ — плотность газа, основ-ное уравнение молекулярно-кинетической теории идеального газа будет иметь еще и такой вид:
p = (1 / 3) . ρv̅ 2 .
Основное уравнение MKT яв-ляется мостиком между двумя подходами в толковании теп-ловых явлений и процессов — термодинамическим и молеку-лярно-кинетическим.
На этой странице материал по темам:
Идеальный газ лекция основное уравнение мкт
Как изменяется импульс слоя газа за счет молекул вылетающих в него
-
На данном уроке мы будем выводить основное уравнение молекулярно-кинетической теории (МКТ), которое связывает макропараметры газа с микропараметрами отдельных молекул.
Вспомним основные сведения про модель идеального газа:
Молекулы движутся хаотически;
Механизм давления идеального газа - это соударение отдельных молекул со стенками сосуда.
Пусть идеальный газ находится в цилиндрическом сосуде (см. Рис. 1). Определим давление p этого газа на поршень.
Рис. 1. Идеальный газ (молекулы) в цилиндрическом сосуде
По определению давление - величина, равная отношению силы (F ), действующей перпендикулярно поверхности, к площади этой поверхности (S ).
Вычислим силу (F ), с которой молекулы действуют на поршень:
1. Определим силу удара одной молекулы о стенку сосуда.
Пусть молекула идеального газа массой движется в плоскости XOY со скоростью и, ударившись о поршень, отскакивает от него со скоростью (см. Рис. 2). Согласно второму закону Ньютона, сила, действующая на молекулу со стороны поршня во время удара, равна:
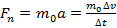 ,
,где a - ускорение молекулы при ударе; - изменение скорости движения молекулы при ударе; - продолжительность удара.
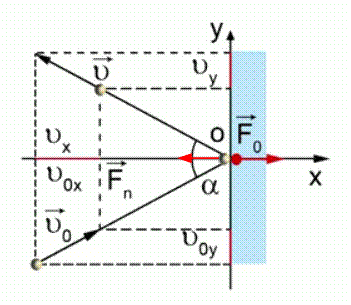
Рис. 2. Столкновение молекулы с поршнем
Проекция скорости на ось OY не изменяется, поэтому всё изменение скорости равно изменению скорости вдоль оси X :
Согласно третьему закону Ньютона, сила, с которой молекула действует на поршень, равна по модулю силе , с которой поршень действует на молекулу. Следовательно:
2. Рассчитаем число молекул N , ударившихся о поршень за интервал .
За интервал времени до поршня успеют долететь только те молекулы, которые движутся в направлении поршня и удалены от него на расстояние (см. Рис. 3). То есть фактически половина числа молекул, заключённых в цилиндре объёмом
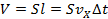 . Следовательно, число молекул, ударившихся о поршень за интервал , равно:
. Следовательно, число молекул, ударившихся о поршень за интервал , равно:Общее число молекул, которое равно произведению концентрации на объём:
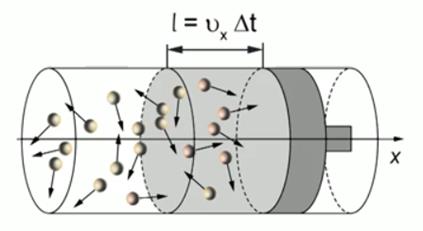
Рис. 3. Молекулы, ударившиеся о поршень за время
3. Определим общую силу ударов молекул о поршень.
Эта сила будет равна произведению силы удара одной молекулы на общее число ударов:
Мы живём в трёхмерном мире, то есть любая молекула имеет проекцию скорости . Так как все молекулы двигаются хаотично, то направления их движения равноправные, поэтому можно написать, что в среднем, для средней квадратичной скорости, одинаковые (). Следовательно, заменяем квадрат проекции скорости на средний квадрат проекции скорости:
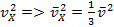
Подставляем это значение в формулу силы ударов молекул о поршень:
Значение данной силы подставим в формулу давления:
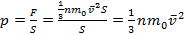
- основное уравнение МКТ идеального газа ,
- давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема
На данном уроке мы вывели основное уравнение МКТ. Обращаться к данному уравнению мы будем нечасто, так как удобнее работать с отдельными макропараметрами (проще отдельно измерить давление, объём, температуру, чем замерять скорость и массу конкретной молекулы). Тем не менее, именно это уравнение назвали основным, потому что оно даёт связь между макромиром и микромиром.
Список литературы
Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика 10. - М.: Просвещение, 2008.
Физика. Тесты. 10-11 классы: учебно-методическое пособие / Н.К. Гладышева, И.И. Нурминский, А.И. Нурминский и др. - М.: Дрофа, 2005
Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Илекса, 2005.
Касьянов В.А. Физика 10 класс. - М.: Дрофа, 2010.
- Easy-physic.ru ().
- Clck.ru ().
- Clck.ru ().
Домашнее задание
Тема: Основы молекулярно-кинетической теории
Урок: Основное уравнение молекулярно-кинетической теорииИзучение любой области физики всегда начинается с введения некой модели, в рамках которой идет изучение в дальнейшем. Например, когда мы изучали кинематику, моделью тела была материальная точка, когда изучали планетарные движения, планеты принимались за сферы и т. д. Как вы уже догадались, модель никогда не будет соответствовать реально происходящим процессам, но часто она очень сильно приближается к этому соответствию.
Молекулярная физика, и в частности МКТ, не является исключением. Над проблемой описания модели работали многие учёные, начиная с восемнадцатого века: М. Ломоносов, Д. Джоуль, Р. Клаузиус (Рис. 1). Последний, собственно, и ввёл в 1857 году модель идеального газа.

() () () Рис. 1. Джеймс Джоуль, Михаил Ломоносов, Рудольф Клаузиус соответственно
Определение. Идеальный газ - модель газа, в рамках которого молекулы и атомы газа представлены в виде очень маленьких (исчезающих размеров) упругих шариков, которые не взаимодействуют друг с другом (без непосредственного контакта), а только сталкиваются (см. Рис. 2).
Следует отметить, что разреженный водород (под очень маленьким давлением) практически полностью удовлетворяет модели идеального газа.
Теперь можно приступить к описанию параметров идеального газа. Они делятся на две группы:
Параметры идеального газа

То есть микропараметры описывают состояние отдельно взятой частицы (микротела), а макропараметры - состояние всей порции газа (макротела). Запишем теперь соотношение, связывающее одни параметры с другими, или же основное уравнение МКТ:
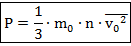
Здесь: - средняя скорость движения частиц;
Определение. - концентрация частиц газа - количество частиц, приходящихся на единицу объёма; ; единица измерения - .
Таким образом, основное уравнение МКТ вводит нам прямо пропорциональную зависимость макропараметра давления от микропараметров массы молекулы и средней скорости движения в квадрате. То есть чем тяжелее частицы и чем больше их скорости, тем сильнее они врезаются в стенки сосуда и тем большее оказывают давление.
Возможны и другие формы записи этого уравнения, если вспомнить некоторые формулы из более ранних разделов физики:
Средняя кинетическая энергия поступательного движения
Источник)
- Почему с увеличением массы молекул увеличивается давление?
- Почему модель идеального газа не соответствует действительности?
- Воздух состоит в основном из азота и кислорода. Концентрация какого газа больше?
- *Почему, говоря о микропараметрах идеального газа, мы указываем только кинетическую энергию молекулы и не указываем потенциальную?
- развивать способности анализировать увиденное, логическое мышление и творческое воображение учащихся;
- учить устанавливать причинно-следственные связи в изучаемых явлениях, формулировать эмпирические закономерности.
- Каковы основные положения молекулярно-кинетической теории строения вещества? (слайд 2)
- Докажите, что все вещества состоят из молекул, между которыми есть промежутки? (слайд 3)
- В чем суть броуновского движения? Доказательством каких положений является броуновское движение? (слайд 4)
- Что такое диффузия? Доказательством каких положений является броуновское движение? (слайд 5)
- Зависит ли скорость диффузии от температуры? (слайд 6)
- О чем говорят опыты, показанные на слайде № 7
- Каковы размеры молекул? (слайд 8)
- Опишите словами модель взаимодействия между молекулами или атомами твердого тела. (слайд 9)
- В каком агрегатном состоянии находится вещество, показанное на слайдах № 10,11,12? Укажите особенности расположения и движения молекул в различных агрегатных состояниях.
«ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ »
Каширина Татьяна Николаевна
ТЕМА «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ » 10 КЛАСС
Цели :
Обучающие: познакомить с понятием идеального газа, вывести основное уравнение молекулярно-кинетической теории газов.
Развивающие:
Воспитывающие : воспитывать ответственное отношение к учебе, положительное отношение к предмету физики.
Оборудование:
Ход урока
I. Повторение пройденного. Беседа с учащимися с использованием презентации (Приложение 1)
II. Изучение нового материала
Итак, мы знаем, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг относительно друга на расстояниях, существенно превышающих их собственные размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше энергии межмолекулярного взаимодействия. Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель газа - идеальный газ.
Идеальный газ - это газ, у которого взаимодействие между молекулами пренебрежимо мало (слайд13) (записываем в тетрадь)
Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа.
Вспомним опыт из 7 класса (слайд14)
Почему при откачивании воздуха из-под колокола воздушный шарик раздувается?
(Это значит, что газ внутри шарика оказывает давление, и когда внешнее давление при откачивании уменьшается, шар благодаря внутреннему давлению воздуха начинает раздуваться?
Что же такое давление газа? (слайд15)
(Давление газа - это результат ударов молекул газа о стенки сосуда)
Сегодня мы с вами попытаемся ответить, от чего зависит давление газа? (Слайд 16)
Даю возможность учащимся сделать предположения, от чего может зависеть давление газа.
Выведем основное уравнение молекулярно-кинетической теории газов (слайд 17)
Пусть в некотором объеме есть молекулы, масса каждой m o , их число равно N , и движутся они со скоростью v (очевидно, что скорости у всех молекул различны, однако среднее значение модуля скорости v вполне определенное)
Учитель делает рисунок на доске, учащиеся в тетрадях
При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку, а значит и давление.
От чего же зависит давление газа?
Во-первых , от массы: чем больше масса молекулы, тем сильнее удар, значит здесь прямая пропорциональная зависимость давления от массы
Запишем:
1 ) р m o
Во-вторых , от скорости: чем быстрее движутся молекулы, тем сильнее будут удары, а значит и давление.
Запишем:
2 ) р v
В-третьих, есть еще одна зависимость от скорости: чем быстрее движутся молекулы, тем чаще удары, а значит и давление.
Запишем:
3) р v
В-четвертых , давление газа зависит от числа молекул в данном сосуде, а точнее от концентрации n.
Концентрация - физическая величина, равная числу молекул, содержащихся в единице объема (n = N/V)
(определение концентрации и единицы измерения записываем в тетрадь )
Запишем:
4) р n
В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы
Это и есть основное уравнение молекулярно-кинетической теории идеального газа. В этом уравнении коэффициент 1/3 означает, что в трехмерном пространстве только треть молекул участвует в движении в определенном направлении (по оси х, например).
Мы получили основное уравнение МКТ идеального газа из общих соображений, но его можно строго вывести, опираясь на законы классической механики (§ 63 , Мякишев Г.Я.)
Это уравнение можно записать по-другому, если умножить и разделить правую часть уравнения на 2.
P = 2/3· n·Ек, где Ек = m o ·v 2 /2
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул
III. Закрепление изученного материала. Выполнение тестов учащимися.
Цель заданий: определить степень усвоения нового материала
1. Давление газа на стенку сосуда обусловлено
А. притяжением молекул друг к другу
Б. столкновениями молекул со стенками сосудов
В. столкновением молекул газа между собой
Г. проникновением молекул сквозь стенки сосуда
2. Как изменилось давление идеального газа, если в данном объеме скорость каждой молекулы газа увеличилась в 2 раза, а концентрация молекул осталась без изменения?
А. увеличилось в 2 раза
Б. увеличилось в 4 раза
В. уменьшилось в 2 раза
Г. уменьшилось в 4 раза
3. При повышении температуры идеального газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с ростом температуры...
А.увеличиваются размеры молекул газа
Б. увеличивается энергия движения молекул газа
В. увеличивается потенциальная энергия молекул газа
Г. увеличивается хаотичность движения молекул газа
4. Как изменится концентрация молекул газа при уменьшении объема сосуда в 2 раза?
А.увеличится в 2 раза
Б. уменьшится в 2 раза
В. не изменится
Г. уменьшится в 4 раза
5. При уменьшении температуры средняя кинетическая энергия молекул
А. увеличится
Б. уменьшится
В. не изменится
Г. иногда увеличится, иногда уменьшится
6. Какое утверждение неправильно ?
При неизменных условиях
А. давление газа постоянно
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ - раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение - уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М.В.Ломоносов . Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики.
Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление , оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т.е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам - Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля». Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж.К.Максвелла и Л.Больцмана , которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов), состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса , который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Молекулярно-кинетическая теория газов.
Каждая молекула, летящая к стенке, при столкновении с ней передает стенке свой импульс. Поскольку скорость молекулы при упругом столкновении со стенкой меняется от величины v до -v , величина передаваемого импульса равна 2mv . Сила, действующая на поверхность стенки D S за время D t , определяется величиной полного импульса, передаваемого всеми молекулами достигнувшим стенки за этот промежуток времени, т.е. F = 2mv n c D S /D t , где n c определено выражением (1). Для величины давления p = F /D S в этом случае находим: p = (1/3)nmv 2.
Для получения окончательного результата можно отказаться от предположения об одинаковой скорости молекул, выделив независимые группы молекул, каждая из которых имеет свою приблизительно одинаковую скорость. Тогда средняя величина давления находится усреднением квадрата скорости по всем группам молекул или
Это выражение можно представить также в виде
где - средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
