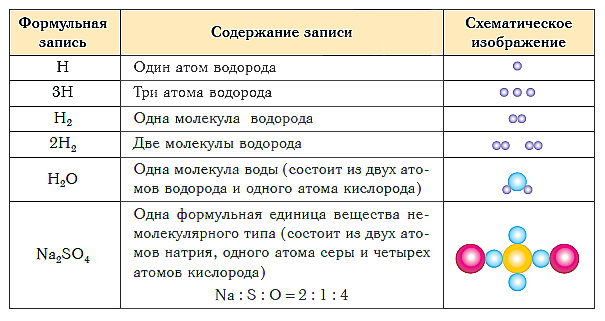
В урок 5 " Химична формула„От курса“ Химия за манекените„Даваме определение на химичните формули и техните индекси, а също така откриваме разликите в химичните формули на вещества с молекулна и немолекулна структура. Припомням ви, че в последния урок "" ние дадохме определение на химичните съединения, проучихме разликите между органични и неорганични съединения и също така разбрахме какво означава качествен и количествен състав.
Съставът на всяко вещество се изразява като химична формула.
Химична формула е условен запис на състава на веществото, използващ химически знаци и индекси.
Качественият състав се показва с помощта на знаци (символи) на химични елементи, а количественият - с помощта на индекси, които се изписват вдясно и точно под знаците на химичните елементи.
индекс - броят на атомите на даден химичен елемент във формулата на вещество.
Например химическата формула на обикновено водородно вещество е написана, както следва:
и четете ал-две.
Химични формули на вещества с молекулна структура
Формули на диатомични молекули: кислород - O2 ("o-два"), хлор - Cl2 ("хлор-два"), азот - N2 ("en-two"). Триатомната озонова молекула и осем-атомната сярна молекула са обозначени с формулите O3 („o-три“) и S8 („es-osm“).
Формулите на молекулите на сложни вещества също отразяват техния качествен и количествен състав. Например, формулата на водата, както вероятно вече добре знаете, е Н20 ("ал-две-о"), метанът е СН4 ("це-ал-четири"), а амонякът е NH3 ("en- пепел три “). Формулите на всякакви сложни вещества се четат по абсолютно същия начин. Например, формулата на сярна киселина е H2SO4 ("al-два-es-o-four"), а глюкозата е C6H 12 O6 ("шест-ал-пепел-дванадесет-о-шест").
Химичните формули на вещества с молекулна структура (те се наричат молекулярни формули) показват състава на елементарни части, тоест условни „тухли”, от които са съставени тези вещества. Такива елементарни компоненти ( елементарни структурни звенаили просто структурни звена) в този случай са молекулите.
И ако веществото има немолекулна структура? Химичните формули на прости вещества от този тип (например метали) се пишат просто чрез знаците на съответните елементи без индекси (или по-скоро с индекс, равен на единица, която не може да бъде написана). И така, формулата на просто вещество е желязо - Fe, мед - Cu, алуминий - Al.
Съставът на сложни вещества с немолекулна структура се изразява с помощта на формули, които показват най-просто атомно съотношение различни химични елементи в тези вещества. Такива формули се наричат най-простият, Например най-простата формула от кварц - основният компонент на речния пясък - SiO 2. Той показва, че в кварцов кристал има два кислородни атома на силициев атом, т.е. най-простото съотношение на броя на силициевите атоми и кислорода в това вещество е 1: 2. Най-простата формула Al 2 O 3 показва, че в това съединение най-простото съотношение между броя на алуминиевите атоми и кислорода е 2: 3.
Група атоми, чийто състав съответства на най-простата формула на немолекулярно вещество, се нарича негова формула единица.
Единицата с формула, натриев хлорид NaCl ("натриев хлор") е група от един натриев атом и един хлорен атом. Официалната кредава единица CaCO 3 („калций-це-о-три“) е група от един калциев атом, един въглероден атом и три кислородни атома.
Формулите на по-сложни съединения с немолекулна структура се четат по подобен начин. Освен това е посочен само броят групи атоми, затворени в скоби: Al 2 (SO 4) 3 („алуминий-два-ес-о-четири-три пъти“), Mg (NO 3) 2 („магнезий-ен-о-три“ „Два пъти“) и т.н.
По този начин структурни единици на веществата молекулярна структура сте молекулите, Структурни единици на веществата немолекулна структура са те формулни единици .
Таблицата по-долу показва формулата и схематичното представяне на състава на вещества от различни видове.
Обобщение на урока:
- Качественият и количествен състав на веществото се изразява с помощта на химични формули.
- Химичната формула на вещество с молекулна структура показва състава на неговата молекула, която е елементарната структурна единица на това вещество.
- Химичната формула на немолекулно вещество показва най-простото съотношение на атомите в неговата формула.
Надявам се урок 5 " Химична формула„Беше разбираемо и информативно. Ако имате въпроси, напишете ги в коментарите.
Класификацията на неорганичните вещества и тяхната номенклатура се основават на най-простата и постоянна във времето характеристика - химичен състав, която показва атомите на елементите, образуващи това вещество, в тяхното числово съотношение. Ако веществото се състои от един атом, т.е. е формата на съществуване на този елемент в свободна форма, той се нарича прост вещество; ако веществото е от атоми на два или повече елемента, тогава се нарича сложна субстанция, Обикновено се наричат \u200b\u200bвсички прости вещества (с изключение на монотомните) и всички сложни вещества химически съединения, тъй като в тях атомите на един или различни елементи са свързани помежду си чрез химически връзки.
Номенклатурата на неорганичните вещества се състои от формули и наименования. Химична формула - изображение на състава на веществото, използвайки символите на химичните елементи, цифровите показатели и някои други знаци. Химическо име - изображение на състава на веществото с помощта на дума или група от думи. Изграждането на химични формули и имена се определя от системата правила за номенклатурата.
Символите и наименованията на химичните елементи са дадени в Периодичната система от елементи D.I. Менделеев. Елементите са условно разделени метали и неметали , Неметалите включват всички елементи от VIIIA групата (благородни газове) и VIIA групата (халогени), елементите от VIA групата (с изключение на полоний), елементите азот, фосфор, арсен (група VA); въглерод, силиций (IVA група); бор (IIIA група), както и водород. Останалите елементи се класифицират като метали.
При съставяне на имената на веществата обикновено се използват руски имена на елементи, например кислород, ксенон дифлуорид, калиев селанат. По традиция за някои елементи корените на техните латински имена се въвеждат в производни термини:
Например: карбонат, манганат, оксид, сулфид, силикат.
имена прости вещества се състоят от една дума - името на химичен елемент с числов префикс, например:
 Използват се следните цифрови конзоли:
Използват се следните цифрови конзоли:
 Неопределено число се обозначава с цифров префикс п - поли.
Неопределено число се обозначава с цифров префикс п - поли.
Използват се и някои прости вещества. специаленимена като O 3 - озон, P 4 - бял фосфор.
Химични формули сложни вещества съставете от нотацията електроположително (условни и реални катиони) и електроотрицателния (конвенционални и реални аниони), например, CuSO 4 (тук Cu 2+ е реален катион, SO 4 2- е истински анион) и PCl 3 (тук P + III е условен катион, Cl-I е условен анион).
имена сложни вещества съставят по химични формули от дясно на ляво. Те се състоят от две думи - имената на електроотрицателните компоненти (в номинативен случай) и електропозитивни компоненти (в генитивния случай), например:
CuSO 4 - меден (II) сулфат
PCl 3 - фосфор трихлорид
LaCl3 - лантанов (III) хлорид
СО - въглероден оксид
Броят на електропозитивните и електроотрицателните компоненти в имената се указва от числовите префикси, дадени по-горе (универсален метод), или от степените на окисляване (ако те могат да бъдат определени по формулата), като се използват римски цифри в скоби (знакът плюс е пропуснат). В редица случаи се дава заряд на йони (за катиони и аниони със сложни състави), като се използват арабски цифри със съответния знак.
За обикновени многоелементни катиони и аниони се прилагат следните специални имена:
За малък брой добре познати вещества те също се използват. специален име:
![]() 1. Киселинни и основни хидроксиди. соли
1. Киселинни и основни хидроксиди. соли
Хидроксиди - вид сложни вещества, които включват атоми на определен елемент Е (с изключение на флуор и кислород) и хидроксилна група ОН; обща формула за хидроксиди E (OH) п където п\u003d 1 ÷ 6. Форма на хидроксиди E (OH) п тя се нарича орто-форма; при п\u003e 2 хидроксида могат също да присъстват в мета-форма, която в допълнение към Е атоми и ОН групи, също О кислородни атоми, например Е (ОН) 3 и ЕО (ОН), Е (ОН) 4 и Е (ОН) 6 и ЕО 2 (ОН) 2.
Хидроксидите се делят на две групи, които са противоположни по химични свойства: киселинни и основни хидроксиди.
^ Киселинни хидроксиди съдържат водородни атоми, които могат да бъдат заменени с метални атоми, подчинени на правилото за стехиометрична валентност. Повечето киселинни хидроксиди се намират в мета-форма, с водородни атоми във формулите на кисели хидроксиди, поставени на първо място, например, H2SO4, HNO3 и H2CO3, а не SO2 (OH) 2, NO2 (OH) и CO (OH) 2. Общата формула на кисели хидроксиди е Н х EO при където електроотрицателния компонент на ЕО при х- наречен киселинен остатък. Ако не всички водородни атоми са заменени с метал, тогава те остават в киселинния остатък.
Имената на обикновените киселинни хидроксиди се състоят от две думи: правилно име с окончание „ай“ и групова дума „киселина“. Даваме формулите и собствените наименования на обикновените киселинни хидроксиди и техните киселинни остатъци (тире означава, че хидроксидът не е известен в свободната си форма или в кисел воден разтвор):
По-рядко срещаните киселинни хидроксиди се наричат \u200b\u200bсъгласно правилата за номенклатурата на сложни съединения, например:
 Имената на киселинни остатъци се използват при изграждането на имена на сол.
Имената на киселинни остатъци се използват при изграждането на имена на сол.
^ Основни хидроксиди съдържат хидроксидни йони, които могат да бъдат заменени с киселинни остатъци, подчинени на правилото за стехиометрична валентност. Всички основни хидроксиди са в орто-форма; общата им формула е M (OH) п където п \u003d 1,2 (рядко 3,4) и М п + - метален катион. Примери на формули и наименования на основни хидроксиди:
 Най-важното химично свойство на основни и кисели хидроксиди е взаимодействието им помежду си с образуването на соли ( реакция на образуване на сол), например:
Най-важното химично свойство на основни и кисели хидроксиди е взаимодействието им помежду си с образуването на соли ( реакция на образуване на сол), например:
Ca (OH) 2 + H2S04 \u003d CaSO4 + 2H20
Ca (OH) 2 + 2H2SO4 \u003d Са (HSO 4) 2 + 2H20
2Ca (OH) 2 + H 2 SO 4 \u003d Ca 2 SO 4 (OH) 2 + 2H20
Соли - вид сложни вещества, които включват катиони M п + и остатъци от киселина *.
Соли с обща формула М х (EO при) п се наричат среден соли и соли с незаместни водородни атоми, - кисел соли. Понякога солите също съдържат хидроксидни - или (и) оксидни йони; такива соли се наричат първичен соли. Ето няколко примера и имена на соли:
 Киселинните и основни соли могат да бъдат превърнати в средни соли чрез реакция със съответния основен и киселинен хидроксид, например:
Киселинните и основни соли могат да бъдат превърнати в средни соли чрез реакция със съответния основен и киселинен хидроксид, например:
Ca (HSO 4) 2 + Ca (OH) \u003d CaSO 4 + 2H20
Ca 2 SO 4 (OH) 2 + H 2 SO 4 \u003d Ca 2 SO 4 + 2H 2 O
Съществуват и соли, съдържащи два различни катиона: често се наричат двойни солинапример:
 2. Кисели и основни оксиди
2. Кисели и основни оксиди
Оксиди Е х ох при - продукти от пълно обезводняване на хидроксиди:
 Киселинни хидроксиди (H 2 SO 4, H 2 CO 3) кисели оксиди се срещат (SO 3, CO 2) и основните хидроксиди (NaOH, Ca (OH) 2) - основни оксиди (Na2O, CaO), освен това, състоянието на окисляване на елемент Е не се променя при прехода от хидроксид към оксид. Пример за формулите и имената на оксидите:
Киселинни хидроксиди (H 2 SO 4, H 2 CO 3) кисели оксиди се срещат (SO 3, CO 2) и основните хидроксиди (NaOH, Ca (OH) 2) - основни оксиди (Na2O, CaO), освен това, състоянието на окисляване на елемент Е не се променя при прехода от хидроксид към оксид. Пример за формулите и имената на оксидите:
 Киселинните и основни оксиди запазват солеобразуващите свойства на съответните хидроксиди при взаимодействие с хидроксиди с противоположни свойства или помежду си:
Киселинните и основни оксиди запазват солеобразуващите свойства на съответните хидроксиди при взаимодействие с хидроксиди с противоположни свойства или помежду си:
N2O5 + 2NaOH \u003d 2NaNO 3 + H20
3CaO + 2H 3 PO 4 \u003d Са 3 (PO 4) 2 + 3H20
La 2 O 3 + 3SO 3 \u003d La 2 (SO 4) 3
^ 3. Амфотерни оксиди и хидроксиди
амфотерни хидроксиди и оксиди - химично свойство, което се състои в образуването на два реда соли, например за хидроксид и алуминиев оксид:
(a) 2Al (OH) 3 + 3SO 3 \u003d Al 2 (SO 4) 3 + 3H20
Al 2 O 3 + 3H 2 SO 4 \u003d Al 2 (SO 4) 3 + 3H 2 O
(б) 2Al (OH) 3 + Na2O \u003d 2NaAlO2 + 3H20
Al2O3 + 2NaOH \u003d 2NaAlO2 + H20
По този начин, хидроксид и алуминиев оксид в реакции (а) проявяват свойства голям хидроксиди и оксиди, т.е. реагират с киселинни хидроксиди и оксид, образувайки съответната сол - алуминиев сулфат Al 2 (SO 4) 3, докато в реакции (б) проявяват свойства киселина хидроксиди и оксиди, т.е. реагират с основен хидроксид и оксид, образувайки сол - натриев диоксоалуминат (III) NaAlO2. В първия случай алуминиевият елемент проявява свойството на метал и е част от електропозитивния компонент (Al 3+), във втория - неметалното свойство и е част от електроотрицателния компонент на солевата формула (AlO 2 -).
Ако тези реакции протичат във воден разтвор, съставът на образуваните соли се променя, но присъствието на алуминий в катиона и аниона остава:
2Al (OH) 3 + 3H2SO4 \u003d 2 (SO 4) 3
Al (OH) 3 + NaOH \u003d Na
Тук квадратните скоби представляват сложни 3+ йони - хексаквалуминиум (III) катион, - - тетрахидроксоалуминат (III) -он.
Елементите, които проявяват метални и неметални свойства в съединенията, се наричат \u200b\u200bамфотерни; те включват елементи от А групите на Периодичната система - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., Както и повечето елементи групи - Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерните оксиди се наричат \u200b\u200bсъщите като основните, например:
 Амфотерните хидроксиди (ако окислителното състояние на даден елемент надвишава + II) могат да бъдат в орто - или (и) мета - форма. Ето няколко примера за амфотерни хидроксиди:
Амфотерните хидроксиди (ако окислителното състояние на даден елемент надвишава + II) могат да бъдат в орто - или (и) мета - форма. Ето няколко примера за амфотерни хидроксиди:
 Амфотерните оксиди не винаги съответстват на амфотерните хидроксиди, тъй като при опит за получаване на последните се образуват хидратирани оксиди, например:
Амфотерните оксиди не винаги съответстват на амфотерните хидроксиди, тъй като при опит за получаване на последните се образуват хидратирани оксиди, например:
 Ако амфотерният елемент в съединенията съответства на няколко окислителни състояния, тогава амфотерността на съответните оксиди и хидроксиди (и следователно амфотерността на самия елемент) ще бъде изразена по различни начини. При състояния с ниско окисление хидроксидите и оксидите проявяват преобладаване на основни свойства, докато самият елемент има преобладаване на метални свойства, така че почти винаги е част от катионите. При състояния с високо окисление, напротив, хидроксидите и оксидите проявяват преобладаване на киселинни свойства, а самият елемент има неметални свойства, така че почти винаги е част от анионите. И така, основните свойства доминират в мангановия (II) оксид и хидроксид, а самият манган е част от катионите от тип 2+, докато мангановият (VII) оксид и хидроксид доминират в киселинни свойства, а самият манган е част от аниона тип MnO 4 - т.е. , Амфотерните хидроксиди с голямо преобладаване на киселинни свойства се приписват на формули и имена, моделирани върху киселинни хидроксиди, например, HMn VII O 4 - манганова киселина.
Ако амфотерният елемент в съединенията съответства на няколко окислителни състояния, тогава амфотерността на съответните оксиди и хидроксиди (и следователно амфотерността на самия елемент) ще бъде изразена по различни начини. При състояния с ниско окисление хидроксидите и оксидите проявяват преобладаване на основни свойства, докато самият елемент има преобладаване на метални свойства, така че почти винаги е част от катионите. При състояния с високо окисление, напротив, хидроксидите и оксидите проявяват преобладаване на киселинни свойства, а самият елемент има неметални свойства, така че почти винаги е част от анионите. И така, основните свойства доминират в мангановия (II) оксид и хидроксид, а самият манган е част от катионите от тип 2+, докато мангановият (VII) оксид и хидроксид доминират в киселинни свойства, а самият манган е част от аниона тип MnO 4 - т.е. , Амфотерните хидроксиди с голямо преобладаване на киселинни свойства се приписват на формули и имена, моделирани върху киселинни хидроксиди, например, HMn VII O 4 - манганова киселина.
По този начин разделението на елементите на метали и неметали е условно; Между елементите (Na, K, Ca, Ba и др.) С чисто метални елементи и елементи (F, O, N, Cl, S, C и др.) С чисто неметални свойства има голяма група елементи с амфотерни свойства.
4. Двоични връзки
Обширен вид неорганични сложни вещества са бинарните съединения. Те включват на първо място всички двуелементни съединения (с изключение на основни, киселинни и амфотерни оксиди), например, H20, KBr, H2S, Cs2 (S2), N2O, NH3, HN3, CaC2 SiH4. Електропозитивните и електроотрицателните компоненти на формулите на тези съединения включват отделни атоми или свързани групи от атоми на един елемент.
Многоелементни вещества, във формулите на които една от съставките съдържа несвързани атоми от няколко елемента, както и едноелементни или многоелементни групи от атоми (с изключение на хидроксиди и соли), се считат за бинарни съединения, например CSO, IO 2 F 3, SBrO 2 F, CrO (O 2) 2, PSI 3, (CaTi) O 3, (FeCu) S 2, Hg (CN) 2, (PF 3) 2 O, VCl 2 (NH2). И така, CSO може да бъде представен като съединение CS2, в което един серен атом е заменен с кислороден атом.
Имената на бинарните съединения са изградени в съответствие с обичайните правила за номенклатурата, например:
 За някои бинарни съединения се използват специални имена, списъкът на които е даден по-рано.
За някои бинарни съединения се използват специални имена, списъкът на които е даден по-рано.
Химичните свойства на бинарните съединения са доста разнообразни, така че те често се разделят на групи по името на аниони, т.е. халиди, халкогениди, нитриди, карбиди, хидриди и др. се разглеждат отделно. Сред бинарните съединения има и такива, които имат някои характеристики на други видове неорганични вещества. И така, съединенията CO, NO, NO2 и (Fe II Fe 2 III) O 4, чиито имена са конструирани с помощта на думата оксид, не могат да бъдат причислени към типа оксиди (киселинни, основни, амфотерни). Въглеродният окис CO, азотният оксид NO и азотният диоксид NO 2 нямат съответните киселинни хидроксиди (въпреки че тези оксиди се образуват от неметали С и N), те не образуват соли, анионите на които биха съдържали C II, N II и N IV атоми. Въпреки че двойният оксид (Fe II Fe 2 III) O4 е оксидът на диажелез (III) желязо (II), въпреки че съдържа атоми на амфотерния елемент, желязото в електропозитивния компонент, той показва две различни окислителни състояния, които при взаимодействие с киселинни хидроксиди образуват не една, а две различни соли.
Бинарните съединения като AgF, KBr, Na2S, Ba (HS) 2, NaCN, NH4C1 и Pb (N3) 2 са изградени като соли от истински катиони и аниони, поради което те се наричат сол като бинарни съединения (или просто соли). Те могат да се разглеждат като продукти на заместване на водородните атоми в съединенията NF, НCl, НBr, Н 2 S, НCN и НN3. Последните във воден разтвор имат киселинна функция и затова техните разтвори се наричат \u200b\u200bкиселини, например НФ (аква) - флуороводородна киселина, Н 2 S (аква) - сероводород. Те обаче не принадлежат към типа киселинни хидроксиди, а техните производни - към соли в класификацията на неорганични вещества.
ХИМИЧЕН КОНТРОЛ
14. Колко Cr (OH) s съдържа същите еквиваленти като 174,96 g Mg (OH) 2?
Моларната маса на магнезиевия хидроксид е 58,32 g / mol, а еквивалентната маса е 29,16 g / mol. Следователно, масата на магнезиев хидроксид 174,96 g съдържа 174,96 g: 29,16 g / mol \u003d 6 mol-еквивалент.
Моларната маса на еквивалента на хромов хидроксид (III) е 1/3 M Cr (OH) s или 34,34 g / mol, а 6 mol-eq на това вещество ще бъде 34,33 g / mol x 6 mol \u003d 205,98 g.
Така 205,98 g Cr (OH) s съдържа същите еквиваленти като 174,96 g Mg (OH) 2.
34. Колко и какви стойности може да вземе магнитно квантово число m l с орбитално квантово число l \u003d 0,1,2,3? Какви елементи в периодичната система се наричат \u200b\u200bs-, p-, d-, f- елементи? Дайте примери
Броят на стойностите на магнитното квантово число зависи от орбиталното квантово число и е равно на
(21 + 1), където 1 е орбиталното квантово число. Следователно за l \u003d 0 m л =0,
при l \u003d 1 m л приема стойностите -1.0, +1;
при 1 \u003d 2 m л приема стойностите -2, -1, 0, + 1, + 2;
при \u003d 3 m л може да приеме стойностите -3, -2, -1, 0, + 1, + 2, + 3.
Химическите елементи, в атомите на които s-, p-, d-, f- орбитали са запълнени съответно с електрони, се наричат \u200b\u200bs-, p-, d-, f-елементи.
Например s-елементите включват H, He, както и алкални и алкалоземни метали (метали 1A и 11A -групи - Na, K, Rb, Be. Ca, Mg, Sg и др.)
Р-елементите включват например елементите, с които завършват периодите в периодичната система от елементи (с изключение на първия период) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Ce, Ar, Rn, Te и други
D-елементите включват елементи, разположени в големи периоди между s-елементи и p-елементи, например Fe, Mn, Cr, Ti, Mo, PT, Co, Ru, Rh и т.н.
F-елементите включват лантаниди, например, Ce, Nd, Pm, Sm, Eu, Gd и актиниди, например Th, U, Np, Pu, Am и т.н.
54. Кое е най-ниското окислително състояние на водород, флуор, сяра и азот? Защо? Съставете формули от калциеви съединения с тези елементи в това състояние на окисляване. Какви са имената на съответните съединения?
Водородният атом има един валентен електрон. Следователно, най-ниската степен на окисление на водорода ще бъде -1 (водородният атом взема 1 електрон от друг елемент). Това състояние на по-ниско окисление +2 -1, водородът се проявява в съединението СаН2. Това съединение се нарича калциев хидрид.
Флуорният атом има седем валентни електрона, до завършване на енергийното ниво липсва един електрон. Следователно, най-ниското (и единствено) състояние на окисляване на флуор е -1. Флуорните съединения в това състояние на окисление + 2–1 се наричат \u200b\u200bфлуориди. Например CaF2 е калциев флуорид.
Серен атом има шест валентни електрона, докато до завършване на енергийното ниво два електрона липсват. Следователно, най-ниската степен на окисление на сярата е -2. Серните съединения в това състояние на окисляване +2 -2 се наричат \u200b\u200bсулфиди. Например, CaS е калциев сулфид.
Азотният атом има пет валентни електрона, докато загубата на енергия не приключи, три електрона липсват. Следователно най-ниската степен на азотно окисление е -3. Азотните съединения в това състояние на окисляване + 2-3 се наричат \u200b\u200bнитриди. Ca s N2 е калциев нитрид.
74. Какво трябва да се разбира под степента на окисляване на атом? Определете степента на окисление на въглеродния атом и неговата валентност в съединенията: СН 4; СНзОН; НСООН; CO 2
Под степента на окисляване се разбира условният заряд на атом в съединение, изчислен от предположението, че той се състои само от йони. Степента на окисляване може да приеме отрицателна, положителна и нулева стойност, да представлява цяло или дробно число. Алгебраичната сума на окислителните състояния на атомите в дадено съединение винаги е нула, а в сложен йон - зарядът на йона.
В горните въглеродни съединения въглеродният атом е четиривалентен. Но степента на окисляване на въглеродния атом в тези съединения е различна.
В метан - СН 4 - окислителното състояние на въглерода е 4.
В метанол - СНЗОН - степента на окисляване на въглерода - 2, в мравчена киселина, НССО - окислителното състояние на въглерода +2, във въглеродния двуокис - СО 2 - окислителното състояние на въглерода +4.
94. По време на изгарянето на 11,5 g течен етилов алкохол се отделя 308,71 kJ топлина. Напишете термохимичното уравнение за реакцията, която произвежда водна пара и въглероден диоксид. Изчислете топлината на образуване на C2H5OH (g). Отговор: -277.67 kJ
С 2 Н 5 ОН (g) + 3 О 2 (ж) \u003d 2 СО 2 (ж) + 3 Н 2 О (п)
1 мол течна етилова спирала има маса 46 g.
За да съставим термохимичното уравнение, съставяме пропорцията:
11,5 g етанол ----------- 308,71 kJ
46 g етанол ------------ x kJ
Тогава термохимичното уравнение на метана приема формата:
C2H5OH (g) + 3 0 2 (g) \u003d 2 C0 2 (g) + 3H20 (n); ∆Н ° \u003d -1234,84
Топлинният ефект на реакцията се изписва със знак минус, тъй като по време на реакцията се отделя топлина.
Според закона на Хес топлинният ефект на реакцията не зависи от пътя на прехода, а зависи само от крайното и първоначалното състояние на системата.
ReactionН ° реакция \u003d ∑∆Н ° присл. - ∑∆Н ° arr начало
Стандартните енталпии на образуването на изходни материали и продукти от реакцията са взети от справочника:
∆N ° arr на СО 2 (g) \u003d -393,51 kJ / mol,
∆Н ° arr N20 (пара) \u003d -241,83 kJ / mol
SampleН ° проба О 2 (g) \u003d 0 kJ / mol.
∆Н ° arr (С 2 Н 5 ОН (ж)) \u003d [∆Н ° arr (Н 2 О) * 3 + ∆Н ° arr (СО2) * 2] - reactionН ° реакция \u003d [(-241, 83) * 3 + (- 393,51) * 2 - (-1234, 84) \u003d - 277,68 kJ / mol
114. Кой от карбонатите: BeCO3, CaCO3 или BaCO3 - може да се получи чрез действието на съответните оксиди с CO 2? Коя е най-енергичната реакция? Заключение направете изчисление ∆G ° 298 реакции
Нека вземем референтните стандартни стойности на Gibbs енергия ∆G ° 298 за изходни материали и крайни продукти на реакцията: ∆G ° 298 BeO \u003d -569,54 kJ / mol, ∆G ° 298 BeCO3 \u003d -944,75, ∆G ° 298 BaO \u003d -525,84 kJ / mol, ΔG ° 298 BaCO3 \u003d -1132,77 kJ / mol; ∆G ° 298 CaO \u003d -603,46 kJ / mol,
ΔG ° 298 СаСО 3 \u003d -1128,35 kJ / mol; ΔG ° 298 CO 2 \u003d -394,37 kJ / mol;
Тогава за реакцията BeO (k) + CO2 (g) \u003d BeCO3 (k), стандартната стойност на енергията на Gibbs ще бъде:
944,75 - [(- 569,54) + (- 394,37)] \u003d + 19,16 kJ / mol.
Положителна стойност на енергията на Гибс за тази реакция показва, че при стандартни условия тази реакция протича главно от дясно на ляво и не може да се получи берилиев кабонат от BeO и CO 2.
За реакцията BaO (k) + CO2 (g) \u003d BaCO3 (k), стандартната енергия на Gibbs е:
1132,77 - [(- 525,84) + (- 394,37)] \u003d - 212,56 kJ / mol /
За реакцията CaO (k) + CO2 (g) \u003d CaCO3 (k), стандартната енергия на Gibbs е:
1128,35 - [(- 603,46) + (- 394,37)] \u003d - 130,52 kJ / mol.
Енергийната стойност на Гибс за тези реакции е отрицателна и тези процеси протичат в посока напред, тоест е възможно да се получат калциеви и бариеви карбонати по този начин. Реакцията между бариев оксид и въглероден диоксид ще бъде най-енергична, тъй като стойността на енергията на Гибс за тази реакция ще има най-отрицателната стойност.
134. Равновесието на хомогенната система 4 NSl (g) + О 2 (g) ↔ 2N 2 0 (g) + 2Сl 2 (g) е установено при следните концентрации на реагиращите вещества mol / L: [N 2 О] р \u003d 0,14; [Cl2] p \u003d 0.14; [Hcl] P \u003d 0.20; [0] p \u003d 0.32. Изчислете началната концентрация на хлороводород и кислород.
[H20] p \u003d 0.14 mol / L
[Cl 2] p \u003d 0.14 mol / l
[Hcl] P \u003d 0.20 мол / л
[0] p \u003d 0,32 mol / l
Ref \u003d? ref \u003d?
Въз основа на реакционното уравнение целият хлор (2 mol) се образува от хлороводород (4 mol), а цялата вода - от първоначалния хлороводород и кислород.
Следователно, за да се образува 0,14 mol хлор, 0,28 mol хлороводород трябва да реагира и за да се получи 0,14 mol вода, 0,07 mol кислород трябва да влезе в реакцията.
По този начин първоначалната концентрация на Hcl е 0,20 + 0,28 \u003d 0,48 mol / L, а началната концентрация на O2 е 0,32 + 0,07 \u003d 0,39 mol / L.
Отговор: Началните концентрации на хлороводород и кислород са съответно 0,48 mol / L и 0,39 mol / L.
154. За неутрализиране на 1 литър разтвор, съдържащ 1,4 g KOH, са необходими 50 cm 3 от киселинен разтвор. Изчислете моларната концентрация на еквивалентния разтвор на киселина
Намерете титъра на разтвора на KOH:
Сега изчисляваме моларната концентрация на еквивалента на разтвора на КОН:
Знаейки стойността на молната концентрация на еквивалента, разтворът на KOH ще изчисли моларната концентрация на киселинния еквивалент:
174. Колко грама урея CO (NH2) 2 трябва да се разтворят в 75 g вода, така че температурата на кристализация на разтвора да намалее с 0,465 °? Криоскопичната константа на водата е 1,86
Моларната маса на карбамида е 60 g / mol. Намаляване на температурата на замръзване на разтвора ΔТ К \u003d 0,465 ° С.
Според закона на Раул, понижението на температурата на кристализация на разтвор в сравнение с температурата на кристализация на чист разтворител зависи от криоскопичната константа на разтворителя и моларната концентрация на разтвореното вещество. От тук можете да изчислите масата на разтвореното вещество - урея в разтвор.
194. Направете молекулни и йонно-молекулни уравнения на реакциите, изразени с йонно-молекулни уравнения
Fe (OH) s + 3H + \u003d Fe 3+ + 3 H20
Cd 2+ + 2 OH - \u003d Cd (OH) 2
H + + NO2 - \u003d HNO2
Fe (OH) 3 (t) + 3 НСl \u003d FeС1 3 + 3 Н 2 О
Fe (OH) 3 (t) + 3 Н + + 3 Сl - \u003d Fe 3+ + ЗСl - + 3 Н 2 О
Fe (OH) 3 (t) + 3 H + \u003d Fe 3+ + 3 H20
Cd (NO h) 2 + 2 KOH \u003d Cd (OH) 2 (t) + 2 KNO3
Cd 2+ + 2NO 3 + 2K + + 2OH - \u003d Cd (OH) 2 (t) + 2 K + + 2 NO 3 -
Cd 2 + 2 OH - \u003d Cd (OH) 2 (t)
НС1 + NaNО 2 \u003d НNО 2 + NaС1
Н + + Сл - + Na + + NO 2 - \u003d НNО 2 + Na + + Сл -
H + + NO2 - \u003d HNO2
214. Когато A12 (SO4) s и Na2C03 се смесват, всяка от приетите соли се хидролизира необратимо, за да се образува съответната основа и киселина. Изразете тази кохидролиза с йонно-молекулни и молекулни уравнения
A1 2 (SO 4) s + 3 Na 2 СО 3 + 3 Н 2 О → 2 А1 (ОН) 3 (t) + 3 Na 2 SO 4 + ЗСО 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + ZSO 3 2- + 3 Н 2 О → 2 Fe (ОН) 3 (t) + 6 Na + + 3 SO 4 2- + ЗСО 2 (d)
2 А1 3+ + ЗСО 3 2- + 3 Н 2 О → 2 А1 (ОН) 3 (t) + ЗСО 2 (ж)
254. Желязо и сребро плочи са свързани чрез външен проводник и се потапят в разтвор на сярна киселина. Направете схема на тази галванична клетка и напишете електронните уравнения на процесите на анода и катода.
(-) Fe | H 2 S0 4 | | H 2 S0 4 | Ag (+)
В анода (желязо) процесът протича Фе-2 ё \u003d Фе 2+, електроните преминават през проводника към сребърната плоча и процесът протича върху сребърната повърхност на катода
2 Н + + 2 ё \u003d Н 2 Т.
Желязната плоча ще се разтвори и на сребърната плоча ще се наблюдава водород.
274. Направете електронни уравнения на процесите, протичащи върху графитни електроди по време на електролизата на разтвор на KBr. Каква маса на веществото се отделя при катода и анода, ако се извърши електролиза в продължение на 1 h 35 min при ток 15 A? Отговорът е: 0886 грама; 70,79g
По време на електролизата на воден разтвор на калиев бромид с инертни (графитни) електроди процесът на възстановяване на водните молекули протича в катода и се отделя водород:
2Н 2 О + 2ё \u003d Н 2 + 2О1Н -
Процесът на окисляване на бромидните йони протича на анода и се освобождава бром: 2Br - - 2b \u003d Br 2 Моларната маса на водородния еквивалент е 1 g / mol, а моларната маса на бромовия еквивалент е 79,904 g / mol.
Тогава, според законите на Фарадей, можете да намерите маса от водород и бром, които се отделят съответно на катода и на анода.
294. Какъв метал е по-добре да изберете за защита на протектора срещу корозия на оловната обвивка на кабела: цинк, магнезий или хром? Защо? Направете електронни уравнения на анодните и катодни процеси на атмосферна корозия. Какъв е съставът на продуктите от корозия?
Със защита на протектора протекторът е по-активен метал, отколкото металът на защитената конструкция служи като анод и се разрушава, като по този начин предпазва конструкцията от разрушаване. Следователно, колкото по-отрицателен е потенциалът на металния протектор, толкова по-ефективна ще бъде защитата на протектора. Магнезият ще има най-ниския потенциал -2.37V, (0.763 V за цинк; 0.74 V за хром)
Тъй като обвивката на кабела е направена от олово, галваничната двойка магнезий - олово ще има най-голямата потенциална разлика. А магнезият ще служи като най-добрата защита на протектора.
С атмосферната корозия процесът протича на повърхността на магнезиевия протектор:
2Mg - 4ё \u003d 2Mg 2+
Електроните преминават през проводника до оловния кабел и на повърхността на оловото се появява деполяризация на кислорода:
О 2 + 2 Н 2 О + 4ё \u003d 4 ОН -
Продуктът на атмосферната корозия е магнезиевият хидроксид.
2 Mg 2+ + 4 OH - \u003d 2 Mg (OH) 2
314. Напишете изразите за константи на нестабилност на следните сложни йони: [Ag (CN) 2] -; [Ag (NH3) 2] +; [Ag (SCM) 2] -. Знаейки, че съответно са равни на 1.0 * 10 -21, 6.8 * 10 -8, 2.1 * 10 -11, посочете в кой разтвор, съдържащ тези йони, при еднаква молна концентрация на Ag + йони, е по-голяма?
Пишем изразите на константата на нестабилността за тези сложни йони:
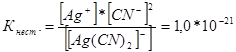
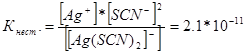
При дадена температура стойността на константата на нестабилността е постоянна стойност. Колкото по-ниска е константата на нестабилността, толкова по-стабилен е комплексът, следователно, най-високата концентрация на сребърни йони ще бъде в разтвора, съдържащ комплексния йон [Ag (NH3) 2] +.
литература
1. Ахметов Н.С. Обща и неорганична химия. М, 2002.
2. Карапетянци М. К., Дракин С. И. Обща и неорганична химия. М. 1994.
3. Глинка Л. I. Обща химия. М. 1984.
