Роден през 1844 г. във Виена. Болтцман е пионер и пионер в науката. Неговите творби и изследвания често са били неразбираеми и отхвърляни от обществото. С по-нататъшното развитие на физиката обаче неговите творби са признати и впоследствие публикувани.
Научните интереси на учения обхващаха такива основни области като физика и математика. От 1867 г. работи като учител в редица висши учебни заведения. В своите изследвания той установява, че се дължи на случайното въздействие на молекулите върху стените на съда, в който се намират, докато температурата директно зависи от скоростта на движение на частиците (молекулите), с други думи, от тях. Следователно, колкото повече тези частици се движат, т.е. толкова по-висока е температурата. Константата на Болцман е кръстена на известния австрийски учен. Именно той направи безценен принос за развитието на статичната физика.
Физическото значение на тази константа
Константата на Болцман определя връзката между температура и енергия. В статичната механика тя играе основна ключова роля. Константата на Болцман е равна на k \u003d 1,3806505 (24) * 10 -23 J / K. Цифрите в скоби показват допустимата грешка на стойността на количеството спрямо последните цифри. Заслужава да се отбележи, че константата на Болцман може да бъде получена и от други физични константи. Тези изчисления обаче са доста сложни и трудни за изпълнение. Те изискват дълбоки познания не само в областта на физиката, но и
· -1
Константата на Болцман ( k (\\ displaystyle k) или k B (\\ displaystyle k _ (\\ rm (B)))) - физическа константа, която определя връзката между температура и енергия. Наречен на австрийския физик Лудвиг Болцман, който направи голям принос за статистическата физика, в която тази константа играе ключова роля. Експерименталната му стойност в Международната система от единици (SI) е:
k \u003d 1380 648 52 (79) × 10 - 23 (\\ displaystyle k \u003d 1 (,) 380 \\, 648 \\, 52 (79) \\ пъти 10 ^ (- 23)) J /.Числата в скоби показват стандартната грешка в последните цифри на стойността.
Връзката между температура и енергия[ | ]
В хомогенен идеален газ при абсолютна температура T (\\ дисплей T), енергията, която се приписва на всяка транслационна степен на свобода, е равна, както следва от разпределението на Максуел, k T / 2 (\\ дисплей стил kT / 2), При стайна температура (300) тази енергия е 2, 07 × 10 - 21 (\\ дисплей 2 (,) 07 \\ пъти 10 ^ (- 21)) J, или 0,013 eV. В едноатомния идеален газ всеки атом има три степени на свобода, съответстващи на три пространствени оси, което означава, че всеки атом има енергия в 3 2 k T (\\ displaystyle (\\ frac (3) (2)) kT).
Познавайки топлинната енергия, можем да изчислим средно-квадратната скорост на атомите, която е обратно пропорционална на квадратния корен на атомната маса. Скоростта на RMS при стайна температура варира от 1370 m / s за хелий до 240 m / s за ксенон. В случай на молекулен газ ситуацията се усложнява, например диатомичният газ има пет степени на свобода (при ниски температури, когато атомните вибрации в молекулата не се възбуждат).
Определение за ентропия[ | ]
Ентропията на термодинамичната система се определя като естествен логаритъм на броя на различни микростати Z (\\ дисплей Z)съответстващо на дадено макроскопично състояние (например състояние с дадена обща енергия).
S \u003d k ln \u2061 Z. (\\ displaystyle S \u003d k \\ ln Z.)Коефициент на пропорционалност k (\\ displaystyle k) и има константа на Болцман. Този израз определя връзката между микроскопичните ( Z (\\ дисплей Z)) и макроскопски състояния ( S (\\ дисплей стил S)), изразява централната идея на статистическата механика.
Основното уравнение на молекулярната кинетична теория идеалният газ носи по-дълбок смисъл от обичайната формула за определяне на налягането на идеалния газ. За да разберем, пишем това уравнение p \u003d (1/3). п m 0v̅ 2 в малко по-различна форма:
p \u003d (2/3). п. m 0v̅ 2/2 \u003d (2/3). ne.
По дефиницияm 0v̅ 2/2е средната кинетична енергия на транслационното движение на молекулата.
Налягането на газа е пропорционално на средната кинетична енергия на транслационното движение на молекулите.
Като се има предвид, че n \u003d N /V \u003dN A /V mуравнение p \u003d (2/3). ne ще изглежда така:
pV M \u003d (2/3). N A E̅.
От друга страна, от уравнението на състоянието на идеален газ
pV M \u003d RT.
Сравнявайки и двете тези уравнения, получаваме:
(2 / 3) . N A E̅ \u003dRT.
E̅ \u003d (3/2). (R /N A) . Т.
От това отношение следва важен извод:
средната кинетична енергия на газовите молекули е пряко пропорционална на нейната абсолютна температура.
Универсално газово постоянно съотношение R до константа Avogadro N a има и константа, която се нарича константа на Болцман к.
R /N A \u003dk - константа на болц мана.
Физическо значение константа на Болцман се състои в това, че тя установява съотношението температура, изразена в енергия (J) и термодинамична (К) единици.
Константа на Болцман е основна константа, стойността на която се определя доста точно:
k \u003d 1,38. 10 -23 Дж/ К.
E̅ \u003d (3/2). kT.
Ако този израз се замества във формулата p \u003d (2/3). ne, получаваме зависимостта на налягането на идеалния газ от температурата и концентрацията на неговите молекули:
p \u003dнКТ.
Тази връзка се потвърждава експериментално карлов закон, според която налягането на дадена маса газ е пряко пропорционално на абсолютната температура: p ~Т. От това също следва, че
при едно и също налягане и температура концентрацията на молекулите във всички газове е еднаква.
По този начин температурата като макро параметър на системата характеризира състоянието на нейното термодинамично равновесие. Материал от сайта
Подходът на телесната температура до абсолютна нула води до намаляване на средната кинетична енергия на молекулите. При абсолютна нула тяхното транслационно движение престава. Съвременната наука отрича възможността за постигане на абсолютни нулеви температури.
В зависимост от избраната скала температурата се измерва в градуси по Целзий или по Фаренхайт или в келвини. Като микро параметър на системата температурата определя средната кинетична енергия на значителен брой молекули; като мярка тя се измерва в джаули. Коефициентът на свързване между тези определения е константа на Болцман.
Въпреки факта, че изводът, че температурата е свързана със средната кинетична енергия на молекулите, е установен за газове, той е валиден и за течности и твърди вещества.
На тази страница материал по темите:
Молекулярно-кинетична интерпретация на явлението осмоза
Константи в молекулярната кинетична физика
Молекулярно кинетична интерпретация на температурата на формулата
-
Болцман Лудвиг (1844-1906)- Големият австрийски физик, един от основателите на молекулярно-кинетичната теория. В творбите на Болцман за първи път молекулярно-кинетичната теория се появява като логически кохерентна, последователна физическа теория. Болтцман даде статистическа интерпретация на втория закон на термодинамиката. Той направи много за разработването и популяризирането на теорията за електромагнитното поле Максуел. Борец по природа Болтман страстно защити нуждата от молекулярна интерпретация на топлинните явления и пое основната тежест на борбата с учени, които отрекоха съществуването на молекули.
Уравнение (4.5.3) включва съотношението на универсалната газова константа R до постоянен Avogadro N А . Това съотношение е едно и също за всички вещества. Нарича се константата на Болцман, в чест на Л. Болтцман, един от основателите на молекулярно-кинетичната теория.
Константата на Болцман е равна на:
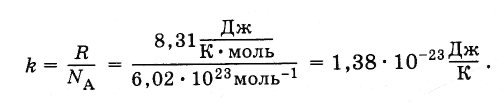 (4.5.4)
(4.5.4)Уравнение (4.5.3), като се взема предвид константата на Болцман, се записва, както следва:
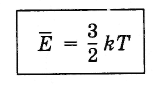 (4.5.5)
(4.5.5)Физическото значение на константата на Болцман
В исторически план първоначално температурата беше въведена като термодинамично количество и за нея беше определена мерна единица - виж точка 3.2. След като се установи връзката на температурата със средната кинетична енергия на молекулите, стана ясно, че температурата може да бъде определена като средна кинетична енергия на молекулите и да се изрази в джаули или ерги, т.е. вместо Tвъведете стойност T *така че
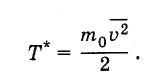
Така определената температура е свързана с температурата, изразена в градуси, както следва:
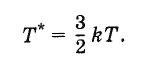
Следователно константата на Болцман може да се разглежда като стойност, свързваща температурата, изразена в енергийни единици, с температурата, изразена в градуси.
Зависимост на налягането на газа от концентрацията на неговите молекули и температурата
изразявайки Eот отношение (4.5.5) и заместване във формула (4.4.10) получаваме израз, показващ зависимостта на налягането на газа от концентрацията на молекулите и температурата:
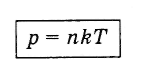 (4.5.6)
(4.5.6)От формула (4.5.6) следва, че при еднакви налягания и температури концентрацията на молекулите за всички газове е една и съща.
Оттук следва законът на Авогадро: равни обеми газове при еднакви температури и налягания съдържат еднакъв брой молекули.
Средната кинетична енергия на транслационното движение на молекулите е пряко пропорционална на абсолютната температура. Коефициент на пропорционалност- константа на Болцманк \u003d 10 -23 J / K - трябва да запомните.
§ 4.6. Разпределение на Максуел
В голям брой случаи познаването само на средните стойности на физическите величини не е достатъчно. Например познаването на средната височина на хората не позволява да се планира производството на дрехи с различни размери. Трябва да знаете приблизителния брой хора, чийто растеж се намира в определен интервал. По същия начин е важно да се знае броят на молекулите, имащи скорости, различни от средната. Максуел беше първият, който откри как може да се определят тези числа.
Вероятност за случайно събитие
В §4.1 вече споменахме, че за да опише поведението на голям набор от молекули, J. Maxwell въведе концепцията за вероятността.
Както многократно беше подчертано, по принцип е невъзможно да се проследи промяната в скоростта (или импулса) на една молекула през дълъг интервал от време. Също така е невъзможно точно да се определят скоростите на всички газови молекули в даден момент. От макроскопичните условия, в които се намира газът (определен обем и температура), определени стойности на молекулните скорости не следват с необходимост. Скоростта на една молекула може да се счита за произволна променлива, която при различни макроскопични условия може да приема различни стойности, точно както при хвърляне на зарове може да отпадне всеки брой точки от 1 до 6 (броят на костните лица е шест). Невъзможно е да се предвиди колко точки ще паднат по време на даден зар. Но вероятността, да речем, пет точки ще бъдат отпаднали, може да се определи.
Каква е вероятността от случайно събитие? Нека се произведе много голям брой Nтест (N е броят на костните ролки). Нещо повече, в N" в случаите е имало благоприятен резултат от тестовете (т.е. загуба на петте). Тогава вероятността от това събитие е равна на съотношението на броя на случаите с благоприятен изход към общия брой на съдебните процеси, при условие че този брой е произволно голям:
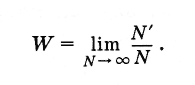 (4.6.1)
(4.6.1)За симетрична кост вероятността за всеки избран брой точки от 1 до 6 е равна.
Виждаме, че на фона на много случайни събития се разкрива определена количествена закономерност, появява се число. Този брой - вероятност - ви позволява да изчислявате средни стойности. Така че, ако направите 300 костни ролки, тогава средният брой от пет капки, както следва от формула (4.6.1), ще бъде: 300 · \u003d 50, и няма значение да хвърлите една и съща кост 300 пъти или 300 еднакви кости едновременно ,
Няма съмнение, че поведението на газовите молекули в съд е много по-сложно от движението на изоставен зар. Но тук също може да се надяваме да намерим определени количествени закономерности, които дават възможност за изчисляване на статистически средни стойности, ако само задачата е поставена по същия начин, както в теорията на игрите, а не както в класическата механика. Необходимо е да изоставим неразрешимия проблем за определяне на точната стойност на скоростта на молекулата в даден момент и да се опитаме да намерим вероятността скоростта да има определена стойност.
