Електрохимията е клон на физическата химия, в който се изучават физикохимичните свойства на йонните системи, както и процесите и явленията на фазовите граници, включващи заредени частици.
Проводниците на електрически ток се делят на електронни (проводници от първия вид) и йонни (проводници от втория вид).
Проводници от първия вид са металите в твърдо и разтопено състояние. В тях електрическият ток се осъществява от движението на електроните на електронния газ. Освен това преминаването на електрически ток в проводници от първи вид не е придружено от химически промени в техния материал.
Проводници от втория вид са някои разтвори на соли, киселини и основи, както и някои вещества, главно соли, в разтопено състояние. Електрическият ток в тях се осъществява от движението на йони (както положителни, така и отрицателни).
Електролитите са химични съединения, които в разтвор (изцяло или частично) се дисоциират в йони. Дисоциацията води до отделянето, отделянето на йони от молекула или кристал в резултат на взаимодействието на йони с молекулите на разтворителя.
Молекулите на разтворителите с добра дисоциираща способност са силно полярни и следователно такива разтворители имат висока диелектрична константа.
Под влияние на електрически полета, създадени от електролитни йони, молекулите на полярния разтворител се привличат от йони, ориентират се около тях и от своя страна привличат йони към себе си, отслабват връзката между йони.
По същия начин те действат върху йони, които съставляват решетката, например, от йонен кристал. Броят йони на всеки знак се определя от стехиометрични коефициенти във формулата на електролитите, при спазване на закона за електронейтралност - сумата от положителните заряди е равна на сумата от отрицателните. По този начин, въпреки наличието на йони, разтворът на електролит остава електрически неутрален.
Електростатичното взаимодействие на електролитния йон с молекулите на разтворителя - солват - води до образуването на молекулен комплекс, солват, около йона. Наборът от молекули на разтворител, заобикалящ йона, е солватационна обвивка. Разтварянето във водни разтвори се нарича хидратация.
Разграничете силните и слабите електролити.
Силните електролити се дисоциират в разтвора почти напълно. Във водни разтвори много минерални киселини (HN0 3, HC1, HC10 4 и др.), Основи (основи) и повечето соли са силни електролити.
Слабите електролити се дисоциират в разтвора само частично. Почти всички органични киселини и основи са слаби електролити във водни разтвори.
Силните и слаби електролити са две различни състояния на химични съединения (електролити) в зависимост от естеството на разтворителя. В един разтворител този електролит може да бъде силен електролит, в друг - слаб.
Процесът на дисоциация на слабите електролити е обратим, тъй като йони от противоположния знак, срещащи се в разтвор, могат да се обединят отново в молекули.
Нека разгледаме най-простия случай на слаб силно разреден бинарен едновалентен електролит, дисоцииращ според схемата
MA<=> M + + A -
Важни характеристики на електролита:
Степента на дисоциация α - съотношението на дисоциираните молекули от броя на първоначално взетите
Константата на дисоциация K d, която за този случай може да бъде представена (използвайки закона на действащите маси - при постоянна температура, скоростта на тази реакция е пряко пропорционална на произведението на концентрациите на реагиращите вещества и всяка от концентрациите се включва в степента, в прости случаи, равна на коефициента пред формулата на това вещество в уравнението реакции) във формата
Например
![]()
Ако тогава ![]() , за малки стойности на a<0,03, (1-a) » 1, следовательно - это математическое выражение законът за разреждане на Ostwald
който гласи следното:
, за малки стойности на a<0,03, (1-a) » 1, следовательно - это математическое выражение законът за разреждане на Ostwald
който гласи следното:
Степента на дисоциация на слаб електролит в разтвор е колкото по-висока, толкова по-разреден е разтворът, т.е. в безкрайно разреден разтвор, степента на дисоциация на всеки електролит е 1.
Взаимното преобразуване на електрическите и химичните форми на енергия се извършва в електрохимичните системи, състоящи се от:
1) проводници от втори вид (/) електролити,
2) проводници от първи вид (//), (///) в контакт с електролита.
3) проводници (IV) - външна верига - осигуряваща преминаването на тока между проводниците (7 /) и (III). На границата между две фази (/ - // и I - III) се прехвърля електрически заряд - протича електрохимична реакция.
Анодът е електрод, върху който възниква реакция на окисляване.
Катодът е електрод, върху който възниква редукционна реакция. Съответно в електрохимията редукционните реакции обикновено се наричат \u200b\u200bкатодни, а окислителните - анодни.
В химически източник на електрически ток - галванична клетка - енергията на химичния процес преминава в електрическа енергия.
Съотношението между количеството електричество и масата на реагиращите вещества при електрохимични реакции върху електродите се изразява от законите на Фарадей.
1-ви закон на Фарадей. Масата на веществото m, претърпяло химическа трансформация под въздействието на електрически ток, е пропорционална на количеството на протичащата електроенергия q
t \u003d k 3 q
където до ъъъ - електрохимичен еквивалент (g / C) - масата на реагираното вещество по време на потока от 1 кулон електричество.
2-ри закон за Фарадей. Когато преминават през различни електролити с едно и също количество електричество, масите от различни вещества, участващи в реакцията на електрода, са пропорционални на моларните им маси от еквиваленти (M equiv):
t x: t 2: t b \u003d M eq]: M eq 2: M eq 3
Следствие.Електрохимичното преобразуване на 1 мол-еквивалент на всяко вещество изисква същото количество електричество F \u003d eN A - 96485 С / мол-екв
(или 26,8 A h / mol-еквивалент), наречен Константа на Фарадей.
Уравнението, съчетаващо двата закона на Фарадей:
където М е моларната маса на веществото, 1 - сила на тока т - време за обработка z -броят на електроните, участващи в електрохимичната реакция.
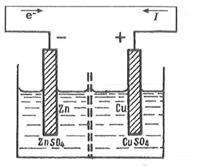 Помислете за превръщането на химическата енергия в електрическа енергия чрез примера на галванична клетка Даниел Якоби.
Помислете за превръщането на химическата енергия в електрическа енергия чрез примера на галванична клетка Даниел Якоби.
При схематично записване на електрохимични системи се използва следната нотация:
1. границата между електрода и разтвора се обозначава с вертикална плътна линия
2. Границата между електролитите се обозначава с две вертикални линии.
Елементът Даниел-Якоби се състои от цинкови и медни електроди, потопени съответно в разтвори на цинкови и медни сулфати, разделени от пореста диафрагма, за да се предотврати смесването им.
Правилото за запис на вериги от електрохимични елементи.
EMF на електрохимична клетка се счита за положителен, ако електрохимичната верига е написана така, че катионите по време на работа на клетката преминават в разтвор от левия електрод вдясно и електроните се движат в същата посока във външната верига. Даниел Якоби Елементна диаграма
(-) Zn | ZnSQ 4 || CuS0 4 | Cu (+)
Когато метал се потопи в разтвор, металните йони под действието на силно полярни водни молекули започват да преминават във водния слой, съседен на металната повърхност.
В този случай повърхностният слой на метала се изчерпва в катиони, придобива излишен отрицателен заряд и между него и катионите в разтвора възниква потенциална разлика, което не позволява на други катиони да напуснат метала - се установява равновесие.
В клетката Даниел-Якоби цинковият електрод, който има по-висока способност да отделя йони в разтвора в сравнение с медта, придобива по-висок отрицателен заряд. Ако свържете електродите с метален проводник, излишните електрони ще преминат от цинковата плоча към медната.
Това нарушава баланса на повърхността на всеки от електродите. В цинковия електрод (отрицателния полюс на елемента - анода) окисляването на цинка продължава Zn \u003d Zn 2+ + 2e ~.
При медния електрод (положителния полюс на елемента - катода) редукцията на мед Cu 2+ + 2e ~ \u003d Cu продължава.
Така се осъществява спонтанно протичащ процес, при който цинковата плоча се разтваря, върху медта се отделя метална мед и във външната верига тече електрически ток. Общата редокс реакция:
Cu 2+ + Zn -\u003e Cu + Zn 2+
От друга страна, ако по време на химическа реакция z мол еквиваленти на дадено вещество се отделят или разтварят на всеки електрод (съгласно закона на Фарадей, zF Cl на електроенергия протича във външната верига), тогава максималната работа, която една галванична клетка прехвърля такса zF между електродите с разлика потенциалите E е равно на zFE.
Електромоторната сила (ЕМП) на елемент Е се нарича разлика на потенциала между полюсите на обратим електрохимичен елемент.
![]() ,
,
където R е газовата константа,
F е числото на Фарадей (96 500 C / mol),
Т е абсолютната температура
n е броят на включените в процеса електрони.
При температура 298 К това уравнение приема следната форма:
![]() .
.
където Е е условният стандартен електроден потенциал във водородна скала.
За да се определи равновесния електроден потенциал по водородна скала съставят елемента от този електрод и стандартен водороден електрод. Което е потопен от платина
електролит, по който се пропуска водороден газ, H + | H 2, Pt) s
активност на водородни йони в разтвор, равен на единство и налягане на водород 1 атм. Потенциалът му при всяка температура условно се приема равен на нула.
В този случай: отляво се поставя стандартен водороден електрод.
Например, за да се определи потенциалът на цинков електрод, се съставя електрохимична верига
Pt, H 2 | H + || Zn 2+ | Zn
Реакцията на електрода се записва като реакция на редукция, т.е. прикрепване на електрон: в този пример, върху водорода (вляво)
електрод 2Н + + 2е ~ \u003d Н2, върху цинковия (десен) електрод Zn 2+ + 2e ~ \u003d Zn. Цялостната реакция се записва като разликата между реакциите отдясно и отляво
H 2 + Zn 2+ \u003d 2H + + Zn
Стандартният електроден потенциал се счита за положителен, ако електродът се зарежда по-положително от стандартния водороден електрод. В този случай електрически ток ще тече вътре в елемента отляво надясно и ЕМП на елемента ще бъде положителен.
Стандартният електроден потенциал се счита за отрицателен, ако електродът се зарежда по-отрицателно от стандартния водороден електрод. В този случай електрически ток ще тече вътре в елемента от дясно на ляво и emf на елемента ще бъде отрицателен.
В разглеждания пример Н2 + Zn 2+ \u003d 2Н + + Zn токът в елемента ще тече от цинковия електрод към водорода (от дясно на ляво) и ЕРС на елемента, подобно на цинковия потенциал, равен на него, ще има отрицателен знак.
Стандартни електродни потенциали, определени от водород скалата при 25 С (298 К) обикновено се поставя в ред. Например
Редокс процес, насилствено протичащ под влияние на електрически ток се нарича електролиза.
Електролизата се извършва в електролизатор, напълнен с електролит, в който са потопени електроди, свързани с външен източник на ток.
Извиква се електрод, свързан с отрицателния полюс на външен източник на ток катод, В катода настъпват процеси на възстановяване на електролитни частици. Извиква се електрод, свързан с положителния полюс на източник на ток анод, На анода продължава окисляването на електролитни частици или електроден материал.
Анодните процеси зависят от естеството на електролита и анодния материал. В тази връзка се отличава електролиза с инертен и разтворим анод.
Анод се нарича инертен, материалът на който не се окислява по време на електролиза. Инертните електроди включват например графит (въглерод) и платина.
Разтворим е анодът, материалът на който може да се окисли по време на електролиза. Повечето метални електроди са разтворими.
Като електролит могат да се използват разтвори или стопилки. В разтвор или разтопен електролит, йони са в хаотично движение. Под въздействието на електрически ток йоните придобиват насочено движение: катионите се придвижват към катода, а анионите - към анода и съответно могат да се разхвърлят върху електродите.
По време на електролиза инертен електрод се топи при катода могат да бъдат намалени само метални катиони, а на анода е възможно окисляване на аниони.
При електролиза на вода решения в допълнение към металните катиони водните молекули могат да бъдат редуцирани в катода, а водородните йони Н + в киселинни разтвори. По този начин при катода са възможни следните конкурентни реакции:
(-) К: Аз п + + ne → Аз
2H20 + 2 ē → H 2 + 2 OH -
2Н + + 2 ē
→ H 2 ![]()
При катода първо протича реакцията с най-висока стойност на потенциала на електрода.
При електролиза на вода разтворими анодни разтвориВ допълнение към окисляването на аниони са възможни окислителни реакции на самия електрод, водни молекули и в алкални разтвори на хидроксидни йони (OH -):
(+) A: Аз - n ē → Аз п +
анионно окисление E 0
2H20 - 4 ē
0 2 + 4 Н + ![]()
4OH - - 4 ē
\u003d 0 + 2Н20 ![]()
На анода реакцията с най-ниската стойност на потенциала на електрода протича първо.
За реакциите на електрода се дават равновесни потенциали при липса на електрически ток.
Електролизата е неравновесен процес, поради което потенциалите на електродните реакции при ток се различават от техните равновесни стойности. Преместването на потенциала на електрода от неговата равновесна стойност под въздействието на външен ток се нарича поляризация на електрода. Величината на поляризацията се нарича пренапрежение. Много фактори влияят върху големината на пренапрежението: естеството на материала на електрода, плътността на тока, температурата, pH околната среда и др.
Пренапреженията на разделянето на катоден метал са сравнително малки.
При високо пренапрежение като правило протича процесът на образуване на газове, като водород и кислород. Минималното пренапрежение на водорода в катода в кисели разтвори се наблюдава при Pt (h \u003d 0,1 V), а максималното при олово, цинк, кадмий и живак. Променя се пренапрежението при замяна на киселинни разтвори с алкални. Например, на платина в алкална среда, пренапрежението на водорода е h \u003d 0,31 V (виж приложението).
Еволюцията на аноден кислород също е свързана с пренапрежение. Минималното пренапрежение на отделянето на кислород се наблюдава при Pt електродите (h \u003d 0,7 V), а максималното - при цинк, живак и олово (виж приложението).
От гореизложеното следва, че при електролиза на водни разтвори:
1) металните йони се възстановяват при катода, чиито електродни потенциали са по-големи от потенциала за намаляване на водата (-0,82 V). Металните йони с повече отрицателни електродни потенциали от -0,82 V не се възстановяват. Те включват йони на алкални и алкалоземни метали и алуминий.
2) на инертен анод, като се вземе предвид пренапрежението на кислорода, окисляването на тези аниони протича, чийто потенциал е по-малък от потенциала на окисляване на водата (+ 1,23 V). Такива аниони включват например I -, Br -, Cl -, NO2 -, OH -. Анионите CO 3 2-, PO 4 3-, NO 3 -, F - - не окисляват.
3) по време на електролиза с разтворим анод, в неутрални и киселинни среди се разтварят електроди от тези метали, електродният потенциал на които е по-малък от + 1,23 V, а в алкален - по-малък от + 0,413 V.
Общите продукти на процесите в катода и анода са електрически неутрални вещества.
За осъществяване на процеса на електролиза трябва да се приложи напрежение към електродите. Електролично напрежение U elza е потенциалната разлика, необходима за реакции на катода и анода. Теоретично напрежение на електролиза ( U elsa, theor), без да се взема предвид пренапрежението, омичния спад на напрежението в проводниците от първи вид и в електролита
U el, theor \u003d E а - E k, (7)
където E и, E k - потенциали на анодни и катодни реакции.
Връзката между количеството вещество, отделено по време на електролиза, и количеството ток, преминат през електролита, се изразява от два закона на Фарадей.
I закон на Фарадей.Количеството вещество, образувано на електрода по време на електролиза, е пряко пропорционално на количеството електричество, преминаващо през електролитния разтвор (стопилка):
където к- електрохимичен еквивалент, g / C или g / A · h; Q- количество електричество, висулка, Q=то; т-време, s; азток, A; F\u003d 96500 С / мол (A · s / mol) \u003d 26,8 A · h / mol - константа на Фарадей; Е е еквивалентната маса на веществото, g / mol.
При електрохимични реакции се определя еквивалентната маса на веществото:
п - Броят на електроните, участващи в реакцията на електрода от образуването на това вещество.
II закон на Фарадей.При преминаване през различни електролити с едно и също количество електроенергия, масите от вещества, отделяни върху електродите, са пропорционални на техните еквивалентни маси:
където m 1 и m 2 - маси от вещества 1 и 2, E 1 и E 2, g / mol - еквивалентни маси от вещества 1 и 2.
На практика, често поради появата на конкурентни окислително-редукционни процеси, по електродите се образува по-малко вещество, отколкото съответства на електричеството, преминало през разтвора.
За да се характеризира загубата на електроенергия по време на електролиза, се въвежда понятието "токов изход". Текущ изход В tсе нарича процентното съотношение на действително полученото количество електролизиран продукт m факт. да теоретично изчислени m теория: 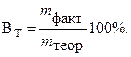
Пример 10, Какви процеси ще възникнат по време на електролизата на воден разтвор на натриев сулфат с въглероден анод? Какви вещества ще се отделят върху електродите, ако въглеродният електрод бъде заменен с меден?
решение: В разтвор на натриев сулфат в електродни процеси могат да участват натриеви йони Na \u200b\u200b+, SO 4 2- и водни молекули. Въглеродните електроди са инертни електроди.
Следните процеси на възстановяване са възможни на катода:
(-) K: Na + + ē
→ Na ![]()
2H20 + 2 ē
→ H 2 + 2 OH - ![]()
При катода първо протича реакцията с най-висока стойност на потенциала на електрода. Следователно възстановяването на водните молекули ще се случи на катода, придружено от отделянето на водород и образуването на хидроксидни йони ОН - в катодното пространство. Натриевите йони Na \u200b\u200b+, присъстващи на катода, заедно с OH йони ще образуват алкален разтвор на NaOH.
(+) А: 2 SO 4 2- - 2 ē
→ S 2 O 8 2- ![]()
2Н20 - 4 ē
→ 4Н + + 0 ![]() .
.
На анода реакцията с най-ниската стойност на потенциала на електрода протича първо. Следователно окисляването на водните молекули с отделянето на кислород ще се случи на анода, а Н + йони се натрупват в анодното пространство. SO4 2 - йони с Н + йони, присъстващи на анода, ще образуват разтвор на сярна киселина H 2 SO 4.
Общата реакция на електролиза се изразява с уравнението:
2 Na 2 SO 4 + 6H 2 O \u003d 2H 2 + 4 NaOH + O 2 + 2H 2 SO 4.
катодни продукти анодни продукти
При замяна на въглероден (инертен) анод с меден на анода, става възможна друга реакция на окисляване - разтваряне на мед:
Cu - 2 ē
→ Cu 2+ ![]()
Този процес се характеризира с по-ниска потенциална стойност от другите възможни анодни процеси. Следователно, по време на електролизата на Na2S04 с меден анод, на анода ще се извърши окисляване на медта и медно сулфат CuSO4 ще се натрупа в анодното пространство. Общата реакция на електролиза се изразява с уравнението:
Na2S04 + 2H2O + Cu \u003d H2 + 2 NaOH + CuSO4.
катодни продукти аноден продукт
Пример 11, Направете уравнение на процесите, протичащи по време на електролизата на воден разтвор на никелов хлорид NiCl2 с инертен анод.
решение: Никеловият хлорид Ni 2+, Cl - и водни молекули могат да участват в разтвор на никелов хлорид в електродни процеси. Като инертен анод може да се използва графитен електрод.
Следните реакции са възможни при катода:
(-) K: Ni 2+ + 2 ē
→ Ni ![]()
2H20 + 2 ē
→ H 2 + 2 OH - ![]()
Потенциалът на първата реакция е по-висок, следователно никелови йони се намаляват при катода.
Следните реакции са възможни на анода:
(+) A: 2 Cl - - 2 ē
→ Cl 2 ![]()
2H20 - 4 ē
0 2 + 4 Н + ![]() .
.
Според стойностите на стандартните електродни потенциали на анода
трябва да се отделя кислород. Всъщност, поради високото пренапрежение на кислорода, хлорът се отделя върху електрода. Величината на пренапрежението зависи от материала, от който е направен електрода. За графита пренапрежението на кислорода е 1,17 V при плътност на тока 1a / cm2, което увеличава окислителния потенциал на водата до 2,4 V.
Следователно, електролизата на разтвор на никелов хлорид протича с образуването на никел и хлор:
Ni2+ + 2Cl - \u003d Ni + Cl2.
при катода на анода
Пример 12, Изчислете масата на веществото и обема на газ, отделен върху инертните електроди по време на електролизата на воден разтвор на сребърен нитрат AgNO 3, ако времето на електролиза е 25 минути, а силата на тока е 3 A.
Решение. По време на електролизата на воден разтвор на AgNO 3 в случай на неразтворим анод (например графит), на електродите се появяват следните процеси:
(-) K: Ag + + ē
→ Ag ![]() ,
,
2H20 + 2 ē → H 2 + 2OH -.
Потенциалът на първата реакция е по-висок, поради което сребърните йони се намаляват при катода.
(+) A: 2H20 - 4 ē
0 2 + 4 Н + ![]() ,
,
анион NO 3 - не се окислява.
G или в литри ![]() л.
л.
задания
5. Запишете реакциите на електролиза върху инертните електроди и изчислете масата на веществото, получено в катода, и обемът на отделения газ на анода по време на електролиза на електролитни разтвори, ако времето на електролиза е 20 минути, токът аз\u003d 2A, ако текущият изход V t \u003d 100%. Какви вещества ще се отделят върху електродите при замяна на инертен анод с метален, посочен в задачата?
| №№ | електролит | Метален електрод |
| CuSO 4 | Cu | |
| MgCl2 | Ni | |
| Zn (NO 3) 2 | Zn | |
| Snf 2 | Sn | |
| CdSO 4 | CD | |
| FeCl 2 | Fe | |
| AgNO 3 | Ag | |
| HCl | Co | |
| COSO 4 | Co | |
| NiCl 2 | Ni |
Край на масата
Когато електролитните йони достигнат до електродите, свързани с полюсите на източник на постоянен ток, положителните йони получават липсващите електрони от отрицателния електрод и по време на реакцията на редукция се превръщат в неутрални атоми (молекули); отрицателните йони дават електрони на положителния електрод и по време на реакцията на окисляване се превръщат в неутрални атоми. Нарича се феноменът на отделяне на веществата върху електродите по време на окислително-възстановителната реакция по време на преминаването на тока през електролита чрез електролиза. Електролизата е наблюдавана за първи път през 1803 г. в Санкт Петербург - В. П. Петров. В годините 1833-1834г. Английският физик М. Фарадей открива законите на електролизата, които установяват от какво зависи масата на веществото, освободено по време на електролиза.
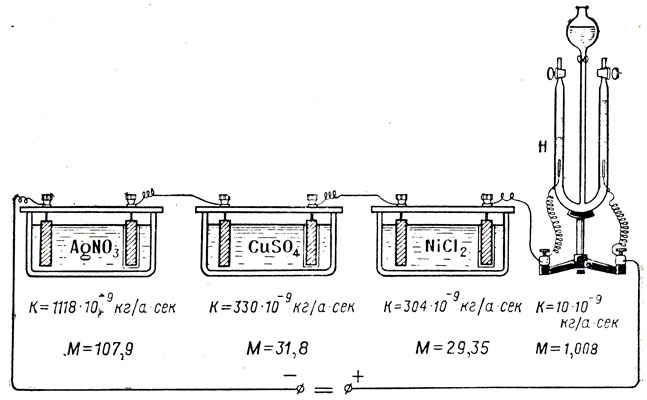
Пропускайки ток със същата сила през различни електролити за равни периоди от време, Фарадей установява, че върху електродите се отделят различни количества материя. И така, токът в 1 а за 1 сек излъчва от разтвор на сребърен нитрат 1,118 mg сребро, от разтвор на меден сулфат - 0,328 mg мед. Това означава, че масата на освободеното вещество по време на електролиза зависи от веществото. Скаларното количество, измервано от масата на веществото, освободено при електролиза чрез ток в1 аза1 сек, наречен електрохимичен еквивалент (посочено от к). Електрохимичният еквивалент има името кг / а * сек или кг / к.
Ако през разтвор на меден сулфат се пропуска малък ток за период от време t, тогава катодът е слабо покрит с мед и ако токът е с по-голяма якост, тогава едновременно на катода ще се отдели повече мед. Оставяме силата на тока същата, но сега увеличаваме времето. Забелязваме, че медта се отделя още повече. Преминавайки различни токове през различни електролити и внимателно измервайки масата на веществото, освободено върху електродите от всеки електролит, Фарадей открива първия закон на електролизата: масата на веществото, освободено по време на електролиза върху електродите, е пряко пропорционално на произведението на силата на тока и времето, преминало през електролита.
Текущи в 1 а по време на 1 s по време на електролиза той излъчва на електрода k kg вещество и тока със сила Аз а след време t сек - в то пъти повече:
m \u003d klt, или m \u003d kq.
Това са формулите на първия закон за електролиза на Фарадей.
Всеки йон носи със себе си определена маса от вещество и заряд, следователно колкото повече йони се приближават до електрода, тоест колкото по-силен е токът в електролита, толкова повече вещества се отделят върху електрода.
Фарадей, преминавайки един и същ ток последователно през няколко различни електролити, забеляза, че масата на веществото, отделено върху електродите, не е еднаква, въпреки че силата на тока и времето, преминаващо през различните електролити, са еднакви (фиг. 109). Прецизно претегляйки освободените вещества, Фарадей забеляза, че теглото им не е случайно, а по-скоро зависи от химическата природа на веществото. За всеки грам отделен водород винаги се оказа 107,9 g сребро; 31,8 g мед; 29,35 g никел. След въвеждането на химическия еквивалент - съотношението на атомната маса (тегло) и валентност - се оказа, че тези числа са химически еквиваленти на тези вещества. Тъй като атомната маса A и валентността n са абстрактни числа, съотношението на числото е абстрактно.
Чрез разделяне на електрохимичните еквиваленти на веществата на техните химически еквиваленти, (k / M)получаваме:
т.е. същото число 1036 * 10 -11 кг / а * сек или 1036 * 10 -11 кг / к. Означавайки това постоянно число с буквата С, пишем: С \u003d 1036 * 10 -11 кг / а * сек, Следователно и електрохимичният еквивалент
k \u003d CM.
Това е формулата на втория закон на Фарадей за електролиза, който гласи следното: електрохимичните еквиваленти на веществата са пряко пропорционални на техните химически еквиваленти.
Заменяйки електрохимичния еквивалент във формулата на първия закон на Фарадей, получаваме формулата за обобщения закон на Фарадей за електролиза:
![]()
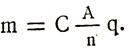
Масите от вещества, освободени по време на електролиза, са пряко пропорционални на атомните им тегла и заряда, преминаващ през електролита, и обратно пропорционални на валентността на веществото.
Законите на Фарадей са следствие от йонната проводимост на тока в електролита. Нека обясним това с такива примери. Нека приемем, че електролизата на едновалентни вещества е извършена, например, разтвори на NaCl и AgNO 3. Зарядите на Na и Ag йони са еднакви. Когато йони прехвърлят заряди с еднаква величина, както в това, така и в друго решение, същият брой йони ще пасне на съответните електроди. Но при равен брой подходящи йони, масите на отложените вещества Na и Ag няма да са еднакви, тъй като самите маси на Na и Ag атомите са различни. Натрият има атомна маса 22.997; сребро - 107,88; следователно, почти пет пъти повече сребро ще бъде пуснато. Това означава, че количеството вещество, отделено по време на електролиза, е пряко пропорционално на атомната му маса, което се потвърждава от закона на Фарадей.
В случая, когато йони с различна валентност участват в електролизата, например, Al с валентност 3 и Na с валентност 1, броят на Al и Na йони, носещи един и същ заряд, ще бъде различен. Колкото по-голяма е валентността на един йон, т.е., колкото по-голям е неговият заряд, толкова по-малко йони ще са необходими за прехвърлянето на този заряд (например, Al йони се нуждаят три пъти по-малко от Na йони). Такава връзка между валентността и заряда на йона се обяснява с факта, че масата на вещество, освободено по време на електролиза, е обратно пропорционално на неговата валентност.
Поради простотата, евтиността и високата чистота на получените продукти, електролизата е широко използвана в промишлеността за извличане на алуминий от бокситни руди, пречистване на метали (например мед, цинк, злато, сребро) от примеси, покриване на метални предмети със слой от друг метал, за да се предпази от ръжда. твърдост на повърхността им (никелиране, хромиране), за производство на бижута (сребро, позлатяване), получаване на метални копия от релефни предмети (например при производството на грамофонни плочи смрад, матрици, клишета).
Задача 30. Олово с висока чистота, използвано в ядрената енергия, се получава чрез електропречистване. Изчислете масата на оловото, разпределено за 1 час плътност на тока 0,02 a / cm 2 и напрежение 0,5 инча Текущата ефективност е 95%. Каква е консумацията на енергия за разпределението 1 кг да доведе? Общата площ на напречното сечение на катодите, върху които се отлага оловото, 10 м 2.

Когато ефективността на електролитната баня е 100% поради цялата консумирана електроенергия A \u003d UIt оловото би се откроило m \u003d kltследователно при подбор 1 кг консумираната олово енергия ![]() или
или
Ние изчисляваме
Отг:. M ≈ 7,5 кг; A 1 ≈ 470 kJ / kg.
Първият закон на Фарадей:
Масата на веществото, отделено върху електродите, е пряко пропорционално на количеството електричество, преминало през разтвора
Вторият закон на Фарадей:
При преминаване през стопилка или разтвор на електролит 96500 Cl електричество, 1 мол от еквивалента на вещество се отделя върху електродите.
Електрохимичният еквивалент на вещество.
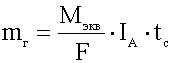 - комбинираното право на Фарадей.
- комбинираното право на Фарадей.
Електролиза поляризация
Поляризацията по време на електролиза се състои от действителната поляризация, която се разделя на химична и концентрационна и свръхнапрежение.
Химическа поляризация
Ent п-ия соларизация възниква, когато се използват инертни електроди.
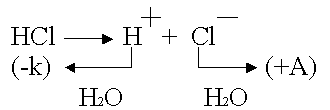 .
.
Каквито и да са инертните електроди (Pt, C, керамика), всички те адсорбират газовете много добре.
Платина - анодът е наситен с хлор; платина - катодът абсорбира водород.
Хлорът може да се намали само, водородът може да се окисли:
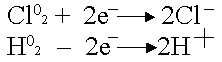 .
.
В електролизатора се образува галванична клетка:
.
Електромотивната сила на получената галванична клетка е насочена срещу външно напрежение и я отслабва.
Този тип поляризация се нарича химическа поради причината, че електродите изглежда променят своята химическа природа.
Поляризацията играе отрицателна роля, тъй като води до прекомерна консумация на електроенергия.
Химическата поляризация се бори химически. Вещества, които почистват електродите на абсорбираните газове, се добавят към разтвора.
Поляризация на концентрацията
Тази поляризация се случва с активния анод, например сребро
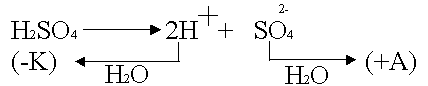
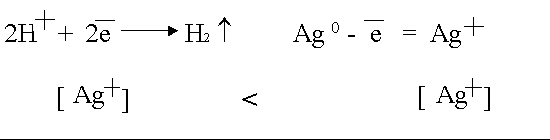 .
.
Поради дифузия сребърните йони от анода са склонни към катода, където те ще започнат да се възстановяват като по-силни окислители.
Тъй като дифузията в течностите е бавна, концентрацията на Ag йони в анодното пространство е много по-висока, отколкото в катода.
В резултат на това в електролизатора възниква концентрационна галванична клетка.
ЕМП на получения концентрационен елемент също е насочен срещу външно напрежение и го отслабва.
Много по-лесно е да се справим с поляризацията на концентрацията, отколкото с химическата поляризация. Елиминира се чрез разбъркване на разтвора.
Електродно пренапрежение
Пренапрежението на електрода е разликата между действителния и теоретичния потенциал на електрода.
Свръхнатоварването на металите е толкова малко, че се пренебрегва. Пренапрежението на водород и кислород е голямо.
Водородното пренапрежение е високо при следните условия:
- ниска плътност на тока
- ниски температури на разтвора.
Пренапрежението също зависи от материала на катода.
Водородното пренапрежение е най-голямо за онези метали, които са разположени близо до водорода в серия от напрежения.
Водородното пренапрежение може да играе както отрицателна, така и положителна роля.
Той играе отрицателна роля, ако е необходимо да се получи водород електролитно.
Положителната роля на пренапрежението, ако е необходимо, се получава чрез електролиза на всеки метал в серията от напрежения до водород.
Възможно е да се създадат условия (плътност на тока, температура на разтвора, катоден материал, чужди йони в разтвора), при които поради високото пренапрежение на водорода от металите е възможно да се възстановят металите в реда на напрежението към водорода (до алуминия).
Тези закони определят съотношението между масата на продукта, образуван върху електрода, и количеството електричество (електрически заряд), преминало през електролита.
Първият закон на Фарадей гласи, че масата на веществото, образувано върху електрода, е пропорционално на количеството предавано електричество. Количествена мярка за електрически заряд е единицата на фарадей. Фарадей е заряд, който носи един мол електрони или един мол еднозарядни йони.
Спомнете си, че числото е число Avogadro (вижте раздел 4.2).
Изпускането на сребърни йони в катода по време на електролизата на разтвор на сребърен нитрат се описва от уравнението на полуреакцията
![]()
Следователно електрически заряд от 1 Фарадей (един мол електрони) освобождава 1 мол сребърни йони, в резултат на което се образува 1 мол сребърни атоми. Това означава, че преминаването на заряд от 2 фарадея води до образуването на 2 мола сребърни атоми, преминаването на 3 зарядна фарада ще доведе до образуването на 3 мола сребърни атоми и т.н.
Вторият закон на Фарадей гласи, че за отделянето на един мол от всеки йон върху електрода е необходимо да се премине през електролита такъв брой фаради заряд, който е равен на броя на елементарните заряди на този йон.
Мол от 2 мола от 1 мол По този начин, за да се освободи един мол йони в катода, е необходимо да се премине 2 фарада за зареждане (2 мола електрони) през него.
Молец 3 мол I мол
За да се освободи един мол алуминиеви йони в катода, е необходимо да се премине през 3 фарада заряд (3 мола електрони) през него.
Молец 1 мол 2 мол
За да се получи един мол молекули бром в резултат на изхвърлянето на два мола бромни йони на анода, е необходимо да се премине 2 фарада заряд през него. Следователно, за отделянето на един мол бромни йони е необходим един заряд на фарадей.
Фарадей не можеше да получи систематично образование в детска възраст. На 14-годишна възраст той става асистент на книгозавър. Но скоро той се заинтересува от науката и след като изслуша лекция на известния химик Хъмфри Дейви, му пише и изпраща бележките си към лекцията. Дейви го заведе като асистент в лабораторията му в Кралския институт в Лондон. Тогава Фарадей беше на 21 години.

Майкъл Фарадей изнася коледна лекция в Кралския институт (Лондон, 1955 г.) в присъствието на членове на кралското семейство: срещу него в първия ред е съпругът на кралицата, отляво е принцът на Уелс (впоследствие Едуард VII), отдясно е херцогът на Единбург.
В следващите години Фарадей откри два нови въглеродни хлорида. Той също успя да постави хлор и други газове в течно състояние. През 1825 г. той успява да изолира бензола и през същата година е назначен за ръководител на лабораторията. В продължение на няколко години той се занимава с експериментално изследване на електролиза и в крайна сметка формулира през 1834 г. своите известни закони на електролиза. По това време той вече беше открил феномена на електромагнитната индукция.
Фарадей става президент на Кралското общество и пише няколко книги, включително „Експериментални изследвания в областта на химията и физиката“ (1858 г.). През 1855 г. поради увреждане на паметта той е принуден да спре изследователската работа. През 1867 г. Фарадей умира.
