|
ОПРЕДЕЛЯНЕ НА ОСНОВНАТА СТРУКТУРА НА ПРОТЕЙНА |
Определянето на първичната структура на протеина ще изисква предварителна серия от операции. Протеинът трябва да бъде добре почистен, чистотата на материала трябва да бъде потвърдена с най-малко два независими метода. Най-често използваната полиакриламидна гел електрофореза (PAGE) и ултрацентрофугиране, След пречистване на протеин, той се разделя на две до три или повече части. Всяка част се третира с различни протеазни ензими (трипсин, химотрипсин) или реагенти (бром циан, iodosobenzoic киселина). Резултатът е два до три (или повече) набора от полипептиди (протеинови сегменти). Специални изисквания за чистота са наложени на протеиназните ензими, в противен случай последващото определяне на последователността на редуване на сегменти от пептиди в нативната протеинова верига ще бъде трудно. От особена трудност е разпознаването на местата на дисулфидни мостове между цистеиновите остатъци. Получената смес от пептиди се отделя чрез електрофореза, след което е възможно да се започне директно процедурата за секвениране. Дължината на един пептид не трябва да надвишава 40 AK остатъци.
Най-често използваният метод за секвениране на пептиди (установяване на последователността на АК остатъци в тях) е процедурата на P. Edman, като се използва фенил изотиоцианат (FITC). Процедурата е в основата на работата на автоматични секвенъри. Проба от пречистения пептид се прилага върху повърхността на реакционния съд под формата на филм. Често пептидът е ковалентно зашит от края на свободната COOH група с повърхностния материал на реакционния съд. След това повторете циклите от поредица от реакции. Една серия от реакции включва:
- взаимодействието на FITC с крайния АК остатък, който има свободна NH2 група, така наречената FTK- ( feniltiokarbamoil) -производни:
- излишъкът от FITC се отстранява, рН на средата се променя чрез добавяне хептафлуоробутиринова киселина, с превръщането на FTK във FTG ( feniltiogidantoin) -производни:
- FTG производното на аминокиселината се отстранява от реакционната среда чрез екстракция с 1-хлоробутан и серията реакции се повтаря в следващия цикъл.
В един цикъл един аминокиселинен остатък се отстранява от NH2 ръба на пептида. Тъй като реакциите с FITC не протичат количествено, но в най-добрия случай с 95 процента, интерфериращите фактори постепенно се натрупват - производни на FTG от остатъци от АК, които не реагират на предишни цикли. В най-благоприятните случаи е възможно надеждно да се идентифицира последователността от само около 40 АК остатъци. Поради автоматизацията на процеса работата все още значително се улеснява.
ТЪЛКУВАНЕ С ПЕПТИДАЗИ:
а) от остатъците от N-терминала, използващи AMINOPEPTIDASES ( хроматографско идентификация и кинетика на натрупване на съответните АК.
б) от С-краищата с karboksipeptidaz (По същия начин).
ХИДРАЗИНОЛИЗА (в безводна среда при 100 градуса С), с изключение на последния остатък със свободен СООН, всички се превръщат в кисели хидразиди:
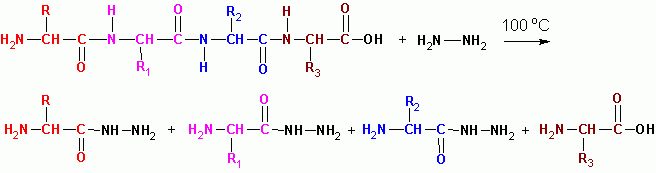
Последователността на пептидите в протеиновите молекули се определя от припокриващи се фрагменти от пептиди:
G-W-V-R А-О-V-K C-E-C-D триптични пептиди (трипсин)
G-W V-R-A-O V-K-C-E-C-D himotripticheskie пептиди (химотрипсин)
ПРЕПОРЪЧИТЕЛНА ЛИТЕРАТУРА:
1. Строев Е.А. Биологична химия. М., 1986.
2. Striyer L. Biochemistry, в 3 тома М., Мир, 1984.
3. Уайт, Хендлер, Смит и др. Основи на биохимията, в 3 т. М., Мир, 1981.
4. Овчинников Ю.А. Биоорганична химия, М., Просвещение, 1987.
5. Анисимов и др. Основи на биохимията. М., гимназия, 1986г.
Една от особеностите на протеините е тяхната сложна структурна организация. Всички протеини имат първична, вторична и третична структура, а тези, които имат два или повече НРС в състава си, също имат кватернерна структура (ES).
Първична протеинова структура (PSB) – това е редът на редуване (последователността) на аминокиселинните остатъци в PPC.
Дори протеините с еднаква дължина и аминокиселинен състав могат да бъдат различни вещества. Например, два различни дипептида могат да бъдат съставени от две аминокиселини:
При броя на аминокиселините, равен на 20, броят на възможните комбинации е 2-10 18. И ако вземете предвид, че в PPC всяка аминокиселина може да се появи повече от 1 път, тогава броят на възможните опции е трудно да се изчисли.
Определяне на първичната структура на протеина (PSB).
PSB протеините могат да бъдат определени чрез използване feniltiogidantoinovogo
метод
, Този метод се основава на реакцията на взаимодействие. фенил изотиоцианат
(FITZ) с α-AK. Резултатът е комплекс от тези две съединения - FITC -ав
.
Например, помислете за пептид ![]() за да се определи неговата PSB, тоест последователността на свързването на аминокиселинни остатъци.
за да се определи неговата PSB, тоест последователността на свързването на аминокиселинни остатъци.
FITC взаимодейства с крайната аминокиселина (a). Комплексът се формира PTH-а, тя се отделя от сместа и се определя автентичността на аминокиселината и, Например, това е - aSN
![]() и т.н. Всички други аминокиселини са последователно разделени и идентифицирани. Това отнема много време процес. Определянето на средно голям PSB протеин отнема няколко месеца.
и т.н. Всички други аминокиселини са последователно разделени и идентифицирани. Това отнема много време процес. Определянето на средно голям PSB протеин отнема няколко месеца.
Приоритетът при декодиране на PSB принадлежи Sendzheru (1953), който откри инсулиновия PSB (лауреат на Нобелова награда). Молекулата на инсулина се състои от 2 НРС - А и В.
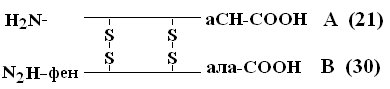
А веригата се състои от 21 аминокиселини, верига В - от 30. Между тях ППС са свързани чрез дисулфидни мостове. Броят на протеините, чийто PSB вече е определен, достига 1500. Дори и малки промени в първичната структура могат значително да променят свойствата на протеина. Червените кръвни клетки на здрави хора съдържат HbA - при смяна в цепи-веригата на HbA, на 6-та позиция glu за вал възниква сериозно заболяване сърповидноклетъчна анемияпри която децата, родени с тази аномалия, умират в ранна възраст. От друга страна са възможни вариации в PSB, които не влияят на неговите физико-химични и биологични свойства. Например, HbC съдържа в 6-та позиция на b веригата вместо глюкоза, HbC почти не се различава по свойствата си от HbA и хората, които имат такъв Hb в червените кръвни клетки, са практически здрави.
PSB стабилност осигурени главно от силни ковалентни пептидни връзки и, второ, от дисулфидни връзки.
Вторичната структура на протеина (VSB).
PPV протеините имат голяма гъвкавост и придобиват определена пространствена структура или структура, В протеините се разграничават 2 нива на такава конформация - това са VSB и третична структура (TSB).
FAB – това е конфигурацията на PPC, тоест начинът, по който е положен или усукан в някакъв вид конформация, в съответствие с програмата вСб
Известни са три основни типа VSD.:
1) спирала;
2) б-структура (сгънат слой или сгънат лист);
3) объркан плетеница.
спирала .
Моделът й е предложен от У. Полинг. Най-вероятно е за глобуларни протеини. За всяка система най-стабилното е състоянието, съответстващо на минималната свободна енергия. При пептидите това състояние възниква, когато CO– и NH– групите се съединят чрез слаба водородна връзка. Най- а спирала NH- групите от първия аминокиселинен остатък взаимодействат с СО - групата на 4-та аминокиселина. В резултат на това пептидният гръбнак образува спирала, за всяко завъртане на която падат 3.6 АА остатъци.
1 стъпка на спирала (1 оборот) \u003d 3,6 AK \u003d 0,54 nm, ъгъл на издигане - 26 °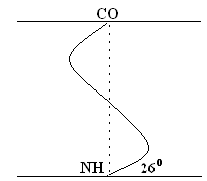
Завиването на НПК става по посока на часовниковата стрелка, тоест спиралата има правилния ход. На всеки 5 завъртания (18 AK; 2.7 nm) конфигурацията на PPC се повтаря.
Стабилизира се FAB предимно водородни връзки и второ, пептидни и дисулфидни връзки. Водородните връзки са 10-100 пъти по-слаби от обикновените химически връзки; поради големия им брой те осигуряват известна твърдост и компактност на VSB. Страничните R-вериги на a-спиралата са обърнати навън и са разположени на различни страни от оста си.
б -структура .
Това са сгънатите участъци на НПК, наподобяващи листо, сгънато в акордеон. PPC слоевете могат да бъдат успоредни, ако и двете вериги започват в N - или C - края.
Ако съседни вериги в слой са ориентирани от противоположни краища N - С и С - N, тогава те се наричат антипаралелен.
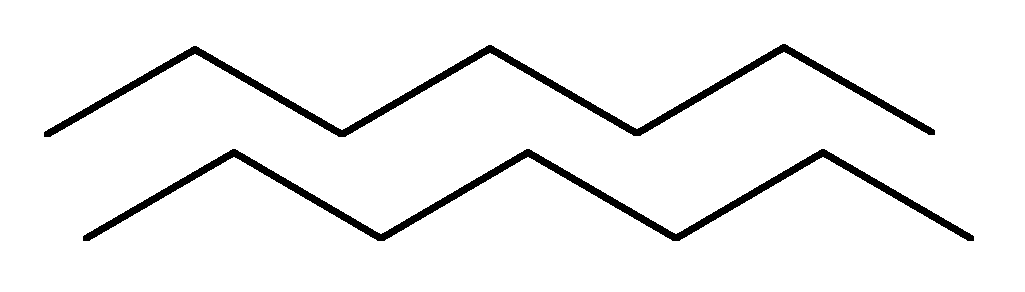 паралелен
паралелен
антипаралелен
Образуването на водородни връзки става, както в а-спиралата, между CO- и NH- групите.
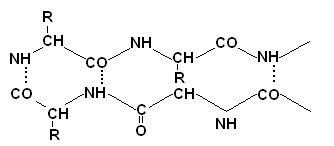
Определяне на първичната структура на протеините
Определянето на първичната структура се предхожда от денатурация и разрушаване на напречни дисулфидни връзки в протеина. Това се постига чрез излишък на меркаптоетанол.
Цистинът се превръща в два цистеинови остатъка, които след това се блокират с излишък от йодооцетна киселина, за да се предотврати обратното образуване на S-S-връзки.
Разцепването на полипептидната верига на фрагменти обикновено се извършва с помощта на протеолитични ензими, като трипсин, химотрипсин или пепсин. Тези ензими действат върху различни части на полипептидната верига, тъй като имат повишен афинитет към различни аминокиселинни остатъци. Необходими аминокиселинни остатъци, т.е. пространствена среда на атакуваната пептидна връзка. Оказа се, че трипсинът хидролизира само онези пептидни връзки, в образуването на които участва карбоксилната група лизин или аргинин, а химотрипсинът хидролизира връзките според фенилаланин, триптофан и тирозин. Обикновено протеолитичните ензими, които хидролизират полипептидните вериги, се обездвижват предварително върху неразтворими матрици, за да се отделят по-лесно от продуктите на хидролизата. След това се определят аминокиселинните последователности на всеки полипептиден фрагмент. За това най-често се използва методът на Едман, който се състои в анализа на полипептид само от N-края. Крайната аминокиселина, когато взаимодейства с фенилизотиоцианат в алкална среда, образува стабилно съединение, което може да бъде отцепено от полипептида без разграждане. Производното на фенилтиохидантоин (FTG) на аминокиселина се идентифицира чрез хроматографски метод.
След идентифициране на крайния N-аминокиселинен остатък, етикетът се въвежда в следващия аминокиселинен остатък, който става терминал. Методът на Едман може да бъде автоматизиран с помощта на секвенсор (от англ. секвестис -последователност), чрез която производни на FTG се отцепват от полипептида и се идентифицират чрез високоефективна течна хроматография.
Ф. Сангер за първи път напълно дешифрира първичната структура на протеиновия хормон инсулин, използвайки метода на Edman.
Друг силно чувствителен метод е така нареченият дансилов метод, свързан с добавянето на данзилхлорид (1-диметиламино-нафтален-5-сулфонил хлорид) към крайната аминокиселина съгласно следната схема:
Първичната структура на протеина може да се установи индиректно, както следва: първо се получава съответната кДНК. След това се идентифицира клонинът, свързан с анализирания протеин, и първичната структура на протеина се определя от редуването на нуклеотиди в него, като се използва библиотека от аминокиселинни последователности.
Определяне на вторичната структура на протеините
Оптичните методи се използват главно за определяне на вторичната структура на протеините. Разбира се, методът на рентгенова дифракция е по-надежден, но прилагането му е изпълнено с определени трудности и изисква значително време. Оптичните методи като дисперсия на оптичното въртене и кръгов дихроизъм са по-прости и, което е важно, могат да определят промените във вторичната структура на протеина в разтворите. С помощта на дисперсията на оптичното въртене може да се получи информация за степента на хеличност на протеинова макромолекула. Въпреки факта, че методът е приблизителен, спирално-спиралните преходи са доста ясно видими. Що се отнася до метода на кръговия дихроизъм, неговият спектър се определя от множеството ъгли w и q, характерни за един или друг вид вторична структура. И двата метода могат да се разглеждат като скрининг и за пълна идентификация на вторичната структура те трябва да се комбинират с рентгенов анализ на протеини.
Протеините са органични съединения с високо молекулно тегло, мономерни единици, които са α-аминокиселини, свързани помежду си с пептидна връзка. класификация:
- под формата на молекули (кълбовидни или фибриларни); Фибриларни протеини, Полипептидните вериги са успоредни една на друга, удължените вериги образуват дълги нишки или слоеве. Те служат като основен органичен материал на съединителната тъкан и са структурен компонент на мускулните влакна. Например колаген, еластин. Глобуларни протеини, Полипептидните вериги са плътно сгънати в компактни сферични структури (глобули). Те са водоразтворими. Например ензими.
- по молекулно тегло (ниско молекулно тегло, високо молекулно тегло и др.);
- химична структура (наличие или отсъствие на небелтъчна част);
- относно изпълняваните функции (транспортни, защитни, структурни протеини и др.);
- чрез локализация в клетката (ядрена, цитоплазмена, лизозомална и др.);
- чрез локализация в организма (кръвни протеини, черен дроб, сърце и др.);
Първична протеинова структура Представлява последователност от аминокиселинни остатъци в полипептидна верига на молекула, свързана с пептидни връзки.
Пептидната връзка се характеризира със следните свойства:
1) О и Н атомите на пептидната връзка са преориентирани;
2) четири атома на пептидната връзка лежат в една и съща равнина, т.е. пептидните връзки се характеризират с копланарност;
3) пептидната връзка в протеиновата молекула проявява кето-енолова тавтомеризация;
4) дължината на C-N връзка, равна на 0,13 nm, има междинна стойност между дължината на двойната ковалентна връзка (0,12 nm) и единичната ковалентна връзка (0,15 nm), което означава, че въртенето около оста C-N е трудно;
5) пептидната връзка е по-силна от обичайната ковалентна връзка, защото тя е една и половина (поради преразпределението на електронната плътност).
За всеки отделен протеин аминокиселинната последователност в полипептидната верига е уникална. Той е генетично обусловен и от своя страна определя по-високи нива на организация на даден протеин.
Аминокиселинният остатък, разположен в края на веригата, където има свободна аминогрупа, се нарича амино терминал, или N-терминал, а остатъкът от другия край, носещ свободната карбоксилна група, се нарича карбокси-терминал или С-терминал. Името на полипептида започва от N-края.
Фрагментация на полипептидни вериги
химотрипсин разцепва пептидни връзки, образувани от карбокси групи от ароматен АА
T ripsinразцепва пептидни връзки, образувани от АА, съдържащи две амино групи (лизин, аргинин)
Бромоцианът (CNBr) разцепва пептидни връзки, образувани между карбоксилната група на метионина и амино групата на всеки друг АК.
Хидроксиламин (NH2OH), разцепва пептидни връзки, образувани между остатъците от аспарагинова киселина и глицин
N-бромосукцинамидът разцепва пептидните връзки, образувани между карбоксилната група на триптофана и амино групата на всеки друг АК).
Sekvinatory - автоматични устройства, които позволяват използването на метода на Edman (реакция на полипептиди с фенилизотиоциацианат) за изследване на първичната структура на пептидите, съдържащи до няколко десетки аминокиселинни остатъци.
Метод на фенилтиохидантоин Метод за определяне на първичната структура на протеин. Въз основа на взаимодействието на фенилизотиоцинат с N-краен АК. Същността на метода е да се обработи изследвания пептид със специфичен набор от реагенти, което води до елиминиране на една аминокиселина от N-края на последователността. Цикличното повторение на реакцията и анализът на реакционните продукти дават информация за последователността на аминокиселините в пептида.
Методи за изследване на структурата на протеините
Пълна хидролиза в алкални или киселинни условия.
Киселинната хидролиза се провежда за 24 часа при t \u003d 110 6-NHCl. Продуктите от хидролизата се разделят чрез йонообменна хроматография (на колона) със сулфониран полистирен. Фракциониране на аминокиселина: с помощта на нинхидрон количеството на аминокиселината се определя от цвета. След това всяка аминокиселина се промива и фотометрично се определя. По този начин могат да бъдат идентифицирани леки аминокиселини (пръстови отпечатъци). Ако има малко количество протеин 10 -9, тогава се използва флуорескамин реагент.
Определяне на аминокиселинната последователност.
Уверете се, че веригата е една.
1.Сенгер метод:обективирано. един АК с N-край
Може да се използва данзилхлорид
(както и в предишния район само за хлор)
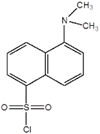
2. Методът на Едман - ви позволява да определите десетки аминокиселини от N-края
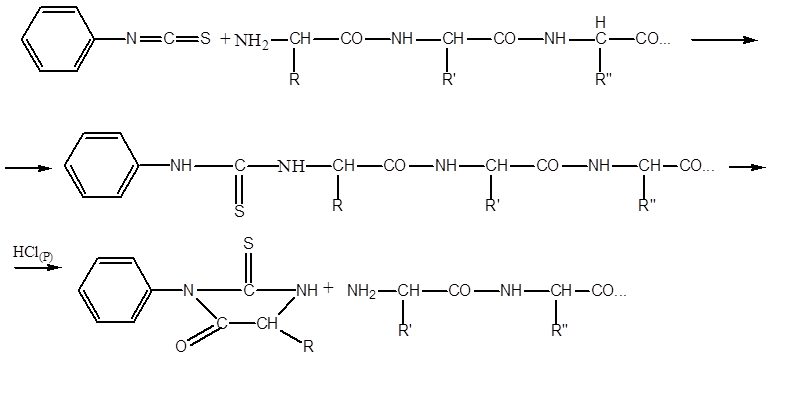
Едман проектира секвенсора. протеинът се поставя като тънък филм във въртящ се цилиндър. съдът, където се подлага на разцепване Дешифрирани 60 аминокиселини от N-края на миоглобина на кита.
3. Определение на 1-ва аминокиселина от края на хидразин.
4. Карбоксипептидазният ензим може да бъде последователно разцепван в 1-ва аминокиселина от С-края.Използва се за определяне на малки полипептиди (до 100)
Ако са повече от 100.
Trepsin- разцепва пептидни връзки, образувани със С-края на основни аминокиселини - лизин и аргенин.
Hemotrepsin- разцепва пептидната връзка от края на ароматните и дикарбоксилните киселини.
Разделени хроматографски, започват да определят. Отново вземете част от полипептида. Разцепва се по друг начин, използвайки химически реагент, използвайте цианоген бромид - разцепване от С-края на метиламин. Вижте, се припокриват секции, които се припокриват.
хидроксиламин–NH 2 OH- разцепва връзката аспарагин-глицин.
2-нитро-5-тиоцианобензоат - разцепва се където аминогрупата цистоин.
1953 г. - инсулинът е най-първата последователност. Имуноглобулинът (4 полипептидни вериги) е най-големият 1300 аминокиселинни остатъци.
В протеините могат да се определят всички аминокиселини.
Метод за пръстови отпечатъци
Бромчиан разцепва метиамин от С-края (90%НСООН)
Последователно е необходимо за:
1) За идентифициране на молекулната основа на биола. дейност.
2) Как първичната структура засяга втората, третичната и четвъртичната.
3) Промяна в последователността може да доведе до заболяване (наследствено).
4) Данните за протеиновата последователност могат да кажат много за еволюцията.
2 РНК
РНК- H 3 PO 4; рибоза; аденин; гуанин; цитозин; урацил
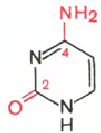
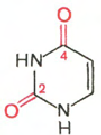
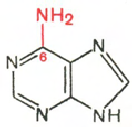
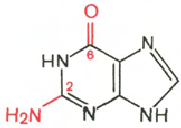
Cytosine Uracil Adenine Guanine
Въглехидратите (рибоза и дезоксирибоза) в молекулите на ДНК и РНК са в β-D-рибофураноза форма:
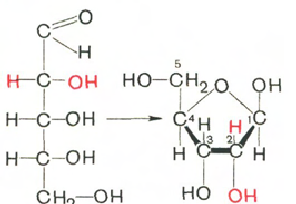
D-рибоза β-D-рибофураноза
Няма точни данни за количеството на РНК, тъй като съдържанието му в различни клетки до голяма степен се определя от интензивността на синтеза на протеини. РНК представлява около 5-10% от общата клетъчна маса. Настоящата класификация на различни видове клетъчна РНК се основава на данни от топография, функция и молекулно тегло. Различават се три основни типа РНК: матрична (информационна) - тРНК, която представлява 2-3% от цялата клетъчна РНК; рибозомална - рРНК, съдържаща 80–85% и транспортна - тРНК, което е около 16%. Тези 3 вида се различават по нуклеотиден състав и функции.
Матрична РНК образувани по време на транскрипцията. Той носи точно копие на генетичната информация, кодирана в определен раздел на ДНК, а именно за последователността на аминокиселините в протеините.
Матричната РНК (тРНК) се синтезира в ядрото върху ДНК матрица, след което влиза в рибозомата, изпълнявайки матрична функция в синтеза на протеини. При навлизане от ядрото в цитоплазмата, тРНК образува комплекси със специфични РНК-свързващи протеини - така наречените информозоми, способни на обратима дисоциация. Информозомите се считат за транспортна форма на тРНК, която насърчава образуването на полирибозоми в цитоплазмата.
Транспортна РНК
(tRNA) имат малко молекулно тегло и се съдържат в разтворимата фракция на цитоплазмата, изпълнявайки функцията за пренасяне на аминокиселини към мястото на синтеза на протеини - рибозомата. Молекулата на tRNA представлява единична полинуклеотидна верига, усукана "върху себе си". Всички tRNA са изградени по един план, всички те се вписват в модела на листата на детелината. Основният принцип е образуването на максимален брой водородни връзки между азотни основи. Листата на детелината съдържа пет спираловидни стъбла, четири от които завършват на бримки от неспарени нуклеитиди. В центъра на молекулата е непокрита област. 3 'и 5' - краищата на полинуклеотидната верига са сдвоени, за да образуват приемащо стъбло. Издържа на приемащо стъбло против кодон. Той носи антикодонов контур, който се състои от 7 нуклеотида. Антикодоновият контур съдържа в средната си част антикодон, състоящ се от 3 нуклеотида, допълващи кодона на дадена аминокиселина в тРНК. Псевдоуридиновият контур, носен от Т-ствола, съдържа второстепенния псевдоуридин. Състои се от 7 нуклеотидни остатъка. Смята се, че именно с този цикъл тРНК взаимодейства с рибозомата. D - стъблото носи контур от 8-12 нуклеотида. Това е цикъл на дихидроуридин, той винаги съдържа няколко остатъка от второстепенния компонент на дихидроуридин. 
Рибосомална РНК - основата, на която са разположени протеините, образувайки рибозома. Рибозомите са локализирани главно в цитоплазмата, в допълнение, в ядрото на митохондриите и хлоропластите. Нуклеотидният състав е подобен: преобладават гуаниловите нуклеотиди, уридиловият и цитидиловият са в малки количества, няма незначителни основи. По размер и молекулно тегло рибозомите се делят:
Бактериални рибозоми (сравнително малко). Константа на утаяване 70S.
Рибозоми на еукариотни клетки. Константа на утаяване 80S.
Рибозоми на митохондриите и хлоропластите.
При хидролизата на РНК образуват се рибоза, аденин, гуанин, урацил, цитозин, фосфорна киселина.
