|
STANOVENIE ŠTRUKTÚRY PRIMÁRNEHO PROTEÍNU |
Určenie primárnej štruktúry proteínu bude vyžadovať predbežnú sériu operácií. Proteín sa musí dôkladne vyčistiť, čistota materiálu sa musí potvrdiť najmenej dvoma nezávislými metódami. Najčastejšie používaná elektroforéza na polyakrylamidovom géli (PAGE) a ultra-odstreďovaním, Po purifikácii proteínu sa rozdelí na dve až tri alebo viac častí. Každá časť je ošetrená rôznymi proteázovými enzýmami (trypsín, chymotrypsín) alebo činidlami (brómkyán, iodosobenzoic kyselina). Výsledkom sú dve až tri (alebo viac) sady polypeptidov (proteínové segmenty). Na proteázové enzýmy sa kladú špeciálne požiadavky na čistotu, inak bude ťažké stanoviť postupnosť striedania segmentov peptidov v natívnom proteínovom reťazci. Obzvlášť ťažké je rozpoznávanie miest disulfidových mostíkov medzi cysteínovými zvyškami. Výsledná zmes peptidov sa separuje elektroforézou, po ktorej je možné zahájiť postup sekvenovania priamo. Dĺžka jedného peptidu by nemala prekročiť 40 AK zvyškov.
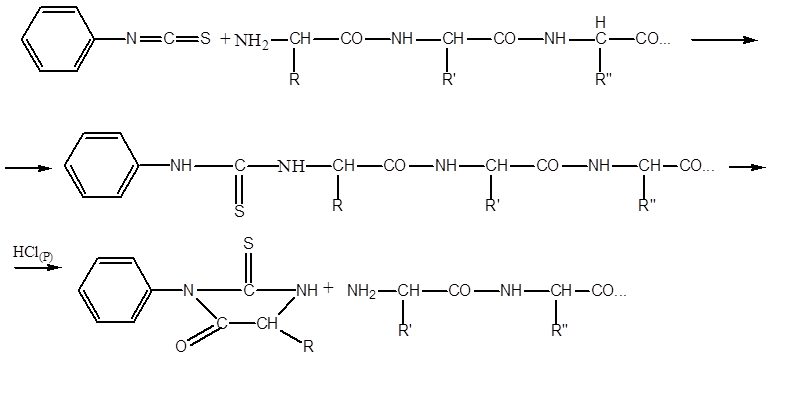
Najbežnejšie používanou metódou na sekvenovanie peptidov (stanovenie sekvencie AK zvyškov v nich) je postup P. Edmana, ktorý používa fenylisothiokyanátu (FITC). Postup spočíva v činnosti automatických sekvencerov. Vzorka purifikovaného peptidu sa aplikuje na povrch reakčnej nádoby vo forme filmu. Peptid sa často kovalentne zošíva z konca voľnej skupiny COOH s povrchovým materiálom reakčnej nádoby. Potom zopakujte cykly zo série reakcií. Jedna séria reakcií zahŕňa:
- interakcia FITC s koncovým AK zvyškom, ktorý má voľnú skupinu NH2, tzv. FTK- ( feniltiokarbamoil) -derivatívne:
- prebytok FITC sa odstráni, pH média sa zmení pridaním heptafluor kyselina, s konverziou FTK na FTG ( feniltiogidantoin) -derivatívne:
- Derivát FTG aminokyseliny sa z reakčného média odstráni extrakciou 1-chlórbutánom a séria reakcií sa opakuje v nasledujúcom cykle.
V jednom cykle sa jeden aminokyselinový zvyšok odstráni z NH2 okraja peptidu. Pretože reakcie s FITC nepostupujú kvantitatívne, ale nanajvýš o 95 percent, interferujúce faktory sa postupne hromadia - deriváty FTG zo zvyškov AK, ktoré nereagovali na predchádzajúce cykly. V najvýhodnejších prípadoch je možné spoľahlivo identifikovať sekvenciu iba asi 40 zvyškov AK. Avšak vďaka automatizácii procesu je práca stále značne uľahčená.
INTERPRETÁCIA S PEPTIDÁZMI:
a) z N-terminálnych zvyškov pomocou AMINOPEPTIDASES ( chromatografický identifikácia a kinetika akumulácie zodpovedajúcich AK.
b) z koncov C s karboksipeptidaz (Rovnakým spôsobom).
HYDRAZINOLYZA (v bezvodom médiu pri 100 ° C), s výnimkou posledného zvyšku s voľným COOH, sa všetky premenia na kyslé hydrazidy:
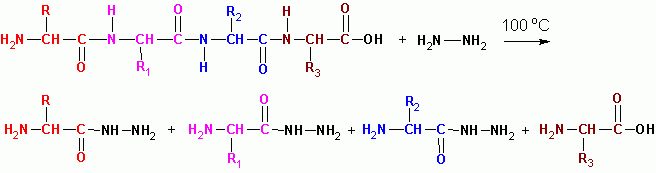
Sekvencia peptidov v proteínových molekulách je určená prekrývajúcimi sa fragmentmi peptidov:
G-W-V-R A-O-V-K C-E-C-D tryptické peptidy (trypsín)
G-W V-R-A-O V-K-C-E-C-D himotripticheskie peptidy (chymotrypsín)
ODPORÚČANÁ LITERATÚRA:
1. Stroyev EA Biologická chémia. M., 1986.
2. Striyer L. Biochemistry, v 3 zväzkoch M., Mir, 1984.
3. White, Handler, Smith a ďalší, základy biochémie, v 3 vol. M., Mir, 1981.
4. Ovchinnikov Yu.A. Bioorganická chémia, M., Enlightenment, 1987.
5. Anisimov a kol., Základy biochémie. M., High School, 1986.
Jednou zo znakov proteínov je ich komplexná štrukturálna organizácia. Všetky proteíny majú primárnu, sekundárnu a terciárnu štruktúru a proteíny, ktoré majú vo svojom zložení dve alebo viac PPC, majú tiež kvartérnu štruktúru (ES).
Štruktúra primárnych proteínov (PSB) – toto je poradie striedania (sekvencie) aminokyselinových zvyškov v PPC.
Aj proteíny rovnakej dĺžky a zloženia aminokyselín môžu byť rôznymi látkami. Napríklad dva rôzne dipeptidy môžu byť tvorené dvoma aminokyselinami:
S počtom aminokyselín rovným 20 je počet možných kombinácií 2 - 10 18. A ak vezmete do úvahy, že v PPC sa každá aminokyselina môže vyskytnúť viac ako jedenkrát, potom je ťažké vypočítať počet možných možností.
Stanovenie primárnej štruktúry proteínu (PSB).
Proteíny PSB sa môžu určiť pomocou feniltiogidantoinovogo
metóda
, Táto metóda je založená na reakcii interakcie. fenylisothiokyanátu
(FITZ) s a-AK. Výsledkom je komplex týchto dvoch zlúčenín - FITC -AC
.
Napríklad, zvážte peptid ![]() za účelom stanovenia jeho PSB, to znamená sekvencie spojenia aminokyselinových zvyškov.
za účelom stanovenia jeho PSB, to znamená sekvencie spojenia aminokyselinových zvyškov.
FITC interaguje s koncovou aminokyselinou (a). Vytvorí sa komplex PTH-asa oddelí od zmesi a stanoví sa autenticita aminokyseliny a, Napríklad, toto je - aSN
![]() atď. Všetky ostatné aminokyseliny sa postupne separujú a identifikujú. Toto je časovo náročný proces. Stanovenie PSB proteínu strednej veľkosti trvá niekoľko mesiacov.
atď. Všetky ostatné aminokyseliny sa postupne separujú a identifikujú. Toto je časovo náročný proces. Stanovenie PSB proteínu strednej veľkosti trvá niekoľko mesiacov.
Priorita pri dekódovaní PSB patrí Sendzheru (1953), ktorá otvorila inzulín PSB (laureát Nobelovej ceny). Inzulínová molekula pozostáva z 2 PPC - A a B.
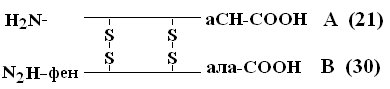
A-reťazec sa skladá z 21 aminokyselín, reťazec B - 30. Medzi nimi sú PPC spojené disulfidovými mostíkmi. Počet proteínov, ktorých PSB bol už stanovený, dosahuje 1 500. Aj malé zmeny v primárnej štruktúre môžu významne zmeniť vlastnosti proteínu. Červené krvinky zdravých ľudí obsahujú HbA - keď sú nahradené v цепи-reťazci HbA, na 6. pozícii glu na šachta vyskytne sa závažné ochorenie kosáčikovitá anémiav ktorej deti narodené s touto anomáliou zomierajú v ranom veku. Na druhej strane sú možné variácie PSB, ktoré neovplyvňujú jeho fyzikálno-chemické a biologické vlastnosti. Napríklad, HbC obsahuje na 6. pozícii b-reťazca namiesto glukózy, HbC sa takmer nelíši vo svojich vlastnostiach od HbA a ľudia, ktorí majú taký Hb v červených krvinkách, sú prakticky zdraví.
Stabilita PSB poskytované hlavne silnými kovalentnými peptidovými väzbami a po druhé disulfidovými väzbami.
Sekundárna štruktúra proteínu (VSB).
Proteíny PPV majú veľkú flexibilitu a získavajú určitú priestorovú štruktúru alebo prispôsobenie, V proteínoch sa rozlišujú 2 úrovne takejto konformácie - sú to VSB a terciárna štruktúra (TSB).
FAB – toto je konfigurácia PPC, to znamená spôsob, akým je uložená alebo skrútená do nejakej konformácie v súlade s programom stanoveným v PSat.
Sú známe tri hlavné typy VSD.:
1) špirála;
2) b-structure (zložená vrstva alebo zložená plachta);
3) chaotický spleť.
špirála .
Jej model navrhol W. Pauling. Je to najpravdepodobnejšie pre globulárne proteíny. Pre každý systém je najstabilnejší stav zodpovedajúci minimálnej voľnej energii. V prípade peptidov sa tento stav vyskytuje, keď sú skupiny CO– a NH– spojené slabou vodíkovou väzbou. špirála Skupiny NH- 1. aminokyselinového zvyšku interagujú so skupinou CO 4. aminokyseliny. Výsledkom je, že peptidová kostra tvorí špirálu, pre každú otáčku, na ktorú pripadá 3,6 AA zvyšku.
1 krok skrutkovice (1 otáčka) \u003d 3,6 AK \u003d 0,54 nm, uhol nábehu - 26 °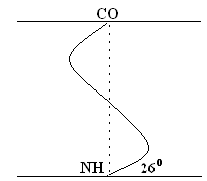
Krútenie PPC nastáva v smere hodinových ručičiek, to znamená, že špirála má správny pohyb. Každých 5 otáčok (18 AK; 2,7 nm) sa opakuje konfigurácia PPC.
Je stabilizovaný FAB primárne vodíkové väzby a po druhé, peptidové a disulfidové väzby. Vodíkové väzby sú 10 až 100 krát slabšie ako bežné chemické väzby; avšak kvôli ich veľkému počtu poskytujú určitú tuhosť a kompaktnosť VSB. Bočné R-reťazce a-helixu smerujú von a sú umiestnené na rôznych stranách od svojej osi.
b -structure .
Toto sú skladané sekcie PPC, ktoré pripomínajú list zložený do tvaru harmoniky. Vrstvy PPC môžu byť rovnobežné, ak oba reťazce začínajú na N - alebo C - konci.
Ak susediace reťazce vo vrstve sú orientované opačnými koncami N - С a С - N, potom sa nazývajú antiparallel.
 paralelné
paralelné
antiparallel
K vodíkovým väzbám dochádza rovnako ako v a-helixe medzi skupinami CO– a NH–.
Stanovenie primárnej štruktúry proteínov
Stanoveniu primárnej štruktúry predchádza denaturácia a prerušenie priečnych disulfidových väzieb v proteíne. Toto sa dosiahne prebytkom merkaptoetanolu.
Cystín sa premieňa na dva cysteínové zvyšky, ktoré sa potom blokujú nadbytkom kyseliny jódoctovej, aby sa zabránilo spätnej tvorbe väzieb S-S.
Štiepenie polypeptidového reťazca na fragmenty sa zvyčajne uskutočňuje pomocou proteolytických enzýmov, ako je napríklad trypsín, chymotrypsín alebo pepsín. Tieto enzýmy pôsobia na rôzne časti polypeptidového reťazca, pretože majú zvýšenú afinitu k rôznym aminokyselinovým zvyškom. Potrebné aminokyselinové zvyšky, t.j. priestorové prostredie napadnutej peptidovej väzby. Ukázalo sa, že trypsín hydrolyzuje iba tie peptidové väzby, na ktorých tvorbe sa podieľa karboxylová skupina lyzínu alebo arginínu, a chymotrypsín hydrolyzuje väzby podľa fenylalanínu, tryptofánu a tyrozínu. Typicky sú proteolytické enzýmy, ktoré hydrolyzujú polypeptidové reťazce, imobilizované na nerozpustných matriciach, aby sa ľahšie oddelili od produktov hydrolýzy. Potom sa určia aminokyselinové sekvencie každého polypeptidového fragmentu. Na tento účel sa najčastejšie používa metóda Edman, ktorá spočíva v analýze polypeptidu iba z N-konca. Konečná aminokyselina, keď reaguje s fenylizotiokyanátom v alkalickom prostredí, tvorí stabilnú zlúčeninu, ktorá sa môže odštiepiť z polypeptidu bez degradácie. Derivát fenyltiohydantoínu (FTG) aminokyseliny sa identifikuje chromatograficky.
Po identifikácii koncového zvyšku N-aminokyseliny sa značka zavedie do nasledujúceho zvyšku aminokyseliny, ktorý sa stáva terminálom. Edmanovu metódu je možné automatizovať pomocou sekvencera (z angličtiny). sekvencia -sekvencia), pomocou ktorej sa FTG deriváty odštiepia od polypeptidu a identifikujú sa vysokoúčinnou kvapalinovou chromatografiou.
F. Sanger prvýkrát dešifroval primárnu štruktúru inzulínu s proteínovým hormónom pomocou Edmanovej metódy.
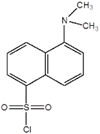
Ďalšou vysoko citlivou metódou je takzvaná dansylová metóda spojená s pridaním dansylchloridu (1-dimetylamino-naftalén-5-sulfonylchloridu) na koncovú aminokyselinu podľa nasledujúcej schémy:
Primárna štruktúra proteínu sa môže stanoviť nepriamo nasledujúcim spôsobom: Najskôr sa získa zodpovedajúca cDNA. Potom sa identifikuje klon súvisiaci s analyzovaným proteínom a primárna štruktúra proteínu sa stanoví striedaním nukleotidov v knižnici pomocou knižnice aminokyselinových sekvencií.
Stanovenie sekundárnej štruktúry proteínov
Optické metódy sa používajú hlavne na určenie sekundárnej štruktúry proteínov. Rôntgenová difrakčná metóda je samozrejme spoľahlivejšia, jej aplikácia je však spojená s určitými ťažkosťami a vyžaduje si značný čas. Optické metódy, ako je disperzia optickej rotácie a kruhový dichroizmus, sú jednoduchšie a, čo je veľmi dôležité, môžu určiť zmeny v sekundárnej štruktúre proteínu v roztokoch. Použitím disperzie optickej rotácie je možné získať informácie o stupni helicity proteínovej makromolekuly. Napriek skutočnosti, že metóda je približná, prechody špirálovo-vinutými cievkami sú celkom dobre viditeľné. Pokiaľ ide o metódu kruhového dichroizmu, jej spektrum je určené množinou uhlov w a q, charakteristických pre jeden alebo iný druh sekundárnej štruktúry. Obe metódy možno považovať za skríning a na úplnú identifikáciu sekundárnej štruktúry sa musia kombinovať s röntgenovou analýzou proteínov.
Proteíny sú organické zlúčeniny s vysokou molekulovou hmotnosťou, monomérne jednotky, ktoré sú a-aminokyseliny, vzájomne prepojené peptidovou väzbou. klasifikácia:
- vo forme molekúl (guľovitých alebo fibrilárnych); Fibrilárne proteíny, Polypeptidové reťazce sú navzájom rovnobežné, pretiahnuté reťazce tvoria dlhé vlákna alebo vrstvy. Slúžia ako hlavný organický materiál spojivového tkaniva a sú štrukturálnou súčasťou svalových vlákien. Napríklad kolagén, elastín. Guľové proteíny, Polypeptidové reťazce sú pevne zložené do kompaktných sférických štruktúr (guľôčky). Sú rozpustné vo vode. Napríklad enzýmy.
- molekulovou hmotnosťou (nízka molekulová hmotnosť, vysoká molekulová hmotnosť atď.);
- chemická štruktúra (prítomnosť alebo neprítomnosť neproteínovej časti);
- o vykonaných funkciách (transport, ochranné, štrukturálne bielkoviny atď.);
- lokalizáciou v bunke (jadrová, cytoplazmatická, lyzozomálna atď.);
- lokalizáciou v tele (krvné bielkoviny, pečeň, srdce atď.);
Štruktúra primárnych proteínov Je sekvencia aminokyselinových zvyškov v polypeptidovom reťazci molekuly spojenej peptidovými väzbami.
Peptidová väzba sa vyznačuje nasledujúcimi vlastnosťami:
1) O a H atómy peptidovej väzby sú transorientované;
2) štyri atómy peptidovej väzby ležia v rovnakej rovine, t.j. peptidové väzby sa vyznačujú koplaritou;
3) peptidová väzba v proteínovej molekule vykazuje keto-enol tautomerizáciu;
4) dĺžka väzby C-N, ktorá sa rovná 0,13 nm, má strednú hodnotu medzi dĺžkou dvojitej kovalentnej väzby (0,12 nm) a jednoduchej kovalentnej väzby (0,15 nm), čo znamená, že rotácia okolo osi C-N je obtiažna;
5) peptidová väzba je silnejšia ako obvyklá kovalentná väzba, pretože je to jeden a pol (kvôli redistribúcii hustoty elektrónov).
Pre každý jednotlivý proteín je aminokyselinová sekvencia v polypeptidovom reťazci jedinečná. Je geneticky určený a následne určuje vyššiu úroveň organizácie daného proteínu.
Aminokyselinový zvyšok umiestnený na konci reťazca, kde je voľná aminoskupina, sa nazýva amino-koniec alebo N-koniec, a zvyšok na druhom konci, ktorý nesie voľnú karboxylovú skupinu, sa nazýva karboxy-koniec alebo C-koniec. Názov polypeptidu začína na N-konci.
Fragmentácia polypeptidových reťazcov
chymotrypsín, štiepi peptidové väzby tvorené karboxylovými skupinami aromatického AA
T ripsinštiepi peptidové väzby tvorené AA obsahujúcimi dve aminoskupiny (lyzín, arginín)
Bromocyan (CNBr) štiepi peptidové väzby tvorené medzi karboxylovou skupinou metionínu a aminoskupinou akejkoľvek inej AK.
Hydroxylamín (NH2OH) štiepi peptidové väzby tvorené medzi zvyškami kyseliny asparágovej a glycínu
N-brómsukcínamid štiepi peptidové väzby tvorené medzi karboxylovou skupinou tryptofánu a aminoskupinou akéhokoľvek iného AK).
Sekvinatory - automatické zariadenia, ktoré umožňujú použitie Edmanovej metódy (reakcia polypeptidov s fenylizotiokyanátom) na štúdium primárnej štruktúry peptidov obsahujúcich až niekoľko desiatok aminokyselinových zvyškov.
Metóda fenyltiohydantoínu Spôsob určovania primárnej štruktúry proteínu. Na základe interakcie fenylizotiocinátu s N-terminálnym AK. Podstatou metódy je spracovanie študovaného peptidu so špecifickou sadou reagencií, čo vedie k eliminácii jednej aminokyseliny z N-konca sekvencie. Cyklické opakovanie reakcie a analýza reakčných produktov poskytujú informácie o sekvencii aminokyselín v peptide.
Metódy štúdia štruktúry proteínov
Kompletná hydrolýza v alkalických alebo kyslých podmienkach.
Kyslá hydrolýza sa uskutočňuje 24 hodín pri t \u003d 110 6-NHC1. Produkty hydrolýzy sa separujú iónomeničovou chromatografiou (na kolóne) so sulfonovaným polystyrénom. Aminokyselinová frakcionácia: použitím ninhydrónu je množstvo aminokyseliny stanovené farbou. Potom sa každá aminokyselina premyje a fotometricky stanoví. Týmto spôsobom je možné identifikovať ľahké aminokyseliny (odtlačky prstov). Ak je malé množstvo proteínu 10-9, potom sa použije fluorescenčné činidlo.
Stanovenie aminokyselinovej sekvencie.
Skontrolujte, či je reťaz jedna.
1. Osobná metóda:objektivizovať. jeden AK s N-koncom
Môže použiť dansylchlorid
(rovnako ako v predchádzajúcom okrese iba pre chlór)
2. Edmanova metóda - umožňuje určiť desiatky aminokyselín z N-konca
Edman navrhol sekvencer. proteín sa umiestni ako tenký film do rotujúceho valca. nádoba, kde sa podrobuje štiepeniu, sa oddeľuje 60 aminokyselín od N-konca myoglobínu veľryby.
3. Definícia 1. aminokyseliny od konca hydrazínu.
4. Enzým karboxypeptidázy sa môže štiepiť na 1. aminokyseline z C-konca.Používa sa na stanovenie malých polypeptidov (do 100)
Ak je viac ako 100%.
Trepsin- štiepi peptidové väzby tvorené C-koncom bázických aminokyselín - lyzínu a argenínu.
Hemotrepsin- štiepi peptidovú väzbu od konca aromatických a dikarboxylových kyselín.
Oddelené chromatograficky, začnite stanovovať. Znovu vezmite časť polypeptidu. Odštiepené iným spôsobom pomocou chemického činidla, použite brómkyán - štiepenie z C-konca metylamínu. Pozrite sa, prekrývajúce sa časti sa porovnávajú.
hydroxylamín-NH2OH- štiepi asparagín-glycínovú väzbu.
2-nitro-5-tiokyanobenzoát - štiepi aminoskupinu cystoínu.
1953 - inzulín je prvá sekvencia. Imunoglobulín (4 polypeptidové reťazce) je najväčšími 1300 aminokyselinovými zvyškami.
V proteínoch môžu byť stanovené všetky aminokyseliny.
Metóda odtlačkov prstov
Bromcian štiepi metiamín z C-konca (90%)HCOOH)
Sekvenovanie je potrebné pre:
1) Identifikovať molekulárny základ biolu. aktivitu.
2) Vplyv primárnej štruktúry na druhý, terciárny a kvartérny.
3) Zmena v poradí môže viesť k ochoreniu (dedičné).
4) Údaje o proteínovej sekvencii môžu veľa povedať o evolúcii.
2 RNA
RNA- H3P04; ribóza; adenín; guanín; cytozín; uracil
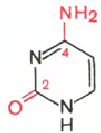
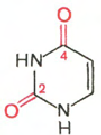
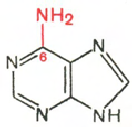
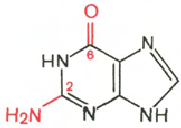
Cytosín Uracil Adenine Guanine
Sacharidy (ribóza a deoxyribóza) v molekulách DNA a RNA sú vo forme β-D-ribofuranózy:
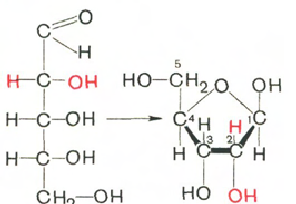
D-ribóza P-D-ribofuranóza
Nie sú k dispozícii žiadne presné údaje o množstve RNA, pretože jej obsah v rôznych bunkách je do značnej miery určený intenzitou proteínovej syntézy. RNA predstavuje asi 5–10% z celkovej bunkovej hmoty. Súčasná klasifikácia rôznych typov bunkovej RNA je založená na údajoch z topografie, funkcie a molekulovej hmotnosti. Rozlišujú sa tri hlavné typy RNA: matica (informačná) - mRNA, ktorá tvorí 2 - 3% z celkovej bunkovej RNA; ribozomálna - rRNA, ktorá obsahuje 80 - 85% a transportná - tRNA, čo je asi 16%. Tieto 3 druhy sa líšia zložením a funkciami nukleotidov.
Matricová RNA vznikajú pri prepise. Nesie presnú kópiu genetickej informácie kódovanej v špecifickej časti DNA, konkrétne o sekvencii aminokyselín v proteínoch.
Matricová RNA (mRNA) je syntetizovaná v jadre na DNA matrici, potom vstupuje do ribozómu a vykonáva maticovú funkciu pri syntéze proteínov. Pri vstupe z jadra do cytoplazmy vytvára mRNA komplexy so špecifickými proteínmi viažucimi RNA - tzv. Informozómy schopné reverzibilnej disociácie. Informozómy sa považujú za transportnú formu mRNA, ktorá podporuje tvorbu polyribozómov v cytoplazme.
Transportná RNA
(tRNA) majú malú molekulovú hmotnosť a sú obsiahnuté v rozpustnej frakcii cytoplazmy, pričom vykonávajú funkciu prenosu aminokyselín do miesta syntézy proteínov - ribozómu. Molekula tRNA je jediný polynukleotidový reťazec skrútený „sám o sebe“. Všetky tRNA sú zostavené podľa jedného plánu, všetky zapadajú do modelu listu ďateliny. Hlavným princípom je tvorba maximálneho počtu vodíkových väzieb medzi dusíkatými bázami. List ďateliny obsahuje päť špirálových stoniek, z ktorých štyri končia v slučkách nepárových nukleitidov. V strede molekuly je nezvinutá oblasť. 3 'a 5' - konce polynukleotidového reťazca sú spárované, aby vytvorili akceptujúci kmeň. Odoláva akceptujúcim kmeňovým anti-kodónovým kmeňom. Nesie antikodónovú slučku, ktorá pozostáva zo 7 nukleotidov. Antikodónová slučka obsahuje v strednej časti antikodón pozostávajúci z 3 nukleotidov komplementárnych ku kodónu danej aminokyseliny v mRNA. Pseudouridínová slučka nesená T-kmeňom obsahuje minoritnú zložku pseudouridínu. Skladá sa zo 7 nukleotidových zvyškov. Predpokladá sa, že práve s touto slučkou tRNA interaguje s ribozómom D - kmeň nesie slučku 8-12 nukleotidov. Toto je slučka dihydrouridínu, vždy obsahuje niekoľko zvyškov minoritnej zložky dihydrouridínu. 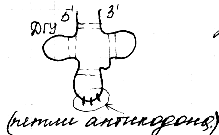
Ribozomálna RNA - základ, na ktorom sa nachádzajú proteíny a tvoria ribozóm. Ribozómy sú lokalizované hlavne v cytoplazme, navyše v jadre mitochondrií a chloroplastov. Nukleotidové zloženie je podobné: prevažujú guanylové nukleotidy, uridylové a cytidylové sú v malom množstve, nie sú prítomné žiadne minoritné bázy. Vo veľkosti a molekulovej hmotnosti sa ribozómy delia:
Bakteriálne ribozómy (relatívne malé). Sedimentačná konštanta 70S.
Ribozómy eukaryotických buniek. Sedimentačná konštanta 80S.
Ribozómy mitochondrií a chloroplastov.
Pri hydrolýze RNA tvoria sa ribóza, adenín, guanín, uracil, cytozín, kyselina fosforečná.
