0
Peptidisidokset johtuvat aminohapon reaktiosta aminohapon kanssa. Aminohappojen koostumuksessa on kaksi ryhmää - aminoryhmä ja karboksyyliryhmä. Peptidisidos tapahtuu, kun dehydraatioreaktio tapahtuu aminohapon välillä yhdessä aminohapossa ja karboksyyliryhmässä toisessa. Karboksyyliryhmä menettää happiatomin ja aminoryhmä menettää parin vetyatomeja, ja muodostuu vettä ja peptidiä.
Peptidisidos
Peptidiyhdisteen ulkonäkö tapahtuu hetkellä, jolloin aminoryhmän typpi sidotaan karboksyylihiileen. Tämä sidos on kovalenttinen ja jotkut tutkijat kutsutaan myös amidiksi. Sidoksen muodostuminen johtuu hydrolyysistä, ei synteesistä, joten se ei vaadi ylimääräistä energialähdettä. Peptidien biosynteesi tapahtuu vain muutamassa sekunnissa, mutta saman reaktion rekonstruktio laboratoriossa voi olla pitkä prosessi. kuitenkin koulutettuja yhteyksiä ovat stabiileja ja katalyyttien puuttuessa vesiliuoksessa peptidit voivat olla tuhansia vuosia.
Jos kaksi aminohappoa sitoutuu toisiinsa, dipeptidi ilmestyy, jos kolme - sitten tripeptidi. Monimutkaisten polymeerirakenteiden muodostamien aminohappojen määrä on lähes rajoittamaton. Aminohapon päätä, jossa on karboksyyliryhmä, kutsutaan N-terminaaliksi. Toisaalta on C-terminaali, toisin sanoen toisen aminohapon vapaa karboksyyliryhmä, joka liittyy yhdisteen muodostumiseen. Peptidisidos on elimistössä erittäin yleistä, usein siitä tulee perusta proteiinien muodostumiselle. Peptidiyhdisteitä ovat hormonit, erityisesti oksitosiini. Peptidien synteesi ihmiskehossa suoritetaan kaikissa soluissa, mukaan lukien aivojen neuronit.

Resonanssi ja biosynteesi
Peptidit ovat erityisen tärkeitä proteiinien toiminnassa ja biosynteesissä, koska ne lopulta määrittävät proteiinin rakenteen. Niiden koostumus mahdollistaa lisäparin siirtymisen elektronien parista hapen ja hiilen välillä kaksoissidoksen ja resonanssin muodostamiseksi. Tämä prosessi on erittäin dynaaminen, koska elektronit ovat pysyvässä liikkeessä, siksi peptidi- yhdisteillä ja niillä on korkea biologinen aktiivisuus. Peptidisidoksessa on läsnä dipolimomentti, joka johtuu erilaisten varausten läsnäolosta yhdisteen kahdessa päässä. Kyky käyttää useita elektroneja, samoin kuin lisätä aminohappoja sidokseen, tekee peptideistä ihanteellisen tiedonvälittäjän, ja niiden resonanssi takaa korkean biologisen aktiivisuuden. Polypeptidit pystyvät säätelemään useimpia biologisia prosesseja, kuten ruokahalua, elpymistä ja regeneroitumista, ruoansulatusta, mielialaa, korkeampaa hermostoa, verenpainetta ja hormonaalista aktiivisuutta.
Epätavallinen yhteys
Sidoksen luonteen vuoksi sillä on rajoitettu pyörimisvapaus, ja peptidistä tulee stabiileja yhdisteitä. Myös polypeptideissä havaitaan aminohappojen paikallistaminen joillakin erityisillä alueilla. Oletetaan, että nämä alueet voivat olla ominaisia kehon eri rakenteille ja määrittää peptidin tarkoituksen. Mutta samanaikaisesti peptidejä on vaikea tutkia ja ne ovat niin erilaisia, että meillä ei ole aavistustakaan siitä, kuinka täsmälleen aminohappojen järjestely sidoksessa määrää peptidin vaikutuksen. Peptidisidosten tutkimus on edelleen kesken.
Peptidisidoksen muodostuminen yleensä on vesielementtien eliminointi.
Hydrolyyttisten entsyymien katalysoimien peptidisidosten muodostumista havaittiin sellaisissa järjestelmissä, joissa reaktiotuote on liukenematon ja siten poistetaan reaktiokallasta.
Peptidisidoksen, joka katalysoituu metalli-ioneilla (hopea, lyijy, kupari tai elohopea), muodostaminen vaatii pH-säädön optimaalisten saantojen saavuttamiseksi.
Peptidisidoksen muodostuminen, kuten jo mainittiin (sekt.
Peptidisidoksen muodostuminen aktivoimalla aminoryhmä kulkee myös positiivisen varauksen hankkimisella karboksyyliryhmän hiiliatomilla, koska prosessin ensimmäinen vaihe on karboksyyliryhmän lisääminen molekyylin aktivoituun osaan. Tässä tapauksessa steeriset tekijät vaikuttavat myös reaktion virtaukseen.
Peptidisidoksen muodostuminen edellyttää makrotaloisten GTP-molekyylien osallistumista.
Peptidisynteesin perusperiaate. Peptidisidoksen muodostuminen dipeptidin tapauksessa on yksinkertainen kemiallinen prosessi. Tämän prosessin peräkkäinen toistaminen näyttää siltä, että sen pitäisi johtaa pitkiin peptideihin ja jopa proteiineihin. Tämän periaatteen toteuttaminen on kuitenkin mahdollista vain vakavissa kontrolloimattoman reaktion olosuhteissa.
Peptidisidoksen muodostuminen, kuten on jo osoitettu (osio. Elektrofiilisten potentiaalien lisääntyminen saavutetaan lisäämällä elektrofiniteetti- I- tai M (induktiivisia tai mesomeerisiä) substituentteja (XR), jotka vähentävät elektronitiheyttä karbonyylihiilellä ja karbonyylihapolla.
Peptidisidoksen muodostuminen voi jatkua yhden tai kahden vaiheen prosessina (osa
Peptidisidoksen muodostaminen on toisen aminohapon karbonyylihiiliatomin yhden aminohapon aminoryhmän nukleofiilinen hyökkäys.
Kun peptidisidos on muodostunut, bentsyylioksikarbonyyliryhmä pilkotaan vetybromidilla jääetikassa. A-karboksyyliryhmän suojaamiseksi se muunnetaan metyyli- tai butyylieetteriksi. Tämän jälkeen vastaava eetteri saippuoidaan tarvittaessa alkalilla.
Sharo-rod-luustomalli (ilman alanyyliproliladenosiinijäännöksen hydrogeenejä donorisubstraattina ribosomin p(toimittanut V.I. Lim, Neuvostoliiton tiedeakatemian proteiinikeskus, Pushchino). samalla kun yksinäinen pari elektroneja kiertää suuntautuu neljänteen huippuun.
Peptidisidoksen muodostuminen on termodynaamisesti epäedullinen, ja se voi edetä vain ankarissa olosuhteissa.
Alla kuvatut peptidisidosmuodon menetelmät erottuvat alkuperäisillä lähestymistavoilla. Tähän asti he eivät ole saaneet laajaa käytännön sovellus, mutta edustavat edelleen mahdollisia mahdollisuuksia peptidikemian kehittämiselle.
Luvut ovat mukana peptidisidosten muodostamisessa. Peptidien synteesissä b-isomeeristä yhdessä H2-ryhmän kanssa suojata y-karboksiryhmää, jolle se esteröidään bentsyylialkoholilla, tai tert-butyyliesteri tuotetaan isobutyleenin vaikutuksesta.
Peptidisidoksen muodostamisessa m-amino-dinaaripuolella ja diaminomikarboksyylihappoina ovat mukana vain hiiliatomiin liittyvät aminoryhmät ja karboksyyliryhmät.
Esimerkiksi peptidisidoksen muodostuminen proteiinissa vastaa Gpb-bsa: n funktion kasvua 17 kJ / mol, mutta biosynteesi ei etene suoraan, ja siinä käytettyjen reaktiosekvenssien määrä vastaa kolmen ATP-molekyylin kulumista kullekin sidokselle. Jos kyseessä on suhteellisen pieni kokoinen proteiini, esimerkiksi myoglobnum, joka sisältää noin 150 peptidisidosta, tarvitaan 450 ATP-molekyyliä tai 12 moolia glukoosia kullekin tuloksena olevan proteiinin moolille biosynteesille.
Peptidisidoksen muodostumisen atsidimenetelmä, vaikkakin siihen liittyy tiettyjä sivuprosesseja (pääasiassa supistettu nopeudella -10 - 5 ° C), vertaa suotuisasti kaikkiin muihin menetelmiin karboksyyliryhmien aktivoimiseksi melkein täydellisestä racemisaation puuttumisesta. Muita menetelmiä voidaan kuitenkin käyttää aktivoimaan aminohapot ja peptidit, joilla on uretaanityypin N-suojaus, sekä peptidejä, joissa on glysiinin ja proliinin C-terminaalisia ryhmiä, jotka ovat resistenttejä raseemiselle.
Brenner kuvasi vuonna 1955 mielenkiintoista menetelmää peptidisidosten muodostamiseksi; hieman myöhemmin näiden teosten tarkastelu ilmestyi (ks. myös [149a], s. 6).
Seuraavaa esimerkkiä havainnollistetaan peptidisidosmuodon yleinen menetelmä.
Seuraavaa esimerkkiä havainnollistetaan peptidisidosmuodon yleinen menetelmä.
Karbodi-imidimenetelmä peptidisidosmuodostukseen käsittää hajoamisen käytön.
Peptidisidoksen muodostuksen prosessissa on välttämätöntä suojata tiettyjen aminohappojen reaktiokohtaiset sivut. Näitä ovat: / - lysiini-aminoryhmä, ornitiinin hiilimonoksidiryhmä, arginiini- guanidiiniryhmä, asparagiini- ja glutamiinihappokarboksyyliryhmät, seriinin, treoniinin, tyrosiinin ja kysteiinin hydroksyylihappo- ja tioliryhmät, histidiini-imidatsolirengas. Joissakin tapauksissa suoritetaan metyoyainin, asparagiinin ja glutumiinin sivuryhmien esto. Viime aikoina on ehdotettu tryptofaanin indolirenkaan suojaryhmiä.
Erittäin kätevä tapa muodostaa peptidisidos on reagoida karboksyylihappo ja amiini disykloheksyylikarbodi-imidin (DCCI; DCCI) kanssa vesilohkaisuaineena.
Erittäin kätevä tapa muodostaa peptidisidos on vuorovaikutuksessa karboksyylihapon ja amiinin kanssa dnc-klooheksyylikarbodi-imidillä (DCCI; DCC.
HIV-1-proteaasin syntetisoimiseksi käytetyt syntonit. Reaktiot, joita käytetään peptidisidosten muodostamiseksi ja suojaryhmien poistamiseksi, voivat vahingoittaa useita sivuvaikutteisia ryhmiä. Siksi suojaryhmien käyttö on tärkeää paitsi fr-amino- ja a-karboksyyliryhmille, myös monille sivuradikaaleille. Näiden ryhmien on oltava suojattuja koko polypeptidiketjun muodostusprosessin aikana ja ne on poistettava vain prosessin lopussa. Polypeptidisynteesissä käytetään näiden ryhmien erilaisia yhdistelmiä. Ne tuodaan monomeereihin ryhmien, jotka suojaavat o-NH2- ja a-C00-ryhmiä, lisäksi. Monomeerejä, jotka sisältävät joukon suojaavia ryhmiä ja joissakin tapauksissa aktivoituja tähteitä, jotka mahdollistavat niiden käytön suoraan synteesimenetelmässä, kutsutaan tavallisesti syntoneiksi. Esimerkkinä taulukosta. 7.6 esittää synteettejä, joita käytetään 99-jäsenisen peptidin syntetisoimiseksi, joka on AIDS-koodia aiheuttavan HIV-1-viruksen koodaama proteaasi. Valtava kiinnostus tähän proteaasiin johtuu toivosta löytää spesifisiä proteaasi-inhibiittoreita, jotka estävät virusproteiinien kypsymisen ja siten tämän viruksen lisääntymisen.
Makrolidin vaikutuksesta peptidisidosten muodostuminen pysäytetään proteiinisynteesin aikana, translokaatioprosessi häiriintyy vaiheessa, jolloin peptidyyli-t-RNA palaa aktseptori (A) -paikasta (P) -kohtaan.
On olemassa suuri määrä menetelmiä peptidisidoksen muodostamiseksi substituoitujen aminohappojen tai peptidien välillä. Yleensä ne jaetaan menetelmiin, joilla karboksyyliryhmä aktivoituu, ja menetelmät, jotka liittyvät aminoryhmän aktivointiin.
Koska tämä on ensimmäinen esimerkki ys-peptidisidoksen muodostumisesta jäännöksessä, joka on erilainen kuin proliini, sitä tulisi käsitellä varoen. Toisaalta on mahdollista, että tämä sidosmenetelmä on tärkeä entsyymin aktiivisuuden kannalta.
Nukleosidin fosforylaatio kloorifosfaatilla on samanlainen kuin peptidisidoksen muodostuminen, joka tapahtuu, kun amiini on vuorovaikutuksessa asyylikloridin kanssa. Luultavasti yksi yksinkertaisimmista tällaisista esimerkeistä on ribonukleosidin reaktio fosforioksikloridin kanssa.
Muistuta, että energia peptidisidoksen muodostamiseksi vapautuu tioeetterin aminolyysin aikana.
Disykloheksyylikarbodi-imidiä ei käytetä pelkästään peptidisidosten muodostamiseen, vaan sitä käytetään myös usein eetteröintiin, esimerkiksi aktivoitujen tioalkyyli- ja tioaryylieettereiden synteesissä. Propi-tiolaktonia syntetisoitiin myös käyttämällä N, N-disykloheksyylikarbodi-imidiä (katso Ch.
Yleisimmät antibiootit. Useimmat grampositiiviset bakteerit estävät peptidisidosten muodostumista molekyylien välillä soluseinäjoka johtaa sen hajoamiseen. Tehokas vain jakautuvia bakteereja vastaan.
Toinen suunta peptidisidosmuodostuksen ongelman ratkaisemiseksi on sellaisten biologisten järjestelmien etsiminen, joilla on selvä tarve joillekin peptideille, jotka ovat selvempiä kuin niiden tarve yksittäisille aminohapoille, jotka muodostavat nämä peptidit. Jos esimerkiksi bakteerisolu käyttää peptidiä kasvuunsa tehokkaammin kuin aminohapot, niin voidaan olettaa, että peptidisynteesin nopeus määrittää sen nopeuden, jolla aminohappoja käytetään proteiinin muodostamiseksi. Tätä menetelmää on käytetty Sophia Simmondsin ja tämän artikkelin kirjoittajan Yalen yliopistossa tekemissä bakteerien peptidinvaihtotutkimuksissa.
Seuraavia menetelmiä peptidisidoksen muodostamiseksi käytetään eniten: 1) karbodi-imidi; 2) atsidi; 3) sekoitetut anhydridit; 4) aktivoidut esterit; 5) karboksihydridi.
Lipman toteaa, että peptidisidosten muodostumista edeltää aminohappojen fosforihappojohdannaisten synteesi.
Maggie määritteli kiinteän polyglysiinin peptidisidoksen muodostumisen lämmön ja entropian, jotka ovat vastaavasti 3 3 kcal / mol ja 17 entr.
Tietenkin, kuten peptidisidoksen muodostumisen tapauksessa, siihen liittyy tietty energia, ja siksi fosfodiesterisidoksen synteesi olisi välttämätöntä, ei yksinkertaisesti sekoittamalla fosforihappoa vastaavien suojattujen nukleosidien kanssa. Lopuksi (katso jäljempänä) voi jopa olla tarpeen estää fosfaatti- ryhmä. Vaikka se ei ole ehdottoman välttämätöntä (eikä sitä käytetty ensimmäisissä nukleotidisynteeseissä), tällä menetelmällä on etunsa ja se on tällä hetkellä yleisin.
Fisherin ja Kurziusin kehittämiä peptidisidosmuodostusmenetelmiä ei käytetty laajalti selektiivisesti pilkkoutuvien suojaryhmien puuttuessa.
Tätä reaktiota suosivat selvästi halutun peptidisidoksen alhainen muodostumisnopeus, joka esiintyy paikkatietoisten esteiden takia, ja tästä syystä isoja aminohappotähteitä, kuten valiinia ja isoleusiinia, ei tulisi sijoittaa silloituskohtiin. Kaikissa tapauksissa, joissa peptidifragmentit sisältävät C-terminaalisia tähteitä, jotka eivät ole glysiiniä tai proliinia, tulisi käyttää tekniikkaa, joka minimoi rasemisaatioriskin.
Kaikille aminohapoille on tunnusomaista kyky muodostaa peptidisidoksia. Tässä tapauksessa yhden aminohappomolekyylin NH2-ryhmä reagoi toisen molekyylin COOH-ryhmän kanssa. Tämän seurauksena vesi irrotetaan ja saadaan monimutkaisen koostumuksen tuotteita, joita kutsutaan peptideiksi.
Kaikille aminohapoille on tunnusomaista kyky muodostaa peptidisidoksia. Tässä tapauksessa yhden aminohappomolekyylin NH3-ryhmä reagoi toisen molekyylin COOH-ryhmän kanssa. Tämän seurauksena vesi irrotetaan ja saadaan monimutkaisen koostumuksen tuotteita, joita kutsutaan peptideiksi.
Ii] ja, kuten tetraetyylipyrofosfiitti, käytetään peptidisidosten muodostamiseen.
Eräs esimerkki tällaisesta prosessista on edellä mainittu peptidisidosmuodostusreaktio, joka etenee järjestelmän vapaan energian kasvun myötä. Tämä reaktio on toteutettavissa disykloheksyylikarbodi-imidin läsnä ollessa, koska kun jälkimmäinen on hydratoitu, vapautuu vapaata energiaa, joka kattaa vapaat energiakustannukset peptidisidosynteesille.
Eräs esimerkki tällaisesta prosessista on edellä mainittu peptidisidosmuodostusreaktio, joka etenee järjestelmän vapaan energian kasvun myötä. Tämä reaktio on toteutettavissa disykloheksyylikarbodi-imidin läsnä ollessa, koska kun jälkimmäinen on hydratoitu, vapautuu vapaa energia, joka kattaa vapaan energian kustannukset peptidisidoksen synteesissä.
Olettaen, että samat arvot vastaavat muiden aminohappojen peptidisidosten muodostumista, Maggie päättelee, että proteiinien synteesi biologisissa olosuhteissa on termodynaamisesti mahdollista, jos siihen liittyy hydrolyysi adenosiinitrifosfaatilla, pyrofosfaatilla tai polyfosfaatilla.
Toisen aminohapon asylointi seka- anhydridillä johtaa peptidisidoksen muodostumiseen. Näin saadun peptidin karboksyyliryhmä voidaan jälleen aktivoida ja liittää seuraavaan aminohappoon.
Peptidisidos- Tämä on yhden aminohapon alfa-karboksyyliryhmän ja toisen aminohapon alfa-aminoryhmän välinen yhteys.
Kuvio 5. Peptidisidoksen muodostuminen
Peptidisidoksen ominaisuuksia ovat:
1. Aminohappojen substituenttien (radikaalien) siirtyminen suhteessa C-N-viestintä. Kuvio 6.
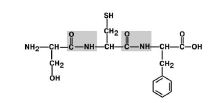
Kuva 6. Aminohapporyhmät ovat trans-asennossa.
2. samantasoisuudeksi
Kaikki peptidiryhmän atomit ovat samassa tasossa, kun taas atomit "H" ja "O" sijaitsevat peptidisidoksen vastakkaisilla puolilla. Kuvio 7, a.
3. Saatavuus ketolomakkeet ja enoliny muodossa. Kuvio 7, b 
Kuva 7. a) b)
4. Koulutuskyky kaksi vetysidostamuiden peptidiryhmien kanssa. Kuvio 8.
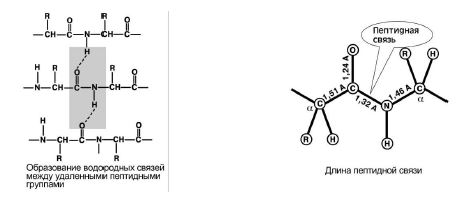
5. Peptidisidos on osittain luonteeltaan. kaksinkertainenviestintä. Sen pituus on pienempi kuin yksittäinen sidos, se on jäykkä rakenne ja kiertäminen sen ympärillä on vaikeaa.
Mutta koska peptidin lisäksi proteiinissa on muitakin sidoksia, aminohappoketju kykenee pyörimään pääakselin ympäri, mikä antaa proteiineille erilaisen konformaation (atomien spatiaalinen järjestely).
Polypeptidiketjun koostumuksessa oleva aminohapposekvenssi on ensisijainen rakenne proteiinia. Se on ainutlaatuinen kaikille proteiineille ja määrittää sen muodon sekä erilaiset ominaisuudet ja toiminnot.
Useimmilla proteiineilla on spiraalin muoto vedyn sidosten muodostumisen seurauksena -CO- ja -NH- polypeptidiketjun eri aminohappotähteiden ryhmät. Vety- sidokset ovat hauraita, mutta ne yhdessä muodostavat melko kiinteän rakenteen. Tämä kierre on toissijainen rakenne proteiinia.
Tertiaarinen rakenne - polypeptidiketjun kolmiulotteinen spatiaalinen "pakkaus". Tulos on outo, mutta jokaiselle proteiinispesifiselle kokoonpanolle - rae. Tertiäärisen rakenteen lujuus saadaan monenlaisista sidoksista, jotka syntyvät aminohapporyhmien välillä.
Kvaternaarinen rakenne ei ole ominaista kaikille proteiineille. Se johtuu useiden makromolekyylien yhdistelmästä, joilla on tertiäärinen rakenne, monimutkaiseksi kompleksiksi. Esimerkiksi ihmisen hemoglobiini on neljän proteiini-makromolekyylin kompleksi, tässä tapauksessa tärkein panos alayksiköiden vuorovaikutukseen tehdään hydrofobisilla vuorovaikutuksilla.
Tällainen proteiinimolekyylien rakenteen monimutkaisuus liittyy näihin biopolymeereihin, esimerkiksi suojaaviin, rakenteellisiin jne., Ominaisia funktioita.
Proteiinin luonnollisen rakenteen loukkaamista kutsutaan denaturointi. Se voi tapahtua lämpötilan, kemikaalien, säteilyenergian ja muiden tekijöiden vaikutuksesta. Heikolla vaikutuksella vain kvaternaarinen rakenne hajoaa vahvemmalla - tertiäärisellä ja sitten sekundäärisellä, ja proteiini pysyy polypeptidiketjuna, eli ensisijaisena rakenteena.
Tämä prosessi on osittain palautuva: jos primäärirakenne ei ole rikki, denaturoitu proteiini pystyy palauttamaan sen rakenteen. Tästä seuraa, että proteiinin makromolekyylin rakenteen koko erityispiirre määräytyy sen primäärirakenteen perusteella.

Kuva 9. Proteiinirakenteet
© 2015-2017 verkkosivusto
Kaikki oikeudet kuuluvat niiden tekijöille. Tämä sivusto ei väitä olevan tekijänoikeus ja tarjoaa ilmaisen käytön.
Peptidejä, joiden sekvenssi on lyhyempi kuin noin 10 - 20 aminohappotähdettä, voidaan kutsua myös oligopeptideiksi, joilla on pidempi sekvenssi, niitä kutsutaan polypeptideiksi. Proteiineja kutsutaan tavallisesti polypeptideiksi, jotka sisältävät noin 50 aminohappotähdettä.
Tähän mennessä tunnetaan yli 1500 tyyppistä peptidiä, niiden ominaisuudet on määritetty ja synteesimenetelmät on kehitetty.
Haiman polypeptidimolekyylit
- APP Linnun haiman polypeptidi
- fi: HPP Ihmisen haiman polypeptidi
Peptidien ominaisuudet
Peptidejä syntetisoidaan jatkuvasti kaikissa elävissä organismeissa fysiologisten prosessien säätämiseksi. Peptidien ominaisuudet riippuvat pääasiassa niiden primäärirakenteesta - aminohappojen sekvenssistä, sekä molekyylin rakenteesta ja sen konfiguraatiosta avaruudessa (sekundaarirakenne).
Peptidiluokitus ja peptidiketjurakenne
Peptidimolekyyli on aminohapposekvenssi: kaksi tai useampia aminohappotähteitä, jotka on yhdistetty amidisidoksella, muodostavat peptidin. Aminohappojen määrä peptidissä voi vaihdella suuresti. Ja niiden lukumäärän mukaan erottele:
- oligopeptidit - molekyylit, jotka sisältävät enintään kymmenen aminohappotähdettä; joskus niiden nimet mainitsevat niiden koostumuksessa olevien aminohappojen lukumäärän, esimerkiksi dipeptidin, tripeptidin, pentapeptidin jne .;
- polypeptidit - molekyylit, jotka sisältävät yli kymmenen aminohappoa.
Yhdisteitä, jotka sisältävät yli sata aminohappotähdettä, kutsutaan tavallisesti proteiineiksi. Tämä jako on kuitenkin ehdollinen, jotkut molekyylit, esimerkiksi hormoni glukagoni, joka sisältää vain kaksikymmentäyhdeksän aminohappoa, kutsutaan proteiini- hormoniksi. Laadullisella koostumuksella erotetaan:
- homomeeriset peptidit - yhdisteet, jotka koostuvat vain aminohappotähteistä;
- heteromeeriset peptidit ovat aineita, jotka sisältävät myös ei-proteiinikomponentteja.
Peptidit on myös jaettu sen mukaan, miten aminohapot on kytketty toisiinsa:
- homodeettiset peptidit, joiden aminohappotähteet on kytketty vain peptidisidoksilla;
- heterodeettiset peptidit ovat yhdisteitä, joissa peptidisidosten lisäksi löytyy myös disulfidi-, esteri- ja tioesterisidoksia.
Toistuvien atomien ketjua kutsutaan peptidirunkoksi: (-NH-CH-OC-). Alue (-CH-), jossa on aminohapporyhmä, muodostaa yhdisteen (-NH-C (R1) H-OC-), jota kutsutaan aminohappotähteeksi. N-terminaalisessa aminohappotähteessä on vapaa a-aminoryhmä (-NH), kun taas vapaan C-terminaalisen aminohappotähteen kohdalla on a-karboksyyliryhmä (OC-). Peptidit eroavat paitsi aminohappokoostumuksessa myös määrässä, samoin kuin polypeptidiketjun aminohappotähteiden sijainnista ja liitännästä. Esimerkki: Pro-Ser-Pro-Ala-His ja His-Ala-Pro-Ser-Pro Huolimatta samasta kvantitatiivisesta ja kvalitatiivisesta koostumuksesta näillä peptideillä on täysin erilaiset ominaisuudet.
Peptidisidos
Peptidi- (amidi) sidos on eräänlainen kemiallinen sidos, joka esiintyy yhden aminohapon a-aminoryhmän ja toisen aminohapon a-karboksiryhmän vuorovaikutuksesta johtuen. Amidisidos on erittäin vahva ja normaaleissa soluolosuhteissa (37 ° C, neutraali ph) se ei hajoa itsestään. Peptidisidos tuhoutuu erityisten proteolyyttisten entsyymien (proteaasien, peptidihydrolaasien) vaikutuksesta siihen.
arvo
Peptidibioregulaattorit
Pietarin tiedemiehen kehittämän teknologian pohjalta eläinten elimistä ja kudoksista eristettiin peptidit, joilla oli kudoskohtaisia vaikutuksia, jotka kykenevät palauttamaan aineenvaihdunnan optimaalisella tasolla niiden kudosten soluissa, joista ne oli eristetty. Näiden peptidien tärkeä erottelu on niiden säätelytoiminta: kun ne tukahduttavat solun toiminnan, ne stimuloivat sitä, ja kun ne kohoavat, ne laskevat sen normaalitasolle. Tämän ansiosta voimme luoda uuden luokan lääkkeitä - peptidibioregulaattoreita.
Ensimmäinen näistä, immunomodulaattori tymaliini, on ollut lääkemarkkinoilla yli 28 vuotta ja sitä käytetään palauttamaan immuunijärjestelmän toiminta eri alkuperää olevissa sairauksissa, mukaan lukien syöpä. Häntä seurasi epitalamiini (neuroendokriinijärjestelmän bioregulaattori), samprost (eturauhasen sairauksien hoitoon tarkoitettu lääke), cortexin (lääke useiden neurologisten sairauksien hoitoon), retinalamiini (lääke verkkokalvon degeneratiivisten disstrofisten sairauksien hoitoon). Peptidibioregulaattoreiden laajamittainen käyttö on yli 25 vuoden ajan saanut yli 15 miljoonaa ihmistä. Niiden käyttöön ja sivuvaikutuksiin ei kuitenkaan liittynyt vasta-aiheita.
Tällä hetkellä todettiin, että timaliini ja muut, kuten se, ovat vasta-aiheisia autoimmuunisairauksissa, koska tymaliini stimuloi myös yliherkkiä immuniteettialueita. Ilmeisesti tymaliinissa täysin suppressorifunktio, joka on erittäin tärkeä autoimmuunisairauksien torjunnassa.
