Molekyylipaino - yksi aineen tärkeimmistä ominaisuuksista. Tämä käsite liittyy läheisesti molekyylin määritelmään.
Ei-molekyylisten aineiden ehdollisissa rakennehiukkasissa (kaavayksiköt) käytetään käsitettä ”kaavan paino”.
Aineen rakenneyksiköiden massat ovat hyvin pieniä. Siksi heille käytetään suhteellisia massoja.
Suhteellinen molekyylipaino tarkoittaa M r.
Ei-molekyylisten aineiden suhteellista kaavapainoa merkitään myös M r.
Suhteellisten molekyylimassien arvoja käytetään laajasti erilaisissa kemiallisissa, fysikaalisissa ja kemiallisesti teknisissä laskelmissa. Siksi on tärkeää osata laskea ne.
Aineen suhteellisen molekyylimassan laskeminen sen kemiallisella kaavalla.Aineen kemiallista kaavaa käyttämällä voidaan paitsi karakterisoida sen koostumus, myös laskea suhteellinen molekyylipaino tai (ei-molekyylisille yhdisteille) suhteellinen kaavan paino.
suhteellinen molekyylipaino koostuu molekyyliin tulevien atomien suhteellisista massoista ottaen huomioon niiden lukumäärä.
Esimerkki.Laskemme rikkihapon suhteellinen molekyylipaino H2S04 (kuva 9.1). Rikkihappomolekyylin suhteellinen massa koostuu kahden vetyatomin, yhden rikkiatomin ja neljän happiatomin suhteellisten massojen summasta:
M r (H2S04) \u003d 2A r (H) + A r (S) + 4A r (0);
M r (H2S04) \u003d 2. 1 + 32 + 4. 16 \u003d 98.
Ei-molekyylisten aineiden suhteelliset kaavamassat lasketaan samalla tavalla.
Esimerkki.Laskemme kalsiumfluoridin suhteellinen kaavapaino CaF2 (kuva 9.2). Kalsiumfluoridin kaavayksikön suhteellinen massa koostuu kalsiumkationin Ca 2+ ja kahden fluori-anionin F -:
M r (CaF2) \u003d Ar r (Ca) + 2A r (F); M r (CaF2) \u003d 40 + 2. 19 \u003d 78.
 |
| Kuva 9.3. Uvarovitin koostumus ja rakenne |
Usein aineiden kemialliset kaavat sisältävät hakasulkeita. Esimerkiksi uvaroviitin kemiallinen koostumus kuvataan kemiallisella kaavalla Ca 3 Cr 2 (SiO 4) 3. Uvarovit on ioninen kide (kuva 9.3). Sen kaavayksikön suhteellinen massa voidaan laskea seuraavasti: Materiaali sivustolta
M r (Ca 3Cr 2 (SiO 4) 3) \u003d 3A r (Ca) + 2A r (Cr) + 3;
M r (Ca 3Cr 2 (SiO 4) 3) \u003d 3. 40 + 2. 52 + 3 (28 + 4. 16) \u003d 500.
Kiinnitä huomiota: sulujen ulkopuolella olevan kemiallisen kaavan indeksit lausutaan tällä tavalla - kahdesti, kolme kertaa jne.
Coca-Cola-juoman koostumus sisältää vettä N2O, hiilidioksidi CO2, hiili N2 CO3 ja fosfori H3PO 4 hapot, sokeri (sokeri) C 12 H 22O 11, kofeiiniC 8H 10N 4O 2.
Tällä sivulla materiaalia aiheista:
Kemmistien koko maailmassa olevien yksinkertaisten ja monimutkaisten aineiden koostumus heijastuu erittäin kauniisti ja tiiviisti kemiallisten kaavojen muodossa. Kemialliset kaavat ovat sanojen analogeja, jotka on kirjoitettu kirjaimilla - kemiallisten elementtien merkillä.
Kemiallisilla symboleilla ilmaistaan \u200b\u200bmaan laajimmin levinneen aineen - veden - koostumus. Vesimolekyyli sisältää kaksi vetyatomia ja yhden happiatomin. Nyt käännämme tämän lauseen kemialliseksi kaavaksi kemiallisilla symboleilla (vety - H ja happi - O). Me kirjoitamme kaavassa olevien atomien lukumäärän käyttämällä indeksejä - numeroita, jotka ovat kemiallisen symbolin oikeassa alakulmassa (ne eivät kirjoita indeksiä 1 happea varten): Н 2 0 (lue al-two-o).
Vedyn ja hapen yksinkertaisten aineiden, joiden molekyylit koostuvat kahdesta identtisestä atomista, kaavat on kirjoitettu seuraavasti: Н 2 (lue al-kaksi) ja 0 2 (lue o-kaksi) (kuva 26).
Kuva 26.
Hapen, vedyn ja veden molekyylimallit ja kaavat
Molekyylien lukumäärän heijastamiseksi käytetään kertoimia, jotka on kirjoitettu ennen kemiallisia kaavoja: esimerkiksi merkintä 2CO 2 (lue ”kaksi-tse-o-kaksi”) tarkoittaa kahta hiilidioksidimolekyyliä, joista kukin koostuu yhdestä hiiliatomista ja kahdesta happiatomista.
Kertoimet kirjoitetaan samalla tavalla, kun ne osoittavat kemiallisen alkuaineen vapaiden atomien määrän. Esimerkiksi, meidän on kirjoitettava lauseke: viisi raudan atomia ja seitsemän atomia happea. Tee tämä seuraavasti: 5Fe ja 7O.
Molekyylien ja etenkin atomien koot ovat niin pienet, ettei niitä voida tutkia parhaimmillakin optisilla mikroskoopeilla, joiden lisäys on 5-6 tuhatta kertaa. Niitä ei voida pitää elektronimikroskoopeissa, jolloin lisäys on 40 tuhatta kertaa. Luonnollisesti molekyylien ja atomien merkityksettömästi pieni koko vastaa niiden merkityksettömiä massoja. Tutkijat ovat laskenut esimerkiksi, että vetyatomin massa on 0,000 000 000 000 000 000 001 674 g, jota voidaan edustaa 1,674 10 - 24 g, happiatomin massa on 0,000 000 000 000 000 000 000 026 667 g tai 2,66667. 10 - 23 g, hiiliatomin massa on 1,993 10 - 23 g ja vesimolekyylin massa on 3,002 10 - 23 g.
Laskemme kuinka monta kertaa happiatomin massa on suurempi kuin vetyatomin, kevyimmän elementin, massa:
Samoin hiiliatomin massa on 12 kertaa suurempi kuin vetyatomin massa:


Kuva 27. Hiiliatomin massa on yhtä suuri kuin 12 vetyatomin massa
Vesimolekyylin massa on 18 kertaa suurempi kuin vetyatomin massa (kuva 28). Nämä arvot osoittavat, kuinka monta kertaa tietyn kemiallisen elementin atomin massa on suurempi kuin vetyatomin massa, ts. Ne ovat suhteellisia.

Kuva 27. Vesiatomin massa on yhtä suuri kuin 18 vetyatomin massa
Fyysikot ja kemit ovat tällä hetkellä sitä mieltä, että elementin suhteellinen atomimassa on arvo, joka osoittaa, kuinka monta kertaa sen atomin massa on enemmän kuin 1/12 hiiliatomin massasta. Suhteellista atomimassaa merkitään Ar: llä, jossa r on englanninkielisen alkukirjain suhteellinen, joka tarkoittaa "suhteellista". Esimerkiksi A r (0) \u003d 16, A r (C) \u003d 12, A r (H) \u003d 1.
Jokaisella kemiallisella elementillä on oma suhteellisen atomimassan arvo (kuva 29). Kemiallisten alkuaineiden suhteelliset atomimassat on ilmoitettu vastaavissa soluissa D. I. Mendelejevin taulukossa.

Kuva 29.
Jokaisella elementillä on oma suhteellisen atomimassan arvo.
Samoin aineen suhteellista molekyylipainoa merkitään Mr: llä, esimerkiksi M r (H20) \u003d 18.
Elementin A r suhteellinen atomimassa ja aineen M r suhteellinen molekyylimassa ovat määriä, joilla ei ole yksiköitä.
Aineen suhteellisen molekyylimassan tuntemiseksi ei ole välttämätöntä jakaa sen molekyylin massaa vetyatomin massalla. Sinun on vain lisättävä aineen muodostavien elementtien suhteelliset atomimassat ottaen huomioon esimerkiksi atomien lukumäärä:
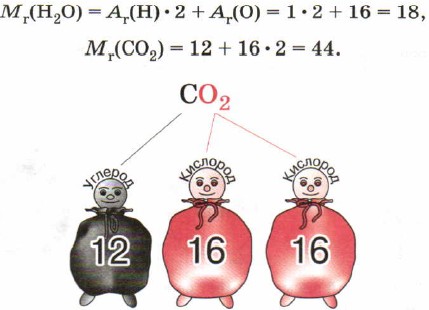
Kemiallinen kaava sisältää tärkeitä tietoja aineesta. Esimerkiksi kaava C0 2 näyttää seuraavat tiedot:
Lasketaan hiili- ja happielementtien massaosuus hiilidioksidissa CO2.
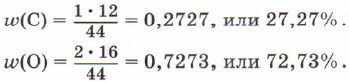
Avainsanat ja ilmaukset
- Kemiallinen kaava.
- Indeksit ja kertoimet.
- Suhteellinen atomimassa (A r).
- Suhteellinen molekyylipaino (M r).
- Aineen elementin massaosuus.
Työskentele tietokoneen kanssa
- Katso sähköinen hakemus. Tutki oppitunti ja suorita ehdotetut toiminnot.
- Löydä Internetistä sähköpostiosoitteita, jotka voivat toimia lisälähteinä, jotka paljastavat kappaleessa olevien avainsanojen ja lauseiden sisällön. Tarjoa opettajallesi apua uuden oppitunnin valmistelussa - kirjoita viesti seuraavan kappaleen avainsanoilla ja lauseilla.
Kysymykset ja tehtävät
- Mitä tietueet tarkoittavat: 3H; 2H20; 5O 2?
- Kirjoita sakkaroosikaava muistiin, jos tiedetään, että sen molekyylissä on kaksitoista hiiliatomia, kaksikymmentäkaksi vetyatomia ja yksitoista happiatomia.
- Kirjoita kuvan 2 avulla aineiden kaavat muistiin ja laske niiden suhteelliset molekyylipainot.
- Minkä hapen kemiallisen elementin olemassaolomuodossa kukin seuraavista merkinnöistä vastaa: 3O; 5O 2; 4CO 2?
- Miksi elementin suhteellisella atomimassalla ja aineen suhteellisella molekyylimassalla ei ole yksiköitä?
- Missä aineista, joiden kaavat ovat SO 2 ja SO 3, rikin massaosuus on suurempi? Vahvista vastaus laskelmilla.
- Laske alkuaineiden massaosuus typpihapossa HNO 3.
- Anna täydellinen karakterisointi glukoosille C 6 H 12 0 6 käyttämällä esimerkkiä hiilidioksidin kuvauksesta.
Tämä on kemiallisen yhdisteen molekyylin ma massan suhde 1/12: aan C + 12-hiiliatomin massasta: Mr \u003d ma / (1/12 mc) \u003d (12 mma) / mc. Suhteellinen molekyylimassa on ulottumaton määrä. D. I. Mendeleevin taulukko auttaa määrittämään suhteellisen molekyylimassan pyöristämällä atomimassan arvot kahteen tai kolmeen merkitsevään numeroon. Suhteellista atomimassaa merkitään Ar: lla, sen arvo on esitetty jaksollisessa taulukossa alkuaineen kemiallisen merkin alla.Aineen suhteellinen molekyylimassa on yhtä suuri kuin kaikkien elementtien suhteellisten atomimassojen summa (ottaen huomioon indeksit). Joten kuinka lasketaan esimerkiksi veden (H2O) molekyylien suhteellinen molekyylipaino: Mr (vesi) \u003d 2Ar (H) + Ar (O) ≈ 2 · 1 + 16 \u003d 18 Veden suhteellinen molekyylipaino on 18 ja tämä tarkoittaa, että molekyylipaino vettä on 18 kertaa enemmän kuin 1/12 C + 12-atomin massasta.
Seos on kaksi tai useampia aineita, jotka vuorottelevat keskenään avaruudessa. Seoksen komponenttien ominaisuudet pysyvät ennallaan. Kuinka löytää seoksen massa? Seoksen massa on yhtä suuri kuin seoksen muodostavien komponenttien massa. mcm \u003d m1 + m2 + ... .. mi Seoksen seoksen tiheys ρ (cm), joka koostuu i-komponentista ja käyttää tilavuutta V, määritetään kaavalla: ρ (cm) \u003d m / V \u003d \u200b\u200b(m1 + m2 + ... + mi) / V \u003d \u200b\u200bm1 / V + m2 / V + ... + mi / V \u003d \u200b\u200bρ1 + ρ2 + ... + ρi missä m1, m2, .............mi; ja ρ1, ρ2, ... ..ρi ovat seoksen kunkin komponentin massat ja tiheydet. Seoksen komponenttien tiheydet määritetään vertailukirjoista. Seoksen massa m on ρcmV \u003d (ρ1 + ρ2 + ... + ρi) V
Aineet koostuvat molekyyleistä, molekyyli on annetun aineen pienin partikkeli. Kuinka määrittää molekyylin massa? Aineen yhden molekyylin massa voidaan määrittää jakamalla aineen moolimassa moolien lukumäärällä yhdessä moolissa, toisin sanoen Avogardon luvulla. Siksi m0 \u003d M / NA. Moolimassa massa vastaa numeerisesti molekyylimassaa, mutta eroaa kooltaan. Sen mitta g / mol, esimerkiksi moolimassa vettä on 18 g / mol. Jotta saadaan selville vesimolekyylin massa, jaa 18 Avogadro-luvulla NA \u003d 6,022 × 10 ^ 23: 18 / (6,022 × 10 ^ 23) \u003d 2,99 · 10 ^ -23. Samalla menetelmällä on helppo löytää ainemolekyylin massa, jolla on tunnettu kemiallinen kaava.
Aineita voi olla useammassa tilassa - kiinteitä, nestemäisiä ja kaasumaisia. Kaasut muuttavat jatkuvasti muotoa ja tilavuutta. Kuinka laskea kaasun massa? Kaasun tilan yhtälö kuvaa termodynaamisia parametrejä, jotka kuvaavat kaasun painetta p, tilavuutta V ja lämpötilaa T: pV \u003d (m / M) RT, missä m on kaasun massa, M on moolimassa ja R on yleinen kaasuvakio. Kaasun massa voidaan määrittää, jos tilaparametrit tunnetaan: m \u003d pVM / RT. R: llä merkitty yleinen kaasuvakio on 8,314 J / (K.mol) tai 1,987 cal / (K.mol). Tämä on universaalivakio - fyysinen vakio.
Liuokset ovat homogeeninen monikomponenttinen järjestelmä, joka koostuu liuottimesta, liuenneista aineista ja niiden vuorovaikutustuotteista. Kuinka määrittää liuoksen massa? Liuoksen massan löytämiseksi voit käyttää kaavaa löytääksesi liuoksen massa: m (liuos) \u003d m (aine) + m (liuotin). Ratkaisuja löytyy kaikkialta. Esimerkiksi hiilidioksidin (CO2) liuos vedessä on tuttu hiilihapotettu vesi. Yksi veden tärkeimmistä ominaisuuksista on sen kyky liuottaa erilaisia \u200b\u200baineita. Liuokset voivat olla myös kaasumaisia, mutta kemiallisia nestemäisiä seoksia kutsutaan yksinkertaisesti ratkaisuiksi. Vesi on yleisimmin käytetty epäorgaaninen liuotin.
MOLEKULAARINEN MASS
molekyylin muodostavien atomien massojen summa; ilmaistuna atomi massayksiköinä (a. m.). 1 a. e. m (joskus kutsutaan daltoniksi, D) on yhtä suuri kuin 1/12 nuklidin 12 C atomin massasta ja massayksiköinä on 1,66057. 10 - 27 kg, M. m: n kertolasku 1,66057: ssä. 10 - 27 antaa abs. molekyylin massa kilogrammoina. Käytä useammin M-suhteellisen mitatonta arvoa - suhteellinen M. m: M rel
jossa M x -\u003e molekyylimassa x, ilmaistuna samoina massayksiköinä (kg, g tai muu) kuin D. M. m., karakterisoi molekyylin keskimääräisen massan ottaen huomioon kaikkien tämän kemikaalin muodostavien elementtien isotooppisen koostumuksen. Hän Yhdistää. Joskus M. m. Määritetään hajoamiseokselle. kuuluisassa koostumus, esim. ilmalle "tehokas" M. m voidaan pitää yhtä suurena kuin 29.
Abs. on sopivaa toimia molekyylimassien kanssa alaatomisten prosessien fysiikan ja radiokemian alalla, missä mittaamalla hiukkasten energia suhteellisuusteorian mukaan niiden abs. massa. Kemian ja kemian aloilla. tekniikkaa on sovellettava makroskooppisena. määrän mittayksiköt euroina. Minkä tahansa hiukkasten (molekyylien, atomien, elektronien tai henkisesti eristettyjen hiukkasten ryhmässä, esimerkiksi Na +- ja Cl-ionien pareja NaCl: n kidehilassa) lukumäärä on yhtä suuri kuin Avogadro-vakio N A \u003d 6,022. 10 23, on makroskooppinen. yksikön lukumäärä v-va-moolia. Sitten voimme kirjoittaa: M rel \u003d x . N A / (D. N A), ts. suhteellinen M. m on yhtä suuri kuin CC: n moolimassan ja N A: n välinen suhde. Jos cc koostuu molekyyleistä, joiden koostumusatomien välillä on kovalenttisia sidoksia, niin määrä x . N A edustaa tämän massan massaa, mittayksikkö on parvi kg-mol (kilomoli, kM). Asioille, jotka eivät sisällä molekyylejä, mutta koostuvat atomista, ioneista tai radikaaleista, massan muoto määritetään, ts. NA: n massa hiukkaset, jotka vastaavat hyväksyttyä v-va-kaavaa (kuitenkin myös Neuvostoliitossa, tässä tapauksessa, ihmiset puhuvat usein M. m.: stä, mikä on väärin).
Aiemmin kemiassa käytettiin käsitteitä grammolekyyli, grammatomi, grammi-ioni, nyt molekyylimooli, atomimooli, ionimooli, tarkoittaen NA-molekyylejä, atomeja, ioneja ja niin edelleen. niiden moolimassat grammoina tai kilogrammoina ilmaistuna. Termiä "molekyylipaino" käytetään perinteisesti synonyyminä, koska massan määritys suoritetaan painoja käyttämällä. Mutta toisin kuin paino, maantieteestä riippuen. koordinaatit, massa on v-va-määrän vakioparametri (hiukkasten normaaleilla nopeuksilla kemiallisissa olosuhteissa), siksi on oikeammin sanoa "molekyylipaino".
Suuri määrä vanhentuneita termejä ja käsitteitä, jotka liittyvät M. m., Johtuen tosiasiasta, että ennen kosmista aikakautta. kemiallisissa lennoissa ei kiinnitetty merkitystä massan ja painon eroon, leikkaukseen, joka johtui vapauden kiihtyvyyden arvojen eroista. putoaa napojen kohdalla (9,83 mss -2) ja päiväntasaajan kohdalla (9,78 mss -2); painovoimaa (painoa) laskettaessa käytetään yleensä keskiarvoa 9,81 mss -2. Lisäksi molekyylin (samoin kuin atomin) käsitteen kehittäminen liittyi makroskooppisen tutkimiseen. in-va-lukumäärä niiden kemiallisissa prosesseissa. (reaktiot) tai fyysiset. () muutokset, kun saarten rakenteen teoriaa ei kehitetty (1800-luku) ja oletettiin, että kaikki oli kemiallista. Conn. rakennettu vain atomeista ja molekyyleistä.
Määritysmenetelmät. Historiallisesti ensimmäistä menetelmää (perusteltu S. Cannizzaron ja A. Avogadro: n tutkimuksilla) ehdotti J. Dumas vuonna 1827, ja se koostui kaasumaisen c-v: n tiheyden mittaamisesta vetykaasun suhteen, jonka moolimassan alun perin oletettiin olevan 2, ja vaihtamisen jälkeen happimittayksikköön. molekyyli- ja atomimassat 2,016 g, seuraavaksi kokeen kehitysvaihe. Mahdollisuudet M. m: n määrittämiseen koostuivat haihtumattomien ja dissosioitumattomien aineiden nesteiden ja liuosten tutkimisesta mittaamalla kollatiivisia ominaisuuksia (ts. Riippuen vain liuenneiden hiukkasten lukumäärästä) - osmoottista. paine (ks osmometrian) alentaa höyrynpainetta, alentaa jäätymispistettä ( kryoskopia) ja nostetaan kiehumispistettä ( ebullioscope) ratkaisu puhtaaseen ratkaisuun verrattuna. Tässä tapauksessa havaittiin elektrolyyttien "epänormaali" käyttäytyminen.
Höyrynpaineen lasku r-rom: lla riippuu liuenneen v-va: n mooliosuudesta (Raoulin laki): [( p - p 0) / p] \u003d N, jossa p 0 -\u003e puhdas höyrynpaine, p höyrynpaine r-rommin yläpuolella, N- tutkitun liuenneen v-va: n moolijae, N \u003d( t x/ M x)/[( t x/ M x) +
(m 0 / M 0)], x ja M x - sotv. näyte (g) ja M. m tutkituista saarista, m 0 ja M 0 ovat samat p-protektorille. Määritysten aikana ekstrapolointi suoritetaan äärettömän erilaisiin aikoihin. ratkaisu, eli asetetaan tutkitun in-va-liuoksille ja tunnetun (standardi) kemikaalin liuoksille. yhteys. Kryoskopian ja ebulioskopian tapauksessa riippuvuudet vastaavat Dt 3 \u003d KC ja Dt k \u003d EY missä Dt 3 on liuoksen jäätymislämpötilan lasku, Dt on liuoksen kiehumislämpötilan nousu, K ja E- vastaavasti. krioskopich. ja ebulioskooppinen. p-toistimen vakio, määritetty standardilla, joka on liuotettu in-wu: iin tarkalleen tunnetulla M. m: llä, tutkitun in-va: n r-re: n c-molalla ( c \u003d M x tx.1000 / m 0). M. m. Laskettu f-lam: lla: M x \u003d t x K.1000 / m 0 Dt 3 tai M x \u003d t x E.1000 / m 0 Dt k. Menetelmille on tunnusomaista melko suuri tarkkuus, koska niissä on erityisiä. (ns. Beckman-lämpömittarit), jolloin voidaan mitata hyvin pieniä muutoksia t-ry.
Isotermistä lämpöä käytetään myös M: n määrittämiseen. r-toistimen tislaus. Tässä tapauksessa näyte tutkitun aineen liuoksesta viedään kammioon kyll. r-höyryhöyry (tällä t-re: llä); p-lauhduttimen parit kondensoituvat, p-p: n p-p nousee ja tasapainon muodostumisen jälkeen pienenee jälleen t-ry: n muutoksella arvioidaan vapautuneen haihtumislämmön määrä, reuna liitetään liuenneen v-va: n M. Ns. izopiestich. menetelmät suorittavat isotermisen. r-toistimen tislaus suljetussa tilassa, esim. H-muotoisessa astiassa. Aluksen yhdessä polvessa on ns. vertailuliuos, joka sisältää tunnetun massan tunnettua v.m. (moolipitoisuus C 1), toisessa liuoksessa, joka sisältää tutkitun m-v: n tunnetun massan (moolipitoisuus) C2 Tuntematon). Jos esimerkiksi C 1\u003e C 2,\u003e P-suojaus tislataan toisesta polvesta ensimmäiseen, kunnes moolipitoisuudet molemmissa polvissa ovat yhtä suuret. Saatujen isopioiden määrien vertaaminen. r-oja, laske M. m tuntematon in-va. M. m: n määrittämiseksi on mahdollista mitata isopioiden massa. liuokset, joissa käytetään McBen-vaakoja, jotka ovat kaksi kuppia, jotka on ripustettu jousiin suljetussa lasisäiliössä; testiliuos asetetaan yhteen kuppiin, toiseen vertailuliuok- seen; määrittämällä isopioiden massa muuttamalla kuppien sijaintia. r-oja ja siksi M. m. tutkivat in-va.
DOS. menetelmä atomin ja mol: n määrittämiseksi. haihtuvat massat massaspektrometria. Yhdisteiden seoksen tutkimiseksi. tehokas käyttö kromatografia-massaspektrometria. Matalassa piikin intensiteetissä mol. ioni käytettiin effusiometrisesti. lisälaitteet massaspektrometreihin. Effusio-metrinen menetelmä perustuu siihen tosiseikkaan, että kaasun vuotonopeus kammioon reiän läpi, jonka halkaisija on paljon pienempi kuin keskimääräinen vapaa polku. molekyylin reitti on käänteisesti verrannollinen M. m: n neliöjuureen. vuotoa säädetään kammion paineen muutoksella. M. m. Haihtuvat yhdisteet. määritetty myös kaasukromatografialla Martin-kaasutaseella. Jälkimmäinen mittaa kaasun liikkumisen nopeutta putkia, kantajakaasua ja Kromin läpi kulkevaa kromatografiavirtaa yhdistävällä kanavalla. pylväät, mikä mahdollistaa näiden kaasujen tiheyserojen määrittämisen tutkitun saaren M. m: stä riippuen.
M. m. Mitattu kemikaalin tunnistamiseksi. comp., yksittäisten nuklidien pitoisuuden määrittämiseksi yhdistelmässä, esim. atomienergiassa käytetyssä vedessä. installaatioita, samoin kuin korkea-asteen tutkimus ja synteesi. yhd., s-va - ryhmään riippuvat merkittävästi heidän M.m: sta (ks. Polymeerin molekyylipaino). Polymeerien M. m. Keskiarvot määritetään käyttämällä yllä lueteltuja menetelmiä, jotka perustuvat laimennettujen liuosten kolligatiivisiin ominaisuuksiin kaksoissidosten ("pehmeä" otsonolyysi) tai funktion lukumäärän mukaan. ryhmät (funktionaalisen analyysin menetelmillä), samoin kuin sellaisilla St.-R: llä niiden oja, kuten valonsironta. Keskimääräinen mol. polymeerien massat, joilla on korkea polymeroitumisaste, määritetään niiden reologisilla. ominaisuudet.
Lit .: Rafikov S. R., Pavlova S. A., Tverdokhlebova I. I., Menetelmät korkean molekyylipainon yhdisteiden molekyylipainojen ja polydispersiteetin määrittämiseksi, M., 1963; Pauling L., Pauling P., kemia, trans. englannista., M., 1978; Vilkov L.V., Pentin Yu.A., kemialliset fysikaaliset tutkimusmenetelmät, M., 1987. Yu. A. Klyachko.
Kemiallinen tietosanakirja. - M .: Neuvostoliiton tietosanakirja. Painos I. L. Knunyantsa. 1988 .
Katso mitä on "MOLECULAR MASS" muissa sanakirjoissa:
Molekyylin massa-arvo, ilmaistuna atomipainoyksiköinä. Lähes M. m. On yhtä suuri kuin siihen tulevien atomien massojen summa (katso. ATOMOMASSI). Fyysinen tietosanakirja. M .: Neuvostoliiton tietosanakirja. Päätoimittaja A. M. Prokhorov. 1983 ... Fyysinen tietosanakirja
- (molekyylipaino) on molekyylin massa ilmaistuna atomipainoyksiköinä. Lähes yhtä suuri kuin molekyylin muodostavien atomien massojen summa. Molekyylimassan arvoja käytetään kemiallisissa, fysikaalisissa ja kemiallisesti teknisissä laskelmissa ... suuri Tietosanakirja
- (moolimassa), termiä käytettiin aikaisemmin viittaamaan suhteellisiin molekyylipainoihin ... Tieteellinen ja tekninen tietosanakirja
Molekyylipaino M m - Molekyylimassa, M. m. * Molekyylipaino, M. m. * Molekyylimassa tai M. m. molekyylin massa, jolla ei ole omia mittayksiköitä, siksi termiä "molekyylipaino" käytetään yleensä tässä mielessä (katso) ... Genetiikkaa. Tietosanakirja
molekyylipaino - - Biotekniikan aiheet EN molekyylimassa ... Tekninen kääntäjän viite
Molekyylipaino - - suhteellinen arvo, tämän aineen molekyylin massan suhde 1/12: aan hiili-isotoopin C12 atomin massasta. [Usherov Marshak A. V. Betonitiede: sanakirja. M .: RIF rakennusmateriaalit. 2009. - 112 s.] Otsikko: Yleiset termit ... Encyclopedia käsitteistä, määritelmistä ja selityksistä rakennusmateriaaleille
molekyylipaino - santykinė molekulinė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Molekulės vidutinės masės arba apibrėžimo medžiagos darinio masės ir nuklido ¹²C atomo masės 1/12 osiosta atitikmenys: angl. molekyylimassa; ... ...
molekyylipaino - santykinė molekulinė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Molekulės sudarančių ir atomų santykinių atominių masių suma, vertine verte lygi medžiagų molio masei. atitikmenys: angl. molekyylimassa; molekyylipaino; ... ... Penkiakalbis aiškinamasis metrologijos terminų žodynas
molekyylipaino - santykinė molekulinė masė statusas T sritis chemija apibrėžtis Molekulė sudarančių atomų santykinių atominių masių suma, vertine verte lygi vienų medžiagų molio masei. atitikmenys: angl. molekyylimassa; molekyylipaino; suhteellinen molekyylimassa ... Chemijos terminų aiškinamasis žodynas
- (molekyylipaino), molekyylin massa, ilmaistuna atomipainoyksiköinä. Lähes yhtä suuri kuin molekyylin muodostavien atomien massojen summa. Molekyylipainoarvoja käytetään kemiallisissa, fysikaalisissa ja kemiallisesti teknisissä laskelmissa. * ... Tietosanakirja
