>> Состав и строение белков
Состав и строение белков.
1. Какова роль белков в организме?
2. Какие продукты богаты белками?
Среди органических веществ белки , или протеины, - самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50-80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты {рис. 5).
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (-NН2) с основными свойствами, другая - карбоксильной группой (-СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реактивность. Через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации
(рис. 6).
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции .
Большинство белков имеют вид спирали в результате образования водородных связей между -СО- и - NH-группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль - вторичная структура белка.
Третичная структура - трехмерная пространственная “ упаковка” полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация - глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
![]()
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка (рис. 7).

Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией (рис. 8). Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном - третичная, а затем - вторичная, и белок остается в виде полипептидной цепи.

Этот процесс частично обратим: если не разрушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Роль белков в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяется в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки, или протеины. Простые и сложные белки. Аминокислоты. Полипептид. Первичная, вторичная, третичная и четвертичная структуры белков.
1. Какие вещества называются белками, или протеинами?
2. Что такое первичная структура белка?
3. Как образуются вторичная, третичная и четвертичная структуры белка?
4. Что такое денатурация белка?
5. По какому признаку белки делятся на простые и сложные?
Каменский А. А., Криксунов Е. В., Пасечник В. В. Биология 9 класс
Отправлено читателями с интернет-сайта
Строение и функции белков. Ферменты
Белки - высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин - 36 000, гемоглобин - 152 000, миозин - 500 000. Для сравнения: молекулярная масса спирта - 46, уксусной кислоты - 60, бензола - 78.
Аминокислотный состав белков
Белки - непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты - могут синтезироваться; незаменимые аминокислоты - не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными - содержат весь набор аминокислот; неполноценными - какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот - различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды - органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом - свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка - последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами - пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, - 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию - транспорт кислорода; в таких случаях у человека развивается заболевание - серповидноклеточная анемия.
Вторичная структура - упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура - укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов - поверхностных белков нервных клеток.
Свойства белков
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов - гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
Ферменты
Ферменты, или энзимы, - особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты - глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы - кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр - небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры - участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент - с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин - 2,0, амилаза слюны - 6,8, липаза поджелудочной железы - 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят - ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому - дегидрогеназа),
трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому - трансаминаза),
гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта - амилаза, липаза),
лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S - декарбоксилаза),
изомеразы (внутримолекулярная перестройка - изомераза),
лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S - синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число - класс, второе - подкласс, третье - подподкласс, четвертое - порядковый номер фермента в данном подподклассе, например, шифр аргиназы - 3.5.3.1.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
- Реферат
- Белки, их строение и функции
- Содержание
- Введение
- 1.Аминокислотный состав белков
- 2.Классификация белков в зависимости от строения
- 3.Строение белков
- 4.Функции белков в организме
- Выводы
- Список литературы
Введение
Белки - это сложные высокомолекулярные природные соединения, состоящие из аминокислот. В состав белков входит 20 различных аминокислот, из разных комбинаций которых получается большое многообразие белков. В организме человека насчитывается до 100 000 белков. белок аминокислотный фибриллярный мембранный
Молекула белка состоит из углерода, водорода, азота, серы, кислорода. Часть белков образует комплексы с другими молекулами, содержащими железо, фосфор, цинк и медь.
Белки имеют большую молекулярную массу: яичный альбумин -- 36 000, гемоглобин -- 152 000, миозин -- 500 000. Для сравнения: молекулярная масса спирта -- 46, уксусной кислоты -- 60, бензола -- 78 .
1.Аминокислотный состав белков
Белки состоят из б-аминокислот. Основными являются 20 видов б-аминокислот, хотя в клетках и тканях их найдено свыше 170.
В организме человека и других животных выделяют:
- заменимые аминокислоты - могут образовываться;
- незаменимые аминокислоты - не могут образовываться.
Незаменимые аминокислоты попадают в организм вместе с пищей. Растения образуют все виды аминокислот.
В зависимости от аминокислотного состава различают белки:
- полноценные - включают все аминокислоты;
- неполноценные - включают только некоторые аминокислоты.
Выделяют белки простые и сложные:
- простые - содержат только из аминокислот;
- сложные - включают кроме аминокислот неаминокислотный компонент (простетическую группу). Он состоит из металлов (металлопротеинов), углеводов (гликопротеинов), липидов (липопротеинов), нуклеиновых кислот (нуклеопротеинов) .
В аминокислотах различают:
1) карбоксильную группу (-СООН),
2) аминогруппу (-NH2),
3) радикал или R-группу (остальная часть молекулы), отличается у разных видов аминокислот.
В зависимости от аминогрупп и карбоксильных групп различают:
- нейтральные аминокислоты, содержащие одну карбоксильную группу и одну аминогруппу;
- основные аминокислоты, содержащие более одной аминогруппы;
- кислые аминокислоты, содержащие более одной карбоксильной группы.
Поэтому аминокислоты проявляют амфотерные свойства .
2.Классификация белков в зависимости от строения
В зависимости от строения выделяют группы белков:
- Фибриллярные белки, их строение высокорегулярно, формируют полимерные соединения.
- Глобулярные белки имеют сферическую форму, являются водорастворимыми.
- Мембранные белки -- имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки.
Различают простые и сложные белки:
- простые содержат только полипептидные цепи,
- сложные включают дополнительно неаминокислотные группы. Их подразделяют в зависимости от химической природы простетических групп:
- Гликопротеины, включают углеводы;
- Липопротеины включают липиды;
- Металлопротеиды включают ионы металлов;
- Нуклеопротеиды включают ДНК или РНК;
- Фосфопротеины включают части фосфорной кислоты;
- Хромопротеиды включают окрашенные остатки различной химической природы .
3.Строение белков
Молекулы белков выглядят как линейные полимеры. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто обозначают пептидами, при большей степени полимеризации -- белками, но такое деление очень относительно .
Пептидные связи в белке формируются в результате взаимодействия б-карбоксильной группы (-COOH) одной аминокислоты с б-аминогруппой (-NH2) другой аминокислоты.
Выделяют 4 уровня структурной организации белков:
1. Первичная структура -- последовательность аминокислотных остатков в полипептидной цепи (рис.1).
Важными характеристиками первичной структуры становятся устойчивые сочетания аминокислотных остатков, несущие определённую функцию .
Рисунок 1 - Первичная структура белков.
2. Вторичная структура -- локальное упорядочивание части полипептидной цепи, уравношенное водородными связями (рис.2).
Рисунок 2 - Вторичная структура белков.
Основные типы вторичной структуры белков:
- б-спирали -- плотные витки вокруг длинной оси молекулы.
- в-листы (складчатые слои) -- несколько зигзагообразных полипептидных цепей.
- р-спирали и др. .
3. Третичная структура -- пространственная форма полипептидной цепи (рис.3). Включает части вторичной структуры, уравновешенные разными видами взаимодействий, но основная роль принадлежит гидрофобным .
Рисунок 3 - Третичная структура белков.
4. Четвертичная структура (субъединичная, доменная) -- взаимное местоположение нескольких полипептидных цепей в структуре единого белкового комплекса (рис.4). Молекулы белка с четвертичной структурой синтезируются на рибосомах по отдельности и только затем формируют общую надмолекулярную структуру. В структуре такого белка могут быть идентичные и различающиеся полипептидные цепочки. В уравновешивании четвертичной формы выделяют взаимодействия, как в третичной структуре. Надмолекулярные комплексы могут включать десятки молекул белка .
Рисунок 4 - Четвертичная структура белков.
4.Функции белков в организме
Белки - это важные компоненты всех живых организмов, они участвуют в жизнедеятельности клетки.
Поскольку один и тот же белок может выполнять несколько функций, то классификация белков по ним достаточно условная .
Каталитическая функция
Ферменты -- это белки катализирующие разные реакции. Они способствуют расщеплению сложных молекул (катаболизм), их образованию (анаболизм), и др. Активный центр - это часть белка, отвечающая за связывание субстрата.
Выделяют 6 классов ферментов:
КФ 1: Оксидоредуктазы активизируют окислительно-восстановительные реакции;
КФ 2: Трансферазы активизируют перенос химических групп с одной молекулы субстрата на другую;
КФ 3: Гидролазы активизируют гидролиз химических связей;
КФ 4: Лиазы активизируют разрыв химических связей без гидролиза с формированием двойной связи в одном из продуктов;
КФ 5: Изомеразы активизируют структурные или геометрические превращения в молекуле субстрата;
КФ 6: Лигазы активизируют формирование химических связей между субстратами за счёт гидролиза дифосфатной связи АТФ или трифосфата .
Структурная функция
Структурные белки отвечают за форму клеток и органов. Многие из них являются филаментозными: например, глобулярные, растворимые мономеры актина и тубулина после полимеризации образуют длинные нити скелета клетки. Коллаген и эластин -- главные части межклеточного вещества соединительной ткани (например, хряща), а из кератина формируются волосы, ногти, перья птиц и некоторые раковины .
Защитная функция
У белка выделяют следующие виды защитных функций:
- Физическая защита организма. В основном это белки со структурной функцией.
- Химическая защита заключается в соединении токсинов белками, т.е. в детоксикации.
- Иммунная защита - белки отвечают на повреждение и на атаку патогенов .
Регуляторная функция
Все реакции клетки управляются белками, они регулируют продвижение клетки по клеточному циклу, трансляцию, транскрипцию, сплайсинг, активность других белков и др. Данную функцию белки проявляют за счёт ферментативной активности (например, протеинкиназы), либо в результате специфичного связывания с другими молекулами .
Сигнальная функция
Это способность молекул передавать сигналы между клетками, тканями, органами и организмами. Часто данную функцию объединяют с регуляторной, так как многие внутриклеточные управляющие белки также выполняют передачу сигналов.
Такую функцию проявляют белки-гормоны, цитокины, факторы роста и др. .
Транспортная функция
Белки, участвующие в транспорте, обладают высоким сродством (аффинность) к субстрату, когда его много, и легко высвобождают его там, где его мало.
Некоторые мембранные белки осуществляют транспорт малых молекул через мембрану клетки, изменяя её проницаемость. Белки-каналы состоят из заполненных водой внутренних пор, которые помогают веществам перемещаться через мембрану .
Запасная (резервная) функция
В виде белков может запасаться энергия и другие вещества в семенах растений (например, глобулины 7S и 11S) и яйцеклетках животных. Определенные белки являются источником аминокислот .
Рецепторная функция
Белковые рецепторы могут быть в цитоплазме и в клеточной мембране. При его воздействии вещества на определённый участок белка происходит его конформационное изменение, в том числе меняется конформация другой части молекулы, и передается сигнал на другие клеточные компоненты.
Моторная (двигательная) функция
Моторные белки отвечают за движение организма. Сюда относится локомоция, перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также направленный и активный внутриклеточный транспорт .
Выводы
Все белки являются полипептидами, но не всякий полипептид является белком.
Каждый белок имеет свое специфическое строение.
Функции белков в организме разнообразны.
Список литературы
1. Гараев С.Н., Редкозубова Г.В., Постолати Г.В. Аминокислоты в живом организме. Кишинев, 2009. 552 с.
2. Кнорре Д.Г., Годовикова Т.С., Мызина С.Д., Федорова О.С. Биоорганическая химия. Новосибирск, 2011. 487 с.
3. Кузьмичева Л.В., Борченко Р.В., Новожилова О.С. Биологическая химия (Краткий курс лекций). Саранск, 2010. 154 с.
4. Кухта В. К., Морозкина Т. С., Олецкий Э. И., Таганович А. Д. Биологическая химия. М.: Бином, 2008. 688 с.
5. Щербак И. Г. Биологическая химия. СПб.: Издательство СПбГМУ, 2005. 480 с.
Размещено на Allbest.ru
...Подобные документы
Белки - высокомолекулярные органические соединения, их аминокислотный состав. Определение свойств белков их составом и структурой белковой молекулы. Характеристика основных функций белков. Органоиды клетки и их функции. Клеточное дыхание и его строение.
контрольная работа , добавлен 24.06.2012
Физические и химические свойства, цветные реакции белков. Состав и строение, функции белков в клетке. Уровни структуры белков. Гидролиз белков, их транспортная и защитная роль. Белок как строительный материал клетки, его энергетическая ценность.
реферат , добавлен 18.06.2010
Белки (протеины) – высоко молекулярные, азотосодержащие природные органические вещества, молекулы которых построены из аминокислот. Строение белков. Классификация белков. Физико-химические свойства белков. Биологические функции белков. Фермент.
реферат , добавлен 15.05.2007
Аминокислотный состав белков в организмах, роль генетического кода. Комбинации из 20 стандартных аминокислот. Выделение белков в отдельный класс биологических молекул. Гидрофильные и гидрофобные белки. Принцип построения белков, уровень их организации.
творческая работа , добавлен 08.11.2009
Белки как источники питания, их основные функции. Аминокислоты, участвующие в создании белков. Строение полипептидной цепи. Превращения белков в организме. Полноценные и неполноценные белки. Структура белка, химические свойства, качественные реакции.
презентация , добавлен 04.07.2015
Биологическая роль воды. Функции минеральных солей. Простые и сложные липиды. Уровни организации белков. Строительная, энергетическая, запасающая и регуляторная функции липидов. Структурная, каталитическая, двигательная, транспортная функции белков.
презентация , добавлен 21.05.2015
Строение, состав и физиологическая роль отдельных органелл клетки. Классификация белков по степени сложности. Состояние воды в живых тканях, ее функции. Полисахариды морских водорослей: состав, строение. Биологическая роль и классификация липидов.
контрольная работа , добавлен 04.08.2015
Белки как класс биологических полимеров, присутствующих в каждом живом организме, оценка их роли и значения в процессе жизнедеятельности. Строение и основные элементы белков, их разновидности и функциональные особенности. Нарушение белкового обмена.
презентация , добавлен 11.03.2013
История исследования белков. Белки: строение, классификация, обмен. Биосинтез белка. Функции белков в организме. Роль в жизнедеятельности организма. Высокомолекулярные органические соединения. Болезни, связанные с нарушением выработки ферментов.
реферат , добавлен 05.10.2006
Основные особенности метаболических процессов. Обмен веществ и энергии. Общая характеристика, классификация, функции, химический состав и свойства белков, их биологическая роль в построении живой материи. Структурные и сложные белки. Способы их осаждения.

Белки - органические вещества с большой молекулярной массой, основными компонентами которых являются альфа аминокислоты, связанные между собой цепочкой пептидных связей. Выявлено множество свойств и функций белков, в зависимости от среды обитания и самих живых организмов, в которых они обитают. Физико-химические свойства белков также различны, что объясняется разным составом аминокислот.
Особенно интересны химические свойства белков, так как некоторые из них совершенно противоположны друг-другу. Одни белки легко растворяются в воде, другие же, напротив, не растворяются вообще. Существуют белки, на которые не действуют разнообразные химические агенты, соответственно есть и такие, которым достаточно самого малого воздействия, вроде, лёгкого прикосновения или небольшого освещения, чтобы измениться. Некоторые разновидности в облике нитей, длинною в сотню нанометров, а встречаются напоминающие шар, имеющий в диаметре около шести нанометров. Однако, вне зависимости от своих размеров и форм свойства белка и его функции остаются неизменными. Белок кератина, например, имеет твёрдость стали и способствует образованию защитных механизмов у животных, таких, как копыта, когти, рога, панцирь, волосяной покров и перья. В мышечный состав включены состоящие из нитевидных молекул белки, обеспечивающие двигательную активность клеток благодаря своей эластичности и способности удлиняться или сужаться. Для перемещения веществ по организму необходимы представители с небольшими, круглыми молекулами. Быстрорастворимые, с легко изменяющейся структурой, белки принимают и передают в клетку сигналы, которые получают из окружающей среды.

Как происходит денатурации белка
Для того чтобы свойства и функции белка изменились, необходима денатурация. Что же это такое? Денатурация – это изменение изначальной структуры белка. Изменить ее можно, воздействуя на белок физическими или химическими факторами, вроде больших температур, механических воздействий или при помощи некоторых химических веществ. Наглядным примером денатурации является сваренное яйцо: из жидкого оно превращается в плотное. Белок перестаёт быть растворимыми и облегчает пищеварительными ферментам своё воздействие на него.
Однако, этот процесс обратим в том случае, если конструкция белка устанавливается особым порядком последовательности аминокарбоновых кислот в полипептидной цепи и его составом. В этом случае уже развёрнутая полипептидная цепь способна в произвольном порядке закрутиться спиралью и уложиться в единую. Эта способность основывается на системе раздражимости, свойственной всему живому.

Белки: функции и свойства
Первостепенная задача белков – строительная. Именно из них составлены мембраны клеток и ее органоидов, стенки системы кровоснабжения организма, сухожилий, хрящей и т.д.
Второй, но не менее важной задачей, является каталитическая. Ферменты являются катализаторами клетки, их активность очень высока. Благодаря им, химические реакции внутри организма ускоряются в разы. Белки являются ферментами по своему химическому составу. Именно они катализируют самые мизерные молекулы, используя для ускорения лишь активный центр белка. Такая реакция возможна лишь при близком нахождении молекул и геометрически верных пропорций конформаций вещества и активного центра белка. При процессе денатурации ускорение активности фермента пропадает по причине того, что конструкция активного центра расстраивается. Для любой химической реакции предусмотрен организмом определённый фермент - катализатор.
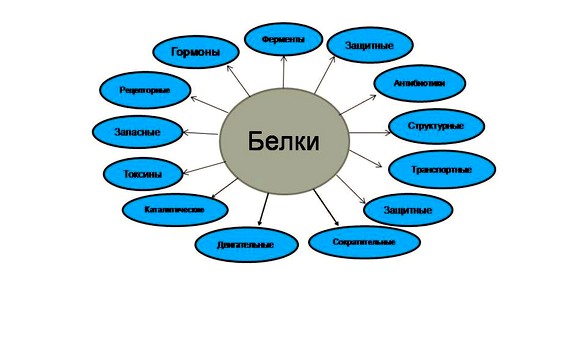
Следующие функции белка - сигнальная и защитная. Сигнальная функция отвечает за то, чтобы молекулы белков, входящие во внешнюю мембрану клетки и имеющие способность менять свою структуру под воздействием внешних раздражителей, принимали сигналы из окружающей среды и передавали в клетку команды. Защитная - за обезвреживание инородных клеток и веществ, вводимых в организм.

Помимо этого, белки обладают двигательной и транспортной функциями. За двигательные функции отвечают сократительные ферменты, демонстрирующие жизненную активность организма. Любое движение, от мерцания ресничек или движения жгутиков у простейших, вплоть до сокращения мышц у животных или человека, осуществляется при помощи актина и миозина. Транспортная функция отвечает за присоединение разнообразных веществ и перемещение их из разных клеточных мест в другие. К примеру, гемоглобин – белок, содержащийся в крови, отвечает за присоединение кислорода и доставку его ко всем тканям и органам организма.
И последняя функция – энергетическая. В клетке происходит распад белков на аминокислоты, одна часть которых обеспечивает синтез белков, а другая тщательно расщепляется для высвобождения энергии.
