1. Аминокиселините са органични амфотерни съединения. Те съдържат две молекулни групи с противоположно естество в молекулата: аминогрупа с основни свойства и карбоксилна група с киселинни свойства. Аминокиселините реагират както с киселини, така и с основи:
Когато аминокиселините се разтварят във вода, карбоксилната група разцепва водороден йон, който може да се присъедини към аминогрупата. В този случай се образува вътрешна сол, молекулата на която е биполярен йон, който се нарича амфотерен:
Киселинно-базичните трансформации на аминокиселини в различни среди могат да бъдат представени по следната схема:
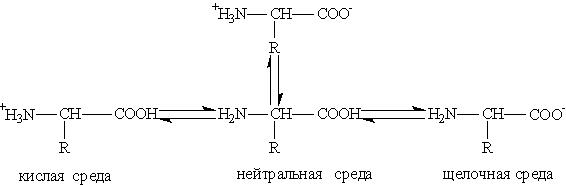
Водните разтвори на аминокиселини имат неутрална, алкална или кисела среда в зависимост от броя на функционалните групи. И така, глутаминовата киселина образува киселинен разтвор (две групи -СООН, една -NH2), лизин - алкална (една група -СООН, две -NH2).
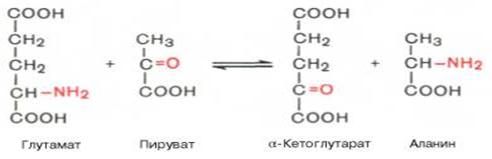
2. Трансаминация - една от реакциите на метаболизма на аминокиселините, която се състои в прехвърлянето на аминогрупа (NH2) от аминокиселина в кетокиселини; в резултат на това се образуват друга кетокиселина и аминокиселина.
3. Дезаминирането еразцепване на аминогрупата (-NH2) от молекула на органично съединение.
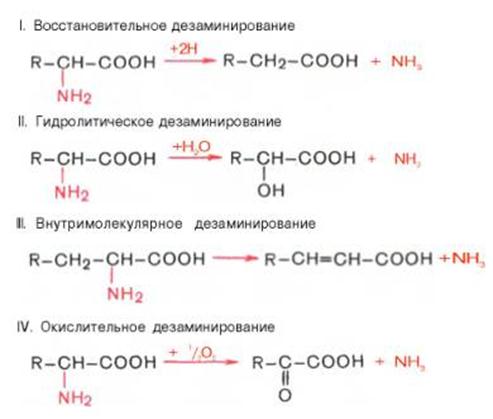
Дезаминирането играе важна роля в метаболитните процеси, по-специално в катаболизма на аминокиселините. Доказано е съществуването на 4 вида дезаминиране на аминокиселини (разцепване на аминогрупи). Изолираха се съответните ензимни системи, които катализират тези реакции и бяха идентифицирани продукти от реакцията. Във всички случаи NH2 групата на аминокиселината се освобождава като амоняк.
4 . декарбоксилиране- Този процес на разцепване на карбоксилната група на аминокиселини под формата на CO 2 се нарича декарбоксилиране. Въпреки ограничения диапазон на аминокиселини и техните производни, които претърпяват декарбоксилиране в животински тъкани, образуваните продукти на реакцията - биогенни амини - имат силно фармакологично въздействие върху много физиологични функции на хора и животни. Например в животинските тъкани хистидин декарбоксилирането под действието на специфична декарбоксилаза протича с висока скорост.
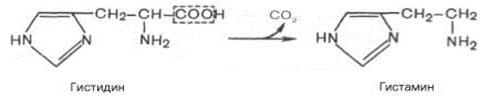
Хистаминът има широк спектър от биологични ефекти. Според механизма на действие върху кръвоносните съдове, той се различава рязко от другите биогенни амини, тъй като има съдоразширяващо свойство. В областта на възпалението се образува голямо количество хистамин, който има определено биологично значение. Като причинява вазодилатация във фокуса на възпалението, хистаминът по този начин ускорява притока на левкоцити, допринасяйки за активирането на защитните сили на организма. В допълнение, хистаминът участва в секрецията на солна киселина в стомаха, която се използва широко в клиниката при изучаване на секреторната активност на стомаха (хистаминов тест). Тя е пряко свързана с явленията на сенсибилизация и десенсибилизация. С повишена чувствителност към хистамин, в клиниката се използват антихистамини (санорин, дифенхидрамин и др.), Които влияят на съдовите рецептори. Хистаминът също е кредитиран с ролята на медиатор за болка.
5 . Преобразуването на аминокиселини при нагряване. α-аминокиселини и още по-лесно техните естери при нагряване образуват циклични пептиди - дикетопиперазини:
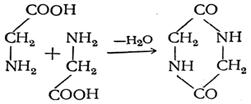
При нагряване β-аминокиселините образуват α, β-ненаситени киселини с елиминирането на аминогрупата и водорода от съседни въглеродни атоми:
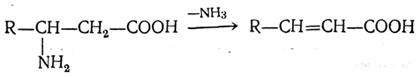
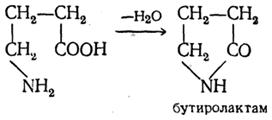
γ-, δ- и ε-аминокиселини, като съответните хидрокси киселини, лесно се разделят на вода и циклизират, образувайки вътрешни амиди - лактами:
6. Качествени реакции на аминокиселини.Качествените (цветни) реакции на аминокиселините са запазили своето значение и до днес. Цялостната качествена реакция на α-аминокиселините е реакция с нинхидрин. Всички аминокиселини се окисляват от нинхидрин с образуването на продукти, оцветени в синьо-виолетов цвят. Тази реакция може да се използва за количествено определяне на аминокиселини чрез спектрофотометричен метод.
Биуретова реакция се използва за откриване на пептидни връзки в пептиди и протеини. За откриване на ароматни и хетероциклични алфа аминокиселини се използва ксантопротеинова реакция. (от гръцки. Ксантос - жълт). Когато ароматните аминокиселини с концентрирана азотна киселина се нагряват, бензолният пръстен се нитрира и се образуват жълто оцветени съединения.
Аминокиселините се наричат \u200b\u200bорганични съединения, съдържащи функционални групи в молекулата: амино и карбоксилни.
Номенклатура на аминокиселини. Според систематичната номенклатура имената на аминокиселините се образуват от имената на съответните карбоксилни киселини и добавянето на думата „амино“. Позицията на аминогрупата се обозначава с числа. Броят е от въглерода на карбоксилната група.
Изомеризъм на аминокиселини. Техният структурен изомеризъм се определя от позицията на аминогрупата и структурата на въглеродния радикал. В зависимост от позицията на NH2 групите се разграничават , и аминокисл аминокиселини.

Протеиновите молекули са изградени от -аминокиселини.
Те се характеризират и с изомеризъм на функционалната група (междукласовите изомери на аминокиселини могат да бъдат естери на аминокиселини или амиди на хидроксиациди). Например за 2-аминопропанова киселина СНЗ – СН (NH) 2 – COOH са възможни следните изомери
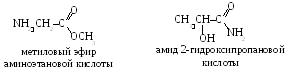
Физични свойства на α-аминокиселини
Аминокиселините са безцветни кристални вещества, нелетливи (ниско налягане на наситени пари), топящи се с разлагане при високи температури. Повечето от тях са силно разтворими във вода и слабо в органични разтворители.
Водните разтвори на моноосновни аминокиселини имат неутрална реакция. -Аминокиселините могат да се считат за вътрешни соли (биполярни йони): + NH3 СН2 COO . В кисела среда те се държат като катиони, в алкална среда се държат като аниони. Аминокиселините са амфотерни съединения, проявяващи както киселинни, така и основни свойства.
Методи за производство на -аминокиселини
1. Ефектът на амоняка върху солите на хлоро заместените киселини.
Cl
СН2
COONH 4 + NH3 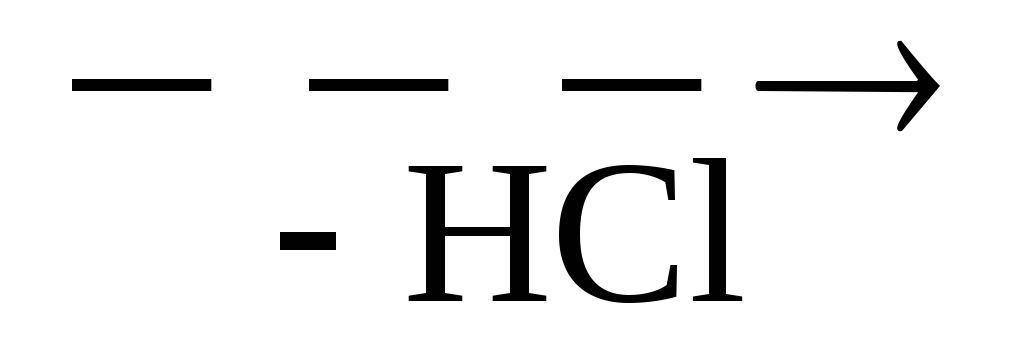 NH2
CH2 COOH
NH2
CH2 COOH
2. Ефектът на амоняка и циановата киселина върху алдехидите.
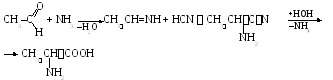
3. Протеиновата хидролиза произвежда 25 различни аминокиселини. Разделянето им е много трудна задача.
Методи за производство на -аминокиселини
1. Добавянето на амоняк към ненаситени карбоксилни киселини.
СН2 = СН COOH + 2NH 3 NH2 СН2 СН2 КООН 4.
2. Синтез на базата на двуосновна малонова киселина.
Химични свойства на аминокиселини
1. Реакции върху карбоксилната група.
1.1. Образуването на естери под действието на алкохоли.
2. Реакции в аминогрупата.
2.1. Взаимодействие с минерални киселини.
NH2 CH2COOH + HCl -H3N + СН2 COOH + Cl
2.2. Взаимодействие с азотна киселина.
NH2 CH 2 COOH + HNO 2 HO СН2 COOH + N2 + H20
3. Преобразуването на аминокиселини при нагряване.
3 .1. аминокиселини образуват циклични амиди.
.1. аминокиселини образуват циклични амиди.
3![]() .2.-аминокиселини разделят аминогрупата и водородния атом на γ-въглеродния атом.
.2.-аминокиселини разделят аминогрупата и водородния атом на γ-въглеродния атом.
Отделни представители
Глицин NH2CH2 COOH (гликол). Една от най-разпространените аминокиселини, които съставят протеини. При обикновени условия безцветни кристали с T pl \u003d 232236C. Разтворим е във вода, неразтворим в абсолютен алкохол и етер. Водородният индекс на водния разтвор е 6,8; pK a \u003d 1,510 10; pK b \u003d 1,710 12.
-аланин - аминопропионова киселина
Широко разпространен в природата. Той се среща в свободна форма в кръвната плазма и в повечето протеини. T PL \u003d 295 - 296 ° С, лесно разтворим във вода, слабо в етанол, неразтворим в етер. pK a (COOH) \u003d 2.34; pK a (NH  )
= 9,69.
)
= 9,69.
-аланин NH2CH2CH2COOH - малки кристали с T PL \u003d 200 ° C, лесно разтворими във вода, слабо в етанол, неразтворими в етер и ацетон. pK a (COOH) \u003d 3,60; pK a (NH  ) \u003d 10,19; отсъства в протеините.
) \u003d 10,19; отсъства в протеините.
Хелатора. Този термин се използва за назоваване на серия от аминокиселини, съдържащи две или три карбоксилни групи. Най-простият:
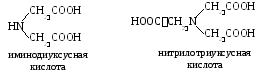
Н 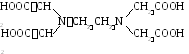 най-често срещаният комплексен е етилендиаминтетраоцетна киселина.
най-често срещаният комплексен е етилендиаминтетраоцетна киселина.
Динатриевата му сол - Trilon B - е изключително широко използвана в аналитичната химия.
Връзката между остатъците на аминокислот-аминокиселините се нарича пептид, а самите получени съединения са пептиди.
Два аминокиселинни остатъка образуват дипептид, три - трипептид. Много остатъци образуват полипептиди. Полипептидите, подобно на аминокиселините, са амфотерни; всеки има своя собствена изоелектрична точка. Протеините са полипептиди.
Аминокиселини - органични киселини, които имат в своята структура аминогрупа в алфа или друга позиция. Алфа аминокиселините са структурни компоненти на протеините. Съставът на естествените протеини включва 20 аминокиселини и някои съединения, подобни на тях.
Протеиновата молекула е изградена от 100 или повече аминокиселинни остатъци, ковалентно свързани в полимерни вериги. В човешкото тяло има 5 милиона протеини и нито един от човешките протеини не е идентичен с протеина на всеки друг жив организъм. Въпреки такова разнообразие от протеинови структури, за изграждането им са необходими само 22 аминокиселини, 9 от които са незаменими, тоест трябва да идват от човешка храна, те не се синтезират в човешкото тяло, други аминокиселини могат да се образуват в тялото ни от други аминокиселини. По този начин е необходимо да се осигури адекватно снабдяване на тези аминокиселини в организма с подходящо хранене с добре балансиран състав на животински и растителни протеини.
Девет незаменими аминокиселини са хистидин (необходим за деца), изолевцин, левцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Тялото е в състояние да изгради протеини само ако има достатъчно количество от всички тях. При липса на поне една от тези киселини протеините вече не се синтезират и храната се използва като източник на енергия или се съхранява в мастни натрупвания.
Останалите 13 аминокиселини се синтезират в човешкото тяло при трансаминационни реакции. Тези аминокиселини са аланин, аргинин, аспарагин / аспарагинова киселина, карнитин, цистеин, цистин, глутаминова киселина, глутамин, глицин, хидроксипролин, пролин, серин, тирозин.
В допълнение към 22 аминокиселини, които изграждат протеините, са известни над 150 други, които се намират в различни клетки и тъкани във свободна или свързана форма, но никога не се намират в протеини.
Значението на аминокиселините не се ограничава до тяхната роля в синтеза на тъканните протеини. Всеки от тях изпълнява своите специални функции в организма, насочени към поддържане на хомеостазата на организма.
Лишаването от всички аминокиселини води до пълна загуба на протеин от организма, изтощение, пълна загуба на енергия, загуба на тегло, анемия, разрушаване на мускулите, в най-лошия случай - до смърт.
Важно е да приемате аминокиселини с кофактори, които обикновено са витамини, минерални соли или други хранителни вещества, които подпомагат аминокиселините по време на метаболитните процеси в човешкото тяло. Важно е също приемането на аминокиселини в комплекс, а не само в една единствена аминокиселина, тъй като сложните метаболитни пътища участват в действието на аминокиселини, които изискват различни кофактори и други аминокиселини.
