1. Aminohapot ovat orgaanisia amfoteerisia yhdisteitä. Ne sisältävät molekyylissä kaksi vastakkaisen luonteen funktionaalista ryhmää: aminoryhmä, jolla on emäksisiä ominaisuuksia, ja karboksyyliryhmä, jolla on happamat ominaisuudet. Aminohapot reagoivat sekä happojen että emästen kanssa:
Kun aminohapot liuotetaan veteen, karboksyyliryhmä pilkkoo vetyionin, joka voi liittyä aminoryhmään. Tässä tapauksessa muodostuu sisäinen suola, jonka molekyyli on bipolaarinen ioni, jota kutsutaan kahtaisioni:
Aminohappojen happo-emäsmuutokset erilaisissa väliaineissa voidaan esittää seuraavalla kaaviolla:
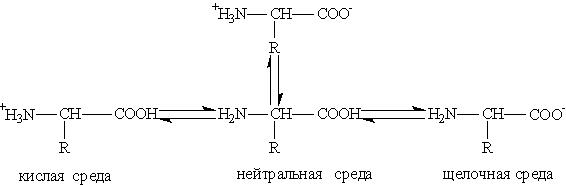
Aminohappojen vesiliuoksilla on neutraali, alkalinen tai hapan ympäristö funktionaalisten ryhmien lukumäärästä riippuen. Joten glutamiinihappo muodostaa happaman liuoksen (kaksi ryhmää - COOO, yksi - NH2), lysiini - alkaliset (yksi ryhmä - COOO, kaksi - NH2).
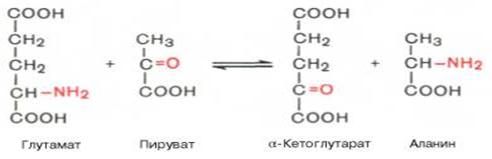
2. Transaminaatio - yksi aminohappojen metabolian reaktioista, joka muodostuu aminoryhmän (NH2) siirtämisestä aminohaposta ketohapoille; seurauksena muodostuu toinen ketohappo ja aminohappo.
3. Deaminointi onaminoryhmän (–NH2) pilkkominen orgaanisesta yhdisteestä.
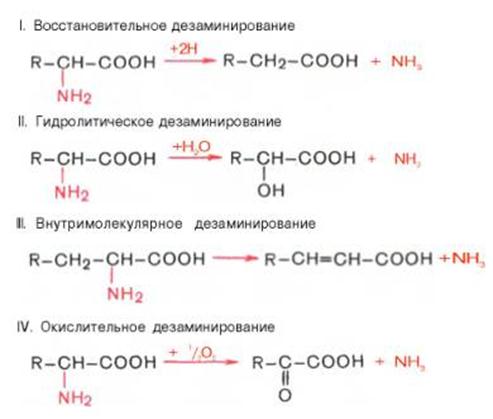
Deaminaatiolla on tärkeä rooli aineenvaihduntaprosesseissa, etenkin aminohappojen katabolismissa. Aminohappojen deaminaation 4 tyypin olemassaolo on osoitettu (aminoryhmien pilkkoutuminen). Vastaavat entsyymijärjestelmät, jotka katalysoivat näitä reaktioita, eristettiin ja reaktiotuotteet tunnistettiin. Kaikissa tapauksissa aminohapon NH2-ryhmä vapautuu ammoniakkina.
4 . dekarboksylaatioon- Tätä aminohappojen karboksyyliryhmän pilkkomista C02: n muodossa kutsutaan dekarboksylaatioksi. Huolimatta aminohappojen ja niiden johdannaisten rajallisesta valikoimasta, joille dekarboksyloituminen tapahtuu eläinkudoksissa, reaktiotuotteet muodostuivat - biogeeniset amiinit - joilla on voimakas farmakologinen vaikutus ihmisten ja eläinten moniin fysiologisiin toimintoihin. Esimerkiksi eläinkudoksissa histidiinin dekarboksylointi spesifisen dekarboksylaasin vaikutuksesta etenee suurella nopeudella.
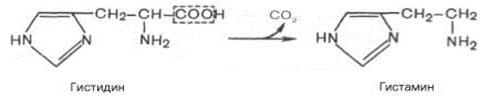
Histamiinilla on laaja valikoima biologisia vaikutuksia. Verisuoniin vaikuttavan mekanismin mukaan se eroaa jyrkästi muista biogeenisistä amiineista, koska sillä on verisuonia laajentava ominaisuus. Tulehduksen alueelle muodostuu suuri määrä histamiinia, jolla on tietty biologinen merkitys. Aiheuttamalla verisuonten laajenemista tulehduksen painopisteessä, histamiini nopeuttaa siten valkosolujen virtausta edistäen kehon suojauskykyä. Lisäksi histamiini osallistuu suolahapon eritykseen vatsassa, jota käytetään laajalti kliinissä tutkimaan vatsan eritysvaikutusta (histamiini-testi). Se liittyy suoraan herkistymisen ja desensibilisaation ilmiöihin. Kun herkkyys histamiinille on lisääntynyt, kliinissä käytetään antihistamiinia (sanorin, difenhydramiini jne.), Jotka vaikuttavat verisuonireseptoreihin. Histamiinille annetaan myös kivun välittäjän rooli.
5 . Aminohappojen muutos kuumennettaessa. α-aminohapot ja vielä helpommin niiden esterit kuumennettaessa muodostavat syklisiä peptidejä - diketopiperatsiineja:
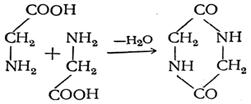
Kuumennettaessa β-aminohapot muodostavat α, β-tyydyttymättömiä happoja poistamalla aminoryhmän ja vedyn viereisistä hiiliatomeista:
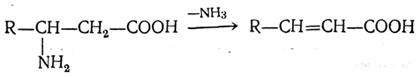
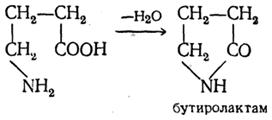
γ-, δ- ja ε-aminohapot, kuten vastaavat hydroksihapot, hajoavat helposti veden ja syklisoituvat muodostaen sisäisiä amideja - laktaamia:
6. Laadulliset reaktiot aminohapoihin.Aminohappojen kvalitatiiviset (väri) reaktiot ovat säilyttäneet merkityksensä tähän mennessä. Α-aminohappojen yleinen kvalitatiivinen reaktio on reaktio ninhydriinin kanssa. Ninhydriini hapettaa kaikki aminohapot, jolloin muodostuu tuotteita, jotka ovat väriltään siniviolettivärisiä. Tätä reaktiota voidaan käyttää aminohappojen kvantifiointiin spektrofotometrisella menetelmällä.
Biureaktiota käytetään peptidien sidosten havaitsemiseksi peptideissä ja proteiineissa. Aromaattisten ja heterosyklisten alfa-aminohappojen havaitsemiseksi käytetään ksantoproteiinireaktiota. (kreikasta. Xanthos - keltainen). Kun aromaattisia aminohappoja, joissa on väkevää typpihappoa, kuumennetaan, bentseenirengas nitrataan ja muodostuu keltaisen värisiä yhdisteitä.
Aminohapoiksi kutsutaan orgaanisia yhdisteitä, jotka sisältävät molekyylissä funktionaalisia ryhmiä: amino- ja karboksyylihappoja.
Aminohappojen nimikkeistö. Systemaattisen nimikkeistön mukaan aminohappojen nimet muodostuvat vastaavien karboksyylihappojen nimistä ja sanan “amino” lisäyksestä. Aminoryhmän sijainti osoitetaan numeroilla. Laskelma on peräisin karboksyyliryhmän hiilestä.
Aminohappojen isomerismi. Niiden rakenne-isomerismi määräytyy aminoryhmän aseman ja hiiliradikaalin rakenteen perusteella. NH2-ryhmien asemasta riippuen, , ja аминокисл-aminohapot erotellaan.

Proteiinimolekyylit on rakennettu -aminohapoista.
Niille on ominaista myös funktionaalisen ryhmän isomerismi (aminohappojen luokkien väliset isomeerit voivat olla aminohappoestereitä tai hydroksihappojen amideja). Esimerkiksi 2-aminopropanoehapon CH3 – CH (NH) 2 – COOH, seuraavat isomeerit ovat mahdollisia
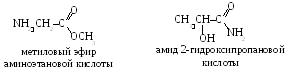
Α-aminohappojen fysikaaliset ominaisuudet
Aminohapot ovat värittömiä kiteisiä aineita, haihtumattomia (matala tyydyttynyt höyrynpaine), jotka sulavat hajoamalla korkeissa lämpötiloissa. Suurin osa niistä liukenee hyvin veteen ja heikosti orgaanisiin liuottimiin.
Yksiemäksisten aminohappojen vesiliuoksilla on neutraali reaktio. -Aminohappoja voidaan pitää sisäisillä suoloilla (bipolaarisilla ioneilla): + NH3 CH2 COO . Happamassa ympäristössä ne käyttäytyvät kuin kationit, emäksisessä ympäristössä käyttäytyvät kuin anionit. Aminohapot ovat amfoteerisia yhdisteitä, joilla on sekä happamia että emäksisiä ominaisuuksia.
Menetelmät -aminohappojen tuottamiseksi
1. Ammoniakin vaikutus kloorisubstituoitujen happojen suoloihin.
cl
CH2
COONH 4 + NH3 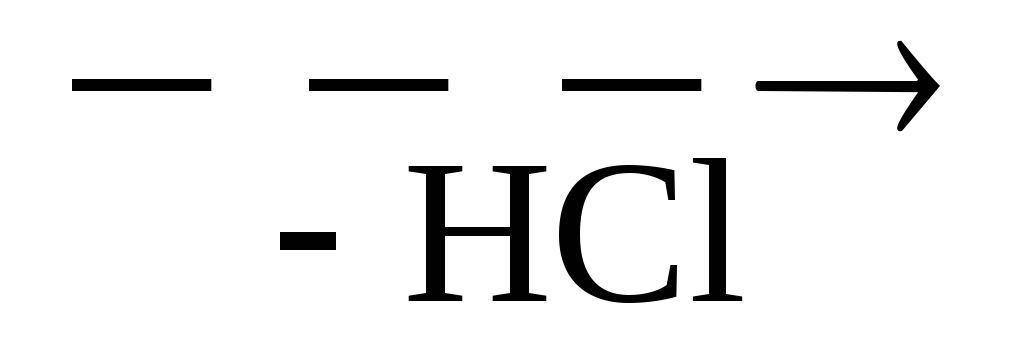 NH2
CH2COOH
NH2
CH2COOH
2. Ammoniakin ja syaanihapon vaikutus aldehydeihin.
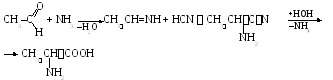
3. Proteiinien hydrolyysi tuottaa 25 erilaista aminohappoa. Niiden erottaminen on erittäin vaikea tehtävä.
Menetelmät -aminohappojen tuottamiseksi
1. Ammoniakin lisääminen tyydyttymättömiin karboksyylihappoihin.
CH2 = CH COOH + 2NH3 ~ NH2 CH2 CH2 KOKO 4.
2. Synteesi, joka perustuu kaksiemäksiseen malonihappoon.
Aminohappojen kemialliset ominaisuudet
1. Reaktiot karboksyyliryhmässä.
1.1. Estereiden muodostuminen alkoholien vaikutuksesta.
2. Reaktiot aminoryhmässä.
2.1. Yhteisvaikutukset mineraalihappojen kanssa.
NH2 CH2COOH + HCI H3N + CH2 COOH + Cl
2.2. Yhteisvaikutukset typpihapon kanssa.
NH2 CH 2COOH + HNO 2 HO CH2 COOH + N2 + H20
3. Aminohappojen muutos kuumennettaessa.
3 .1. aminohapot muodostavat syklisiä amideja.
.1. aminohapot muodostavat syklisiä amideja.
3![]() .2.-aminohapot jakavat y-hiiliatomin aminoryhmän ja vetyatomin.
.2.-aminohapot jakavat y-hiiliatomin aminoryhmän ja vetyatomin.
Yksittäiset edustajat
Glysiini NH2CH2COOH (glykoli). Yksi yleisimmistä proteiineista koostuvista aminohapoista. Tavanomaisissa olosuhteissa värittömiä kiteitä, joiden T pl \u003d 232 - 236 ° C. Se liukenee veteen, ei liukene absoluuttiseen alkoholiin ja eetteriin. Vesiliuoksen vetyindeksi on 6,8; pKa \u003d 1,5-1010; 10; pKb \u003d 1,7 - 10 x 12.
-alaniini - aminopropionihappo
Leviänyt luonnossa. Sitä esiintyy vapaassa muodossa veriplasmassa ja useimmissa proteiineissa. T PL \u003d 295 - 296 ° C, liukenee helposti veteen, heikosti etanoliin, ei liukene eetteriin. pKa (COOH) \u003d 2,34; pKa (NH  )
= 9,69.
)
= 9,69.
-alaniini NH2CH2CH2COOH - pienet kiteet, joiden T PL \u003d 200 ° C, liukenee helposti veteen, heikosti etanoliin, liukenematon eetteriin ja asetoniin. pKa (COOH) \u003d 3,60; pKa (NH  ) \u003d 10,19; puuttuu proteiineista.
) \u003d 10,19; puuttuu proteiineista.
Kelaattoreista. Tätä termiä käytetään nimeämään sarja -aminohappoja, jotka sisältävät kaksi tai kolme karboksyyliryhmää. Yksinkertaisin:
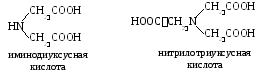
H 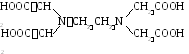 yleisin kompleksi on.
yleisin kompleksi on.
Sen dinatriumsuolaa - Trilon B - käytetään erittäin laajasti analyyttisessä kemiassa.
Аминокислот-aminohappojen tähteiden välistä suhdetta kutsutaan peptidiksi, ja tuloksena olevat yhdisteet ovat itse peptidejä.
Kaksi -aminohappotähdettä muodostavat dipeptidin, kolme - tripeptidin. Monet tähteet muodostavat polypeptidejä. Polypeptidit, kuten aminohapot, ovat amfoteerisia, jokaisella on oma isoelektrinen piste. Proteiinit ovat polypeptidejä.
Aminohapot - orgaaniset hapot, joiden rakenteessa aminoryhmä on alfa- tai muissa asemissa. Alfa-aminohapot ovat proteiinien rakenteellisia komponentteja. Luonnollisten proteiinien koostumus sisältää 20 aminohappoa ja joitain niiden kaltaisia \u200b\u200byhdisteitä.
Proteiinimolekyyli rakennetaan 100 tai useammasta aminohappotähteestä, jotka on kovalenttisesti kytketty polymeeriketjuihin. Ihmiskehossa on 5 miljoonaa proteiinia, eikä yksikään ihmisen proteiineista ole identtinen minkään muun elävän organismin proteiinin kanssa. Tästä monenlaisista proteiinirakenteiden monista huolimatta niiden rakentamiseen tarvitaan vain 22 aminohappoa, joista 9 on välttämätöntä, ts. Niiden on oltava peräisin ihmisravinnosta, niitä ei syntetisoida ihmiskehossa, kehossa voi muodostua muita aminohappoja muista aminohapoista. Siksi on välttämätöntä varmistaa näiden aminohappojen riittävä saanti kehossa asianmukaisella ravinnolla eläin- ja kasviperäisten proteiinien tasapainoisella koostumuksella.
Yhdeksän välttämätöntä aminohappoa ovat histidiini (välttämätön lapsille), isoleusiini, leusiini, lysiini, metioniini, fenyylialaniini, treoniini, tryptofaani ja valiini. Keho pystyy rakentamaan proteiineja vain, jos niitä kaikkia on riittävästi. Jos vähintään yhtä näistä hapoista ei ole, proteiineja ei enää syntetisoida, ja ruokaa käytetään energianlähteenä tai varastoidaan rasvakerroksiin.
Loput 13 aminohappoa syntetisoidaan ihmiskehossa transaminaatioreaktioissa. Nämä aminohapot ovat alaniini, arginiini, asparagiini / asparagiinihappo, karnitiini, kysteiini, kystiini, glutamiinihappo, glutamiini, glysiini, hydroksiproliini, proliini, seriini, tyrosiini.
Proteiinien muodostavien 22 aminohapon lisäksi tunnetaan yli 150 muuta, joita löytyy erilaisista soluista ja kudoksista joko vapaassa tai sitoutuneessa muodossa, mutta joita ei löydy proteiineista.
Aminohappojen merkitys ei rajoitu niiden rooliin kudosproteiinien synteesissä. Jokainen heistä suorittaa kehossa erityistehtävänsä, jonka tarkoituksena on ylläpitää kehon homeostaasia.
Kaikkien aminohappojen riistäminen johtaa kehon täydelliseen proteiinin menetykseen, uupumukseen, täydelliseen energian menetykseen, painonpudotukseen, anemiaan, lihaksen tuhoutumiseen, pahimmassa tapauksessa - kuolemaan.
Tärkeää on ottaa aminohappoja kofaktorien kanssa, jotka ovat yleensä vitamiineja, mineraalisuoloja tai muita ravintoaineita, jotka auttavat aminohappoja ihmiskehon aineenvaihduntaprosessien aikana. On myös tärkeää ottaa aminohapot kompleksiin eikä vain yhteen aminohappoon, koska monimutkaiset metaboliset reitit osallistuvat aminohappojen toimintaan, jotka vaativat erilaisia \u200b\u200bkofaktoreita ja muita aminohappoja.
