|
ALKUPERÄISEN PROTEIINIRAKENNON MÄÄRITTÄMINEN |
Proteiinin primaarirakenteen määrittäminen vaatii alustavan operaatiosarjan. Proteiini on puhdistettava huolellisesti, materiaalin puhtaus on vahvistettava vähintään kahdella riippumattomalla menetelmällä. Yleisimmin käytetty pol(PAGE) ja ultrasentrifugointi. Proteiinipuhdistuksen jälkeen se jaetaan kahteen tai kolmeen osaan. Jokainen osa on käsitelty erilaisilla proteaasi-entsyymeillä (trypsiini, kymotrypsiini) tai reagensseilla (bromisyaani, iodosobenzoic happo). Tuloksena on kaksi tai kolme (tai enemmän) polypeptidijoukkoa (proteiinisegmentit). Proteinaasientsyymeille asetetaan erityisiä puhtausvaatimuksia, muuten myöhemmin natiivin proteiiniketjun peptidisegmenttien vaihtosekvenssin määrittäminen on vaikeaa. Erityisen vaikeaa on disulfidisiltojen paikkojen tunnistaminen kysteiinitähteiden välillä. Saatu peptidien seos erotetaan elektroforeesilla, jonka jälkeen on mahdollista aloittaa sekvensointimenettely. Yksittäisen peptidin pituuden ei tulisi ylittää 40 AK-tähtettä.
Yleisimmin käytetty menetelmä peptidien sekvensoimiseksi (AK-tähteiden sekvenssin määrittäminen niissä) on P. Edman -menetelmä, jossa käytetään fenyyli-isotiosyanaattia (FITC). Menetelmä perustuu automaattisten sekvenssien toimintaan. Näyte puhdistetusta peptidistä levitetään reaktioastian pintaan kalvon muodossa. Usein peptidi ommellaan kovalenttisesti vapaan COOH-ryhmän päästä reaktioastian pintamateriaalin kanssa. Toista sitten jaksot sarjasta reaktioita. Yksi reaktiosarja sisältää:
- FITC: n vuorovaikutus terminaalisen AK-jäännöksen kanssa, jolla on vapaa NH2-ryhmä, ns. FTK- ( feniltiokarbamoil) -johdannainen:
- ylimääräinen FITC poistetaan, elatusaineen pH: ta muutetaan lisäämällä heptafluorivoihappo happo muuttamalla FTK FTG: ksi ( feniltiogidantoin) -johdannainen:
- Aminohapon FTG-johdannainen poistetaan reaktioväliaineesta uuttamalla 1-klooributaanilla ja reaktiosarja toistetaan seuraavassa syklissä.
Yhdessä syklissä yksi aminohappotähde poistetaan peptidin NH2-reunasta. Koska reaktiot FITC: n kanssa eivät etene kvantitatiivisesti, mutta parhaassa tapauksessa 95 prosentilla, häiritsevät tekijät kerääntyvät vähitellen - PTH-johdannaiset AK-tähteistä, jotka eivät reagoineet aikaisempien syklien aikana. Edullisimmissa tapauksissa on mahdollista luotettavasti tunnistaa vain noin 40 AK-tähteen sekvenssi. Prosessin automatisoinnin vuoksi työtä kuitenkin helpotetaan huomattavasti.
TULKINTO PEPTIDASEILLA:
a) N-terminaalisista tähteistä käyttämällä AMINOPEPTIDASES ( kromatografinen vastaavien AK: ien tunnistaminen ja kertymisen kinetiikka.
b) C-päästä karboksipeptidaz (Samalla tavalla).
HYDRAZINOLYYSI (vedettömässä väliaineessa 100 ° C: ssa), lukuun ottamatta viimeistä jäännöstä, jolla on vapaa COOH, muuttuvat kaikki happohydratsidiksi:
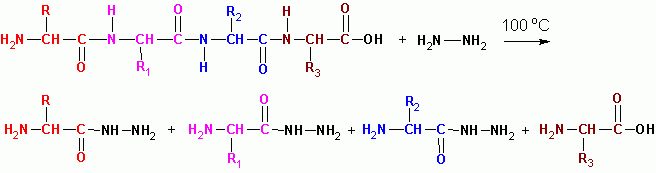
Proteiinimolekyylien peptidien sekvenssi määritetään päällekkäin peptidien fragmenttien kanssa:
G-W-V-R- A-O-V-K C-E-C-D- tryptiset peptidit (trypsiini)
G-W V-R-A-O- V-K-C-E-C-D- himotripticheskie peptidit (kymotrypsiini)
SUOSITELTU KIRJOITUS:
1. Strojev EA Biologinen kemia. M., 1986.
2. Striyer L. Biokemia, 3 osaa, M., Mir, 1984.
3. White, Handler, Smith ja muut, Biokemian perusteet, 3 tilavuusosaa, M., Mir, 1981.
4. Ovchinnikov Yu.A. Bioorgaaninen kemia, M., Enlightenment, 1987.
5. Anisimov ym., Biokemian perusteet. M., lukio, 1986.
Yksi proteiinien ominaisuuksista on niiden monimutkainen rakenteellinen organisointi. Kaikilla proteiineilla on primaari, sekundaarinen ja tertiäärinen rakenne, ja proteiineilla, joiden koostumuksessa on kaksi tai useampia PPC: itä, on myös kvaternäärinen rakenne (ES).
Ensisijainen proteiinirakenne (PSB) – tämä on aminohappotähteiden vaihtumisjärjestys (sekvenssi) PPC: ssä.
Jopa samanpituiset ja aminohappokoostumuksella varustetut proteiinit voivat olla erilaisia \u200b\u200baineita. Esimerkiksi kaksi erilaista dipeptidiä voi koostua kahdesta aminohaposta:
Aminohappojen lukumäärän ollessa 20, mahdollisten yhdistelmien lukumäärä on 2-10 18. Ja jos otat huomioon, että PPC: ssä jokaista aminohappoa voi esiintyä useammin kuin kerran, niin mahdollisten vaihtoehtojen lukumäärää on vaikea laskea.
Proteiinin (PSB) primaarirakenteen määrittäminen.
PSB-proteiinit voidaan määrittää käyttämällä feniltiogidantoinovogo
menetelmä
. Tämä menetelmä perustuu vuorovaikutuksen reaktioon. fenyyli-isotiosyanaattia
(FITZ) a-AK: n kanssa. Tuloksena on näiden kahden yhdisteen kompleksi - FITC -ac
.
Harkitse esimerkiksi peptidiä ![]() sen PSB: n, toisin sanoen aminohappotähteiden kytkentäsekvenssin, määrittämiseksi.
sen PSB: n, toisin sanoen aminohappotähteiden kytkentäsekvenssin, määrittämiseksi.
FITC on vuorovaikutuksessa terminaalisen aminohapon (a) kanssa. Kompleksi muodostetaan PTH-a, se erotetaan seoksesta ja aminohapon aitous määritetään ja. Tämä on esimerkiksi aSN
![]() jne. Kaikki muut aminohapot erotetaan ja tunnistetaan peräkkäin. Tämä on aikaa vievä prosessi. Keskikokoisen PSB-proteiinin määritys vie useita kuukausia.
jne. Kaikki muut aminohapot erotetaan ja tunnistetaan peräkkäin. Tämä on aikaa vievä prosessi. Keskikokoisen PSB-proteiinin määritys vie useita kuukausia.
Ensisijaisuus PSB: n dekoodaamisessa kuuluu Sendzheru (1953), joka avasi PSB-insuliinin (Nobel-palkinnon saaja). Insuliinimolekyyli koostuu kahdesta PPC: stä - A ja B.
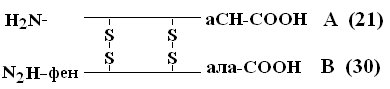
A-ketju koostuu 21 aminohaposta, ketju B - 30. PPC: t yhdistetään keskenään disulfidisiltojen avulla. Niiden proteiinien lukumäärä, joiden PSB on määritetty jo nyt, on 1500. Jo pienet muutokset primaarirakenteessa voivat muuttaa merkittävästi proteiinin ominaisuuksia. Terveiden ihmisten punasolut sisältävät HbA: ta - kun se korvataan HbA: n цепи-ketjussa, 6. asemassa glu päälle akseli esiintyy vakava sairaus sirppisoluanemiajossa tämän poikkeavuuden kanssa syntyneet lapset kuolevat varhaisessa iässä. Toisaalta, muutokset PSB: ssä ovat mahdollisia, jotka eivät vaikuta sen fysikaalis-kemiallisiin ja biologisiin ominaisuuksiin. Esimerkiksi, HbC sisältää b-ketjun 6. asemassa glukoosin sijaan, HbC ei melkein eroa ominaisuuksiltaan HbA: sta, ja ihmiset, joilla on tällaista Hb: tä punasoluissa, ovat käytännössä terveitä.
PSB-vakaus aikaansaatu pääasiassa vahvoilla kovalenttisilla peptidisidoksilla ja toiseksi disulfidisidoksilla.
Proteiinin (VSB) sekundäärinen rakenne.
PPV-proteiineilla on suuri joustavuus ja ne saavat tietyn alueellisen rakenteen tai rakenne. Proteiineissa erotetaan 2 tällaisen konformaation taso - nämä ovat VSB: tä ja tertiääristä rakennetta (TSB).
FAB – tämä on PPC: n kokoonpano, eli tapa, jolla se asetetaan tai kierretään jonkinlaiseksi rakenteeksi P: ssä vahvistetun ohjelman mukaisestiLa
VSD-levyjen kolme päätyyppiä tunnetaan.:
1) helix;
2) b-rakenteen (taitettu kerros tai taitettu levy);
3) sotkuinen sekava.
helix .
Hänen mallinsa ehdotti W. Pauling. Se on todennäköisimmin globaalien proteiinien kohdalla. Missä tahansa järjestelmässä vakain on tila, joka vastaa vähimmäisvapaata energiaa. Peptideillä tämä tila tapahtuu, kun CO- ja NH- ryhmät yhdistetään heikolla vety sidoksella. helix Ensimmäisen aminohappotähteen NH– ryhmät ovat vuorovaikutuksessa 4. aminohapon CO-ryhmän kanssa. Seurauksena on, että peptidin runko muodostaa spiraalin, jokaiselle kierrokselle 3,6 AA-tähteet putoavat.
1 kierukkavaihe (1 kierros) \u003d 3,6 AK \u003d 0,54 nm, nousukulma - 26 °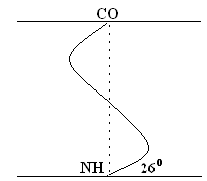
PPC: n kiertyminen tapahtuu myötäpäivään, eli spiraalilla on oikea liike. Joka viiden kierroksen jälkeen (18 AK; 2,7 nm), PPC-konfiguraatio toistetaan.
On vakautettu FAB ensisijaisesti vety- sidoksia ja toiseksi peptidi- ja disulfidisidoksia. Vety sidokset ovat 10-100 kertaa heikompia kuin tavalliset kemialliset sidokset; suuren määränsä ansiosta ne kuitenkin tarjoavat VSB: n tiettyä jäykkyyttä ja kompaktiutta. A-kierukan sivuttaiset R-ketjut ovat ulospäin ja sijaitsevat eri puolilla sen akselia.
b -rakenteen .
Nämä ovat PPC: n taitetut osat, jotka muistuttavat muodoltaan harmonikkaan taitettua lehteä. PPC-kerrokset voivat olla yhdensuuntaiset, jos molemmat ketjut alkavat N- tai C-päässä.
Jos kerroksen vierekkäiset ketjut on suunnattu vastakkaisten päiden N - С ja С - N suuntaan, niin niitä kutsutaan antiparalleelisesta.
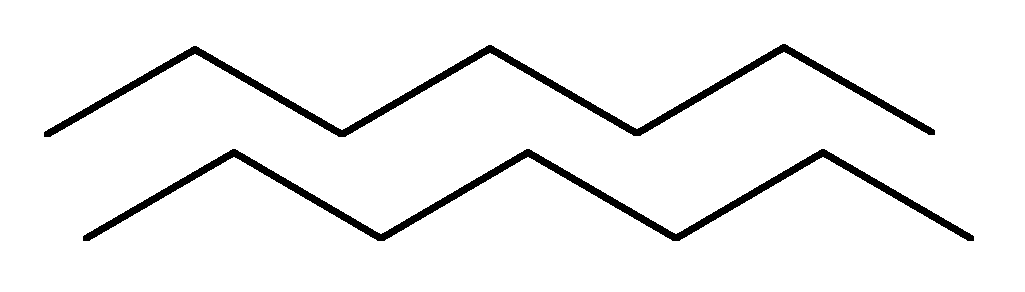 rinnakkainen
rinnakkainen
antiparalleelisesta
Vety- sidosten muodostuminen tapahtuu, kuten a-kierroksessa, CO– ja NH– ryhmien välillä.
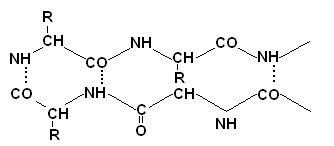
Proteiinien primaarirakenteen määrittäminen
Primaarisen rakenteen määrittämistä edeltää proteiinin poikittaisten disulfidisidosten denaturointi ja katkaiseminen. Tämä saavutetaan ylimäärällä merkaptoetanolia.
Kystiini muuttuu kahdeksi kysteiinitähteeksi, jotka sitten estetään ylimäärällä jodietikkahappoa S-S-sidosten käänteisen muodostumisen estämiseksi.
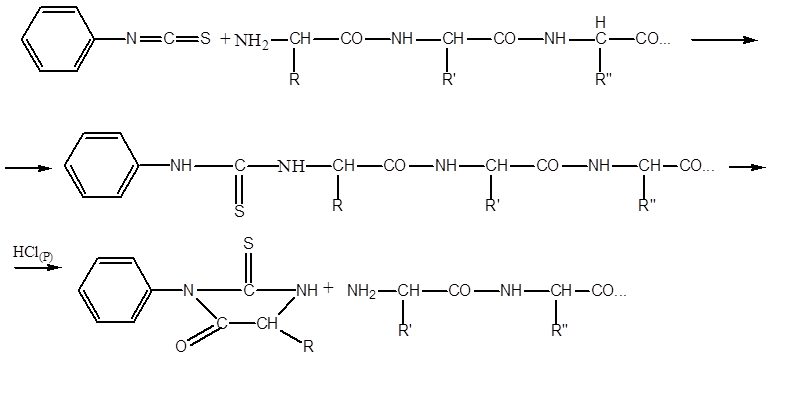
Polypeptidiketjun katkaisu fragmenteiksi suoritetaan yleensä käyttämällä proteolyyttisiä entsyymejä, kuten trypsiiniä, kymotrypsiiniä tai pepsiiniä. Nämä entsyymit vaikuttavat polypeptidiketjun eri osiin, koska niillä on lisääntynyt affiniteetti erilaisille aminohappotähteille. Tarvittavat aminohappotähteet, ts. hyökkätyn peptidisidoksen alueellinen ympäristö. Kävi ilmi, että trypsiini hydrolysoi vain ne peptidisidokset, joiden muodostukseen osallistuu lysiinin tai arginiinin karboksyyliryhmä, ja kymotrypsiini hydrolysoi sidoksia fenyylialaniinin, tryptofaanin ja tyrosiinin mukaan. Tyypillisesti proteolyyttiset entsyymit, jotka hydrolysoivat polypeptidiketjuja, esi-immobilisoidaan liukenemattomiin matriiseihin niiden erottamiseksi helpommin hydrolyysituotteista. Sitten määritetään kunkin polypeptidifragmentin aminohapposekvenssit. Tätä varten käytetään yleisimmin Edman-menetelmää, joka koostuu polypeptidin analyysistä vain N-päästä. Kun terminaalinen aminohappo saatetaan reagoimaan fenyyli-isotiosyanaatin kanssa alkalisessa väliaineessa, se muodostaa stabiilin yhdisteen, joka voidaan katkaista polypeptidistä ilman hajoamista. Aminohapon fenyylitiohydantoiini (FTG) -johdannainen tunnistetaan kromatografisella menetelmällä.
Kun terminaali N-aminohappotähde on tunnistettu, leima viedään seuraavaan aminohappotähteeseen, josta tulee terminaalinen. Edmanin menetelmä voidaan automatisoida sekvensserillä (englanniksi. jatko -sekvenssi), jolla FTG-johdannaiset pilkotaan polypeptidistä ja tunnistetaan korkean suorituskyvyn nestekromatografialla.
F. Sanger puristi ensimmäisen kerran kokonaan proteiinihormoninsuliinin primaarirakenteen Edman-menetelmällä.
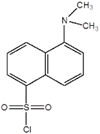
Toinen erittäin herkkä menetelmä on ns. Dansyylimenetelmä, joka liittyy dansyylikloridin (1-dimetyyliamino-naftaleen-5-sulfokloridin) lisäämiseen terminaaliseen aminohappoon seuraavan kaavion mukaisesti:
Proteiinin primaarirakenne voidaan epäsuorasti määrittää seuraavasti: ensin saadaan vastaava cDNA. Sitten tunnistetaan analysoituun proteiiniin liittyvä klooni ja proteiinin primaarirakenne määritetään siinä olevasta nukleotidisekvenssistä käyttämällä aminohapposekvenssikirjastoa.
Proteiinien sekundaarisen rakenteen määrittäminen
Optisia menetelmiä käytetään pääasiassa proteiinien sekundaarisen rakenteen määrittämiseen. Röntgendiffraktiomenetelmä on tietysti luotettavampi, mutta sen soveltaminen on tietyissä vaikeuksissa ja vaatii huomattavasti aikaa. Optiset menetelmät, kuten optisen rotaation dispergointi ja pyöreä dikroismi, ovat yksinkertaisempia ja, mikä tärkeintä, voivat määrittää proteiinin sekundaarisen rakenteen muutokset liuoksissa. Optisen pyörimisen dispersiota käyttämällä voidaan saada tietoa proteiinimakromolekyylin helikiteetin asteesta. Huolimatta siitä, että menetelmä on likimääräinen, spiraalikelamuutokset ovat melko selvästi näkyvissä. Ympyrän muotoisen dikroismin menetelmän suhteen sen spektri määräytyy kulmajoukkojen w ja q avulla, jotka ovat ominaisia \u200b\u200byhdelle tai toiselle sekundaarirakenteen tyypille. Molempia menetelmiä voidaan pitää seulonnana, ja sekundaarisen rakenteen täydelliseksi tunnistamiseksi ne on yhdistettävä proteiinien röntgenanalyysiin.
Proteiinit ovat suurimolekyylipainoisia orgaanisia yhdisteitä, monomeerisiä yksiköitä, jotka ovat a-aminohappoja, jotka on kytketty toisiinsa peptidisidoksella. luokitus:
- molekyylien muodossa (globaalit tai fibrillaariset); Fibrillaariproteiinit. Polypeptidiketjut ovat yhdensuuntaiset toistensa kanssa, pitkänomaiset ketjut muodostavat pitkiä juosteita tai kerroksia. Ne toimivat sidekudoksen tärkeimpänä orgaanisena materiaalina ja ovat lihaskuidun rakenneosa. Esimerkiksi kollageeni, elastiini. Globular proteiinit. Polypeptidiketjut taitetaan tiukasti kompakteiksi pallomaisiksi rakenteiksi (palloiksi). Ne ovat vesiliukoisia. Esimerkiksi entsyymit.
- molekyylipainon perusteella (pieni moolimassa, korkea moolimassa jne.);
- kemiallinen rakenne (ei-proteiiniosan olemassaolo tai puuttuminen);
- suoritetuista toiminnoista (kuljetus-, suoja-, rakenneproteiinit jne.);
- paikallistamalla soluun (ydin, sytoplasminen, lysosomaalinen jne.);
- paikallistamalla kehossa (veriproteiinit, maksa, sydän jne.);
Ensisijainen proteiinirakenne Onko aminohappotähteiden sekvenssi molekyylin polypeptidiketjussa, jotka on kytketty peptidisidoksilla.
Peptidisidokselle on tunnusomaista seuraavat ominaisuudet:
1) peptidisidoksen O- ja H-atomit orientoituvat;
2) peptidisidoksen neljä atomia sijaitsevat samassa tasossa, ts. peptidisidoksille on ominaista yhteinen tasoisuus;
3) peptidisidos proteiinimolekyylissä osoittaa keto-enolin tautomeroitumisen;
4) C-N-sidoksen pituudella, joka on yhtä suuri kuin 0,13 nm, on väliarvo kaksoiskovalenttisen sidoksen (0,12 nm) ja yksittäisen kovalenttisen sidoksen (0,15 nm) välillä, mikä tarkoittaa, että kierto C-N-akselin ympäri on vaikeaa;
5) peptidisidos on vahvempi kuin tavallinen kovalenttinen sidos, koska se on puolitoista (johtuen elektronien tiheyden uudelleen jakautumisesta).
Kullakin yksittäisellä proteiinilla aminohapposekvenssi polypeptidiketjussa on ainutlaatuinen. Se on geneettisesti määritetty ja puolestaan \u200b\u200bmäärää tietyn proteiinin korkeammat organisaatiotasot.
Aminohappotähtettä, joka sijaitsee ketjun päässä, jossa on vapaa aminoryhmä, kutsutaan aminoterminaaliksi tai N-terminaaliseksi ja jäännöstä toisessa päässä, jossa on vapaa karboksyyliryhmä, kutsutaan karboksipäätteeksi tai C-terminaaliksi. Polypeptidin nimi alkaa N-päässä.
Polypeptidiketjujen fragmentoituminen
kymotrypsiini, pilkkoo aromaattisten AA: n karboksiryhmien muodostamat peptidisidokset
T ripsinpilkkoo AA: n muodostamat peptidisidokset, jotka sisältävät kaksi aminoryhmää (lysiini, arginiini)
Bromocyan (CNBr) pilkkoo peptidisidokset, jotka on muodostettu metioniinin karboksyyliryhmän ja minkä tahansa muun AK: n aminoryhmän välillä.
Hydroksyyliamiini (NH2OH), hajottaa peptidisidokset, jotka on muodostettu asparagiinihapon ja glysiinin tähteiden väliin
N-bromisukkinamidi pilkkoo peptidisidokset, jotka on muodostettu tryptofaanin karboksyyliryhmän ja minkä tahansa muun AK: n aminoryhmän välillä.
Sekvinatory - automaattiset laitteet, jotka mahdollistavat Edman-menetelmän käytön (polypeptidien reaktio fenyyli-isotiosyanaatin kanssa) sellaisten peptidien primaarisen rakenteen tutkimiseksi, jotka sisältävät jopa useita kymmeniä aminohappotähteitä.
Fenyylitiohydantoiinimenetelmä Menetelmä proteiinin primaarisen rakenteen määrittämiseksi. Perustuu fenyyli-isotiosinaatin vuorovaikutukseen N-pään AK: n kanssa. Menetelmän ydin on prosessoida tutkittu peptidi spesifisellä reagenssisarjalla, mikä johtaa yhden aminohapon eliminointiin sekvenssin N-päästä. Reaktion syklinen toisto ja reaktiotuotteiden analyysi tarjoavat tietoa peptidin aminohappojen sekvenssistä.
Menetelmät proteiinien rakenteen tutkimiseksi
Täydellinen hydrolyysi joko emäksisissä tai happamissa olosuhteissa.
Happohydrolyysi suoritetaan 24 tunnin ajan lämpötilassa t \u003d 110 6-NHCl. Hydrolyysi- tuotteet erotetaan ioninvaihtokromatografialla (pylväässä) sulfonoidulla polystyreenillä. Aminohappofraktiointi: käyttämällä ninhydronia, aminohapon määrä määritetään värin perusteella. Sitten kukin aminohappo pestään ja määritetään fotometrisesti. Tällä tavalla voidaan tunnistaa kevyet aminohapot (sormenjäljet). Jos proteiinia 10 - 9 on pieni määrä, käytetään fluoresamiinireagenssia.
Aminohapposekvenssin määrittäminen.
Varmista, että ketju on yksi.
1.Senger-menetelmä:objektiivisoida. yksi AK N-päätteellä
Voi käyttää dansyylikloridia
(samoin kuin edellisellä alueella vain kloorilla)
2. Edmanin menetelmä - antaa sinun määrittää kymmeniä aminohappoja N-päästä
Edman suunnitteli sekvensserin. proteiini asetetaan ohuena kalvona pyörivään sylinteriin. suonen, jossa se läpi pilkkoa. Koodattu 60 aminohappoa valaan myoglobiinin N-päästä.
3. Ensimmäisen aminohapon määritelmä hydratsiinin päässä.
4. Karboksipeptidaasientsyymi voidaan pilkkoa peräkkäin ensimmäisessä aminohapossa C-päästä.Käytetään pienten polypeptidien (enintään 100) määrittämiseen
Jos yli 100.
Trepsin- katkaisee peptidisidokset, jotka on muodostettu emäksisten aminohappojen - lysiinin ja argeniinin - C-päällä.
Hemotrepsin- katkaisee peptidisidoksen aromaattisten ja dikarboksyylihappojen päästä.
Erotettu kromatografisesti, alkaa määrittää. Ota jälleen osa polypeptidistä. Liuotetaan toisella tavalla, käyttämällä kemiallista reagenssia, syanogeenibromidia - pilkkomista metyyliamiinin C-päästä. Katso, päällekkäisiä osioita verrataan.
hydroksyyliamiini–NH2OH - katkaisee asparagiini-glysiinisidoksen.
2-nitro-5-tiosyanobentsoaatti - pilkkoo missä kystoiinin aminoryhmä.
1953 - insuliini on ensimmäinen sekvenssi. Immunoglobuliini (4 polypeptidiketjua) on suurin 1300 aminohappotähde.
Proteiineissa kaikki aminohapot voidaan määrittää.
Sormenjälkimenetelmä
Bromcian katkaisee metamiinin C-päästä (90%HCOOH)
Sekvensointia tarvitaan:
1) Tunnistaa bioolin molekyylipohja. aktiivisuutta.
2) Kuinka primaarirakenne vaikuttaa toiseen, tertiääriseen ja kvaternääriseen.
3) Järjestyksen muutos voi johtaa sairauteen (perinnöllinen).
4) Proteiinisekvenssitiedot voivat kertoa paljon evoluutiosta.
2 RNA
RNA- H3P04; riboosi; adeniini; guaniini; sytosiini; urasiili
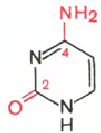
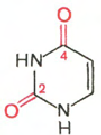
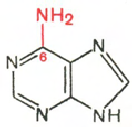
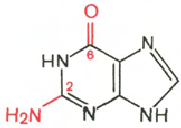
Sytosiini Uracil Adenine Guanine
Hiilihydraatit (riboosi ja deoksiribroosi) DNA- ja RNA-molekyyleissä ovat β-D-ribofuranoosimuodossa:
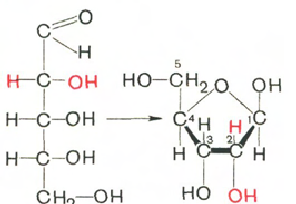
D-riboosi β-D-ribofuranoosi
RNA: n määrästä ei ole tarkkoja tietoja, koska sen pitoisuus eri soluissa määräytyy suurelta osin proteiinisynteesin voimakkuuden perusteella. RNA: n osuus on noin 5–10% koko solumassasta. Eri tyyppisten solu-RNA: n nykyinen luokittelu perustuu topografian, funktion ja molekyylipainon tietoihin. Erotellaan kolme päätyyppiä RNA: matriisi (informatiivinen) - mRNA, joka muodostaa 2 - 3% kaikista solujen RNA: sta; ribosomaalinen - rRNA, joka käsittää 80 - 85% ja kuljetus - tRNA, joka on noin 16%. Nämä 3 lajia eroavat nukleotidikoostumuksesta ja toiminnoista.
Matriisin RNA muodostui transkription aikana. Siinä on tarkka kopio tiettyyn DNA-osaan koodatuista geneettisistä tiedoista, nimittäin proteiinien aminohappojen sekvenssistä.
Matriisi-RNA (mRNA) syntetisoidaan ytimessä DNA-matriisin kanssa, sitten se tulee ribosomiin suorittamalla matriisitoiminto proteiinisynteesissä. Kun mRNA tulee sytoplasmaan ytimestä, se muodostaa komplekseja spesifisten RNA: ta sitovien proteiinien kanssa - ns. Informaattiset atomit, jotka kykenevät palautuvaan dissosiaatioon. Informosomeja pidetään mRNA: n kuljetusmuotona, joka edistää polyribosomien muodostumista sytoplasmassa.
Kuljetus RNA
(tRNA: t) on pieni molekyylipaino ja ne sisältyvät sytoplasman liukoiseen fraktioon suorittaen aminohappojen siirtämisen tehtävä proteiinisynteesin paikkaan - ribosomiin. TRNA-molekyyli on yksi itsestään kierretty polynukleotidiketju. Kaikki tRNA: t on rakennettu yhden suunnitelman mukaan, ne kaikki sopivat apilalehden malliin. Pääperiaate on maksimaalisen määrän vety sidosten muodostuminen typpipitoisten emästen välille. Apilalehti sisältää viisi spiraalivarret, joista neljä päättyy parittomien nukleitidien silmukoihin. Molekyylin keskellä on kääritty alue. 3 'ja 5' - polynukleotidiketjun päät on muodostettu pariksi muodostamaan hyväksyvä varsi. Kestää hyväksyvän varren antikodonivarren. Siinä on antikodonisilmukka, joka koostuu 7 nukleotidistä. Antikoodisilmukka sisältää keskiosassaan antikodonin, joka koostuu 3 nukleotidistä, jotka ovat komplementaarisia tietyn aminohapon kodonille mRNA: ssa. T-varren kantama pseudouridiinisilmukka sisältää alakomponentin pseudouridiinin. Se koostuu 7 nukleotiditähteestä. Uskotaan, että tRNA on vuorovaikutuksessa ribosomin kanssa juuri tämän silmukan kanssa. D– varsi kantaa silmukkaa, jossa on 8–12 nukleotidia. Tämä on dihydrouridiinin silmukka, se sisältää aina useita tähteitä dihydrouridiinin vähäisemmästä komponentista. 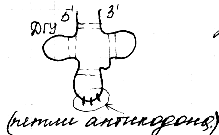
Ribosomaalinen RNA - pohja, jolla proteiinit sijaitsevat, muodostaen ribosomin. Ribosomit sijaitsevat pääasiassa sytoplasmassa, lisäksi mitokondrioiden ja kloroplastien ytimessä. Nukleotidikoostumus on samanlainen: guanyylinukleotidit ovat vallitsevia, uridyyli- ja sytidyylimolekyylit ovat pieniä määriä, ei ole pienempiä emäksiä. Ribosomit jaetaan kooltaan ja molekyylipainolta:
Bakteeriset ribosomit (suhteellisen pienet). Sedimentaatiovakio 70S.
Eukaryoottisolujen ribosomit. Sedimentaatiovakio 80S.
Mitokondrioiden ja kloroplastien ribosomit.
RNA: n hydrolyysissä muodostuu riboosi, adeniini, guaniini, urasiili, sytosiini, fosforihappo.
