Solussa on kolme aminohappolähdettä - verenhuolto, solunsisäisten proteiinien hajoaminen ja ei-välttämättömien aminohappojen synteesi.
Reitti aminohappojen muuntamiseksi edelleen riippuu solun tyypistä ja toiminnasta, sen olemassaolon olosuhteista ja hormonaalisista vaikutuksista. Aineiden valikoima, jonka solu saa aminohapoista, on erittäin laaja.
Solun aminohappojen muuntoreaktiot jaetaan tavanomaisesti kolmeen osaan reagoivasta ryhmästä riippuen:
1. sivuketjua pitkin (radikaali):
Aminohapot voivat antaa energiaa
Koska vartalo sisältää 20 proteinogeenistä ja vielä enemmän ei-proteinogeenistä aminohappoa, jotka eroavat toisistaan \u200b\u200bsivuradikaalin rakenteessa, niiden sivuryhmän katabolismille on samanlainen määrä spesifisiä reittejä. Mutta silti kaikki nämä polut sulautuvat yhteen ja muuttuvat yhdeksi kuudeksi tuotteeksi, jotka tulevat keskuslämmityskompleksiin ja hapettuvat kokonaan hiilidioksidiksi ja vedeksi vapauttaen energiaa. Aminohappojen osuus kehossa tuotetusta kokonaismäärästä on noin 10%.

Tietyissä olosuhteissa aminohappojen hiilirunko ei hajoa, mutta osallistuu hiilihydraattien (glukogeeniset aminohapot) ja lipidien (ketogeeniset aminohapot) synteesiin.
Glukogeenisiin aminohappoihin sisältyy (suurin osa niistä), joiden hajoamisen aikana muodostuu pyruvaatti- ja CTK-metaboliitteja, esimerkiksi oksaaloasetaatti tai a-ketoglutaraatti.
Lysiini ja leusiini ovat tiukasti ketogeenisiä, kun ne hapetetaan, muodostuu vain asetyyli-S-CoA. Hän osallistuu ketonirunkojen, rasvahappojen ja kolesterolin synteesiin.
Eristetään myös pieni ryhmä sekoitettuja aminohappoja, joista muodostuu pyruvaatti, CTK: n metaboliitit ja asetyyli-S-CoA (fenyylialaniini, tyrosiini, isoleusiini, tryptofaani).
2. karboksyyliryhmän mukaan:
Neurotransmitterit muodostuvat aminohapoista
Neurotransmitterien synteesi aminohapoista liittyy ensisijaisesti aminohappojen osallistumiseen a-karboksyyliryhmän aineenvaihduntaan tai yksinkertaisemmin sen poistamiseen.
histamiini
Histamiinin muodostumisen reaktio tapahtuu aktiivisimmin keuhkojen, ihon, maksan, basofiilien ja eosinofiilien syöttösoluissa. Niissä histamiini syntetisoidaan ja kertyy erittyviin rakeisiin.

Histamiinin synteesireaktio
Histamiini vapautuu verenkiertoon kudosvaurioiden, sokin ja sähköisen ärsytyksen yhteydessä. Kliinisessä käytännössä histamiinin eritys liittyy yleensä allergioihin - kun antigeeni palautuu aiemmin herkistyneeseen elimeen, allerginen reaktio kehittyy.
Fysiologiset vaikutukset
valtimoiden ja kapillaarien laajeneminen ja seurauksena ihon punoitus, alentaen verenpainetta;
kapillaariseinämän läpäisevyyden lisääminen ja sen seurauksena nesteen poistuminen solujen väliseen tilaan (turvotus), alentaen verenpainetta;
jos edelliset kohdat tapahtuvat aivoissa - kallonsisäisen paineen nousu;
lisää keuhkoputkien sileiden lihasten sävyä seurauksena - kouristuksia ja tukehtumista;
lisää hieman ruoansulatuskanavan lihasväriä;
stimuloi syljen ja mahamehun eritystä.
serotoniinin
Serotoniini syntetisoidaan aktiivisesti ihon, keuhkojen, maksan, pernan ja keskushermoston syöttösoluissa.
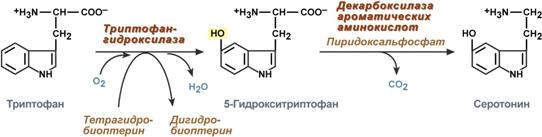
Serotoniinin synteesireaktiot
Fysiologiset vaikutukset
stimuloi maha-suolikanavan sileiden lihasten vähentymistä ja sen seurauksena lisääntynyttä ruuansulatuskanavan liikkuvuutta;
stimuloi selvästi verisuonten sileiden lihasten supistumista, paitsi sydänlihaksen ja luustolihasten verisuonia, ja seurauksena verenpaineen nousua;
lisää hieman keuhkoputkien sileiden lihasten sävyä;
keskushermostossa on estävä välittäjä;
ääreishermostossa aiheuttaa kipua ja kutinaa (esimerkiksi hyönteisten puremalla).
Gamma aminovoihappo
Γ-aminovoihapon (GABA) synteesi tapahtuu yksinomaan keskushermostossa - aivojen subkortisissa muodostelmissa.

GABA-synteesireaktio
Fysiologiset vaikutukset
Keskushermostossa GABA (yhdessä glutamiinihapon kanssa) on estävä välittäjä. Sen tärkein rooli on ajallisessa ja edessä olevassa aivokuoressa, hippokampuksessa, amygdala- ja hypotalamuksen ytimissä ,rodia nigrassa ja pikkuaivoissa.
Dopamiinisynteesi tapahtuu pääasiassa diencephalonin ja keskiaivojen neuroneissa.

Dopamiinin synteesireaktiot
Fysiologiset vaikutukset
Se välittää dopamiinireseptoreita keskushermoston subkortikaalisissa muodostelmissa, suurina annoksina se laajentaa sydämen verisuonia, stimuloi sydämen supistumisten tiheyttä ja voimakkuutta, laajentaa munuaisten verisuonia lisäämällä diureesia.
Ravinneamiinien hävittäminen
Ravinneamiinien inaktivointia on kahta tyyppiä - deaminointi ja metylaatio.
Deaminointi etenee vapaan ammoniakin muodostumisesta ja FAD: n osallistumisella. Se katalysoi monoaminioksidaasin reaktiota, sitä on monissa kudoksissa, mutta se on aktiivisin maksassa, vatsassa, munuaisissa, suolissa ja hermostossa.
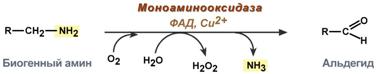
Monoaminioksidaasireaktio
Biogeenisen amiinin metylaatio tapahtuu, kun siinä on hydroksyyliryhmä (dopamiini, serotoniini). Reaktio osallistuu metioniinin - S-adenosyylimetioniinin (SAM) aktiiviseen muotoon, muodostetaan amiinin metyloitu muoto ja S-adenosyylihomosysteiini (SAG).
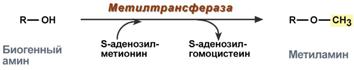
Metylointireaktio
3. aminoryhmän osallistumisella:
Deaminointia on 4 tyyppiä
Aminohappojen konversio NH2-ryhmän osallistumisen myötä vähenee sen pilkkomiseksi hiilirungosta - deaminaatioreaktio.
Deaminaation tyypit
intramolekulaarinen - tyydyttymättömien rasvahappojen muodostuessa:

pelkistäminen - muodostuessa tyydyttyneitä rasvahappoja:
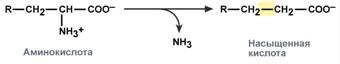
hydrolyyttinen - muodostaen karboksyylihydroksihappoa:
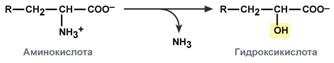
hapettava - ketohappojen muodostuessa:

Ihmisillä oksidatiivinen deaminaatio on aminohappokatabolismin pääreitti. Aminohapot, kuten seriini ja histidiini, voivat kuitenkin menettää aminoryhmän käyttämällä muun tyyppisiä deaminaatioita, ja treoniini pilkotaan välittömästi suoralla glysiinillä ja asetaldehydillä.
Aminohapot on kuljetettava kalvojen yli
Aminohappojen siirto solukalvojen läpi sekä imeytymisen aikana suoliston onteloista soluihin että siirron aikana verestä eri kudosten soluihin tapahtuu käyttämällä kahta mekanismia: sekundaarinen aktiivinen kuljetus ja glutationiisi kuljetusjärjestelmä.
Aminohappojen kuljetus kalvoissa
Toissijainen aktiivinen kuljetus
Toissijainen aktiivinen kuljetus on aineiden, tässä tapauksessa aminohappojen, kuljetusta käyttämällä natriumpitoisuusgradienttia solukalvon sisä- ja ulkopinnan välillä.
Toissijainen aktiivinen kuljetus perustuu pienen pitoisuuden natriumionien käyttämiseen soluissa, jotka on luotu kalvoentsyymi Na +, K + -ATPaasi. Spesifinen kuljetusproteiini sitoo aminohappoa ja natriumionia enterosyyttien apikaalisella pinnalla. Tärkeä asia on, että natriumin puuttuessa aminohappo ei kykene ottamaan yhteyttä kantajaproteiiniin.
Sitten, muuttamalla sen asemaa kalvossa, proteiini antaa natriumionia sytosolille pitoisuusgradientissa. Heti tämän jälkeen aminohappo menettää sidoksensa proteiiniin ja pysyy sytoplasmassa.
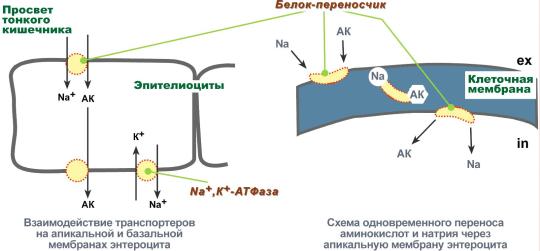
Aminohappojen sekundaarinen aktiivinen kuljetus kalvojen läpi
Tällä hetkellä on 5 kuljetusjärjestelmää:
suurille neutraaleille, mukaan lukien alifaattiset ja aromaattiset aminohapot,
pienille neutraaleille - alaniini, seriini, treoniini,
emäksisille aminohapoille - arginiinille ja lysiinille,
happamille aminohapoille - aspartaatti ja glutamaatti,
pienille aminohapoille - glysiini, proliini ja oksiproliini.
Glutationi kuljetusjärjestelmä
Toinen menetelmä aminohappojen siirtämiseksi soluun tapahtuu kompleksi glutationin kanssa käyttämällä entsyymiä y-glutamyylitransferaasia.
Glutationiaminohappokuljetus

Tämän järjestelmän mukaan tiettyjen aminohappojen (yleensä neutraalien) kantaja on glutationitripeptidi (y-glutamyylisysteyliglysiini). Kun glutationi vuorovaikutuksessa solukalvon ulkopuolella olevan aminohapon kanssa osallistuu glutamyylitransferaasiin. Y-glutamyylitähde sitoo aminohappoa ja se liikkuu solun sisällä. Sitten glutatiooni hajoaa aineosiinsa. Aminohapon erottamisen jälkeen tapahtuu glutationin uudelleen synteesi.
Ammoniakkia muodostuu jatkuvasti soluihin.
Ammoniakkia muodostuu jatkuvasti kehon kaikissa elimissä ja kudoksissa. Sen aktiivisimmat veren tuottajat ovat elimiä, joissa on suuri aminohappojen ja biogeenisten amiinien vaihto - hermokudos, maksa, suolet, lihakset.
Tärkeimmät ammoniakin lähteet
Tärkeimmät ammoniakin lähteet ovat seuraavat reaktiot:
tiettyjen aminohappojen (seriini, treoniini, histidiini) ei-oksidatiivinen deaminaatio maksassa,
glutamiinihapon oksidatiivinen deaminaatio kaikissa kudoksissa (paitsi lihaksissa), erityisesti maksassa ja munuaisissa,
glutamiinihappojen ja asparagiinihappojen amidien deaminointi - maksassa ja munuaisissa,
biogeenisten amiinien katabolismi - kaikissa kudoksissa, enimmäkseen hermokudoksessa,
paksusuolen bakteerien elintärkeä aktiivisuus,
puriini- ja pyrimidiiniemästen hajoaminen - kaikissa kudoksissa.
Ammoniakin sitominen
Koska ammoniakki on erittäin myrkyllinen yhdiste, kudoksiin liittyy useita ammoniakkia sitovia (neutraloivia) reaktioita - glutamiinihapon ja glutamiinin synteesi, asparagiinin synteesi, karbamoyylifosfaatin synteesi:
glutamiinihapposynteesi (pelkistävä aminointi) - a-ketoglutaraatin vuorovaikutus ammoniakin kanssa. Reaktio on olennaisesti päinvastainen kuin oksidatiivinen deaminaatio, mutta NADPH: ta käytetään koentsyyminä. Sitä esiintyy melkein kaikissa kudoksissa paitsi lihaksessa, mutta sillä ei ole merkitystä, koska glutamaattidehydrogenaasin tapauksessa edullinen substraatti on glutamiinihappo ja reaktion tasapaino siirtyy kohti a-ketoglutaraattia,
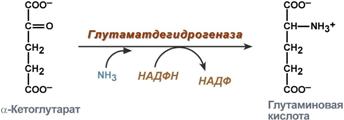
Glutamiinihapon synteesireaktio
glutamiinin synteesi - glutamaatin vuorovaikutus ammoniakin kanssa. Se on tärkein tapa poistaa ammoniakki; se on aktiivisin hermo- ja lihaskudoksissa, munuaisissa, verkkokalvossa ja maksassa. Reaktio etenee mitokondrioissa.
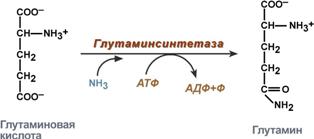
Glutamiinin synteesireaktio
Suuren määrän glutamiinin muodostuminen tarjoaa korkeat pitoisuudet veressä (0,5 - 0,7 mmol / l).
Koska glutamiini tunkeutuu solukalvojen läpi helpottamalla diffuusiota, se pääsee helposti paitsi maksasoluihin, myös muihin soluihin, joissa aminoryhmiä tarvitaan. Solut käyttävät glutamiinilla kuljetettua typpeä puriini- ja pyrimidiinirenkaiden, guanosiinimonofosfaatin (GMF), asparagiinin, glukosamiini-6-fosfaatin (kaikkien muiden aminosokereiden edeltäjä) syntetisoimiseksi.
asparagiinin synteesi - aspartaatin vuorovaikutus ammoniakin kanssa. Se on toissijainen tapa poistaa ammoniakki, se on energian kannalta epäedullinen, koska samaan aikaan käytetään 2 makroergistä sidosta,
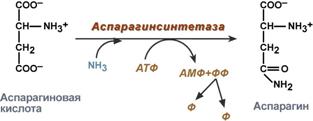
Asparagiinin synteesi
karbamoyylifosfaatin synteesi maksan mitokondrioissa - reaktio on ensimmäinen ureasynteesin prosessissa, keino poistaa ammoniakki kehosta.
Ammoniakin kuljetus
Kudoksista maksaan kulkevat ammoniakin kuljetusmuodot ovat glutamiini ja alaniini, pienemmässä määrin asparagiini ja glutamaatti, tietty määrä ammoniakkia on veressä vapaassa muodossa. Glutamiini ja alaniini ovat edustettuina eniten, niiden osuus kaikista veren aminohapoista on jopa 50%. Suurin osa glutamiinista tulee lihaksista ja hermokudoksesta, alaniini kuljettaa ammoniakkia lihaksista ja suolen seinämästä.
Glukoosi-alaniinisykli
Lihaksissa pyruvaatti on ylimääräisen aminitypen pääasiallinen vastaanottaja. Lihasten proteiinikatabolismin aikana tapahtuu aminohappojen transaminoituminen, muodostuu glutamaatti, joka siirtää sitten aminotypen pyruvaattiin ja muodostuu alaniini. Veri lihaksista alaniini siirtyy maksaan, missä käänteisessä reaktiossa se siirtää aminoryhmänsä glutamaattiin. Saatua pyruvaattia käytetään substraattina glukoosin synteesireaktioissa (glukoneogeneesissä), ja glutamiinihappo deaminoidaan, ja ammoniakkia käytetään urean synteesissä.
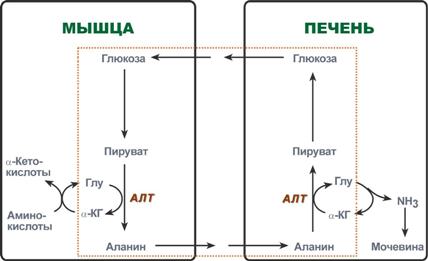
Glukoosiallaniinisyklin reaktiot (korostettu ruudussa).
Ammoniakin kuljetusmuotoihin liittyvät reaktiot
Kohde-elimet ammoniakin kuljetukseen ovat maksa, munuaiset ja suolet.
Maksassa:
asparagiini ja glutamiini deaminoidaan vastaavasti asparaginaasilla ja glutaminaasilla, saatua ammoniakkia käytetään urean syntetisointiin,
alaniini tulee transaminointireaktioon α-ketoglutaraatin kanssa,
glutamiinihapolla tapahtuu oksidatiivinen deaminaatio.
Suolistossa osa glutamiinista deaminoi glutaminaasi. Tämän jälkeen muodostunut ammoniakki vapautuu suolimen luumeniin (enintään 5%) tai kulkee verisuonen veren kautta maksaan, ja glutamaatti siirtyy transaminointiin pyruvaatin kanssa, minkä seurauksena aminotyppi kulkee alaniiniin ja myös maksaan,
Munuaisissa muodostuu ammoniumsuoloja käyttämällä glutamaattia, glutamiinia ja asparagiinia.
Ammoniakin kertyminen on ongelma
Ammoniakki on myrkyllinen yhdiste, jota löytyy verestä suhteellisen pieninä pitoisuuksina (11,0-32,0 μmol / l). Ammoniakkimyrkytysoireet ilmenevät, kun nämä rajat ylitetään vain 2–3 kertaa. Suurin sallittu ammoniakkitaso veressä on 60 μmol / L. Kun ammoniakkipitoisuus (hyperammonemia) nousee raja-arvoihin, koomaa ja kuolemaa voi esiintyä. Kroonisessa hyperammonemiassa kehittyy henkinen viivästyminen.
Ammoniakin toksiset hypoteesit
Ammoniakin toksisuus johtuu seuraavista olosuhteista:
1. Ammoniakin sitoutuminen glutamaatin synteesiin aiheuttaa α-ketoglutaraatin poistumisen trikarboksyylihapposyklistä, kun taas ATP-energian muodostuminen vähenee ja soluaktiivisuus huononee.
2. Ammoniumionit NH4 + aiheuttavat veriplasman alkaloitumista. Samanaikaisesti hemoglobiinin affiniteetti happea kohtaan kasvaa (Bor-vaikutus), hemoglobiini ei anna happea kapillaareissa, seurauksena soluhypoksia.
3. Vapaan NH4 + -ionin kertyminen sytosoliin vaikuttaa kalvopotentiaaliin ja solunsisäisten entsyymien toimintaan - se kilpailee ionipumppujen kanssa Na +: sta ja K +: sta.
4. Tuote ammoniakin sitoutumisesta glutamiinihappoon - glutamiiniin - on osmoottisesti aktiivinen aine. Tämä johtaa veden pidättämiseen soluissa ja niiden turvotukseen, mikä aiheuttaa kudoksen turvotusta. Hermokudoksen tapauksessa tämä voi aiheuttaa aivoödeeman, kooman ja kuoleman.
5. α-ketoglutaraatin ja glutamaatin käyttö ammoniakin neutraloimiseksi aiheuttaa heikentyneen hermostoa estävän välittäjän γ-aminovoihapon (GABA) synteesi.
Perinnölliset ja hankitut hyperammonemian muodot
Hankitut lomakkeet
Hankittu (toissijainen) hyperammonemia kehittyy maksasairauksien ja virusinfektioiden seurauksena. Äärimmäisissä vaikeissa tapauksissa se ilmenee pahoinvointina, oksenteluna, kouristuksina, epäselvänä puheena, näön hämärtymisenä, vapinaina, heikentyneenä liikkeiden koordinaationa.
Perinnölliset muodot
Hyperammonemian perinnölliset muodot johtuvat geneettisestä puutteesta missä tahansa viidestä urea-synteesientsyymistä. Entsyymin mukaan tauti on jaettu viiteen tyyppiin. Hyperammonemian ensisijaiset merkit ovat uneliaisuus, ruuan kieltäytyminen, oksentelu, ahdistus, kouristukset, heikentynyt liikkeiden koordinointi, takypnea, hengitysteiden alkaloosi. Maksan vajaatoiminta, keuhko- ja kallonsisäinen verenvuoto voi kehittyä.
Yleisin on tyypin II hyperammonemia, johon liittyy opuute. Tauti on taantumaton, liitetty X-kromosomiin. Äidillä on myös hyperammonemia ja vastenmielisyys proteiinituotteille. Täydellisellä entsyymivirheellä perinnöllinen hyperammonemia alkaa varhain (jopa 48 tuntia syntymän jälkeen).
Taudin laboratoriokriteeri on glutamiinin (vähintään 20 kertaa) ja ammoniakin kertyminen vereen, selkäydinnesteeseen ja virtsaan.
Hyperammonemian hoidon perustana on proteiinin rajoittaminen ruokavaliossa. Tämä auttaa jo estämään monia aivojen toiminnan häiriöitä.
Urean synteesi
Maassa kaikki poistettu ammoniakki käytetään urean syntetisointiin. Ureasynteesin lisääntymistä havaitaan kudosproteiinien ja typpiyhdisteiden hajoamisella (nälkä, tulehdukselliset prosessit, diabetes mellitus) tai liiallisella proteiiniravinnolla. Imeväisillä ja lapsilla ureasynteesiä voidaan vähentää kahdesta syystä: maksan epäkypsyydessä ja proteiinien ja nukleiinihappojen aktiivisessa synteesissä kehon kasvun kanssa.
Ureasynteesireaktiot ovat syklisiä prosesseja, joita kutsutaan ornitiinisykliksi. Ureasynteesi alkaa mitokondrioissa (ensimmäinen ja toinen reaktio), loput kolme reaktiota tapahtuvat sytosolissa. Sitrulliinin ja ornitiinin siirtämiseksi mitokondriaalikalvon läpi on erityisiä kantajia.
Ornitiinisyklin sivutuotteena muodostuu fumaarihappo, joka siirretään takaisin mitokondrioihin. Tässä CTK: n reaktioissa muodostuu siitä oksoasetaattia, joka transaminoidaan glutamaatin kanssa aspartaatiksi, menee sytosoliin ja reagoi jälleen sitrulliinin kanssa.
Yhden ureamolekyylin, 1 NH4 + -molekyylin, 1 CO2-molekyylin, 1 asparagiinihappomolekyylin aminoryhmän muodostuksessa osallistuu kolmen ATP-molekyylin 4 makroerginen sidos.

Kreatiinifosfaatti - kiireellinen energiavaranto
Kreatiini on luurankojen lihaksen, sydänlihaksen ja hermokudoksen aine. Kreatiinifosfaatin muodossa kreatiini on makroergisten sidosten "varasto", jota käytetään ATP: n nopeaan uudelleen synteesiin solutyön aikana.

Kreatiinifosfaatin käyttö ATP-synteesiin
Erityisesti paljastaa kreatiinin rooli lihaskudoksessa. Kreatiinifosfaatti aikaansaa ATP: n uudelleen synteesin ensimmäisissä sekunteissa (5-10 sekuntia), kun ei anaerobista glykolyysiä eikä glukoosin ja rasvahappojen aerobista hapettumista ole aktivoitu ja lihaksen verenkiertoa ei ole lisätty. Hermokudossoluissa kreatiinifosfaatti tukee solujen elinkelpoisuutta hapen puuttuessa.
Lihasten työn aikana sarkoplasmisesta retikulumista vapautuneet Ca2 + -ionit ovat kreatiinkinaasin aktivaattoreita. Reaktio on edelleen mielenkiintoinen, koska sen esimerkillä voidaan havaita käänteinen positiivinen suhde - entsyymin aktivointi reaktiotuotteen kreatiinilla. Tämä välttää reaktionopeuden laskun työn aikana, jonka pitäisi tapahtua toimivien massojen lain mukaan, koska kreatiinifosfaatin pitoisuus laskee työlihaksissa.
Noin 3% kreatiinifosfaatista muuttuu jatkuvasti kreatiniiniksi ei-entsymaattisessa defosforylaatiossa. Terveen ihmisen erittelemä kreatiniinimäärä päivässä on aina melkein sama ja riippuu vain lihasmassasta.

Kreatiinifosfaatin kreatiniinin muodostuminen
Kreatiinisynteesi tapahtuu peräkkäin munuaisissa ja maksassa kahdessa transferaasireaktiossa. Synteesin lopussa kreatiini, jolla on verenvirtaus, toimitetaan lihaksiin tai aivoihin.


Munuaisten ja maksasynteesireaktiot
Täällä se fosforyloituu ATP-energian läsnä ollessa (lepotilassa tai lepoaikana) kreatiinifosfaatin muodostuessa.
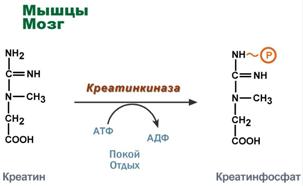
Kreatiinifosfaatin synteesi
Jos kreatiinin synteesi on ennen sen kiinnittymistä lihaskudokseen, kehittyy kreatinuria - kreatiinin esiintyminen virtsassa. Fysiologista kreatinuriaa havaitaan lapsen ensimmäisinä vuosina. Joskus fysiologiseen sisältyy ikääntyneiden kreatinuria, joka tapahtuu lihasten surkastumisen ja maksassa muodostuneen kreatiinin puutteellisen käytön seurauksena. Lihasjärjestelmän sairauksissa (myopatian tai progressiivisen lihasdystrofian kanssa) korkeimmat kreatiinipitoisuudet, patologinen kreatinuria, havaitaan virtsassa.
kirjallisuus
Proteiinia muodostavien aminohappojen biosynteesin tapoja ( proteinogen-seen) ovat melko monimutkaisia, monipuolisia (sama aminohappo voidaan syntetisoida eri tavoin) ja voivat erota merkittävästi eri organismeista. Siitä huolimatta näissä prosesseissa on melko suuri määrä kuvioita, ja mukavuuden vuoksi kaikki 20 proteinogeenistä aminohappoa voidaan jakaa viiteen biosynteettiseen perheeseen. Samaan perheeseen kuuluville aminohapoille on läsnä yleisiä prekursoreita, jotka muodostuvat TCA: ssa glykolyysin aikana pentoosifosfaattipolkujen aikana.
Välttämättömät aminohapot syntetisoidaan käyttämällä melko yksinkertaisia \u200b\u200breaktioita, kun taas välttämättömien aminohappojen biosynteesi on erittäin monimutkaista. Valkoisille rotille välttämättömiä aminohappoja ovat: valiini, isoleusiini, leusiini, treoniini, metioniini, lysiini, fenyylialaniini, tryptofaani, histidiini ja arginiini. Ihmiskehossa ei myöskään syntetisoidu kahdeksan luetellusta aminohaposta. On edelleen kiistanalaista, ovatko histidiini ja arginiini välttämättömiä ihmisille.
Glutamaattiperheen aminohappojen biosynteesi . Tähän perheeseen kuuluvat: glutamaatti, glutamiini, proliini ja arginiini. Kaksi ensimmäistä aminohappoa muodostetaan a-ketoglutaraatista, ja aminoryhmät ovat peräisin ammoniakkimolekyyleistä (kuva 16.3). Proliini syntetisoidaan glutamaatista neljässä reaktiossa: glutamaatin g-karboksyyliryhmä reagoi ATP: n kanssa asyylifosfaatin muodostamiseksi. Jälkimmäinen pelkistetään NADPH: n osallistumisella aldehydiksi, ja sitten se muuttuu spontaanin dehydraation aikana sykliseksi yhdisteeksi - pyrroliinikarboksylaatiksi. Tätä tuotetta pelkistetään NADPH: n osallistumisella proliiniin (kuva 16.4).
Arginiinin synteesi (kuvio 16.5) suoritetaan myös glutamaatista, joka asetyloidaan ensin aminoryhmässä, ja sitten se käy läpi edellä kuvatut fosforylointi- ja hemaldehydinmuodostusreaktiot. N-asetyyliglutamaatin g-puolialdehydi ei kuitenkaan syklisoidu, kuten proliinin biosynteesireitillä, vaan transaminoi glutamaatin (Glu) osallistumisella. Tämän reaktion tuloksena muodostuu a-ketoglutaraatti (KG) ja N-asetyyliornitiini. Viimeksi mainitussa tehdään deasetylointi ornitiinin muodostuessa. Ornitiini muuttuu arginiiniksi useiden ureasyklissä esiintyvien reaktioiden aikana.
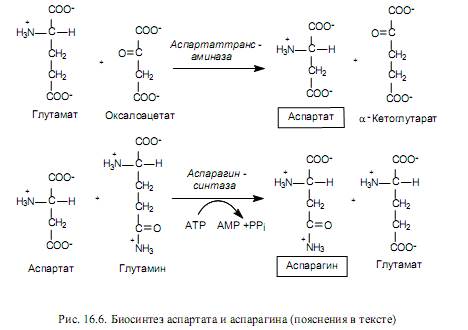
Aspartaattiperheen aminohappojen biosynteesi. Aspartaattiperheeseen kuuluvat: aspartaatti, asparagiini, lysiini, treoniini, isoleusiini ja metioniini. Viimeiset viisi aminohappoa tästä koostumuksesta syntetisoidaan aspartaatista, joka puolestaan \u200b\u200bmuodostetaan oksaaloasetaatista, CTK: n välituotteesta, transaminaatioreaktion aikana. Tässä tapauksessa glutamaatti toimii aminoryhmän luovuttajana (kuva 16.6).
Aspartaatti toimii edeltäjänä asparagiinin synteesille, ja monissa bakteereissa aspartaatti voidaan suoraan amiinoida ATP-riippuvaisessa reaktiossa, joka sisältää asparagiinisyntetaasin (16.2).
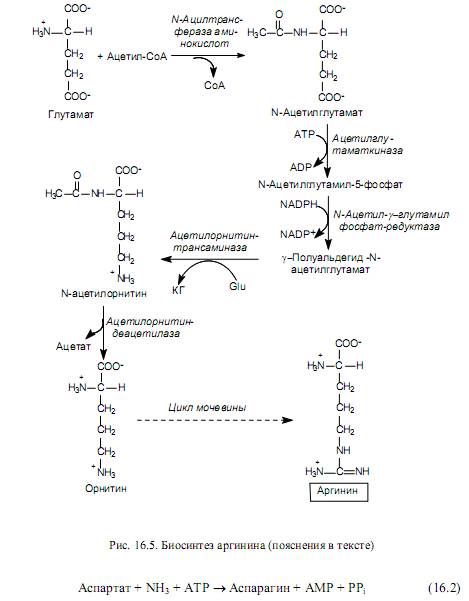
Nisäkässoluissa tapahtuu toinen reaktio (kuva 16.6), jossa glutamiini toimii aminoryhmän luovuttajana asparagiinin muodostumisen aikana.
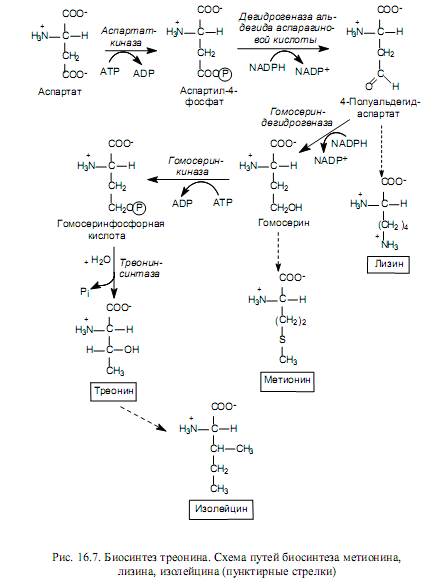
Lysiini, metioniini ja treoniini syntetisoidaan aspartaattijohdannaisista (kuva 16.7) ja isoleusiini treoniinista.
Lysiini bakteeri- ja kasvisoluissa syntetisoidaan asparagiinihapon semialdehydin ja pyruvaatin aldolikondensaation aikana, mitä seuraa pelkistys, sukkinaattijäännöksen lisääminen, transaminointi glutamaatin kanssa, molekyylin sisäinen uudelleenjärjestely ja dekarboksylointi. Sienisoluissa käytetään toista tapaa lysiinin biosynteesiin - a-ketoglutaraatista ja asetyyli-CoA: sta.
Metioniinin hiilirunko muodostetaan homoseriinista, rikkiatomi tulee kysteiinistä ja N-metyylitetrahydrofolihappo toimii metyyliryhmän luovuttajana.
Treoniini on lähde neljälle kuudesta hiiliatomista isoleusiinimolekyylissä. Synteesin ensimmäisessä vaiheessa treoniini deaminoidaan, muuttuu 2-ketobutyraatiksi, sitten se on vuorovaikutuksessa pyruvaatin kanssa, tapahtuu rakenteellisissa uudelleenjärjestelyissä ja transaminaatioreaktiossa, jossa glutamaatti toimii aminoryhmän luovuttajana.
Pyruvaattiperheen aminohappojen biosynteesi. Seuraavat yhdisteet syntetisoidaan pyruvaatista: alaniini, valiini ja leusiini.
Alaniini muodostuu transaminaatioreaktiossa, jossa glutamaatti toimii aminoryhmän luovuttajana (kuva 16.8). Valiinin ja leusiinin synteesillä on useita yhteisiä vaiheita ja se alkaa asetolaktaatin muodostumisella. Tämä metaboliitti muodostetaan kahdesta pyruvaattimolekyylistä: toinen niistä dekarboksyloidaan ja muodostunut aktiivinen asetaatti siirretään toiseen molekyyliin (kuva 16.8). Asetolaktaattisyntaasi katalysoi tätä reaktiota osallistumalla tiamiinipyrofosfaattiin. 2-asetolaktaatti pelkistetään dioksiisovaleriinihapoksi, johon liittyy metyyliryhmän kulkeutuminen. Dioksisovaleraatti dehydratoidaan 2-ketoisovaleraatiksi. Tämä tuote voidaan muuttaa valiiniksi transaminaatioreaktiossa, joka sisältää glutamaattia, samoin kuin kondensoida asetyyli-CoA: n kanssa, ja monien reaktioiden (isomerointi, pelkistys, dekarboksylointi, transaminointi) aikana, se voidaan muuntaa leusiiniksi. Glutamaatti on myös aminoryhmän luovuttaja leusiinin muodostuksessa (kuva 16.8).
Aminohappobiosynteesi. Perheeseen kuuluvat seriini, kysteiini ja glysiini. Näiden aminohappojen edeltäjä on 3-fosfoglyseraatti, glykolyysin välituote.
3-fosfoglysyraatti hapetetaan 3-fosfohydroksipyruvaatiksi ja sitten amiinoidaan glutamaatilla 3-fosfoseriiniksi ja defosforyloidaan seriiniksi (kuva 16.9). On olemassa vaihtoehtoinen tapa, kun fosfaattiryhmä poistetaan ennen hapettumisreaktiota:
3-fosfoglyseraatti → glyseraatti → hydroksipyruvaatti → seriini
Seriini toimii substraattina glysiinin ja kysteiinin synteesille. Glysiinin muodostumisen aikana seriinin sivuketjun b-hiiliatomi hyväksyy yksihiilifragmenttien kantajan - kofaktori-tetrahydrofolaattihapon osallistuessa seriini-hydroksimetyylitransferaasi-entsyymiin (kuva 16.9). On toinen tapa syntetisoida glysiini: hiilidioksidista, NH + 4: stä jata, jota katalysoi glysiinisyntaasi.

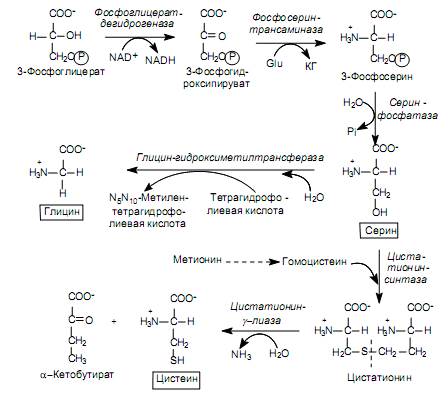
Seriinin muuttaminen kysteiiniksi liittyy sivuketjun happiatomin korvaamiseen rikkiatomilla, jonka luovuttaja on metioniini. Aluksi metioniini sarjassa ATP-riippuvaisia \u200b\u200breaktioita, joissa muodostuu sen aktivoitunut muoto (S-adenosyylimetioniini), menettää metyyliryhmän rikkiatomissa ja muuttuu homosysteiiniksi:
Sitten homokysteiini on vuorovaikutuksessa seriinin kanssa muodostaen kystationiinin, jonka kystationiini-g-lyaasi pilkoo kysteiiniksi ja a-ketobutyraatiksi (kuva 16.9).
Joillekin mikro-organismeille on olemassa vaihtoehto tapa syntetisoida kysteiini, jossa rikkiatomin luovuttajana on rikkivety. Tässä tapauksessa seriini asetyloidaan ensin asetyyli-CoA: lla (katalysoi seriini-transaasetylaasin reaktiota), ja sitten asetyyliseriini on vuorovaikutuksessa rikkivedyn kanssa O-asetyyliseriinisulfhydrolaasin osallistuttua:
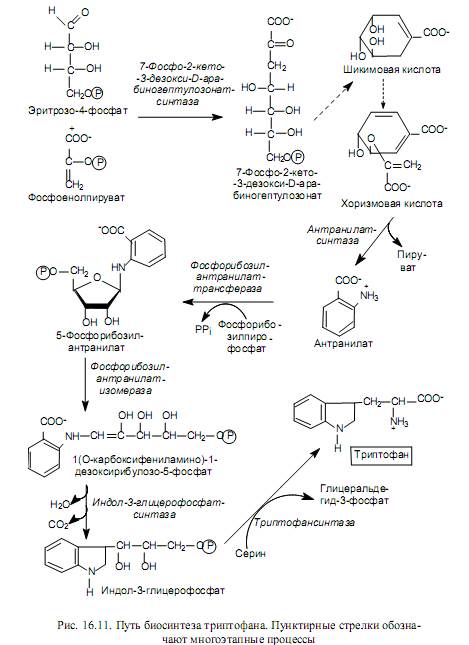
Pentoosiperheen aminohappojen biosynteesi. Tähän perheeseen kuuluvat aminohapot (histidiini, tryptofaani, fenyylialaniini ja tyrosiini) syntetisoidaan osallistumalla pentoosifosfaattireittien viiden hiilen välituoteyhdisteeseen - riboosi-5-fosfaattiin, jonka perusteella ne yhdistetään pentoosien perheeseen. Kuvassa 1 16.10 esittää riboosi-5-fosfaatin transformaatioreittejä, mikä johtaa yhdisteiden muodostumiseen, joista nämä aminohapot syntetisoidaan.
Histidiinin biosynteesin prosessi on melko monimutkainen ja se suoritetaan osallistumalla 5-fosforibosyyli-1-pyrofosfaattiin, ATP: hen ja glutamiiniin. Kuvassa 1 16.10 hiili- ja typpiatomien alkuperä esitetään histidiinimolekyylissä: imidatsolirenkaan yksi typpiatomi on peräisin glutamiinin amidiryhmästä, toinen typpiatomi ja yksi renkaan hiiliatomeista on peräisin ATP: stä, ja loput hiiliatomit ovat peräisin 5-fosforibosyyli-1-: sta. pyrofosfaatti.
Aromaattisten aminohappojen biosynteesi alkaa erytroosi-4-fosfaatin kondensaation vaiheesta fosfoenolipyruvaatin kanssa. Saatu puolihiiliyhdiste (7-fosfo-2-keto-3-deoksi-D-arabinoheptuloosinaatti) defosforyloidaan, syklisoidaan, dehydratoidaan ja pelkistetään NADPH: n osallistumisella shikimihappoon. Shikimiinihappo kondensoituu jälleen fosfoenolipyruvaatin kanssa ja sen jälkeen kun fosforihappotähde on eliminoitu, muuttuu korismihapoksi (kuva 16.11). Horisontti on tryptofaanin biosynteesireitin pääesine, joka on esitetty kuvassa. 16.11.
Koriishappoa käytetään myös fenyylialaniinin synteesissä, toisin sanoen muodostumisvaiheessa kahden välttämättömän aromaattisen aminohapon - tryptofaanin ja fenyylialaniinin - biosynteesissä (tästä johtuu kuorismaatin nimi, joka tulee kreikan sanasta "haarukka").
Fenyylialaniini muodostuu kolmen peräkkäisen reaktion aikana: koorismaatin isomerointi prefenaatiksi, prefenaatin dehydratointi ja dekarboksylointi fenyylipyruvaatiksi ja fenyylipyruvaatin transaminointi glutamaatin osallistumisella.
Korvattava happotyrosiini voidaan syntetisoida fenyylialaniinista hydroksyloimalla fenyylialaniini-4-monoksigenaasilla, samoin kuin prefeenihapolla sen dekarboksyloinnin ja aminoinnin jälkeen.

Aminohappojen biosynteesin mallit . Katsaus proteinogeenisten aminohappojen patogeenibiosynteesiin paljastaa näiden prosessien seuraavat peruslait: 1) aminohappojen hiilirungot ovat peräisin glykolyysin välituotteista (3-fosfoglyseraatti, fosfoenolipruvaatti, pyruvaatti), pentoosifosfaattireitit (riboosi-5-fosfaatti ja erytroso-4-fosfaatti) , CTK (oksaaloasetaatti ja a-ketoglutaraatti); 2) glutamaatti, harvemmin glutamiini, toimii aminoryhmien luovuttajana useimmille proteinogeenisille aminohapoille; reaktioita, joissa aminohapon aminoryhmä siirretään ketohappoon, kutsutaan ”transaminaatioreaktioiksi”; 3) monien aminohappojen biosynteesi suoritetaan "perheillä", joille käytetään yleisiä esiasteita; monet aminohapot itse toimivat substraattina muiden aminohappojen synteesille; 4) monet aminohappojen biosynteesin vaiheet vaativat energian virtausta, ja niihin liittyy ATP: n hydrolyysi (histidiinin, proliinin, metioniinin, asparagiinin, glutamiinin, arginiinin synteesin vaiheet); lisäksi käytetään synteesiin osallistuvien aktivoitujen molekyylien energiaa; lopuksi välituotteet, jotka voisivat tarjota solulle energian varastoinnin, poistetaan katabolisista ja amfibolisista prosesseista; 5) monet aminohappojen biosynteesin vaiheet edellyttävät pelkistävien ekvivalenttien (NADH ja NADPH) osallistumista, jotka voivat hapettua hengitysketjussa ja aiheuttaa energian lisäystä.
Siksi aminohappojen biosynteesi on melko kallista solulle. Siksi ei ole yllättävää, että tämä prosessi jokaisessa organismissa (solussa) on erittäin monimutkaisen säätelyn alainen (luku 19), jonka toisaalta määrittelee proteinogeenisten aminohappojen biosynteesin monimutkaisuus ja haarautuminen, ja toisaalta sen tulisi varmistaa solujen resurssien (energian, restaurointiekvivalentit, rakennuspalikat). Vaikuttaa loogiselta, että etenkin eksogeenisten aminohappojen läsnäollessa mikro-organismien solut eivät suorita synteesiään yksinään, vaan käyttävät valmiita muotoja.
1. Kahdeksan välttämättömän aminohapon hiilirunko (Ala, Asp, Asn, Ser, Gly, Pro, Glu, Gln)ja kysteiinivoidaan syntetisoida glukoosista (kuva 9.15).
A-aminoryhmä viedään vastaaviin a-ketohappoihin käyttämällä transaminaatioreaktiota. A-aminoryhmän yleinen luovuttaja on glutamaatti.
Suoraan transaminoimalla OPK-metaboliitit glutamaatin kanssa syntetisoidaan:
 Kuva 9.15. Välttämättömien aminohappojen biosynteesireitit
Kuva 9.15. Välttämättömien aminohappojen biosynteesireitit
2. Osittain vaihdettavat aminohapot Arg ja Hissyntetisoidaan pieninä määrinä, jotka eivät vastaa kehon tarpeita, mikä on erityisen havaittavissa lapsuudessa. Arginiinin synteesitapahtuu ornitiinisyklin reaktioissa. histidiinisyntetisoitu ATP: stä ja riboosista.
Ehdollisesti korvattavat aminohapot Tyr ja Cismuodostetaan välttämättömien aminohappojen avulla:
Fenyylialaniini muuttuu tyrosiinifenyylialaniinihydroksylaasin vaikutuksen alaisena;
Koulutukseen kysteiinirikkiä, jonka luovuttaja on metioniini, tarvitaan. Synteesissä käytetään hiilen luurankoa ja seriinin a-aminoryhmää.
AMINOhappojen vaihtotutkimuksen määrälliset ominaisuudet tässä modulaarisessa yksikössä
Seerumin ammoniakkipitoisuus: 0,04–0,07 mg / dl (25–40 μmol / l)
Seerumin ureapitoisuus: 15-50 mg / dl (2,5-8,4 mmol / l)
Urean päivittäinen poisto: -25 g / päivä
Ammoniumsuolojen päivittäinen erittyminen: -0,5 g / päivä
Modulaarinen yksikkö 3 ERITTÄINEN ERINÄISEN AMINOHAPPOJEN VAIHTO: SERIINI, GLYSIINI, METIONIINI, FENYYLALANIINI, TYROSIINI JA HISTIDIINI. VITAMIINIEN ROLLA 12-, 6- JA FOLIHAPPASSA. FENYLALANANIININ JA TYROSIININVAIHTOEN PARANTAMISEKSI LIITTYVÄT TAPAUDET.
Synteesi, biologinen rooli ja inaktivointi
Biogeeniset amiinit
Aihe 9.9. VAIHTAVA SERIINI JA GLYSIINI.
FOLIHAPON ROLL
Useimmille proteiineja muodostaville aminohapoille ominaisten metabolisten reittien lisäksi melkein kaikilla aminohapoilla on myös spesifisiä muutosreittejä. Harkitse tiettyjen aminohappojen vaihtoa, joiden spesifiset muutosreitit johtavat biologisesti tärkeiden tuotteiden synteesiin ja määräävät suurelta osin ihmisen fysiologisen tilan.
1. Seriini- välituotteesta syntetisoidut vaihdettavat aminohapot
glykolyysituote - 3-fosfoglyseraatti dehydrauksen, transaminaation ja hydrolyysin reaktiosekvenssissä fosfataasin vaikutuksesta
Kehossa seriiniä käytetään syntetisoimaan:
Fosfolipidit (fosfatidyyliseriinit, sphingomyelins);
Aminohapot (glysiini, kysteiini).
Seriinin katabolismin pääreitti- sen demuunio pyruvaatin muodostumisen kanssa (ks. aihe 9.3).
2. Glysiini muodostuu seriinistä seriinvaikutuksella. koentsyymitämä entsyymi on tetrahydrofolaattihappo (H4-folaatti),
joka kiinnittää seriinin P-hiiliatomin metyleeni-H4-folaatin muodostamiseksi
Glysiini on edeltäjä seuraaville:
Porfirinov (heme),
Puriini emäkset,
coenzymes,
Glutationi et ai. Glysiinin katabolismijatkuu
myös h4-folaatin osallistuminen,joka sitoo glysiinin a-CH2-ryhmää (katso kuva 9.18).
3. H4-folaattimuodostuu maksassa foolihaposta (folaatista) folaattireduktaasin ja dihydrofolaattireduktaasi-entsyymien osallistumisella (kuva 9.19). Näiden reduktaasien koentsyymi on NADPH.
Metyleeniryhmä - CH2 -molekyylissä metyleeni-N4-folaattivoi muuttua muiksi yhden hiilen ryhmiksi:
H4-folaattikykenee siirtämään nämä ryhmät muihin yhdisteisiin ja on rooli välituotekantaja monohiiliryhmiä.
Yhden hiilen fragmentteja käytetään nukleotidien ja useiden yhdisteiden synteesiin (katso kuva 9.18).
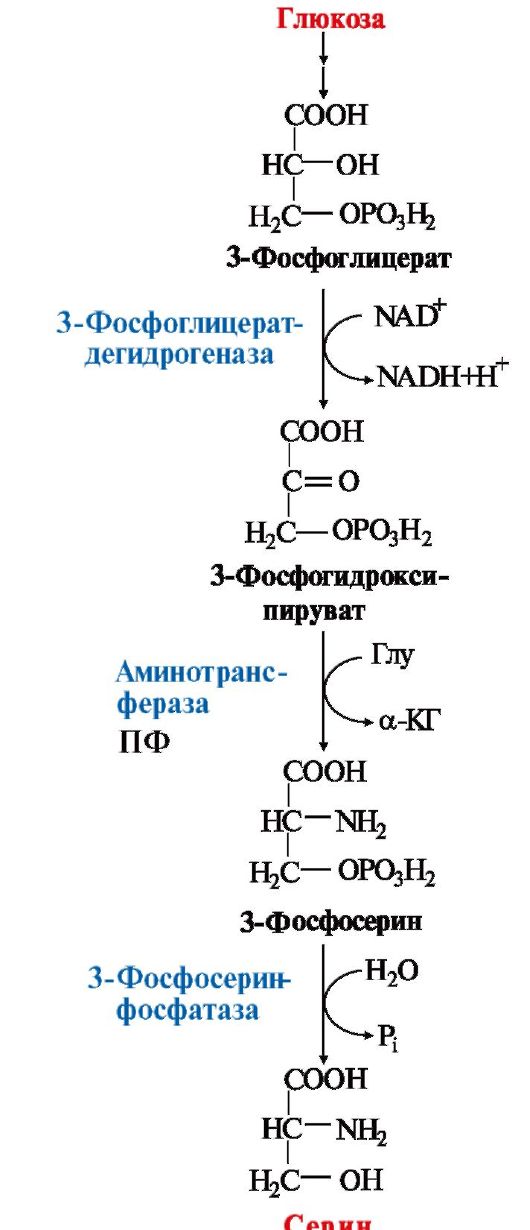 Kuva 9.17. Seriinin synteesi glukoosista
Kuva 9.17. Seriinin synteesi glukoosista
 Kuva 9.18. Monohiiliryhmien biologinen rooli
Kuva 9.18. Monohiiliryhmien biologinen rooli
Kuva 9.19. H4-folaatin synteesi maksassa
4. Foolihappoon vitamiini ihmisille ja useimmille nisäkkäille (B-C-vitamiinitai B 9).Se on levinnyt laajasti elintarvikkeisiin ja suoliston bakteerit syntetisoivat sen. vitamiinin puuteihmisillä sitä esiintyy melko harvoin. Syyt siihen voivat olla:
Aliravitsemus - vihannesten, hedelmien ja lihatuotteiden riittämätön kulutus;
Foolihapon imeytymisen heikentyminen suolistossa;
Hepatiitti, kirroosi ja muut maksavauriot, jotka aiheuttavat folaattireduktaasiaktiivisuuden heikkenemistä.
Foolihapon hyvovitaminoosi johtaa häiriöihin nukleiinihappojen synteesissä kehossa, mikä vaikuttaa ensisijaisesti nopeasti jakautuviin verisoluihin, ja megaloblastinen anemia.
5. Monet patogeenit kykenevät syntetisoimaan foolihappoa para-aminobentsoehaposta, joka on kiinteä osa folaattia. Tämän perusteella sulfonamidilääkkeiden bakteriostaattinen vaikutus,jotka ovat n-aminobentsoehapon rakenteellisia analogeja:
Lääkkeet ovat bakteerien foolihapposynteesi-entsyymien kilpailukykyisiä estäjiä tai niitä voidaan käyttää pseudosubstraattina, minkä seurauksena muodostuu yhdiste, joka ei suorita foolihapon toimintoja. Tämä tekee solunjakautumisen mahdottomaksi, bakteerit lopettavat lisääntymisen ja kuolevat. Sulfanilamideja kutsutaan anti-vitamiineiksi.
esittely
2. Aminohappojen valmistajat.
3. AMINOHAPPOJEN BIOSYNTEESI.
3.1 Yksivaiheinen menetelmä aminohappojen tuottamiseksi.
3.2 Kaksivaiheinen menetelmä aminohappojen tuottamiseksi.
3.3 Lysiinin saaminen.
3.4 Aminohappojen saaminen immobilisoiduilla entsyymeillä ja soluilla.
3.5 Teknologia glutamaatin tuottamiseksi.
4. AMINOHAPPOJEN TEOLLINEN SYNTEESI.
4.1 Mikrobiologinen synteesi.
4.2 Kemiallinen synteesi.
5. Aminohappojen levittäminen. Päätelmät.
Luettelo käytetyistä lähteistä.
esittely
Biotekniikan nykyinen kehitystaso johtuu tieteen ja tekniikan yleisestä edistymisestä etenkin viimeisen 50 vuoden aikana. Riittää, kun todetaan vain sellaiset tapahtumat kuin nukleiinihappojen rakenteen ja toimintojen määrittäminen, DNA-restriktioentsyymien havaitseminen ja niiden merkityksen tunnistaminen solujen elämässä, jota voidaan myöhemmin käyttää geenitekniikassa, hybridoomien luominen ja monoklonaalisten vasta-aineiden tuottaminen, tietokoneiden ja tietotekniikan käyttöönotto bioteknologisissa prosesseissa.
Teollisuuden aminohappojen biosynteesi viittaa mikrobioteknologiaan. Pohjimmiltaan mikrobioteknologia on identtistä teollisen (teknisen) mikrobiologian kanssa. Sen kohteina ovat mikrobit - virukset (mukaan lukien viroidit ja faagit), bakteerit, sienet, jäkälät, alkueläimet. Joissain tapauksissa biologiset kohteet ovat mikrobista peräisin olevia primaarisia metaboliitteja - entsyymejä, joiden katalyyttinen aktiivisuus perustuu tekniseen entsymologiaan.
Verrattuna kasvi- ja eläinsoluihin, mikrobit moninkertaistuvat yleensä nopeammin, ja siksi kaikki metaboliset (metaboliset) prosessit etenevät nopeammin. Useimpien mikrobien suhteelliset edut bioobjekteina ovat seuraavat:
1) genomin organisoinnin suuri "yksinkertaisuus",
2) melko helppo sopeutua (joustavuus) ympäristöön luonnollisissa ja keinotekoisissa olosuhteissa,
3) entsymaattisten reaktioiden ja solumassan kasvun voimakkaat nopeudet yksikköä kohti.
Ensimmäinen etu tarjoaa mikrobisoluille parempia mahdollisuuksia perinnöllisen materiaalin mittaamiseen ja uudelleenjärjestelyyn, esimerkiksi vieraan geenitiedon sisällyttämiseen siihen, plasmidien tuomiseen soluihin tai päinvastoin niiden eliminoimiseen.
Toinen mikrobien joustavuuteen liittyvä etu voidaan osoittaa bakteerien ja sienten esimerkillä. Joten suhteessa lämpötilaan, mikrobit jaetaan psykofiileihin mesofyllissä ja termofiilissä.
1. AMINOHAPPOJEN OMINAISUUDET.
Aminohapoilla on suuri rooli terveydenhoidossa, kotieläintaloudessa ja kevyessä teollisuudessa. Makro-organismin arvon perusteella aminohapot jaetaan keskenään vaihdettaviin ja korvaamattomiin. Välttämättömiä aminohappoja ovat ne aminohapot, joita ei syntetisoida eläimen tai ihmisen kehossa, ne on vietävä ruokaan tai eläinrehuun (taulukko 1).
Taulukko 1
Välttämättömät ja välttämättömät aminohapot.
Korvaukset syntetisoidaan in vivo ammoniakista ja erilaisista hiililähteistä. Mikro-organismit itse syntetisoivat kaikki tarvitsemansa aminohapot ammoniakista ja nitraateista ja hiili "luurangot" vastaavista välituotteista.
Aminohappojen arvioinnin perusteella tutkijat ovat jo pitkään pyrkineet käyttämään mikro-organismien kykyä tuottaa välttämättömiä ja välttämättömiä aminohappoja konkreettisissa määrissä.
Ihmisten aminohappojen tarve on riittävän suuri, ja tämä määrää heidän tuotantotasonsa maailmassa (noin 500 tuhatta tonnia vuodessa).
Useimmat mikro-organismit ja vihreät kasvit kykenevät syntetisoimaan denovo kaikki 20 aminohappoa. Aminohappojen hiilirungot muodostuvat välituotteiden metaboliatuotteista.
Lähtöaine aminohappojen synteesille ovat yksinkertaiset katabolismin välituotteet (pyruvaatti, 2-hydroksiglutaraatti, oksoasetaatti ja fumaraatti, erigroso-4-fosfaatti, riboosi-5-fosfaatti ja ATP). Useimpien aminohappojen synteesissä aminoryhmä viedään vasta viimeisessä vaiheessa transaminoimalla. Jotkut aminohapot muodostuvat muun aminohappojen muunnoksien seurauksena, ja näissä tapauksissa transaminointia ei vaadita.
Proteiinit syntetisoidaan ribosomeissa aminohapoista m - RNA-tietojen mukaan, jotka transkriptoidaan (transkription avulla) DNA-geeneistä.
2. Aminohappojen valmistajat
Spesifiset entsyymit, jotka säätelevät aminohappojen biosynteesiä, ovat bakteereissa laajalti levinneet; niitä on tutkittu Escherichiacolilla tietyllä syvyydellä. Salmonellatyphimurium, Bacillussubtilis ja muut. Sienissä aminohappojen rajoittamiseksi entsyymien määrä, joka katalysoi erilaisten aminohappojen biosynteesiä, lisääntyy samanaikaisesti, samanaikaisesti. Tätä "aminohappojen biosynteesin yleistä hallintaa" kutsuttiin myös "metaboliseksi interblockiksi" tai "ristireittien säätelyksi", jonka M. Karsiotis ja työtoverit tunnistivat ensin Neurosporacrassassa vuonna 1965, ja myöhemmin Saccharomycescerevisiaessa, Aspergillusnidulasissa ja muissa sienissä.
Escherichiacolin, Serratiamarcescensin ja muiden viljelmien yksittäisten aminohappojen ylituotannossa Feedakillä on tärkeä rooli - tukahduttaminen esimerkiksi aromaattisten aminohappojen biosynteesissä viimeisissä vaiheissa.
Missä tahansa elävässä organismissa aminohapot kulutetaan ensisijaisesti primaaristen metaoliittien - entsyymien ja ei-entsyymiproteiinien - biosynteesiin. Siksi denovoaminohappojen biosynteesin lisäksi, toinen tapa niiden saamiseksi on mahdollista, nimittäin vastaavien proteiinien hydrolysaateista (tryptofaani tuhoutuu happohydrolyysillä), mukaan lukien mikrobisolujen luonnollisista biomassoista.
Luonnolliset aminohapot ovat tyypillisesti optisesti aktiivisia L- ja D-muotoja, joita on vaikea erottaa. Siksi mikrobien synteesi korybakteerien ja joidenkin muiden mikrobien avulla on nyt tärkein ja kustannustehokas. Ensisijaisesti miehittää Japani, jossa pelkästään glutamiinihappo tuottaa yli 100 tuhatta tonnia vuodessa; suurimman osan luonnollisista välttämättömistä aminohapoista tuottaa Takeda. S. Kinoshita, joka löysi ensimmäistä kertaa 1950-luvulla mikrobien synteesin lupauksen ja todisti sen, myönsi vuonna 1963: "Ei ole epäilystäkään siitä, että on lähellä aikaa, jolloin on mahdollista tuottaa kaikki tunnetut aminohapot mikro-organismien avulla." Tällä kertaa on jo kulunut 70 vuotta. Saatiin mikrobeja - supertuottajia sukuista Brevibacterium, Corynebacterium, Micrococcus ja muita, joiden avulla hallittiin paitsi glutamaatin myös L - lysiinin, L - valiinin, L - histidiinin ja muiden suurten kapasiteettien tuotanto. Superproduktion yhteydessä kloonatun geenin ilmentymisen taso ilmenee spesifisen proteiinin synteesissä määränä, joka on 2% kaikista isäntäsolun liukoisista proteiineista. Tällä hetkellä on tuottajia, joissa syntetisoidun spesifisen proteiinin määrä saavuttaa 10 - 15% (tässä integroitujen geenien monikopioplasmideilla on tärkeä rooli). Geenitekniikan menetelmillä Kaikkien Venäjän teollisen mikro-organismien genetiikan ja jalostamisen tutkimuslaitoksessa (Moskova) saatiin Escherichiacoli-kanta, jolla on L-treoniinin ylituotanto (30 g / l 40 tuntia käymistilaisuudessa).
Jos kanta tuottaa mitä tahansa aminohappoa, huolellinen ja huolellinen käsittely on välttämätöntä sen pitämiseksi aktiivisessa tilassa pitkään.
Saatiin Escherichiacoli-kanta, joka tuotti 27 g / l L-proliinia 48 tunnissa, ja kanta, joka tuotti jopa 22,4 g / l L-fenylaniinia.
Corynebacteriumsp: n käyttö. voit saada alkalipitoisia väliaineita L - tyrosiinia (jopa 19 g / l); käyttämällä Corynebacteriumglutamicumia glukoosiväliaineessa - L - valiini (enintään 11 \u200b\u200bg / l; L - arginiini, L - histidiini, L - isoleusiini - 15 - 20,8 g / l).
3. AMINOHAPPOJEN BIOSYNTEESI
Aminohappojen tuotantoteknologia perustuu tuottajien käymisperiaatteisiin ja sekundaaristen metaboliittien eristämiseen, toisin sanoen kohdun viljelmä levitetään ensin agarisoidulle väliaineelle koeputkissa, sitten nestemäiselle väliaineelle pulloissa, inokulaattoreissa ja inokulaattoreissa ja sitten pään (pää) fermentaatioissa. Viljelynesteiden prosessointi ja aminohappojen valinta suoritetaan järjestelmän mukaisesti, joka on samanlainen kuin antibioottien valmistusmenetelmä. Kohdetuotteen eristetyt puhtaat kiteet kuivataan yleensä tyhjössä ja pakataan.
3.1 Yksivaiheinen menetelmä aminohappojen tuottamiseksi
Aminohappojen tuottamiseksi tunnetaan kaksi menetelmää: yksivaiheinen ja kaksivaiheinen. Ensimmäisen menetelmän mukaan esimerkiksi aminohappoa tuottava mutanttinen polyauxotrofinen kanta viljellään optimaalisessa elatusaineessa biosynteesiä varten. Kohdetuote kertyy kasvatusnesteeseen, josta se eristetään kuvion d kaavion mukaisesti
1 - fermentoija
2 - jäähdytin, 3,9 - jääkaapit,
4 - esikäsittelykyky,
5 - sentrifugi,
6 - tyhjiö - höyrystin,
7 - suora laite
8 - rumpusuodatin, A, B - reitit (tarvittaessa sulkeminen),
10 - ultrasuodatuslaite,
11 - entsyymiliuoksen säilöntäkyky,
12 - kalvosuodatin,
13 - käyttönestesäilöntäaine, 14-säiliö entsyymin laskeutumiseen,
15 - suodatin - paina,
16 - sumutuskuivaaja,
17 - aja kuiva kuiva tiiviste.
Kuvio nro 1 Arvioitu teknologinen kaava aminohappojen tuottamiseksi.
3.2 Kaksivaiheinen menetelmä aminohappojen tuottamiseksi
Kaksivaiheisessa menetelmässä tuottajamikrobia viljellään ympäristössä, jossa se saadaan, ja syntetisoidaan kaikki tarvittavat aineosat kohdetuotteen myöhempää synteesiä varten (idiofaasissa).
Jos aminohappojen biosynteesi-entsyymit kerääntyvät solunsisäisesti, mutta ensimmäisen vaiheen jälkeen solut erotetaan, hajoavat ja levitetään solu mehu. Muissa tapauksissa soluja käytetään suoraan kohdetuotteiden biosynteesiin.
3.3 Lysiinin saaminen
Jos aminohappo on tarkoitettu rehun lisäaineeksi, rehutuotteen bioteknologiseen prosessiin kuuluvat seuraavat vaiheet: käyminen, aminohapon stabilointi viljelynesteessä ennen haihduttamista, tyhjöhaihdutus, haihtuneen liuoksen standardisointi lisättäessä täyteainetta, kuivaus ja lopputuotteen pakkaaminen, joka ei saisi sisältää yli 10% pääaineesta. Esimerkiksi teollisuudessa tuotetaan lysiinin kuivarehua ja nestemäisiä rehukonsentraatteja kiteisen lysiinin kanssa (kuva 2).
Kuva №2
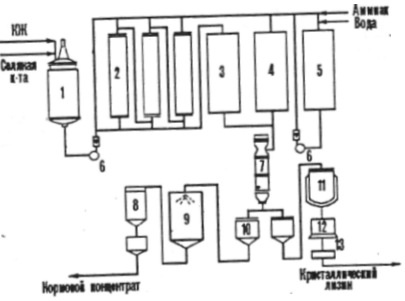
1 - kasvatusnesteen kapasiteetti (QOL),
2 - ioninvaihtopylväät
3 - kokoelma zluaattia,
4 - kokoelma suodosta,
5 - eluaatin kapasiteetti,
7 - tyhjiö - höyrystin,
8 - sykloni
9 - kuivatusrehu tiiviste,
10 - kokoelma
11 - reaktorikiteytin,
12 - sentrifugi,
13 - kuivain.
Jos tiiviste sisältää 70 - 80% kiinteitä aineita, se on melko kestävä mikrobien pilaantumiselle ainesosien lisääntyneen osmoottisen pitoisuuden takia.
3.4 Aminohappojen saaminen immobilisoiduilla entsyymeillä ja soluilla
Taloudellisesti toteuttamiskelpoisia ovat menetelmät aminohappojen tuottamiseksi käyttämällä immobilisoituja entsyymejä ja soluja. Suhteellisen kauan sitten toteutettiin prosessi L-asparagiinihapon saamiseksi fumaarihaposta ja ammoniakkista yhdessä vaiheessa käyttämällä immobilisoituja E. coli- tai Pseudomonasaeruginosa -soluja, joilla oli aspartaasiaktiivisuutta (katso kaavio).
Aspartaasi katalysoi ammoniakin lisäämisen reaktiota fumaarihapoksi. Pysymättömässä tilassa oleva entsyymi säilyttää aktiivisuuden alkutasolla 2 - 2,5 viikkoa tai enemmän.
L - asparagiinihappoa voidaan saada myös käyttämällä immobilisoituja soluja, mikä pidentää merkittävästi järjestelmän kestoa, jonka suorituskyky kohdetuotteelle on noin 2000 kg 1 m: n reaktorista. Määräaikaista käymistä käytetään muiden L-aminohappojen (glutamiini, fenyylialaniini, lysiini, tryptofaani jne.) Tuotannossa. Tässä tapauksessa yleensä viljellään erityisiä mutanttikantoja, joiden metaboliaa kohdetuotteelle on tutkittu melko täydellisesti. Joten esimerkiksi havaittiin, että Corynebacillus geriasin rajoittava aine, joka muodostaa glutamiinihapon, on biotyyppi annoksella 1 - 5 μg / L. Biotiini indusoi solukalvon rakenteellisia ja toiminnallisia muutoksia, mikä lisää sen läpäisevyyttä glutamiinihappoon, jättäen solun viljelynesteeseen. Yksittäiset tuottajakannat kykenevät keräämään yli 50 g / l melassiväliaineisiin.
Biotiinin rooli on samanlainen proliinin tapauksessa, joka on glutamiinihapon johdannainen.
Tämän tekniikan yksinkertaisuus ja sen edut syvään käymiseen nähden osoittavat selvästi japanilaisen Tanabe Sayyaku -yrityksen kokemuksen. Vuonna 1973 tämä yritys kehitti menetelmän asparagiinihapon tuottamiseksi käyttämällä immobilisoituja bakteerisoluja, joilla on aspartaasiaktiivisuutta. Aspartaasi katalysoi ammoniakin lisäystä fumaarihapon kaksoissidoksessa, ts. Asparagiinihappo muodostuu yhdessä vaiheessa ja tämä bioteknologinen prosessi voidaan luokitella orgaanisten yhdisteiden biotransformaatioksi. Geeliin immobilisoitu entsyymi toimi hyvin, sen puoli-inaktivoinnin kesto oli 1 kuukausi. Sitten tuottajasolut immobilisoitiin geeliin stabiloimalla niitä edelleen kemiallisella sidoksella keskenään ja geeliin. Solujen inaktivoinnin kesto nousi tässä tapauksessa 4 kuukauteen. Siten fumaarihapon biotransformaatio-tekniikka voidaan esittää seuraavassa järjestyksessä:
solukasvu syvällä fermentaatiolla ja niiden valinta sentrifugoimalla;
biokatalyyttisolujen immobilisointi geelissä rakeiden muodossa, joiden koko on 2-3 mm;
ammoniumfumaraatin biotransformaatio pylväässä katalyytin kanssa virtausmoodissa ja asparagiinihapon liuoksen saamiseksi;
kiteytys, sentrifugointi ja kiteiden pesu.
Asparagiinihapon 1 m bioreaktorin biotransformaatiojärjestelmän suorituskyky 1700 kg.
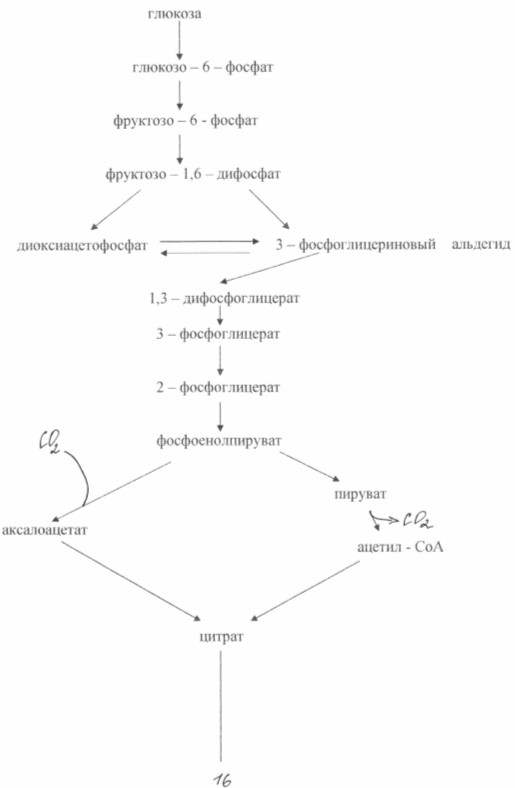
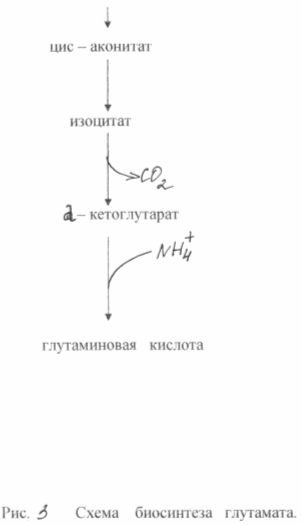
3.5. Teknologia glutamaatin tuottamiseksi.
Näissä bakteereissa esiintyvän glutamiinihapon supersynteesin perustana on kaksi biokemiallista periaatetta: entsyymin puutos - ketoglutaraattidehydrogenaasi ja estävä biotiinin biosynteesi. Solujen kyvyttömyys syntetisoida biotiinia johtaa sytoplasmisen kalvon läpäisevyyden lisääntymiseen, mikä lisää glutamaatin erittymistä. Se muodostuu - ketoglutaraatin aminoinnin tuloksena, joka ei kykene jatkamaan muutoksia trikarboksyylihapposyklissä. Glukoosin biosynteesi glukoosista tämän tyyppisissä mutanteissa on esitetty kuviossa 3. 3
Glutamiinihapon biosynteesissä biotiinin pitoisuus väliaineessa on erittäin tärkeä. On tarpeen varmistaa, että sen pitoisuus on 1 - 5 μg / l. Tässä tapauksessa membraanifosfolipidien normaali synteesi häiriintyy ja jälkimmäisestä tulee glutamaatin läpäisevä. Biotiinipitoisuuden ollessa 15 μg / l havaitaan biomassan voimakas kasvu. Sytoplasmisen membraanin läpäisevyyttä glutamaatille voidaan myös vähentää penisilliinillä lisäämällä se väliaineeseen logaritmisen kasvuvaiheen aikana. Tässä tapauksessa fosfolipidit uutetaan kalvosta ja glutamaatti voidaan kuljettaa 40-50 tunnin sisällä. Glutamaatin bakteerisynteesi antaa sinulle mahdollisuuden saada noin 50%: n saanto tuotteesta sokerista ja kertyä fermentaatioväliaineeseen 200 g / l: aan glutamaattia. Tunnetut menetelmät glutamaatin tuottamiseksi etanoliväliaineissa (enintään 60 g / l) tai asetaatissa (korkeintaan 98 g / l).
4. TEOLLISEN AMINOHAPPYYNTEESI
Aminohappojen teollinen tuotanto tapahtuu kahdella tavalla: mikrobiologisella ja kemiallisella.
4.1 Mikrobiologinen synteesi
Mikrobiologinen synteesi perustuu tietyn tyyppisten mikro-organismien viljelyyn ravintoalustoissa, joilla on sopiva hiililähde. Yleensä nämä ovat sokeria, joka sisältyy esimerkiksi melassiin. Mutatoituneet mikro-organismit, joiden typen metabolia on heikentynyt, vapauttaa suuren määrän mitä tahansa aminohappoa liuokseen. Kun käymisprosessi on valmis, aminohappo eristetään liuoksesta kemiallisilla menetelmillä
Mikrobiologisella käymisellä saadaan pääosa glutamiinihaposta ja kaikesta lysiinistä. Tällä prosessilla on omat edut ja haitat. Toisaalta siinä on vähän vaiheita ja tarvitaan suhteellisen yksinkertaisia \u200b\u200bja yleismaailmallisia laitteita. Toisaalta elävät mikro-organismit, joiden kanssa sinun on työskenneltävä, ovat erittäin herkkiä pienimmälle olosuhteiden muutokselle, ja kohdetuotteen pitoisuus on alhainen, mikä johtaa laitteiden koon lisääntymiseen.
Fenyylialaniinin tuottamiseksi on käytetty mikrobiologista menetelmää käyttämällä tyrosiinia - ja metioniinivajaista mutanttia Brevibacteriumlactofermentum. Eräkäymisprosessissa saatiin tuotekonsentraatio 24,8 g / l. Tämä prosessi vaatii kuitenkin monimutkaisia \u200b\u200bja kalliita ympäristöjä. Erityisen mielenkiintoista on fenyylialaniinin biosynteesi auksotrofisella mutantilla E. coli, jota voidaan viljellä glukoosiväliaineessa fosfaattien kanssa. Käymisprosessi suoritetaan täyttömenetelmällä biomassan kierrätyksellä. Reaktorin biomassa saavuttaa 60. tunnissa 45–50 g / l, ja fenyylialaniinipitoisuus on 22,4–22,8 g / l. Järjestelmän tuottavuus 0,72 - 0,86 g / (LH); tuotteen saanto 0,11 g.
4.2 Kemiallinen synteesi
Kemiallinen synteesi on universaalisempaa kuin mikrobiologinen, ja se antaa sinulle mahdollisen rakenteen mukaisia \u200b\u200byhdisteitä. Tässä käytetään muita kuin ruoka-mineraaliraaka-aineita, tuotepitoisuus saavutetaan, mutta yleensä prosessi on monivaiheinen ja vaatii monimutkaisempia laitteita.
Molemmat menetelmät tarjoavat luonnolliset aminohapot, joilla on vaadittava kemiallinen ja optinen puhtausaste. Joten lopullisessa analyysissä, kun kyse on teollisuustuotannosta, viimeinen sana jää taloudelle: Ulkomaisten asiantuntijoiden mukaan kemiallisista menetelmistä tulee laajassa mittakaavassa kustannustehokkaampia.
Metioniinin laajimmin kehitetty teollinen synteesi on aminohappo, jonka pääasiallinen kuluttaja on siipikarjan kasvatus. Lähtöaine on propeeni, öljykrakkauksen tuote. Propeeni hapetetaan akroleiiniksi, joka sarjan reaktioiden seurauksena muuttuu raseemiseksi metioniiniksi.

Kemiallinen synteesi johtaa yleensä seokseen, jossa on yhtä suuret määrät aminohappojen L- ja D-isomeerejä, kun taas proteiinit sisältävät yksinomaan L-isomeerejä. Nämä samat isomeerit ovat ravitsevia. Kehon D-isomeerit eivät yleensä absorboidu ja ovat painolastia. Siksi erottaminen on välttämätöntä, mikä vaikuttaa väistämättä kielteisesti talouteen. Viime aikoina on tapahtunut merkittävää edistystä aminohappojen raseemisten seosten pilkkomisessa. SV: n teoksissa. Rogozhina ja V.A. Davankova osoitti, että optisesti inaktiiviset aminohapot muodostavat kovalenttisesti liukenemattomaan polymeerikantajaan helposti komplekseja kuparin, nikkelin jne. Kanssa. toinen raseeminen aminohappo liuoksessa vie kaksi vapaata koordinaatiokohtaa metalliatomissa, ja L- ja D-isomeerien kompleksien lujuus on erilainen. Ei väliä kuinka pieni tämä ero, joka toistuu monta kertaa kromatografiaprosessissa, se tarjoaa optisten antipoodien täydellisen tai osittaisen erottelun. Parhaat tulokset saatiin DL-proliinilla, joka voidaan erottaa preparatiivisesti optisiksi isomeereiksi.
Monien tutkijoiden pyrkimykset kohdistuvat myös sellaisen kemiallisen synteesin kehittämiseen, joka antaisi vain yhden halutun luonnollisen optisesti aktiivisen isomeerin - elävän luonnon syntetisoiman isomeerin - epäsymmetrisen synteesin. Tähän suuntaan on saavutettu vakavia menestyksiä viime vuosina. A. Kaganin (Ranska) ja E: n Kornin (USA) teoksilla saavutettiin käytännössä kvantitatiivinen optinen lähtö. On erittäin houkuttelevaa toistaa aminohappojen synteesi luonnollisten entsyymijärjestelmien avulla. Pyroksalisestä riippuvaiset entsyymit suorittavat suuren määrän sellaisia \u200b\u200bsynteesejä, ja aminohapon haluttu optinen isomeeri saadaan välittömästi. Suuren panoksen näiden prosessien tutkimukseen antoi akateemikko A.E. Braunstein (Venäjä) ja professori J. Snell (Yhdysvallat).
Venäläisten tutkijoiden tavoitteena on löytää kemiallisia järjestelmiä, jotka eivät vain pystyisi simuloimaan biokemiallisia reaktioita, vaan myös toteuttamaan prosesseja, joita ei tapahdu elävässä organismissa. Sellaisena systeeminä valittiin aminohappojen Schiff-emästen kompleksit siirtymämetalli-ioneilla. Oletetaan, että salisyylihappoaldehydi näissä komplekseissa tulee toimimaan liridoksaalina, lisäämällä aminohapon C-H-sidoksen reaktiivisuutta, metalli-ioni tekee saman, mutta pitää järjestelmän kuitenkin jäykässä tasaisessa tilassa, joka luonnossa tarjoaa entsyymiproteiinin. Kompleksin yleinen epäsymmetria antoi meille toivoa, että se tarjoaa luonnossa entsyymiproteiinin. Kompleksin yleinen epäsymmetria antoi meille toivoa, että reaktio voidaan suorittaa stereospesifisesti, ts. sen seurauksena antaa optisesti aktiivinen happo.
Sellaisia \u200b\u200breaktioita ei esiinny luonnossa, mutta niiden käytännöllinen arvo on siinä, että glutamiinihappo saadaan välittömästi. Siten tie avautuu uudelle aminohappojen yleiselle synteesille, joka tapahtuu äärimmäisissä olosuhteissa.
Oli verrattain vaikeampaa toistaa luonnollisten entsyymien toiminnan toinen puoli - asymmetrinen synteesi. Tätä varten kompleksit jaettiin optisesti aktiivisiin antipodoihin.

5. Aminohappojen levittäminen
Kaikkien organismien proteiinit viruksesta ihmisille koostuvat 21 aminohaposta, jotka biologisen arvonsa mukaan jakautuvat keskenään vaihdettaviin (elimistö voi syntetisoida ne rakentamaan proteiineja riittävän nopeasti) ja korvaamattomiksi (se ei voi syntetisoida niitä, ja se on saatava ruuan ulkopuolelta). Jokainen proteiini sisältää tietyn määrän kutakin aminohappoa. Jos kulutetussa proteiinissa ei ole tai on vähän aminohappoa, kehon proteiineja ei rakenneta. Siksi tarve tasapainottaa ruokavaliota, mikä johtaa niiden ravintoarvon nousuun.
Kuviossa (4) kaseiini, ravitseva eläinproteiini, otettiin etanoliksi. Jokaisen pylvään varjostettu osa vastaa luonnollisen proteiinin ravintoarvoa CEB-yksikköinä (proteiinitehokkuuskerroin). Tietyn määrän lysiiniä, ensimmäisen rajoittavaa aminohappoa, lisääminen tuotteeseen johtaa ravitsemuksen voimakkaaseen lisääntymiseen, toisen rajoittavan aminohapon lisääminen lisää ravintoa eläinproteiinien tasolle.
Kuva 4 Proteiinin ravintoarvon lisääminen lisäämällä aminohappoja rajoittavia yksiköitä CEB: tä
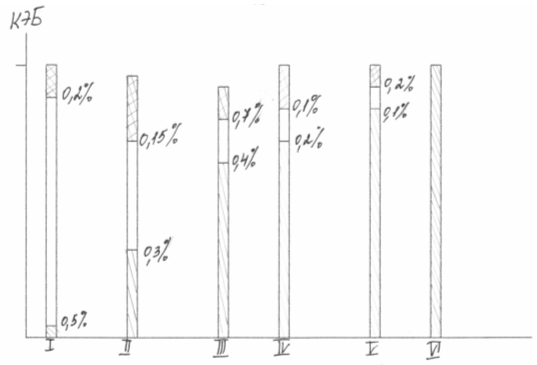
Ruokavalion tasapainottamista käytetään laajalti maataloudessa. M.F. Tomme, I.F. Tkachev, 0,2 - 0,5% lysiinin sisällyttäminen porsaiden ja kanojen ruokavalioon voi vähentää rehuproteiinin kulutusta 25% ja lisätä eläinten tuottavuutta 10-13%. Yhteenvetona sekä venäläisten että ulkomaisten kirjoittajien tutkimustuloksista saamme, että kun järjestämme 20 tuhannen tonnin lysiinin tuotantoa vuodessa, saat lisää 1,2 miljoonaa tonnia lihaa ja säästät 3,6 miljoonaa tonnia proteiinirehua. Hollantilaisen ekonomistin N. Marguderin mukaan 0,125% sikarehujen lysiinistä, joka koostuu maissijauheesta ja maapähkinöistä, antaa 100%: n nettotuloksen.
Viljatuotteiden tasapainottamista puhtaiden aminohappojen kanssa ei ole vielä löytynyt laajasta käytöstä elintarviketeollisuudessa, vaikka se parantaa kasviproteiinin ravintoominaisuuksia ja lisää siten ruoassa käytettäväksi sopivan proteiinin määrää. Viimeksi mainittu on erityisen tärkeä, koska on olemassa todellinen mahdollisuus tarjota nopeasti kasvavat ruokaproteiinitarpeet muuttamatta samanaikaisesti ruokavalioiden luonnetta ja tuotteiden aistinvaraisia \u200b\u200bominaisuuksia. Aminohappoja on käytetty menestyksekkäästi lääketieteessä. Raskaiden leikkausten, palovammojen jne. Jälkeen ihmiskeho ei usein kykene absorboimaan proteiinia regeneraatioprosessien kannalta tarpeellisessa määrin, ja tämä johtaa potilaan tilan huonontumiseen. Sitten turvautua aminohappojen ravitsemukseen. Näissä tapauksissa saavutettu erinomainen terapeuttinen vaikutus aiheuttaa suuren tarpeen aminohappojen seoksille. Seosta, joka ei sisällä fenyylialaniinia, syötetään lapsille, jotka kärsivät fenyylipyruviivisesta oligofreniasta.
Aminohapot toimivat lähtöaineina polypeptidien synteesille, joista monet ovat vahvimpia fysiologisesti aktiivisia yhdisteitä, samoin kuin muiden lääkkeiden luomiseen.
Lopuksi, polykondensaatioprosessissa aminohapot muodostavat polymeerejä, jotka ilman proteiinien biologista aktiivisuutta ovat rakenteeltaan samanlaisia \u200b\u200bkuin ne ja rajoittavat joitain niiden tärkeistä fysikaalisista ominaisuuksista. Aminohappojen avulla saatu keinotekoinen villa, silkki ja nahka eivät ole huonompi suorituskyky kuin luonnolliset materiaalit.
Huolimatta aminohappojen laajasta käytöstä lääketieteessä, teollisuudessa ja maataloudessa, elintarviketeollisuus on edelleen niiden pääasiallinen kuluttaja. Joten mononatriumglutamaatti (glutamiinihapon natriumsuola) on voimakas maunparantaja. Monissa maissa sitä lisätään kaikkiin tuotteisiin purkittamisen, jäädyttämisen ja pitkäaikaisen varastoinnin aikana; sitä käytetään ateriapalveluissa ja kotitalouksissa sekoituksena ruokasuolan kanssa. Aminohappojen seoksesta ovat myös koostumukset, jotka simuloivat ruuan makua ja tuoksua.
Aminohappojen kulutus maailmassa kasvaa vuosittain 10%. Niiden tuotannolle on ominaista seuraavat luvut
johtopäätös
Kurssityö on omistettu aminohappojen teolliselle biosynteesille. Tämän työn ansiosta sain selville, että aminohappojen tuottamiseksi on olemassa seuraavat menetelmät:
1. Aminohappojen biosynteesi, joka sisältää yksivaiheiset ja kaksivaiheiset menetelmät;
2. Aminohappojen teollinen synteesi - mikrobiologinen ja kemiallinen synteesi.
Tutkimme aminohappojen tuotantoa käyttämällä immobilisoituja entsyymejä ja soluja, samoin kuin tekniikkaa lysiinin ja glutamaatin tuottamiseksi.
Löysi aminohappojen käytön paitsi lääketieteessä, myös maataloudessa rehuvalkuaisaineiden kulutuksen vähentämiseksi; ja elintarviketeollisuudessa säilöntäaineina ja arominvahvennina
Luettelo käytetyistä lähteistä
1. E.A. Viritykset. Biologinen kemia. M., lukio, 1986.
2. M.E. Becker, G.K. Liepinin, E.P. Raypulis. Biotekniikka. M., VO Agropromizdat, 1990.
3. W.E. Viestur, I.A. Shmit, A.V. Zhilevich. Biotekniikka. Bioteknologiset aineet, tekniikka, laitteet. Riika, Zinatne, 1987.
4. G.K. Liepinin, M.E. Duntse. Raaka-aineet ja ravintoalustat teollisuuden bioteknologiaan. Riika, Zinatne, 1986.
5. N.P. Blinov. Biotekniikan perusteet. Pietari., Science, 1995.
6. L.I. Vorobyov. Teollinen mikrobiologia. M., Moskovan osavaltion yliopisto, 1989.
7. S.D. Varfolomeev, S.V. Kalyuzhny. Biotekniikka. Mikrobiologisten prosessien kineettinen perusta. M., lukio, 1990.
8. V.M. Belikov. Aminohapot, niiden kemiallinen synteesi ja käyttö. Moskov. Neuvostoliiton tiedeakatemia, 1973.
9. J. Bailey, D. Ollis. Biokemiallisen tekniikan perusteet, t. 1. M "Mir, 1989.
10. G.S. Murovtsev, R.G. Butenko, T.N. Tikhonenko, M.I. Prokofjev. Maatalouden bioteknologian perusteet. M., VO Agropromizdat, 1990.
11. Biotekniikka: periaatteet ja soveltaminen. Painos I. Higgins, D. Best, J. Jones. M., World, 1988.
Aiheen käytännön merkitys. Aminohapot, jotka pääsevät kehoon ruuan kautta, voivat olla hiili- ja typpiatomien lähteitä monille muille kuin proteiiniyhdisteille. Erityisesti aminohapot voivat käydä muuntoreaktioissa, mikä varmistaa kehon tarpeet korvattaville aminohapoille riippumatta niiden ulkoisesta tarjonnasta. Aminohapoista muodostettuihin fysiologisesti tärkeisiin tuotteisiin kuuluvat hemi, kreatiini, koliini, puriini ja pyrimidiininukleotidit, jotkut hormonit ja välittäjäaineet. Näiden metabolisten reittien tuntemus on tärkeä tiettyjen hyvvitaminoosien ja synnynnäisten fermentopatioiden patogeneesin ymmärtämiseksi, menetelmien kehittämiseksi niiden biokemialliseksi diagnoosiksi ja korjaamiseksi.
Oppitunnin tarkoitus. Opiskeltuaan tätä aihetta, opiskelijan tulee tuntea ei-välttämättömien aminohappojen synteesin perusreaktiot ihmiskehossa, tapoja käyttää aminohappoja muiden kuin proteiinipitoisten typpiyhdisteiden synteesiin ja näiden prosessien mahdolliset rikkomukset, kyetä soveltamaan saatuja tietoja teoreettisten ja käytännön ongelmien ratkaisemiseen.
Alkuperäinen tietotaso.
Aminohappojen (glysiini, seriini, metioniini, kysteiini, fenyylialaniini, tyrosiini) rakenne.
Funktionaaliset siirtoreaktiot biologisissa järjestelmissä.
Α-ketohappojen pelkistävä aminointi: entsyymit, rooli kehossa.
Aminohappojen transaminointi: reaktiot, rooli kehossa.
Vitamiinien koentsyymitoiminnat (foolihappo, syaanikobalamiini).
Periaatteet entsyymien synnynnäisten vikojen diagnosoimiseksi.
3.1. Kudosten aminohappojen biosynteesi.
3.1.1. Ihmiskehossa on välttämätöntä aminohappojen synteesi mahdollista, joihin kuuluvat: alaniini, arginiini, aspartaatti, histidiini, glysiini, glutamaatti, glutamiini, proliini, seriini, tyrosiini, kysteiini. Minkään näiden aminohappojen ravintovajeesta ei seuraa kehon puutetta. Tärkeimmät tapoja muodostaa välttämättömiä aminohappoja ovat: 1) a-ketohappojen transaminointi, 2) a-ketohappojen pelkistävä aminointi, 3) välttämättömien aminohappojen synteesi.
3.1.2. transaminaatiolla (katso aihe 2). Hiiliatomien lähteet näissä reaktioissa ovat glykolyysi- ja Krebs-syklin metaboliitteja, typpiatomien lähteet ovat muita aminohappoja, useimmiten glutamaattia (katso kuva 7).
3.1.3. Pelkistävä aminointi (katso aihe 2). Aminoryhmän typpiatomin lähde on ammoniakkimolekyyli, hiilen lähde on α-ketohappo, useimmiten α-ketoglutaraatti (katso kuva 3.1).
Kuva 3.1.Vaihdettavien aminohappojen biosynteesi kudoksissa käyttämällä glukoosin hiilirunkoa (transaminaatioreaktiot esitetään yhdellä tähdellä ja pelkistävä aminointi kahdella).
3.1.4. Synteesi välttämättömien aminohappojen kanssa. Essentiaalinen aminohappo tyrosiini voidaan muodostaa välttämättömästä aminohaposta fenyylialaniinista:
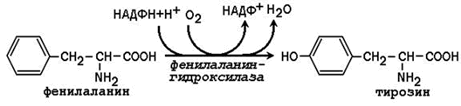
Fenyylialaniinihydroksylaasi on tyypillinen sytokromi P 450: stä riippuvainen hydroksylaasi, jolla on sekoitettu funktio: yksi happiatomi sisältyy veteen ja toinen tyrosiinin hydroksyyliryhmään. Kofaktori on pelkistävä aine. tetrahydrobiopteriinin, jota ylläpitää alennetussa tilassa NADPH-riippuvainen entsyymi dihydrobiopteriinireduktaasi.
Essentiaalinen aminohappo kysteiini syntetisoidaan osallistumalla välttämättömään aminohappoon metioniiniin, jota käytetään rikkiatomin lähteenä. Sen jälkeen kun metyyliryhmä on toipunut transmetylointireaktioissa, metioniini muuttuu homokysteiiniksi. Kun seriini on vuorovaikutuksessa korvattavan aminohapon kanssa, se muodostaa kystationiinin:
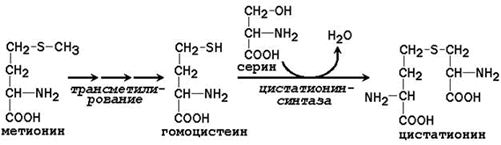
Kystationiini pilkotaan kysteiiniksi ja homoseriiniksi, joka deaminoidaan α-ketobutyraatiksi:
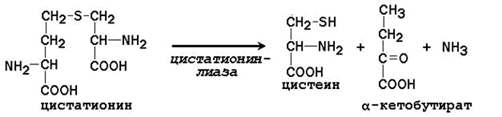
Siksi ruoan mukana toimitettua fenyylialaniinia ja metioniinia käytetään osittain välttämättömien aminohappojen synteesiin. Siksi fenyylialaniinin ja metioniinin päivittäinen tarve voidaan vähentää merkittävästi, kun tyrosiinin ja kysteiinin määrät otetaan vastaavasti lisää.
