Happi O on atominumero 8, joka sijaitsee pääryhmässä (alaryhmä a) VI ryhmä toisella jaksolla. Happiatomissa valenssielektronit sijaitsevat toisella energiatasolla, jolla on vain s- ja porbitaalien. Tämä sulkee pois mahdollisuuden O-atomien siirtymisestä viritetyssä tilassa, siksi kaikissa yhdisteissä hapen valenssi on yhtä suuri kuin II. Koska yhdisteillä on korkea elektronegatiivisuus, happiatomit ovat aina negatiivisesti varautuneita (niin \u003d 2 tai -1). Poikkeuksena ovat OF2- ja O2F2-fluoridit.
Hapelle tunnetaan hapetustilat -2, -1, +1, +2
Elementin yleiset ominaisuudet
Happi on maapallon runsain alkuaine, sen osuus on hieman alle puolet, 49% maankuoren kokonaismassasta. Luonnollinen happi koostuu 3 stabiilista isotoopista 16 O, 17 O ja 18 O (16 O vallitsee). Happi on osa ilmakehää (20,9 tilavuusprosenttia, 23,2 painoprosenttia), vettä ja yli 1 400 mineraalia: piidioksidi, silikaatit ja alumiinisilikaatit, marmorit, basaltit, hematiitti ja muut mineraalit ja kivet. Happi muodostaa 50-85% kasvien ja eläinten kudosten massasta, koska se sisältyy proteiineihin, rasvoihin ja hiilihydraateihin, jotka muodostavat eläviä organismeja. Hapen tunnettu rooli hengityksessä, hapetusprosesseissa.
Happi liukenee suhteellisen vähän veteen - 5 tilavuutta 100 tilavuusosaan vettä. Jos kaikki veteen liuennut happi menisi ilmakehään, niin se vie valtavan määrän - 10 miljoonaa km 3 (nu). Tämä on noin 1% kaikesta ilmakehän happeesta. Hapen ilmakehän muodostuminen maan päälle johtuu fotosynteesin prosesseista.
Avasivat ruotsalainen C. Scheele (1771 - 1772) ja englantilainen J. Priestley (1774). Ensimmäinen käytetty kuumennussuola, toinen - elohopeaoksidi (+2). Nimen on antanut A. Lavoisier (“oxygenigenium” - “happoa tuottava”).
Vapaassa muodossaan sitä esiintyy kahdessa allotrooppisessa muunnelmassa - ”tavallisessa” happea O 2 ja otsonia O 3.

Otsonimolekyylin rakenne
3 ° 2 \u003d 2 ° 3 - 285 kJ
Stratosfäärin otsoni muodostaa ohutkerroksen, joka absorboi suurimman osan biologisesti haitallisesta ultraviolettisäteilystä.
Varastoinnin aikana otsoni muuttuu itsestään happea. Kemiallisesti happi O 2 on vähemmän aktiivinen kuin otsoni. Hapen elektronegatiivisuus 3.5.
Hapen fysikaaliset ominaisuudet
O 2 - kaasu ilman väriä, hajua ja makua, joten pl. –218,7 ° C, kp –182,96 ° С, paramagneettinen.
Nestemäinen O 2 on sininen, kiinteä on sininen. O 2 liukenee veteen (paremmin kuin typpi ja vety).
Hapen tuotanto
1. Teollinen menetelmä - nestemäisen ilman tislaus ja veden elektrolyysi:
2Н 2 О → 2Н 2 + О 2 
2. Laboratoriossa happea saadaan:
1. Emäksisten vesipitoisten liuosten tai happea sisältävien suolojen vesipitoisten liuosten (Na2S04 ja muut) elektrolyysi
2. Kaliumpermanganaatin terminen hajoaminen KMnO 4:
2KMnO4 \u003d K2MnO4 + MnO2 + O2,
Bertoletova-suola KClO 3:
2KClO3 \u003d 2KCl + 3O2 (MnO2-katalyytti)
Mangaanioksidi (+4) MnO 2:
4MnO2 \u003d 2Mn2O3 + O2 (700 ° C),
3Mn02 \u003d 2Mn3O4 + O 2 (1000 ° C),
Bariumperoksidi BaO 2:
2BaO2 \u003d 2BaO + 02
3. Vetyperoksidin hajoaminen:
2H 2 O 2 \u003d H 2 O + O 2 (Mn02 katalyytti)
4. Nitraattien hajoaminen:
2KNO 3 → 2KNO 2 + O 2
Avaruusaluksissa ja sukellusveneissä happea saadaan K 2 O 2: n ja K 2 O 4: n seoksesta:
2K204 + 2H20 \u003d 4KOH + 302
4KOH + 2CO2 \u003d 2K2C03 + 2H20
yhteenveto:
2K204 + 2CO2 \u003d 2K2C03 + 3О2
Kun käytetään K 2 O 2: ta, kokonaisreaktio näyttää tältä:
2K2O2 + 2CO2 \u003d 2K2C03 + O2
Jos K2O2 ja K2O4 sekoitetaan tasaisesti (ts. Ekvimolaarisina) määrinä, vapautuu 1 mooli 02: ta yhtä moolia absorboitunutta hiilidioksidia kohti.
Hapen kemialliset ominaisuudet
 Happi tukee palamista. Palava - b
aineen nopea hapetusprosessi, johon liittyy suuri määrä lämpöä ja valoa.
Jotta voidaan todistaa, että pullossa on happea eikä muuta kaasua, on tarpeen laskea sulatusreikä pulloon. Hapessa haiseva soihtu syttyy kirkkaasti. Erilaisten aineiden palaminen ilmassa on redox-prosessi, jossa happi on hapettava aine. Hapettavat aineet ovat aineita, jotka “poistavat” elektroneja pelkistävistä aineista. Hapen hyvät hapettavat ominaisuudet voidaan helposti selittää sen ulkoisen elektronikuoren rakenteella.
Happi tukee palamista. Palava - b
aineen nopea hapetusprosessi, johon liittyy suuri määrä lämpöä ja valoa.
Jotta voidaan todistaa, että pullossa on happea eikä muuta kaasua, on tarpeen laskea sulatusreikä pulloon. Hapessa haiseva soihtu syttyy kirkkaasti. Erilaisten aineiden palaminen ilmassa on redox-prosessi, jossa happi on hapettava aine. Hapettavat aineet ovat aineita, jotka “poistavat” elektroneja pelkistävistä aineista. Hapen hyvät hapettavat ominaisuudet voidaan helposti selittää sen ulkoisen elektronikuoren rakenteella.
Hapen valenssikuori sijaitsee 2. tasolla - suhteellisen lähellä ydintä. Siksi ydin houkuttelee voimakkaasti elektroneja. Hapen valenssikuoressa 2s 2 2p 4 elektroneja on 6. Siksi oktettista saakka puuttuu kaksi elektronia, jota happea pyrkii ottamaan muiden elementtien elektronikuorista reagoidessaan niiden kanssa hapettimena.
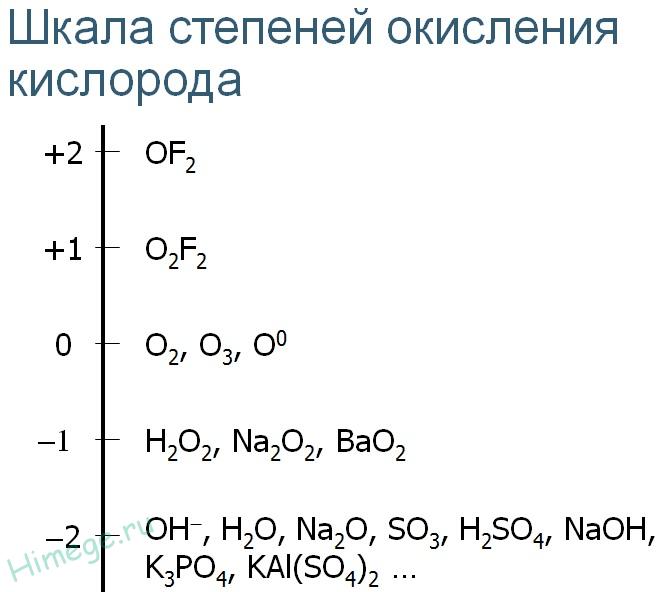 Happilla on toinen (fluorin jälkeen) elektronegatiivisuus Paulingin asteikolla. Siksi hapessa on suurimmassa osassa sen yhdisteitä muiden elementtien kanssa negatiivinen hapetustila. Vahvempi hapetin kuin happi on vain sen jakson naapuri - fluori. Siksi happi- ja fluoriyhdisteet ovat ainoat, joissa hapolla on positiivinen hapetustila.
Happilla on toinen (fluorin jälkeen) elektronegatiivisuus Paulingin asteikolla. Siksi hapessa on suurimmassa osassa sen yhdisteitä muiden elementtien kanssa negatiivinen hapetustila. Vahvempi hapetin kuin happi on vain sen jakson naapuri - fluori. Siksi happi- ja fluoriyhdisteet ovat ainoat, joissa hapolla on positiivinen hapetustila.
Joten happi on toiseksi voimakkain hapettava aine kaikista jaksollisen järjestelmän elementeistä. Suurin osa sen tärkeimmistä kemiallisista ominaisuuksista liittyy tähän.
Kaikki alkuaineet paitsi Au, Pt, He, Ne ja Ar reagoivat hapen kanssa kaikissa reaktioissa (paitsi vuorovaikutuksessa fluorin kanssa) happi - hapetin.
 Happi reagoi helposti alkali- ja maa-alkalimetallien kanssa:
Happi reagoi helposti alkali- ja maa-alkalimetallien kanssa:
4Li + O 2 → 2Li 2 O,
2K + O 2 → K 2 O 2,
2Ca + O 2 → 2CaO,
2Na + O 2 → Na 2 O 2,
2K + 2O 2 → K 2 O 4
Hieno rautajauhe (ns. Pyroforinen rauta) syttyy itsestään itsestään ilmassa muodostaen Fe 2 O 3: ta ja teräslanka palaa happea, jos sitä kuumennetaan etukäteen:
3 Fe + 2O 2 → Fe 3 O 4
2Mg + O 2 → 2MgO
2Cu + O 2 → 2CuO
Ei-metallien (rikki, grafiitti, vety, fosfori jne.) Kanssa happi reagoi kuumennettaessa:
S + O 2 → SO 2,
C + O 2 → CO 2,
2H 2 + O 2 → H 2 O,
4P + 5O 2 → 2P 2 O 5,
Si + O 2 → SiO 2 jne.
Lähes kaikki happea O 2 sisältävät reaktiot ovat eksotermisiä, harvoin poikkeuksin, esimerkiksi:
N 2 + O 2 → 2NO - Q
Tämä reaktio etenee yli 1200 o C: n lämpötilassa tai sähköpurkauksena.
Happi pystyy hapettamaan monimutkaisia \u200b\u200baineita, esimerkiksi:
2H 2S + 3O 2 → 2SO 2 + 2H 2O (ylimäärä happea),
2H 2S + O 2 → 2S + 2H 2 O (happivaje),
4NH3 + 3O2 → 2N2 + 6H20 (ilman katalyyttiä),
4NH3 + 5O 2 → 4NO + 6H20 (Pt-katalyytin läsnä ollessa),
CH4 (metaani) + 2O 2 → CO 2 + 2H 2O,
4FeS2 (pyrite) + 11O 2 → 2Fe 2 O 3 + 8SO 2.
Yhdisteet, jotka sisältävät dioksigenyyli-O2 + -kationia, esimerkiksi O2 + -, tunnetaan (tämän yhdisteen onnistunut synteesi sai N. Bartlettia yrittämään saada inerttejä kaasuyhdisteitä).

otsoni
Otsoni on kemiallisesti aktiivisempi kuin happi O 2. Joten otsoni hapettaa jodidia - ioneja I - Kl-liuoksessa:
O3 + 2Kl + H20 \u003d I 2 + O 2 + 2 KOH
Otsoni on erittäin myrkyllinen, sen myrkylliset ominaisuudet ovat vahvempia kuin esimerkiksi rikkivetyssä. Luonnossa ilmakehän korkeisiin kerroksiin sisältyvä otsoni toimii kuitenkin koko maapallon elämän suojelijana auringon tuhoisalta ultraviolettisäteilyltä. Ohut otsonikerros imee tämän säteilyn, eikä se päästä maan pintaan. Tämän kerroksen paksuuden ja laajuuden merkittäviä vaihteluita ajanjaksolla (ns. Otsonireiät) havaitaan, sellaisten heilahtelujen syitä ei ole vielä selvitetty.
Hapen käyttö O 2: harkkoraudan ja teräksen tuotantoprosessien tehostamiseen, ei-rautametallien sulattamiseen, hapettimena erilaisissa kemianteollisuuksissa, sukellusveneiden tukemiseen sukellusveneissä, rakettipolttoaineen (nestemäinen happi) hapettimena, lääketieteessä sekä metallien hitsaamiseen ja leikkaamiseen.
Otsonin O 3 käyttö: juomaveden, jäteveden, ilman desinfiointiin, kankaiden valkaisuun.
Tiivistelmän valmisti luokan 9 “A” opettaja Vasilyeva N.
Venäjän federaation opetusministeriö
Yläasteen koulun numero 34.
habarovsk
minä . Johdanto.
Jos tarkastellaan jaksollisen järjestelmän taulukkoa D.I. Mendeleev ja katsokaa ryhmää VI, voit nähdä, että siinä on elementtejä, joiden atomeissa on 6 valenssielektronia ja niiden suurin hapetustila yhdisteissä on +6. Ryhmä VI on jaettu kahteen alaryhmään - pää- ja toissijaiseen. Pääosa sisältää pienten ja suurten jaksojen alkuaineita: O (happi), S (rikki), Se (seleeni), Te (telluuri), Po (polonium); sivulle vain suurten jaksojen elementit: Cr (kromi), Mo (molybdeeni), W (volframi). Tällainen jakauma osoittaa, että jopa yhden ryhmän sisällä on elementtejä, jotka ovat ominaisuuksiltaan lähempänä toisiaan ja vähemmän samanlaisia.
Itse asiassa pääryhmässä on elementtejä, jotka ovat luonteeltaan pääasiassa ei-metallisia. Vahvimmin nämä ominaisuudet ilmenevät happeessa ja rikissä. Seleeni ja telluuri vievät väliaseman metallien ja ei-metallien välillä. Kemiallisista ominaisuuksistaan \u200b\u200bne ovat lähempänä ei-metalleja. Poloniumissa, alaryhmän raskaimman elementin, radioaktiivisen ja suhteellisen lyhytaikaisen metallin luonne on selvempi, mutta joissain ominaisuuksissa se on lähellä telluuria. Niinpä siirtyessä happeesta poloniumiin, kidehilan rakennetyypeissä on suuri monimuotoisuus, sekä yksinkertaisissa aineissa että niiden yhdisteissä.
Happi, rikki, seleeni ja telluuri yhdistetään "kalkogeenien" ryhmään, joka kreikan kielellä tarkoittaa "malmien tuottamista". Nämä elementit ovat osa monia malmeja. Joten suurin osa luonnossa olevista metalleista on sitoutuneessa tilassa sulfidien, oksidien, selenidien jne. Muodossa. Esimerkiksi tärkeimmät rauta- ja kuparimalmit ovat punainen rautamalmi Fe2O3, magneettinen rautamalmi Fe3O4, pyrite FeS2, punainen magneettimalmi Cu2O ja kuparin kiilto Cu2S. Kaikkien malmien koostumus sisältää ryhmän VI elementtejä.
Alaryhmä koostuu metalleista: kromi, molybdeeni ja volframi. Useimpien fysikaalisten ja kemiallisten ominaisuuksiensa perusteella molybdeeni ja volframi ovat samankaltaisia \u200b\u200bja eroavat jonkin verran kromista.
II . Elementtien karakterisointi VI alaryhmiä.
Elementtien kemialliset ominaisuudet määräytyvät pääasiassa ulkoisten elektronisten kerrosten rakenteen mukaan (energiatasot). Yllä oleva kaavio (kuva 1) esittää ryhmän VI elementtien atomikerrosten peräkkäisen täyttämisen elektronilla.
Kerrosten (Z) suurin mahdollinen elektronien lukumäärä määritetään kaavalla: Z \u003d 2n2, missä n on kerroksen lukumäärä.
Tämän riippuvuuden mukaan elektronien lukumäärän tulisi olla yhtä suuri: ensimmäisessä kerroksessa - 2, toisessa - 8, kolmannessa - 18, neljännessä - 32 jne. Yli 32 elektronia ei kuitenkaan löydetty minkään tällä hetkellä tunnetun elementin atomikerroksesta.
8 2 6 1 13 8 2 +24
16 2 8 6 1 13 18 8 2 +42
34 2 8 18 6 2 12 32 18 8 2 +74
84 2 8 18 32 18 6
Kuva 1. Ryhmän VI elementtien atomien rakennekaavio.
Ryhmän VI elementtien atomien elektroninen rakenne voidaan esittää seuraavasti (taulukko. 1).
Taulukko 1
Ryhmän VI elementtien atomien elektroniset kokoonpanot
16S1s2 2s2 2p6 3s2 3p4
34Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
52Te 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p4
84Po 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p4
24Cr 1s2 2s2 2p6 3s2 3p6 3d5 4s1
42Mo 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1
74W 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2
Jos tarkastelemme tarkkaan esitettyjä rakenteita, voit nähdä, että kaikkien näiden elementtien atomien kahden viimeisen alatason elektronien summa on 6. Tämä on syy yhteisiin kemiallisiin ominaisuuksiin. Mutta pää- ja toissijaisten alaryhmien elementtien atomien välillä on myös suuri ero elektronisissa kokoonpanoissa.
Ulommassa elektronikerroksessa olevan pääryhmän elementtien atomilla on sama määrä elektroneja - 6. Viimeksi mainitut sijaitsevat s- ja p-alatasoilla (s2 p4) ja osallistuvat kemiallisten sidosten muodostumiseen.
Elementtejä, joiden atomit täytetään elektronilla ulkokerroksen p-alatasolla, kutsutaan p-elementeiksi. Tällaisia \u200b\u200bovat happi, rikki, telluuri, seleeni ja polonium: niiden atomissa s-alataso on täytetty ja ulkokerroksen p-alataso on elektronilla. Näiden elementtien atomien taipumus kohti lisää (kaksi) elektronia vetoaa neutraaleihin atomiin verrattuna. Se ilmenee yhdisteissä, jotka eivät sisällä metalleja (CuS, Na2S, K2Te) ja negatiivisina ioneina aktiivisimpien metallien (S2-, Se2-, Te2-) sulasuoloissa.
On huomattava, että telluurin ja poloniumin atomeilla ei ole toiseksi viimeistä kerrosta, toisin kuin happea, rikkiä ja seleeniä, jossa se on täynnä. Mutta ryhmän VI p-elementtien yhteisistä ominaisuuksista huolimatta niiden välillä on joitain eroja.
Kromin ja molybdeenin atomeissa on 1 elektroni ulommassa elektronikerroksessa ja 13 elektronia viimeisimmässä. Volframiatomeilla elektronikerrosten lukumäärä ulkokerroksessa nousee 2: een ja yhden ainoan pienenee 12: een. Elementtejä, joiden atomissa ulkokerroksen vieressä olevan kerroksen d-alitaso on täynnä elektrooneja, kutsutaan d-elementeiksi. Tällaisia \u200b\u200bovat kromi, molybdeeni ja volframi.
Siksi sekundaarisen alaryhmän (d-elementtien) elementtien ulkokerrosta edustaa vain s-alataso ja kemiallisen sidoksen muodostumisessa, mukaan lukien 1-2 elektronia tästä ylemmästä tasosta, mukana on tietty määrä elektroneja viimeisen viimeisen kerroksen d-ylätasosta. Nämä erot vaikuttavat d-elementtien kemiallisiin ominaisuuksiin. Ensinnäkin, nämä ovat metalleja. Niiden spesifiset ominaisuudet liittyvät pieneen määrään atomien ulkoisia elektroneja. Tietyissä olosuhteissa, esimerkiksi happojen vesiliuoksissa, 2 tai 3 elektronia siirtyvät täysin muihin atomiin, ja metalliatomit muuttuvat vastaavasti kaksi- tai kolmevaraisiksi hydratoituiksi kationeiksi. Metalliatomien kyky siirtää osittain tai kokonaan elektronejaan muihin atomiin aiheuttaa vahvojen yhdisteiden muodostumisen ei-metallisten kanssa, vedyn siirtymisen hapoista, oksidien ja hydroksidien emäksisen luonteen jne.
Joten elektronien lukumäärä ja tila atomin ulkoisilla tasoilla on yksi tärkeimmistä merkeistä kemiallisesta luonteesta. Yksittäisten elementtien kemiallisen yksilöllisyyden - niiden metallisen ja ei-metallisen aktiivisuuden - määräävät paitsi atomien ulkoiset elektroniset rakenteet, myös atomien koko rakenne: ytimen varaus, yksittäisten kerrosten elektronien lukumäärä ja tila sekä atomien säteet.
Elementtien kemiallisten ominaisuuksien kvantitatiivinen ominaisuus määräytyy ulkoisen elektronisen kerroksen rakenteen mukaan, joka voi sisältää yhden eri kerroksen kerroksen elektroneja tai joskus kahden vierekkäisen kerroksen vierekkäisiä alatasoja (esimerkiksi sekundaaristen alaryhmien elementeille).
Happiatomissa on kaksi neljästä p-elektronista, ja siksi viritysenergiaa (a) ei tarvita kahden elektroniparin muodostukseen, kun ne ovat vuorovaikutuksessa yhden tai toisen atomin kanssa. Solut vastaavat tiettyjä elektronien tiloja (kiertoratoja) jokaisessa alatasossa; alatasoille on ominaista elektronisten pilvien eri muodot. Kaaviossa olevat elektronit on esitetty nuolella. Kaikissa yhdisteissä hapetustila -2 on tyypillinen hapelle, lukuun ottamatta O + 2F2 ja O + 4O2 (otsoni).
Happianalogien (rikki, seleeni, telluuri ja polonium) tilanne on täysin erilainen. Esimerkiksi rikkiatomin ulkoisessa elektronikerroksessa on myös 6 elektronia, mutta toisin kuin happi, niitä voi olla 18, ts. on vapaita paikkoja (b). Siksi, jotta rikki pääsee reaktioon, saavuttamaan yhdisteiden hapetustilan +4 tai +6, atomin pieni viritys on tarpeen, koska elektronit siirretään saman energiakerroksen d-alitasoon, mikä epäilemättä vaatii tietyn määrän energiaa (c ja d).
Samaa selitystä voidaan soveltaa seleeniin, telluuriin, poloniumiin ja kromialaryhmän metalleihin. Nämä elementit voivat osoittaa vaihtelevia hapetusasteita: välillä -2 - +6.
Taulukko 2
Ryhmän VI elementtien atomien mahdolliset hapettumistilat
Taulukko 2 näyttää ryhmän VI elementtien atomien hapetustilat.
Pääryhmän elementeillä on laajat rajat hapettumisasteen muuttamiseksi: suurimmasta mahdollisesta negatiivisesta -2: stä erittäin positiiviseen, joka vastaa ryhmän numeroa.
Siirtyessään happeesta telluuriin ja kromista volframiin, sulamis- ja kiehumispisteet kasvavat. Happilla on alhaisimmat kiehumis- ja sulamislämpötilat, koska sen molekyylin polarisoitavuus on pieni. Tämä voi myös selittää hapen heikon liukoisuuden veteen: 5 tilavuusosaa O2: ta 100 tilavuusyksikössä H20: ta 0 ° C: ssa.
Kaikkein tulenkestävämpi ja korkeimmalla kiehuva metalli kaikista metalleista on volframi. Sen kiehumispiste on melkein 6000 ° C, kuten auringon pinnalla. Volframi sulaa 3380 ° C: ssa. Tässä lämpötilassa suurin osa metalleista muuttuu höyryksi.
Ryhmän VI metallien korkeat sulamispisteet selitetään sillä, että niillä on korkea elektronitiheys, ts. Suuri määrä vapaita elektroneja tilavuusyksikköä kohti. Kuten tiedät, metallisidos johtuu vapaiden elektronien vuorovaikutuksesta ioniatomien kanssa. Ryhmän VI metalleissa vapaiden elektronien lukumäärä saavuttaa kuusi jokaisesta ioniatomista, ja siksi ne ovat myös tulenkestäviä.
Tarkemmin puhun happea.
III . Tarina hapen löytämisestä.
Hapen löytö merkitsi modernin kemian kehitysjakson alkua. Muinaisista ajoista lähtien on ollut tiedossa, että palamista varten tarvitaan ilmaa, mutta satojen vuosien ajan palamisprosessi pysyi käsittämättömänä. Kaksi huomattavaa kemistiä löysi happea melkein samanaikaisesti 1700-luvun jälkipuoliskolla. - Ruotsalainen Karl Scheele ja englantilainen Joseph Priestley. K. Scheele sai ensimmäisenä happea, mutta hänen teoksensa "Ilma ja tuli", jossa tämä kaasu kuvailtiin, ilmestyi jonkin verran myöhemmin kuin D. Priestleyn viesti.
K. Scheele ja D. Priestley löysivät uuden elementin, mutta eivät ymmärtäneet sen roolia palamis- ja hengitysprosesseissa. Päivänsä loppuun saakka he pysyivät phlogiston-teorian puolustajina: palamisella tarkoitettiin palavan kappaleen rappeutumista ja phlogistonin vapautumista, jossa jokainen palava aine muuttui palamattomaksi:
sinkki \u003d phlogiston + sinkkioksidi
(polttoaine) (ei-polttoaine)
Siksi metalleja, rikkiä ja muita yksinkertaisia \u200b\u200baineita pidettiin monimutkaisina ja päinvastoin kompleksisina aineina - yksinkertaisia \u200b\u200b(kalkki, hapot jne.).
Phlogiston-teorian kannattajat selittivät polttoilman tarvetta sillä, että phlogiston ei vain katoa palamisen aikana, vaan se yhdistyy ilmaan tai sen osaan. Jos ilmaa ei ole, palaminen pysähtyy, koska phlogistonilla ei ole mitään yhteyttä.
F. Engels K. Scheelen ja D. Priestleyn löytöstä kirjoitti: molemmat "he eivät tienneet mitä heidän käsissään oli ... Se elementti, jonka oli tarkoitus kaata kaikki logistiset näkemykset ja mullistaa kemia, katosi heidän käsissään kokonaan". Lisäksi F. Engels kirjoitti, että hapen löytö kuuluu Lavoisierille, koska C. Scheele ja D. Priestley eivät edes tienneet, mitä he kuvaavat.
Kemia vapautui phlogiston-teoriasta johtuen tarkkojen tutkimusmenetelmien käyttöönotosta kemiassa, jonka alku määritettiin MV Lomonosovin teoksilla. Vuosina 1745-1748. MV Lomonosov osoitti kokeellisesti, että palaminen on aineyhdisteen reaktio ilmahiukkasten kanssa.
Ranskalainen kemisti Antoine Lavoisier vietti kymmenen vuotta (1771-1781) vahvistaakseen palamisen teorian paikkansapitävyyden erilaisten aineiden kemiallisena vuorovaikutuksena hapen kanssa. Aluksi tutkia metallien palamisen ja ”palamisen” ilmiöitä, hän kirjoitti: ”Ehdotan toistaa kaiken edeltäjiensä tekemän kaikenlaiset varotoimenpiteet yhdistääkseen jo tiedossa olevan sidotun tai vapautuneen ilman muiden tosiasioiden kanssa ja antaa uuden teorian. Mainittujen kirjoittajien teokset antavat tästä näkökulmasta katsottuna ketjun yksittäiset linkit ... Mutta täydellisen johdonmukaisuuden saavuttamiseksi on tehtävä monia kokeita. ” Lokakuussa 1772 aloitetut vastaavat kokeet asetti A. Lavoisier tiukasti kvantitatiivisesti punnitsemalla huolellisesti alkuperäiset ja lopulliset reaktiotuotteet. Hän lämmitti elohopeaa suljetussa retortissa ja havaitsi sen ilmamäärän vähentyneen, "elohopea-asteikon" punaisten asteikkojen muodostumisen. Toisessa jälkikäteen hän hajotti edellisessä kokeessa saadun ”elohopeaasteikon”, sai elohopeaa ja pienen määrän kaasua, jota D. Priestley kutsui ”log-ilmaan” ja päätteli: kuinka paljon ilmaa kulutetaan elohopean muuttamiseksi mittakaavaksi, niin paljon talteen otetaan kun hajoaa vaaka.
Retortin muuta ilmaa, joka ei ollut mukana reaktiossa, kutsuttiin typeksi, joka tarkoitti elottomana (kreikkaksi ”a” tarkoittaa kieltämistä, “zoe” tarkoittaa elämää). "Elohopea-asteikon" hajoamisen seurauksena muodostuneella kaasulla oli typen vastakkaiset ominaisuudet - se tuki hengitystä ja palamista. Siksi A. Lavoisier kutsui sitä "elintärkeäksi". Myöhemmin hän korvasi tämän nimen kreikan kieleltä lainatulla latinalaisella sanalla “oxygenum”, jossa sana “oxus” tarkoittaa hapanta ja “gennao” - synnydan, tuotan (tuotan happoa). Elementin nimi käännetään kirjaimellisesti venäjäksi - ”happea”.
Joten vuonna 1777 polttamisen ydin selkeytettiin. Ja tarve phlogistonille - ”tuliselle aineelle” - on kadonnut. Palamisen happiteoria on korvannut phlogiston-teorian.
IV . Hapen biologinen merkitys.
Happi on maapallon runsain alkuaine, sen osuus (erilaisten yhdisteiden, pääasiassa silikaattien koostumuksessa) on noin 47,4% kiinteän maankuoren massasta. Meri ja makeat vedet sisältävät valtavan määrän sitoutunutta happea - 88,8% (painosta), ilmakehässä vapaan hapen pitoisuus on 20,95% (tilavuudesta). Happielementti on osa yli 1500 maankuoren yhdistettä.
Happi on tärkein biogeeninen elementti, joka on osa kaikkien tärkeimpien aineiden molekyylejä, jotka tarjoavat solujen rakenteen ja toiminnot - proteiinit, nukleiinihapot, hiilihydraatit, lipidit sekä monet pienimolekyylipainoiset yhdisteet. Jokaisessa kasvissa tai eläimessä on paljon enemmän happea kuin missään muussa alkuaineessa (keskimäärin noin 70%). Ihmisen lihaskudos sisältää 16% happea, luukudos - 28,5%; Keskimääräisen ihmisen ruumiissa (ruumiinpaino 70 kg) on \u200b\u200byhteensä 43 kg happea. Eläimissä ja ihmisissä happi saapuu pääasiassa hengityselinten (vapaa happi) ja veden (sitoutunut happi) kautta. Kehon hapntarve määräytyy aineenvaihdunnan tason (intensiteetin) mukaan, joka riippuu kehon massasta ja pinnasta, iästä, sukupuolesta, ruokavaliosta, ympäristöolosuhteista jne. Ekologiassa yhteisön kokonaisen hengityksen (ts. Kokonaishapetusprosessien) suhde määritetään tärkeän energiaominaisuuden perusteella organismit sen kokonaisbiomassaan.
Lääketieteessä käytetään pieniä määriä happea: happea (ns. Happea-tyynyistä) annetaan jonkin aikaa hengittää potilaille, joilla on hengitysvaikeuksia. On kuitenkin pidettävä mielessä, että happea sisältävän ilman pitkäaikainen hengittäminen on haitallista ihmisten terveydelle. Korkeat happipitoisuudet aiheuttavat kudoksissa vapaiden radikaalien muodostumisen, mikä häiritsee biopolymeerien rakennetta ja toimintaa. Samanlaisia \u200b\u200bvaikutuksia kehossa on ionisoivaa säteilyä. Siksi kudosten ja solujen happipitoisuuden (hypoksia) vähentymisellä, kun kehoa säteilytetään ionisoivalla säteilyllä, on suojaava vaikutus - ns. Happivaikutus. Tätä vaikutusta käytetään säteilyhoidossa: kasvaimen happipitoisuuden lisääminen ja sen pitoisuuden alentaminen ympäröivissä kudoksissa lisää kasvainsolujen säteilyvaurioita ja vähentää terveiden solujen vaurioita. Joissakin sairauksissa happikyllästystä käytetään korotetussa paineessa - hyperbaarinen hapetus.
V . Hapen fysikaaliset ja kemialliset ominaisuudet.
Kemiallinen elementtihappi muodostaa kaksi yksinkertaista ainetta - happea O2 ja O3, joiden fysikaaliset ominaisuudet eroavat toisistaan.
Happi O2 on kaasu, jolla ei ole väriä ja hajua. Sen molekyyli on O2. Se on paramagneettinen (vetää magneettia), koska se sisältää kaksi paritonta elektronia. Happimolekyylin rakenne voidaan esittää seuraavien rakennekaavojen muodossa:
O - O tai O - O
Ilmakehän happi koostuu piimaan sisäisistä molekyyleistä. Interatominen etäisyys O2-molekyylissä on 0,12074 nm. Molekyylihappi (kaasumainen ja nestemäinen) on paramagneettinen aine, jokaisessa O2-molekyylissä on 2 paritonta elektronia. Tämä tosiasia voidaan selittää sillä, että molekyylissä on yksi pariton elektroni jokaisella löysäävällä kiertoradalla.
O2-molekyylin dissosioitumisen energia atomiksi on melko korkea ja se on 493,57 kJ / mol.
Happimolekyyli O2 on melko inertti. Happimolekyylin stabiilisuus ja useimpien hapettumisreaktioiden korkea aktivaatioenergia mahdollistavat sen, että matalassa ja huoneenlämpötilassa monet happea sisältävät reaktiot etenevät tuskin havaittavalla nopeudella. Vain kun luodaan olosuhteet radikaalien - O- tai R-O-O- - esiintymiselle, jotka kiihdyttävät ketjuprosessia, hapettuminen etenee nopeasti. Tässä tapauksessa käytetään esimerkiksi katalyyttejä, jotka kykenevät nopeuttamaan hapettumisprosesseja.
Normaaleissa olosuhteissa happikaasun tiheys on 1,42897 kg / m3. Nestemäisen hapen (neste on sininen) kiehumispiste on -182,9 ° C. Lämpötiloissa -218,7 ° C - -229,4 ° С on kiinteää happea kuutiomaisella hilalla (-modifikaatio), lämpötiloissa -229,4 ° С - -249,3 ° С - modifiointi kuusikulmaisella hilalla ja lämpötiloissa alle -249,3 ° С - kuutiomodifikaatio. Korotetussa paineessa ja alhaisissa lämpötiloissa saatiin myös muita kiinteän hapen muunnoksia.
20 ° C: ssa O2-kaasun liukoisuus: 3,1 ml / 100 ml vettä, 22 ml / 100 ml etanolia, 23,1 ml / 100 ml asetonia. Orgaanisia fluoria sisältäviä nesteitä esiintyy (esim. Perfluoributyylitetrahydrofuraani), joissa hapen liukoisuus on paljon korkeampi.
O2-molekyylin atomien välisen kemiallisen sidoksen korkea lujuus johtaa siihen, että huoneenlämpötilassa kaasumainen happi on kemiallisesti melko passiivinen. Luonnossa se muuttuu hitaasti muutoksiksi rappeutumisprosessien aikana. Lisäksi huoneenlämpötilassa oleva happi pystyy reagoimaan veren hemoglobiinin kanssa, mikä varmistaa hapen siirtymisen hengityselimestä muihin elimiin.
Happi on vuorovaikutuksessa monien aineiden kanssa kuumentamatta, esimerkiksi alkali- ja maa-alkalimetallien kanssa (muodostuu vastaavia tyyppejä Li2O, CaO jne., Tyypin Na2O2, BaO2 peroksideja ja tyypin KO2, RbO2 jne. Superoksideja). ruoste terästuotteiden pinnalla. Kuumentamatta happi reagoi valkoisen fosforin, joidenkin aldehydien ja muiden orgaanisten aineiden kanssa.
Pienessäkin lämmitettäessä hapen reaktiivisuus kasvaa voimakkaasti. Palaessaan se reagoi räjähdyksen kanssa vedyn, metaanin ja muiden palavien kaasujen kanssa, lukuisten yksinkertaisten ja monimutkaisten aineiden kanssa.
Normaali ilmakehän happi koostuu seoksesta, joka koostuu kolmesta isotoopista: 16O (99,7%), 17O (0,01%), 18O (0,2%). Koska 17: n ja 18: n isotooppien pitoisuus happeessa on pieni verrattuna 16: n isotooppiin, hapen atomimassan oletetaan olevan 15 999 o o. e.
Luonnollisista olosuhteista riippuen hapen isotooppinen koostumus voi muuttua, joko rikastetuin raskaille isotoopeille tai ehtyneille niistä. Joten vesimolekyylit Н216О siirtyvät höyryn tilaan suhteellisen helposti kuin molekyylit Н217О ja Н218О. Siksi merestä haihtuvien vesihöyryjen koostumus sisältää happea, jonka raskasten isotooppien pitoisuus on suhteellisen pienempi kuin merivedessä jäävän hapen.
Raskaan happi-isotoopin 18О atomeja käyttämällä oli mahdollista määrittää kasvien fotosynteesin aikana vapauttaman hapen "alkuperä". Sen ajateltiin vapauttavan happea hiilimonoksidimolekyyleistä, ei vedestä. Tällä hetkellä on tullut tunnetuksi, että kasvit sitovat hiilimonoksidihappoa ja veden happi palautetaan ilmakehään.
Happi muodostaa yhdisteitä kaikkien alkuaineiden kanssa, lukuun ottamatta joitain jalokaasuja (helium, neon, argon). Joten useimpien metallien kanssa happi reagoi jopa huoneenlämpötilassa, esimerkiksi:
2Na ° + О2 ° \u003d Na2 + 102-2
Na ° -1 (g) Na + 1 2 pelkistävä aine
O2 ° +2 (g) 2 2O-2 hapettava aine
2Zn ° + O2 ° \u003d 2Zn + 2O-2
Zn ° -2 (g) Zn + 2 pelkistävä aine
O2 ° +2 (g) 2 2O-2 hapettava aine
Happi reagoi ei-metallien kanssa yleensä kuumennettaessa. Joten happi reagoi aktiivisesti fosforin kanssa lämpötilassa 60 ° C:
4P ° + 502 ° \u003d 2P2 + 505-2
P ° -5 (g) P + 52 pelkistävä aine
O2 ° +2 (g) 2 2O-2 5 hapettava aine
rikillä - lämpötilassa noin 250 ° C:
S ° + 02 ° \u003d S + 402-2
S ° -4 (g) S + 4 pelkistävä aine
O2 ° +2 (g) 2 2O-2 2 hapettava aine
hiilellä (grafiitin muodossa) - lämpötilassa 700–800 ° C:
С ° + О2 ° \u003d С + 4О2-2
C ° -4 (g) C + 4 pelkistävä aine
O2 ° +2 (g) 2 2O-2 2 hapettava aine
Hapen ja typen vuorovaikutus alkaa vasta 1200 ° C: ssa tai sähköpurkauksessa:
N2 + O2 2NO - Q.
Happi reagoi monien monimutkaisten yhdisteiden kanssa, esimerkiksi typen oksidien kanssa, se reagoi jopa huoneenlämpötilassa:
2N + 2O + O2 ° \u003d 2N + 4O2-2
N + 2 -2 (g) N + 4 1 pelkistävä aine
O2 ° +2 (g) 2 2O-2 2 hapettava aine
Rikkivety, reagoidessaan hapen kanssa kuumennettuaan, tuottaa rikkiä:
2H2S-2 + О2 ° \u003d 2S ° + 2Н2О-2
S-2 -2 (d) S ° pelkistin
O2 ° +2 (g) 2 2O-2 hapettava aine
tai rikkioksidi (IV)
2H2S + ZO2 \u003d 2SO 2 + 2H 2O
riippuen hapen ja rikkivedyn välisestä suhteesta.
Edellä olevissa reaktioissa happi on hapettava aine. Useimmissa hapettumisreaktioissa, joihin liittyy happea, vapautuu lämpöä ja valoa - sellaisia \u200b\u200bprosesseja kutsutaan palamisiksi.
Hapen allotrooppinen muuntaminen on otsonia. Sen molekyyli on triatominen - O3. Sen rakennetta voidaan kuvata seuraavalla rakennekaavalla:
Mahdolliset muutokset samojen atomien lukumäärässä tai järjestelyssä molekyylissä edellyttävät laadullisesti uuden aineen, jolla on erilaisia \u200b\u200bominaisuuksia, ilmestymistä. Ominaisuuksissaan otsoni eroaa hapesta. Normaaliolosuhteissa se on sinistä kaasua, jossa on pistävä, ärsyttävä haju. Sen nimi tulee kreikkalaisesta sanasta "ozane", joka tarkoittaa hajua. Se on myrkyllistä. Toisin kuin happi, otsonimolekyylille on ominaista suuri molekyylipaino, polarisoitavuus ja polaarisuus. Siksi otsonilla on korkeampi kiehumispiste (-111,9 ° C) kuin hapolla (-182,9 ° C), voimakas väri ja parempi liukoisuus veteen.
Luonnollisissa olosuhteissa otsonia muodostuu happea salamanpurkausten aikana ja 10-30 km: n korkeudessa - ultraviolettivalon auringonvalon vaikutuksesta. Se viivästyttää auringon haitallista ultraviolettisäteilyä. Lisäksi otsoni imee maan infrapunasäteet estäen sen jäähtymisen. Tämän seurauksena hapen allotrooppisella muodolla - otsonilla - on suuri rooli maan elämän säilyttämisessä.
Otsonin muodostumiseen liittyy atomisen hapen vapautuminen. Nämä ovat pääosin ketjureaktioita, joissa aktiivisen hiukkasen (yleensä merkitty *: llä) esiintyminen aiheuttaa suuren määrän (ketjua) inaktiivisten molekyylien peräkkäisiä muutoksia, esimerkiksi O2. Hapen otsonin muodostumisen ketjureaktio voidaan ilmaista seuraavasti:
* O2 + O2 \u003d O3 + O
O + O2 \u003d O3,
tai yhteensä:
Teknologiassa otsonia tuotetaan otsonisaattoreiden sähköpurkauksilla.
O3-molekyyli on epävakaa, ja suurissa pitoisuuksissa otsoni hajoaa räjähdyksellä:
Otsonin hapettava vaikutus on paljon korkeampi kuin hapen. Esimerkiksi jo tavanomaisissa olosuhteissa otsoni hapettaa sellaisia \u200b\u200binaktiivisia yksinkertaisia \u200b\u200baineita kuin hopea ja elohopea muodostaen niiden oksidit ja happi:
8Ag +203 \u003d 4Ag20 + O2
Vahvana hapettavana aineena otsonia käytetään juomaveden puhdistamiseen ja ilman desinfiointiin. Havumetsien ilmaa pidetään hyödyllisenä, koska se sisältää pienen määrän otsonia, joka muodostuu havupuiden hartsin hapettumisen aikana.
Happi O3 (hapen allotrooppinen modifikaatio) on vielä voimakkaampi hapettava aine kuin happi O2. Se muodostuu ilmakehään salamanpurkauksen aikana, mikä selittää ukkosen jälkeisen raikkauden erityisen hajun.
Laboratorioissa otsonia saadaan johtamalla päästö happea läpi (endoterminen reaktio):
302 203 - 284 kJ.
Kun otsoni on vuorovaikutuksessa kaliumjodidiliuoksen kanssa, jodi vapautuu, kun taas tätä reaktiota ei tapahdu hapen kanssa:
2KI + 03 + H20 \u003d I2 + 2KOH + 02.
Reaktiota käytetään usein laatureaktioina I- tai otsoni-ionien havaitsemiseksi. Tätä varten liuokseen lisätään tärkkelystä, joka antaa ominaisen sinisen kompleksin vapautuneen jodin kanssa. Reaktio on myös kvalitatiivinen, koska otsoni ei hapetta Cl- ja Brionit
Hapen - tetraatominen (O4) - modifikaatio on toinen:
Tämä modifikaatio muodostuu kahden happimolekyylin heikon vuorovaikutuksen aikana. Tetatomiatomimolekyylien pitoisuus kaasumaisessa happessa tavanomaisissa olosuhteissa on vain 0,1% nestemäisen ja kiinteän hapen molekyylien kokonaismäärästä - jopa 50%. Tässä on tasapaino:
Matalassa lämpötilassa se siirtyy oikealle, ts. Kohti O4-molekyylien muodostumista. Molekyylien rakenteelliset muutokset aiheuttavat eroja aineiden ominaisuuksissa. Joten nestemäinen ja kiinteä happi, toisin kuin kaasumainen, ovat sinisiä.
Kuumennettuna happi reagoi vedyn kanssa muodostaen vettä. Kun molempien kaasujen seos sytytetään tilavuussuhteessa 2: 1 (räjähtävä kaasu), reaktio etenee räjähdyksellä. Mutta se voi edetä tasaisesti, jos tämä seos saatetaan kosketukseen erittäin pienen määrän hienojakoista platinaa, joka toimii katalyytin roolina:
2Н2 + О8 \u003d 2 Н20 + 572,6 kJ / mol
Happi voi hapettaa suoraan kaikki metallit. Jos metallilla on suuri haihtuvuus, niin hapetusprosessi etenee yleensä palamisen muodossa. Matalahaihtuvien metallien polttaminen happea voidaan suorittaa muodostuneen oksidin korkean haihtuvuuden olosuhteissa. Tämän prosessin tehokkuus riippuu metallin pelkistävästä aktiivisuudesta, ja sille on tunnusomaista syntyvän tuotteen muodostumislämpö. Metallien ja hapen (oksidien) vuorovaikutuksen tuotteet voivat olla emäksisiä, happamia ja amfoteerisia.
Kun joitain aktiivisia metalleja poltetaan happea, toisinaan ei muodostu niiden oksideja, vaan peroksideja ja peroksideja. Joten kaliumin ja rubidiumin palamisen aikana muodostuu näiden metallien superperoksideja:
Tämä johtuu tosiasiasta, että happimolekyyli voi kiinnittää tai menettää elektroneja muodostaessaan molekyyli-ioneja, kuten O2-2, O2- ja O2 +. Yhden elektronin lisääminen happea aiheuttaa superoksidioksidin O2 muodostumisen:
O - O + e \u003d [O - O] -
Parittoman elektronin läsnäolo O2– -ionissa määrittää superperoksidien paramagneettisuuden.
Kiinnittämällä kaksi elektronia, happimolekyyli es
pyörii peroksidi-ioniksi O2-2, jossa atomit ovat sitoutuneet
ne on kytketty yhdellä kahden elektronin sidoksella, ja siksi se on diamagneettinen:
O - O + 2ё \u003d [O - O] -2
Esimerkiksi bariumin ja hapen vuorovaikutus etenee BaO2-peroksidin muodostuessa:
Ba + O2 \u003d BaO2
VI. Hapen saaminen.
Hapen sisältävien kemiallisten yhdisteiden monimuotoisuus ja niiden saatavuus mahdollistavat hapen saamisen eri tavoin. Kaikki menetelmät hapen tuottamiseksi voidaan jakaa kahteen ryhmään: fysikaalisiin ja kemiallisiin. Suurin osa niistä on kemiallisia, ts. Hapen tuotannon perusta ovat tietyt reaktiot. Esimerkiksi, kun tarvitaan erittäin puhdasta happea, se saadaan vedestä hajottamalla se. Harkitse tätä menetelmää.
Elektrodit, useimmiten platina, lasketaan astiaan, joka on täytetty elektrolyyteillä (rikkihapolla hapotettu tislattu vesi), ja sähkövirta johdetaan. Positiivisesti varautuneet vetyionit siirtyvät negatiivisesti varautuneeseen elektrodiin (katodi), ja negatiivisesti varautuneet hydroksidi-ionit OH- ja sulfaatti-ionit SO42- ohjataan positiivisesti varautuneeseen elektrodiin (anodi). Elektrodien kohdalla ionit purkautuvat. On huomattava, että H + ja OH-ionien purkautuminen tapahtuu paljon helpommin kuin SO42: n sulfaatti-ioneja. Siten vety vapautuu katodilla ja happi vapautuu anodilla:
4Н + + 4ё - 2Н2
4ON- - 4ё - 2Н2О + О2
Kehittyneet kaasut kerätään eri astioihin tai käytetään suoraan.
Koulun laboratoriossa on mukavampaa käyttää alkaliliuosta elektrolyyttinä. Sitten elektrodit voivat olla rautalankaa tai -levyä. Emäksisessä väliaineessa vesimolekyylit purkautuvat suoraan katodilla:
Н2О + ё - Н ° + Н-
Н ° + Н ° - H2
Kokeessa käytetään laboratorioelektrolysaattoria. Tämä on U-muotoinen lasiputki, johon elektrodit juotetaan. Elektrolyyttisessä menetelmässä saadaan riittävän puhdasta happea (0,1% epäpuhtauksista).
Harkitse toista kemiallista menetelmää hapen tuottamiseksi. Jos bariumoksidi BaO kuumennetaan lämpötilaan 540 ° C, se sitoutuu ilmakehän happea muodostuessaan bariumperoksidia BaO2. Viimeksi mainittu hajoaa kuumennettuaan 870 ° C: seen ja happea vapautuu:
2VaO + O2 \u003d 2VaO2
2ВаО2 \u003d 2ВаО + О2
Bariumperoksidi toimii hapen kantajana.
Viime vuosisadalla kehitettiin kasveja hapen tuottamiseksi tällä menetelmällä. Ne sisälsivät pystysuunnassa sijaitsevia astioita, joissa oli lämmitysjärjestelmä. Ilmavirta johdettiin bariumoksidin läpi, joka oli kuumennettu lämpötilaan 400–500 ° C. Bariumperoksidin muodostumisen jälkeen ilman syöttö lopetettiin ja säiliöt lämmitettiin 750 ° C: seen (Ba02-hajoamislämpötila).
Kehitettäessä tekniikoita alhaisten lämpötilojen tuottamiseksi on kehitetty fysikaalinen menetelmä hapen tuottamiseksi ilmakehän ilmasta. Se perustuu ilman syvään jäähdytykseen ja ilman muodostavien kaasujen kiehumispisteiden erojen käyttöön.
Jäähdytysyksiköistä saatu nestemäinen ilma on seos, joka sisältää 79 tilavuusprosenttia typpeä ja 21 tilavuusprosenttia happea. Nestemäinen typpi kiehuu lämpötilassa 195,8 ° C ja nestemäinen happi lämpötilassa 182,9 ° C. Typen ja hapen kiehumispisteiden eron perusteella niiden erottelu perustuu. Nestemäisen hapen ja typpikaasun täydelliseksi erottamiseksi käytetään nestemäisen ilman useita höyrystyksiä, joihin liittyy sen höyryn kondensoituminen. Tätä prosessia kutsutaan jakotislaamiseksi tai puhdistamiseksi. Tällä hetkellä tästä menetelmästä on tullut tärkein tapa saada teknistä happea (halvat raaka-aineet ja suuren kapasiteetin laitokset). Nestemäinen happi varastoidaan ja kuljetetaan erityisissä säiliökonteissa ja säiliöissä, joissa on hyvä lämmöneristys.
Koska fysikaalista hapen tuotantomenetelmää käytetään laajalti teollisuudessa, kemialliset valmistusmenetelmät ovat käytännössä menettäneet teknisen merkityksensä, ja niitä käytetään hapen tuottamiseen laboratoriossa.
Ympäröivän maailman ihmisten tieteellisen ja teknologisen kehityksen myötä hapen ja ilman pilaantumisen kohtalot alkavat olla huolestuttavia. Monissa kaupungeissa on nyt vaikea hengittää. Maailman tilastojen mukaan kaikki autot päästävät vain yhdessä tunnissa käyttötunnilla jopa 600 tuhatta tonnia myrkyllistä hiilimonoksidia. Kun 1 tonni bensiiniä poltetaan autossa, muodostuu 600 kg hiilimonoksidia. Tällä hetkellä maailmanlaajuinen autokanta on 190 miljoonaa autoa. Asiantuntijoiden mukaan vuonna 1980 heidän lukumääränsä ylittää 200 miljoonaa. Nämä luvut ovat ajattelevia.
Auton ilmamyrkytys on tullut uhkaavaksi esimerkiksi Tokiossa, Lontoossa, New Yorkissa, Pariisissa, Roomassa, Moskovassa. Lisäksi muut haitalliset kaasut (SO2, H2S), tuhka, monien yritysten päästöt aiheuttavat savun pilaantumista ilmakehälle. Seurauksena on, että viimeisen 100 vuoden aikana aurinkoisten päivien lukumäärä teollisuuskeskusten ympärillä on vähentynyt neljänneksellä: siellä missä niitä oli 200, siitä tuli 150. Kaikissa maailman suurimmissa kaupungeissa paksujen likaisten sumujen seurauksena auringon valaistus laski 1900-luvun alkuun verrattuna. 10-30%. Lontoossa vuonna 1952 noin 4000 ihmistä kuoli muutaman päivän aikana sumua ollessa likainen ja hengästynyt ilmaan. Siksi kamppailu puhdasta ilmasta on tullut yhdeksi modernin hygienian kiireellisistä ongelmista.
Tiedetään, että vihreät kasvit ovat ylittämättömiä maan ilmakehän puhdistajia ja tilauksia. Fotosynteesi on ainoa prosessi, joka on tukenut happisykliä maapallon ilmakehässä noin 2 miljardia vuotta. Vihreät kasvit ovat jättimäinen laboratorio, joka tuottaa happea ja imee hiilimonoksidia CO2. Tutkijoiden mukaan kasvit ympäri maailmaa absorboivat noin 86,5 miljardia tonnia hiilidioksidia vuodessa. Tältä osin vihreiden puistojen luominen suurten kaupunkien ympärille, puutarhojen perustaminen, neliöiden ja kukkapenkkien jakaminen ovat olennainen osa nykyaikaista kaupunkisuunnittelua, tarvittaessa vesijohtojen ja katuvalaistuksen asentaminen. Arvioidaan, että Moskovan, Leningradin, Kharkovin viheralueilla ilman pölyisyyttä on 2–3 kertaa vähemmän kuin viereisillä kaduilla.
Viime vuosina metsäpalot ovat olleet akuutti Venäjällä. Tuhannet hehtaarit metsämetsät kuolevat tulessa. Uskon, että ellei hätätoimenpiteitä toteuteta tulipalojen ja metsien uudelleenmetsittämiseksi, ympäristökatastrofi odottaa meitä lähitulevaisuudessa. Luonnonsuojelualueet, metsät palavat, ainutlaatuiset kasvit ja eläimet kuolevat. Lämpiminä kuukausina kaupungit, kylät ... ovat varjostettu savusta. Haitallisia aineita löytyy suurina määrinä hengittämästämme ilmasta. Immuniteetti heikkenee, kun ihmisillä esiintyy tai pahenee erilaisia \u200b\u200bkroonisia sairauksia. Lapsilla on synnynnäisiä epämuodostumia, immuunikato, vaurioita keskushermostoon ...
Luonnonsuojelu, luonnonsuojelualueet ovat olleet olemassa jo pitkään. Mutta luultavasti maamme kehityksen tässä vaiheessa tämä asia on pysynyt viimeisimmällä paikalla. Kaikkien ihmisten on muutettava mieltään ja huolehdittava luonteestamme. Itse asiassa 95% kaikista metsäpaloista johtuu heidän syystä.
VII . Hapen käyttö.
Minkä tahansa aineen käyttö liittyy niiden fysikaalisiin ja kemiallisiin ominaisuuksiin sekä jakautumiseen luonnossa.
Tuotetun metallin määrä henkeä kohti on yksi mittari kunkin maan teollisen kehityksen tasosta. Rautametallien ja ei-rautametallien sulaminen on mahdotonta ilman happea.
Nyt maassamme vain rautametallurgia absorboi yli 60% tuotetusta hapesta. Mutta happea käytetään myös ei-rautametallurgiassa.
Happi tehostaa pyrometallurgisten prosessien lisäksi myös hydrometallurgisia prosesseja, joissa metallien erottaminen malmeista tai niiden konsentraateista perustuu erityisten reagenssien vaikutukseen vesiliuoksiin. Joten tällä hetkellä tärkein tapa saada kultaa malmista on syaanit. Sen avulla voit poimia kultaa sisältävistä malmeista jopa 95% kultaa, ja siksi sitä käytetään jopa jalostamiseen malmeissa, joiden kultapitoisuus on vähäinen. Malmien sisältämän kullan liuotusprosessi on erittäin aikaa vievä toimenpide. Kävi ilmi, että tämän metallin liukeneminen voi nopeutua huomattavasti, jos ilman sijasta käytetään puhdasta happea. Syaaniliuoksissa oleva kulta muodostaa monimutkaisen yhdisteen Na, jota edelleen käsitellään sinkillä, ja kulta vapautuu seurauksena:
4Au + 8NaCN + 2H20 + O2 \u003d 4Na + 4NaOH
2Na [Au (CN) 2] + Zn \u003d Na2 + 2Au
Tämän menetelmän kullan ottamiseksi malmista kehitti venäläinen insinööri P. R. Bagration, joka oli vuoden 1812 isänmaallisen sodan sankarin sukulainen.
Happi käytetään laajalti kemianteollisuudessa. Noin 30% tuotetusta hapesta käytetään tämän teollisuuden tarpeisiin maassamme. Ilman korvaaminen hapella kontaktirikkihapon tuotantoprosessin aikana lisää kasvin tuottavuutta viidestä kuuteen. Mutta ei vain tämä hyöty hapen käytöstä ilman sijaan. Puhtaan hapen avulla saat 100-prosenttisesti rikkioksidia ilman ylimääräisiä työvoimavaltaisia \u200b\u200btoimenpiteitä, jotka ovat välttämättömiä käytettäessä ilmaa hapettimena.
Typpihapon tuotannossa ammoniakin katalyyttisellä hapetuksella happea käytetään myös hapettimena. Jos sen pitoisuus ilmassa kasvatetaan 25%: iin, asennuksen tuottavuus kaksinkertaistuu.
Kun happi osallistuu lämpöhapettumisen krakkausprosessiin, saadaan asetyleeni suuressa mittakaavassa, jota käytetään laajalti metallien leikkaamiseen ja hitsaamiseen sekä orgaanisten aineiden synteesiin:
6CH4 + 4O2 \u003d C2H2 + 8H2 + 3CO + CO2 + 3H20
Happia käytetään tuottamaan korkeita lämpötiloja. Jos poltat vetyä happivirrassa, niin yhden moolin veden muodostuminen tuottaa 286,3 kJ ja 2 moolin - 572,6 kJ. Tämä on valtavaa energiaa! Tällaisten polttimien liekissä saavutettuja korkeita lämpötiloja (enintään 3000 ° C) käytetään metallien leikkaamiseen ja hitsaamiseen.
Happi palvelee myös avaruudessa. Joten Centaurus-amerikkalaisen avaruusraketin toisen vaiheen moottorissa nestemäinen happi toimi hapettimena. Happia käytetään myös laajalti raketeissa useissa korkean korkeuden tutkimuksissa.
Nestemäinen happi on osa räjähteitä. Eri räjähteet käyttivät pitkään ammoniitteja ja muita typpeä sisältäviä räjähteitä. Niiden käyttö edusti tiettyjä vaikeuksia, esimerkiksi kuljetuksen monimutkaisuus ja vaara, tarve rakentaa varastoja. Tällä hetkellä nestemäisiä happiräjähteitä voidaan valmistaa käyttöpaikassa. Kaikista huokoisista palavista aineista (sahanpuru, turve, heinät, oljet) tulee nestehapolla kyllästettyinä räjähdysvaarallinen. Sellaisia \u200b\u200baineita kutsutaan hydroksikviiteiksi ja ne voivat tarvittaessa korvata dynamiitin malmiesiintymien kehittyessä. Räjähdyksessä käytetään happipitoista patruunaa - yksinkertaista pitkää, palavalla materiaalilla täytettyä pussiin, johon elektroninen sulake työnnetään. Se ladataan välittömästi ennen reikään sijoittamista upottamalla nestehappoon. Reikä on pyöreä reikä, joka porataan yleensä kiviin ja täytetään räjähteillä. Jos jostain syystä happea nestemäistä patruunaa ei räjähtää reikään, patruuna purkautuu itsestään nestemäisen hapen haihtumisen seurauksena. Happijäristykset vaikuttavat orgaanisten aineiden erittäin nopeaan palamiseen puhtaassa happea. Lyhytaikaiseen palamisprosessiin liittyy suurten määrien lämmön ja kaasujen intensiivinen vapautuminen, mikä johtaa oksikviitin käyttämiseen voimakkaina räjähteinä, joilla on räjäytys (murskaus).
Happia käytetään lääketieteessä, ilmailussa. Keuhko- ja sydänsairauksien lääketieteellisessä käytännössä, kun hengitys on vaikeaa, potilaille annetaan happea happityynyistä, jotka sijoitetaan erityistiloihin, joissa ylläpidetään tarvittavaa happipitoisuutta. Henkilön yksi hengitys happea vastaa viittä hengitystä ilmaa. Siksi hengitettynä tämä kaasu ei vain pääse potilaaseen riittävästi, vaan myös säästää voimia itse hengitysprosessiin. Lisäksi ihonalainen hapen antaminen on osoittautunut tehokkaaksi tiettyjen sairauksien, kuten gangreenin, tromboflebiitin, elefantioosin ja trooppisten haavaumien hoidossa.
Kehon "happea nälkää" -ilmiö voi johtua myös hapen puutteesta ympäristössä. Esimerkiksi 10 000 m korkeudessa ilmanpaine ilmanpaineessa laskee arvoon 217 mm Hg. Art. ja ilman absoluuttinen happipitoisuus vähenee neljä kertaa. Tämä kaasumäärä on liian pieni normaaliksi hengittämiseksi. Siksi lentäjät käyttävät korkeissa korkeuksissa happisäiliöitä.
VIII. Maapallon yläpuolella oleva otsonikerros.
Otsoni on hapen "sisar". Sen molekyylin muodostavat tämän kemiallisen elementin kolme atomia: O3. Sähkökipin kohdalla ilmenee omituinen raikkauden haju, koska sähköpurkaus on edellytys ilman hapen muuntamiseksi otsoniksi:
happea otsoni
Haistamme ilmassa otsonin ukonilman jälkeen. Otsonia on havumetsissä, etenkin mäntymetsissä. Puutervan hajoaminen tuottaa vähän otsonia.
Ilmakerroksen otsoni on hajaantunut, sen pitoisuus on pieni. Tämä kaasu on lyhytaikainen, koska se muuttuu takaisin happea:
otsonin happi
Jopa pienissäkin määrissä otsoni toimii hapettavana aineena monille aineille. Ne desinfioivat vesijohtovettä otsonilla ja puhdistavat patogeenisten bakteerien ilmaa. Aktiivisuudestaan \u200b\u200bjohtuen otsoni voi tulla vaaralliseksi ihmisten ja eläinten terveydelle, jos sen sallittu pitoisuus ilmassa ylitetään. Tätä ei kuitenkaan tapahdu luonnossa.
Korkealla maapallon yläpuolella, stratosfäärissä korkeintaan 30 km (merenpinnan yläpuolella) on aina ohut otsonikerros, joka suojaa planeettamme elämää aurinkojen lyhytaaltoisen ultraviolettisäteilyn tuhoisilta vaikutuksilta. Otsoni imee aurinko-ultraviolettisäteilyn, ja vain osa siitä tunkeutuu maahan aiheuttamatta erityistä haittaa sen asukkaille. Kaikille eläville olentoille haitalliset lyhyet aallot viivästyvät, maapallolle kulkevat pitkät ultravioletti-aallot, jotka ovat vaarattomia.
Stratosfäärissä on enemmän otsonia kuin pintailmassa, mutta tämä ei tarkoita, että kerros muodostuu vain otsonista. Vain 1 otsonimolekyyli otsonikerroksessa / 100 000 muiden kaasujen molekyyliä kohti. Mutta tämä otsoni riittää suojelemaan planeetan elämää ultraviolettisäteilyltä.
Pitkäaallon ultraviolettisäteet vaikuttavat ihmisen ihoon, ruskeanruskea ilmestyy. Mutta ihosolut voivat reagoida tuskallisesti lyhytaaltoihin tapahtuvaan säteilyyn, erilaisia \u200b\u200bkasvaimia ilmaantuu. UV-säteily on myös haitallista näkölle.
Siksi on niin tärkeää, että maan päällä on suojaava otsonikerros!
Stratosfäärissä otsoni on ollut olemassa melko kauan, sen ei tarvitse tavata pelkistäviä aineita siellä usein, mutta jos ne tunkeutuvat sinne, otsoni reagoi niiden kanssa ja sen määrä vähenee. Tätä ilmiötä otsonipitoisuuden laskusta tietyissä stratosfäärin osissa kutsutaan "otsonireikien muodostumiseksi". Äskettäin havaittiin otsonipitoisuuden laskua stratosfäärissä melkein 40% Etelämanneriin verrattuna. Tätä tasaista maanosaa ympäröi valtameri, etelänavan yli muodostuu tuulen suppilo, joka kiertää mantereen ympäri ja tuo aineita, joiden kanssa otsoni reagoi. Mitä nämä aineet ovat?
Nämä ovat keinotekoisesti saatuja ja käytännössä erittäin arvokkaita aineita - esimerkiksi erilaisten koostumusten kloorifluorihiilivetyjä, kuten:
Näitä aineita saadaan vetyatomien hiilivedyissä. Kloorifluorihiilivedyt ovat hitaasti hajoavia aineita, jotka eivät liukene veteen, eivät ole myrkyllisiä, eivät pala, eivät aiheuta korroosiota, ja erinomaiset eristimet. Ne eristävät rakennusten seinät, kertakäyttöiset astiat kuumille juomille. Tämän ryhmän nestemäiset aineet (freonit) ovat hyviä liuottimia, tehokkaita kylmäaineita jääkaappeissa ja ilmastointilaitteissa. Niitä käytetään aerosolipurkeissa erityisten aineiden vaarattomina liuottimina, automaattisissa sammutusjärjestelmissä (CBrF3).
Näiden aineiden tuotanto kehittyi kiihtyneessä tahdissa, kunnes he huomasivat, että ne stratosfääriin saapuessaan tuhoavat otsonia (Nyt he yrittävät korvata freoneja vähemmän haihtuvilla aineilla. Esimerkiksi, ne käyttävät fluorikloorimetaania jäähdytysaineina, ja nesteytettyjä kaasumaisia \u200b\u200btyydyttyneitä hiilivetyjä käytetään aerosolitölkkeihin). ).
Nämä aineet saavuttavat stratosfäärin muuttumattomana. Loppujen lopuksi ne ovat kemiallisesti stabiileja. Ja stratosfäärissä, jossa on paljon ultraviolettisäteilyä, niiden molekyylit tuhoutuvat, kun taas halogeenin aktiiviset atomit, erityisesti kloori, jakautuvat:
Yksiarvoinen klooriradikaali reagoi otsonin kanssa:
03 + Cl \u003d O2 + ClO
otsonin kloorihappioksidi
(radikaali) kloori (II)
Ultraviolettisäteiden vaikutuksesta otsonista muodostuu happea, joka vapautumisen hetkellä tapahtuu myös aktiivisessa monatomisessa tilassa:
atomihappi otsoni
happi
Kloori (II) oksidi reagoi atomihapen kanssa, ja sitten muodostuu uudelleen klooriradikaali, joka taas tuhoaa otsonin; tapahtuu, useita kertoja toistuva ketjureaktio:
ClO + O \u003d Cl + O2
kloorioksidiatomi
kloori (II) happi (radikaali)
O3 + C1 \u003d O2 + ClO
Yksi klooriatomi on mukana sarjassa tällaisia \u200b\u200breaktioita ja voi tuhota jopa 100 000 otsonimolekyyliä. Kloori voi “poistua pelistä”, kun se kohtaa metaanimolekyylin. Sitten, kun hän on kiinnittänyt yhden vetyatomin metaanista itseensä, se muodostaa vetykloridia, joka veteen liukeneessa muodostaa suolahappoa. Joten kloorin tuhoaja palaa maan päälle hapan sateen muodossa:
СН4 + 2С1 - СН3С1 + НС1
metaanikloorikloorivetykloridi
(radikaali) metaani (liuoksessa - suolahappo)
Vaikka kloorifluorihiilivetyjen tuotantoa vähennetään kaikkialla, otsonikerroksen tuhoaminen koko planeetalla jatkuu. Otsonikerrosta heikentyvä ilma hajoaa vähitellen, kaasut ilmakehässä sekoittuvat, ilman sisältämät kloorifluorihiilivedyt jatkavat otsonia tuhoavaa työtä erittäin kauan, ainakin 100 vuotta.
Vuonna 1990 Lontoon 92 maan hallituksen edustajat allekirjoittivat sopimuksen kloorifluorihiilivetyjen tuotannon täydellisestä lopettamisesta vuoteen 2000 mennessä. Tämän sopimuksen noudattaminen on ehtona ctratosfäärin luonnollisen otsonipitoisuuden palauttamiselle asteittain, koska jo ilmakehän klooripitoisuuden pitäisi vähentyä ajan myötä, kuitenkin tällä kertaa. - vuosisata.
IX . Päätelmät.
Joten olemme saaneet erilaisia \u200b\u200btietoja ryhmän VI alkuaineiden kemian alalta ja suuressa määrin happeesta, oppineet missä ja miten happea käytetään ja miten sitä käytetään ja miten happea vaikuttaa elämäämme, kansantaloutta ja kulttuuria kohtaan.
Jos esseesi lukemisen jälkeen sinulla oli halu saada lisätietoja kyseisen tieteen valtavasta kentästä, josta saatiin tietoa D. I. Mendelejevin jaksollisen järjestelmän VI-ryhmän elementeistä, suoritin tehtäväni.
Viitteet
1. Kemia. Koululaisille Art. luokat ja yliopistoihin pääsy: Oppikirja. Korvaus / N. E. Kuzmenko, V. V. Eremin, V. A. Popkov - 4. painos, stereotyyppi. - M .: Bustard, 2001. - 544 s .: Ill.
2. Luettava kirja epäorgaanisesta kemiasta. Vol. opiskelijoille. 2 tunnissa, osa 1 / pak. V. A. Kritsman - 3. toim. - M .: Koulutus, 1993. - 192 s., 8 l ill .: sairas. - ISBN 5-09-002972-5
3. Kemia. Proc. 9 cl. ympäristöissä. vk. / F. G. Feldman, G. E. Rudzitis - M .: Koulutus, 1990. - 176 s .: Ill. ISBN 5-09-002624-6
4. Kemia: Oppikirja. 8-9 solulle yleinen koulutus. Laitokset / R. G. Ivanova. - 3. painos, Moskova: Koulutus, 2001. - 270 s., Ill. - ISBN 5-09-010278-3
5. Matkustaminen kuudennessa ryhmässä. D. I. Mendelejevin jaksollisen järjestelmän VI ryhmän elementit. Oppaat opiskelijoille. / G. L. Nemchaninova - M., "Enlightenment", 1976 - 128 sivua, Ill.
Kemian oppitunti 9. luokasta aiheesta”Hapen ominaisuudet, tuotanto ja käyttö”
Kemian opettaja Pritulo T.V.
Happi on keskus, jonka ympärillä kaikki kemiat pyörivät.
J. Berzelius.
tavoitteet: 1. Opiskelijoiden tiedon kehittäminen yksinkertaisesta aineesta - hapesta, sen fysikaalisista ja kemiallisista ominaisuuksista. Mieti hapen merkitystä luonnossa ja ihmisen elämässä käyttämällä esimerkiksi palamis- ja hitaita hapetusprosesseja. Tutustuminen sen valmistusmenetelmiin, soveltamiseen.
2., Taitojen kehittäminen syy-seuraussuhteiden luomiseksi, kemiallisten kaavojen, reaktioyhtälöiden laatimiseksi, reaktioiden tyypin määrittämiseksi, kemiallisen kokeen analysoimiseksi, yleistämiseksi ja analysoimiseksi, tiedon käyttämiseksi uusissa tilanteissa.
3. Aiheidenvälisen viestinnän toteuttaminen ympäristökurssien kanssa. maantiede, biologia, historia tosiasioiden tasolla, yleiset käsitteet, oppimisen kokonaisvaltaiset näkökohdat.
4. Opiskelijoiden kiinnostuksen kehittyminen kemian opiskeluun viitaten heidän elämäkokemukseensa, tutkitun materiaalin käytännön merkityksen paljastaminen, opiskelijoiden luovat kyvyt.
5 .. Luonnonrakkauden ja vastuun siitä kouluttaminen.
Laitteet ja reagenssit: metalli jalusta jalka, laite kaasujen tuottamiseksi, alkoholilamppu, kiteyttäjä vedellä, pullo tulpalla, dekantterilasi, lusikka aineiden polttamiseen, kaliumpermanganaatti, rikki, täplä
Oppitunnin tyyppi - yhdistetty ..
Tuntisuunnitelma
1.Orgmoment.
2. Päivitetään tietoa:
2.1. Taulussa: Koota oksidien kaavat: litium, kalsium, alumiini, fosfori (+5).
2.2. Frontal keskustelu luokan kanssa:
Mikä on kemiallisen sidoksen tyyppi happimolekyylissä? Määritä kidehilan tyyppi, jonka happimolekyylit muodostavat. Mitä happiyhdisteitä ilmakehässä tiedät? Mitkä happeayhdisteet ovat litosfäärissä? Mitkä happeayhdisteet ovat biosfäärissä?
Päätelmät. Happi on maapallon runsain alkuaine.
3. Uuden materiaalin oppiminen.
Happi on tärkeä elementti kaikille organismeille. Hänen osallistumisellaan yksi luonnon tärkeimmistä prosesseista - hengitys. Ilman happea prosessit, kuten rappeutuminen ja palaminen, ovat mahdottomia.
Luomme motiivin opiskelijoiden aktiivisuuteen kääntymällä Prometheuksen legendaan. Tämän avulla opiskelijat ymmärtävät palamisprosessien merkityksen ihmisen sivilisaation kehityksessä.
Legendan mukaan ihmiset muinaisina aikoina eivät tienneet tulipaloa, kokkasivat luoliin, metsästivät kivillä ja mailoilla, söivät raakaa lihaa ja kasvien juuria ... Samanaikaisesti elämä virtaa Olympuksella, täynnä intohimoja ja juonittelua. Kerran Prometheus varasti pyhän tulen kipinän Olympuksesta ja esitti sen ihmisille. Pyhä tuli syttyi ihmisten sydämessä halua työtä ja luovuutta. He hallitsivat käsityöt ja osallistuivat taiteeseen. Zeus ei antanut Prometheukselle anteeksi petosta. Kaikki tietävät kuinka hän teki Titanin kanssa, mutta harva tietää, että hän ketjutti Prometheuksen tarkalleen Eagle Rocksiin. Zeus tuomitsi Prometheuksen kauhistuttavaan kärsimykseen kaukaisessa vuoristomaassa, ketjutti hänet Eagle-kallioille. Kalliolla, jota nykyään kutsutaan Promethejeviksi, varastoidaan edelleen ketjujen jäännöksiä sekä voimakkaan kehon ja tulisen sydämen lämpöä. Eikä ihme, koska niin kauan yksi paikallisen pakanallisen jumalan raivokkaimmista ja verenhimoisimmista kotkista Okhyna revitti Prometheuksen rintaan päivittäin terävillä kynsillä ja kynsi maksan. Kauneus Agura toi salaa sankarille ruokaa ja vettä, jota varten hänestä tehtiin joki.
Tämän jälkeen jatkamme oppitunnin pääaineiston käsittelyä.
.
. Lähetä oppitunnin aiheet ja tavoitteet. Pöydän valmistelu.
3.2. Aivoriihi: -kirjoita taulukkoon mitä tiedät oppitunnin aiheesta, keskustele tästä kumppanisi kanssa (2–3 minuuttia).
3.3. Täytäntöönpanon vaihe ja pohdinta:
Historiallinen tausta:
Ruotsalainen tiedemies C. Scheele hankki vapaassa muodossa olevan hapen vuonna 1770. Kun suolaa lämmitettiin, ja vuonna 1774 englantilainen tutkija D. Priestley elohopeaoksidin ja lyijyminiumin hajoamisen aikana. Hapen merkitys palamisreaktioissa selitettiin ensimmäisen kerran vuonna 1775 ranskalaisella tiedemiehellä A. Lavoisier.
Analysoi esittelykokeen aikana
yritä täydentää taulukon sisältöä. Muistio auttaa sinua tässä (katso liite 1).
Hapen vastaanoton ja talteenoton osoittaminen, sen kemialliset ominaisuudet.
3.4.Heijastusvaihe:
- Kokeen analyysi , taulukon täyttäminen, reaktioyhtälöiden laatiminen, reaktion tyypin määrittäminen, OVR: n analyysi yhdestä esimerkistä (eri tavalla). Kiinnitä huomiota:yleinen merkki palamisreaktioista on valon ja lämmön vapautuminen. Houkutella ja laajentaa opiskelijoiden tietoa fossiilisista polttoaineista ja niiden varastoista.
Kysymys. Kuinka happea tuotetaan teollisuudessa? Opettaja ehdottaa, että löydetään vastaus tähän kysymykseen oppikirjasta.
Tutkimus järjestelmästä "Hapen käyttö". Tehtävä: hapen levitysalueiden jakaminen ryhmiin käytetyn ominaisuuden mukaan (katso liite nro 2).
-Beseda:
ilma kuluttaa jopa 50 tonnia happea 9 tunnin lentotunnissa. Miksi sen pitoisuus ilmassa ei vähene?
Kuinka "siirtää" happea?
Mitkä tosiasiat todistavat, että happi liukenee huonosti veteen?
4. Yhteenveto oppitunnista. D \\ Z:s. 20., 1, 3, s. 98 (perustaso), "nro 1-3, 4.5. (kohonnut taso). Kiinnostuneille opiskelijoille ehdotetaan, että ne laativat viestit (mahdollisesti esityksen kanssa) aiheista: 1. Mikä on hapen merkitys eläville organismeille? 2. Mitä ympäristö- ja ympäristöongelmia luonnossa aiheutuvat spontaanit palamisprosessit (tulipalot jne.) Aiheuttavat tai liittyvät ihmisen toimintaan?
Liite nro 1
Menetelmistä, joilla happea voidaan kerätä. Mihin kaasuominaisuuksiin ne perustuvat?
Mitä merkkejä tutkittavan kaasun fysikaalisista ominaisuuksista ilmenee?
Mihin kaasun ominaisuuksiin ne perustuvat menetelmistä sen määrittämiseksi?
Kemiallisten reaktioiden merkkejä, joissa happea on mukana.
Hapen käyttö Tietoja 2
1. Metallurgiassa (metallien valmistukseen).
2. Lääketieteessä (happityynyt).
3. Metallien hitsaukseen ja leikkaamiseen.
4. Räjäytysten aikana.
5. Lentokoneiden moottoreiden, autojen käyttöä varten.
6.Työssä vedenalaisessa tilassa ja avaruudessa.
suunnitelma:
Löytötarina
Nimi alkuperä
Oleminen luonnossa
vastaanotto
Fysikaaliset ominaisuudet
Kemialliset ominaisuudet
hakemus
10. Isotoopit
happi
happi - elementti 16. ryhmästä (vanhentuneen luokituksen mukaan - VI ryhmän pääryhmä), kemiallisten elementtien jaksollisen järjestelmän toinen jakso D. I. Mendeleev, atominumero 8. Sitä merkitään symbolilla O (lat. Oxygenium). Happi - kemiallisesti aktiivinen ei-metalli, on helpoin alkuaine halkogeenien ryhmästä. Yksinkertainen aine happi (CAS-numero: 7782-44-7) se on normaaleissa olosuhteissa kaasu, jolla ei ole väriä, makua ja hajua, jonka molekyyli koostuu kahdesta happiatomista (O 2-kaava), minkä vuoksi sitä kutsutaan myös happea. sininen väri, ja kiinteä aine on vaaleansininen kiteitä.
On myös muita hapen allotrooppisia muotoja, esimerkiksi otsoni (CAS-numero: 10028-15-6) - normaaleissa olosuhteissa sinisenvärinen kaasu, jolla on erityinen haju ja jonka molekyyli koostuu kolmesta happiatomista (kaava O 3).
Löytötarina
Englannin kemisti Joseph Priestley löysi virallisesti happea 1. elokuuta 1774 hajottamalla elohopeaoksidia ilmatiiviisti suljetussa astiassa (Priestley lähetti auringonvaloa tähän yhdisteeseen voimakkaan linssin avulla).
Priestley ei kuitenkaan alun perin ymmärtänyt löytäneensä uutta yksinkertaista ainetta, hän uskoi eristäneensä yhden ilman osista (ja kutsui tätä kaasua "log-ilmaan"). Priestley ilmoitti löytöstään merkittävälle ranskalaiselle kemistille Antoine Lavoisierille. Vuonna 1775 A. Lavoisier totesi, että happi on kiinteä osa ilmaa, happoja ja sisältyy moniin aineisiin.
Muutama vuosi aiemmin (vuonna 1771) ruotsalainen kemisti Karl Scheele sai happea. Hän kalsinoi nitraatin rikkihapolla ja hajotti sitten syntyneen typpioksidin. Scheele kutsui tätä kaasua "tuliseksi ilmaan" ja kuvasi löytöjään vuonna 1777 julkaistussa kirjassa (nimenomaan siksi, että kirja julkaistiin myöhemmin kuin se ilmoitti löytävänsä Priestleyn, jälkimmäistä pidetään hapen löytäjänä). Scheele kertoi myös kokemuksestaan \u200b\u200bLavoisierin kanssa.
Tärkeä vaihe, joka helpotti hapen löytämistä, oli ranskalaisen kemisti Pierre Bainin työ, joka julkaisi työt elohopean hapetuksesta ja sen oksidin myöhemmästä hajoamisesta.
Lopuksi A. Lavoisier ymmärsi lopulta saadun kaasun luonteen käyttämällä Priestleyn ja Scheelen tietoja. Hänen työllään oli suuri merkitys, koska sen ansiosta tuolloin hallitseva ja kemian kehitystä estänyt phlogiston-teoria kaadettiin. Lavoisier suoritti kokeilun erilaisten aineiden palamisesta ja kumosi phlogiston-teorian julkaisemalla tulokset palaneiden elementtien painosta. Tuhkan paino ylitti alkuaineen alkuperäisen painon, mikä antoi Lavoisierille oikeuden väittää, että palamisen aikana tapahtuu aineen kemiallinen reaktio (hapettuminen), tämän yhteydessä alkuperäisen aineen massa kasvaa, mikä kumota phlogistonin teorian.
Siten hapen löytämisen ansiot jaetaan todella Priestleyn, Scheelen ja Lavoisierin kesken.
Nimi alkuperä
Sana happea (jota kutsuttiin 1800-luvun alussa myös "happo-emäkseksi") johtuu jossain määrin sen esiintymisestä venäjän kielellä MV Lomonosoville, joka esitteli muiden neologismien ohella sanan "acid"; Sana "happi" puolestaan \u200b\u200boli jäljityspaperille termille "happi" (ranskalainen oksigeeni), jonka oli ehdottanut A. Lavoisier (muista kreikkalaisista sanoista sourς - "hapan" ja γεννάω - "minä synnytin"), joka kääntää "Hapon luominen", joka liittyy sen alkuperäiseen merkitykseen - "happo", tarkoittaa aikaisemmin aineita, joita nykyaikaisen kansainvälisen nimikkeistön mukaan kutsutaan oksideiksi.
Oleminen luonnossa
Happi on maapallon runsain alkuaine, sen osuus (erilaisten yhdisteiden, pääasiassa silikaattien koostumuksessa) on noin 47,4% kiinteän maankuoren massasta. Meri ja makeat vedet sisältävät valtavan määrän sitoutunutta happea - 88,8% (massa), ilmakehässä vapaan hapen pitoisuus on 20,95 tilavuusprosenttia ja 23,12 massaprosenttia. Yli 1500 maankuoren yhdistettä sisältää happea.
Happi on osa monia orgaanisia aineita ja sitä on läsnä kaikissa elävissä soluissa. Elävien solujen atomien lukumäärällä se on noin 25%, massaosuudella - noin 65%.
vastaanotto
Tällä hetkellä teollisuudessa happea saadaan ilmasta. Tärkein teollisuusmenetelmä hapen tuottamiseksi on kryogeeninen tislaus. Kalvoteknologian pohjalta toimivat happilaitokset ovat myös hyvin tunnettuja ja menestyksekkäästi käytettyjä teollisuudessa.
Laboratoriot käyttävät teollisuushappia, jota toimitetaan terässylintereissä noin 15 MPa: n paineessa.
Pieniä määriä happea voidaan saada kuumentamalla kaliumpermanganaattia KMnO 4:
Vetyperoksidin H 2 O 2 katalyyttistä hajoamista käytetään myös mangaani (IV) oksidin läsnä ollessa:
Happi voidaan saada hajottamalla katalyyttisesti kaliumkloraatti (bertholate suola) KClO 3:
Laboratoriomenetelmiin hapen tuottamiseksi sisältyy emästen vesipitoisten liuosten elektrolyysi sekä elohopea (II) oksidin hajoaminen (t \u003d 100 ° C):
Sukellusveneissä, jotka yleensä saadaan ihmisten uloshengitetyn natriumperoksidin ja hiilidioksidin reaktiolla:
Fysikaaliset ominaisuudet

Valtamereissä liuenneen O 2: n pitoisuus on suurempi kylmässä vedessä ja vähemmän lämpimässä vedessä.
Normaalitilanteessa happi on kaasu, jolla ei ole väriä, makua tai hajua.
Yhden litran sen massa on 1,429 g. Hieman raskaampaa kuin ilma. Se liukenee heikosti veteen (4,9 ml / 100 g 0 ° C: ssa, 2,09 ml / 100 g 50 ° C: ssa) ja alkoholiin (2,78 ml / 100 g 25 ° C: ssa). Se liukenee hyvin sulaan hopeaan (22 tilavuusosaa O2: ta 1 tilavuusosaa Ag: tä 961 ° C: ssa). Interatominen etäisyys on 0,12074 nm. Se on paramagneetti.
Kun kaasumaista happea kuumennetaan, tapahtuu sen palautuva hajoaminen atomiksi: lämpötilassa 2000 ° C - 0,03%, lämpötilassa 2600 ° C - 1%, 4000 ° C - 59%, 6000 ° C - 99,5%.
Nestemäinen happi (kiehumispiste −182,98 ° C) on vaaleansininen neste.

O 2 -vaihekaavio
Kiinteä happi (sulamispiste −218,35 ° C) - siniset kiteet. Kiteisiä faaseja on 6, joista kolme esiintyy 1 atm: n paineessa:
a-O2 - esiintyy lämpötilassa alle 23,65 K; kirkkaan siniset kiteet kuuluvat monokliiniseen syngoniaan, soluparametrit a \u003d 5,403 Ä, b \u003d 3,442 Ä, c \u003d 5,086 Ä; p \u003d 132,53 °.
p-O2 - esiintyy lämpötila-alueella 23,65 - 43,65 K; vaaleansinisillä kiteillä (kun paine kasvaa, väri muuttuu vaaleanpunaiseksi) on romboedrinen hila, soluparametrit a \u003d 4,21 Å, α \u003d 46,25 °.
y-O2 - esiintyy lämpötiloissa välillä 43,65 - 54,21 K; vaaleansinisillä kiteillä on kuutiosymmetria, hilajakso a \u003d 6,83 Ä.
Korkeassa paineessa muodostuu vielä kolme vaihetta:
δ-02: n lämpötila-alue 20-240 K ja paine 6-8 GPa, oranssit kiteet;
e-O4-paine välillä 10 - 96 GPa, kiteiden väri tummanpunaisesta mustana, monokliininen syngonia;
ζ-Оn paine on yli 96 GPa, metallitila, jolla on ominainen metalli kiilto, alhaisissa lämpötiloissa siirtyy suprajohtavaan tilaan.
Kemialliset ominaisuudet
Vahva hapettava aine, vuorovaikutuksessa melkein kaikkien alkuaineiden kanssa muodostaen oksideja. Hapetustila on −2. Yleensä hapettumisreaktio etenee lämmön vapautumisen myötä ja kiihtyy lämpötilan noustessa (katso. Palaminen). Esimerkki huoneenlämpötilassa tapahtuvista reaktioista:
Se hapettaa yhdisteitä, jotka sisältävät alkuaineita, joilla ei ole maksimihapetustilaa:
Hapettaa useimmat orgaaniset yhdisteet:
Tietyissä olosuhteissa on mahdollista suorittaa orgaanisen yhdisteen lievä hapetus:
Happi reagoi suoraan (normaaleissa olosuhteissa kuumennettaessa ja / tai katalyyttien läsnä ollessa) kaikkien yksinkertaisten aineiden, paitsi Au: n ja inerttien kaasujen (He, Ne, Ar, Kr, Xe, Rn) kanssa; reaktiot halogeenien kanssa tapahtuvat sähköpurkauksen tai ultraviolettisäteilyn vaikutuksesta. Epäsuorasti saadut kullan oksidit ja raskaat inertit kaasut (Xe, Rn). Kaikissa kaksielementtihappoyhdisteissä, joissa on muita elementtejä, hapella on hapettimen rooli, paitsi fluoriyhdisteillä
Happi muodostaa peroksideja, joiden happiatomin hapetustila on muodollisesti yhtä suuri kuin -1.
Esimerkiksi peroksideja saadaan polttamalla alkalimetalleja happea:
Jotkut oksidit absorboivat happea:
A. N. Bachin ja K. O. Englerin kehittämän palamisteorian mukaan hapettuminen tapahtuu kahdessa vaiheessa muodostamalla välituoteperoksiiniyhdiste. Tämä välituoteyhdiste voidaan eristää esimerkiksi jäähdyttämällä palavan vedyn liekki jäällä veden kanssa, jolloin muodostuu vetyperoksidia:
Superperoksideissa hapen hapetustila on muodollisesti -1, toisin sanoen yksi elektroni kahdesta happiatomista (O - 2-ioni). Saavutetaan peroksidien vuorovaikutuksessa hapen kanssa kohotetussa paineessa ja lämpötilassa:
Kalium K, rubidium Rb ja cesium Cs reagoivat hapen kanssa muodostaen superperoksideja:
Dioksigenyyli-ionissa O2 + hapen muodollinen hapetustila on + ½. Vastaanottaminen:
Happifluoridi
Happidifluoridi, jonka hapen hapetustila on 2 +2, saadaan johtamalla fluoria alkaliliuoksen läpi:
Happimonofluoridi (dioksidi), O 2 F2, epästabiili, hapen hapetustila +1. Saatu fluorin ja hapen seoksesta hehkutuksessa lämpötilassa -196 ° C:
Läpäisemällä hehkulamppu fluorin ja hapen seoksen läpi tietyssä paineessa ja lämpötilassa, saadaan korkeampien happifluoridien O3F2, O4F2, O5F2 ja O6F2 seoksia.
Kvanttimekaaniset laskelmat ennustavat trifluorihydroksoniumionin OF 3 + vakaan olemassaolon. Jos tämä ioni todella esiintyy, niin hapen hapettumisaste siinä on +4.
Happi tukee hengitys-, palamis- ja rappeutumisprosesseja.
Elementti on vapaassa muodossaan kahdessa allotrooppisessa modifikaatiossa: O 2 ja O 3 (otsoni). Kuten vuonna 1899 perustettiin, Pierre Curie ja Maria Sklodowska Curie ionisoivan säteilyn vaikutuksesta muuttuvat O 3: ksi.
hakemus
Hapen laajalle levinnyt teollisuuskäyttö alkoi 1900-luvun puolivälissä, kun keksittiin turbolaajennuksia - laitteita nestemäisen ilman nesteyttämiseksi ja erottamiseksi.
metallurgia
Muunnosmenetelmä teräksen tai mattakäsittelyn tuottamiseksi käsittää hapen käytön. Monissa metallurgisissa yksiköissä polttoaineissa poltetaan polttoainetta hapen ja ilman seosta ilman sijaan.
Metallien hitsaus ja leikkaus
Sinisen värisylinterien happea käytetään laajalti liekkien leikkaamiseen ja metallien hitsaukseen.
Rakettipolttoaine
Nestemäistä happea, vetyperoksidia, typpihappoa ja muita happea sisältäviä yhdisteitä käytetään rakettipolttoaineen hapettimena. Nestemäisen hapen ja nestemäisen otsonin seos on yksi rakettipolttoaineen tehokkaimmista hapettimista (vety-otsoniseoksen ominaisimpulssi ylittää vety-fluori- ja vety-happifluoridi -parin ominaisimpulssin).
lääketiede
Lääketieteellistä happea varastoidaan sinisissä metallisissa korkeapaineisissa kaasupulloissa (paineistettuja tai nesteytettyjä kaasuja varten), joiden värit ovat 1,2-10,0 litraa paineessa 15 MPa (150 atm) paineeseen saakka, ja sitä käytetään hengityskaasuseosten rikastamiseen anestesialaitteissa, hengitysteiden vajaatoiminta, keuhkoastman hyökkäyksen lopettamiseksi, minkä tahansa geneesin aiheuttaman hypoksian poistaminen dekompressiosairauden takia maha-suolikanavan patologian hoitamiseksi happikokteilien muodossa. Henkilökohtaista käyttöä varten sylinterien lääketieteellinen kumi täytetään erityisillä kumilla varustetuilla astioilla - happityynyillä. Eri malleja ja muunnoksia sisältäviä happi-inhalaattoreita käytetään syöttämään happea tai happi-ilma-seosta yhdelle tai kahdelle loukkaantuneelle kentällä tai sairaalassa samanaikaisesti. Happi-inhalaattorin etuna on, että kaasuseoksessa on lauhdutin-kostutin, joka käyttää uloshengitetyn ilman kosteutta. Sylinterissä jäljellä olevan hapen määrän laskemiseksi litroissa yleensä sylinterin paine ilmakehässä (vaihdelaatikon painemittarin mukaan) kerrotaan sylinterin kapasiteetin arvolla litroissa. Esimerkiksi sylinterissä, jonka tilavuus on 2 litraa, manometri näyttää 100 atm: n happipaine. Happitilavuus on tässä tapauksessa 100 × 2 \u003d 200 litraa.
elintarviketeollisuus
Elintarviketeollisuudessa happi rekisteröidään lisäaineena E948, ponneaineena ja pakkauskaasuna.
kemianteollisuus
Kemianteollisuudessa happea käytetään reagenssin hapettimena monissa synteeseissä, esimerkiksi hiilivetyjen hapetuksessa happea sisältäviksi yhdisteiksi (alkoholit, aldehydit, hapot), ammoniakista typen oksidiksi typpihapon tuotannossa. Hapetuksen aikana kehittyvien korkeiden lämpötilojen takia jälkimmäiset suoritetaan usein palamismuodossa.
maatalous
Kasvihuoneessa happikokteilien valmistukseen, painonnousuun eläimissä, vesiympäristön happea rikastamiseen kalankasvatuksessa.
Hapen biologinen merkitys

Hätähappitoimitus pommisuojassa
Suurin osa elävistä esineistä (aerobit) hengittää happea ilmassa. Happia käytetään laajalti lääketieteessä. Sydän- ja verisuonisairauksien hoidossa aineenvaihduntaprosessien parantamiseksi syötetään happea vaahtoa (”happikokteili”) mahaan. Subkutaanista hapen annostelua käytetään troofisiin haavaumiin, elefantioosiin, gangreeniin ja muihin vakaviin sairauksiin. Keinotekoista rikastamista otsonilla käytetään ilman desinfiointiin ja hajun parantamiseen sekä juomaveden puhdistamiseen. Hapen 15 O radioaktiivista isotooppia käytetään tutkimaan veren virtausnopeutta, keuhkojen tuuletusta.
Hapen myrkylliset johdannaiset
Jotkut happijohdannaiset (ns. Reaktiiviset happilajit), kuten singlettihappi, vetyperoksidi, superoksidi, otsoni ja hydroksyyliradikaali, ovat erittäin myrkyllisiä tuotteita. Ne muodostuvat hapen aktivoinnin tai osittaisen pelkistyksen yhteydessä. Superoksidia (superoksidradikaali), vetyperoksidia ja hydroksyyliradikaalia voi muodostua ihmisen ja eläimen kehon soluihin ja kudoksiin ja aiheuttaa hapettavaa stressiä.
isotoopit
Hapella on kolme stabiilia isotooppiä: 16 O, 17 O ja 18 O, joiden keskimääräinen pitoisuus on 99,759%, 0,037% ja 0,204% Maan happiatomien kokonaismäärästä. Seoksen kevyimmän 16 O-isotoopin ylivoima johtuu tosiasiasta, että 16 O-atomin ydin koostuu 8 protonista ja 8 neutronista (kaksinkertainen maaginen ydin täytetyillä neutroni- ja protonikuorilla). Ja sellaiset ytimet, kuten käy ilmi atomiatuman rakenteen teoriasta, ovat erityisen vakaita.
Tunnetaan myös radioaktiivisia happi-isotooppeja, joiden massa on 12 - 24 O. Kaikilla radioaktiivisilla happi-isotoopeilla on lyhyt puoliintumisaika, pitkäikäisimpiä niistä on 15 O, puoliintumisaika ~ 120 s. Lyhytaikaisen isotoopin 12O puoliintumisaika on 5,8 · 10 –22 s.
Happea. Sen ominaisuudet ja käyttö
Hapen kohtalo ja ilmakehän pilaantuminen alkavat huolestuttaa koko maailmaa. Monissa kaupungeissa on nyt vaikea hengittää. Maailman tilastojen mukaan kaikki autot päästävät vain yhdessä tunnissa käyttötunnilla jopa 600 tuhatta tonnia myrkyllistä hiilimonoksidia. Kun 1 tonni bensiiniä poltetaan autossa, muodostuu 600 kg hiilimonoksidia. Tällä hetkellä maailmanlaajuinen autokanta on 190 miljoonaa autoa. Asiantuntijoiden mukaan vuonna 1980 heidän lukumääränsä ylittää 200 miljoonaa. Nämä luvut ovat ajattelevia.
Auton ilmamyrkytys on tullut uhkaavaksi esimerkiksi Tokiossa, Lontoossa, New Yorkissa, Pariisissa, Roomassa, Moskovassa. Lisäksi muut haitalliset kaasut (SO2, H2S), tuhka, monien yritysten päästöt aiheuttavat savun pilaantumista ilmakehälle. Seurauksena on, että viimeisen 100 vuoden aikana aurinkoisten päivien lukumäärä teollisuuskeskusten ympärillä on vähentynyt neljänneksellä: siellä missä niitä oli 200, siitä tuli 150. Kaikissa maailman suurimmissa kaupungeissa paksujen likaisten sumujen seurauksena auringon valaistus laski 1900-luvun alkuun verrattuna. 10-30%. Lontoossa vuonna 1952 noin 4000 ihmistä kuoli muutaman päivän aikana sumua ollessa likainen ja hengästynyt ilmaan. Siksi kamppailu puhdasta ilmasta on tullut yhdeksi modernin hygienian kiireellisistä ongelmista.
Tiedetään, että vihreät kasvit ovat ylittämättömiä maan ilmakehän puhdistajia ja tilauksia. Fotosynteesi on ainoa prosessi, joka on tukenut happisykliä maapallon ilmakehässä noin 2 miljardia vuotta. Vihreät kasvit ovat jättimäinen laboratorio, joka tuottaa happea ja imee hiilimonoksidia CO2. Tutkijoiden mukaan kasvit ympäri maailmaa absorboivat noin 86,5 miljardia tonnia hiilidioksidia vuodessa. Tältä osin vihreiden puistojen luominen suurten kaupunkien ympärille, puutarhojen perustaminen, neliöiden ja kukkapenkkien jakaminen ovat olennainen osa nykyaikaista kaupunkisuunnittelua, tarvittaessa vesijohtojen ja katuvalaistuksen asentaminen. Arvioidaan, että Moskovan, Leningradin, Kharkovin viheralueilla ilman pölyisyyttä on 2–3 kertaa vähemmän kuin viereisillä kaduilla.
Viime vuosina metsäpalot ovat olleet akuutti Venäjällä. Tuhannet hehtaarit metsämetsät kuolevat tulessa. Uskon, että ellei hätätoimenpiteitä toteuteta tulipalojen ja metsien uudelleenmetsittämiseksi, ympäristökatastrofi odottaa meitä lähitulevaisuudessa. Luonnonsuojelualueet, metsät palavat, ainutlaatuiset kasvit ja eläimet kuolevat. Lämpiminä kuukausina kaupungit, kylät ... ovat varjostettu savusta. Haitallisia aineita löytyy suurina määrinä hengittämästämme ilmasta. Immuniteetti heikkenee, kun ihmisillä esiintyy tai pahenee erilaisia \u200b\u200bkroonisia sairauksia. Lapsilla on synnynnäisiä epämuodostumia, immuunikato, vaurioita keskushermostoon ...
Luonnonsuojelu, luonnonsuojelualueet ovat olleet olemassa jo pitkään. Mutta luultavasti maamme kehityksen tässä vaiheessa tämä asia on pysynyt viimeisimmällä paikalla. Kaikkien ihmisten on muutettava mieltään ja huolehdittava luonteestamme. Itse asiassa 95% kaikista metsäpaloista johtuu heidän syystä.
VII. Hapen käyttö.
Minkä tahansa aineen käyttö liittyy niiden fysikaalisiin ja kemiallisiin ominaisuuksiin sekä jakautumiseen luonnossa.
Tuotetun metallin määrä henkeä kohti on yksi mittari kunkin maan teollisen kehityksen tasosta. Rautametallien ja ei-rautametallien sulaminen on mahdotonta ilman happea.
Nyt maassamme vain rautametallurgia absorboi yli 60% tuotetusta hapesta. Mutta happea käytetään myös ei-rautametallurgiassa.
Happi tehostaa pyrometallurgisten prosessien lisäksi myös hydrometallurgisia prosesseja, joissa metallien erottaminen malmeista tai niiden konsentraateista perustuu erityisten reagenssien vaikutukseen vesiliuoksiin. Joten tällä hetkellä tärkein tapa saada kultaa malmista on syaanit. Sen avulla voit poimia kultaa sisältävistä malmeista jopa 95% kultaa, ja siksi sitä käytetään jopa jalostamiseen malmeissa, joiden kultapitoisuus on vähäinen. Malmien sisältämän kullan liuotusprosessi on erittäin aikaa vievä toimenpide. Kävi ilmi, että tämän metallin liukeneminen voi nopeutua huomattavasti, jos ilman sijasta käytetään puhdasta happea. Syaaniliuoksissa oleva kulta muodostaa monimutkaisen yhdisteen Na, jota edelleen käsitellään sinkillä, ja kulta vapautuu seurauksena:
4Au + 8NaCN + 2H20 + O2 \u003d 4Na + 4NaOH
2Na [Au (CN) 2] + Zn \u003d Na2 + 2Au
Tämän menetelmän kullan ottamiseksi malmista kehitti venäläinen insinööri P. R. Bagration, joka oli vuoden 1812 isänmaallisen sodan sankarin sukulainen.
Happi käytetään laajalti kemianteollisuudessa. Noin 30% tuotetusta hapesta käytetään tämän teollisuuden tarpeisiin maassamme. Ilman korvaaminen hapella kontaktirikkihapon tuotantoprosessin aikana lisää kasvin tuottavuutta viidestä kuuteen. Mutta ei vain tämä hyöty hapen käytöstä ilman sijaan. Puhtaan hapen avulla saat 100-prosenttisesti rikkioksidia ilman ylimääräisiä työvoimavaltaisia \u200b\u200btoimenpiteitä, jotka ovat välttämättömiä käytettäessä ilmaa hapettimena.
Typpihapon tuotannossa ammoniakin katalyyttisellä hapetuksella happea käytetään myös hapettimena. Jos sen pitoisuus ilmassa kasvatetaan 25%: iin, asennuksen tuottavuus kaksinkertaistuu.
Kun happi osallistuu lämpöhapettumisen krakkausprosessiin, saadaan asetyleeni suuressa mittakaavassa, jota käytetään laajalti metallien leikkaamiseen ja hitsaamiseen sekä orgaanisten aineiden synteesiin:
6CH4 + 4O2 \u003d C2H2 + 8H2 + 3CO + CO2 + 3H20
Happia käytetään tuottamaan korkeita lämpötiloja. Jos poltat vetyä happivirrassa, niin yhden moolin veden muodostuminen tuottaa 286,3 kJ ja 2 moolin - 572,6 kJ. Tämä on valtavaa energiaa! Tällaisten polttimien liekissä saavutettuja korkeita lämpötiloja (enintään 3000 ° C) käytetään metallien leikkaamiseen ja hitsaamiseen.
Happi palvelee myös avaruudessa. Joten Centaurus-amerikkalaisen avaruusraketin toisen vaiheen moottorissa nestemäinen happi toimi hapettimena. Happia käytetään myös laajalti raketeissa useissa korkean korkeuden tutkimuksissa.
Nestemäinen happi on osa räjähteitä. Eri räjähteet käyttivät pitkään ammoniitteja ja muita typpeä sisältäviä räjähteitä. Niiden käyttö edusti tiettyjä vaikeuksia, esimerkiksi kuljetuksen monimutkaisuus ja vaara, tarve rakentaa varastoja. Tällä hetkellä nestemäisiä happiräjähteitä voidaan valmistaa käyttöpaikassa. Kaikista huokoisista palavista aineista (sahanpuru, turve, heinät, oljet) tulee nestehapolla kyllästettyinä räjähdysvaarallinen. Sellaisia \u200b\u200baineita kutsutaan hydroksikviiteiksi ja ne voivat tarvittaessa korvata dynamiitin malmiesiintymien kehittyessä. Räjähdyksessä käytetään happipitoista patruunaa - yksinkertaista pitkää, palavalla materiaalilla täytettyä pussiin, johon elektroninen sulake työnnetään. Se ladataan välittömästi ennen reikään sijoittamista upottamalla nestehappoon. Reikä on pyöreä reikä, joka porataan yleensä kiviin ja täytetään räjähteillä. Jos jostain syystä happea nestemäistä patruunaa ei räjähtää reikään, patruuna purkautuu itsestään nestemäisen hapen haihtumisen seurauksena. Happijäristykset vaikuttavat orgaanisten aineiden erittäin nopeaan palamiseen puhtaassa happea. Lyhytaikaiseen palamisprosessiin liittyy suurten määrien lämmön ja kaasujen intensiivinen vapautuminen, mikä johtaa oksikviitin käyttämiseen voimakkaina räjähteinä, joilla on räjäytys (murskaus).
Happia käytetään lääketieteessä, ilmailussa. Keuhko- ja sydänsairauksien lääketieteellisessä käytännössä, kun hengitys on vaikeaa, potilaille annetaan happea happityynyistä, jotka sijoitetaan erityistiloihin, joissa ylläpidetään tarvittavaa happipitoisuutta. Henkilön yksi hengitys happea vastaa viittä hengitystä ilmaa. Siksi hengitettynä tämä kaasu ei vain pääse potilaaseen riittävästi, vaan myös säästää voimia itse hengitysprosessiin. Lisäksi ihonalainen hapen antaminen on osoittautunut tehokkaaksi tiettyjen sairauksien, kuten gangreenin, tromboflebiitin, elefantioosin ja trooppisten haavaumien hoidossa.
Kehon "happea nälkää" -ilmiö voi johtua myös hapen puutteesta ympäristössä. Esimerkiksi 10 000 m korkeudessa ilmanpaine ilmanpaineessa laskee arvoon 217 mm Hg. Art. ja ilman absoluuttinen happipitoisuus vähenee neljä kertaa. Tämä kaasumäärä on liian pieni normaaliksi hengittämiseksi. Siksi lentäjät käyttävät korkeissa korkeuksissa happisäiliöitä.
VIII. Maapallon yläpuolella oleva otsonikerros.
Otsoni on hapen "sisar". Sen molekyylin muodostavat tämän kemiallisen elementin kolme atomia: O3. Sähkökipin kohdalla ilmenee omituinen raikkauden haju, koska sähköpurkaus on edellytys ilman hapen muuntamiseksi otsoniksi:
happea otsoni
Haistamme ilmassa otsonin ukonilman jälkeen. Otsonia on havumetsissä, etenkin mäntymetsissä. Puutervan hajoaminen tuottaa vähän otsonia.
Ilmakerroksen otsoni on hajaantunut, sen pitoisuus on pieni. Tämä kaasu on lyhytaikainen, koska se muuttuu takaisin happea:
otsonin happi
Jopa pienissäkin määrissä otsoni toimii hapettavana aineena monille aineille. Ne desinfioivat vesijohtovettä otsonilla ja puhdistavat patogeenisten bakteerien ilmaa. Aktiivisuudestaan \u200b\u200bjohtuen otsoni voi tulla vaaralliseksi ihmisten ja eläinten terveydelle, jos sen sallittu pitoisuus ilmassa ylitetään. Tätä ei kuitenkaan tapahdu luonnossa.
Korkealla maapallon yläpuolella, stratosfäärissä korkeintaan 30 km (merenpinnan yläpuolella) on aina ohut otsonikerros, joka suojaa planeettamme elämää aurinkojen lyhytaaltoisen ultraviolettisäteilyn tuhoisilta vaikutuksilta. Otsoni imee aurinko-ultraviolettisäteilyn, ja vain osa siitä tunkeutuu maahan aiheuttamatta erityistä haittaa sen asukkaille. Kaikille eläville olentoille haitalliset lyhyet aallot viivästyvät, maapallolle kulkevat pitkät ultravioletti-aallot, jotka ovat vaarattomia.
Stratosfäärissä on enemmän otsonia kuin pintailmassa, mutta tämä ei tarkoita, että kerros muodostuu vain otsonista. Vain 1 otsonimolekyyli otsonikerroksessa / 100 000 muiden kaasujen molekyyliä kohti. Mutta tämä otsoni riittää suojelemaan planeetan elämää ultraviolettisäteilyltä.
Pitkäaallon ultraviolettisäteet vaikuttavat ihmisen ihoon, ruskeanruskea ilmestyy. Mutta ihosolut voivat reagoida tuskallisesti lyhytaaltoihin tapahtuvaan säteilyyn, erilaisia \u200b\u200bkasvaimia ilmaantuu. UV-säteily on myös haitallista näkölle.
Siksi on niin tärkeää, että maan päällä on suojaava otsonikerros!
Stratosfäärissä otsoni on ollut olemassa melko kauan, sen ei tarvitse tavata pelkistäviä aineita siellä usein, mutta jos ne tunkeutuvat sinne, otsoni reagoi niiden kanssa ja sen määrä vähenee. Tätä ilmiötä otsonipitoisuuden laskusta tietyissä stratosfäärin osissa kutsutaan "otsonireikien muodostumiseksi". Äskettäin havaittiin otsonipitoisuuden laskua stratosfäärissä melkein 40% Etelämanneriin verrattuna. Tätä tasaista maanosaa ympäröi valtameri, etelänavan yli muodostuu tuulen suppilo, joka kiertää mantereen ympäri ja tuo aineita, joiden kanssa otsoni reagoi. Mitä nämä aineet ovat?
Nämä ovat keinotekoisesti saatuja ja käytännössä erittäin arvokkaita aineita - esimerkiksi erilaisten koostumusten kloorifluorihiilivetyjä, kuten:
Näitä aineita saadaan vetyatomien hiilivedyissä. Kloorifluorihiilivedyt ovat hitaasti hajoavia aineita, jotka eivät liukene veteen, eivät ole myrkyllisiä, eivät pala, eivät aiheuta korroosiota, ja erinomaiset eristimet. Ne eristävät rakennusten seinät, kertakäyttöiset astiat kuumille juomille. Tämän ryhmän nestemäiset aineet (freonit) ovat hyviä liuottimia, tehokkaita kylmäaineita jääkaappeissa ja ilmastointilaitteissa. Niitä käytetään aerosolipurkeissa erityisten aineiden vaarattomina liuottimina, automaattisissa sammutusjärjestelmissä (CBrF3).
Näiden aineiden tuotanto kehittyi kiihtyneessä tahdissa, kunnes he huomasivat, että ne stratosfääriin saapuessaan tuhoavat otsonia (Nyt he yrittävät korvata freoneja vähemmän haihtuvilla aineilla. Esimerkiksi, ne käyttävät fluorikloorimetaania jäähdytysaineina, ja nesteytettyjä kaasumaisia \u200b\u200btyydyttyneitä hiilivetyjä käytetään aerosolitölkkeihin). ).
Nämä aineet saavuttavat stratosfäärin muuttumattomana. Loppujen lopuksi ne ovat kemiallisesti stabiileja. Ja stratosfäärissä, jossa on paljon ultraviolettisäteilyä, niiden molekyylit tuhoutuvat, kun taas halogeenin aktiiviset atomit, erityisesti kloori, jakautuvat:
Yksiarvoinen klooriradikaali reagoi otsonin kanssa:
03 + Cl \u003d O2 + ClO
otsonin kloorihappioksidi
(radikaali) kloori (II)
Ultraviolettisäteiden vaikutuksesta otsonista muodostuu happea, joka vapautumisen hetkellä tapahtuu myös aktiivisessa monatomisessa tilassa:
atomihappi otsoni
happi
Kloori (II) oksidi reagoi atomihapen kanssa, ja sitten muodostuu uudelleen klooriradikaali, joka taas tuhoaa otsonin; tapahtuu, useita kertoja toistuva ketjureaktio:
ClO + O \u003d Cl + O2
kloorioksidiatomi
kloori (II) happi (radikaali)
O3 + C1 \u003d O2 + ClO
Yksi klooriatomi on mukana sarjassa tällaisia \u200b\u200breaktioita ja voi tuhota jopa 100 000 otsonimolekyyliä. Kloori voi “poistua pelistä”, kun se kohtaa metaanimolekyylin. Sitten, kun hän on kiinnittänyt yhden vetyatomin metaanista itseensä, se muodostaa vetykloridia, joka veteen liukeneessa muodostaa suolahappoa. Joten kloorin tuhoaja palaa maan päälle hapan sateen muodossa:
СН4 + 2С1 - СН3С1 + НС1
metaanikloorikloorivetykloridi
(radikaali) metaani (liuoksessa - suolahappo)
Vaikka kloorifluorihiilivetyjen tuotantoa vähennetään kaikkialla, otsonikerroksen tuhoaminen koko planeetalla jatkuu. Otsonikerrosta heikentyvä ilma hajoaa vähitellen, kaasut ilmakehässä sekoittuvat, ilman sisältämät kloorifluorihiilivedyt jatkavat otsonia tuhoavaa työtä erittäin kauan, ainakin 100 vuotta.
Vuonna 1990 Lontoon 92 maan hallituksen edustajat allekirjoittivat sopimuksen kloorifluorihiilivetyjen tuotannon täydellisestä lopettamisesta vuoteen 2000 mennessä. Tämän sopimuksen noudattaminen on ehtona ctratosfäärin luonnollisen otsonipitoisuuden palauttamiselle asteittain, koska jo ilmakehän klooripitoisuuden pitäisi vähentyä ajan myötä, kuitenkin tällä kertaa. - vuosisata.
IX. Päätelmät.
Joten olemme saaneet erilaisia \u200b\u200btietoja ryhmän VI alkuaineiden kemian alalta ja suuressa määrin happeesta, oppineet missä ja miten happea käytetään ja miten sitä käytetään ja miten happea vaikuttaa elämäämme, kansantaloutta ja kulttuuria kohtaan.
Jos esseesi lukemisen jälkeen sinulla oli halu saada lisätietoja kyseisen tieteen valtavasta kentästä, josta saatiin tietoa D. I. Mendelejevin jaksollisen järjestelmän VI-ryhmän elementeistä, suoritin tehtäväni.
Viitteet
1. Kemia. Koululaisille Art. luokat ja yliopistoihin pääsy: Oppikirja. Korvaus / N. E. Kuzmenko, V. V. Eremin, V. A. Popkov - 4. painos, stereotyyppi. - M .: Bustard, 2001. - 544 s .: Ill.
2. Luettava kirja epäorgaanisesta kemiasta. Vol. opiskelijoille. 2 tunnissa, osa 1 / pak. V. A. Kritsman - 3. toim. - M .: Koulutus, 1993. - 192 s., 8 l ill .: sairas. - ISBN 5-09-002972-5
3. Kemia. Proc. 9 cl. ympäristöissä. vk. / F. G. Feldman, G. E. Rudzitis - M .: Koulutus, 1990. - 176 s .: Ill. ISBN 5-09-002624-6
4. Kemia: Oppikirja. 8-9 solulle yleinen koulutus. Laitokset / R. G. Ivanova. - 3. painos, Moskova: Koulutus, 2001. - 270 s., Ill. - ISBN 5-09-010278-3
5. Matkustaminen kuudennessa ryhmässä. D. I. Mendelejevin jaksollisen järjestelmän VI ryhmän elementit. Oppaat opiskelijoille. / G. L. Nemchaninova - M., "Enlightenment", 1976 - 128 sivua, Ill.
