Oppitunnissa 5 " Kemiallinen kaava"Kurssilta" Kemia nukkeille"Annamme määritelmän kemiallisille kaavoille ja niiden indekseille, ja selvitämme myös erot molekyyli- ja ei-molekyylirakenteisten aineiden kemiallisissa kaavoissa. Muistutan, että viimeisessä oppitunnissa "" annoimme määritelmän kemiallisille yhdisteille, tutkimme eroja orgaanisten ja epäorgaanisten yhdisteiden välillä ja selvitimme myös, mitä laadullinen ja kvantitatiivinen koostumus tarkoittaa.
Minkä tahansa aineen koostumus ilmaistaan kemiallinen kaava.
Kemiallinen kaava on ehdollista kirjaa aineen koostumuksesta kemiallisia merkkejä ja indeksejä käyttämällä.
Laadullinen koostumus esitetään kemiallisten elementtien merkkien (symboleiden) avulla ja kvantitatiivinen - indeksien avulla, jotka on kirjoitettu oikealle ja juuri kemiallisten elementtien merkien alle.
indeksi - tietyn kemiallisen alkuaineen atomien lukumäärä aineen kaavassa.
Esimerkiksi yksinkertaisen vetyaineen kemiallinen kaava kirjoitetaan seuraavasti:
ja lukea kaksi.
Kemialliset kaavat aineille, joilla on molekyylirakenne
Diatomisten molekyylien kaavat: happi - O2 ("o-kaksi"), kloori - Cl2 ("kloori-kaksi"), typpi - N2 ("en-kaksi"). Triatomista otsonimolekyyliä ja kahdeksan atomin rikin molekyyliä merkitään kaavoilla O 3 (“o-kolme”) ja S 8 (“es-kahdeksan”).
Monimutkaisten aineiden molekyylien kaavat heijastavat myös niiden laadullista ja kvantitatiivista koostumusta. Esimerkiksi, kuten todennäköisesti jo tiedät hyvin, veden kaava on H20 (“al-kaksi-o”), metaani on CH4 (“ce-al-neljä”) ja ammoniakki on NH3 (“en- tuhka kolme "). Kaikkien monimutkaisten aineiden kaavat luetaan täsmälleen samalla tavalla. Esimerkiksi rikkihappokaava on H2S04 (”al-kaksi-es-o-neljä”) ja glukoosi on C6H12O6 (“ce-kuusi-al-tw-o-kuusi”).
Kemialliset kaavat aineille, joilla on molekyylirakenne (niitä kutsutaan molekyylikaavat) esittävät alkuaineosien koostumuksen, eli ehdolliset ”tiilet”, joista nämä aineet koostuvat. Tällaiset peruskomponentit ( perusrakenneyksiköttai vain rakenneyksiköt) tässä tapauksessa ovat molekyylit.
Ja jos aineella on ei-molekyylinen rakenne? Tämän tyyppisten yksinkertaisten aineiden (esimerkiksi metallien) kemialliset kaavat kirjoitetaan yksinkertaisesti vastaavien elementtien merkkeillä ilman indeksejä (tai pikemminkin indeksillä, joka on yhtä suuri kuin yksikkö, jota ei voida kirjoittaa). Joten, yksinkertaisen aineen kaava on rauta - Fe, kupari - Cu, alumiini - Al.
Ei-molekyylirakenteisten monimutkaisten aineiden koostumus ilmaistaan \u200b\u200bkaavoilla, jotka osoittavat yksinkertaisin atomisuhde erilaiset kemialliset alkuaineet näissä aineissa. Sellaisia \u200b\u200bkaavoja kutsutaan yksinkertaisin. Esimerkiksi yksinkertaisin kvartsikaava - jokihiekan pääkomponentti - SiO 2. Se osoittaa, että kvartsikiteessä on kaksi happiatomia kohti piiatomia, ts. Yksinkertaisin pii-atomien lukumäärän ja hapen suhde tässä aineessa on 1: 2. Yksinkertaisin kaava Al203 osoittaa, että tässä yhdisteessä yksinkertaisin alumiiniatomien lukumäärän ja hapen välinen suhde on 2: 3.
Atomiryhmää, jonka koostumus vastaa ei-molekyyliaineen yksinkertaisinta kaavaa, kutsutaan sen atomiksi kaavayksikkö.
Kaavayksikkö, natriumkloridi NaCl ("natriumkloori") on ryhmä, jossa on yksi natriumatomi ja yksi klooriatomi. Muodollinen kalkkiyksikkö CaCO 3 (”kalsium-tse-o-kolme”) on ryhmä, jossa on yksi kalsiumatomi, yksi hiiliatomi ja kolme happiatomia.
Kaavoja monimutkaisemmille yhdisteille, joilla ei ole molekyylirakenne, luetaan samalla tavalla. Lisäksi on ilmoitettu vain sulkeisiin suljettujen atomiryhmien lukumäärä: Al 2 (SO 4) 3 (“alumiini-kaksi-es-o-neljä-kolme kertaa”), Mg (NO 3) 2 (“magnesium-en-o-kolme “Kahdesti”) jne.
Tällä tavalla aineiden rakenneyksiköt molekyylirakenne olemme molekyylit. Aineiden rakenneyksiköt ei-molekyylirakenne ovatko he kaavayksiköt .
Seuraava taulukko näyttää kaavan ja kaaviomaisen esityksen erityyppisten aineiden koostumuksista.
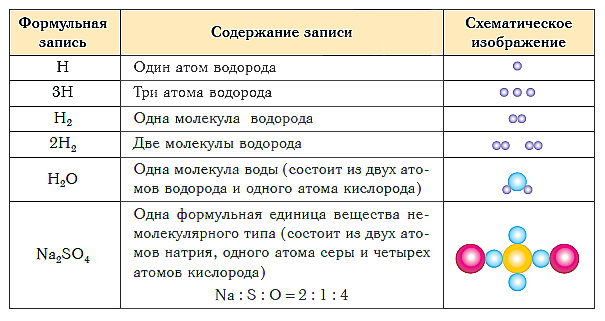
Yhteenveto oppitunnista:
- Aineen laadullinen ja kvantitatiivinen koostumus ilmaistaan \u200b\u200bkemiallisilla kaavoilla.
- Molekyylirakenteisen aineen kemiallinen kaava osoittaa sen molekyylin koostumuksen, joka on tämän aineen perusrakenneyksikkö.
- Ei-molekyylisen aineen kemiallinen kaava osoittaa atomi-suhteen yksinkertaisin kaavayksikössä.
Toivon oppitunnin 5 " Kemiallinen kaava"Oli ymmärrettävää ja informatiivista. Jos sinulla on kysyttävää, kirjoita ne kommentteihin.
Epäorgaanisten aineiden luokittelu ja niiden nimikkeistö perustuvat yksinkertaisimpaan ja vakioimpaan ajanjaksoominaisuuteen - kemiallinen koostumus, joka osoittaa tämän aineen muodostavien elementtien atomien numeerisessa suhteessa. Jos aine koostuu yhdestä atomista, ts. on tämän elementin olemassaolomuoto vapaassa muodossa, sitä kutsutaan yksinkertaiseksi aine; jos aine on kahden tai useamman alkuaineen atomista, sitä kutsutaan monimutkainen aine. Kaikkia yksinkertaisia \u200b\u200baineita (paitsi monatomisia) ja kaikkia komplekseja aineita kutsutaan yleensä kemialliset yhdisteet, koska niissä yhden tai eri elementin atomit on kytketty toisiinsa kemiallisilla sidoksilla.
Epäorgaanisten aineiden nimikkeistö koostuu kaavoista ja nimistä. Kemiallinen kaava - kuva aineen koostumuksesta käyttämällä kemiallisten elementtien tunnuksia, numeerisia indeksejä ja joitain muita merkkejä. Kemiallinen nimi - kuva aineen koostumuksesta käyttämällä sanaa tai sanaryhmää. Kemiallisten kaavojen ja nimien rakenteen määrää järjestelmä nimikkeistösäännöt.
Kemiallisten elementtien symbolit ja nimet on annettu alkujaksojen järjestelmässä D.I. Mendelejev. Elementit jaetaan ehdollisesti metallit ja epämetalliatomeja . Ei-metalleihin kuuluvat kaikki VIIIA-ryhmän (jalokaasut) ja VIIA-ryhmän (halogeenit), VIA-ryhmän (paitsi polonium) alkuaineet, typen, fosforin, arseenin (VA-ryhmä) alkuaineet; hiili, pii (IVA-ryhmä); boori (IIIA-ryhmä), samoin kuin vety. Loput elementit luokitellaan metalleiksi.
Aineiden nimiä laadittaessa käytetään yleensä venäläisiä alkuaineiden nimiä, esimerkiksi happea, ksenonidifluoridia, kaliumselenaattia. Perinteisesti joillekin elementeille niiden latinalaisten nimien juuret johdetaan johdannaisiksi:
Esimerkiksi: karbonaatti, manganaatti, oksidi, sulfidi, silikaatti.
nimet yksinkertaiset aineet koostuvat yhdestä sanasta - kemiallisen elementin nimi, jolla on numeerinen etuliite, esimerkiksi:
 Seuraavia käytetään numeeriset konsolit:
Seuraavia käytetään numeeriset konsolit:
 Rajoittamaton numero on merkitty numeerisella etuliitteellä n - poly.
Rajoittamaton numero on merkitty numeerisella etuliitteellä n - poly.
Käytetään myös joitain yksinkertaisia \u200b\u200baineita. erityinennimet, kuten O 3 - otsoni, P 4 - valkoinen fosfori.
Kemialliset kaavat monimutkaiset aineet muodostavat merkinnän elektropositiivisella (ehdolliset ja todelliset kationit) ja electronegative (tavanomaiset ja oikeat anionit) ainesosat, esimerkiksi CuSO 4 (tässä Cu 2+ on todellinen kationi, SO 4 2 on todellinen anioni) ja PCI 3 (tässä P + III on ehdollisen kationin, Cl-I on ehdollisen anionin).
nimet monimutkaiset aineet täytetään kemiallisilla kaavoilla oikealta vasemmalle. Ne koostuvat kahdesta sanasta - esimerkiksi sähköonegatiivisten komponenttien nimet (nimeävässä tapauksessa) ja sähköopositiivisten komponenttien nimet (genitiivisessä tapauksessa):
CuSO 4 - kupari (II) sulfaatti
PCl3 - fosforitrikloridi
LaCl3 - lantaani (III) kloridi
Hiilimonoksidi
Nimissä esiintyvien sähköpositiivisten ja elektronegatiivisten komponenttien lukumäärä osoitetaan yllä annetuilla numeerisilla etuliitteillä (yleinen menetelmä) tai hapetusasteilla (jos ne voidaan määrittää kaavalla) suluissa olevilla roomalaisilla numeroilla (plusmerkki jätetään pois). Useissa tapauksissa annetaan ionipanos (kationeille ja anioneille, joilla on monimutkaisia \u200b\u200bkoostumuksia) käyttämällä arabialaisia \u200b\u200bnumeroita vastaavalla merkillä.
Tavallisille monielementtisiin kationeihin ja anioneihin sovelletaan seuraavia erityisiä nimiä:
Käytetään myös pieni joukko tunnettuja aineita. erityinen nimi:
![]() 1. Happamat ja emäksiset hydroksidit. suolat
1. Happamat ja emäksiset hydroksidit. suolat
Hydroksidit - tyyppi monimutkaisista aineista, joihin sisältyy tietyn elementin E atomit (paitsi fluori ja happi) ja hydroksyyliryhmä OH; yleinen kaava hydroksideille E (OH) n jossa n\u003d 1 ÷ 6. Hydroksidien muoto E (OH) n sitä kutsutaan orto-muodossa; at n\u003e 2-hydroksidia voi olla myös läsnä meta-muoto, joka E-atomien ja OH-ryhmien lisäksi myös O-happiatomeja, esimerkiksi E (OH) 3 ja EO (OH), E (OH) 4 ja E (OH) 6 ja EO2 (OH) 2.
Hydroksidit jaetaan kahteen ryhmään, jotka ovat kemiallisilla ominaisuuksiltaan vastakkaiset: happamat ja emäksiset hydroksidit.
^ Hapon hydroksidit sisältävät vetyatomeja, jotka voidaan korvata metalliatomilla, jotka ovat stoikiometrisen valenssisäännön alaisia. Suurinta osaa happohydroksidista löytyy meta- muodostavat vetyatomeilla happamien hydroksidien kaavoissa, joista ensisijaisesti asetetaan esimerkiksi H2S04, HN03 ja H2C03 kuin S02 (OH) 2, N02 (OH) ja CO (OH) 2. Happohydroksidien yleinen kaava on H x EO at jossa EO: n elektronegatiivinen komponentti at x- jota kutsutaan happotähteeksi. Jos kaikkia vetyatomeja ei korvata metalla, niin ne jäävät happotähteeseen.
Tavallisten happohydroksidien nimet koostuvat kahdesta sanasta: oikea nimi, jonka lopussa on "ay", ja ryhmäsana "happo". Annamme kaavat ja oikeat nimet tavallisille happohydroksidille ja niiden happojäännöksille (viiva tarkoittaa, että hydroksidia ei tunneta sen vapaassa muodossa tai happamassa vesiliuoksessa):
Vähemmän yleisiä happohydroksideja kutsutaan monimutkaisten yhdisteiden nimikkeistösääntöjen mukaisesti, esimerkiksi:
 Happojäännösten nimiä käytetään suolanimien rakentamisessa.
Happojäännösten nimiä käytetään suolanimien rakentamisessa.
^ Emäksiset hydroksidit sisältävät hydroksidi-ioneja, jotka voidaan korvata happojäännöksillä, jotka ovat stoikiometrisen valenssisäännön alaisia. Kaikki tärkeimmät hydroksidit ovat sisällä orto-muodossa; niiden yleinen kaava on M (OH) n jossa n \u003d 1,2 (harvoin 3,4) ja M n + - metallikationi. Esimerkkejä kaavoista ja emäksisten hydroksidien nimistä:
 Emäksisten ja happohydroksidien tärkein kemiallinen ominaisuus on niiden vuorovaikutus suolojen muodostumiseen ( suolan muodostumisreaktio), esimerkiksi:
Emäksisten ja happohydroksidien tärkein kemiallinen ominaisuus on niiden vuorovaikutus suolojen muodostumiseen ( suolan muodostumisreaktio), esimerkiksi:
Ca (OH) 2 + H2S04 \u003d CaSO4 + 2H20
Ca (OH) 2 + 2H2S04 \u003d Ca (HSO4) 2 + 2H20
2Ca (OH) 2 + H2S04 \u003d Ca2S04 (OH) 2 + 2H20
Suolat - tyyppi monimutkaisista aineista, joihin kuuluvat kationit M n + ja happotähteet *.
Suolat yleisen kaavan M kanssa x (EO at) n kutsutaan keskimääräinen suolat ja suolat substituoimattomien vetyatomien kanssa, hapan suoloja. Joskus suolat sisältävät myös hydroksidi- tai (ja) oksi-ioneja; sellaisia \u200b\u200bsuoloja kutsutaan ensisijainen suoloja. Tässä on esimerkkejä ja suolojen nimistä:
 Hapan ja emäksinen suola voidaan muuttaa keskisuolaksi reaktiolla vastaavan emäksisen ja hapan hydroksidin kanssa, esimerkiksi:
Hapan ja emäksinen suola voidaan muuttaa keskisuolaksi reaktiolla vastaavan emäksisen ja hapan hydroksidin kanssa, esimerkiksi:
Ca (HSO 4) 2 + Ca (OH) \u003d CaSO 4 + 2H 2O
Ca 2SO 4 (OH) 2 + H2S04 \u003d Ca 2SO 4 + 2H 2O
On myös suoloja, jotka sisältävät kaksi eri kationia: niitä kutsutaan usein kaksoissuolatesimerkiksi:
 2. Happamat ja emäksiset oksidit
2. Happamat ja emäksiset oksidit
Oksidit E x oi at - hydroksidien täydellisen dehydraation tuotteet:
 Hapon hydroksidit (H2SO4, H2CO3) happooksidit tapaavat (S03, CO 2) ja tärkeimmät hydroksidit (NaOH, Ca (OH) 2) - emäksiset oksidit (Na20, CaO), lisäksi elementin E hapetustila ei muutu siirryttäessä hydroksidista oksidiksi. Esimerkki kaavoista ja oksidien nimistä:
Hapon hydroksidit (H2SO4, H2CO3) happooksidit tapaavat (S03, CO 2) ja tärkeimmät hydroksidit (NaOH, Ca (OH) 2) - emäksiset oksidit (Na20, CaO), lisäksi elementin E hapetustila ei muutu siirryttäessä hydroksidista oksidiksi. Esimerkki kaavoista ja oksidien nimistä:
 Hapot ja emäksiset oksidit säilyttävät vastaavien hydroksidien suolaa muodostavat ominaisuudet, kun ne ovat vuorovaikutuksessa vastakkaisten ominaisuuksien hydroksidien kanssa tai keskenään:
Hapot ja emäksiset oksidit säilyttävät vastaavien hydroksidien suolaa muodostavat ominaisuudet, kun ne ovat vuorovaikutuksessa vastakkaisten ominaisuuksien hydroksidien kanssa tai keskenään:
N205 + 2NaOH \u003d 2NaN03 + H20
3CaO + 2H3P04 \u003d Ca3 (PO4) 2 + 3H20
La 2 O 3 + 3SO 3 \u003d La 2 (SO 4) 3
^ 3. Amfoteeriset oksidit ja hydroksidit
amfoteeriset hydroksidit ja oksidit - kemiallinen ominaisuus, joka muodostuu kahden rivin suoloista, esimerkiksi hydroksidille ja alumiinioksidille:
(a) 2Al (OH) 3 + 3S03 \u003d Al2 (S04) 3 + 3H20
Al203 + 3H2S04 \u003d Al2 (SO4) 3 + 3H20
(b) 2Al (OH) 3 + Na20 \u003d 2NaAlO2 + 3H20
Al203 + 2NaOH \u003d 2NaAlO 2 + H20
Siten hydroksidilla ja alumiinioksidilla reaktioissa (a) on ominaisuuksia merkittävä hydroksidit ja oksidit, ts. reagoida happamien hydroksidien ja oksidien kanssa muodostaen vastaavan suolan - alumiinisulfaatin Al 2 (SO 4) 3, kun taas reaktioissa (b) niillä on ominaisuuksia happo hydroksidit ja oksidit, ts. reagoi emäksisen hydroksidin ja oksidin kanssa muodostaen suola - natriumdioksoaluminaatti (III) NaAlO 2. Ensimmäisessä tapauksessa alumiinielementillä on metallin ominaisuus ja se on osa sähköpositiivista komponenttia (Al 3+), toisessa ei-metalliominaisuutta ja on osa suolakaavan (AlO 2 -) sähköä negatiiviseen komponenttiin.
Jos nämä reaktiot tapahtuvat vesiliuoksessa, muodostettujen suolojen koostumus muuttuu, mutta alumiinin läsnäolo kationissa ja anionissa pysyy:
2Al (OH) 3 + 3H2S04 \u003d 2 (S04) 3
Al (OH) 3 + NaOH \u003d Na
Tässä hakasulkeet edustavat monimutkaisia \u200b\u200b3+ -ioneja - heksaakalumiinium (III) -kationia, - - tetrahydroksoaluminaatti (III) -ionia.
Alkuaineita, joilla on yhdisteissä metallisia ja ei-metallisia ominaisuuksia, kutsutaan amfoteerisiksi; niihin sisältyy jaksollisen järjestelmän A-ryhmien elementit - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po jne., Samoin kuin suurin osa elementeistä ryhmät - Cr, Mn, Fe, Zn, Cd, Au jne. Amfoteerisia oksideja kutsutaan samoiksi kuin pääryhmiä, esimerkiksi:
 Amfoteeriset hydroksidit (jos elementin hapetustila ylittää + II) voivat olla orto - tai (ja) meta - muoto. Tässä on esimerkkejä amfoteerisista hydroksideista:
Amfoteeriset hydroksidit (jos elementin hapetustila ylittää + II) voivat olla orto - tai (ja) meta - muoto. Tässä on esimerkkejä amfoteerisista hydroksideista:
 Amfoteeriset oksidit eivät aina vastaa amfoteerisia hydroksideja, koska jälkimmäisiä yritettäessä muodostuu esimerkiksi hydratoituneita oksidia:
Amfoteeriset oksidit eivät aina vastaa amfoteerisia hydroksideja, koska jälkimmäisiä yritettäessä muodostuu esimerkiksi hydratoituneita oksidia:
 Jos yhdisteissä oleva amfoteerinen elementti vastaa useita hapetustiloja, niin vastaavien oksidien ja hydroksidien amfoteerisuus (ja siten itse elementin amfoteerisuus) ilmaistaan \u200b\u200beri tavalla. Matalahapetustiloissa hydroksideilla ja oksideilla on pääasiassa emäksisiä ominaisuuksia, kun taas itse elementissä on pääosin metalliominaisuuksia, joten se on melkein aina osa kationeja. Korkeahapetustiloissa päinvastoin, hydroksideilla ja oksideilla on pääosin happamia ominaisuuksia, ja itse elementillä on ei-metalliset ominaisuudet, joten se on melkein aina osa anioneja. Joten pääominaisuudet hallitsevat mangaani (II) oksidissa ja hydroksidissa, ja mangaani itsessään kuuluu tyypin 2+ kationeihin, kun taas mangaani (VII) oksidi ja hydroksidi hallitsevat happamissa ominaisuuksissa, ja mangaani itsessään on osa MnO 4 -tyyppistä anionia - . Amfoteeriset hydroksidit, joilla on suuri määrä happamia ominaisuuksia, luokitellaan kaavoihin ja nimiin, jotka on mallinnettu happamille hydroksidille, esimerkiksi HMn VII O 4 - mangaanihappo.
Jos yhdisteissä oleva amfoteerinen elementti vastaa useita hapetustiloja, niin vastaavien oksidien ja hydroksidien amfoteerisuus (ja siten itse elementin amfoteerisuus) ilmaistaan \u200b\u200beri tavalla. Matalahapetustiloissa hydroksideilla ja oksideilla on pääasiassa emäksisiä ominaisuuksia, kun taas itse elementissä on pääosin metalliominaisuuksia, joten se on melkein aina osa kationeja. Korkeahapetustiloissa päinvastoin, hydroksideilla ja oksideilla on pääosin happamia ominaisuuksia, ja itse elementillä on ei-metalliset ominaisuudet, joten se on melkein aina osa anioneja. Joten pääominaisuudet hallitsevat mangaani (II) oksidissa ja hydroksidissa, ja mangaani itsessään kuuluu tyypin 2+ kationeihin, kun taas mangaani (VII) oksidi ja hydroksidi hallitsevat happamissa ominaisuuksissa, ja mangaani itsessään on osa MnO 4 -tyyppistä anionia - . Amfoteeriset hydroksidit, joilla on suuri määrä happamia ominaisuuksia, luokitellaan kaavoihin ja nimiin, jotka on mallinnettu happamille hydroksidille, esimerkiksi HMn VII O 4 - mangaanihappo.
Täten elementtien jakautuminen metalleiksi ja ei-metalleiksi on ehdollista; Puhtaasti metallisten elementtien (Na, K, Ca, Ba jne.) Ja elementtien (F, O, N, Cl, S, C jne.), Joilla on puhtaasti ei-metallisia ominaisuuksia, välillä on suuri joukko elementtejä, joilla on amfoteerisiä ominaisuuksia.
4. Binaariliitännät
Laaja tyyppinen epäorgaaninen kompleksi aine on binaarisia yhdisteitä. Näihin kuuluvat ensinnäkin kaikki kaksielementtiyhdisteet (paitsi emäksiset, happamat ja amfoteeriset oksidit), esimerkiksi H20, KBr, H2S, Cs2 (S2), N20, NH3, HN3, CaC2 SiH 4. Näiden yhdisteiden kaavojen elektropositiiviset ja elektronegatiiviset komponentit sisältävät yhden elementin yksittäiset atomit tai sukulaiset atomiryhmät.
Monielementtejä, joiden kaavoissa yksi aineosista sisältää useiden elementtien toisiinsa liittymättömiä atomeja, samoin kuin yksielementtisiä tai monielementtisiä atomiryhmiä (paitsi hydroksidit ja suolat), pidetään binaarisina yhdisteinä, esimerkiksi CSO, IO 2 F 3, SBrO 2 F, CrO (O2) 2, PSI3, (CaTi) O3, (FeCu) S2, Hg (CN) 2, (PF3) 20, VCI2 (NH2). Joten CSO voidaan edustaa yhdisteenä CS2, jossa yksi rikkiatomi on korvattu happiatomilla.
Binaaristen yhdisteiden nimet rakennetaan tavanomaisten nimikkeistösääntöjen mukaisesti, esimerkiksi:
 Joillekin binääriyhdisteille käytetään erityisiä nimiä, joiden luettelo on annettu aiemmin.
Joillekin binääriyhdisteille käytetään erityisiä nimiä, joiden luettelo on annettu aiemmin.
Binaaristen yhdisteiden kemialliset ominaisuudet ovat melko erilaisia, joten ne jaetaan usein ryhmiin anionien nimellä, ts. halogenideja, kalkogenidejä, nitridejä, karbideja, hydridejä jne. tarkastellaan erikseen. Binaaristen yhdisteiden joukossa on myös sellaisia, joilla on joitain ominaisuuksia muun tyyppisillä epäorgaanisilla aineilla. Joten yhdisteitä CO, NO, NO 2 ja (Fe II Fe 2 III) O 4, joiden nimet on rakennettu käyttämällä sanaa oksidi, ei voida luokitella oksidityypille (happamat, emäksiset, amfoteeriset). Hiilimonoksidilla CO, typpimonoksidilla NO ja typpidioksidilla NO 2 ei ole vastaavia happohydroksideja (vaikka nämä oksidit muodostavat ei-metalliset C ja N), ne eivät muodosta suoloja, joiden anionit sisältäisivät C II, N II ja N IV atomia. Vaikka kaksoisoksidi (Fe II Fe 2 III) O 4 on diezhelez (III) raudan (II) oksidi, vaikka se sisältää sähköpositiivisessa komponentissa amfoteerisen elementin, raudan, atomit, sillä on kaksi erilaista hapetustilaa, jotka muodostuessaan vuorovaikutuksessa happohydroksidien kanssa ei yksi, vaan kaksi eri suolaa.
Binaariset yhdisteet, kuten AgF, KBr, Na2S, Ba (HS) 2, NaCN, NH4CI ja Pb (N3) 2, rakennetaan, kuten suolat, oikeista kationeista ja anioneista, siksi niitä kutsutaan suolamainen binaariset yhdisteet (tai vain suolat). Niitä voidaan pitää vetyatomien substituutiotuotteina yhdisteissä НF, НCl, НBr, Н 2 S, НCN ja НN 3. Viimeksi mainituilla vesiliuoksessa on hapan tehtävä, ja siksi niiden liuoksia kutsutaan hapoiksi, esimerkiksi НF (aqua) - fluorivetyhappo, Н 2 S (aqua) - rikkivedyksi. Ne eivät kuitenkaan kuulu happamien hydroksidien tyyppiin, ja niiden johdannaiset - suoloihin epäorgaanisten aineiden luokittelussa.
KEMIAN VALVONTA
14. Kuinka paljon Cr (OH) s sisältää samat ekvivalentit kuin 174,96 g Mg (OH) 2?
Magnesiumhydroksidin moolimassa on 58,32 g / mol ja ekvivalentti massa on 29,16 g / mol. Siksi magnesiumhydroksidin massa 174,96 g sisältää 174,96 g: 29,16 g / mol \u003d 6 mooliekvivalenttia.
Kromihydroksidin (III) ekvivalentin moolimassa on 1/3 M Cr (OH) s tai 34,34 g / mol, ja 6 mol-ekvivalenttia tätä ainetta on 34,33 g / mol x 6 mol \u003d 205,98 g.
Siten 205,98 g Cr (OH): ta sisältää samat ekvivalentit kuin 174,96 g Mg (OH) 2: ta.
34. Kuinka monta ja mitkä arvot magneettinen kvanttiluku m l voi ottaa kiertoradan kvanttilukulla l \u003d 0,1,2,3? Mitä jaksollisen järjestelmän elementtejä kutsutaan s-, p-, d-, f-elementeiksi? Anna esimerkkejä
Magneettisen kvanttilukun arvojen lukumäärä riippuu kiertoradan kvanttilukusta ja on yhtä suuri kuin
(21 + 1), missä 1 on kiertoradan kvanttinumero. Siksi, varten l \u003d 0 m l =0,
at l \u003d 1 m l ottaa arvot -1,0, +1;
at 1 \u003d 2 m l ottaa arvot -2, -1, 0, + 1, + 2;
at \u003d 3 m l voi ottaa arvot -3, -2, -1, 0, + 1, + 2, + 3.
Kemiallisia elementtejä, joiden atomissa s-, p-, d-, f- orbitaalien täyttäminen vastaavasti elektronilla, kutsutaan s-, p-, d-, f-elementeiksi.
Esimerkiksi s-elementteihin kuuluvat H, He samoin kuin alkali- ja maa-alkalimetallit (metallit 1A ja 11A-ryhmät - Na, K, Rb, Be. Ca, Mg, Sg jne.)
P-elementteihin kuuluvat esimerkiksi elementit, joiden jaksot jaksollisessa elementtijärjestelmässä (paitsi ensimmäinen jakso) päättyvät - B, C, N, Ne, J, Cl, Br, P, S, F, As, Ce, Ar, Rn, Te ja muut
D-elementteihin sisältyvät elementit, jotka sijaitsevat suurina aikoina s-elementtien ja p-elementtien välillä, esimerkiksi Fe, Mn, Cr, Ti, Mo, PT, Co, Ru, Rh jne.
F-elementteihin sisältyvät lantanidit, esimerkiksi Ce, Nd, Pm, Sm, Eu, Gd, ja aktinidit, esimerkiksi Th, U, Np, Pu, Am jne.
54. Mikä on vety, fluori, rikki ja typpi alhaisin hapetustila? Miksi? Koota kalsiumyhdisteiden kaavat näiden alkuaineiden kanssa tässä hapetustilassa. Mitkä ovat vastaavien yhdisteiden nimet?
Vetyatomissa on yksi valenssielektroni. Siksi vetyhapetuksen alin aste on -1 (vetyatomi ottaa yhden elektronin toisesta elementistä). Tämä alempi hapetustila +2 -1, vety ilmenee yhdisteenä CaH2. Tätä yhdistettä kutsutaan kalsiumhydridiksi.
Fluoriatomilla on seitsemän valenssielektronia, energiatason loppuunsaattamiseen puuttuu yksi elektroni. Siksi fluorin alin (ja ainoa) hapetustila on -1. Fluoriyhdisteitä, joiden hapetustila on +2–1, kutsutaan fluorideiksi. Esimerkiksi CaF2 on kalsiumfluoridi.
Rikkiatomissa on kuusi valenssielektronia, kunnes kaksi energiaelektroniä puuttuu energiatason loppuunsaattamisesta. Siksi alin rikin hapettumisaste on -2. Rikkiyhdisteitä tässä hapetustilassa +2 -2 kutsutaan sulfideiksi. Esimerkiksi CaS on kalsiumsulfidi.
Typpiatomissa on viisi valenssielektronia; kolme energiaa puuttuu, kunnes energiahäviö on valmis. Siksi alhaisin typen hapettumisaste on -3. Typpiyhdisteitä tässä hapetustilassa + 2-3 kutsutaan nitrideiksi. Ca s N 2 on kalsiumnitridi.
74. Mitä atomin hapettumisasteella tulisi ymmärtää? Määritä yhdisteiden hiiliatomin hapetusaste ja sen valenssi: CH4; CH30H; HCOOH; CO 2
Hapetusasteella tarkoitetaan yhdisteessä olevan atomin ehdollista varausta laskettuna oletuksesta, että se koostuu vain ioneista. Hapetusaste voi ottaa negatiivisen, positiivisen ja nolla-arvon, edustaa kokonaislukua tai murto-osaa. Yhdisteessä olevien atomien hapetustilojen algebrallinen summa on aina nolla, ja kompleksi-ionissa, ionin varaus.
Edellä mainituissa hiiliyhdisteissä hiiliatomi on tetravalentti. Mutta näiden yhdisteiden hiiliatomin hapettumisaste on erilainen.
Metaanissa - CH4 - hiilen hapetustila on 4.
Metanolissa - СНЗОН - hiilen hapetusaste - 2, muurahaishapossa, НССО - hiilen hapettumisaste +2, hiilidioksidissa - СО 2 - hiilen hapettumisaste +4.
94. 11,5 g nestemäistä etyylialkoholia palaessa palautui 308,71 kJ lämpöä. Kirjoita lämpökemiallinen yhtälö reaktiolle, joka tuottaa vesihöyryä ja hiilidioksidia. Laske C2H5OH (g) muodostumislämpö. Vastaus: -277,67 kJ
С 2 Н 5 ОН (g) + 3 О 2 (g) \u003d 2 СО 2 (g) + 3 Н 2 О (p)
1 moolin nestemäisen etyylispiraalin massa on 46 g.
Termokemiallisen yhtälön laatimiseksi lasketaan osuus:
11,5 g etanolia ---------- 308,71 kJ
46 g etanolia ------------ x kJ
Silloin metaanin termokemiallinen yhtälö on seuraava:
C 2H 5OH (g) + 3 0 2 (g) \u003d 2 C02 (g) + 3 H 2 O (n); ∆Н ° \u003d -1234,84
Reaktion lämpövaikutus kirjoitetaan miinusmerkillä, koska reaktion aikana vapautuu lämpöä.
Hessin lain mukaan reaktion lämpövaikutus ei riipu siirtymäpolusta, vaan riippuu vain järjestelmän lopullisesta ja alkutilasta.
∆Н ° reaktio \u003d ∑∆Н ° arr. - ∑∆Н ° arr alkaa
Lähtöaineiden ja reaktiotuotteiden muodostumisen tavanomaiset entalpiat on otettu hakuteoksesta:
СО2 (g) arrН ° arr - \u003d -393,51 kJ / mol,
'NR ° arr N20 (höyry) \u003d -241,83 kJ / mol
∆Н ° näyte О 2 (g) \u003d 0 kJ / mol.
∆Н ° arr (С 2 Н 5 ОН (ж)) \u003d [∆Н ° arr (Н 2 О) * 3 + ∆Н ° arr (СО 2) * 2] - ∆Н ° reaktio \u003d [(-241, 83) * 3 + (- 393,51) * 2 - (-1234, 84) \u003d - 277,68 kJ / mol
114. Mitkä karbonaateista: BeCO3, CaCO3 tai BaCO3 - voidaan saada tekemällä vastaavat oksidit CO 2: lla? Mikä on energinen reaktio? Päätelmä tekee laskelman °G ° 298 reaktiot
Otetaan normaalien Gibbs-energian viitearvot bsG ° 298 lähtöaineille ja lopullisille reaktiotuotteille: ∆G ° 298 BeO \u003d -569,54 kJ / mol, ∆G ° 298 BeCO3 \u003d -944,75, ∆G ° 298 BaO \u003d -525,84 kJ / mol, AG ° 298 BaC03 \u003d -1132,77 kJ / mol; ∆G ° 298 CaO \u003d -603,46 kJ / mol,
AG ° 298 CaCO3 \u003d -1128,35 kJ / mol; AG ° 298 C02 \u003d -394,37 kJ / mol;
Sitten reaktiolle BeO (k) + CO2 (g) \u003d BeCO3 (k), Gibbs-energian vakioarvo on:
944,75 - [(- 569,54) + (- 394,37)] \u003d + 19,16 kJ / mol.
Gibbs-energian positiivinen arvo tälle reaktiolle osoittaa, että standardiolosuhteissa tämä reaktio etenee pääosin oikealta vasemmalle ja berylliumkarbonaattia BeO: sta ja C02: sta ei voida saada.
Reaktiolle BaO (k) + CO2 (g) \u003d BaCO3 (k) Gibbsin vakioenergia on:
1132.77 - [(- 525.84) + (- 394.37)] \u003d - 212,56 kJ / mol /
Reaktiolle CaO (k) + CO2 (g) \u003d CaCO3 (k) Gibbsin vakioenergia on:
1128,35 - [(- 603,46) + (- 394,37)] \u003d - 130,52 kJ / mol.
Gibbsin energia-arvo näille reaktioille on negatiivinen ja nämä prosessit etenevät eteenpäin, ts. On mahdollista saada kalsium- ja bariumkarbonaatteja tällä tavalla. Reaktio bariumoksidin ja hiilidioksidin välillä on kaikkein energinen, koska Gibbsin energian arvolla tässä reaktiossa on kaikkein negatiivisin arvo.
134. Homogeenisen järjestelmän 4 НСl (g) + О 2 (g) ↔ 2Н 2 0 (g) + 2Сl 2 (g) tasapainotettiin seuraavilla reagoivien aineiden pitoisuuksilla mol / L: [Н 2 О] р \u003d 0,14; [Cl2] p \u003d 0,14; [Hcl] P \u003d 0,20; [02] p \u003d 0,32. Laske vetykloridin ja hapen alkupitoisuus.
[H20] p \u003d 0,14 mol / L
[Cl2] p \u003d 0,14 mol / l
[Hcl] P \u003d 0,20 mol / L
[02] p \u003d 0,32 mol / l
Ref \u003d? ref \u003d?
Reaktioyhtälön perusteella kaikki kloori (2 mol) muodostetaan vetykloridista (4 mol) ja kaikki vesi - alkuperäisestä kloorivedystä ja hapesta.
Siksi, jotta 0,14 moolia klooria muodostuisi, 0,28 moolin vetykloridia on reagoitava, ja 0,14 moolin veden saamiseksi 0,07 moolia happea on päästävä reaktioon.
Siten Hcl: n alkukonsentraatio oli 0,20 + 0,28 \u003d 0,48 mol / L ja 02: n alkuperäinen konsentraatio oli 0,32 + 0,07 \u003d 0,39 mol / L.
Vastaus: Vetykloridin ja happen alkuperäiset pitoisuudet ovat vastaavasti 0,48 mol / L ja 0,39 mol / L.
154. 1 litran liuoksen, joka sisältää 1,4 g KOH, neutraloimiseksi tarvitaan 50 cm3 happoliuosta. Laske ekvivalenttihappoliuoksen moolipitoisuus
Etsi KOH-liuoksen tiitteri:
Nyt lasketaan KOH-liuoksen ekvivalentin moolipitoisuus:
Kun KOH-ratkaisu tietää ekvivalentin moolipitoisuuden arvon, se laskee happoekvivalentin moolipitoisuuden:
174. Kuinka monta grammaa urea CO (NH2) 2: ta tulisi liuottaa 75 g: aan vettä, jotta liuoksen kiteytymislämpötila laskee 0,465 °? Veden kryoskooppivaki on 1,86
Urean moolimassa on 60 g / mol. Liuoksen jäätymislämpötilan lasku ΔТ К \u003d 0,465 ° С.
Raoultin lain mukaan liuoksen kiteytymislämpötilan lasku verrattuna puhtaan liuottimen kiteytyslämpötilaan riippuu liuottimen kryoskopisesta vakiosta ja liuenneen aineen moolipitoisuudesta. Täältä voit laskea liuenneen aineen - urean - massan liuoksessa.
194. Luo reaktioiden molekyyli- ja ionimolekyyliyhtälöt, jotka ilmaistaan \u200b\u200bionimolekyylin yhtälöinä
Fe (OH) s + 3H + \u003d Fe3 + + 3H20
Cd2 + + 2OH - \u003d Cd (OH) 2
H + + NO2 - \u003d HNO2
Fe (OH) 3 (t) + 3 НСl \u003d FeС1 3 + 3 Н 2 О
Fe (OH) 3 (t) + 3 Н + + 3 Сl - \u003d Fe 3+ + ЗСl - + 3 Н 2 О
Fe (OH) 3 (t) + 3H + \u003d Fe3 + + 3H20
Cd (NO h) 2 + 2 KOH \u003d Cd (OH) 2 (t) + 2 KN03
Cd2 + + 2N03 + 2K + + 2OH - \u003d Cd (OH) 2 (t) + 2 K + + 2N03 -
Cd2 + 2OH - \u003d Cd (OH) 2 (t)
НС1 + NaNО 2 \u003d НNО 2 + NaС1
Н + + Сl - + Na + + NO 2 - \u003d НNО 2 + Na + + Сl -
H + + NO2 - \u003d HNO2
214. Kun A12 (S04) ja Na2C03 sekoitetaan, kukin otettu suola hydrolysoidaan palautumattomasti vastaavan emäksen ja hapon muodostamiseksi. Ilmoita tämä yhteishydrolyysi ionimolekyylin ja molekyylin yhtälöillä
A1 2 (SO 4) s + 3 Na 2 СО 3 + 3 Н 2 О → 2 A1 (ОН) 3 (t) + 3 Na 2 SO 4 + ЗСО 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + ЗСО 3 2- + 3 Н 2 О → 2 Fe (ОН) 3 (t) + 6 Na + + 3 SO 4 2- + ЗСО 2 (d)
2 A1 3+ + ЗСО 3 2- + 3 Н 2 О → 2 А1 (ОН) 3 (t) + ЗСО 2 (g)
254. Rauta- ja hopealevyt yhdistetään ulkoisella johtimella ja upotetaan rikkihappoliuokseen. Tee kaavio tästä galvaanisesta kennosta ja kirjoita anodin ja katodin prosessien elektroniset yhtälöt.
(-) Fe | H2S04 | | H2S04 | Ag (+)
Anodilla (rauta) prosessi etenee Фе-2 ё \u003d Фе 2+, elektronit kulkevat johtimen läpi hopealevylle ja prosessi etenee katodin hopeapinnalla.
2 Н + + 2 ё \u003d Н 2 Т.
Rautalevy liukenee ja vetyä havaitaan hopealevyllä.
274. Tee elektroniset yhtälöt grafiittielektrodien KBr-liuoksen elektrolyysin aikana tapahtuvista prosesseista. Mikä aineen massa vapautuu katodilla ja anodilla, jos elektrolyysi suoritetaan 1 h 35 minuutin ajan 15 A virralla? Vastaus on: 0,886g; 70,79g
Kun inertteillä (grafiitti) elektrodeilla varustettua kaliumbromidin vesiliuosta elektrolysoidaan, vesimolekyylien palautusprosessi etenee katodilla ja vety vapautuu:
2Н 2 О + 2ё \u003d Н 2 + 2О1H -
Anodilla bromidi-ionien hapettumisprosessi etenee ja bromi vapautuu: 2Br - - 2o \u003d Br 2 Vetyekvivalentin moolimassa on 1 g / mol ja bromiekvivalentin moolimassa on 79,904 g / mol.
Sitten Faradayn lakien mukaan löydät vety- ja bromimassan, jotka vapautuvat vastaavasti katodilla ja anodilla.
294. Mikä metalli on parempi valita kaapelin lyijyvaipan suojaamiseksi kulutuspinnan suojaamiseksi: sinkki, magnesium tai kromi? Miksi? Tee elektroniset yhtälöt ilmakehän korroosion anodisista ja katodisista prosesseista. Mikä on korroosiotuotteiden koostumus?
Kulutuspinnan suojauksella kulutuspinta on aktiivisempi metalli kuin suojatun rakenteen metalli toimii anodina ja tuhoutuu suojaten siten rakennetta tuhoutumiselta. Siksi, mitä negatiivisempi metallipintapotentiaali on, sitä tehokkaampi kulutuspinnan suojaus on. Magnesiumilla on alhaisin potentiaali -2,37 V, (0,673 V sinkille; 0,74 V kromille)
Koska kaapelin vaippa on valmistettu lyijystä, galvaanisella parilla magnesium - lyijyllä on suurin potentiaaliero. Ja magnesium toimii parhaana kulutuspinnan suojana.
Ilmakehän korroosion kanssa prosessi etenee magnesiumpinnan pinnalla:
2Mg - 4ё \u003d 2Mg 2+
Elektronit kulkevat johtimen läpi lyijykaapeliin ja hapenpolarisoituminen tapahtuu lyijyn pinnalla:
О 2 + 2 Н 2 О + 4ё \u003d 4 OH -
Ilmakehän korroosion tuote on magnesiumhydroksidi.
2 Mg 2+ + 4 OH - \u003d 2 Mg (OH) 2
314. Kirjoita seuraavien kompleksi-ionien epävakausvakioiden lausekkeet: [Ag (CN) 2] -; [Ag (NH3) 2] +; [Ag (SCM) 2] -. Tietäen, että ne ovat vastaavasti yhtä suuret kuin 1,0 * 10 -21, 6,8 * 10 -8, 2,1 * 10 -11, ilmoita, missä liuos, joka sisältää näitä ioneja, Ag + -ionien yhtä molaarisella pitoisuudella on suurempi?
Me kirjoitamme näiden monimutkaisten ionien epävakauden vakion lausekkeet:
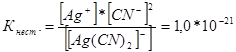
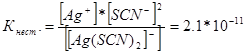
Tietyssä lämpötilassa epävakauden vakion arvo on vakio. Mitä alempi epävakausvakio, sitä vakaampi kompleksi, siksi korkein hopea-ionien konsentraatio on liuoksessa, joka sisältää kompleksi-ionia [Ag (NH3) 2] +.
kirjallisuus
1. Akhmetov N.S. Yleinen ja epäorgaaninen kemia. M, 2002.
2. Karapetyantit M.Kh., Drakin S. I. Yleinen ja epäorgaaninen kemia. M. 1994.
3. Glinka L. I. Yleinen kemia. M. 1984.
