Syntynyt vuonna 1844 Wienissä. Boltzmann on tieteen edelläkävijä ja edelläkävijä. Hänen teoksensa ja opintonsa olivat usein käsittämättömiä ja yhteiskunnan hylättyjä. Fysiikan kehittämisen myötä hänen teoksensa kuitenkin tunnustettiin ja julkaistiin myöhemmin.
Tutkijan tieteelliset edut kattoivat sellaiset perustavanlaatuiset alueet kuin fysiikka ja matematiikka. Vuodesta 1867 hän on työskennellyt opettajana useissa korkeakouluissa. Tutkimuksissaan hän havaitsi, että se johtuu molekyylien sattumanvaraisesta vaikutuksesta verisuonen seinämiin, jossa ne sijaitsevat, kun taas lämpötila riippuu suoraan hiukkasten (molekyylien) liikkumisen nopeudesta, toisin sanoen niihin. Siksi, mitä enemmän nämä hiukkaset liikkuvat, mitä korkeampi lämpötila. Boltzmannin vakio on nimetty kuuluisan itävaltalaisen tutkijan mukaan. Juuri hän antoi korvaamattoman panoksen staattisen fysiikan kehittämiseen.
Tietyn vakion fyysinen merkitys
Boltzmann-vakio määrittää suhteen kuten lämpötila ja energia. Staattisessa mekaniikassa sillä on merkittävä avainrooli. Boltzmann-vakio on yhtä suuri kuin k \u003d 1 380 6505 (24) * 10-23 J / K. Suluissa olevat numerot osoittavat määrän arvon sallitun virheen suhteessa viimeisiin numeroihin. On syytä huomata, että Boltzmann-vakio voidaan saada myös muista fysikaalisista vakioista. Nämä laskelmat ovat kuitenkin melko monimutkaisia \u200b\u200bja vaikeita suorittaa. Ne vaativat syvää tietämystä paitsi fysiikan myös
· -1
Boltzmannin vakio ( k (\\ displaystyle k) tai k B (\\ näyttötyyli k _ (\\ rm (B)))) - fyysinen vakio, joka määrittelee lämpötilan ja energian välisen suhteen. Nimetty itävaltalaisen fyysikon Ludwig Boltzmannin mukaan, joka on vaikuttanut merkittävästi tilastolliseen fysiikkaan. Tässä vakiossa on avainasemassa. Sen kokeellinen arvo kansainvälisessä yksikköjärjestelmässä (SI) on:
k \u003d 1 380 648 52 (79) × 10 - 23 (\\ näyttötyyli k \u003d 1 (,) 380 \\, 648 \\, 52 (79) \\ kertaa 10 ^ (- 23)) J /.Suluissa olevat numerot ilmaisevat standardivirheen arvon viimeisissä numeroissa.
Lämpötilan ja energian välinen suhde[ | ]
Homogeenisessa ihanteellisessa kaasussa absoluuttisessa lämpötilassa T (\\ näyttötyyli T), jokaiselle translaation vapausasteelle kuuluva energia on yhtä suuri, kuten seuraa Maxwellin jakaumasta, k T / 2 (\\ displaystyle kT / 2). Huoneenlämpötilassa (300 ° C) tämä energia on 2, 07 × 10 - 21 (\\ näyttötyyli 2 (,) 07 \\ kertaa 10 ^ (- 21)) J tai 0,013 eV. Monatomisessa ideaalikaasussa jokaisella atomilla on kolme vapausastetta, joka vastaa kolmea avaruusakselia, mikä tarkoittaa, että jokaisella atomilla on energiaa 3 2 k T (\\ näyttötyyli (\\ frac (3) (2)) kT).
Tietäen lämpöenergian, voimme laskea atomien keskimääräisen neliönopeuden, joka on käänteisesti verrannollinen atomimassan neliöjuureen. Rms-nopeus huoneenlämpötilassa vaihtelee 1370 m / s heliumin kohdalta 240 m / s ksenonin kohdalla. Molekyylikaasun tapauksessa tilanne muuttuu monimutkaisemmaksi, esimerkiksi kovakaasulla on viisi vapausastetta (matalissa lämpötiloissa, kun molekyylin atomivärähtelyt eivät ole kiihtyviä).
Entropian määritelmä[ | ]
Termodynaamisen järjestelmän entropia määritellään luonnollisena logaritmina erilaisten mikrostaattien lukumäärälle Z (\\ näyttötyyli Z)jotka vastaavat annettua makroskooppista tilaa (esimerkiksi tila, jolla on annettu kokonaisenergia).
S \u003d k ln \u2061 Z. (\\ displaystyle S \u003d k \\ ln Z.)Suhteellisuuskerroin k (\\ displaystyle k) ja siellä on Boltzmann-vakio. Tämä lauseke määrittelee mikroskooppisen ( Z (\\ näyttötyyli Z)) ja makroskooppiset tilat ( S (\\ displaystyle S)), ilmaisee tilastomekaniikan keskeisen ajatuksen.
Molekyyli-kineettisen teorian perusyhtälö ihanteellisella kaasulla on syvempi merkitys kuin tavanomaisella kaavalla ihanteellisen kaasun paineen määrittämiseksi. Selvittääksesi kirjoitamme tämän yhtälön p \u003d (1/3). n m 0v2 hieman eri muodossa:
p \u003d (2/3). n. m 0v̅ 2/2 \u003d (2/3). ne.
Määritelmän mukaanm 0v 2/2on molekyylin translaation liikkeen keskimääräinen kineettinen energia.
Kaasun paine on verrannollinen molekyylien translaation liikkeen keskimääräiseen kineettiseen energiaan.
Ottaen huomioon, että n \u003d N /V \u003dN A /V myhtälö p \u003d (2/3). nE näyttää seuraavalta:
pV M \u003d (2/3). N A E̅.
Toisaalta ideaalikaasun tilan yhtälöstä
pV M \u003d RT.
Vertaamalla näitä kahta yhtälöä saadaan:
(2 / 3) . N A E̅ \u003dRT.
E̅ \u003d (3/2). (R /N A) . T.
Tästä suhteesta seuraa tärkeä johtopäätös:
kaasumolekyylien keskimääräinen kineettinen energia on suoraan verrannollinen sen absoluuttiseen lämpötilaan.
Yleinen kaasuvakio-suhde R jatkuvaan Avogadroon N a on myös vakio, jota kutsutaan boltzmann-vakio k.
R /N \u003dk - boltz mana vakio.
Fyysinen merkitys boltzmann-vakio koostuu siitä, että se vahvistaa lämpötilan suhteen ilmaistuna energiana (J) ja termodynaamisena (K) yksikköä.
Boltzmann-vakio on perustavakio, jonka arvo määritetään melko tarkasti:
k \u003d 1,38. 10 - 23 J/ K.
E̅ \u003d (3/2). kT.
Jos tämä lauseke korvataan kaavassa p \u003d (2/3). nE, saadaan ihanteellisen kaasun paineen riippuvuus lämpötilasta ja sen molekyylien pitoisuuksista:
p \u003dnKT.
Tämä suhde vahvistetaan kokeellisesti kaarlen laki, jonka mukaan tietyn kaasumassan paine on suoraan verrannollinen absoluuttiseen lämpötilaan: p ~T. Siitä seuraa myös, että
samassa paineessa ja lämpötilassa molekyylien pitoisuus kaikissa kaasuissa on sama.
Siksi lämpötila järjestelmän makroparametrina kuvaa sen termodynaamisen tasapainotilan tilaa. Materiaali sivustolta
Kehon lämpötilan lähestyminen absoluuttiseen nollaan johtaa molekyylien keskimääräisen kineettisen energian laskuun. Absoluuttisen nollan kohdalla niiden translaation liike lakkaa. Moderni tiede kieltää mahdollisuuden saavuttaa absoluuttinen nolla lämpötila.
Lämpötila mitataan valitusta asteikosta riippuen celsiusasteina tai Fahrenheit-asteina tai kelviineinä. Järjestelmän mikroparametrina lämpötila määrittää merkittävän määrän molekyylien keskimääräisen kineettisen energian; mittanaan hänet mitataan jouleina. Kytkentäkerroin näiden määritelmien välillä on boltzmann-vakio.
Huolimatta siitä, että päätelmä, jonka mukaan lämpötila on suhteessa molekyylien keskimääräiseen kineettiseen energiaan, tehdään kaasuille, se pätee myös nesteille ja kiinteille aineille.
Tällä sivulla materiaalia aiheista:
Osmoosi-ilmiön molekyylis-kineettinen tulkinta
Vakiot molekyyli-kineettisessä fysiikassa
Kaavan lämpötilan molekyylikineettinen tulkinta
-
Boltzmann Ludwig (1844-1906)- Suuri itävaltalainen fyysikko, yksi molekyyli-kineettisen teorian perustajista. Boltzmannin teoksissa molekyylikineettinen teoria esiintyi ensin loogisesti koherenttina, yhtenäisenä fysikaalisena teoriana. Boltzmann antoi tilastollisen tulkinnan termodynamiikan toisesta laista. Hän teki paljon kehittääkseen ja popularisoidakseen Maxwellin sähkömagneettisen kentän teoriaa. Luonnostaan \u200b\u200bpainija, Boltzmann puolusti intohimoisesti tarvetta lämpöilmiöiden molekyylitulkinnalle ja aloitti taistelun tutkijoiden kanssa, jotka kiistivät molekyylien olemassaolon.
Yhtälö (4.5.3) sisältää yleisen kaasuvakion suhteen R jatkuvaan Avogadroon N . Tämä suhde on sama kaikille aineille. Sitä kutsutaan Boltzmann-vakiona L. Boltzmannin kunniaksi, joka on molekyylikineettisen teorian perustaja.
Boltzmann-vakio on yhtä suuri kuin:
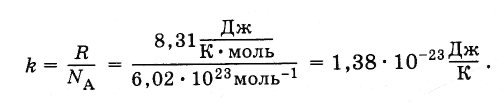 (4.5.4)
(4.5.4)Yhtälö (4.5.3), jossa otetaan huomioon Boltzmann-vakio, kirjoitetaan seuraavasti:
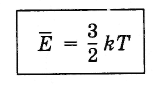 (4.5.5)
(4.5.5)Boltzmann-vakion fyysinen merkitys
Historiallisesti lämpötila otettiin ensin käyttöön termodynaamisena määränä ja sille asetettiin mittayksikkö - aste (ks. Kohta 3.2). Sen jälkeen kun lämpötilan suhde molekyylien keskimääräiseen kineettiseen energiaan oli määritetty, kävi ilmeiseksi, että lämpötila voidaan määritellä molekyylien keskimääräiseksi kineettiseksi energiaksi ja ilmaista jouleina tai ergeinä, ts. Tsyötä arvo T *niin että
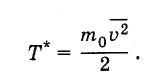
Näin määritetty lämpötila on suhteessa lämpötilaan, ilmaistuna asteina, seuraavasti:
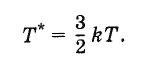
Siksi Boltzmann-vakion voidaan katsoa olevan arvo, joka yhdistää lämpötilan, energiayksikköinä ilmaistuna, lämpötilan ilmaistuna asteina.
Kaasun paineen riippuvuus sen molekyylien pitoisuuksista ja lämpötilasta
ilmentäviä Esuhteesta (4.5.5) ja korvaamalla kaavaksi (4.4.10) saamme lausekkeen, joka osoittaa kaasun paineen riippuvuuden molekyylipitoisuuksista ja lämpötilasta:
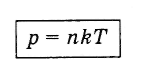 (4.5.6)
(4.5.6)Kaavasta (4.5.6) seuraa, että samoissa paineissa ja lämpötiloissa molekyylien pitoisuus kaikille kaasuille on sama.
Tästä seuraa Avogadro-lakia: yhtä suuret määrät kaasuja samoissa lämpötiloissa ja paineissa sisältävät saman määrän molekyylejä.
Molekyylien translaation liikkeen keskimääräinen kineettinen energia on suoraan verrannollinen absoluuttiseen lämpötilaan. Suhteellisuuskerroin- boltzmann-vakiok \u003d 10 - 23 J / K - täytyy muistaa.
§ 4.6. Maxwellin jakauma
Useissa tapauksissa tieto fysikaalisten määrien keskimääräisistä arvoista ei yksin riitä. Esimerkiksi ihmisten keskimääräisen korkeuden tuntemus ei salli erikokoisten vaatteiden tuotannon suunnittelua. Sinun on tiedettävä likimääräinen määrä ihmisiä, joiden kasvu on tietyllä aikavälillä. Samoin on tärkeää tietää niiden molekyylien lukumäärä, joiden nopeudet ovat muut kuin keskimääräiset. Maxwell löysi ensimmäisenä, kuinka nämä luvut voidaan määrittää.
Satunnaisen tapahtuman todennäköisyys
Kohdassa 4.1.1 mainitsimme jo, että kuvaamaan suuren molekyylisarjan käyttäytymistä J. Maxwell esitteli todennäköisyyden käsitteen.
Kuten toistuvasti korostettiin, on periaatteessa mahdotonta jäljittää yhden molekyylin nopeuden (tai vauhdin) muutosta pitkällä aikavälillä. On myös mahdotonta määrittää tarkasti kaikkien kaasumolekyylien nopeuksia tiettynä ajankohtana. Makroskooppisista olosuhteista, joissa kaasu sijaitsee (tietty tilavuus ja lämpötila), tietyt molekyylinopeuksien arvot eivät seuraa tarpeellisuutta. Molekyylin nopeutta voidaan pitää satunnaisena muuttujana, joka voi erilaisissa makroskooppisissa olosuhteissa ottaa erilaisia \u200b\u200barvoja, kuten noppaa heitettäessä, kaikki pisteet 1-6 voivat pudota (luupintojen lukumäärä on kuusi). On mahdotonta ennustaa, kuinka monta pistettä putoaa tietyn nopan aikana. Mutta todennäköisyys, että esimerkiksi viisi pistettä hylätään, voidaan määrittää.
Mikä on satunnaisen tapahtuman todennäköisyys? Olkoon tuotettu erittäin suuri määrä Ntesti (N on luurullien lukumäärä). Lisäksi vuonna N" tapauksissa testien tulos oli suotuisa (ts. Viiden menetys). Tällöin tämän tapahtuman todennäköisyys on yhtä suuri kuin suotuisten tapausten lukumäärän suhde tutkimusten kokonaismäärään, edellyttäen että tämä määrä on mielivaltaisesti suuri:
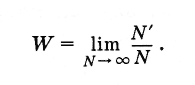 (4.6.1)
(4.6.1)Symmetrisen luun tapauksessa minkä tahansa valitun pistemäärän todennäköisyys 1-6 on yhtä suuri.
Näemme, että monien satunnaisten tapahtumien taustalla paljastuu tietty kvantitatiivinen säännöllisyys, luku ilmestyy. Tämä luku - todennäköisyys - antaa sinun laskea keskiarvot. Joten jos teet 300 luurullaa, niin keskimäärin viiden tipan lukumäärä kaavan (4.6.1) mukaisesti on: 300 · \u003d 50, eikä ole merkitystä heittää sama luu 300 kertaa tai 300 identtistä luua samanaikaisesti .
Ei ole epäilystäkään siitä, että kaasumolekyylien käyttäytyminen astiassa on paljon monimutkaisempaa kuin hylätyn noppaa liikkuminen. Mutta täällä voi myös toivoa löytävänsä tiettyjä kvantitatiivisia säännöllisyyksiä, jotka mahdollistavat tilastollisten keskiarvojen laskemisen, jos vain tehtävä asetetaan samalla tavalla kuin peliteoriassa, eikä kuten klassisessa mekaniikassa. On tarpeen hylätä ratkaisematon ongelma määrittää molekyylin nopeuden tarkka arvo tietyllä hetkellä ja yrittää löytää todennäköisyys, että nopeudella on tietty arvo.
