Aminohapporadikaalien rakenne on erittäin monipuolinen. Tämä seikka sallii useiden värireaktioiden käytön useimpien aminohappojen havaitsemiseksi. Monet heistä ovat niin herkkiä ja erittäin spesifisiä, että ne mahdollistavat vähäisten määrien yksittäisten aminohappojen havaitsemisen kompleksisissa seoksissa, biologisissa nesteissä, proteiinihydrolysaateissa jne. Siksi joitain värireaktioita käytetään aminohappojen kvantifiointiin.
Yhteisvaikutukset ninhydriinin kanssa on yksi herkimmistä reaktioista ilmaiseksi a-aminoryhmät aminohapoissa. Kuumennettaessa proteiinit, polypeptidit ja aminohapot muodostavat sinistä tai siniviolettiyhdisteitä ninhydriinin kanssa, poikkeus on proliini - sen reaktiotuotteet ninhydriinin kanssa ovat kirkkaan keltaisia. Reaktion ydin on, että ninhydriinin kanssa reagoivien a-aminohappojen oksidatiivinen deaminaatio ja dekarboksylointi tapahtuvat samanaikaisesti.
Yksi reaktiotuotteista on gidrindantin on vuorovaikutuksessa ammoniakin ja toisen ninhydriinimolekyylin kanssa muodostaen värillisen yhdisteen - diketohydrindiliden-diketohydrindamine (DIDA).
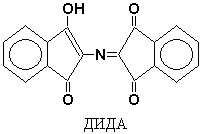
Ninhydriini pystyy reagoimaan paitsi a-aminohappojen, mutta myös muiden amiinien kanssa - samalla värin ollessa kehittyessä, mutta ilman hiilidioksidin vapautumista. Siksi C02: n vapautuminen on osoitus tarkalleen a-aminohappojen osallistumisesta ninhydriinireaktioon. Peptidit ja NH3 reagoivat myös ninhydriinin kanssa, mutta vähemmän aktiivisia kuin a-aminohapot.
Ksantofeenireaktio erityinen radikaaleille aromaattiset aminohapot. Sen olemus on, että kuumennettaessa aromaattisia aminohappoja tai proteiineja ja niitä sisältäviä polypeptidejä väkevällä typpihapolla muodostuu keltaisia \u200b\u200bnitroyhdisteitä. Reaktio etenee kahdessa vaiheessa. Ensimmäisessä vaiheessa aminohapon bentseenirengas nitrataan.
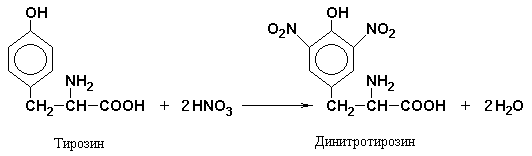
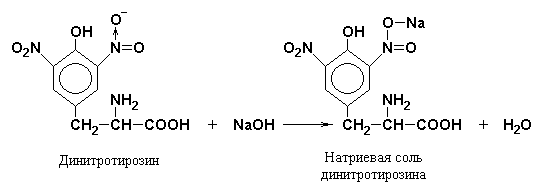
Toisessa vaiheessa nitraatiotuotteet reagoivat natrium- tai ammoniumhydroksidin kanssa natrium- tai ammoniumsuolan muodostamiseksi, jonka väri on keltaoranssi.
Suoritettaessa ksantofeenireaktiota kontrollina käytetään gelatiinia, joka ei sisällä aromaattisia aminohappoja.
Foley-reaktio erityinen rikkiä sisältävät aminohapot- kysteiini, kystiini, metioniini tai näitä aminohappoja sisältäville proteiineille. Reaktio etenee kahdessa vaiheessa. Ensin natriumhydroksidin vaikutuksesta kuumennettaessa aminohappojen SH-ryhmät pilkotaan ja rikki siirtyy orgaanisesta yhdisteestä epäorgaaniseen:
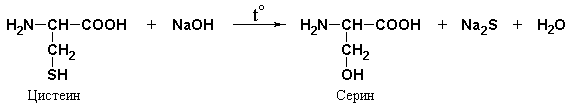
Sitten natriumsulfidi on vuorovaikutuksessa lyijyietikkahapon kanssa, jolloin muodostuu lyijysulfidia, joka saostuu mustana saostumana.
VAIKUTTAVAT REAKTIOT AMINOhappoihin ja proteiineihin
Työn tarkoitus:tutkia kvalitatiivisia reaktioita, joita käytetään proteiinien havaitsemiseen ja niiden aminohappokoostumuksen määrittämiseen
Värireaktiot
Proteiinien havaitsemiseksi käytetään värireaktioita, jotka on jaettu kahteen tyyppiin: yleinen tai universaali ja spesifinen. Yleismaailmallisia reaktioita ovat biureatti (peptidisidokselle) ja ninhydriini (a-aminohapoille). Niiden avulla voit havaita minkä tahansa proteiinin. Erityisiin reaktioihin sisältyy reaktioita yksittäisiin aminohappoihin, jotka mahdollistavat aminohapporadikaalien spesifisten funktionaalisten ryhmien havaitsemisen.Värireaktiot proteiineille ovat menetelmiä, joiden avulla määritetään aineiden proteiiniluonne, tutkitaan aminohappokoostumusta ja proteiinien kvantitatiivista sisältöä.
Toimi 1. Biureettireaktio (Piotrovsky-reaktio).
Emäksisessä ympäristössä proteiinit, samoin kuin niiden hydrolyysituotteet (polypeptidit), antavat violetin tai punavioletin värjäyksen kuparisulfaatilla. Reaktio johtuu peptidisidosten läsnäolosta sädeissä, jotka muodostavat värillisiä suolamaisia \u200b\u200bkompleksiyhdisteitä. Värin voimakkuus riippuu peptidisidosten lukumäärästä molekyylissä ja kuparisuolan määrästä.
Reaktio sai nimensä ureajohdannaisesta - biureetista, joka antaa tämän reaktion. Biureeni muodostuu kuumentamalla ureaa poistamalla siitä ammoniakkia:
Biureetin dienolimuodon kaksi molekyyliä ovat vuorovaikutuksessa alkalisessa väliaineessa muodostettujen kupari (II) hydroksidien kanssa. Reaktiotuote on monimutkainen yhdiste (värillinen kupari-natriumbiureettisuola), jossa koordinaatiosidokset muodostuvat imiiniryhmien elektronisten typpiatomiparien takia:
1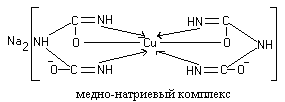
Peptidien ja proteiinien värjätyt värjätyt kupari-natriumsuolat rakennetaan samalla tavalla.
Biureaktioreaktiota tarjoavat myös asparagiini (asparagiinihappoamidi) ja aminohapot histidiini, sarja, treoniini.
Työn eteneminen. 10-12 tippaa muna- tai kasviproteiiniliuosta kaadetaan yhteen koeputkeen, 20-30 mg ureaa kaadetaan toiseen ja kuumennetaan alkoholilampulla, kunnes ammoniakin haju katoaa ja jäähtyy. 10 tippaa natriumhydroksidin 10-prosenttista liuosta ja 1-2 tippaa kupari (II) sulfaatin 1-prosenttista liuosta lisätään molempiin putkiin. Molemmissa koeputkissa näkyy sinivioletti tai puna-violetti värjäys.
Toimi 2. Ninhydriinireaktio.
Ninhydriinillä kuumennetut proteiinit, polypeptidit ja aminohapot antavat sinisen ja sinivioletin värin. Ninhydriinireaktio johtuu a-aminohappojen läsnäolosta ja se on yksi herkimmistä a-aminoryhmien havaitsemiseksi.
Reaktion ydin on, että in-aminohapot ja peptidit reagoivat ninhydriinin kanssa oksidatiivisella deaminaatiolla ja dekarboksylaatiolla:
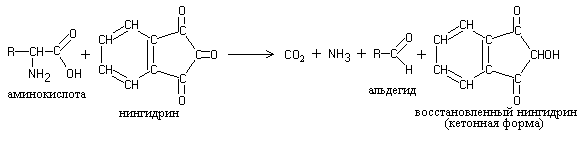
Pelkistetty ninhydriini on vuorovaikutuksessa ammoniakin ja toisen ninhydriinimolekyylin kanssa, mikä johtaa monimutkaisen värillisen yhdisteen mureksidirakenteen muodostumiseen:
1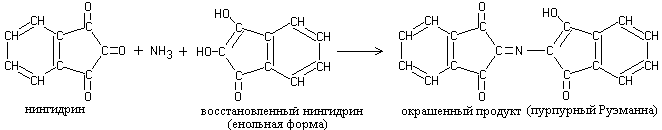
Työn eteneminen. Kaksi putkea kaadetaan: yhteen 10 tippaa muna- tai kasviproteiiniliuosta, toisiin 10 tippaan 0,1-prosenttista glysiiniliuosta. Jokaiseen niistä lisätään 2–3 tippaa 0,1-prosenttista ninhydriiniliuosta ja kuumennetaan. 1-2 minuutin kuluttua vaaleanpunainen, sitten punainen ja sitten sininen näkyy.
Työ 3. Ksantoproteiinireaktio (Mulder-reaktio)
Kuumennettaessa useimpien proteiinien liuoksia väkevällä typpihapolla, muodostuu keltainen väri, joka muuttuu alkalisesta liuoksesta oranssiksi.
Reaktion aiheuttaa sykliset aminohapot, jotka reagoidessaan typpihapon kanssa muodostavat keltaisia \u200b\u200bnitrojohdannaisia, esimerkiksi:
1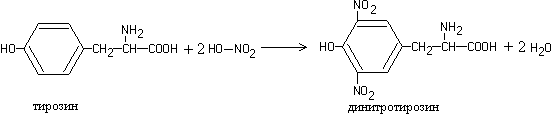
Syklisten aminohappojen nitraatiotuotteet, jotka reagoivat kaustisen soodan tai ammoniumhydroksidin kanssa, muodostavat vastaavat suolat oranssinvärisellä:
1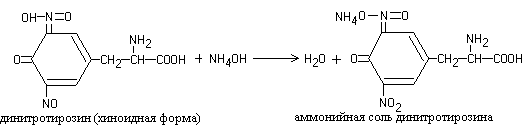
Työn eteneminen. 8-10 tippaa muna- tai kasviproteiinia kaadetaan koeputkeen, lisätään 3-5 tippaa väkevää typpihappoa ja kuumennetaan. Koeputkeen ilmestyy keltainen tahra. Jäähdyttämisen jälkeen seokseen lisätään ylimäärä väkevää ammoniakkiliuosta tai 30-prosenttista natriumhydroksidiliuosta. Keltainen väri muuttuu oranssiksi.
Toimi 4. Reaktio tyrosiinille (Millon-reaktio)
Useimpien proteiinien kuumentaminen Millonin reagenssilla (elohopean (I) ja (II) nitraattien ja nitriittien liuos typpihapossa) johtaa punaisen sakan muodostumiseen.
Reaktio johtuu proteiinissa esiintyvästä tyrosiiniaminohaposta, joka reagoidessaan Millonin reagenssin kanssa antaa nitrosoyhdisteen, jonka elohopeayhdiste on väriltään punainen:
1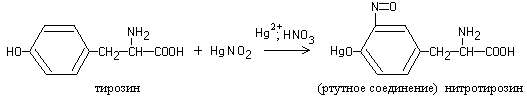
Työn eteneminen.8 - 10 tippaan proteiiniliuosta lisätään 2-3 tippaa Millonin reagenssia ja kuumennetaan varovasti. Neste muuttuu punaiseksi ja muodostuu punaruskea sakka.
Työ 5. Diatsoreaktio histidiinille ja tyrosiinille (Pauli-reaktio)
Kun diatsoreaktiviproteiini lisätään alkaliseen liuokseen, neste saa oranssinpunaisen värin.
Reaktio johtuu siitä, että proteiinissa on aminohappoja histidiiniä ja tyrosiinia, jotka reagoidessaan diatsobentseenisulfonihapon kanssa muodostavat punaisen atsovärin:
1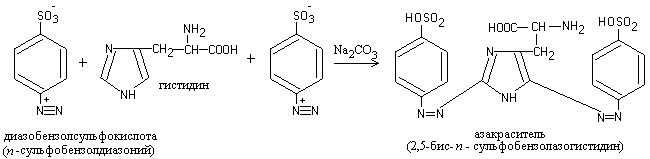
Työn eteneminen.Äskettäin valmistettuihin diazoreaktiiveihin (3 tippaa 1-prosenttista sulfanilihappoliuosta 2-prosenttisessa suolahappoliuoksessa ja 3 tippaa 5-prosenttista natriumnitriittiliuosta) lisätään 6-8 tippaa proteiiniliuosta ja sekoittamisen jälkeen 3-5 tippaa 10-prosenttista natriumkarbonaattiliuosta. Voimakas punainen väri kehittyy.
Toimi 6. Reaktiot tryptofaaniin
Reaktiot perustuvat happamassa väliaineessa olevan tryptofaanin kykyyn olla vuorovaikutuksessa aldehydien kanssa muodostaen värillisiä kondensaatiotuotteita.
a) Adamkevitšin reaktio. Tryptofaanin vuorovaikutus glyoksyylihapon kanssa (jota on aina läsnä jääetikkahapossa) johtaa punaviolettiyhdisteen muodostumiseen:
1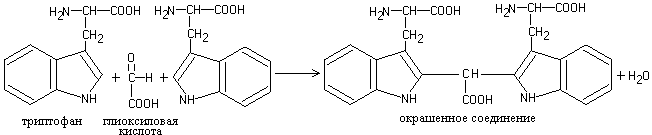
Työn eteneminen. 5-6 tippaan proteiiniliuosta lisätään 5 tippaa väkevää etikkahappoa, hieman lämmin ja kerrostettu (varovasti !!!. Kaltevan putken seinämää pitkin) yhtä suuri määrä väkevää rikkihappoa. Puna-violetti rengas ilmestyy kahden nestekerroksen rajalle.
b) Schulz-Raspail-reaktio. Tryptofaani, joka on vuorovaikutuksessa oksimetyylifurfuraalin kanssa (muodostuu sakkaroosin hydrolyysin ja monosakkaridien dehydraation aikana väkevöitetyn rikkihapon vaikutuksesta), muodostaa kirsikanpunaisen kompleksin.
Työn eteneminen.5-6 tippaan proteiiniliuosta kaadetaan 1 tippa 10-prosenttista sakkaroosiliuosta ja kerrostetaan 1 ml väkevää rikkihappoa. Käyttöliittymässä ilmestyy kirsikanpunainen väri.
Toimi 7. Foolin reaktio rikkiä sisältävissä aminohapoissa
Kuumentamalla proteiini alkalilla ja plumbiteilla saadaan aikaan ruskea tai musta sakka. Reaktio johtuu rikkipitoisten aminohappojen läsnäolosta proteiinissa, jotka alkalin vaikutuksesta tuhoutuvat muodostaen alkalimetallisulfidia; jälkimmäinen plumbiitin kanssa antaa saostuman lyijysulfidista:
1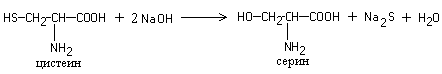
Pb (CH3COO) 2 + 4 NaOH → Na2
Na2 + Na2S → PbS + + 4 NaOH
Työn eteneminen.5-6 tippaan proteiiniliuosta lisätään 10 tippaa 30% natriumhydroksidiliuosta ja 1 tippa 5% lyijyasetaattiliuosta. Pitkäaikaisella lämmityksellä saostuu musta lyijysulfidin sakka.
Ohjauksen määritelmä
Kontrolliproteiiniliuoksella suoritetaan kaikki tutkitut reaktiot aminohapoihin ja proteiineihin, joiden perusteella tehdään johtopäätös proteiinin aminohappokoostumuksesta. Kokeiden tulokset merkitään taulukkoon.
Raportti on laadittu osoittaen työn tarkoitus, sisältää reaktion yhtälöt, kokeelliset tiedot ja päätelmät. Päätelmät sisältävät tietoja proteiinien aminohappokoostumuksesta ja niiden havaitsemisen mahdollisuudesta värireaktioiden avulla.
Ninhydriinireaktio, värireaktio, jota käytetään aminohappojen, aminohappojen ja amiinien kvalitatiiviseen ja kvantitatiiviseen määritykseen. Kuumennettaessa ninhydriinin (triketohydriinihydraatti, C 9 Hb O 4) alkalisessa ympäristössä aineilla, joilla on primaarisia aminoryhmiä (-NH2), muodostuu tuote, jolla on vakaa voimakas sinivioletti väri ja jonka suurin absorptio on noin 570 nm. Koska absorptio tällä aallonpituudella riippuu lineaarisesti vapaiden aminoryhmien lukumäärästä, ninhydriinireaktio toimi perustana niiden kvantitatiiviselle määrittämiselle kolorimetrisesti tai spektrofotometrisesti. Tätä reaktiota käytetään myös määrittämään sekundaariset aminoryhmät (\u003e NH) aminohapoissa proliini ja hydroksiproliini; tässä tapauksessa muodostuu kirkkaan keltainen tuote. Herkkyys - jopa 0,01%. Nykyaikainen automaattinen aminohappoanalyysi suoritetaan yhdistämällä aminohappojen ioninvaihtoerottelu ja niiden kvantitatiivinen määritys käyttämällä ninhydriinireaktiota. Kun erotetaan aminohappojen seokset paperikromatografialla, on mahdollista määrittää jokainen aminohappo määränä, joka on vähintään 2 - 5 μg.
Värin voimakkuutta voidaan käyttää arvioimaan aminohappojen määrää.
Tämä reaktio on positiivinen paitsi vapaiden aminohappojen lisäksi myös peptidien, proteiinien jne.
Xantoproteiinireaktio sallii aromaattisten aminohappojen (fenyylialaniini, tyrosiini, histidiini, tryptofaani) havaitsemisen aromaattisessa ytimessä olevien elektrofiilisten substituutioreaktioiden perusteella (nitraatti).
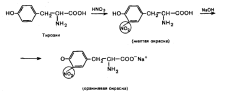
Kun väkevä typpihappo vaikuttaa tyrosiiniin, muodostuu keltainen tuote.
Biuretareaktio - käytetään värireaktiona proteiineille. Emäksisessä ympäristössä kupari (II) suolojen läsnä ollessa ne antavat violetin värin. Väri johtuu kuparin (II) monimutkaisen yhdisteen muodostumisesta johtuen peptidiryhmästä CO-NH- mikä on ominaista proteiineille. Tämä reaktio sai nimensä ureajohdannaisesta - biureetista, joka muodostuu kuumentamalla ureaa ammoniakin poistamisen avulla:
Proteiinien ja biureetin lisäksi muutkin tätä ryhmää sisältävät yhdisteet antavat saman värin: amidit, karboksyylihappoimidit, samoin kuin yhdisteet, jotka sisältävät -CS-NH- tai \u003d CH-NH- molekyylissä. Proteiinit, jotkut aminohapot, peptidit, biureetit ja keskipeptonit myös antavat reaktion.
Erilaisten peptidien kanssa tapahtuvassa biureaktiossa saadun kompleksin väri on jonkin verran erilainen ja riippuu peptidiketjun pituudesta. Peptidit, joiden ketjun pituus on neljä aminohappotähdettä ja yli, muodostavat punaisen kompleksin, tripeptidit muodostavat violetin ja dipeptidit muodostavat sinisen.
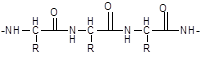
polypeptidin ketonimuoto
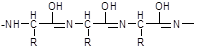
polypeptidin enolimuoto
muodostus peptidisidos.
-aminohappojen molekyylien välinen vuorovaikutus johtaa peptidien muodostumiseen. Kun kaksi -aminohappoa ovat vuorovaikutuksessa, muodostuu dipeptidi.
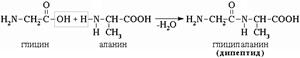
Kolmen -aminohapon molekyylien välinen vuorovaikutus johtaa tripeptidin muodostumiseen jne.
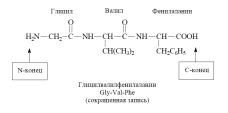
Peptidiketjun muodostavia aminohappomolekyylien fragmentteja kutsutaan aminohappotähteiksi ja CO - NH-sidoksiksi peptidisidos.
22. α-aminohappojen dekarboksylaatio - biogeenisten amiinien ja bioregulaattorien (histamiini, tryptamiini) muodostuminen.
Jotkut aminohapot ja niiden johdannaiset voivat käydä läpi dekarboksyloinnin - os-karboksyyliryhmän pilkkoutumisen. Nisäkkään kudoksissa useita aminohappoja tai niiden johdannaisia \u200b\u200bvoidaan dekarboksyloida: kolme, Tyr, Val, His, Glu, Cis, Apr jne. Reaktiotuotteet ovat CO 2 ja amiinit, joilla on selvä biologinen vaikutus kehoon (biogeeniset amiinit):
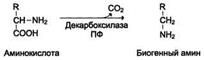
Dekarboksylaatioreaktiot ovat peruuttamattomia ja niitä katalysoivat dekarboksylaasientsyymit. Dekarboksylaasien proteesiryhmä eläinsoluissa on pyridoksalfosfaatti.
Aminohappojen dekarboksyloinnin aikana muodostuneet amiinit ovat usein biologisesti aktiivisia aineita. Ne suorittavat välittäjäaineiden (serotoniini, dopamiini, GABA jne.), Hormonien (norepinefriini, adrenaliini), paikallisen toiminnan säätelytekijät (histamiini, karnosiini, spermiini jne.).
Histamiini muodostuu aminohapon histidiinin dekarboksyloinnista. Se syntetisoidaan syöttösoluissa, kertyy erittyviin rakeisiin ja vapautuu solujen ärsytyksen aikana.
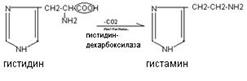
Histamiinilla on erilaisia \u200b\u200bbiologisia vaikutuksia: se aiheuttaa verisuonten laajenemista, alentaa verenpainetta, lisää kudosten läpäisevyyttä, aiheuttaa paikallista turvotusta, stimuloi mahalaukun eritystä ja sillä on bronkospaattinen vaikutus. Korkeana pitoisuutena se on välittäjä tulehduksellisille ja allergisille reaktioille.
Serotoniini muodostuu hydroksitryptofaanin dekarboksyloinnin aikana. Se syntetisoidaan kromaffiinisoluissa, joissakin subkortikaalisten rakenteiden ytimissä, verihiutaleissa.
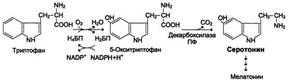
Serotoniinin vaikutukset: aiheuttaa vasospasmia, kohonnut verenpaine, stimuloi suoliston liikkuvuutta, osallistuu termoregulaatioon, unen mekanismeihin, on lähde melatoniinihormonin synteesille ja vaikuttaa ihmisen henkisiin reaktioihin. Joten skitsofrenian kanssa serotoniininvaihdossa rikotaan.
Katekoliamiinit (dopamiini, adrenaliini, norepinefriini) syntetisoidaan tyrosiiniaminohaposta.
Dopamiini on mielenkiintoinen välittäjä, jonka puutteella kehittyy Parkinsonin tauti (adynamia, jäykkyys, vapina). Adrenaliini aiheuttaa vasospasmia, nostaa verenpainetta, stimuloi sydäntä, on hormoni.
Norepinefriini suorittaa pääasiassa välittäjäainetoimintoja.
Polyamiinit (spermiini, spermidiini) syntetisoidaan ornitiinistä ja metioniinista, ovat osa kromatiinia ja osallistuvat translaation, transkription ja replikaation säätelyyn.
Koska biogeeniset amiinit ovat erittäin aktiivisia, ne inaktivoituvat nopeasti kudoksiin. Biogeenisten amiinien hajoaminen suoritetaan useilla tavoilla: hapetus, metylointi, deaminointi. Tärkein menetelmä biogeenisten amiinien inaktivoimiseksi on oksidatiivinen deaminaatio aminooksidaasientsyymien (monoaminioksidaasit, polyaminooksidaasit) vaikutuksen alaisena.
![]()
Aminohapot voivat sitoutua kovalenttisesti toisiinsa peptidisidosten kautta. Yhden aminohapon karboksyyliryhmä sitoutuu kovalenttisesti toisen aminohapon aminoryhmään. Tämä luo R-CO-NH-R-sidoksen, jota kutsutaan peptidisidokseksi. Kun tämä tapahtuu, vesimolekyylin pilkkoutuminen.
Proteiinit muodostavat solun kemiallisen aktiivisuuden aineellisen perustan. Proteiinien toiminnot luonnossa ovat universaalia. Nimi proteiinit,kotimaisessa kirjallisuudessa hyväksytyin, vastaa termiä proteiineja(Kreikan kielestä proteios- ensin). Tähän päivään mennessä on saavutettu suuria menestyksiä proteiinien rakenteen ja toimintojen korrelaation määrittämisessä, niiden osallistumismekanismissa kehon elämän tärkeimmissä prosesseissa ja monien sairauksien patogeneesin molekyylipohjan ymmärtämisessä.
Peptidit ja proteiinit erotellaan molekyylipainosta riippuen. Peptideillä on alempi molekyylipaino kuin proteiineilla. Peptideille säätelytoiminto on tyypillisempi (hormonit, entsyymien estäjät ja aktivaattorit, membraanien läpi kulkevat ionin kuljettajat, antibiootit, toksiinit jne.).
12.1. α Aminohapot
12.1.1. luokitus
Peptidit ja proteiinit rakennetaan a-aminohappojen tähteistä. Luonnossa esiintyvien aminohappojen kokonaismäärä on yli 100, mutta osa niistä löytyy vain tietystä eliöyhteisöstä, 20 tärkeintä a-aminohappoa löytyy jatkuvasti kaikista proteiineista (kaavio 12.1).
a-aminohapot ovat heterofunktionaalisia yhdisteitä, joiden molekyylit sisältävät samanaikaisesti aminoryhmän ja karboksyyliryhmän samassa hiiliatomissa.
Kaavio 12.1.Välttämättömät α-aminohapot *
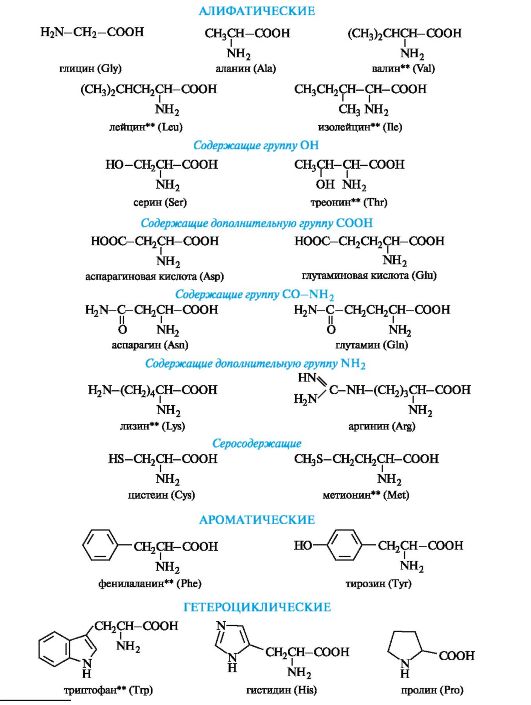
* Lyhenteitä käytetään vain aminohappotähteiden kirjaamiseen peptidien ja proteiinien molekyyleihin. ** Välttämättömät aminohapot.
Α-aminohappojen nimet voidaan rakentaa korvaamisnimikkeistöllä, mutta niiden triviaalisia nimiä käytetään useammin.

Α-aminohappojen triviaaliset nimet yhdistetään yleensä erittymislähteisiin. Seriini on osa silkki fibroiinia (lat. serieus- silkkinen); tyrosiini eristettiin ensin juustosta (kreikkalaisesta tyros- juusto); glutamiini - viljagluteenista (siitä. gluteenia- liima); asparagiinihappo - parsaakkoista (lat. lat. parsaparsa).
Elimistössä syntetisoidaan monia a-aminohappoja. Jotkut proteiinien synteesiin tarvittavat aminohapot eivät muodostu kehossa, ja niiden on tultava ulkopuolelta. Sellaisia \u200b\u200baminohappoja kutsutaan korvaamaton(katso kaavio 12.1).
Välttämättömiä a-aminohappoja ovat:
valiini isoleusiinimetioniini tryptofaani
leusiinilysiini-treoniinifenyylialaniini
a-aminohapot luokitellaan monella tavalla, riippuen piirteestä, joka perustuu niiden jakautumiseen ryhmiin.
Yksi luokitteluominaisuuksista on radikaalin R kemiallinen luonne. Tämän ominaisuuden mukaan aminohapot jaetaan alifaattisiksi, aromaattisiksi ja heterosyklisiksi (katso kaavio 12.1).
alifaattisiaα aminohapot.Tämä on suurin ryhmä. Sen sisällä aminohapot on jaoteltu alaluokkiin käyttämällä lisäluokitusominaisuuksia.
Seuraavat erotetaan riippuen molekyylin karboksyyliryhmien ja aminoryhmien lukumäärästä:
Neutraali aminohappo - yksi NH-ryhmä kukin2 ja COOH;
Välttämättömät aminohapot - kaksi NH-ryhmää2 ja yksi ryhmä
COOH;
Hapan aminohapot - yksi ryhmä NH2: ta ja kaksi ryhmää COOH: ta.
Voidaan huomata, että alifaattisten neutraalien aminohappojen ryhmässä hiiliatomien lukumäärä ketjussa ei ylitä kuutta. Lisäksi ketjussa ei ole aminohappoa, jossa on neljä hiiliatomia, ja aminohapoilla, joissa on viisi ja kuusi hiiliatomia, on vain haarautunut rakenne (valiini, leusiini, isoleusiini).
Alifaattinen radikaali voi sisältää "ylimääräisiä" funktionaalisia ryhmiä:
Hydroksyyli - seriini, treoniini;
Karboksyylihappo - asparagiini- ja glutamiinihapot;
Tioli - kysteiini;
Amidi - asparagiini, glutamiini.
aromaattinenα aminohapot.Tähän ryhmään kuuluvat fenyylialaniini ja tyrosiini, jotka on rakennettu siten, että niissä olevat bentseenirenkaat erotetaan yhteisestä a-aminohappofragmentista metyleeniryhmällä -CH2-.
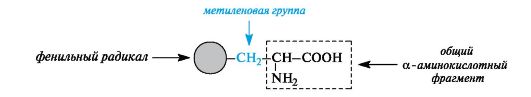
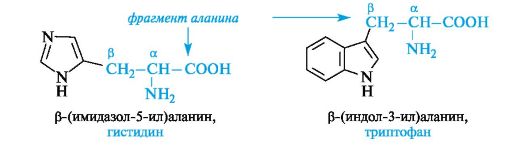
heterosykliset α aminohapot.Tähän ryhmään kuuluvat histidiini ja tryptofaani sisältävät vastaavasti heterosyklejä - imidatsolia ja indolia. Näiden heterosyklien rakennetta ja ominaisuuksia käsitellään jäljempänä (katso 13.3.1; 13.3.2). Heterosyklisten aminohappojen rakentamisen yleinen periaate on sama kuin aromaattinen.
Heterosyklisiä ja aromaattisia a-aminohappoja voidaan pitää alaniinin P-substituoiduina johdannaisina.
Aminohappo viittaa myös labosyklisiin proliini,jossa sekundaarinen aminoryhmä sisältyy pyrrolidiinin koostumukseen
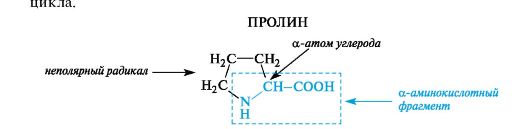
Α-aminohappojen kemiassa kiinnitetään paljon huomiota “sivu” R-radikaalien rakenteeseen ja ominaisuuksiin, joilla on tärkeä merkitys proteiinien rakenteen muodostumisessa ja niiden biologisissa toiminnoissa. Erittäin tärkeitä ovat sellaiset ominaisuudet kuin ”sivuradikaalien polaarisuus, funktionaalisten ryhmien läsnäolo radikaaleissa ja näiden funktionaalisten ryhmien kyky ionisoitua.
Aminohapot kanssa poolittomat(hydrofobiset) radikaalit ja aminohapot c polaarinen VALTIOSTA(hydrofiiliset) radikaalit.
Ensimmäiseen ryhmään kuuluvat aminohapot, joissa on alifaattisia sivuradikaaleja - alaniini, valiini, leusiini, isoleusiini, metioniini - ja aromaattiset sivuradikaalit - fenyylialaniini, tryptofaani.
Toinen ryhmä sisältää aminohapot, joissa radikaalilla on polaarisia funktionaalisia ryhmiä, jotka kykenevät ionisaatioon (ioninen) tai eivät kykene siirtymään kehon ioniseen tilaan (ioniton). Esimerkiksi tyrosiinissa hydroksyyliryhmä on ioninen (sillä on fenolinen luonne), seriinissä se ei-ioninen (sillä on alkoholipitoisuus).
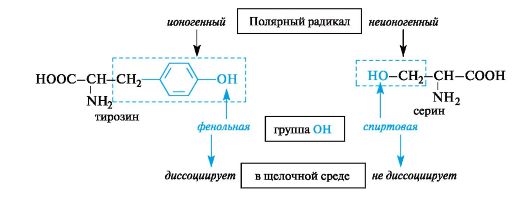
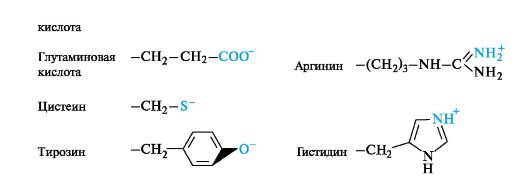
Tietyissä olosuhteissa polaariset aminohapot, joissa on radikaalien ionisia ryhmiä, voivat olla ionisessa (anionisessa tai kationisessa) tilassa.
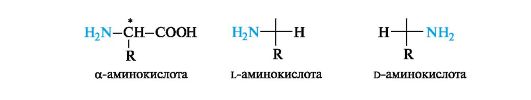
12.1.2. stereoisomeriaa
Α-aminohappojen rakentamisen päätyyppi, ts. Saman hiiliatomin sidos kahden eri funktionaalisen ryhmän, radikaalin ja vetyatomin kanssa, yksin määrittelee a-hiiliatomin kiraalisuuden. Poikkeuksena on yksinkertaisin aminohappo glysiini H2 NCH2 COOH ilman kiraalisuuskeskusta.
A-aminohappojen konfiguraatio määräytyy konfiguraatiostandardin - glyserolialdehydin avulla. Aminoryhmän sijainti vasemmalla Fisher-standardin esityskaavassa (kuten OH-ryhmä l-glyserolialdehydissä) vastaa kiraalisen hiiliatomin l-konfiguraatiota ja oikealla d-konfiguraatiota. päälle R,S-järjestelmässä kaikkien l-sarjan a-aminohappojen a-hiiliatomilla on S- ja d-sarjoilla R-konfiguraatio (poikkeus on kysteiini, katso 7.1.2).
Useimmat a-aminohapot sisältävät molekyylissä yhden epäsymmetrisen hiiliatomin ja esiintyvät kahden optisesti aktiivisen enantiomeerin ja yhden optisesti inaktiivisen rasemaatin muodossa. Lähes kaikki luonnolliset a-aminohapot kuuluvat l-sarjaan.
Aminohapot isoleusiini, treoniini ja 4-hydroksiproliini sisältävät molekyylissä kaksi kiraalisuuskeskusta.
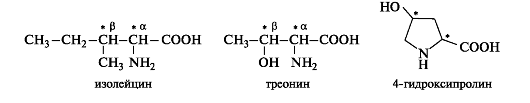
Tällaiset aminohapot voivat esiintyä neljän stereoisomeerin muodossa, jotka ovat kaksi enantiomeeriparia, joista kukin muodostaa rasemaatin. Eläinorganismien proteiinien rakentamiseksi käytetään vain yhtä enantiomeereistä.
Isoleusiinin stereoisomerismi on samanlainen kuin aiemmin harkittu treoniinin stereoisomerismi (ks. 7.1.3). Neljästä stereoisomeeristä proteiinien koostumus sisältää l-isoleusiinia, jolla on molempien asymmetristen hiiliatomien C-a ja C-P S-konfiguraatio. Toisen enantiomeeriparin nimet, jotka ovat diastereomeerejä leusiinin suhteen, käyttävät etuliitettä allo.
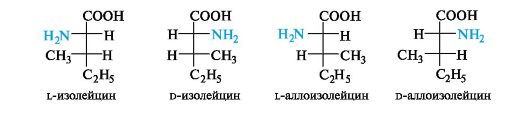
Racemaattien raivaaminen. L-sarjan a-aminohappojen lähde on proteiineja, joille suoritetaan hydrolyyttinen pilkkominen tätä varten. Koska yksittäisiä enantiomeerejä on suuri tarve (proteiinien, lääkkeiden jne. Synteesille), kemiallinensynteettisten raseemisten aminohappojen jakamismenetelmät. parempi entsymaattinenentsyymien katkaisumenetelmä. Tällä hetkellä kiraalista sorbenttikromatografiaa käytetään raseemisten seosten erottamiseen.
12.1.3. Happo-emäs -ominaisuudet
Aminohappojen amfoterisuus johtuu haposta (COOH) ja emäksisestä (NH2) funktionaaliset ryhmät niiden molekyyleissä. Aminohapot muodostavat suoloja sekä emästen että happojen kanssa.
Kiteisessä tilassa α-aminohapot ovat dipolaareina ioneina H3N + - CHR-COO- (yleisesti käytetty merkintä
aminohapon rakenne ionisoimattomassa muodossa on vain mukavuuden vuoksi).
Vesipitoisessa liuoksessa aminohapot esiintyvät tasapainoseoksen muodossa, jossa on dipolaarisia ioneja, kationisia ja anionisia muotoja.
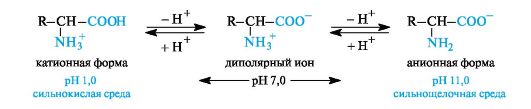
Tasapainon sijainti riippuu väliaineen pH: sta. Kaikilla aminohapoilla kationiset muodot ovat vallitsevia voimakkaasti happamissa (pH 1-2) ja anionisissa muodoissa voimakkaasti emäksisissä (pH\u003e 11) väliaineissa.
Ionirakenne määrittelee aminohappojen joukon erityisiä ominaisuuksia: korkea sulamispiste (yli 200 ° C), liukoisuus veteen ja liukenemattomuus ei-polaarisiin orgaanisiin liuottimiin. Useimpien aminohappojen kyky liueta hyvin veteen on tärkeä tekijä niiden biologisen toiminnan varmistamisessa, se liittyy aminohappojen imeytymiseen, niiden kuljetukseen kehossa jne.
Bronsted-teorian näkökulmasta täysin protonoitu aminohappo (kationinen muoto) on kaksiemäksinen happo,
Luovuttamalla yhden protonin, sellaisesta kaksiemäksisestä haposta tulee heikko yksiemäksinen happo - dipolaarinen ioni, jossa on yksi happoryhmä NH3 + . Dipolaarisen ionin deprotonointi johtaa aminohapon anionisen muodon, karboksylaatti-ionin, joka on Bronsted-emäs, tuotantoon. Arvot kuvaavat
aminohappojen karboksyyliryhmän happamat ominaisuudet ovat yleensä välillä 1 - 3; merkitys pK a2 karakterisoimalla ammoniumryhmän happamuus välillä 9-10 (taulukko 12.1).
Taulukko 12.1.Tärkeimpien α-aminohappojen happamat emäsominaisuudet
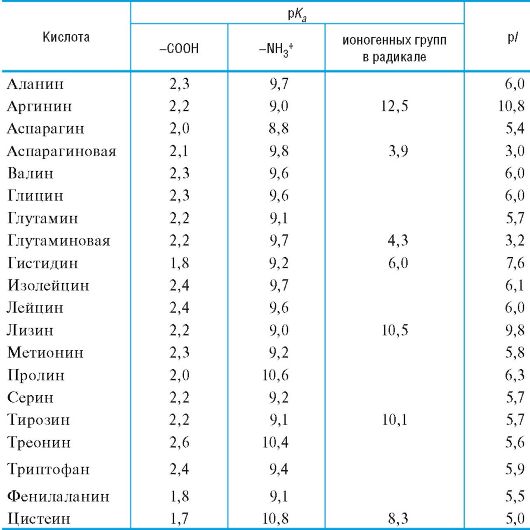
Tasapainoasema, ts. Aminohapon eri muotojen suhde vesiliuoksessa tietyissä pH-arvoissa, riippuu olennaisesti radikaalin rakenteesta, pääasiassa ionogeenisten ryhmien läsnäolosta siinä, jotka toimivat lisähappo- ja emäksisissä keskuksissa.
PH-arvoa, jolla dipolaaristen ionien pitoisuus on suurin, ja aminohapon kationisten ja anionisten muotojen vähimmäispitoisuudet ovat yhtä suuret, kutsutaanisoelektrinen piste (p /).
neutraaliα aminohapot.Nämä aminohapot ovat tärkeitäplhieman alle 7 (5,5 - 6,3) johtuen suuremmasta kyvystä ionisoida karboksyyliryhmää NH2-ryhmän - / - vaikutuksen vaikutuksesta. Esimerkiksi alaniinissa isoelektrisen pisteen pH on 6,0.
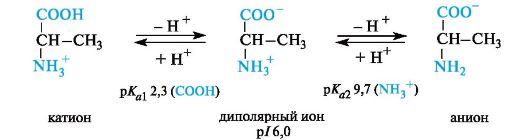
hapanα aminohapot.Näillä aminohapoilla on ylimääräinen karboksyyliryhmä radikaalissa ja voimakkaasti happamassa väliaineessa ovat täysin protonoidussa muodossa. Hapan aminohapot ovat kolmiemäksisiä (Brandsted), jolla on kolme merkitystäpK akuten voidaan nähdä asparagiinihapolla (p / 3,0).
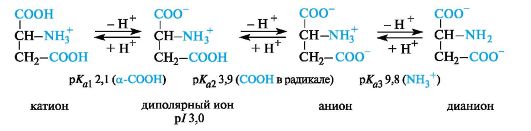
Happoissa aminohapoissa (asparagiini- ja glutamiinihappo) isoelektrisen pisteen pH on paljon alempi kuin 7 (katso taulukko 12.1). Kehossa fysiologisissa pH-arvoissa (esimerkiksi veren pH 7,3-7,5) nämä hapot ovat anionisessa muodossa, koska molemmat karboksyyliryhmät ionisoituvat niissä.
Tärkeinα aminohapot.Emäksisten aminohappojen tapauksessa isoelektriset pisteet ovat pH-alueella yli 7. Voimakkaasti happamassa väliaineessa nämä yhdisteet ovat myös kolmiemäksisiä happoja, joiden ionisaatiovaiheet on esitetty lysiinin esimerkillä (p / 9,8).
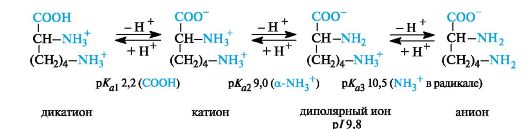
Kehossa tärkeimmät aminohapot ovat kationien muodossa, ts. Molemmat aminoryhmät protonoidaan niissä.
Yleensä ei ainoa a-aminohappo in vivose ei ole isoelektrisessä pisteessään eikä pudota tilaan, joka vastaa vähiten liukoisuutta veteen. Kaikki kehon aminohapot ovat ionisessa muodossa.
12.1.4. Analyyttisesti tärkeät reaktiot α aminohapot
a-aminohapot heterofunktionaalisina yhdisteinä alkavat reaktioihin, jotka ovat ominaisia \u200b\u200bsekä karboksyyli- että aminoryhmille. Jotkut aminohappojen kemialliset ominaisuudet johtuvat radikaalin funktionaalisista ryhmistä. Tässä osassa käsitellään aminohappojen tunnistamiseen ja analysointiin käytännöllisesti tärkeitä reaktioita.
Esteröintiin.Kun aminohapot ovat vuorovaikutuksessa alkoholien kanssa happokatalyytin (esimerkiksi kaasumaisen vetykloridin) läsnä ollessa, estereitä hydrokloridien muodossa saadaan hyvällä saannolla. Vapaiden estereiden eristämiseksi reaktioseos käsitellään kaasumaisella ammoniakilla.
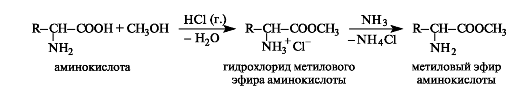
Aminohappoestereillä ei ole dipolaarista rakennetta, siksi, toisin kuin lähtöhapot, ne liukenevat orgaanisiin liuottimiin ja ovat haihtuvia. Joten glysiini on kiteinen aine, jolla on korkea sulamispiste (292 ° C), ja sen metyylieetteri on neste, jonka kiehumispiste on 130 ° C. Aminohappoestereiden analyysi voidaan suorittaa käyttämällä kaasu-nestekromatografiaa.
Formaldehydireaktio. Käytännössä on tärkeätä reaktio formaldehydin kanssa, joka perustuu aminohappojen kvantitointiin muodollinen titraus(Sørensen-menetelmä).
Aminohappojen amfoterisuus ei salli suoraa titrausta alkalilla analyyttisiin tarkoituksiin. Aminohappojen vuorovaikutus formaldehydin kanssa tuottaa suhteellisen stabiileja aminoalkoholeja (ks. 5.3) - N-hydroksimetyylijohdannaisia, joiden vapaa karboksyyliryhmä titrataan sitten alkalilla.
Laadulliset reaktiot. Aminohappojen ja proteiinien kemian piirre on lukuisten kvalitatiivisten (väri) reaktioiden käyttö, jotka aiemmin muodostivat kemiallisen analyysin perustan. Tällä hetkellä, kun tutkimuksia suoritetaan fysikaalis-kemiallisilla menetelmillä, monia kvalitatiivisia reaktioita käytetään edelleen a-aminohappojen havaitsemiseksi, esimerkiksi kromatografisessa analyysissä.
Chelation. Raskasmetallien kationien kanssa a-aminohapot bifunktionaalisina yhdisteinä muodostavat kompleksikompleksisia suoloja, esimerkiksi vastavalmistetun kuparihydroksidin (11) kanssa lievissä olosuhteissa, hyvin kiteytyneen kelatoivan
siniset kuparisuolat (11) (yksi epäspesifisistä menetelmistä a-aminohappojen havaitsemiseksi).
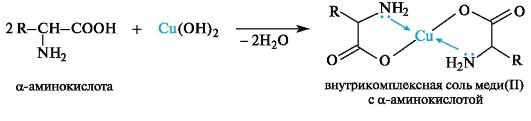
Ninhydriinireaktio. A-aminohappojen yleinen kvalitatiivinen reaktio on reaktio ninhydriinin kanssa. Reaktiotuotteella on sinivioletti väri, jota käytetään aminohappojen visuaaliseen havaitsemiseen kromatogrammeissa (paperilla, ohut kerros), samoin kuin spektrofotometriseen määritykseen aminohappoanalysaattoreilla (tuote absorboi valoa alueella 550-570 nm).
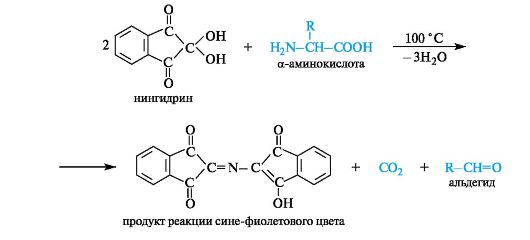
Deamination. Laboratorio-olosuhteissa tämä reaktio suoritetaan typpihapon vaikutuksesta a-aminohapoihin (ks. 4.3). Tässä tapauksessa muodostuu vastaava a-hydroksihappo ja vapautuu typpikaasua, jonka tilavuus määrää reagoineen aminohapon määrän (Van Slyke-menetelmä).
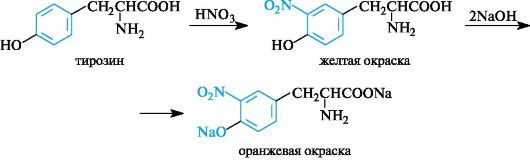
Xantoproteiinireaktio. Tätä reaktiota käytetään havaitsemaan aromaattiset ja heterosykliset aminohapot - fenyylialaniini, tyrosiini, histidiini, tryptofaani. Esimerkiksi konsentroidun typpihapon vaikutuksesta tyrosiiniin muodostuu nitrojohdannainen, joka on väriltään keltainen. Emäksisessä väliaineessa väri muuttuu oranssiksi fenolisen hydroksyyliryhmän ionisoitumisen ja anionin osuuden lisääntymisen seurauksena konjugoitumiseen.
On myös joukko erityisiä reaktioita, jotka sallivat yksittäisten aminohappojen havaitsemisen.
tryptofaanihavaittu reaktiolla r- rikkihapossa olevan p- (dimetyyliamino) bentsaldehydin kanssa puna-violetin värjäytymisen vaikutuksesta (Ehrlichin reaktio). Tätä reaktiota käytetään kvantifioimaan tryptofaani proteiinien hajoamistuotteissa.
kysteiinilöydetty käyttämällä useita kvalitatiivisia reaktioita, jotka perustuvat siihen sisältyvän merkaptoryhmän reaktiivisuuteen. Esimerkiksi, kun proteiiniliuosta, jossa on lyijyasetaattia (CH3COO) 2Pb, kuumennetaan alkalisessa väliaineessa, muodostuu lyijysulfidin PbS: n musta sakka, joka osoittaa kysteiinin läsnäolon proteiineissa.
12.1.5. Biologisesti tärkeät kemialliset reaktiot
Eri entsyymien vaikutuksesta kehossa tapahtuu joukko tärkeitä aminohappojen kemiallisia muutoksia. Tällaisia \u200b\u200bkonversioita ovat transaminointi, dekarboksylointi, eliminaatio, aldolin pilkkominen, oksidatiivinen deaminaatio, tioliryhmien hapetus.
transaminaatiolla on pääreitti a-aminohappojen biosynteesille α-oksohapoista. Aminoryhmän lahjoittaa aminohappo, jota on läsnä soluissa riittävä määrä tai ylimäärä, ja sen vastaanottaja on a-oksohappo. Aminohappo muuttuu tässä tapauksessa oksohapoksi ja oksohappo aminohapoksi, jolla on vastaava radikaalien rakenne. Seurauksena on, että transaminointi on amino- ja oksoryhmien vaihtamisen palautuva prosessi. Esimerkki tällaisesta reaktiosta on l-glutamiinihapon valmistus 2-oksogluorihaposta. Luovuttajaaminohappo voi olla esimerkiksi l-asparagiinihappo.
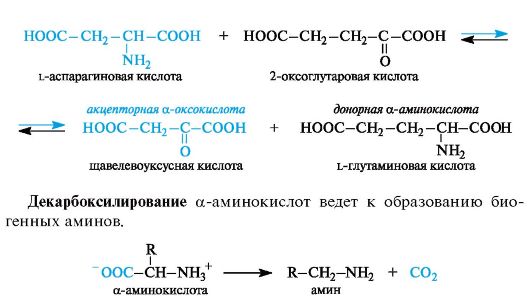
α-aminohapot sisältävät karboksyyliryhmän a-asemassa elektroneja vetävän aminoryhmän (tarkemmin sanottuna protonoidun aminoryhmän NH3 +), tässä yhteydessä kykenevät dekarboksylaatioon.
eliminointitunnusomaista aminohapoille, joissa elektroneja vetävä funktionaalinen ryhmä, esimerkiksi hydroksyyli tai tioli, sisältyy lateraaliseen radikaaliin p-asemassa karboksyyliryhmään. Niiden pilkkoutuminen johtaa välituotereaktiivisiin a-enaminohappoihin, jotka muuttuvat helposti tautomeerisiksi aminohapoiksi (analogisesti keto-enolin tautomerismin kanssa). C \u003d N-sidoksen hydraation ja sen jälkeen a-iminohappojen pilkkoutumisen seurauksena ammoniakkimolekyylit muuttuvat a-oksohapoiksi.
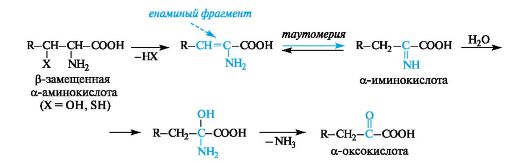
Tämän tyyppistä muutosta kutsutaan eliminointi-nesteytys.Esimerkki on pyruviinihapon tuotanto seriinistä.
Aldolin pilkkominen tapahtuu a-aminohappojen tapauksessa, joissa p-asema sisältää hydroksyyliryhmän. Esimerkiksi seriini hajoaa muodostaen glysiiniä ja formaldehydiä (jälkimmäinen ei erotu vapaassa muodossaan, mutta sitoutuu välittömästi koentsyymiin).
Hapetushoito voidaan suorittaa osallistumalla entsyymeihin ja koentsyymiin NAD + tai NADP + (ks. 14.3). a-aminohapot voidaan muuttaa α-oksohapoiksi paitsi transaminoinnin, myös hapettavan deaminaation avulla. Esimerkiksi a-oksogluorihappo muodostetaan l-glutamiinihaposta. Reaktion ensimmäisessä vaiheessa glutamiinihappo dehydrataan (hapetetaan) α-iminoglutaariseksi
happo. Toisessa vaiheessa tapahtuu hydrolyysi, josta seuraa a-oksogluorihappo ja ammoniakki. Hydrolyysivaihe etenee ilman entsyymin osallistumista.
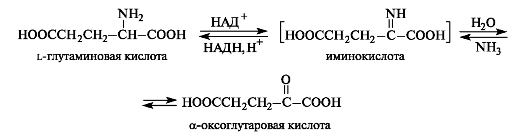
A-oksohappojen pelkistävä aminointi etenee vastakkaiseen suuntaan. Soluissa aina esiintyvä a-oksogluorihappo (hiilihydraattien metabolian tuotteena) muuttuu tällä tavalla L-glutamiinihapoksi.
Tioliryhmien hapetus kysteiini- ja kystiinitähteiden interkonversioiden taustalla on joukko redox-prosesseja solussa. Kysteiini, kuten kaikki tiolit (ks. 4.1.2), hapettuu helposti muodostamalla disulfidikystiini. Kystiinissä oleva disulfidisidos pelkistyy helposti kysteiiniksi.
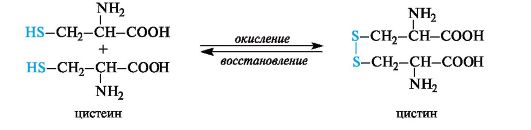
Koska tioliryhmä hapettuu helposti, kysteiinillä on suojaava tehtävä altistettaessa aineille, joilla on korkea hapetuskyky. Lisäksi hän oli ensimmäinen lääke, jolla oli säteilyn vastainen vaikutus. Kysteiiniä käytetään farmaseuttisessa käytännössä lääkkeiden stabilointiaineena.
Kysteiinin muutos kystiiniksi johtaa disulfidisidosten muodostumiseen esimerkiksi pelkistetyssä glutationissa
(katso 12.2.3).
12.2. Peptidien ja proteiinien primaarirakenne
Perinteisesti peptidit sisältävät jopa 100 molekyylissä (joka vastaa jopa 10 tuhannen molekyylipainoa) ja proteiinit sisältävät yli 100 aminohappotähdettä ( molekyylipaino 10 tuhannesta useaan miljoonaan).
Peptidiryhmässä puolestaan \u200b\u200bon tapana erottaa toisistaan oligopeptidejä(pienimolekyylipainoiset peptidit), jotka sisältävät ketjussa enintään 10 aminohappotähdettä, ja polypeptiditjonka ketju sisältää jopa 100 aminohappotähdettä. Makromolekyylit, joiden aminohappotähteiden lukumäärä lähestyy tai hiukan ylittää 100, eivät erota polypeptidejä ja proteiineja käsitteiden suhteen; näitä termejä käytetään usein synonyymeinä.
Peptidi- ja proteiinimolekyyli voidaan muodollisesti edustaa a-aminohappojen polykondensaation tuloksena, joka etenee peptidi (amidi) -sidoksen muodostumisesta monomeeristen yksiköiden välille (kaavio 12.2).
Polyamidiketjun rakenne on sama kaikille peptideille ja proteiineille. Tällä ketjulla on haarautumaton rakenne ja se koostuu vuorottelevista peptidiryhmistä (amidi) - CO - NH - ja fragmenteista - CH (R) -.
Ketjun toinen pää, jolla NH-vapaa aminohappo sijaitsee2, nimeltään N-pää, toinen - C-pää,
Kaavio 12.2.Peptidiketjun rakentamisen periaate
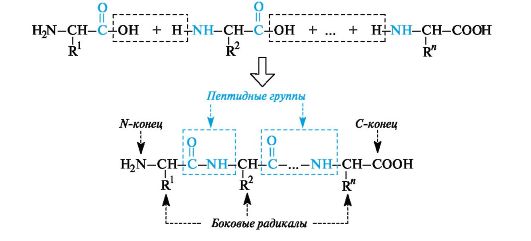
jossa on aminohappo, jossa on vapaa COOH-ryhmä. Peptidi- ja proteiiniketjut rekisteröidään N-päästä.
12.2.1. Peptidiryhmän rakenne
Peptidi (amidi) -ryhmässä - CO - NH - hiiliatomi on sp2-hybridisaation tilassa. Typpiatomin jakamaton elektronipari saapuu C \u003d O-kaksoissidoksen π-elektronien kanssa. Elektronisen rakenteen näkökulmasta peptidiryhmä on kolmen keskuksen p, π-konjugoitu järjestelmä (katso 2.3.1), jossa elektronien tiheys siirtyy kohti enemmän elektronisesti negatiivista happiatomia. Konjugaattisysteemin muodostavat atomit C, O ja N ovat samassa tasossa. Elektronitiheyden jakautuminen amidiryhmässä voidaan esittää käyttämällä rajarakenteita (I) ja (II) tai elektronitiheyden siirtymää NH: n ja C \u003d O-ryhmien + M- ja - M-vaikutusten seurauksena (III).
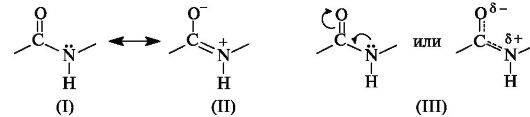
Parittumisen seurauksena tapahtuu jonkin verran sidospituuksia. Kaksinkertainen sidos С \u003d О pidennetään arvoon 0,124 nm tavanomaista 0,121 nm: n pituutta vastaan, ja С-N-sidos lyhenee - 0,132 nm verrattuna 0,147 nm: iin tavallisessa tapauksessa (kuva 12.1). Peptidiryhmän litteä konjugoitu järjestelmä aiheuttaa pyörimisvaikeuksia C-N-sidoksen ympärillä (kiertoeste on 63–84 kJ / mol). Siten elektroninen rakenne määrittää melko jäykän tasainenpeptidiryhmän rakenne.
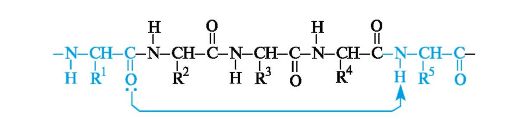
Kuten kuvasta 9 voidaan nähdä Kuvassa 12.1, aminohappotähteiden a-hiiliatomit sijaitsevat peptidiryhmän tasossa C-N-sidoksen vastakkaisilla puolilla, ts. Edullisemmassa trans-asemassa: aminohappotähteiden sivuradikaalit R ovat tässä tapauksessa kaukana toisistaan \u200b\u200bavaruudessa.
Polypeptidiketjulla on yllättävän samanlainen rakenne ja se voidaan esittää sarjana kulmikas
![]()
Kuva 12.1.Peptidiryhmän —CO – NH— ja aminohappotähteiden α-hiiliatomien tasojärjestely
toisiinsa peptidiryhmien tasoihin, jotka on kytketty toisiinsa a-hiiliatomien kautta Cα-N- ja Cα-Csp-sidoksilla2 (Kuva 12.2). Pyöritys näiden yksittäisten sidosten ympärillä on hyvin rajallista johtuen aminohappotähteiden sivuradikaalien spatiaalisen jakautumisen vaikeuksista. Siten peptidiryhmän elektroninen ja spatiaalinen rakenne määrää suurelta osin polypeptidiketjun rakenteen kokonaisuutena.
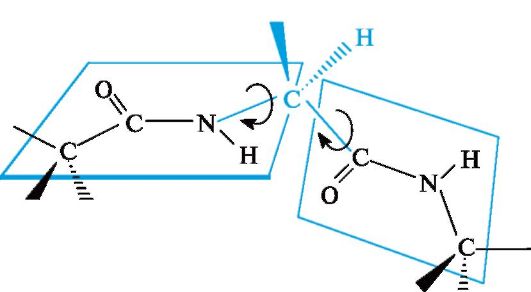
Kuva 12.2.Peptidiryhmien tasojen suhteellinen sijainti polypeptidiketjussa
12.2.2. Koostumus ja aminohapposekvenssi
Yhdenmukaisesti rakennetussa polyamidiketjussa peptidien ja proteiinien spesifisyys määritetään kahdella tärkeimmällä ominaisuudella - aminohappokoostumus ja aminohapposekvenssi.
Peptidien ja proteiinien aminohappokoostumus on niihin sisältyvien a-aminohappojen luonne ja kvantitatiivinen suhde.
Aminohappokoostumus määritetään analysoimalla peptidi- ja proteiinihydrolysaatit pääasiassa kromatografisilla menetelmillä. Tällä hetkellä tämä analyysi suoritetaan käyttämällä aminohappoanalysaattoreita.
Amidisidokset kykenevät hydrolysoitumaan sekä happamissa että emäksisissä ympäristöissä (katso 8.3.3). Peptidit ja proteiinit hydrolysoidaan joko lyhyempien ketjujen muodostamiseksi - tämä on ns osittainen hydrolyysitai aminohappojen seos (ionisessa muodossa) - täydellinen hydrolyysi.Tyypillisesti hydrolyysi suoritetaan happamassa ympäristössä, koska alkalisen hydrolyysin olosuhteissa monet aminohapot ovat epästabiileja. On huomattava, että myös asparagiinin ja glutamiinin amidiryhmät hydrolysoituvat.
Peptidien ja proteiinien primaarirakenne on aminohapposekvenssi, ts. A-aminohappotähteiden vuorottelujärjestys.
Primäärinen rakenne määritetään aminohappojen peräkkäisellä pilkkomisella ketjun mistä tahansa päästä ja niiden tunnistamisella.
12.2.3. Peptidien rakenne ja nimikkeistö
Peptidinimet rakennetaan luettelemalla peräkkäin aminohappotähteet, alkaen N-päässä, lisäämällä jälkiliiteyyli, paitsi viimeinen C-terminaalinen aminohappo, jolle sen täydellinen nimi on säilytetty. Toisin sanoen nimet
aminohapot, jotka ovat alkaneet muodostaa peptidisidoksia "heidän" ryhmänsä COOH vuoksi, päättyvät peptidin nimessä yyli: alanyyli, laakso jne. (asparagiini- ja glutamiinihappotähteille käytetään vastaavasti nimiä “aspartyyli” ja “glutamyyli”). Aminohappojen nimet ja symbolit osoittavat niiden kuulumisenl - jollei toisin ilmoiteta (d tai dl).
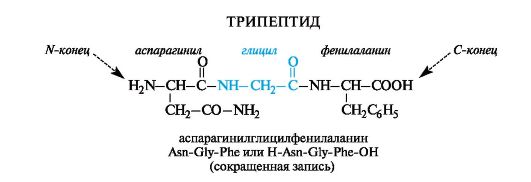
Joskus lyhennetyssä merkinnässä symbolit H (osana aminoryhmää) ja OH (osana karboksyyliryhmää) määrittelevät terminaalisten aminohappojen funktionaalisten ryhmien substituoimattomuuden. Tällä tavalla on kätevää kuvata peptidien funktionaaliset johdannaiset; esimerkiksi yllä olevan peptidin amidi C-terminaalisessa aminohapossa kirjoitetaan nimellä H-Asn-Gly-Phe-NH2.
Peptidejä löytyy kaikista organismeista. Toisin kuin proteiinit, heillä on heterogeenisempi aminohappokoostumus, erityisesti, ne sisältävät usein aminohappojad sarja järjestyksessä. Rakenteellisesti ne ovat myös monimuotoisempia: ne sisältävät syklisiä fragmentteja, haarautuneita ketjuja jne.
Yksi tripeptidien yleisimmistä edustajista on glutationi- sisältyvät kaikkien eläinten vartaloon, kasveihin ja bakteereihin.
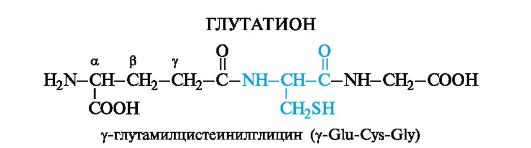
Glutationissa oleva kysteiini mahdollistaa glutationin olemassaolon sekä pelkistetyissä että hapettuneissa muodoissa.
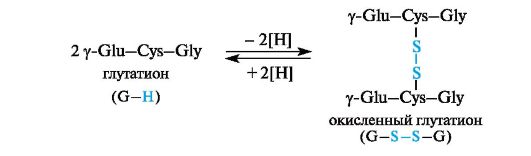
Glutationi on mukana monissa redox-prosesseissa. Se toimii proteiinien suojana, ts. Aineena, joka suojaa vapaiden SH-tioliryhmien proteiineja hapettumiselta -S-S-disulfidisidosten muodostumiselta. Tämä koskee niitä proteiineja, joille tällainen menetelmä ei ole toivottava. Näissä tapauksissa glutationi omaa hapettavan aineen vaikutuksen ja "suojaa" siten proteiinia. Glutationin hapetuksen aikana tapahtuu kahden tripeptidifragmentin molekyylien välinen silloittuminen disulfidisidoksen johdosta. Prosessi on palautuva.
12.3. Polypeptidien ja proteiinien sekundäärinen rakenne
Korkean molekyylipainon omaaville polypeptideille ja proteiineille primaarisen rakenteen ohella korkeammat organisaatiotasot, joita kutsutaan toissijainen korkea-asteja kvaternaarisetrakenteet matkat.
Toissijaista rakennetta kuvaa pääpolypeptidiketjun, tertiäärisen, paikallinen orientaatio - koko proteiinimolekyylin kolmiulotteisen arkkitehtuurin avulla. Sekä sekundaarinen että tertiäärinen rakenne liittyvät makromolekulaarisen ketjun järjestettyyn järjestelyyn avaruudessa. Proteiinien tertiääristä ja kvaternääristä rakennetta tarkastellaan biokemian aikana.
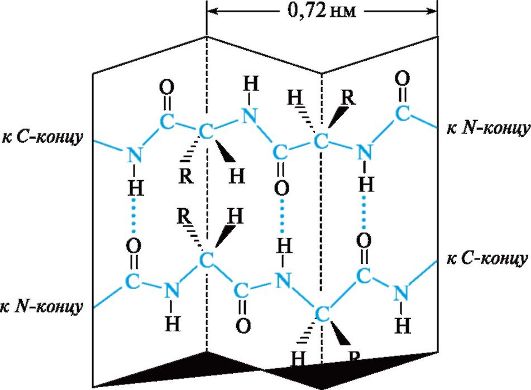
Laskennalla osoitettiin, että polypeptidiketjua varten yksi edullisimmista konformaatioista on avaruudessa sijaitseva järjestely oikeakätisen spiraalin muodossa, jota kutsutaan α-heliksin(Kuva 12.3, a).
Α-kierteisen polypeptidiketjun alueellinen järjestely voidaan kuvitella kuvittelemalla, että se ympäröi tietyn
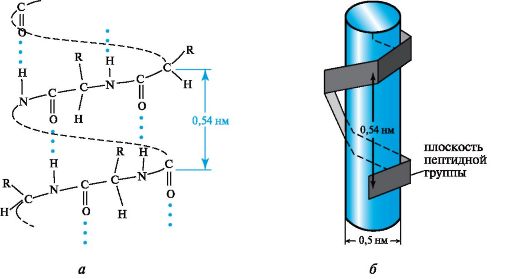
Kuva 12.3.Polypeptidiketjun a-kierteinen konformaatio
sylinteri (katso kuva 12.3, b). Keskimäärin 3,6 aminohappotähdettä spiraalikiertoa kohti, kierrekorkeus on 0,54 nm ja halkaisija on 0,5 nm. Kahden vierekkäisen peptidiryhmän tasot sijaitsevat 108 ° kulmassa, ja aminohappojen sivuradikaalit ovat kierukan ulkopuolella, ts. Ne ovat suunnattu ikään kuin sylinterin pinnalta.
Päärooli ketjun tällaisen muodonmuodostuksen vahvistamisessa on vety sidoksilla, jotka muodostuvat kunkin ensimmäisen karbonyylihappiatomin ja jokaisen viidennen aminohappotähteen NH-ryhmän vetyatomin välille a-kierroksessa.
Vedosidokset on suunnattu melkein yhdensuuntaiseksi a-kierukan akselin kanssa. He pitävät ketjun kiertyneenä.
Tyypillisesti proteiiniketjut eivät ole täysin spiraalistuneet, mutta vain osittain. Proteiinit, kuten myoglobiini ja hemoglobiini, sisältävät melko pitkät a-kierteiset alueet, kuten myoglobiiniketju
75% kierretty. Monissa muissa proteiineissa kierteisten alueiden osuus ketjussa voi olla pieni.
Toinen polypeptidien ja proteiinien sekundaarirakenne on p-rakennekutsutaan myös taitettu arkkitai taitettu kerros.Pidennetyt polypeptidiketjut on pinottu taitettuihin levyihin, jotka on kytketty monilla vety- sidoksilla näiden ketjujen peptidiryhmien välillä (kuva 12.4). Monet proteiinit sisältävät samanaikaisesti a-kierteiset ja p-taitetut rakenteet.
Kuva 12.4.Polypeptidiketjun sekundäärinen rakenne taitetun levyn muodossa (p-rakenne)
